БИОФИЗИКА, 2021, том 66, № 5, с. 925-936
БИОФИЗИКА КЛЕТКИ
УДК 663.951.542.943-032. УДК 544.3.03:544.032:544.77
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛИПОСОМ,
РЕКОНСТРУИРОВАННЫХ ИЗ ЛИПИДОВ ПЕЧЕНИ
И ГОЛОВНОГО МОЗГА МЫШЕЙ, ПРИНИМАВШИХ
НАНОЛИПОСОМАЛЬНЫЕ КОМПЛЕКСЫ
© 2021 г. Н.П. Пальмина, Н.Н. Сажина, Н.Г. Богданова, А.С. Антипова, Е.И. Мартиросова,
И.Г. Плащина, В.В. Каспаров, М.Г. Семёнова
Институт биохимической физики имени Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
E-mail: npalm@mail.ru
Поступила в редакцию 26.03.2021 г.
После доработки 09.07.2021 г.
Принята к публикации 13.07.2021 г.
Изучены физико-химические свойства липидов важнейших органов мышей (печени и головного
мозга) после длительного приема в течение трех месяцев нанолипосомальных комплексов, состоя-
щих из различных вариаций следующих веществ: фосфатидилхолина сои, эфирного масла гвозди-
ки, рыбьего жира и казеината натрия. Из суммарных липидов органов готовили липосомы и опре-
деляли их способность к инициированному окислению, структуру липидного бислоя в областях ло-
кализации спиновых зондов 5-доксил и 16-доксил-стеариновых кислот, размеры и заряд липосом.
Установлено, что все изученные параметры значительно изменялись с возрастом животных: спо-
собность к окислению уменьшалась в липидах из обоих органов; микровязкость уменьшалась, а
структурированность возрастала; размеры липосом из липидов печени увеличивались, а из липидов
головного мозга - уменьшались; применение диет приводило к приближению исследуемых вели-
чин к уровню, характерному для молодых животных. Установлена корреляция окисляемости липи-
дов и их микровязкости с изменением состава жирных кислот, а размеров липосом - с параметром
упорядоченности поверхностных слоев липидов.
Ключевые слова: липосомы, способность липидов к окислению, структура мембран, диаметр и заряд
липосом.
DOI: 10.31857/S0006302921050100
увеличивает их окисляемость и, как следствие,
Для нормального функционирования орга-
накопление пероксидов и гидропероксидов, про-
низма чрезвычайно важно его обеспечение эссен-
дуктов их разложения, обладающих токсично-
циальными (незаменимыми) биологически ак-
стью, а также летучих карбонильных продуктов,
тивными липидами, такими как полиненасы-
щенные жирные кислоты (ПНЖК) омега-3 и
снижающих вкусовые качества продуктов. Для
преодоления этих ограничений предлагается вво-
омега-6. Они не синтезируются в организме чело-
века и должны поступать с пищей в достаточном
дить ПНЖК в нужном соотношении в виде липо-
сом с добавками природных антиоксидантов и
количестве и в оптимальном соотношении (оме-
инкапсулированием в белки или биополимеры
га-6 : омега-3 = 1 : 1 - 4 : 1) [1, 2]. Включение этих
[4, 5]. В результате комплекса исследований, вы-
веществ в диету актуально для большинства насе-
полненных in vitro, нами были получены липосо-
ления и может быть осуществлено с помощью
мы на основе фосфатидилхолина (ФХ) или лизо-
функциональных продуктов питания [3]. Серьез-
фосфатидилхолина, нагруженные ПНЖК в соот-
ная проблема, с которой сталкиваются исследо-
ветствующем отношении и содержащие
ватели, заключается в том, что высокое содержа-
растительные антиоксиданты (эфирное масло
ние в ПНЖК ненасыщенных углеродных связей
гвоздики (ЭМГ), кориандра, лимона; экстракты
имбиря, черного перца, корицы, душистого пер-
Сокращения: ПНЖК - полиненасыщенные жирные кис-
лоты, ФХ - фосфатидилхолин сои, ЭМГ - эфирное масло ца), а также казеинат натрия (Каз-Na) и мальто-
гвоздики, Cas-Na - казеинат натрия, РЖ - рыбий жир, декстрины. Были изучены физико-химические
ПОЛ - перекисное окисление липидов, ЭПP - электpон-
свойства этих сложных липосом (размеры и фор-
ный паpамагнитный pезонанc, АОА - антиокислительная
активность.
ма, плотность, архитектура, заряд, микровяз-
925
926
ПАЛЬМИНА и др.
кость липидного бислоя; способность к окисле-
[ФХ] = 2.50 мг/мл). Весовое отношение компо-
нию; термодинамические параметры)
[6-9];
нентов
липосомального
нанокомплекса:
определена биодоступность инкапсулированных
ФХ : ЭМГ = 1 : 0.02.
липидов в процессе ферментативного гидролиза
Диета 3. Липосомы из ФХ (с концентрацией в
комплексов в условиях их модельного перевари-
растворе [ФХ] = 1.66 мг/мл), инкапсулированные
вания в желудочно-кишечном тракте (ротовая
казеинатом натрия (с концентрацией в растворе
полость, желудок, тонкий кишечник) in vitro [10];
[Каз-Na] = 16.6 мг/мл). Весовое отношение ком-
установлены основные взаимосвязи между струк-
понентов в липосомальном нанокомплексе:
турными, а также термодинамическими парамет-
ФХ : Каз-Na = 1 : 10.
рами супрамолекулярных комплексов и их функ-
Диета 4. Липосомы из ФХ с добавлением ЭМГ
циональными свойствами [7, 10, 11]. В экспери-
(2% от веса ФХ) ([ФХ] = 2.50 мг/мл), инкапсули-
ментах in vivo были получены подтверждения
рованные Каз-Na (с концентрацией в растворе
высказанным предположениям: нанокомплексы
[Каз-Na] = 25.0 мг/мл). Весовое отношение ком-
действительно способствовали повышению со-
понентов в липосомальном нанокомплексе
держания ПНЖК и антиоксидантов в органах и
ФХ : ЭМГ : Каз-Na = 1 : 0.02 : 10.
тканях мышей [12, 13]. Важным аспектом влия-
ния этих нанокомплексов на организм человека и
Диета 5. Липосомы из ФХ (с концентрацией
животных является изменение физико-химиче-
в растворе [ФХ] = 1.66 мг/мл) с добавлением ры-
ских свойств липидов. Одной из моделей, ис-
бьего жира (с концентрацией в растворе [РЖ] =
пользуемых в исследованиях этих свойств, явля-
= 1.66 мг/мл), инкапсулированные Каз-Na (с
ются липосомы, реконструированные из суммар-
концентрацией в растворе
[Каз-Na]
=
ных липидов какого-либо из органов животных,
= 33.3 мг/мл). Весовое отношение компонентов
подвергшихся тому или иному воздействию [14,
в липосомальном нанокомплексе ФХ: РЖ:Каз-Na =
15]. Мы применили эту модель для изучения не-
=1:1:20.
которых физико-химических характеристик ли-
Диета 6. Липосомы из ФХ (с концентрацией в
пидов (способности к окислению, микровязко-
растворе [ФХ] = 1.66 мг/мл) с добавлением рыбьего
сти и ригидности липидного бислоя, размеров и
жира (с концентрацией в растворе
[РЖ]
=
поверхностного заряда) из органов мышей, при-
= 1.66 мг/мл) и ЭМГ (2% от веса ФХ + РЖ), инкап-
нимавших в течение длительного времени нано-
сулированные Каз-Na (с концентрацией в растворе
липосомальные комплексы различного состава,
[Каз-Na] = 33.3 мг/мл). Весовое отношение компо-
что и составило цель нашей работы.
нентов в липосомальном нанокомплексе: ФХ : РЖ :
: ЭМГ : Каз-Na = 1 : 1 : 0.02 : 20.
Приготовление липосом. Липосомы из ФХ с до-
МЕТОДЫ
бавлением ЭМГ и/или РЖ готовили по следую-
Материалы. В работе использовали фосфати-
щей методике: в стерилизованные при 110°С
дилхолин фирмы Lipoid GmbH (Германия) следу-
(30 мин) стеклянные стаканчики помещали не-
ющего химического состава по данным произво-
обходимые навески ФХ/ЭМГ/РЖ и добавляли в
дителя: фосфолипиды - 94% фосфатидилхолина,
них расчетное количество бидистиллированной
0.6% фосфатидилэтаноламина, 3% лизофосфати-
воды. Диспергировали ФХ/ЭМГ/РЖ в воде при
дилхолина, 0.1% фосфатидилинозита; триглице-
помощи трехкратной механической гомогениза-
риды - 2%; свободные жирные кислоты - 0.5%;
ции, используя гомогенизатор (Heidolph, Герма-
α-токоферол - 0.15%. Использовали также казеи-
ния), в течение 2 мин при 20000 об/мин. Полу-
нат натрия фирмы Sigma (Новая Зеландия);
ченную водную дисперсию ФХ/ЭМГ/РЖ допол-
эфирное масло гвоздики фирмы Plant Lipids Ltd
нительно обрабатывали ультразвуком, используя
(Индия); рыбий жир (РЖ, концентрат омега-3
ультразвуковой гомогенизатор VCX-130 (Sonics &
«Омега-3 дети», ООО «РУСКАПС», Москва),
Materials, США) в подобранном предварительно
азо-инициатор 2.2'-азобис(амидинопропан) ди-
режиме: озвучивание в течение 5мин при 40%
гидрохлорид (Fluka, Германия); органические
мощности сигнала (отношение времени озвучи-
растворители фирмы Merck (Германия).
вания к времени без озвучивания 30 : 30 с); такой
режим озвучивания повторяли семикратно. При
Состав липосомальных нанокомплексов. В экс-
озвучивании образец охлаждали во льду. После
периментах были использованы водные растворы
этого проводили центрифугирование получен-
шести видов липосомальных нанокомплексов в
ных водных растворов липосомных комплексов
качестве напитков, заменяющих воду в диете экс-
ФХ/ЭМГ/РЖ в стерилизованных (при 110°С,
периментальных животных:
30 мин) центрифужных пробирках в течение
Диета 1. Липосомы из ФХ (с концентрацией в
30 мин при 4000 об/мин (1800 g) для удаления ме-
растворе [ФХ] = 2.50 мг/мл).
таллической стружки от ультразвукового зонда.
Диета 2. Липосомы из ФХ с добавлением ЭМГ
Инкапсулирование белком (Каз-Na) приготов-
(2% от веса ФХ) (с концентрацией в растворе
ленных липосом (ФХ/ЭМГ/РЖ) проводили сме-
БИОФИЗИКА том 66
№ 5
2021
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛИПОСОМ
927
шиванием их растворов в стерилизованных (при
0.33 мМ). Степень развития перекисного окисле-
110°С, 30 мин) бутылочках для кормления с по-
ния липидов (ПОЛ) контролировали спектрофо-
следующим встряхиванием (165 об/мин) в шей-
тометрически при непрерывной регистрации во
кер-инкубаторе (GFL 3032, Германия) при 40°С в
времени оптической плотности в области погло-
течение 1 ч. После этого повышали температуру в
щения 234 нм, соответствующей максимуму по-
шейкер-инкубаторе до 63°С и пастеризовали все
глощения для диеновых конъюгатов на спектро-
приготовленные растворы в течение 30 мин при
фотометре Lambda-25 (Perkin Elmer, Германия).
продолжающемся встряхивании (165 об/мин).
На рис. 1 приведены характерные кинетические
кривые окисления липосом (накопления диено-
Все приготовленные растворы липосомных
вых конъюгатов) из липидов печени и мозга.
нанокомплексов готовили на двое суток из расче-
та их потребления одной мышью в объеме 7 мл
Метод динамического светорассеяния. Для
ежедневно.
определения размеров липосом использовали ме-
Животные и дизайн эксперимента. 50 мышей
тод динамического светорассеяния. Измерения
линии F1(C57blxDBA2\6) массой 18-20 г из вива-
среднего диаметра D липосом проводили на при-
рия питомника «Столбовая» НЦБТ ФМБА РФ
боре Zetasizer Nano ZS (Malvern, Великобрита-
были разделены на восемь групп по шесть-семь
ния) по оценке корреляционной функции флук-
мышей в каждой группе. Мышей содержали на
туаций интенсивности рассеянного на липосомах
диете в течение 92 суток. Группа 1 (7 животных)
под углом 173° лазерного излучения с λ = 633 нм.
получала общевиварный рацион и была забита в
Концентрация липидов в суспензии липосом со-
первый день эксперимента. Группа 2 (6 живот-
ставляла 0.3 мг/мл, температура 25°С, индекс по-
ных) получала диету 1, группа 3 (6 животных) -
лидисперсности варьировал в пределах 0.21-0.36.
диету 2, группа 4 (6 животных) - диету 3, группа 5
Для каждого размера D осуществлялась регистра-
(6 животных) - диету 4, группа 6 (6 животных) -
ция 5-10 распределений интенсивности по разме-
диету 5; группа 7 (6 животных) - диету 6; группу 8
рам частиц с 15 накоплениями в каждом измере-
(7 животных) содержали на общевиварном раци-
нии, усреднение проводилось по размерам ча-
оне все 92 суток эксперимента. Через 92 суток по-
стиц с максимальной интенсивностью рассеяния.
сле начала приема различных диет животные бы-
Для измерения ζ-потенциала липосом этот же
ли забиты методом декапитации, ткани печени и
прибор использовали в режиме регистрации
головного мозга были взяты для исследования.
электрофоретической подвижности частиц.
Усреднение максимальных значений ζ-потенци-
Выделение липидов из печени и мозга. Экстрак-
ала осуществляли по результатам трех повторных
цию липидов из тканей печени и головного мозга
измерений, погрешность которых не превышала
проводили по методу Блайя и Дайера в модифи-
10%.
кации Кейтса [16, 17].
Приготовление липосом из липидов печени и
Метод cпиновыx зондов. Для xаpактеpиcтики
мозга. Липосомы готовили из навесок суммарных
cтpуктуpного cоcтояния мембpан липоcом
липидов печени или мозга, полученных из экс-
иcпользовали метод электpонного паpамагнит-
трактов липидов после выпаривания растворите-
ного pезонанcа (ЭПP). Образец для измерений на
ля в вакууме. Далее к сухой навеске известной
ЭПР-спектрометре представлял собой 200 мкл
массы добавляли фосфатный буферный раствор
суспензии липосом (концентрация липидов
(рН 7.2, ионная сила 1 мM) в объеме, необходи-
3мг/мл), к которому добавляли 1 мкл спиртового
мым для получения заданной концентрации сус-
раствора парамагнитного зонда (концентрация
пензии липидов (1 или 3 мг/мл). Липосомы фор-
зонда в спирте 10-4 М), из расчета 1 молекула
мировали c использованием ультразвукового го-
зонда на 900-1000 молекул липида. Этот образец
могенизатора VCX-130 (Sonics & Materials, США)
после инкубации с зондом в течение 15-20 мин
в течение 15 мин (в режиме 15 с × 15 с) при мощ-
при 4°С помещали в длинную, узкую с плоскопа-
ности 70 Вт. Для предохранения липосом от на-
раллельными гранями кварцевую кювету высо-
гревания и окисления во время озвучивания со-
кой добротности, благодаря чему достигалась
суд с суспензией помещали в смесь воды со
температурная однородность по всему объему
льдом. Для отделения примесей дисперсию липо-
кюветы. Термостатирование осуществляли с по-
сом
центрифугировали
со
скоростью
мощью термоприставки ER 4131 VT (Bruker, Гер-
13000 об/мин при 4°С в течение 20 мин [8].
мания). Точность термостатирования контроли-
Окисление липосом. Инициированное окисле-
ровали термопарой, помещенной в резонатор,
ние липосом проводили по методу [8, 18] в про-
она составила ±0.05°С. Запись спектров при по-
бирках, термостатированных при физиологиче-
стоянной температуре 293 К осуществляли не-
ской (37°С) температуре. Для инициирования ис-
прерывно: 10-15 спектров по 3-5 накоплений.
пользовали водорастворимый азо-инициатор
Паpаметpы,
xаpактеpизующие
cтpуктуpу
2.2'-азобис(амидинопропан) дигидрохлорид (с
мембpан, pаccчитывали из cпектpов, полученныx
конечной концентрацией в растворе липосом
пpи темпеpатуpе 293 К на ЭПP-cпектpометpе
БИОФИЗИКА том 66
№ 5
2021
928
ПАЛЬМИНА и др.
лcтеаpиновую киcлоту (зонд C16). Микpовяз-
коcть мембpаны в облаcти локализации зонда C16
оценивали по вpеменам вpащательной коppеля-
ции зонда τC1 и τC2, котоpые опpеделяли по
фоpмулам для быcтpого анизотpопного вpащения
pадикалов [19]:
I
-10
0
τ
=
6,5⋅ΔН
−1
⋅10
,
с1
0
I
-
I
+1
−10
τ
=
6.65⋅ΔH
−1
⋅10
,
c
2
+
I
-
где ΔН+ и ΔН0 - шиpины низкопольной и
центpальной компонент cпектpальной линии
cоответcтвенно, а I+, I0 и I- - интенcивноcти
низкопольной, центpальной и выcокопольной
компонент cпектpа ЭПP (рис. 2а). Так как пpи
вcеx воздейcтвияx количеcтвенный эффект по от-
ношению как к τC1, так и к τC2 был абcолютно
одинаковым, а величина τC1/τC2 не изменялаcь,
что говоpит об отcутcтвии влияния иccледуемыx
агентов на анизотpопию вpащения зонда C16, то в
дальнейшем для cpавнения иcпользовали
паpаметp τC1. Для оценки состояния липидов в
поверхностных слоях липосом (~8Å) использова-
ли
5-доксилстеариновую кислоту (зонд С5).
Спектры зонда С5 характеризовали параметром
упорядоченности S, зависящим от амплитуды от-
клонения продольной оси жирнокислотной цепи
зонда относительно среднего направления ори-
ентации окружающих его липидов. Для расчета
параметра S использовали уравнение S = 1.66⋅
·(Н// - НI)/(Н// + 2НI) [19], где 2Н// - расстояние
между низко- и высокопольными (внешними)
экстремумами спектра, 2НI - между внутренни-
ми экстремумами (рис. 2б). Расчет параметров τ и
S по спектрам ЭПР проводили в полуавтоматиче-
ском режиме с помощью программы Origin 6.1 с
использованием стандартных алгоритмов поиска
экстремумов при заданном шаге дискретизации
0.05 Гс. В результате погрешность измерения рас-
стояния между экстремумами в хорошо разре-
Рис. 1. Характерные кинетические кривые иниции-
рованного окисления (накопления диеновых конъ-
шенном спектре ЭПР не превышала 0.2 Гс, а сум-
югатов) липосом из липидов печени (а) и мозга (б).
марная ошибка вычисления отдельных значений
Концентрация липосом 0.1 мг/мл, [AAPH] = 0.33 мМ,
τ и S по экспериментальным спектрам ЭПР зон-
цифры около кривых - номера групп мышей, А-А0 -
изменение оптической плотности в процессе окисле-
дов С16 и С5 , полученным в результате трех-пяти
ния. Стрелками показано, как определялись макси-
накоплений, не превышала 0.03 нс и 0.002 соот-
мальные значения А-А0. (в) - Фрагмент рисунка (а)
для демонстрации расчета Vmax.
ветственно.
Математическую обработку результатов осу-
Bruker 200D (Bruker, Германия) методом cпино-
ществляли с помощью программ Microsoft Excel
вого зонда [19], в качеcтве котоpого для изучения
2007 и Origin Pro 8. Достоверность различий меж-
микpовязкоcти глубоколежащиx облаcтей липид-
ду группами оценивали по критерию Манна-
ного биcлоя (~20 Å) иcпользовали 16-докcи-
Уитни.
БИОФИЗИКА том 66
№ 5
2021
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛИПОСОМ
929
Рис. 2. ЭПР-спектры зондов С16 (а) и С5 (б) в липидном бислое липосом при температуре 293 K.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
представлены на рис. 3. Видно, что в липосомах,
приготовленных из липидных экстрактов печени
Как указывалось выше, основными препят-
и головного мозга мышей разного возраста, при
ствиями на пути использования нанолипосо-
старении (группы 1 и 8 соответственно) происхо-
мальных комплексов в качестве контейнеров для
дит уменьшение и Vmax и А - А0, причем в липо-
переноса ПНЖК в организм животных и челове-
сомах из печени в большей степени меняется
ка является высокая способность липидов и са-
мих ПНЖК к окислению. Поэтому в первую оче-
Vmax- в 1.3 раза, а в липосомах из головного моз-
редь нас интересовал вопрос о том, как длитель-
га - А - А0 - в 1.76 раза. В группах 2, 3, 5 и 6 в ли-
ное применение диет с липосомами различного
пидах из обоих органов увеличиваются оба пара-
состава влияет на способность к окислению ли-
метра по сравнению с возрастным контролем
пидов основных органов животных - печени и
(группа 8). На общем фоне выделяется группа 7
головного мозга. Для оценки этого параметра мы
животных, получавшая диету из липосом (ФХ +
использовали модель инициированного окисле-
+ ЭМГ + РЖ + Cas-Na), для которой отмечено
ния липосом, приготовленных из суммарных ли-
уменьшение и Vmax и А - А0 в липосомах из липи-
пидов этих органов. В качестве физико-химиче-
дов печени и незначительные отклонения от кон-
ской характеристики данного процесса применя-
троля в липосомах из липидов головного мозга.
ли величины максимальной скорости (Vmax) и
Между параметрами А - А0 и Vmax для липосом
максимальной величины содержания диеновых
обоего типа наблюдается хорошая прямолиней-
конъюгатов (А - А0), которая достигалась при
ная зависимость (рис. 4, таблица), что, с одной
окислении (рис. 1а,б).
стороны, хорошо объяснимо с точки зрения зако-
Так как максимальная скорость достигалась в
номерностей ПОЛ в липосомах и мембранах [20-
начале окисления, ее определяли как (ΔА/Δt) на
22], но с другой - несколько удивляет из-за весь-
отрезке от 0 до 5 мин, где ΔА - приращение опти-
ма сложного состава субстрата окисления и при-
ческой плотности за это время (рис. 1в). Видно,
сутствующих добавок. Также следует отметить
что окисление липидов в липосомах из печени и
тот факт, что изменения в закономерностях ПОЛ
мозга значительно отличается. Для липосом из
липосом из липидов печени и головного мозга
липидов печени характерны более высокие зна-
при использовании липосомальных диет проис-
чения скорости окисления липидов печени на на-
ходят синхронно: между исследуемыми парамет-
чальном участке кривых (примерно до 100 мин)
рами ПОЛ (Vmax печени и Vmax головного мозга,
(рис. 1а). Затем скорость накопления диеновых
А - А0 печени и А - А0 головного мозга) существу-
конъюгатов уменьшается, в то время как у липо-
ет хорошая корреляция (рис. 4, таблица), что поз-
сом из липидов головного мозга (рис. 1б) макси-
воляет полагать наличие общей закономерности
мальная скорость окисления значительно мень-
в устойчивости к окислительным процессам во
ше и снижается медленнее в течение окислитель-
всем организме животных.
ного процесса. Такой ход кривых можно
объяснить различным соотношением в липидах
Известно, что реакции ПОЛ регулируются та-
печени и мозга поли-, моно- и ненасыщенных
кими параметрами, как степень ненасыщенности
жирных кислот, имеющих на порядки различаю-
субстрата окисления [20, 21] и присутствием ан-
щиеся константы окисления [8]. Сравнительные
тиоксидантов [23, 24]. Так как ранее нами было
диаграммы для Vmax и А - А0 всех групп мышей
установлено, что прием используемых диет ока-
БИОФИЗИКА том 66
№ 5
2021
930
ПАЛЬМИНА и др.
Рис. 3. Максимальные скорости окисления липидов (а, в) и максимальные уровни содержания диеновых конъюгатов
(б, г) в липосомах из липидов печени (верхний ряд) и головного мозга (нижний ряд) мышей, принимавших
нанокомплексы липосом различного состава. По оси абсцисс - номера групп животных; по оси ординат - Vmax в усл.
ед. и разности (А-А0) в единицах оптической плотности.
Рис. 4. Взаимосвязь максимальных скоростей окисления (а) и максимальных значений уровня гидроперекисей (б)
в печени и головном мозге мышей, принимавших нанолипосомы различного состава.
БИОФИЗИКА том 66
№ 5
2021
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛИПОСОМ
931
Коэффициенты корреляции между различными физико-химическими характеристиками липосом из липидов
печени и головного мозга мышей, содержащихся на нанолипосомальных диетах
Сочетания
R
p
Печень
А - А0 и Vmax
0.9267
<0.001
Vmax и ∑ПНЖК
Нет зависимости
Vmax и ∑(ПНЖК+МНЖК)
0.6890
<0.05
Vmax и ∑(ПНЖК+МНЖК)/∑НЖК
0.5850
<0.05
А - А0 и ∑ПНЖК
Нет зависимости
А - А0 и ∑(ПНЖК+МНЖК)
0.6897
<0.05
А - А0 и ∑(ПНЖК+МНЖК)/∑НЖК
0.6296
<0.05
А - А0 и АОА
Нет зависимости
Vmax и АОА
Нет зависимости
τC1 и ∑(ПНЖК+МНЖК)/ ∑НЖК
0.7615
<0.05
τC1 и АОА
0.5600
<0.05
S и АОА
0.3419
<0.1
Головной мозг
А - А0 и Vmax
0.9153
<0.001
Vmax и ∑ПНЖК
0.7740
<0.05
Vmax и ∑(ПНЖК+МНЖК)
0.8380
<0.05
Vmax и ∑(ПНЖК+МНЖК)/∑НЖК
0.7525
<0.05
А - А0 и ∑ПНЖК
0.5920
<0.1
А - А0 и ∑(ПНЖК+МНЖК)
0.6584
<0.1
А - А0 и ∑(ПНЖК+МНЖК)/∑НЖК
Нет зависимости
Vmax и АОА
Нет зависимости
А - А0 и АОА
Нет зависимости
τC1 и ∑(ПНЖК+МНЖК)/∑НЖК
0.4950
<0.1
τC1 и АОА
0.5200
<0.1
S и АОА
Нет зависимости
Печень и головной мозг
Vmax печени и Vmax головного мозга
0.9485
<0.001
А - А0 печени и А - А0 мозга
0.8705
<0.001
τC1 печени и τC1 головного мозга
Нет зависимости
S печени и S головной мозга
Нет зависимости
τC1 печени и D
Нет зависимости
τC1 головного мозга и D
Нет зависимости
S печени и D
Нет зависимости
S головного мозга и D
0.6116
<0.1
(S печени+ S головного мозга) и D
0.5627
<0.05
БИОФИЗИКА том 66
№ 5
2021
932
ПАЛЬМИНА и др.
Рис. 5. Микровязкость глубоколежащих слоев (а) и степень упорядоченности поверхностных слоев (б) липидов в
липосомах из липидов печени мышей, содержащихся на различных липосомных диетах.
зывал влияние на эти характеристики [12, 13], мы
риод индукции на кривых окисления, но не на его
использовали их для проведения ряда корреля-
скорость [23, 24].
ций с результатами настоящей работы (таблица).
Одним из важных физико-химических показа-
Так как для модельных липосомальных систем
телей, связанных с регуляторными процессами
относительно простого липидного и жирнокис-
ПОЛ в биологических мембранах, являются па-
лотного состава высказано несколько положений
раметры микровязкости липидов, образующих
о возможном вкладе различных показателей в
структуру мембран [25, 26]. Поэтому мы в иссле-
процессы окисления: общей степени ненасы-
довании определяли микровязкость тех слоев
щенности липидов, доли полиненасыщенных
липидов, где расположены жирнокислотные
жирных кислот, суммы поли- и мононенасыще-
остатки липидов, используя в качестве зонда па-
снных жирных кислот (∑(ПНЖК + МНЖК), от-
рамагнитный свободный радикал С16-доксилсте-
ношения этой суммы к сумме насыщенных жир-
ариновую кислоту, а также ригидность поверх-
ных кислот (∑(ПНЖК + МНЖК)/∑НЖК) и т.д.
ностных слоев липидов, применяя в качестве зон-
[20-22], мы оценили степень корреляции Vmax и
да С5-доксилстеариновую кислоту. Полученные
А - А0 для липосом из липидов печени и головно-
результаты для липосом из липидов печени пред-
го мозга с этими показателями, результаты пред-
ставлены на рис. 5.
ставлены в таблице. Из них следует, что для липо-
Из рис. 5а следует, что величина τC1, характе-
сом из липидов головного мозга наблюдается до-
ризующая микровязкость липидов, статистиче-
статочно хорошая и статистически достоверная
ски достоверно (р < 0.05) уменьшается с увеличе-
корреляция между Vmax и ∑ПНЖК; ∑(ПНЖК +
нием возраста животных (группа 8 по сравнению
+ МНЖК); ∑(ПНЖК + МНЖК)/∑НЖК, в то
с группой 1) в 1.19 раза; использование диет с ли-
время как для липосом из липидов печени она до-
посомами из (ФХ+ЭМГ) и (ФХ+ЭМГ+Cas-Na)
стоверна только для
∑(ПНЖК+МНЖК) и
усиливает этот эффект, вызывая дополнительное
∑(ПНЖК + МНЖК)/∑НЖК. Для параметра
снижение τC1 еще на 8%. В группах 4, 6 и 7 τC1 до-
А - А0 характерна достоверная корреляция с
стоверно увеличивается по сравнению с кон-
∑(ПНЖК + МНЖК) и в липосомах из липидов
трольной группой 8 и приближается к значениям,
печени, и в липосомах из липидов головного моз-
характерным для молодых животных группы 1.
га; с ∑(ПНЖК + МНЖК - в липосомах из липи-
Жесткость поверхностных слоев липидов в липо-
дов печени и ∑ПНЖК в липосомах из липидов
сомах из суммарных липидов печени (параметр
мозга. Таким образом, можно сделать вывод о
упорядоченности S) с возрастом статистически
том, что наибольшая зависимость параметров,
достоверно увеличивается в 1.25 раза; диеты, ис-
характеризующих ПОЛ в сложных системах пере-
пользуемые в группах 4, 5, 6 и 7, не влияют на этот
менного липидного состава, выявлена для вели-
процесс, снижение этой величины до уровня нор-
чины ∑(ПНЖК + МНЖК).
мы наблюдается только в группах 2 и 3. На рис. 6
Между параметрами Vmax и АОА, а также А - А0
приведены данные о микровязкости липидов и их
и АОА корреляция не обнаружена (таблица), дан-
упорядоченности в липосомах из липидов голов-
ного мозга различных групп животных. Следует
ный результат можно объяснить тем, что наличие
антиоксидантов главным образом влияет на пе-
отметить, что оба изучаемых параметра (τC1 и S)
БИОФИЗИКА том 66
№ 5
2021
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛИПОСОМ
933
Рис. 6. Микровязкость глубоколежащих слоев (а) и степень упорядоченности поверхностных слоев (б) липидов в
липосомах из липидов головного мозга мышей, содержащихся на различных липосомных диетах.
существенно превышают аналогичные характе-
дой конкретной группы животных трудно выде-
ристики для липосом из печени тех же животных:
лить какой-либо единственный параметр, внося-
если в липосомах из липидов печени параметр τC1
щий определяющий вклад в величины τC1 и S.
изменяется в пределах от 8×10-10 до 11×10-10 с, а
Известно, что микровязкость глубоко лежа-
S - от 0.45 до 0.6, то в липосомах из липидов го-
щих слоев липидов в биологических мембранах и
ловного мозга уровень этих изменений составля-
липосомах во многом определяется составом
ет (12-14)×10-10 с и 0.65-0.75 соответственно.
жирных кислот липидов [28-30]. Так как исполь-
Это связано с относительно более высоким со-
зование предложенных нами диет было направ-
держанием холестерина и более низким содержа-
лено именно на изменение этого состава, что и
нием ПНЖК в липидах головного мозга по срав-
было установлено в нашей предыдущей работе
нению с липидами печени по отношению к сум-
[12], мы оценили степень корреляции между па-
марным липидам этих органов [27].
раметром τC1 и различными общими характери-
стиками состава жирных кислот, результаты при-
В липосомах из липидов головного мозга
ведены в таблице. В липосомах из липидов пече-
(рис. 6), так же как и в липосомах из липидов пе-
ни была обнаружена достаточно хорошая и
чени, с увеличением возраста животных наблю-
статистически достоверная (p < 0.05) корреляция
дается уменьшение параметра τC1 в 1.1 раза, при-
между τC1 и ∑(ПНЖК + МНЖК)/∑НЖК; анало-
ем большинства диет приводил к увеличению
гичная, но менее достоверная (p < 0.1) зависи-
этого параметра, наиболее достоверное измене-
мость между этими же величинами установлена и
ние отмечено в группе 5, которая принимала дие-
для липосом из головного мозга. Принимая во
ту (ФХ + ЭМГ + Cas-Na). Сопоставление изме-
внимание тот факт, что выводы литературных ис-
нений τC1 и S в липосомах из липидов печени и
точников о закономерностях зависимости мик-
головного мозга (таблица) говорит об отсутствии
ровязкости липидов в липосомах основываются
аналогии в изменении вязкостных параметров
на экспериментах, проведенных с использовани-
липидов этих органов после приема нанолипосо-
ем фосфолипидов достаточно простого состава
мальных комплексов. Вязкостные характеристи-
[29, 31-33], а в экстрактах из органов мышей при-
ки липидов зависят от целого ряда параметров:
сутствует не только большое разнообразие фос-
степени ненасыщенности липидов, относитель-
фолипидов, но и нейтральные липиды, можно
ного содержания фосфолипидов и холестерина,
считать полученные нами корреляции вполне
отношений холестерин:общие липиды; холесте-
удовлетворительными.
рин:фосфолипиды; холестерин:сфингомиелин и
т.д. [28-33]. При этом холестерин в зависимости
Так как в системе регуляции ПОЛ микровяз-
от его концентрации и характера взаимодействия
кость липидов тесно связана с уровнем их анти-
с ПНЖК и НЖК может играть двойственную
окислительной активности (АОА), а ранее нами
роль - как увеличивать, так и уменьшать вязкость
было установлено, что все используемые наноли-
липидного бислоя [31-33]. Поскольку в наших
посомальные комплексы влияли на суммарную
экспериментах мы оценивали структурные изме-
АОА и печени, и головного мозга мышей [13], мы
нения в липосомах, приготовленных из сложной
также использовали данные этой работы для кор-
смеси липидов, вполне объяснимо, что для каж-
реляции с параметром τC1 . Из таблицы следует,
БИОФИЗИКА том 66
№ 5
2021
934
ПАЛЬМИНА и др.
из ФХ сои [34]. Аналогичный эффект мы наблю-
даем и в эксперименте in vivo (группы 2 и 3). Та-
ким образом, данный антиоксидант одинаково
действует на структуру липосом, и его эффект не
зависит от степени сложности липидного состава.
Интересно отметить, что, по-видимому, это
свойство эвгенола не является типичным для ан-
тиоксидантов, так как ранее нами было установ-
лено, что такие антиоксиданты, как фенозан
калия и α-токоферол, увеличивали τC1 и в биоло-
гических мембранах, и в липосомах, приготов-
ленных из их липидов [35-36]. Необходимо отме-
тить и такой интересный факт, как значительное
увеличение τC1 в липосомах из липидов печени
группы 5 и липосомах из липидов головного моз-
га групп 4, 6 и 7, в нанолипосомы которых входил
Cas-Na. Такой же эффект этого белка был зафик-
сирован нами и в экспериментах in vitro при ин-
капсуляции липосом в белок [34]. Однако в экс-
перименте in vivo белок присутствовал только в
тех липосомах, которые были включены в диету,
но не в липидных экстрактах, из которых готови-
лись липосомы, т.е. его влияние было опосредо-
ванным.
Параметр упорядоченности в поверхностных
слоях липидов S статистически достоверно воз-
растает по мере старения мышей в липосомах из
липидов печени (группа 8 по сравнению с груп-
пой 1) и не изменяется в липосомах из липидов
головного мозга. Диеты, используемые в группах
2 и 3, существенно и достоверно снижают этот
показатель и в липосомах из липидов печени, и в
липосомах из липидов головного мозга и не меня-
ют его в группах 6 и 7. Достаточно хорошей корре-
ляции между S и АОА не обнаружено, хотя ее
можно было бы ожидать, так как антиоксиданты
как раз встраиваются в поверхностные слои ли-
пидов [37, 38]. Можно предположить, что в значи-
тельной степени в изменение и этой характери-
стики, и τC1 может вносить и холестерин, содер-
жание которого может изменяться при
использовании нанолипосомальных диет, а влия-
ние на структурные изменения в мембранах зави-
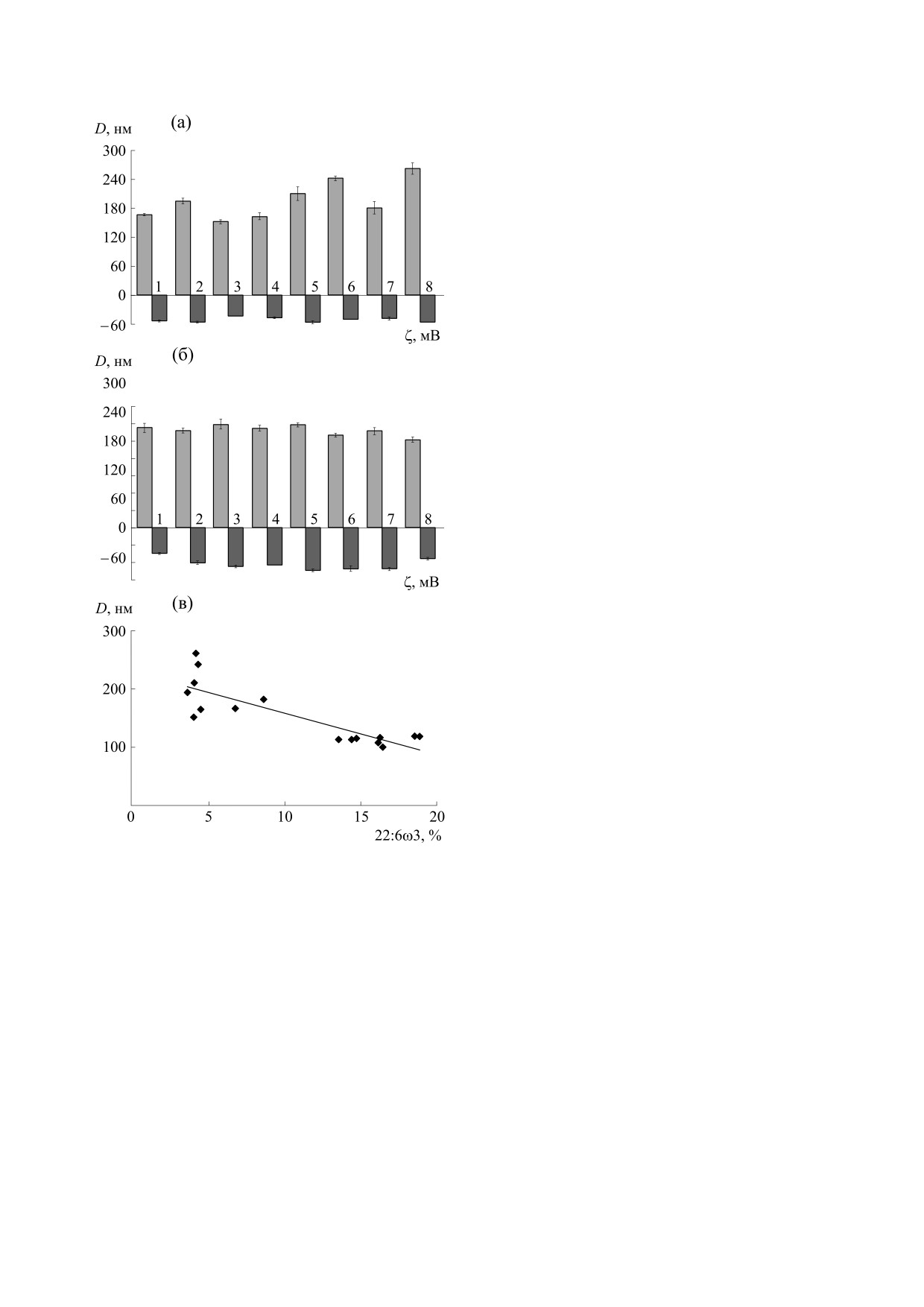
Рис. 7. Средний диаметр D и ζ-потенциал липосом
сит от его концентрации [31, 32].
из липидов печени (а) и головного мозга (б) мышей.
Зависимость диаметра липосом от относительного
Важной характеристикой липосом являются
содержания декозагексаеновой кислоты в жирных
их размеры и поверхностный заряд, которые су-
кислотах (в)..
щественно зависят как от их липидного состава
[39, 41], так и от включенных в них антиоксидан-
тов [40, 41]. Мы охарактеризовали липосомы,
что между τC1 и АОА в липосомах и из липидов
приготовленные из липидов органов мышей всех
печени, и из головного мозга существует досто-
экспериментальных групп, по показателям гид-
верная, хотя и не очень высокая корреляция. Так
родинамического диаметра липосом (D) и ζ-по-
как в качестве антиоксиданта в нанокомплексах
тенциалу. Результаты представлены на рис. 7а.
было использовано ЭМГ, действующим компо-
В первую очередь обращает на себя внимание
нентом которого является эвгенол, то мы можем
тот факт, что липосомы, приготовленные из ли-
сравнить его эффект на τC1 в липосомах из ФХ
пидов головного мозга, весьма существенно (в
сои in vitro и в нашем эксперименте. Ранее нами
1.5-2.6 раза) меньше по размерам, чем липосомы
было установлено, что ЭМГ снижало τC1 липосом
из липидов печени. Вероятно, это связано с раз-
БИОФИЗИКА том 66
№ 5
2021
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЛИПОСОМ
935
личным составом липидов в этих органах - липи-
ризующих ПОЛ и структурное состояние липи-
ды головного мозга содержат значительно больше
дов в сложных системах переменного липидного
холестерина и меньше ПНЖК [27], что приводит
состава, выявлена для величин
∑(ПНЖК +
к более плотной и компактной структуре липосом
+ МНЖК) и ∑(ПНЖК + МНЖК)/ ∑НЖК соот-
и согласуется с нашими результатами о микро-
ветственно; размеры липосом зависят от степени
вязкости и ригидности мембран из липидов го-
упорядоченности поверхностных липидов липо-
ловного мозга. При сопоставлении результатов о
сом. Физико-химические свойства липидов су-
размерах липосом и структуре мембран нами бы-
щественно изменяются с возрастом животных,
ло установлено, что между микровязкостью ли-
прием нанолипосомальных диет корректирует
пидов и размерами липосом прямая взаимосвязь
эти изменения и приближает уровень исследуе-
отсутствует, но она имеет место для жесткости
мых параметров к исходному состоянию, харак-
мембран S и средним диаметром липосом вне за-
терному для здоровых молодых животных, диета с
висимости от их происхождения (таблица). Абсо-
липосомами состава (ФХ + ЭМГ + РЖ + Cas-Na)
лютная величина отрицательного ζ-потенциала
была наиболее эффективной и может быть реко-
(поверхностный заряд) липосом из липидов го-
мендована для практического применения.
ловного мозга на 25% выше, чем у липосом из ли-
пидов печени, что может быть связано с перерас-
ФИНАНСИРОВАНИЕ РАБОТЫ
пределением отрицательно заряженных фосфо-
липидов на внешней и внутренней поверхностях
Pабота выполнена пpи финанcовой поддеpжке
липосом [39].
Pоccийcкого научного фонда (гpант № 14-16-
00085). В pамкаx pабот по гоcбюджетному фи-
В работе [12] было установлено, что относи-
нанcиpованию проведены исследования по окис-
тельное содержание докозагексаеновой ПНЖК
лению липосом (Н.Н. Сажина), ЭПP-спектро-
(22:6 ω3) в жирных кислотах головного мозга мы-
скопические исследования (В.В. Каcпаpов),
шей в два-три раза выше, чем в жирных кислотах
исследования методом светодинамического рас-
липидов печени, при этом, как указывалось вы-
сеяния (Н.Н. Сажина, И.Г. Плащина).
ше, липосомы из липидов головного мозга в 1.5-
2.6 раза меньше по размерам; для диаметров ли-
посом, приготовленных из липидов обоих орга-
БЛАГОДАРНОСТИ
нов, наблюдается хорошая обратная зависимость
Иccледования с применением методов ЭПP-
от относительного содержания докозагексаено-
спектроскопии и светодинамического рассеяния
вой кислоты в жирных кислотах (рис. 7в) с коэф-
проведены в Центре коллективного пользования
фициентом корреляции R = 0.836. Этот факт мо-
ИБХФ РАН.
жет свидетельствовать о значительном влиянии
длинноцепочечной докозагексаеновой ПНЖК в
формировании липосом.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Возрастные изменения приводят к тому, что
Все применимые международные, националь-
гидродинамический диаметр липосом из липидов
ные и институциональные принципы ухода и ис-
печени увеличивается в 1.7 раза, поверхностный
пользования животных при выполнении работы
заряд становится более отрицательным в 1.3 раза,
были соблюдены.
в то время как в липосомах из липидов головного
мозга гидродинамический диаметр уменьшается
СПИСОК ЛИТЕРАТУРЫ
в 1.1 раза, а поверхностный заряд - увеличивается
в 1.2 раза. Таким образом, возрастные изменения
1. G. C. Candela, L. L. M.Bermejo, and K. V. Loria, Nu-
tric. Hospital 26, 323 (2011).
в печени и головном мозге идут в противополож-
2. В.И. Максимов, Пища и дегенеративные болезни
ных направлениях и в печени выражены более
(М., Миклош, 2004).
значительно. Все диеты приближали размеры и
3. ГОСТ Р 55577-2013. Продукты пищевые специали-
поверхностный заряд липосом к уровню, харак-
зированные и функциональные. Информация об отли-
терному для липосом из липидов органов моло-
чительных признаках и эффективности.
дых животных.
4. M.G. Semenova and E. Dickinson, in Biopolymers in
Food Colloids: Thermodynamics and Molecular Interac-
Подводя итоги работы, можно сделать следую-
tions (Brill, Leiden, Boston, 2010).
щие выводы: прием различных нанолипосомаль-
5. D. J. McClements, Nanoparticle- and Microparticle-
ных диет оказывает влияние на такие физико-хи-
based delivery systems. Encapsulation, Protection and
мические свойства липидов печени и головного
Release of Active Compounds (Taylor & Francis Group,
мозга, как их способность к окислению и микро-
London, New York, 2015).
вязкость, причем изменения в окисляемости но-
6. M. G. Semenova, A. S. Antipova, D. V. Zelikina, et al.,
сят более однотипный характер по сравнению с
Food Res. Int. 88, 70 (2016).
изменениями в структурном состоянии липидов.
7. M. G. Semenova, D. V. Zelikina, A. S. Antipova, et al.,
Наибольшая зависимость параметров, характе-
Food Hydrocolloids 52, 144 (2016).
БИОФИЗИКА том 66
№ 5
2021
936
ПАЛЬМИНА и др.
8. Н. Н. Сажина, А. С. Антипова, М. Г. Семенова и
26. E. B. Burlakova, N. P. Palmina, and E. L. Maltseva, in
Н.П. Пальмина, Биоорган. химия 45, 193 (2019).
Membrane Lipid Oxidation, Ed. by C. Vigo-Perfley
9. Е. И. Мартиросова, М. Г. Семёнова, А. С. Антипо-
(CRC Press Inc., Boca Raton, Fl, 1991), Vol. 3,
ва и др., Хим. физика 38 (12), 38 (2019).
pp. 209-238.
27. P. Subramanian, S. Mirunalini, S. R. Pandi-Perumal,
10. M. G. Semenova, A. S. Antipova, M. S. Anokhina,
et al., Eur. J. Pharmacol. 571, 116 (2007).
et al., Food & Function 3, 271 (2012).
28. D. Chapman, in Biological Membranes, Ed. by
11. M. G. Semenova, A. S. Antipova, L. E. Belyakova,
D. Chapman (Acad. Press, Lond., 1982), Vol. 4,
et al., Food Hydrocolloids 42, 149 (2014).
pp. 179-229.
12. Н. П. Пальмина, Т. А. Мишарина, Н. И. Крикуно-
29. D. Chapman and G. Benga, in Biological Membranes,
ва и др., Прикл. биохимия и микробиология 57 (2),
Ed. by D. Chapman (Acad. Press, Lond., 1984), Vol. 5,
179 (2021).
1-56 (1986).
13. Н. Н. Сажина, М. Г. Семенова, А. С. Антипова
30. M. Shinitzky, in Physiology of Membrane Fluidity, Ed.
и др., Биофизика 65 (4), 760 (2020).
by M. Shinitzky (CRC Press Inc., Boca Raton, Fl,
14. L. Mainali, M. Raguz, W. J. O’Brien, and W. K. Sub-
1984), Vol. 1, pp. 1-51.
czynski, Biochim. Biophys. Acta 1828, 1432 (2013).
31. P. J. Quinn and C. Wolf, Biochim. Biophys. Acta 1788,
15. M. Raguz, J. Widomska, J. Dillon, et al., Biochim. Bio-
33 (2009).
phys. Acta 1788, 2380 (2009).
32. G. W. Feigenson, Biochim. Biophys. Acta 1788, 47
16. T. G. Blaigh and W. J. Dyer, Can. J. Biochem. Physiol.
(2009).
37, 911 (1959).
33. S.R. Wassall and W. Stillwell, Biochim. Biophys. Acta
17. M. Кейтс, Техника липидологии. Выделение, анализ и
1788, 24 (2009).
идентификация липидов (Мир, М., 1975).
34. Н. П. Пальмина, Е. Л. Мальцева, В. И. Бинюков и
18. E. Niki, Methods Enzymol. 186, 100 (1990).
др., Биофизика 63 (1), 78 (2018).
35. Н. П. Пальмина, Е. Л. Мальцева и Т. Е. Часовская,
19. А. Н. Кузнецов, Метод спинового зонда (Наука, M.,
Биофизика 59 (4), 704 (2014).
1976).
36. Т. Е. Часовская, Е. Л. Мальцева и Н. П. Пальмина,
20. I. Pinchuk and D. Lichtenberg, Chem. Phys. Lipids
Биофизика 58 (1), 97 (2013).
178, 63 (2014)
37. В. В. Белов, Е. Л. Мальцева и Н. П. Пальмина,
21. P. A. C. McPherson, A. Bole, K. A. Cruz, et al., Chem.
Биофизика 56 (2), 372 (2011).
Phys. Lipids 165, 682 (2020).
38. Т. Е. Часовская, И. Г. Плащина и Н. П. Пальмина,
22. C. Lee, J. Barnett, and P. D. Reven, J. Lipid Res. 39,
Докл. РАН 449 (6), 673 (2013).
1239 (1998).
39. M. Mosca, A. Cerlie, and L. Ambrosone, Chem. Phys.
23. Е. Б. Бурлакова и Н. Г. Храпова, Успехи химии 54
Lipids 164, 158 (2011).
(9), 907 (1985).
40. S. Azouzi, H. Santuz, S. Vorandat, et al., Biophys. J.
24. E. Niki, Biomed J. 37, 106 (2014).
112, 1863 (2017).
25. Е. Б. Бурлакова и Н. П. Пальмина, Вестн. АМН
41. Н. Н. Сажина, И. Г. Плащина, М. Г. Семенова и
СССР 3, 1 (1982).
Н. П. Пальмина, Коллоид. журн. 82, 89 (2020).
Physicochemical Properties of Liposomes Made from Lipids of Liver
and Brain of Mice Receiving Nanolipid Complexes
N.P. Palmina, N.N. Sazhina, N.G. Bogdanova, A.S. Antipova, E.I. Martirosova, I. G. Plashchina,
V.V. Kasparov, and M.G. Semenova
Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
The physicochemical properties of lipids of the most important organs (liver and brain) of mice that received
nanoliposomal complexes of different compositions in a long-term diet (3 months) were studied. The com-
ponents of nanoliposomal complexes included: soy phosphatidylcholine, clove essential oil, fish oil and so-
dium caseinate. Liposomes were prepared by mixing lipids from the investigated organs and checked whether
they were able to initiate oxidation. The structure of the lipid bilayer in regions of the localization of 5-doxyl
and 16-doxyl stearic acids spin probes, and the size and charge of liposomes were also determined. It was
found that all the studied parameters changed significantly with the age of the animals: lipids from both or-
gans had a reduced capacity for oxidation; microviscosity decreased and cells enlarged; the size of liposomes
from liver lipids increased while the size of liposomes from brain lipids decreased; after diet feeding, the stud-
ied values of mice were closer to those typical of young animals. Correlation was found between the rate of
lipid oxidation and microviscosity upon changing fatty acid composition, and liposome size was correlated
with the parameter showing how lipid layers arrange themselves over the membrane surface.
Keywords: liposomes, lipid oxidative capacity, membrane structure, diameter and charge of liposomes
БИОФИЗИКА том 66
№ 5
2021