БИОФИЗИКА, 2021, том 66, № 5, с. 954-963
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.25
ОПТИМИЗАЦИЯ КИСЛОТНО-ЩЕЛОЧНОГО СОСТАВА
ИНКУБАЦИОННОЙ СРЕДЫ ДЛЯ ДЛИТЕЛЬНОЙ И ОБРАТИМОЙ
КРИОКОНСЕРВАЦИИ СРЕЗОВ МОЗГА
НЕГИБЕРНИРУЮЩИХ ЖИВОТНЫХ
© 2021 г. А.А. Мокрушин
Институт физиологии им. И.П. Павлова РАН, Россия, 199034, Санкт-Петербург, наб. Макарова, 6
E-mail: mok@inbox.ru
Поступила в редакцию 29.10.2020 г.
После доработки 01.12.2020 г.
Принята к публикации 03.12.2020 г.
Обнаружено, что после длительного криосохранения срезов мозга при -10°С активность N-метил-D-
аспартат-зависимых механизмов (амплитуда N-метил-D-аспартат-потенциалов) блокировалась. Для
восстановления активности N-метил-D-аспартат-зависимых механизмов после криосохранения/ото-
гревания исследовали изменения внеклеточного (рНо) инкубационного раствора. Обнаружено,
что при интервалах рНо 7.2-7.4 происходило ступенчатое закисление инкубационной среды до
рНо 6.5 ± 0.2. При этом значении рНо амплитуда N-метил-D-аспартат-потенциалов снижалась до
33%. Изменение инкубационной среды (гибридная буферная система, включающая карбонатный,
фосфатный и трис-буфер) до рНо 7.7 способствовало восстановлению амплитуды N-метил-D-аспар-
тат-потенциалов до 84% по сравнению с исходными значениями (до криоконсервации). Таким обра-
зом, использование буферной системы с трис(гидроксиметил)аминометаном, а также увеличение рНо
до 7.7 были наиболее оптимальными условиями для восстановления активности N-метил-D-аспартат-
зависимых механизмов при отогревании после длительного криосохранения.
Ключевые слова: срезы мозга, НМДА-потенциалы, криосохранение, буферные системы.
DOI: 10.31857/S0006302921050136
нением клеточной неоднородности и синаптиче-
Исследование закономерностей и способов
ских связей. Исследователи также изучали при-
обратимого ингибирования жизнедеятельности
чины криоповреждения и способы криопротек-
клеток и органов млекопитающих после их крио-
ции нервной ткани моллюска. Для этих целей
сохранения при низких температурах представля-
было протестировано нейропротекторное дей-
ет особый как теоретический интерес, так и прак-
ствие пептида TSKY, выделенного из мозга зим-
тическое значение для пересадки тканей, органов
и создания криобанка трансплантатов [1].
неспящих животных [2-4]. Несомненным досто-
инством этих работ являются результаты с ис-
В настоящее время в медицине и ветеринарии
пользованием метода культуры in vitro, было
применяется низкотемпературное хранение од-
показано, что нейроны, выделенные из оттаянно-
нотипных клеток (ооциты, сперматозоиды, клет-
го мозга моллюска, сохраняют способность фор-
ки крови и др.) с последующим восстановлением
мировать нейриты и образовывать нейрональные
их биологических функций после отогревания и
сети, аналогичные тем, что образуют нейроны
использования их в клинических условиях.
моллюска, не прошедшие криоконсервацию. Эти
В России проблемы низкотемпературного
данные позволяют изучать криосохранение нерв-
криосохранения активно изучаются в Институте
ной ткани незимнеспящих млекопитающих для
биофизики клетки РАН (Пущино Московской
создания криобанка.
области). Одним из интересных направлений
Другие перспективные исследования криосо-
являются исследования под руководством
хранения возбудимых тканей проводятся в том же
Э.Н. Гаховой на целом мозге моллюска с сохра-
институте в лаборатории Е.Е. Фесенко на мио-
карде крыс и изолированного сердца барана. Од-
Сокращения: АМПА - α-амино-3-гидрокси-5-метилизок- нако это направление связано с применением га-
сазол-4-пропионовая кислота, НМДА - N-метил-D-ас-
зовой среды, состоящей из смеси газов СО и О2,
партат, ЛОТ - латеральный обонятельный тракт, ФП -
фокальный потенциал.
что принципиально отличается от жидких сред
954
ОПТИМИЗАЦИЯ КИСЛОТНО-ЩЕЛОЧНОГО СОСТАВА
955
криосохранения живых тканей. Для пролонгиро-
явленные закономерности модификаций НМДА-
вания криосохранения миокарда крыс применя-
зависимых механизмов можно использовать для
ются нейропротекторы и антибиотики. Практи-
создания банка трансплантантов.
ческим достижением этих исследований является
Традиционно для сохранения функциониро-
разработка камеры для гипотермического хране-
вания нервных структур используются различные
ния сердца крыс и баранов. Полученные положи-
криопротекторы. Однако они проявляют выра-
тельные результаты криосохранения миокарда
женные негативные эффекты на функциониро-
обнадеживают [5].
вание нейронов и синапсов. По этой причине мы
Что касается длительной криоконсервации
отказались от их использования в настоящей ра-
боте.
нервных тканей незимнеспящих млекопитаю-
щих, то надежные протоколы и методы для при-
Для выявления причины криоповреждения
менения в терапии лечения заболеваний до сих
НМДА-механизмов были исследованы измене-
пор детально не разработаны. По всей вероятно-
ния рНо инкубационной среды и было обнаруже-
сти, это связано с гетерогенным клеточным со-
но снижение рНо (закисление) инкубационной
ставом нервной ткани (нейроны, глиальные клет-
среды в процессе отогревания срезов. Была вы-
ки, синапсы), а также с отсутствием стандартных
сказана гипотеза, что для уменьшения наруше-
протоколов процесса замораживания/отогрева-
ний функционирования глутаматергических
ния [6-8].
ионотропных НМДА-зависимых механизмов при
Большое значение в решении этой проблемы,
криоконсервации необходимо оптимизировать
на наш взгляд, имеет выбор экспериментальных
характеристики рНо инкубационного раствора.
моделей для изучения механизмов криосохране-
Справедливость этого предположения подтвер-
ния нервной ткани млекопитающих. При разра-
ждается результатами исследований, в которых
ботке методов криоконсервации нервной ткани
было выявлено, что возбудимость нейронов в
срезы мозга являются оптимальными экспери-
нормотермических условиях особенно чувстви-
ментальными объектами. Ранее проведенные на-
тельна к изменениям внутриклеточного рН (pHi)
ми эксперименты выявили некоторые законо-
и внеклеточного рН (pHо) [18-23]. Однако в экс-
мерности влияния физических факторов, таких
периментах на срезах мозга наиболее надежно
как скорость и глубина замораживания, на вос-
можно измерять влияние рНо на функциониро-
становление синаптической активности в срезах
вание нейронов и синапсов, в том числе на
мозга [9]. В результате исследований было обна-
НМДА-зависимые механизмы.
ружено, что при низких скоростях охлаждения
срезов обонятельной коры мозга
(0.1-
Экспериментально установлено, что опти-
0.125°С/мин) до 16°С активности глутаматергиче-
мальный диапазон рНо инкубационной среды
ских ионотропных АМПА- (α-амино-3-гидрок-
при нормотермических условиях (37°С) для дли-
си-5-метилизоксазол-4-пропионовая кислота) и
тельного поддержания активностей нервных кле-
НМДА-зависимых (N-метил-D-аспартат) меха-
ток и синапсов в срезах мозга составляет рНо 7.2-
низмов сохранялись [10].
7.4. При этих условиях активности глутаматерги-
В дальнейших исследованиях была выявлена
ческих ионотропных (АМПА и НМДА) механиз-
различная резистентность АМПА и НМДА меха-
мов сохранялись в течение 10-12 ч. Отклонения
низмов на замораживании/отогревании срезов
от этих показателей сопровождается нестабиль-
мозга после длительного криосохранения при бо-
ностью активности этих механизмов в срезах моз-
лее глубокой температуре и длительности (-10°С,
га [15].
30 суток). НМДА-зависимые процессы при этих
Цель настоящей работы заключалась в изучении
условиях ингибировались и блокировались тогда,
эффектов гибридной буферной системы (карбонат-
как АМПА механизмы сохранялись, что свиде-
ный (NaHCO3), фосфатный (KH2PO4) трис(гид-
тельствует о значительных криоповреждениях
роксиметил)аминометан (HOCH2)3CNH2)) инку-
НМДА механизмов [9, 11-13]. Это важно, по-
бационного раствора на восстановление электроге-
скольку НМДА-зависимые механизмы ключевые
неза НМДА-механизмов после длительной
структуры возбуждающей глутаматергической
криоконсервации. Активности НМДА-механизмов
медиаторной системы. Они являются адаптивны-
определяли электрофизиологическими методами по
ми механизмами в мозге, участвуют в обучении,
величине амплитуд НМДА-потенциалов.
формировании следов памяти, а также при разви-
тии различных нейропатологий (эпилепсия,
ишемия, травма и др.) [14-17].
МАТЕРИАЛЫ И МЕТОДЫ
Таким образом, изучение особенностей крио-
Эксперименты проведены на крысах-самцах
повреждения НМДА-механизмов имеет исклю-
линии Вистар массой 180-200 г из биоколлекции
чительно важное значение для сохранения актив-
Института физиологии им. И.П. Павлова РАН
ности этих механизмов при криосохранении. Вы-
(«Коллекция лабораторных млекопитающих раз-
БИОФИЗИКА том 66
№ 5
2021
956
МОКРУШИН
ной таксономической принадлежности»), под-
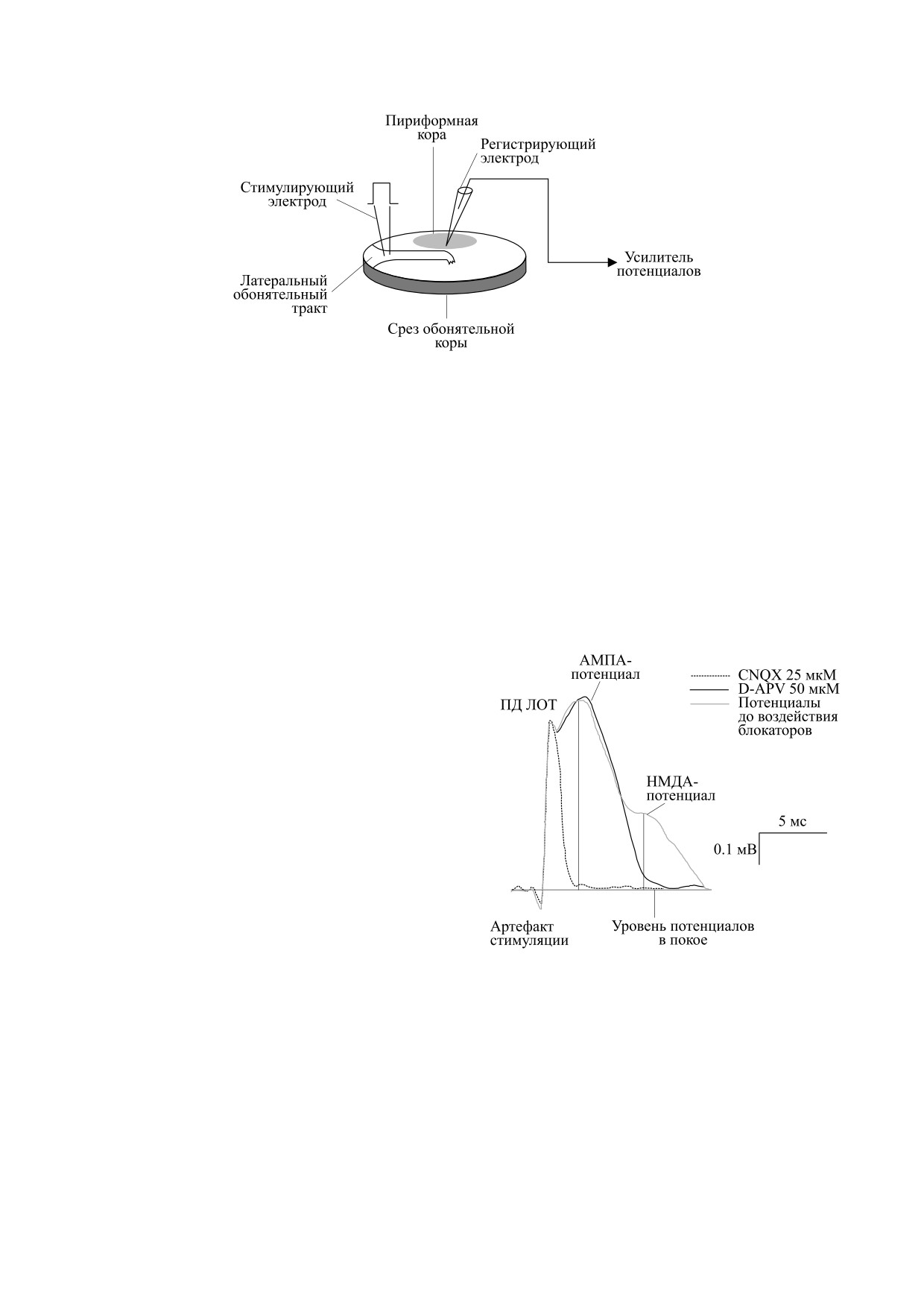
определяли при регистрации этих потенциалов
держанной программой биоресурсных коллек-
экстраклеточно стеклянными микроэлектродами
ций Минобрнауки России с соблюдением реко-
сопротивлением 1-5 мОм, заполненными 1 M
мендаций по этике работы с животными,
NaCl, в ответ на ортодромные электрические им-
предложенными European Communities Council
пульсы (прямоугольной формы, длительностью
Direction (86/609 EEC). Опыты с животными про-
0.1 мс, интенсивностью 0.1-0.3 мА, частотой
водили в соответствии с Руководством Совета
0.003 Гц), генерируемые стимулятором ЭСУ-1
Федерации по уходу и использованию лаборатор-
(Россия) латерального обонятельного тракта
ных животных (1996 г.) и принципами этического
(ЛОТ). Индифферентный хлорсеребряный элек-
кодекса Института физиологии им. И.П. Павлова
трод находился в инкубационной камере. Для де-
РАН (1996 г.).
текции НМДА-потенциалов использовали уси-
Исследования проводили на тангенциальных
литель
(«НТО», Россия). Далее потенциалы
срезах обонятельной коры толщиной 400-500 мкм
оцифровывали при помощи аналого-цифрового
[24], которые изготавливали из мозга крыс-сам-
устройства (Е 20-10, Россия) с частотой кванто-
цов (29 животных). В результате проведенных ис-
вания 20 кГц и обрабатывали на компьютере с по-
следований было установлено, что предельно до-
мощью специальной компьютерной программы
пустимая толщина кортикальных срезов крыс при
«Анализ электрической активности нейронов»
инкубации в атмосфере кислорода составляет в
(Институт физиологии им. И.П. Павлова РАН).
среднем 0.052 см (520 мкм), а при инкубации сре-
Морфологические особенности обонятельной
зов в атмосфере воздуха и присутствии углекислого
коры мозга хорошо различимы в световом микро-
газа - 0.22 мм (220 мкм) [24]. Для изготовления
скопе и позволяют стабильно повторять локали-
срезов использовали станок Емельянова (Инсти-
зации раздражающего электрода в проксималь-
тут физиологии им. И.П. Павлова РАН) [24]. Сре-
ной части ЛОТ, а регистрирующего - в точке его
зы преинкубировали в стеклянных виалах объемом
изгиба. Ранее проведенные исследования проде-
1 мл в аппарате Варбурга (модель ВА 01 10, Герма-
монстрировали, что в этой точке находится фокус
ния) при температуре 37°С с частотой качания
максимальной активности при погружении реги-
120/мин в течение 2 ч, что имитирует кровообра-
стрирующего электрода на глубину 230-270 мкм
щение в мозге. Инкубационная среда одного и того
от пиальной поверхности среза (рис. 1). Парамет-
же состава в виалах со срезами менялась дважды
ры электрической стимуляции ЛОТ (частота, ин-
(через 1 ч и 2 ч преинкубации) для устранения по-
тенсивность) для данного среза после криокон-
врежденных клеток и их метаболитов.
сервации были такие же, как и до замораживания.
Для приготовления инкубационных растворов
была использована дистиллированная вода, ко-
Идентификацию отдельных компонентов фо-
торая хранилась в стеклянном сосуде темного
кального потенциала (ФП), регистрируемого в
цвета объемом 10 л. Непосредственно перед при-
срезах обонятельной коры, проводили с исполь-
готовлением раствора дистиллированную воду
зованием специфических блокаторов: для НМ-
пропускали через колонку с ионообменным за-
ДА-рецепторов - D-2-амино-5-фосфоновалери-
полнителем, состоящим из катионита КУ-2-8 и
ата; для АМПА-рецепторов - 6-циано-7-нитро-
анионита АВ-17-8 («Химреактив», Россия) для
хиноксалин-2,3-диона, с помощью методов,
дополнительной очистки. Значение кислотности
описанных в работах [15, 25, 26]. Вызванные ФП
рНо 7.0 этой воды сохранялось при 25-39°С.
регистрировались в ответ на стимуляцию ЛОТ в
контроле и во время инкубации срезов специфи-
На такой воде были приготовлены инкубаци-
ческими антагонистами АМПА- и НМДА-рецеп-
онные растворы с буферными системами для
торов. ФП является многокомпонентным потен-
предварительной инкубации срезов до заморажи-
циалом и состоит из пресинаптического компо-
вания, хранения и последующего отогревания до
нента, который отражает активность проводящих
37°С.
волокон ЛОТ, и постсинаптических компонен-
Искусственная церебральная жидкость для
тов, которые отражают активацию глутаматерги-
инкубации срезов была следующего состава (в
ческих ионотропных механизмов - АМПА- и
мM): NaCl - 124.0, KCl - 5.0, CaCl2 - 2.6,
НМДА-потенциалов (рис. 2). Для идентифика-
KH2PO4 - 1.24, MgSO4 - 1.2, NaHCO3 - 3.0, глю-
ции НМДА-потенциалов срезы инкубировали с
коза - 10.0, трис-НCl - 23.0, рН - 7.2-7.3. Инку-
D-2-амино-5-фосфоновалериатом (50 мкМ). Для
бационный раствор в виалах со срезами и газовую
предотвращения блокады этих рецепторов иона-
атмосферу над раствором насыщали кислородом,
ми Mg2+ срезы инкубировали в среде с низкой
углекислый газ не использовался.
концентрацией этих ионов (200 мкМ) в течение
После преинкубации срезы поочередно пере-
20 мин. Полученные результаты продемонстри-
носили в регистрирующую проточную камеру
ровали редукцию позднего синаптического ком-
электрофизиологической установки [13, 15]. В
понента ФП, что указывает на его активацию
ней активности НМДА-зависимых механизмов
НМДА-рецепторами. Для выявления АМПА-
БИОФИЗИКА том 66
№ 5
2021
ОПТИМИЗАЦИЯ КИСЛОТНО-ЩЕЛОЧНОГО СОСТАВА
957
Рис. 1. Схема обонятельной коры среза мозга крыс, вид с пиальной поверхности.
компонента ФП срезы инкубировали с 6-циано-
амплитуд НМДА-потенциалов рассматривали
7-нитрохиноксалин-2,3-дионом (25 мкМ) в тече-
как контрольные перед замораживанием. Было
ние 20 мин. Такое воздействие блокировало ран-
выявлено, что применение более частой стимуля-
ний постсинаптический компонент, а также
ции вызывает в срезах частотно-зависимые изме-
НМДА-компонент, сохранялся только преснап-
нения амплитуд ответов, особенно НМДА-по-
тический компонент (рис. 2). Таким образом,
тенциалов, что не представляется оптимальным
проведенная фармакологическая идентификация
для длительного криосохранения.
синаптических компонентов ФП свидетельству-
Затем срезы градуально замораживали до
ет, что ранний АМПА-потенциал отражает акти-
-10°С при медленной скорости (0.1°С/мин) и со-
вацию АМПА-, а поздний - НМДА-рецепторов
храняли при температуре -10°С в морозильнике
(рис. 2). Учитывая проведенные исследования,
термостата «ThermoStat plus» (Eppendorf, Герма-
было выявлено, что максимальная амплитуда
НМДА регистрировалась в фиксированной точке
(8 мс) от артефакта стимуляции (рис. 2).
Криопротекторы в процессе криосохранения
срезов не применялись.
Химические реактивы для приготовления ис-
кусственной цереброспинальной жидкости пред-
ставлены фирмой «Химреактив» (Россия).
Статистическую обработку цифровых данных
проводили с использованием непараметрическо-
го параметра (U-критерий Вилкоксона-Манна-
Уитни). Уровень статистической значимости был
p ≤ 0.05.
Протокол криосохранения срезов заключался в
следующем. Инкубационную среду с вышеописан-
ным ионным составом готовили на гибридной бу-
ферной системе: карбонатный буфер (NaHCO3),
фосфатный буфер (KH2PO4) и трис(гидроксиме-
тил)аминометан (HOCH2)3CNH2). Исходные зна-
Рис. 2. Фармакологическая идентификация пре- и
чения рНо среды для преинкубации срезов до замо-
постсинаптических компонентов фокальных потен-
раживания составляли 7.2-7.3 при 37°С. Активность
циалов, вызываемых электрической стимуляцией ла-
терального обонятельного тракта (ЛОТ). Представле-
глутаматергических ионотропных механизмов
ны усредненные ФП в инкубационной среде до воз-
(АМПА- и НМДА-механизмов) при этой темпера-
действия блокаторов (n = 11), ФП при воздействии
туре и рНо была оптимальной.
блокатора АМПА-рецепторов
6-циано-7-нитрохи-
ноксалин-2,3-диона (n = 10) и ФП при воздействии
Срезы в проточной камере перфузировали со
блокатора НМДА-рецепторов D-2-амино-5-фосфо-
скоростью 2 мл/мин. В них до замораживания ре-
новалериата в среде с пониженным содержанием
гистрировали амплитуды НМДА-потенциалов
Mg2+ (200 мкM) (n = 7). Вертикальные серые линии -
при 37°С в течение 20 мин. Полученные значения
измерение амплитуд АМПА- и НМДА-потенциалов.
БИОФИЗИКА том 66
№ 5
2021
958
МОКРУШИН
Рис. 3. Потенциалы, регистрируемые в срезах обонятельной коры мозга до и после криосохранения (30 суток при -10°С).
Компоненты потенциалов: артефакт стимуляции; потенциал действия ЛОТ отражает активацию проводящих волокон
ЛОТ; АМПА- и НМДА-потенциалы соответственно. Вертикальная серая стрелка - измерение амплитуд НМДА-
потенциалов во временной точке 8 мс от артефакта стимуляции. На врезке справа показаны в увеличенном масштабе
амплитуды НМДА-потенциалов до и после криосохранения. Вертикальные стрелки - измерение амплитуд НМДА-
потенциалов до и после криосохранения.
ния). Через 30 суток криосохранения срезы ото-
мерение этих параметров на срезах приводило к
гревали до 37°С и в них вновь регистрировали ам-
неконтролируемому искажению данных рНо и
плитуды НМДА-потенциалов. При обработке ре-
НМДА-потенциалов.
зультатов экспериментов амплитуды НМДА-
потенциалов определяли по отношению к кон-
После отогревания срезы перфузировали ин-
трольным значениям и выражали в процентах.
кубационной средой такого же состава, что и до
замораживания. Это необходимо, чтобы морфо-
Измерение рНо инкубационной среды осу-
логически сохранить структуры срезов. Инкуба-
ществляли с применением pH-метра Seven Com-
ционные растворы со срезами продували кисло-
pact S220 (Mettler Toledo, США). Значения рНо
родом, углекислый газ не использовали. Осадков
определяли с точностью до 0.1. Температуру ин-
в виде нерастворимых солей не выявлено. Специ-
кубационной среды со срезом до замораживания
ального контроля ионного состава среды не про-
при регистрации НМДА потенциалов до криосо-
водили. Необходимость использования среды, в
хранения измеряли с помощью терморегулятора
которой был заморожен срез при отогревании,
«ПИД ТРМ12» (Россия). Термодатчик находится
заключается в том, чтобы не вызывать механиче-
рядом с регистрирующей камерой, но изолиро-
ских повреждений структур среза, находящихся
ван тонкой стенкой от среза, чтобы не вызывать
сначала в твердой фазе среды - во льду, а при ото-
негативные воздействия на активность нейронов
гревании в жидкой фазе - в растворе.
срезов. Чувствительность рН-метра проверяли по
стандартным титрам для приготовления образцо-
вых буферных растворов для рН-метрии (Рос-
РЕЗУЛЬТАТЫ
сия): калий фосфорнокислый однозамещенный
(KH2PO4) - натрий фосфорнокислый двузаме-
На рис. 3 представлены типичные профили
щенный (Na2HPO4), рН 6.86 при 25°С; натрий
экстраклеточных потенциалов, регистрируемых
тетраборнокислый (Na2B4O7 10H2O), pH 9.18 при
после криосохранения и последующего отогрева-
25°С. В этих диапазонах рН проводили точную
ния до 37°С. Анализируя изменения амплитуд
настройку рН-метра.
АМПА- и НМДА-потенциалов до и после крио-
сохранения, следует отметить разнонаправлен-
Измерение кислотно-основного баланса внут-
ные модификации активности глутаматергиче-
ри клеток (рНi) срезов мозга с использованием
ских ионотропных механизмов. Так, амплитуда
микродатчиков или специфических красителей
АМПА-потенциалов увеличивалась по сравне-
не применялось, поскольку их использование
нию со значением амплитуд до криосохранения:
вызывало необратимые изменения амплитуд
до замораживания 290 мкВ, после отогревания -
НМДА-потенциалов.
410 мкВ, p ≤ 0.05, U = 7, n = 12. Напротив, ампли-
Определение рНо и НМДА-потенциалов по-
туда НМДА-потенциалов уменьшалась после
сле криосохранения проводили в параллельных
криосохранения и отогревания до нормотерми-
опытах. Это связано с тем, что одновременное из-
ческих значений: до замораживания 157 мкВ, по-
БИОФИЗИКА том 66
№ 5
2021
ОПТИМИЗАЦИЯ КИСЛОТНО-ЩЕЛОЧНОГО СОСТАВА
959
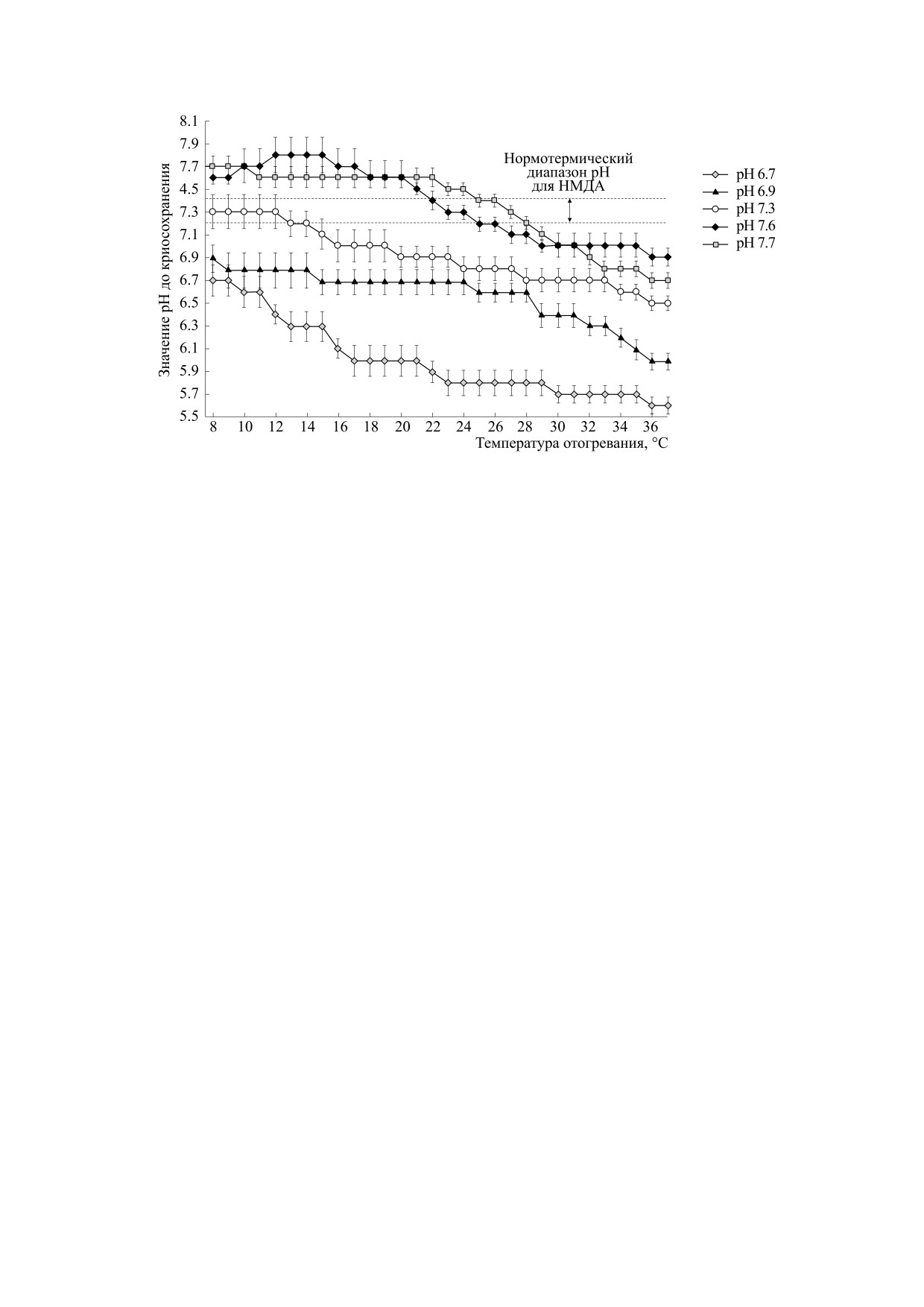
Рис. 4. Изменения рНо инкубационной среды с различными значениями рНо до криосохранения (30 суток при -10°С)
в процессе отогревания до 37°С. Измерения рНо проводили с интервалом 1°С. Горизонтальные пунктирные линии -
оптимальный нормотермический диапазон для активности НМДА-зависимых механизмов; n = 5 (рНо 6.7); n = 7
(рНо 6.9); n = 12 (рНо 7.3); n = 9 (рНо 7.6); n = 5 (рНо 7.7). Различия данных выявляли с использованием
непараметрического U-критерия Вилкоксона-Манна-Уитни, р ≤ 0.05.
сле отогревания - 94 мкВ, p ≤ 0.05, U = 7, n = 12
Для восстановления активности НМДА-меха-
(рис. 3).
низмов после криосохранения было проведено
изучение модификаций кислотно-щелочных ха-
Полученные результаты соответствуют дан-
рактеристик трис-буфера в инкубационной среде
ным, полученным ранее по криосохранению с
(рис. 4).
различными длительностями и последующим
отогреванием до нормотермических значений.
При использовании инкубационных раство-
Было обнаружено, что после длительного крио-
ров трис-буфера были выявлены определенные
сохранения срезов мозга амплитуды АМПА-по-
закономерности изменения рНо инкубационной
тенциалов увеличивались, тогда как амплитуды
среды при отогревании в зависимости от различ-
НМДА-потенциалов снижались до минимальных
ных исходных рНо до криосохранения. Было об-
значений или блокировались [11, 13].
наружено, что при рНо 7.3, традиционно исполь-
Для поиска ответа на вопрос о причине сниже-
зуемом для сохранения активности НМДА-меха-
ния активности НМДА-механизмов были прове-
низмов при инкубации срезов мозга
[15],
дены исследования изменений показателей кис-
происходит ступенчатое закисление рНо до зна-
лотно-щелочного баланса инкубационного рас-
чения 6.5. Отметим, что при этих значениях рНо
твора после криосохранения. Было обнаружено,
амплитуда НМДА-потенциалов снижалась до
что после длительного криосохранения и после-
33%: до замораживания - рНо 7.3, НМДА-потен-
дующего отогревания происходит закисление ин-
кубационной среды и высказано предположение,
циал 140 мкВ vice versa при отогревании - рНо 6.5,
что такое изменение в инкубационной среде при-
НМДА-потенциал 46 мкВ; p ≥ 0.05, U = 11, n = 12.
водит к уменьшению активности НМДА-меха-
При рНо 6.9 и 6.7 закисление среды в процессе
низмов.
отогревания происходит более интенсивно, как и
В связи с этой гипотезой было изучено влия-
блокирование активности НМДА-механизмов
ние на сохранение и восстановление активности
(рис. 4).
НМДА-зависимых механизмов после криосохра-
При рНо 7.6 и 7.7 в процессе отогревания также
нения (30 суток) инкубационного раствора с ги-
происходит закисление рНо среды до величин 6.7
бридной буферной системой (карбонатный бу-
и 6.9 соответственно, но этот процесс более мед-
фер - фосфатный буфер - трис(гидроксиме-
ленный.
тил)аминометан). В такой буферной системе трис
играет ключевую роль в длительном поддержании
Следует отметить факт, что в процессе отогре-
кислотно-щелочного равновесия в срезах мозга. вания инкубационной среды в диапазоне темпе-
БИОФИЗИКА том 66
№ 5
2021
960
МОКРУШИН
рНо был 7.7. Такое изменение рНо инкубацион-
ной среды до замораживания сопровождалось
восстановлением амплитуд НМДА-потенциалов
до 84% по сравнению с исходными значениями:
после отогревания - при рНо 7.7 и температуре
37°С НМДА-потенциал 80 мкВ vice versa в кон-
трольных условиях - при рНо 7.3 и температуре
37°С НМДА-потенциал 95 мкВ; p ≥ 0.05, U = 12,
n = 14.
Анализ данных, представленных на рис. 6, по-
казывает, что амплитуды НМДА-потенциалов
модифицируются S-образно. В интервалах тем-
ператур 6-12°С инкубационная среда защелачи-
валась до рНо 7.9. При достижении интервалов
температур 13-25°С происходило ступенчатое
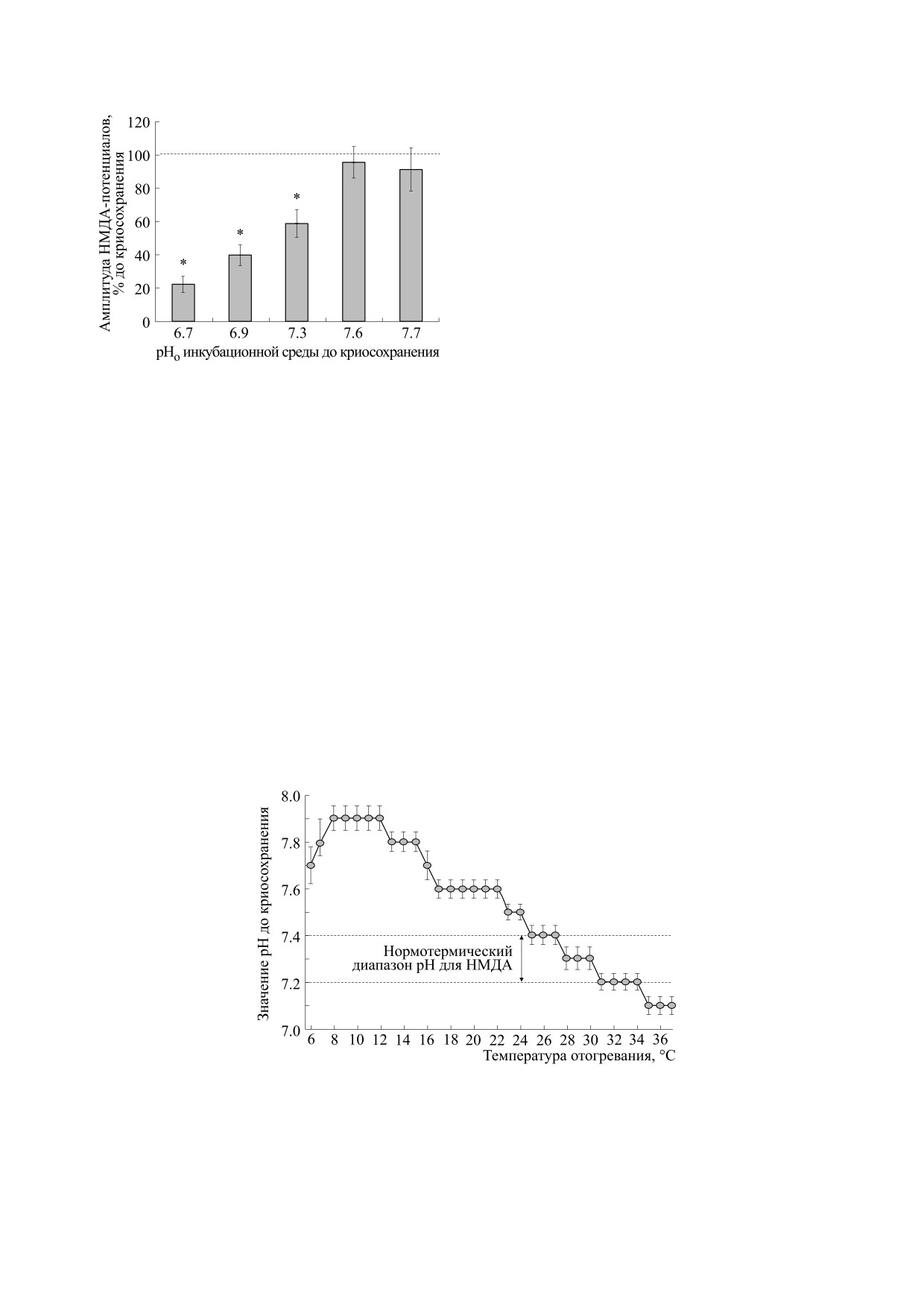
Рис. 5. Изменения амплитуды НМДА-потенциалов
снижение до рНо 7.4. Нормотермический диапа-
при отогревании до 37°С после криосохранения
зон (рНо 7.2-7.4) для оптимальной активности
(30 сут при -10°С) в зависимости от различных рНо.
до криосохранения, по оси ор-
По оси абсцисс - рНо
НМДА-механизмов сохранялся при отогревании
динат - амплитуда НМДА-потенциалов при отогре-
при интервалах температур 25-34°С (рис. 6). При
вании, в % к значениям до криосохранения; n = 5
дальнейшем отогревании до 37°С развивалось за-
(рНо 6.7); n = 7 (рНо 6.9); n = 12 (рНо 7.3); n = 9
кисление инкубационной среды до рНо 7.1. Одна-
(рНо 7.6); n = 5 (рНо 7.7). Различия данных выявляли
ко снижение рНо инкубационной среды не влия-
с использованием непараметрического U-критерия
Вилкоксона-Манна-Уитни, р ≤ 0.05.
ло на амплитуды НМДА-потенциалов: при рНо
7.1 и температуре 37°С НМДА-потенциал равнял-
ся 85 мкВ vice versa в контрольных условиях - рНо
ратур 22-28°С при рНо 7.6 и 7.7 активности НМ-
7.3 и температуре 37°С - НМДА-потенциал со-
ДА-механизмов находятся в нормотермическом
ставлял 98 мкВ; p ≥ 0.05, U = 10, n = 12. Такие из-
диапазоне этих рецепторных механизмов (рис. 5).
менения НМДА-потенциалов представлены на
Далее было исследовано влияние значения
рис. 7. Следовательно, применение трис-буфера с
рНо 7.7 инкубационного раствора после отогрева-
рНо 7.7 при замораживании/отогревании способ-
ния. Последовательность приемов при проведе-
ствует сохранению активности НМДА-механиз-
нии этих экспериментов заключалась в следую-
мов.
щем. При плавном охлаждении инкубационной
среды и достижении 20°С ее состав менялся на
Обращает на себя внимание факт, что измене-
другой, в котором солевой состав был тот же, но
ния рНо инкубационного раствора после криосо-
Рис. 6. Изменения рНо инкубационной среды при рНо (7.7) в зависимости от температуры при отогревании после
криосохранения при -10°С; n = 14 для каждой точки. Различия данных в процессе отогревания по сравнению с тем-
пературной точкой 6°С выявляли с использованием непараметрического U-критерия Вилкоксона-Манна-Уитни,
р ≤ 0.05.
БИОФИЗИКА том 66
№ 5
2021
ОПТИМИЗАЦИЯ КИСЛОТНО-ЩЕЛОЧНОГО СОСТАВА
961
Рис. 7. Изменения НМДА-потенциалов при отогревании после криосохранения (рНо инкубационной среды 7.7, 37°С.
НМДА-потенциалы представлены в увеличенном масштабе.
хранения происходит ступенчато, что может спо-
точном дыхании) по сравнению с карбонатным
собствовать сохранению НМДА-механизмов при
буфером. Положительной характеристикой
отогревании.
HEPES является уменьшение диссоциации воды
при понижении температуры, что дает основание
использовать его при низких температурах. Одна-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ко существенным негативным эффектом HEPES
Таким образом, проведенные исследования
является его фототоксичность, когда под воздей-
влияния рНо инкубационной среды с гибридной
ствием света образуется перекись водорода, кото-
рая негативно влияет на функционирование ней-
буферной системой (карбонатный, фосфатный и
ронов и синапсов [27-29].
трис-буфер) на сохранение и восстановление
активности глутаматергических ионотропных
Карбонатная и фосфатная буферные системы
НМДА-зависимых механизмов оказались опти-
также применяются для инкубации срезов мозга.
мальными для их восстановления после дли-
Однако следует отметить, что солевые растворы с
тельного криосохранения срезов. Наряду с ис-
карбонатным буфером нестабильны по показате-
пользованием гибридной буферной системы вос-
лям рНо и, как было обнаружено в наших иссле-
становлению активности НМДА-механизмов
дованиях, отрицательно влияют на активность
способствовала замена инкубационной среды в
НМДА-зависимых механизмов, что выражалось в
процессе замораживания. Солевой состав не ме-
непредсказуемых изменениях их амплитудных
нялся, но рНо увеличивался до 7.7. Такое измене-
значений как в нормотермических условиях, так
ние рНо сопровождалось восстановлением ам-
и, что особенно важно, после криосохранения
срезов мозга.
плитуды НМДА-потенциалов до 84% по сравне-
нию с исходными значениями. Таким образом,
Что касается фосфатного буфера, то он, в от-
использование гибридной буферной системы и
личие от карбонатного буфера, более стабилен,
увеличение рНо инкубационной среды до 7.7 бы-
однако его буферная емкость при понижении
ли наиболее оптимальными условиями для вос-
температуры инкубационного раствора снижает-
становления активности НМДА-зависимых ме-
ся. Из-за этого использование карбонатного бу-
ханизмов при отогревании после длительного
фера при криосохранении срезов является не-
криосохранения (-10°С, 30 суток).
оптимальным.
Следует отметить, что в работах, связанных с
Учитывая ограничения свойств в поддержа-
клеточными культурами, в том числе срезами
нии кислотно-щелочного равновесия в наших
мозга, применяются другие буферные системы.
исследованиях, мы применили гибридную бу-
Так, широко используется буферная система на
ферную систему (карбонатный, фосфатный и
основе HEPES, который представляет собой
трис-буфер) для длительной инкубации срезов
цвиттерионный органический буферный агент.
мозга и устойчивой регистрации активностей
HEPES используется главным образом потому,
НМДА-механизмов [15]. Трис является эффек-
что лучше поддерживает физиологическую вели-
тивным в качестве буфера в широком диапазоне
чину рНо, несмотря на изменения концентрации
pHо от 7.0 до 9.2. Отличительной чертой трис-бу-
диоксида углерода (вырабатывающемся при кле-
фера является то, что значение pKa уменьшается
БИОФИЗИКА том 66
№ 5
2021
962
МОКРУШИН
приблизительно на 0.03 при снижении темпера-
и С.Е. Боровикову за техническую помощь в на-
туры на 1°С [30, 31]. Отметим, что диапазон рНо
ладке и обслуживания электрофизиологической
7.0-9.0 соответствует физиологическим значени-
установки.
ям рНо для большинства организмов. Такие ха-
рактеристики трис-буфера делают его оптималь-
ФИНАНСИРОВАНИЕ РАБОТЫ
ным буфером не только в биохимии и молекуляр-
Работа выполнена при финансовой поддержке
ной биологии, но и для криосохранения нервной
Программы фундаментальных научных исследо-
ткани в нейробиологии [32-34].
ваний государственных академий на 2013-2020
В результате проведенных исследований были
годы (ГП-14, раздел 65.2).
выявлены определенные закономерности приме-
нения трис-буфера в инкубационном растворе.
Происходили изменения рНо инкубационной
КОНФЛИКТ ИНТЕРЕСОВ
среды при отогревании в зависимости от рНо до
Автор заявляет об отсутствии конфликта инте-
криосохранения срезов. Было обнаружено, что
ресов.
при рНо 7.3, традиционно используемом для со-
хранения активности НМДА-механизмов в сре-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
зах мозга [15], происходило ступенчатое закисле-
ние рНо до значения 6.5. При таком сдвиге рНо
Все применимые международные, националь-
ные и институциональные принципы ухода и ис-
инкубационной среды в процессе отогревания
пользования животных при выполнении работы
амплитуда НМДА-потенциалов снижалась по
были соблюдены.
сравнению со значениями амплитуд до криосо-
хранения. Мы предположили, что в процессе
криосохранения (замораживания/оттаивания)
СПИСОК ЛИТЕРАТУРЫ
срезов происходит изменение кислотно-щелоч-
1. J. Ichikawa, R.X.Yamada, and R. Muramatsu, J. Phar-
ного баланса в сторону закисления инкубацион-
macol. Sci. 104, 387 (2007).
ной среды. Такой сдвиг рНо приводит к наруше-
2. Н. А. Ивличева, Автореферат дис. … канд. биол.
нию функционирования НМДА-зависимых ме-
наук (Пущино, 2013).
ханизмов, что проявляется при отогревании. Для
3. Н. А. Ивличева, Е. В. Дмитриева, М. А. Костенко и
того чтобы избежать такие негативные измене-
Э. Н. Гахова, Биофизика 49 (4), 710 (2004).
ния, нами был использован прием изменения
рНо в процессе замораживания при 20°С до рНо,
4. Н. А. Ивличева, И. А. Чистопольский, Л. И. Кра-
марова и Э. Н. Гахова, Биол. мембраны 31 (5), 342
равного 7.7. Такой прием был основан на наших
(2014).
предыдущих данных о том, что в диапазоне тем-
ператур 20-24°С в процессе замораживания сре-
5. Е. Е. Фесенко (мл.), Е. Л. Гагаринский, А. С. Аве-
зов они перестают быть чувствительными к гипо-
рин и др., Биофизика 65 (4), 780 (2020).
ксии и другим цитотоксичным воздействиям [13].
6. C. B. Morris, Methods Mol. Biol. 368, 227 (2007).
Эти данные позволили предположить, что изме-
7. S. J. Paynter, Brain Res. Bull. 75, 1 (2008).
нения рНо не повлияют на сохранение активно-
8. X.-H. Ma, Y. Shi, and Y. Hou, Cryobiology. 60, 184
сти НМДА-механизмов в процессе криосохране-
(2010).
ния и последующего отогревания, что и было
9. A. A. Mokrushin, CryoLetters 36 (6), 367 (2015).
подтверждено в настоящей работе. Очевидно, та-
10. A. A. Mokrushin, L. I. Pavlinova, and S. E. Borovikov,
кой сдвиг рНо инкубационной среды протектиру-
J. Therm. Biol. 44, 5 (2014).
ет НМДА-зависимые механизмы от негативных
11. А. А. Мокрушин и Л. И. Павлинова, Бюл. экспе-
влияний процесса криосохранения.
рим. биологии и медицины 161 (1), 36 (2016).
12. А. А. Мокрушин и С. Е. Боровиков, Молекуляр.
ВЫВОДЫ
медицина 15 (2), 14 (2017).
13. А. А. Мокрушин, Изв. РАН. Сер. биол. № 1, 67
Таким образом, использование гибридной бу-
(2020).
ферной системы и увеличение рНо до 7.7 опти-
14. E. D. Kanter and L. B. Haberly, Brain Res. 525, 175
мальны для восстановления активности НМДА-
(1990).
зависимых механизмов при отогревании после
длительного криосохранения (-10°С, 30 суток).
15. А. А. Мокрушин, Дис. … д-ра биол. наук (Институт
физиологии им. И. П. Павлова РАН, СПб., 1997).
16. T. V. P. Bliss and G. L. Collingridge, Nature 361, 31
БЛАГОДАРНОСТИ
(1993).
Автор выражает признательность Г.П. Смир-
17. T. P. Obrenovitch and J. Urenjak, Progr. Neurobiol. 51,
новой за помощь при проведении экспериментов
39 (1997).
БИОФИЗИКА том 66
№ 5
2021
ОПТИМИЗАЦИЯ КИСЛОТНО-ЩЕЛОЧНОГО СОСТАВА
963
18. S. F. Traynelis and S. D. Cull-Candy, Nature 345
27. J. L. Lepe-Zuniga, J. S. Zigler, and I. Gery, J. Immu-
(6273), 347 (1990).
nol. Methods 103 (1), 145 (1987).
19. J. W. McDonald, T. Bhattacharyya, and S. L. Sensi, J.
28. A. Penna, D. S. Wang, and J. Yu, Neurosci. 34 (32),
Neurosci. 18 (16), 6290 (1998).
10624 (2014).
20. Y. Buskila, P. Breen, and J. Tapson, Sci. Rep. 4, 5309
29. A. K. Chauhan and N. S. Magoski, J. Neurosci. 1, 1460
(2014).
(2019).
21. V. A. Ruffin, A. I. Salameh, and W. F. Boron, Front.
Physiol. 5 (43), 1 (2014).
30. A. A. El-Harakany, F. M. Abdel Halima, and A. O.
Barakat, J. Electroanal. Chem. 162 (1-2), 285 (1984).
22. F. Pischedda, C. Montani, and J. Obergasteiger, Front.
Cell. Neurosci. 12, 81 (2018).
31. C. A. Vega, R. A. Butler, and B. Perez, J. Chem. Eng.
23. U. Bonnet, D. Bingmann, and E. J. Speckmann, Brain
Data 30, 376 (1985).
Res. 1710, 146 (2019).
32. B. S. Markofsky and B. Sheldon, Nitro Compounds,
24. М. И. Митюшов, Н. А. Емельянов, А. А. Мокру-
Aliphatic in Ullmann`s Encyclopedia of Industrial Chem-
шин и др., Переживающий срез мозга как объект
istry (New York, 2000).
нейрофизиологического и нейрохимического исследо-
вания (Наука, Л.,1986).
33. Z. Ghalanbor, N. Ghaemi, and S. A. Marashi, Prot.
Peptide Lett. 15 (2), 212 (2008).
25. W. H. Hoffman and L. J. Haberly, Neurosci. 9 (1), 206
(1989).
34. D. Rohanová, D. Horkavcová, and L. Paidere, J.
26. M. W. Jung, J. Larson, and G. Lynch, Exp. Brain Res.
Biomed. Mater. Res. B. Appl. Biomater. 106 (1), 143
82 (5), 451 (1990).
(2018).
Optimization of the Acidic-Alkaline Composition of the Incubation Medium
for a Long-Term and Reversible Cryopreservation of Brain Slices
of Non-Hibernating Animals
A.A. Mokrushin
Pavlov Institute of Physiology, Russian Academy of Sciences, nab. Makarova 6, St. Petersburg, 199034 Russia
It was found that the activity of the NMDA receptors (bursts of action potentials) was blocked after long-term
cryostorage of brain slices at -10°С. To reactivate the NMDA receptors after cryostorage/thawing, alterations
in extracellular pH (pHo) of the incubation medium were studied. It was found that in the pHo range (7.2-
7.4), a stepwise decrease in pH until pHo 6.5 ± 0.2 was reached led to acidification of the incubation medium.
As a result, NMDA receptor current amplitude decreased to 33%. The use of a hybrid buffer system (carbon-
ate, phosphate, and Tris buffer, pHo 7.7) prompted reactivation of NMDA receptors. Such a change in pHo
was accompanied by an increase in NMDA spike amplitude up to 84% compared to the initial amlitude (be-
fore cryostorage). Thus, the use of the hybrid buffer system and an increase in the pHo level up to 7.7 were the
most optimal conditions for reactivation of NMDA receptors during thawing after prolonged cryopreserva-
tion.
Keywords: brain slices, NMDA receptors, cryopreservation, buffer systems
БИОФИЗИКА том 66
№ 5
2021