БИОФИЗИКА, 2021, том 66, № 6, с. 1045-1055
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ПРОЦИАНИДИН В3 - ПОТЕНЦИАЛЬНЫЙ ИНГИБИТОР
ЧЕЛОВЕЧЕСКОГО СЕПТИНА 9
© 2021 г. А.В. Вахрушева*, А.В. Кудрявцев*, О.С. Соколова*, **, К.В. Шайтан*, ***
*Биологический факультет Московского государственного университета имени М.В. Ломоносова,
119234, Москва, ул. Ленинские горы, 1/12
**Биологический факультет Университета МГУ-ППИ в Шэньчжэне,
517182, Провинция Гуандун, Шэньчжэнь, ул. Гоцзидасюеюань, 1, Китай
***Институт химической физики им. Н. Н. Семёнова РАН, 119991, Москва, ул. Косыгина, 4
E-mail: sokolova@mail.bio.msu.ru
Поступила в редакцию 23.08.2021 г.
После доработки 23.08.2021 г.
Принята к публикации 31.08.2021 г.
Цитоскелетные белки септины участвуют во многих клеточных процессах, изменение их экспрес-
сии является маркером онкологических заболеваний. В связи с этим септины могут являться потен-
циальной мишенью при воздействии на раковые клетки. Для поиска новых малых молекул, влияю-
щих на структурную организацию септиновых филаментов, был проведен виртуальный скрининг
библиотеки соединений базы данных PubChem и выбрано наиболее аффинное вещество из всех -
флавоноид процианидин В3. С помощью молекулярного моделирования показано, что проциани-
дин В3 взаимодействует с мономером септина SEPT9 в важной для связывания ГТФ области G1- и
G4-мотивов и предотвращает димеризацию септиновых мономеров. Следовательно, процианидин
В3 может рассматриваться как перспективное соединение для воздействия на структуру септино-
вых филаментов раковых клеток.
Ключевые слова: септин, конформационные изменения, SEPT9, процианидин В3, молекулярное модели-
рование, фармакофор.
DOI: 10.31857/S0006302921060016
полагается, через активацию сигнального пути
Септины являются ГТФ-связывающими бел-
MEK/ERK [7]. Аналогичные результаты были по-
ками, структурно и эволюционно относящимися
лучены и для септина изоформы SEPT9 [8].
к суперсемейству Ras ГТФаз [1]. Впервые септи-
ны были обнаружены в почкующихся дрожжах
Во многих исследованиях показано, что септи-
Saccharomyces cerevisiae на месте разделения мате-
ны значительно меняют свою экспрессию при
ринской и дочерней клеток [2, 3]. У млекопитаю-
разных типах онкологии [9]. При этом часть из
щих известно 13 генов, кодирующих септины. На
них выступает в качестве супрессоров опухолевых
основе схожести последовательностей септины
процессов, а часть, наоборот, является онкоген-
млекопитающих делятся на четыре группы
ной. При раке груди, яичников и поджелудочной
(табл. 1) [4, 5].
железы наблюдается повышенная экспрессия
SEPT2, SEPT7, SEPT9, что коррелирует с худшим
Септины играют важную роль в процессах
прогнозом выживаемости [10]. Показано, что
пролиферации и миграции клеток. Нокдаун
септины путем прямого взаимодействия с HER-2
SEPT2 и SEPT7 приводил к снижению инвазии
могут таким образом увеличивать резистентность
раковых клеток и влиял на их механочувствитель-
к онкологическим лекарственным препаратам,
ность [6], также происходило значительное сни-
направленным на ингибирование протоонкоге-
жение клеточной пролиферации, миграции и ин-
на, рецепторной тирозинкиназы HER-2 (human
вазии, увеличивался апоптоз [7]. В то же время
epidermal growth factor receptor-2), кодируемую ге-
повышенная экспрессия данных септинов при-
ном ErbB2 и высоко ассоциированную с прогрес-
водила к увеличению миграционной подвижно-
сией рака груди [11].
сти, пролиферации и инвазии клеток, как пред-
Базовые септиновые комплексы являются тет-
Сокращения: GEF - фактор обмена гуанинового нуклеоти-
ра-, гекса- или октамерами, из которых формиру-
да, СКО - среднеквадратичное отклонение.
ются высокоолигомерные структуры, такие как
1045
1046
ВАХРУШЕВА и др.
Таблица 1. Классификация септинов млекопитающих
Группа септинов
Септины млекопитающих
SEPT2
SEPT1, SEPT2, SEPT4, SEPT5
SEPT6
SEPT6, SEPT8, SEPT10, SEPT11, SEPT14
SEPT7
SEPT7
SEPT3 (в некоторых источниках SEPT9)
SEPT3, SEPT9, SEPT12
филаменты, сетки и кольца [12, 13]. В организме
структуры септинов, чем непосредственно их
человека септины собираются в гетеро-гексаком-
гидролиз [21, 23, 24].
плексы SEPT7-SEPT6-SEPT2-SEPT2-SEPT6-
В настоящее время активно исследуется толь-
SEPT7 [14] и октамеры SEPT9-SEPT7-SEPT6-
ко одно вещество, предположительно влияющее
SEPT2-SEPT2-SEPT6-SEPT7-SEPT9 (рис.
1)
на структуру септинов - CPPU (N-(2-хлор-4-пи-
[15]; также филаменты могут формироваться на
ридил)-N'-фенилмочевина). Микромолярные
основе гексамерного комплекса SEPT2-SEPT6-
концентрации этого соединения ингибировали
SEPT7 [14]. Обычно септиновые комплексы фор-
пролиферацию, миграцию и инвазию человече-
мируются из представителей разных групп, в не-
ских раковых линий in vitro [25] и in vivo [26]. Экс-
которых случаях септины из одной группы могут
перименты по молекулярному докингу показали
быть взаимозаменяемы (табл. 1).
преимущественное связывание CPPU с сайтом
Интересно отметить, что SEPT9 может не
связывания ГТФ септина, что предположительно
только участвовать в формировании филаментов,
стабилизирует филаментную организацию
но и напрямую взаимодействовать с фактором
септинов и препятствует дальнейшему связыва-
обмена гуанинового нуклеотида (GEF). Показа-
нию и гидролизу ГТФ [27]. Модификация CPPU
но, что SEPT9 через взаимодействие с GEF инги-
путем добавления атомов фтора и хлора UR214-1,
бирует Rho-сигналинг, играющий ключевую
UR214-7 и UR214-9 привела к ингибированию
роль во многих клеточных процессах, включая
пролиферации клеточных линий рака яичников и
реорганизацию цитоскелета [16, 17]. Также обна-
рака эндометрия [28]. Однако CPPU имеет корот-
ружена колокализация GEF-SEPT9 с актиновым
кий период полувыведения, обладает цитоток-
цитоскелетом [16]. Нарушение локализации сеп-
сичностью, его применение вызывает небольшое
тинов с актином и, как следствие, ремоделирова-
системное воспаление [26]. Также было показа-
ние последнего, может приводить к апоптозу кле-
но, что CPPU в низких концентрациях влияет на
ток [18, 19].
морфологию и функции митохондрий. В резуль-
тате было предположено, что эффект CPPU отно-
Формирование септиновых филаментов начи-
сительно ингибирования пролиферации клеток
нается с того, что две субъединицы септина гете-
не является специфичным [29].
родимеризуются через два альтернативных ин-
терфейса (G- и NC-) (рис. 1) путем конформаци-
В соответствии с этим поиск новых малых мо-
онных изменений в ГТФ-связывающем кармане
лекул, влияющих на структуру септинов и соот-
G-интерфейса [20]. Однако стоит отметить, что
ветственно на миграционные и пролифератив-
скорость гидролиза ГТФ у септинов очень низкая
ные свойства клеток, является актуальной зада-
[21]. Более того, не все типы септинов имеют воз-
чей. В данной работе методами молекулярного
можность гидролизовать ГТФ [20, 22]. Таким об-
моделирования проанализированы различные
разом, предполагается, что связывание нуклеоти-
конформационные состояния септина на приме-
дов важнее для формирования филаментной
ре SEPT9 и выбрана библиотека соединений базы
Рис. 1. Схематичное изображение организации септиновых гексамеров, октамеров и филаментов. Цифрами указаны
номера септинов, N-C - N-C-интерфейс взаимодействия двух септиновых субъединиц, G-G - G-интерфейс взаимо-
действия двух септиновых субъединиц.
БИОФИЗИКА том 66
№ 6
2021
ПРОЦИАНИДИН В3 - ПОТЕНЦИАЛЬНЫЙ ИНГИБИТОР
1047
данных PubChem для проведения виртуального
Их перечень включал следующие препараты:
скрининга. В результате было выявлено соедине-
153SM оксабифор, миглитол, лодоксамид, иопро-
ние класса флавоноидов - процианидин В3, свя-
мид, микофеноловая кислота, допамин, занами-
зывающееся предположительно с высокой
вир. Данные лиганды предварительно выравни-
аффинностью с септином SEPT9 в области при-
вали для нахождения общих функциональных
соединения ГТФ и препятствующее олигомери-
групп. Построение фармакофора проводили в
зации септиновых филаментов.
модуле Phase (Schrödinger, LLC, New York, США)
[32]. Для генерации фармакофора соединения
были подготовлены со следующими параметра-
МЕТОДЫ
ми: до 10 конформационных состояний на одну
Подготовка белковых структур и лигандов. Под-
вращающуюся связь и до 50 конформаций всего.
готовкa белковых структур проводилась с помо-
Каждый лиганд был представлен минимум одной
щью модуля Protein Preparation (Schrödinger, LLC,
конформацией.
New York, США) [30] и включала удаление кри-
Комбинированный виртуальный скрининг на ос-
сталлографической воды на расстояние более 5 Å
нове фармакофорного скрининга и молекулярного
от белка, добавление полярных водородов и при-
докинга. Для скрининга соединений использова-
своение частичных зарядов Гастайгера. Силовое
ли модули Glide и Phase (Schrödinger, LLC, New
поле OPLS_2005 использовали для минимизации
York, США) [32, 33]. 3Д-фармакофорный скри-
структур.
нинг большой библиотеки соединений проводи-
Для исследований методом виртуального
ли по созданной ранее модели фармакофора.
скрининга использовали библиотеку PubChem.
Оценку пригодности лигандов в данном случае
Для построения фармакофора использовали ма-
проводили исходя из СКО и направлений векто-
лую библиотеку FDA Pharm Classes, содержащую
ров отклонения атомов лиганда от фармакофора,
около 1 тысячи соединений, являющихся одоб-
описывающих отличия
3Д-структуры лиганда
ренными FDA лекарственными препаратами,
при наложении на фармакофор. Из приблизи-
прошедшими доклинические и клинические ис-
тельно одного миллиона соединений через дан-
пытания. В связи с тем, что вещества были прове-
ный скрининг было отобрано 25108 веществ, ко-
рены относительно их безопасности, создание на
торые затем подготавливали с помощью LigPrep
их основе фармакофора и последующего скри-
(Schrödinger, LLC, New York, США) по описан-
нинга библиотеки веществ обладало более высо-
ной выше процедуре подготовке лигандов для мо-
кой вероятностью отбора безопасного соедине-
лекулярного докинга.
ния, пригодного для применения на человеке.
Пространственная ячейка для докинга имела
Также для сравнения и валидации результатов до-
размеры 20 × 20 × 20 Å с центром относительно
кинга в библиотеку были добавлены структуры,
ключевых аминокислотных участков, находя-
связывающиеся с септинами, - ГТФ, ГДФ, ГТФ-
щихся в активном центре белка. Молекулярный
γ-S, CPPU и UR214-9. Для виртуального скри-
докинг проводили в три стадии: HTVS (high-
нинга использовали большую библиотеку соеди-
throughput virtual screening), SP (standard precision)
нений, включающую в себя около миллиона суб-
и XP (extra precision). Результаты оценивали с по-
станций из раздела «Органические соединения»
мощью встроенных в пакет Schrödinger оценоч-
базы данных PubChem [31].
ных функций: Glide Score, Glide Emodel, а также
Структуры лигандов подготавливали с исполь-
по свободной энергии связывания, вычисленной
зованием модуля LigPrep (Schrödinger, LLC, New
по обобщенному методу Борна (MM-GBSA).
York, США). Лигандам приписывали частичные
Glide Score и Glide Emodel являются эмпири-
атомные заряды; несколько возможных состоя-
ческими оценочными функциями, аппроксими-
ний ионизации генерировали при pH 7.0 ± 2.0 для
рующими свободную энергию связывания лиган-
каждого соединения. Минимизацию энергии
да. Более отрицательные значения по данным па-
проводили для каждого лиганда до тех пор, пока
раметрам отображают более сильное связывание.
она не достигала среднеквадратичного отклоне-
Для сравнения оценочных функций в данной
ния (СКО) в 0.01 Å.
работе использовали оценку свободной энергии
Построение 3Д-фармакофора. 3Д-фармакофор
Гиббса DEMM/GBSA, вычисленнe. с использова-
для скрининга лигандов был построен на основе
нием обобщенного метода Борна (MM/GBSA)
анализа лиганд-рецепторного комплекса белка
для учета эффекта сольватации на основании уче-
SEPT9 с лигандами, отобранными после молеку-
та площади поверхности структуры, контактиру-
лярного докинга малой библиотеки FDA Pharm
ющей с растворителем [34]:
Classes в сайт связывания ГТФ и присоединения
соседней септиновой субъединицы. Лиганды,
ΔEMM/GBSA = Екомп - Ерец - Елиг,
имеющие значения Glide Score от -5 и ниже, ис-
пользовали далее для построения фармакофора.
ΔEMM/GBSA = ЕMM + ЕGB + γASA,
БИОФИЗИКА том 66
№ 6
2021
1048
ВАХРУШЕВА и др.
где Екомп - полная энергия EMM/GBSA комплекса
(ГТФ-γ-S). Выбор таргетной молекулы основы-
вался на том, что SEPT9 является замыкающим
«лиганд-рецептор», Ерец
- полная энергия
фрагментом октамерной септиновой единицы и
EMM/GBSA рецептора, Елиг - полная энергия
соединяет соседние октамеры в филаменты [15], а
EMM/GBSA лиганда, ЕMM - молекулярно-механи-
также имеет треониновый остаток, необходимый
для гидролиза ГТФ [5]. Этот вариант септина еще
ческая энергия, включающая в себя все механи-
не исследовался на предмет влияния на него ма-
ческие, электростатические и ван-дер-ваальсовы
лых молекул, в том числе и единственного извест-
взаимодействия; ЕGB
- обобщенная энергия
ного ингибитора септинов - CPPU.
Борна, учитывающая влияние растворителя на
свободную энергию молекулы; γASA - вклад в
Была проведена предварительная минимиза-
свободную энергию, пропорциональный площа-
ция кристаллической структуры SEPT9 (PDB ID
ди поверхности молекулы ASA.
5CYP) со связанным аналогом ГТФ-γ-S. Через
3 нс система «лиганд-рецептор» была уравнове-
Соединения с наилучшими показателями по
шена, так как СКО не превышало 2.4 Å (рис. 2а).
Glide Score, GlΔide Emodel и MM-GBSA отбира-
При анализе полученных данных были выявлены
ли для последующих исследований.
аминокислотные остатки белка SEPT9: Lys36,
Молекулярная динамика. Молекулярную дина-
Ser37, Thr38, Arg60, Lys170, Asp172, которые в ос-
мику проводили с помощью программного паке-
новном участвуют в образовании водородных
та Desmond (Schrödinger, LLC, New York, США)
связей; Ser37, Thr64, Asp87 - в образовании ион-
[35]. Для этого структуру помещали в ячейку с
ных связей; Arg241 - единственного гидрофобно-
размерами 1.5 нм в длину; использовали модель
го взаимодействия; Ile61, His145, Glu178 - в обра-
явного растворителя - SPC. Далее следовала ми-
зовании водных мостиков. В этой связи следует
нимизация методом наискорейшего спуска в си-
отметить аминокислотный остаток His145, кото-
ловом поле OPLS3e. Для релаксации использова-
рый образовывал стабилизирующую связь через
ли стандартный протокол, входящий в состав
водный мостик в димере септинов между
программного пакета Desmond и подходящий, по
одной субъединицей и ГТФ, закрепленным в сай-
информации разработчика, для большинства
те связывания второй субъединицы (рис. 2б,в).
стандартных систем. Данный протокол включал в
Аминокислотные остатки Lys36, Ser37, Thr38,
себя две стадии минимизации (с фиксированны-
Arg60, Thr64 на протяжении всего времени моде-
ми и нефиксированными тяжелыми атомами), за
лирования постоянно контактировали с лиган-
которыми следовало четыре стадии молекуляр-
дом ГТФ-γ-S.
ной динамики с последовательно уменьшающи-
Так как целью работы был поиск малых моле-
мися ограничениями. Применение данного про-
кул, нарушающих олигомеризацию септиновых
токола апробировано для подготовки сайта свя-
филаментов, наша задача состояла в том, чтобы
зывания белковых молекул и анализа лиганд-
предотвратить проникновение ГТФ в сайт связы-
рецепторных взаимодействий.
вания SEPT9. Нуклеозидтрифосфаты, связыва-
Молекулярную динамику проводили при по-
ясь, участвуют в полимеризации и стабилизируют
стоянной температуре (300 К) и давлении с ис-
филаментную структуру септинов. Помимо это-
пользованием термостата Нозе-Хувера и бароста-
го, важно было также обеспечить, чтобы новый
та Паринелло-Рамана соответственно. Времена
лиганд не связывал и не стабилизировал две субъ-
расчета молекулярно-динамических траекторий
единицы димерного SEPT9 друг с другом. Соот-
указаны отдельно в тексте.
ветственно, для дальнейшего виртуального скри-
нинга была выбрана мономерная структура
Для оценки траекторий проведенной молеку-
SEPT9 в конформации без ГТФ и предварительно
лярной динамики использовали параметры сред-
неквадратичного отклонения и среднеквадратич-
промоделированная в течение 50 нс (данные не
ной флуктуации, также были проанализированы
приведены). Отобранные впоследствии лиганды
различные виды лиганд-белковых взаимодей-
также затем проверяли на димерной структуре.
ствий с помощью модуля Desmond - Simulation
Комбинированный скрининг библиотеки малых
Interactions Diagram [35].
молекул. Для построения фармакофора была вы-
брана малая библиотека FDA Pharm Classes из ба-
зы PubChem, содержащая ориентировочно
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1000 соединений. Пространственная ячейка раз-
Взаимодействие ГТФазного домена септина с
мером 20 × 20 × 20 Å, по которой проводили до-
аналогом ГТФ. На первом этапе для характери-
кинг, была центрирована по координатам -6.943,
стики сайта и взаимодействий лиганд-рецептор
14.994, -0.952 (X, Y, Z) и ориентирована на место
проводили молекулярную динамику димера
связывания фосфатной группы ГТФ, а также на
ГТФазных доменов септина SEPT9 (PDB ID
область присоединения второй септиновой субъ-
5CYP) с нерасщепляемым аналогом ГТФ
единицы, включая место стабилизирующей связи
БИОФИЗИКА том 66
№ 6
2021
ПРОЦИАНИДИН В3 - ПОТЕНЦИАЛЬНЫЙ ИНГИБИТОР
1049
Рис. 2. (а) - СКО в зависимости от времени: серая кривая - Cα-атомы белка SEPT9 относительно референсного
фрейма, черная кривая - лиганд ГТФ-γ-S относительно SEPT9; (б) - общий вид димера из ГТФазных доменов
септина 9 (SEPT9) в комплексе с ГТФ-γ-S (2.89 Å), PDB ID 5CYP; (в) - схема контактов, образуемых ГТФ-γ-S с
аминокислотными остатками SEPT9.
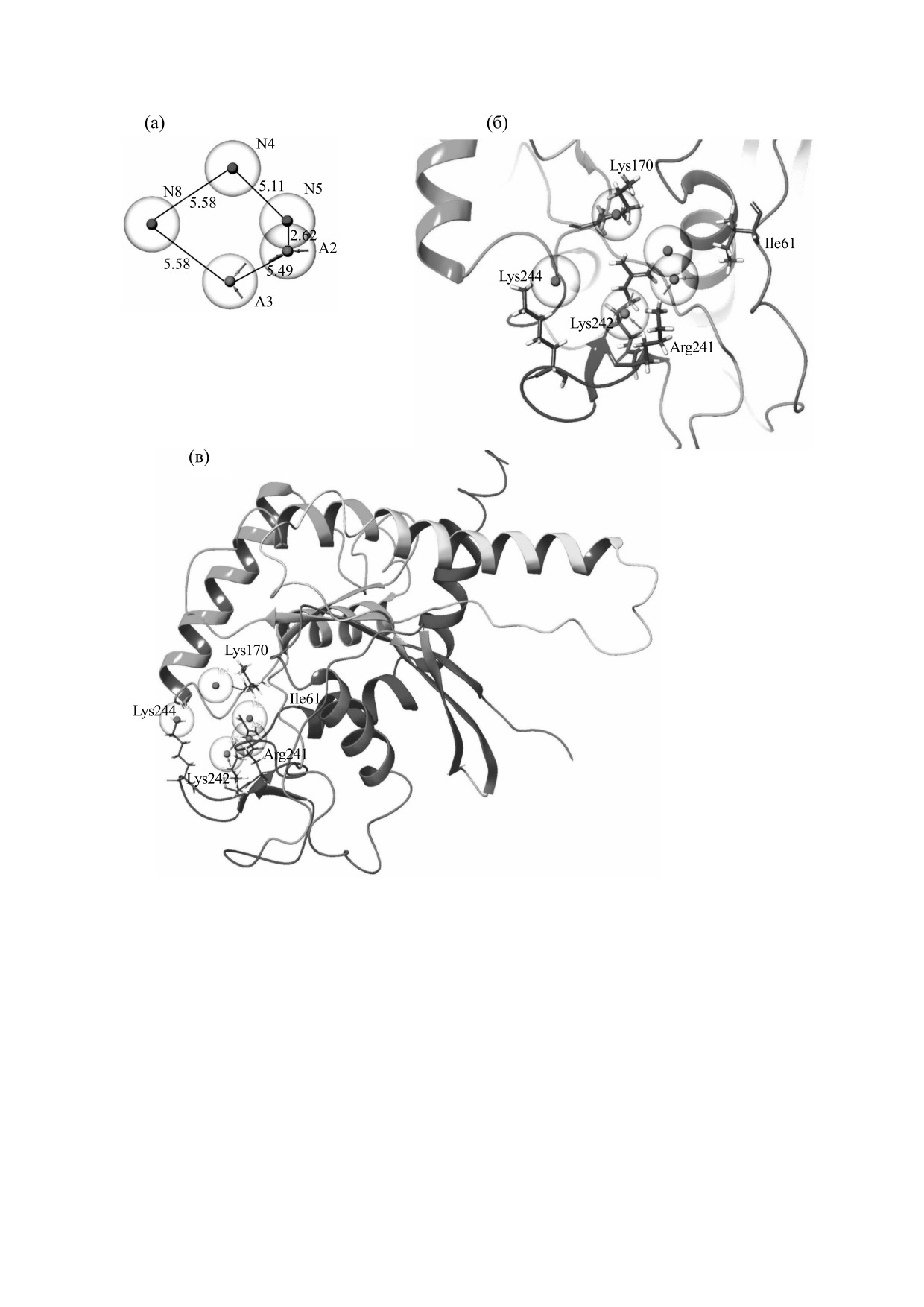
His145. По совокупности лучших значений ото-
стороны белка-рецептора были выделены следу-
бранных веществ на основании Glide Score, Glide
ющие аминокислотные остатки, участвующие во
Emodel и энергии связывания MM-GBSA (см.
взаимодействии с лигандами: Lys170, Arg241,
раздел «Методы») были определены функцио-
Lys242, Lys244 и Ile61, находящиеся в «боковой»
нальные группы, важные для формирования вза-
области стыковки двух септиновых субъединиц
имодействий лиганд-белок в рассматриваемом
(рис. 3б,в). По данному фармакофору проводили
сайте. После этого на основании проведенного
скрининг полной библиотеки соединений (около
анализа был сконструирован фармакофор
(рис. 3а). Фармакофор содержит пять основных
одного миллиона) с помощью программного
функциональных групп для образования связей -
обеспечения Glide (Glide, Schrödinger, LLC, New
две акцепторные и три отрицательно-ионные. Со
York, США).
БИОФИЗИКА том 66
№ 6
2021
1050
ВАХРУШЕВА и др.
Рис. 3. (а) - Фармакофор (А - акцепторная группа, N - отрицательно-ионный тип группы), числами указано
расстояние (в Å) между функциональными группами фармакофора; (б) - фармакофор в активном сайте белка SEPT9,
выделены ключевые аминокислотные остатки; (в) - общий вид положения фармакофора относительно белка SEPT9.
Соединения после скрининга были ранжиро-
Отобранные соединения были протестирова-
ваны согласно параметрам Glide Score, Glide
ны также с помощью других программ для моле-
Emodel и MM-GBSA. Вещества, связавшиеся с
кулярного докинга, таких как AutoDock Vina [37],
наибольшей аффинностью, перечислены в
DockThor [38], SwissDock [39] и CB-Dock [40].
табл. 2. Их потенциальную биологическую анти-
Наибольшую аффинность к септину по результа-
неопластическую (противоопухолевую) актив-
там всех тестов, как и ожидалось, показали ГТФ и
ность оценивали с помощью веб-сервиса PAS-
его производные, а также вещества процианидин
Sonline [36].
В3 и микофеноловая кислота; наименьшая аф-
БИОФИЗИКА том 66
№ 6
2021
ПРОЦИАНИДИН В3 - ПОТЕНЦИАЛЬНЫЙ ИНГИБИТОР
1051
Таблица 2. Характеристики соединений с наибольшей аффинностью к септину
Предсказанная
Номер
Название
MM-GBSA,
MM-GBSA,
№
Glide Score
Glide Emodel
биологическая
соединения
вещества
ккал/моль
ккал/моль
активность
1
135398633
ГТФ
-8.313
-31.27
-63.713
-37.52
Не определена
2
135398675
ГТФ-γ-S
-8.25
-29.53
-63.542
-31.2
Не определена
3
135398619
ГДФ
-8.824
-33.67
-63.366
-33.49
Не определена
4
126941
Метотрексат
-3.694
-27.25
-36.609
-21.27
0.319
5
6918837
Панобиностат
-5.03
-28.22
-56.272
-30.78
0.44
6
44564
Лодоксамид
-6.813
-28.72
-59.331
-37.52
0.351
7
446541
Микофеноловая
-7.94
-31.53
-54.785
-31.53
0.463
кислота
8
53465279
Лезинурад
-7.263
-30.86
-47.539
-30.86
Не определена
9
73417413
Метокарбамол
-4.31
-26.49
-40.735
-25.17
Не определена
10
93379
CPPU
-2.175
-20.36
-30.396
-19.02
0.263
11
-
UR214-9
-2.341
-25.44
-37.638
-23.44
0.194
12
146798
Процианидин В3
-9.339
-30.64
-70.429
-35.64
0.582
финность была выявлена у CPPU и его аналога
финность при связывании с мономерной формой
UR214-9 (данные не приведены).
SEPT9 (рис. 4).
Второе найденное вещество с высокой аффин-
Для валидации аффинных соединений была
ностью - микофеноловая кислота - не препят-
выбрана оценочная функция Glide Emodel, так
ствовало формированию димерной формы сеп-
как она имела наилучшую корреляцию с MM-
тина и было исключено из дальнейших исследо-
ваний.
GBSA (R2 = 92%, p = 0.001). В итоге для дальней-
Процианидин В3 с высокой аффинностью
ших исследований было выбрано вещество про-
связывается с мономерной формой септина в об-
цианидин В3, которое показало наибольшую аф-
ласти присоединения второй субъединицы и кон-
сервативного сайта для посадки ГТФ - G1- и G4-
мотивов, контактирующих с фосфатными груп-
пами и гуаниновым основанием нуклеотида соот-
ветственно и важных для связывания ГТФ. Про-
цианидины принадлежат к проантоцианидинам
класса флавоноидов, встречающихся в яблоках,
какао, винограде и ягодах [41].
Для идентификации образуемых взаимодей-
ствий между мономером SEPT9 и процианиди-
ном В3 проводили молекулярную динамику. Че-
рез 3 нс комплекс достигал равновесного состо-
яния и отклонение белка составило не более
1.5 Å, а лиганда - не более 1 Å (рис. 5а). Образу-
емые связи между процианидином B3 и SEPT9
перечислены в табл. 3. Дополнительно были вы-
делены водные мостики, образованные амино-
Рис. 4. Оценочная функция Glide Emodel относитель-
кислотными остатками Gly33, Arg241, Lys244.
но значений свободной энергии MM-GBSA малых
Помимо этого сама структура мономера в ком-
молекул: CPPU (1), метотрексат (2), UR214-9 (3), ме-
плексе с процианидином В3 стала более ста-
токарбамол (4), лезинурад (5), микофеноловая кисло-
бильной, в частности, регионы аминокислот-
та (6), панобиностат (7), лодоксамид (8), ГТФ-γ-S (9),
ных остатков 100-120, 180-210, по сравнению с
ГДФ (10), ГТФ (11), процианидин В3 (12); p = 0.001.
димерной формой септина в комплексе с ГТФ-
БИОФИЗИКА том 66
№ 6
2021
1052
ВАХРУШЕВА и др.
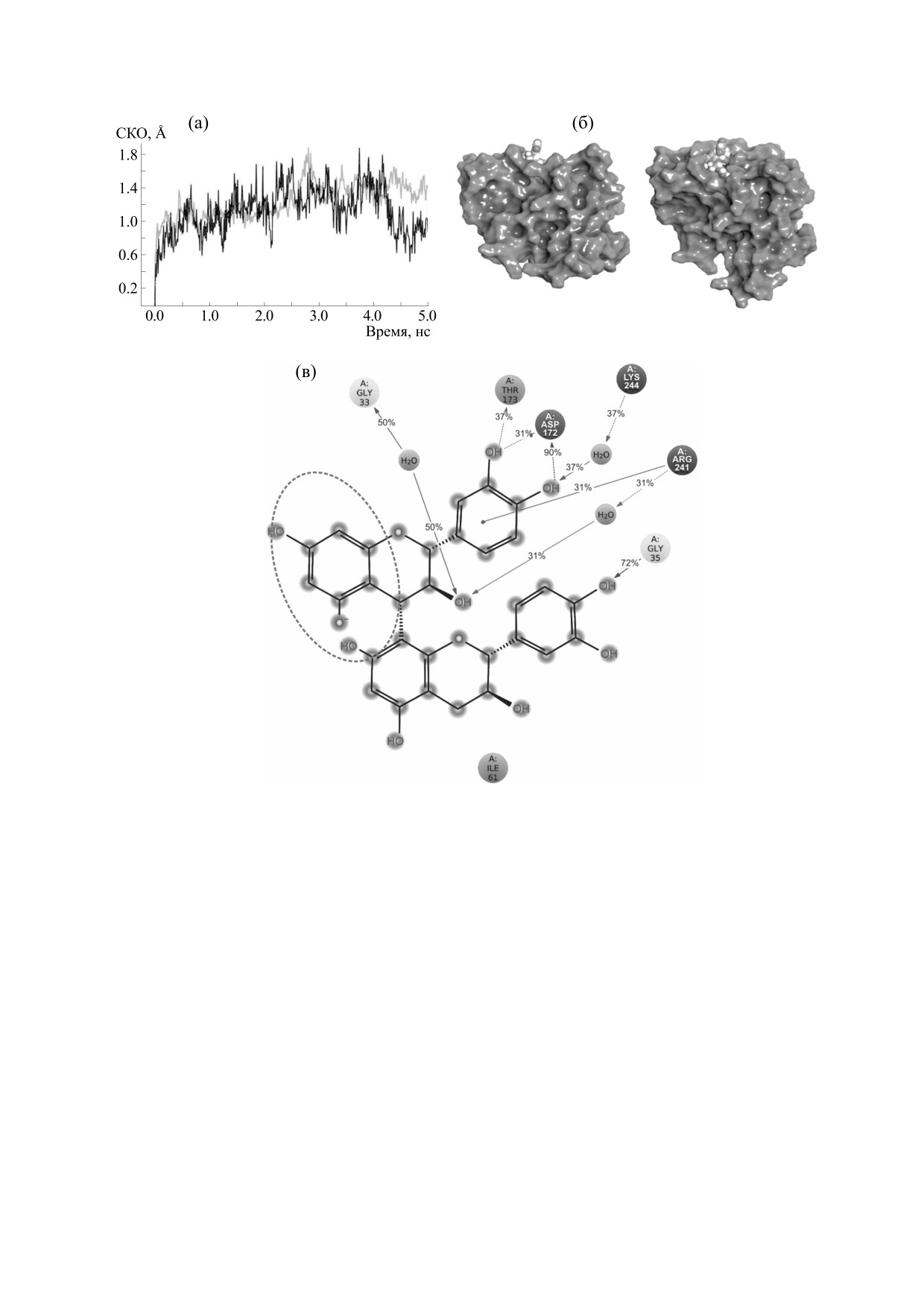
Рис. 5. (а) - СКО в зависимости от времени: серая кривая - Cα атомы мономерного белка SEPT9 относительно
референсного фрейма, черная кривая - лиганд относительно SEPT9; (б) - общий вид в двух проекциях структуры
мономерной формы SEPT9 с процианидином B3; (в) - схема контактов, образуемых процианидином В3 с
аминокислотными остатками SEPT9; пунктирной линией выделена часть молекулы, стерически препятствующая
стабилизации димерной формы SEPT9.
γ-S, где среднеквадратичные флуктуации дости-
По результатам анализа формируемых взаимо-
гали 2.5-3.0 Å, по сравнению с 1.5-2.0 Å в случае
действий процианидина В3 с мономерной фор-
комплекса мономерного септина с процианиди-
мой SEPT9 было обнаружено следующее распо-
ном В3. При этом вторичная структура белка не
ложение лиганда (рис. 5б,в): одна из групп про-
нарушилась. Учитывая, что значение ΔG (сво-
цианидина В3 - пирокатехин - связывалась с
бодной энергии Гиббса), рассчитанное методом
Gly35 из G1 мотива SEPT9, таким образом зани-
MM-GBSA, для данного комплекса составило
мая место присоединения фосфатных групп ГТФ.
около -35 ккал/моль (-147 кДж/моль) в началь-
При этом бензопирановая часть процианидина
ной позиции и -52 ккал/моль (-209 кДж/моль)
В3 фиксировалась со стороны боковой петли че-
после молекулярной динамики, то можно пред-
рез гидрофобные взаимодействия с Ile61 и ча-
полагать высокую стабильность данного ли-
стично через водородные связи с аминокислотой
ганд-рецепторного комплекса.
Arg60, как и в случае комплекса SEPT9 со связан-
БИОФИЗИКА том 66
№ 6
2021
ПРОЦИАНИДИН В3 - ПОТЕНЦИАЛЬНЫЙ ИНГИБИТОР
1053
Таблица 3. Связи между процианидином B3 и мономерной формой SEPT9
Атом со стороны белка
№
Атом со стороны процианидина В3
Тип связи (Å)
SEPT9
1
Gly35(NH)
O12
Водородная (2.31)
2
Arg241(HH22)
Ароматическая группа (C3-C16)
Пи-катионное взаимодействие (4.7)
3
Lys244(NZ)
Ароматическая группа (C13-C27)
Пи-катионное взаимодействие (5.7)
4
Asp172(OD2)
H21
Водородная (1.72)
5
Thr173(HG1)
O10
Водородная (1.96)
6
Thr173(OG1)
H20
Водородная (1.88)
7
Arg60(HH21)
O4
Водородная (2.04)
8
Arg60(HH22)
О6
Водородная (1.99)
9
Arg60(NH2)
O7
Солевой мостик (4.8)
10
Ile61(O)
H22
Водородная (2.47)
ной структурой ГТФ-γ-S. Таким образом, часть
антипролиферативный эффект был зафиксиро-
процианидина В3 занимала и блокировала место
ван для клеток рака легкого A427, рака груди
связывания фосфатных групп ГТФ. Более того,
MCF-7, желудочной аденокарциномы CRL-1739
вторая часть процианидина В3 формировала свя-
[42] и других типов рака. При этом механизм дей-
зи с регионом связывания гуанинового основа-
ствия проантоцианидинов остается не до конца
ния - G4, а именно с аминокислотными остатка-
исследованным. Показано, что в большинстве
ми Asp172, Thr173. В результате процианидин В3
случаев запускаются процессы апоптоза в рако-
полностью задействовал основные консерватив-
вых клетках [43]. В работе [44] был предложен ме-
ные регионы структуры SEPT9, фиксировав по-
ханизм ингибирования процианидином В3 ги-
ложения аминокислотных остатков, участвую-
стоновой ацетилтрансферазы, в работе [45] - ме-
щих в связывании ГТФ, в пре-конформации, т.е.
ханизм снижения процианидином В2 активности
до связывания ГТФ. Помимо этого, проциани-
ДНК метилтрансфераз или [46] через связывание
дин В3 имел два дополнительных пи-катионных
с фактором NF-κB. Тем не менее пока не были
взаимодействия, что обеспечивало дополнитель-
проведены структурные исследования взаимо-
ную аффинность связывания (см. табл. 3). Стоит
действий процианидина В3. Стоит отметить, что
отметить, что процианидин В3 располагается в
влияние процианидинов на септины пока не ис-
сайте связывания SEPT9 таким образом, что одна
следовалось. Как отмечалось выше, экспрессия
из его ароматических групп оказывается развер-
септинов и механизмы их действия изменяются
нута в сторону, стерически препятствуя присо-
по-разному в зависимости от типа онкологии. В
единению другой септиновой субъединицы. До-
частности, экспрессия SEPT9 повышена при раке
кинг процианидина В3 в сайт взаимодействия од-
груди, яичников [8, 47]. При лейкемии наблюда-
ной септиновой субъединицы со второй не
ется другой механизм, а именно образование хи-
приводил к высоко аффинному связыванию про-
мерных белков септинов с геном MLL (Mixed
цианидина В3 в сайте второй субъединицы, в том
Lineage Leukemia) путем хромосомных трансло-
числе не формировалась стабилизирующая связь
каций. В связи с этим предполагается разный эф-
с аминокислотным остатком His145, участвую-
фект веществ, влияющих на септины, относи-
щая в образовании димерной молекулы SEPT9 в
тельно клеточных процессов, происходящих в ра-
случае связывания ГТФ или его аналогов. Также
ковых клетках различного генеза.
при моделировании димерной структуры септи-
Таким образом, в данной работе был проведен
нов с процианидином В3 связывание лиганда не
виртуальный скрининг соединений, нарушаю-
происходило, что подтверждает неспособность
щих димеризацию септинов SEPT9 и найдено ве-
процианидина В3 стабилизировать димерную
щество из группы флавоноидов — процианидин
форму SEPT9.
В3. Данный флавоноид связывается с септином
В литературе влияние проантоцианидинов на
SEPT9 предположительно с высокой аффинно-
пролиферацию рассматривалось относительно
стью в важной для связывания ГТФ области G1-
широкого спектра раковых клеток. Например,
и G4-мотивов, контактирующих с фосфатными
БИОФИЗИКА том 66
№ 6
2021
1054
ВАХРУШЕВА и др.
группами и гуаниновым основанием нуклеотида,
13. M. Kinoshita, C. M. Field, M. L. Coughlin, et al., De-
что, вероятно, может предотвращать димериза-
velopmental Cell 3 (6), 791 (2002).
цию септиновых мономеров. Для того чтобы под-
14. M. Sirajuddin, M. Farkasovsky, F. Hauer, et al., Nature
твердить селективное влияние процианидина В3
449 (7160), 311 (2007).
на пролиферативную способность раковых кле-
15. M. S. Kim, C. D. Froese, M. P. Estey, and W. S. Trim-
ток, необходимо в дальнейшем провести допол-
ble, J. Cell Biol. 195 (5), 815 (2011).
нительные исследования по изучению влияния
16. K.-I. Nagata and M. Inagaki, Oncogene 24 (1), 65
процианидина В3 на структуру септинов и меха-
(2004).
низмы пролиферации в раковых клетках.
17. Y. Zeng, Y. Cao, L. Liu, et al., Cell Death & Disease 10,
720 (2019).
18. C. Poüs, L. Klipfel, and A. Baillet, Front. Cell Devel.
ФИНАНСИРОВАНИЕ РАБОТЫ
Biol. 4, 126 (2016).
Исследование выполнено при финансовой
19. M. Desouza, P. W. Gunning, and J. R. Stehn, BioAr-
поддержке Российского фонда фундаментальных
chitecture 2 (3), 75 (2012).
исследований в рамках научного проекта № 19-
20. M. Sirajuddin, M. Farkasovsky, E. Zent, and A. Wit-
34-90178.
tinghofer, Proc. Natl. Acad. Sci. USA 106 (39), 16592
(2009).
21. E. Zent and A. Wittinghofer, Biol. Chem. 395 (2), 169
БЛАГОДАРНОСТИ
(2014).
Исследование выполнено с использованием
22. A. M. Vrabioiu, S. A. Gerber, S. P. Gygi, et al., J. Biol.
оборудования Центра коллективного пользова-
Chem. 279 (4), 3111 (2004).
ния сверхвысокопроизводительными вычисли-
23. M. Farkasovsky, P. Herter, B. Voss, and A. Witting-
тельными ресурсами МГУ имени М.В. Ломоно-
hofer, Biol. Chem. 386 (7) (2005).
сова [48].
24. M. Mendoza, A. A. Hyman, and M. Glotzer, Curr. Bi-
ol. 12 (21), 1858 (2002).
25. D. Vardi-Oknin, M. Golan, and N. J. Mabjeesh, PLoS
КОНФЛИКТ ИНТЕРЕСОВ
One 8 (8), e73179 (2013).
Авторы заявляют об отсутствии конфликта
26. W. Blum, T. Henzi, L. Pecze, et al., Oncotarget 10 (65),
интересов.
6944 (2019).
27. D. Angelis, E. P. Karasmanis, X. Bai, and E. T. Spilio-
tis, PLoS One 9 (5), e96390 (2014).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
28. K. K. Kim, R. K. Singh, N. Khazan, et al., Sci. Rep. 10
Настоящая работа не содержит описания ис-
(1) (2020).
следований с использованием людей и животных
29. L. R. Heasley, G. Garcia, and M. A. Mcmurray, Eu-
в качестве объектов.
karyotic Cell 13 (11), 1411 (2014).
30. G. M. Sastry, M. Adzhigirey, T. Day, et al., J. Comput-
СПИСОК ЛИТЕРАТУРЫ
er-Aided Mol. Design 27 (3), 221 (2013).
31. S. Kim, J. Chen, T. Cheng, et al., Nucl. Acids Res. 49
1. D. D. Leipe, Y. I. Wolf, E. V. Koonin, and L. Aravind,
(D1), D1388 (2021).
J. Mol. Biol. 317 (1), 41 (2002).
32. S. L. Dixon, A. M. Smondyrev, and S. N. Rao, Chem.
2. L. Hartwell, Exp. Cell Res. 69 (2), 265 (1971).
Biol. Drug Design 67 (5), 370 (2006).
3. B. Byers and L. Goetsch, J. Cell Biol. 69 (3), 717
33. R. A. Friesner, R. B. Murphy, M. P. Repasky, et al., J.
(1976).
Med. Chem. 49 (21), 6177 (2006).
4. C. Martínez, M. A. Sanjuan, J. A. Dent, et al., Bio-
34. D. A. Case, T. E. Cheatham 3rd, T. Darden, et al., J.
chem. J. 382 (3), 783 (2004).
Comput. Chem. 26 (16), 1668 (2005).
5. E. T. Spiliotis, J. Cell Sci. 131 (1), 207555 (2018).
35. K. J. Bowers, D. E. Chow, H. Xu, et al., in Proc. 2006
6. F. Calvo, R. Ranftl, S. Hooper, et al., Cell Reports 13
ACM/IEEE Conf. on Supercomputing (SC'06) (2006),
(12), 2699 (2015).
p. 84.
7. N. Zhang, L. Liu, N. Fan, et al., Oncotarget 7 (38),
36. D. A. Filimonov, A. A. Lagunin, T. A. Gloriozova,
61587 (2016).
et al., Chem. Heterocyclic Compounds 50 (3), 444
8. M. E. Gonzalez, E. A. Peterson, L. M. Privette, et al.,
(2014).
Cancer Res. 67 (18), 8554 (2007).
37. O. Trott and A. J. Olson, J. Comput. Chem. (2009).
9. D. Connolly, I. Abdesselam, P. Verdier-Pinard, and
C. Montagna. Biol. Chem. 392 (8-9), 725 (2011).
38. I. A. Guedes, A. M. S. Barreto, D. Marinho, et al., Sci.
10. R. K. Singh, K. K. Kim, N. Khazan, et al., BioRxiv
Rep. 11, 3198 (2021).
2020, 954529 (2020).
39. A. Grosdidier, V. Zoete, and O. Michielin, Nucl. Acids
Res. 39, W270 (2011).
11. E. A. Marcus, E. Tokhtaeva, S. Turdikulova, et al., Bio-
chem. J. 473 (12), 1703 (2016).
40. Y. Liu, M. Grimm, W. Dai, et al., Acta Pharmacol. Si-
12. A. A. Rodal, L. Kozubowski, B. L. Goode, et al., Mol.
nica 41 (1), 138 (2019).
Biol. Cell 16 (1), 372 (2005).
41. Y. Lee, Toxicol. Res. 33 (4), 273 (2017).
БИОФИЗИКА том 66
№ 6
2021
ПРОЦИАНИДИН В3 - ПОТЕНЦИАЛЬНЫЙ ИНГИБИТОР
1055
42. X. Ye, R. L. Krohn, W. Liu, et al., Mol. Cell Biochem.
46. G. G. Mackenzie, A. M. Adamo, N. P. Decker, and
196 (1-2), 99 (1999).
P. I. Oteizaet, Biochem. Pharmacol.
75
(7),
1461
43. U. Lewandowska, K. Szewczyk, K. Owczarek, et al.,
(2008).
Nutrition and Cancer 65 (8), 1219 (2013).
47. J. F. Burrows, S. Chanduloy, M. A. McIlhatton, et al.,
44. K.-C. Choi, S. Park, B. J. Lim, et al., Biochem. J. 433
J. Pathology 201 (4), 581 (2003).
(1), 235 (2011).
45. A. Shilpi, S. Parbin, D. Sengupta, et al., Chemico-Bio-
48. V. V. Voevodin, A. S. Antonov, D. A. Nikitenko, et al.,
logical Interactions 233, 122 (2015).
Supercomput. Front. Innovations 6 (2), 4 (2019).
Procyanidin B3 as a Potential Inhibitor of Human Septin 9
A.V. Vakhrusheva*, A.V. Kudryavtsev*, O.S. Sokolova*, **, and K.V. Shaitan *, ***
*Faculty of Biology, Lomonosov Moscow State University, Leninskie Gory 1/12, Moscow, 119234 Russia
**Faculty of Biology, Shenzhen MSU-BIT University, International University Park Road 1,
Guangdong Province, Shenzhen 517182, Chinese People's Republic
***Semenov Institute of Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119991 Russia
Septin cytoskeletal proteins are involved in many cellular processes; changes in gene expression are a hall-
mark of cancer. In this context, septins emerge as a potential target for cancer cells. In search of new small
molecules that may affect the organization of septin filaments in the cellular structures, a virtual screening of
the PubChem database compound library was performed and procyanidin B3, a flavonoid lipid molecule,
with better affinity than other substances, was selected. Molecular modeling showed that procyanidin B3 can
interact with the septin monomer SEPT9 in the region of the G1 and G4 motifs important for GTP binding
and prevent dimerization of septin monomers. Therefore, procyanidin B3 could be considered to be a prom-
ising compound to affect the structure of septin filaments in cancer cells.
Keywords: septin, conformational changes, SEPT9, procyanidin B3, molecular modeling, pharmacophore
БИОФИЗИКА том 66
№ 6
2021