БИОФИЗИКА, 2021, том 66, № 6, с. 1056-1064
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
НИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ГЕМОГЛОБИНА
В РАЗЛИЧНЫХ МОДЕЛЬНЫХ СИСТЕМАХ
© 2021 г. Д.И. Грачев*, **, К.Б. Шумаев**, ***, О.В. Космачевская***,
А.Ф. Топунов***, Э.К. Рууге*, **
*Физический факультет Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы, 1/2
**Национальный медицинский исследовательский центр кардиологии Минздрава России,
121552, Москва, 3-я Черепковская ул., 15а
***ФИЦ «Фундаментальные основы биотехнологии» РАН, 119071, Москва, Ленинский просп., 33/2
E-mail: di.grachev@physics.msu.ru
Поступила в редакцию 31.07.2021 г.
После доработки 31.07.2021 г.
Принята к публикации 14.09.2021 г.
Комплексы оксида азота (NO) с железом гемовой группы гемоглобина (Hb(II)NO) и динитрозильные
комплексы железа c тиолами, в том числе с цистеиновыми остатками гемоглобина (Hb-ДНКЖ), могут
играть важную роль в процессах окислительного, галогенирующего и нитрозативного стресса в сер-
дечно-сосудистой системе. В работе в различных модельных системах с помощью спектроскопии
электронного парамагнитного резонанса парамагнитных комплексов NO и спиновых аддуктов
DEPMPO рассмотрено взаимодействие гемоглобиновых комплексов NO двух этих типов с активными
формами галогенов, кислорода и азота, а также алкоксильными и алкилперекисными радикалами.
Показано, что хлорноватистая кислота (гипохлорит) и пероксинитрит количественно разрушают Hb-
ДНКЖ. В присутствии дитионита S-нитрозоглутатион может участвовать в нитрозилировании дезок-
сигемоглобина с образованием Hb(II)NO, тогда как добавление в эту систему пероксинитрита приво-
дит к формированию динитрозильных комплексов железа. Вместе с тем Hb(II)NO и Hb-ДНКЖ сни-
жают уровень органических свободных радикалов, продуцируемых в реакции гемоглобина с гидропе-
роксидом трет-бутила. Полученные данные указывают на способность исследованных нитрозильных
комплексов гемоглобина перехватывать активные формы кислорода, азота и галогенов и тем самым
влиять на процессы свободнорадикального окисления.
Ключевые слова: окислительный стресс, динитрозильные комплексы железа, гемоглобин, антиоксидан-
ты, электронный парамагнитный резонанс, спиновые ловушки.
DOI: 10.31857/S0006302921060028
Изучение воздействия окислительного, гало-
рают активные формы галогенов, в частности
хлорноватистая кислота (HClO), активные фор-
генирующего и нитрозативного стресса на мета-
мы азота (пероксинитрит, нитроксильный анион
болизм оксида азота (NO) имеет весьма важное
и др.), а также активные формы кислорода (раз-
значение как для общего понимания физиологи-
личные гидропероксиды, гидроксильный и су-
ческих процессов с участием NO и его комплек-
сов, в первую очередь в сердечно-сосудистой си-
пероксидный радикалы). Эти активные метабо-
литы вызывают модификацию и инактивацию
стеме, так и для изучения патогенеза различных
биомолекул [1, 2], причем общими мишенями их
заболеваний, возможностей терапевтического
действия в белках являются тиольные (-SH)
воздействия, а также разработки новых методов
группы и металлсодержащие центры. В гемогло-
диагностики.
бине (Hb) в качестве таких функциональных
Во многих случаях, например при воспалении,
групп выступают гем и SH-группы цистеинов, в
проявления окислительного, нитрозативного и
первую очередь остатков Cys93 β-субъединиц.
галогенирующего стрессов тесно связаны друг с
Наряду с транспортом кислорода гемоглобин
другом. Наиболее существенную роль в развитии
участвует в метаболизме столь важной сигналь-
различных патофизиологических процессов иг-
ной молекулы, как оксид азота. Так, оксигемо-
глобин (Hb(II)O2) реагирует с NO, окисляя его до
Сокращения: Hb - гемоглобин, ДНКЖ - динитрозильные
комплексы железа.
нитрата (NO-диоксигеназная реакция) [3]. Сле-
1056
НИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ГЕМОГЛОБИНА
1057
дует отметить, что интермедиатом этой реакции
леза. Известно также, что нитрозилирование
является связанный с гемовым железом перокси-
гемового железа может ингибировать проокси-
нитрит. С другой стороны, дезоксигемоглобин
дантное действие гемопротеидов [13-15]. Имеют-
может действовать как нитритредуктаза с образо-
ся данные о том, что NO способен ингибировать
ванием оксида азота [4, 5]. Тем не менее NO, про-
реакции фентоновского типа, т.е. генерацию гид-
дуцируемый в эритроцитах при восстановлении
роксильного радикала при взаимодействии пе-
нитрита, будет далее реагировать с другими моле-
роксида водорода с ионами двухвалентного желе-
кулами гемоглобина. Известно, что ферроформа
за. Однако механизм подобного действия NO
гема (порфирин-Fe(II)) связывает NO c очень вы-
остается не вполне ясным [16, 17].
сокой аффинностью, константа диссоциации об-
Важно, что Hb(II)NO и моноядерные ДНКЖ
разующегося нитрозильного комплекса гемового
являются парамагнитными, что позволяет иссле-
железа (Hb(II)NO) находится в пределах 10-10-
довать их с помощью спектроскопии электронно-
10-11 M [4]. Комплекс ферриформы гемовой
го парамагнитного резонанса (ЭПР)
[6-8].
группы (порфирин-Fe(III)) с оксидом азота на-
Структура этих нитрозильных комплексов гемо-
много менее прочен, константа его диссоциации
вого и негемового железа представлена на рис. 1.
равна 2.5×10-4 M. Образование нитрозильных
Целью настоящей работы является изучение
комплексов гемового железа происходит в следу-
взаимодействия между различными прооксидан-
ющих реакциях:
тами и комплексами гемоглобинa c оксидом азота
порфирин-Fe(II) + NO → порфирин-Fe(II)-NO, (1)
в системах, моделирующих галогенирующий,
нитрозативный и оксилительный стресс.
порфирин-Fe(III) + NO → порфирин-Fe(III)-NO. (2)
Считается, что эти реакции, а также NO-диок-
сигеназная и нитритредуктазная реакции играют
МАТЕРИАЛЫ И МЕТОДЫ
ключевую роль в регуляции гемоглобином сиг-
Реактивы. Парамагнитные комплексы NO с
нальной функции оксида азота [3, 4]. Вместе с тем
гемоглобином регистрировали методом ЭПР-
NO может связываться с ионами железа и тиоль-
спектроскопии в суспензии эритроцитов крови
ными группами Cys93 β-субъединиц Hb с образо-
человека и в модельных системах, содержавших
ванием динитрозильных комплексов железа
бычий гемоглобин (Sigma-Aldrich, США) в раз-
(ДНКЖ) [6-8]. Кроме того, в результате нитрози-
личных реакционных смесях, в том числе с гипо-
лирования этих SH-групп гемоглобина формиру-
хлоритом натрия (NaClO) и донорами NO -
ется белковый S-нитрозотиол [6]. В то же время
DEA/NO (diethylamine NONOate) (Sigma-Aldrich,
ферриформа Hb (метгемоглобин) в сочетании с
США). Спиновая ловушка DEPMPO (5-(диэток-
нитритом и тиолами участвует в продукции низ-
сифосфорил)-5-метил-1-пирролин-N-оксид)
комолекулярных S-нитрозотиолов, в том числе
была получена от фирмы Cayman Chemical Eu-
S-нитрозоглутатион (GSNO) [5]. Нужно отме-
rope (Эстония).
тить, что S-нитрозотиолы и ДНКЖ, связанные с
белками или низкомолекулярными лигандами,
Пероксинитрит (ONOO-) был синтезирован в
ответственны за реализацию большого числа фи-
соответствии с методикой, описанной в работах
зиологических функций оксида азота [5-8].
[7, 18]. GSNO получали, смешивая эквимолярные
В свою очередь такие метаболиты NO, как GS-
концентрации восстановленного глутатиона и
NO и нитрит, в условиях, моделирующих окисли-
нитрита в кислой среде [9].
тельный и карбонильный стресс, вызывают мо-
ДНКЖ с фосфатными лигандами получали,
дификацию винильных групп порфирина метге-
пропуская в сосуде Тунберга газообразный оксид
моглобина и формирование Hb(II)NO
[9].
азота через раствор FeSO4 в 100 мМ К,Na-фос-
Недавно нами было показано, что включение
фатном буфере (рН 6.8). Для получения ДНКЖ,
Cys-93 β-субъединиц как лигандов в состав ДН-
связанных с глутатионом, к фосфатным комплек-
КЖ является важным способом регуляции реак-
сам добавляли восстановленный глутатион, в ре-
ционной способности SH-групп Hb, причем фор-
зультате чего Fe-NO-группа переходила на новые
мирование этих комплексов NO защищает тиоль-
лиганды.
ные группы от окисления гидропероксидом
трет-бутила [10].
Эритроциты крови человека были получены в
Авторы работ [11, 12] установили, что цитопро-
клинико-диагностической лаборатории НМИЦ
текторное и антиоксидантное действие NO в
кардиологии (Москва). Эритроциты отмывали
культуре обработанных гидропероксидом трет-
центрифугированием в изотоническом растворе
бутила эритролейкемических клеток обусловлено
(0.9% NaCl) при ускорении 1000 g в течение
как его взаимодействием с органическими сво-
5 мин, далее надосадочную жидкость удаляли, а
бодными радикалами, так и образованием нитро-
осадок ресуспендировали в изотоническом рас-
зильных комплексов гемового и негемового же-
творе. Процедуру повторяли еще два раза.
БИОФИЗИКА том 66
№ 6
2021
1058
ГРАЧEВ и др.
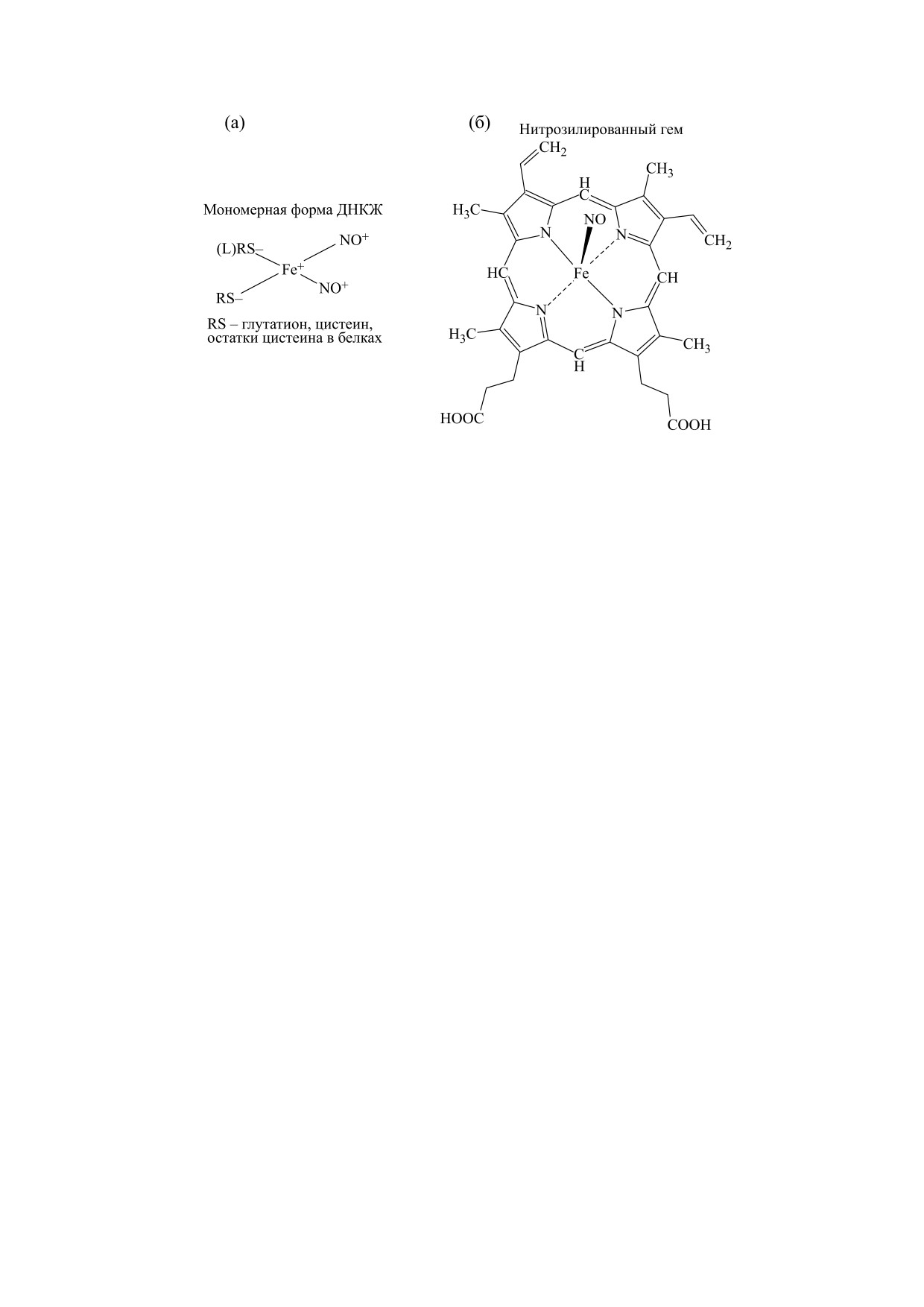
Рис. 1. (а) - Динитрозильные комплексы железа с тиольными лигандами (в белках один из остатков цистеина может
быть заменен на другой лиганд (L), например, на остаток гистидина); (б) - нитрозилированный по железу гем (пор-
фирин-Fe(II)-NO).
Концентрация гемоглобина, растворенного в
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
0.2 М K,Na-фосфатном буфере (pH 7.5), состав-
ляла 0.4 мМ.
Ранее в работе [22] было показано, что низко-
молекулярные ДНКЖ с глутатионовыми лиган-
Hb-ДНКЖ получали в результате добавления
дами (GS-ДНКЖ) эффективно защищают эрит-
к раствору метгемоглобина фосфатных ДНКЖ в
роциты человеческой крови от гемолиза, вызван-
молярном соотношении 1 : 2.5.
ного хлорноватистой кислотой. В связи с этим мы
Концентрация дитионита натрия во всех экс-
также исследовали взаимодействие GS-ДНКЖ c
периментах с его использованием составляла
HClO в присутствии эритроцитов и донора NO,
70 мМ.
который имитировал продукцию оксида азота
Регистрация спектров ЭПР динитрозильных ком-
NO-синтазой. В данной системе моделировался
плексов железа и спиновых аддуктов DEPMPO.
галогенирующий стресс, возникающий при ре-
Спектры ЭПР записывали при комнатной темпе-
спираторном взрыве в ходе воспалительного от-
ратуре (25°C) на спектрометре E-109Е фирмы
вета. Из спектров ЭПР, представленных на рис. 2,
Varian (CША), а также малогабаритном автомати-
видно, что в суспензии эритроцитов человека, со-
зированном спектрометре ESR 70-03 XD/2 (УП
держащей донор NO (DEA/NO), GS-ДНКЖ и
«КБСТ» БГУ, Беларусь).
HClO, образуется Hb(II)NO (рис. 1б), хотя кине-
Условия записи спектров ЭПР: на Varian E-
тика этого процесса более медленная, чем в ана-
109E СВЧ-мощность 10 мВт, СВ-частота 9.15 ГГц;
логичной реакционной среде без HClO (рис. 2а).
на ЭПР-спектрометре ESR 70-03 XD/2 частота
Вместе с тем GS-ДНКЖ в этих условиях разруша-
9.35 ГГц, ослабление СВЧ 5 дБ. Амплитуда моду-
ются почти полностью. Быстрое разрушение GS-
ляции внешнего магнитного поля составляла
ДНКЖ под действием HClO согласуется с данны-
0.2 мТл при регистрации сигналов ДНКЖ и
ми работы [22]. При этом регенерация ДНКЖ не
Hb(II)NO, а при регистрации сигналов спиновых
происходит даже в присутствии свободного NO,
аддуктов DEPMPO - 0.025 мТл.
образующегося при распаде DEA/NO. В то же
Для исследования алкоксильного и алкилпе-
время Hb(II)NO внутри эритроцитов, вероятно,
рекисного радикалов трет-бутила использовали
менее доступен окислению хлорноватистой кис-
спиновую ловушку DEPMPO в соответствии с
лотой. Также было показано, что ДНКЖ, связан-
методикой, которая продемонстрирована в рабо-
ные с бычьим гемоглобином, количественно раз-
тах [19-21].
рушаются под действием HClO (рис. 3). Следова-
Статистический анализ. Обработка и анализ
тельно, если Hb-ДНКЖ образуется в модельной
экспериментальных результатов, в том числе ста-
системе с эритроцитами, описанной выше, то эти
тистические расчеты, были проведены в програм-
комплексы NO не регистрируются, поскольку
ме Origin Pro 8 (OriginLab Corp., США).
они должны быстро разрушаться.
БИОФИЗИКА том 66
№ 6
2021
НИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ГЕМОГЛОБИНА
1059
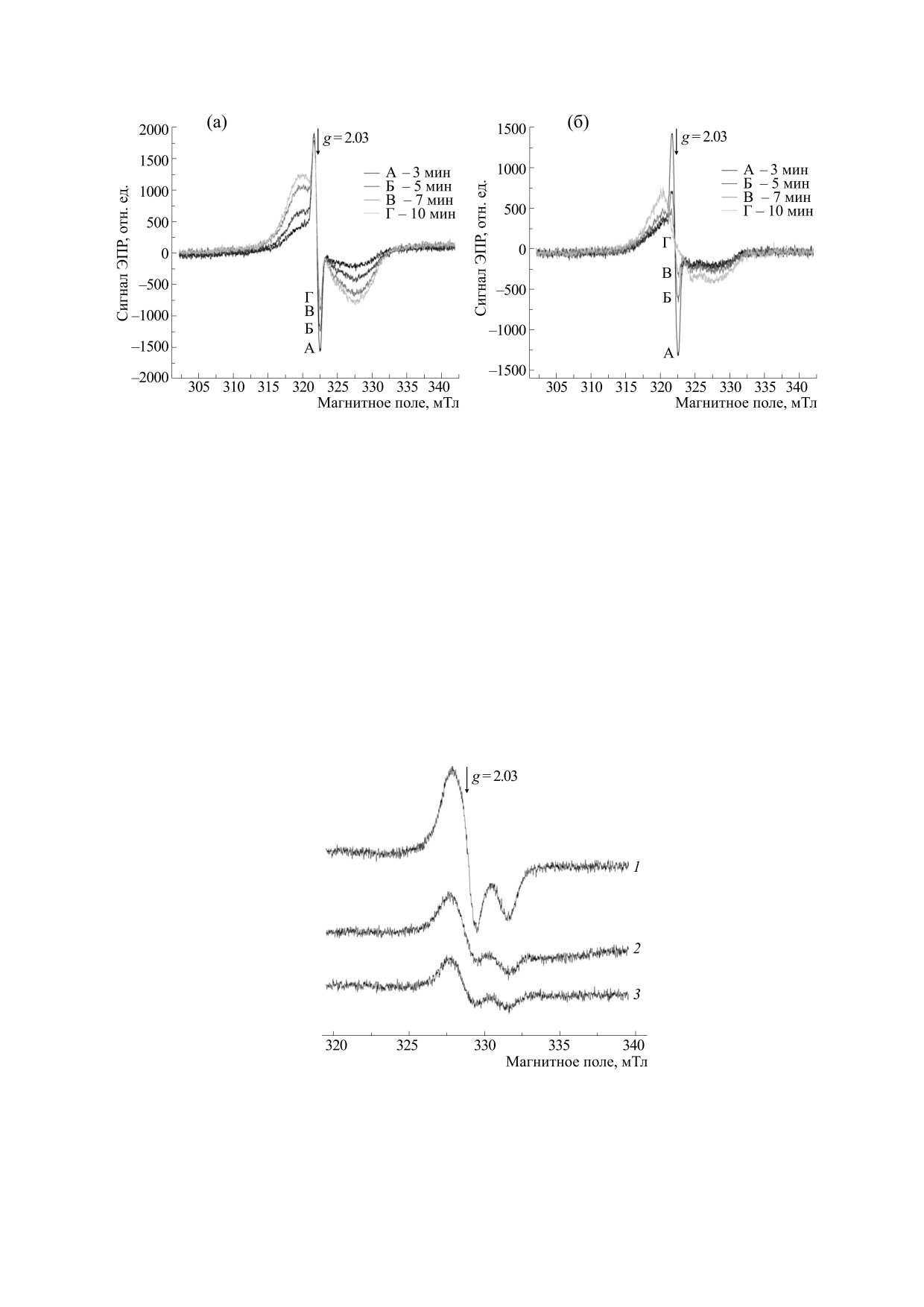
Рис. 2. Спектры ЭПР, зарегистрированные в реакционной среде, содержавшей эритроциты, 0.8 мМ GS-ДНКЖ и
10 мМ DEA/NO (а), а также после добавления в реакционную среду 0.1 мМ NaOCl (б). Узкий сигнал с g-фактором 2.03
принадлежит ДНКЖ с глутатионовыми лигандами, широкий сигнал является суперпозицией сигналов ЭПР
нитрозилированных гемовых групп Hb. Во всех образцах содержался изотонический К,Na-фосфатный буфер (pH 7.4).
В условиях, моделирующих нитрозативный
ДНКЖ под действием супероксида [8]. Тем не
стресс, исследовали взаимодействие Hb-ДНКЖ и
менее в данном эксперименте образование
пероксинитрита (ONOO-). Было показано, что
Hb(II)NO не наблюдалось.
пероксинитрит, аналогично НClO, дозозависимо
Известно, что образование Hb(II)NO в при-
разрушает Hb-ДНКЖ. Кинетика разрушения Hb-
сутствии S-нитрозоглутатиона существенно сти-
ДНКЖ при трех разных концентрациях перокси-
мулируется таким сильным восстановителем, как
нитрита в сравнении с контрольным образцом
дитионит [23]. Авторы статьи предполагают, что
без пероксинитрита продемонстрирована на
рис. 4. Нельзя исключить, что при разрушении
при восстановлении GSNO образуется свобод-
Hb-ДНКЖ высвобождается NO и происходит
ный NO и тиолят-анион глутатиона:
нитрозилирование гемовой группы гемоглобина.
Такой процесс происходил при разрушении Hb-
GSNO + e- → GSNO- → GS- + NO.
(3)
Рис. 3. Разрушение гемоглобиновых ДНКЖ под действием хлорноватистой кислоты. Спектры ЭПР Hb-ДНКЖ
(концентрация 0.4 мМ): 1 - образец без хлорноватистой кислоты (контрольный); 2 - то же, что и (1), + HClO в
концентрации 0.02 мМ; 3 - то же, что и (1), + HClO в концентрации 0.2 мМ. Во всех образцах содержался 100 мМ
К,Na-фосфатный буфер.
БИОФИЗИКА том 66
№ 6
2021
1060
ГРАЧEВ и др.
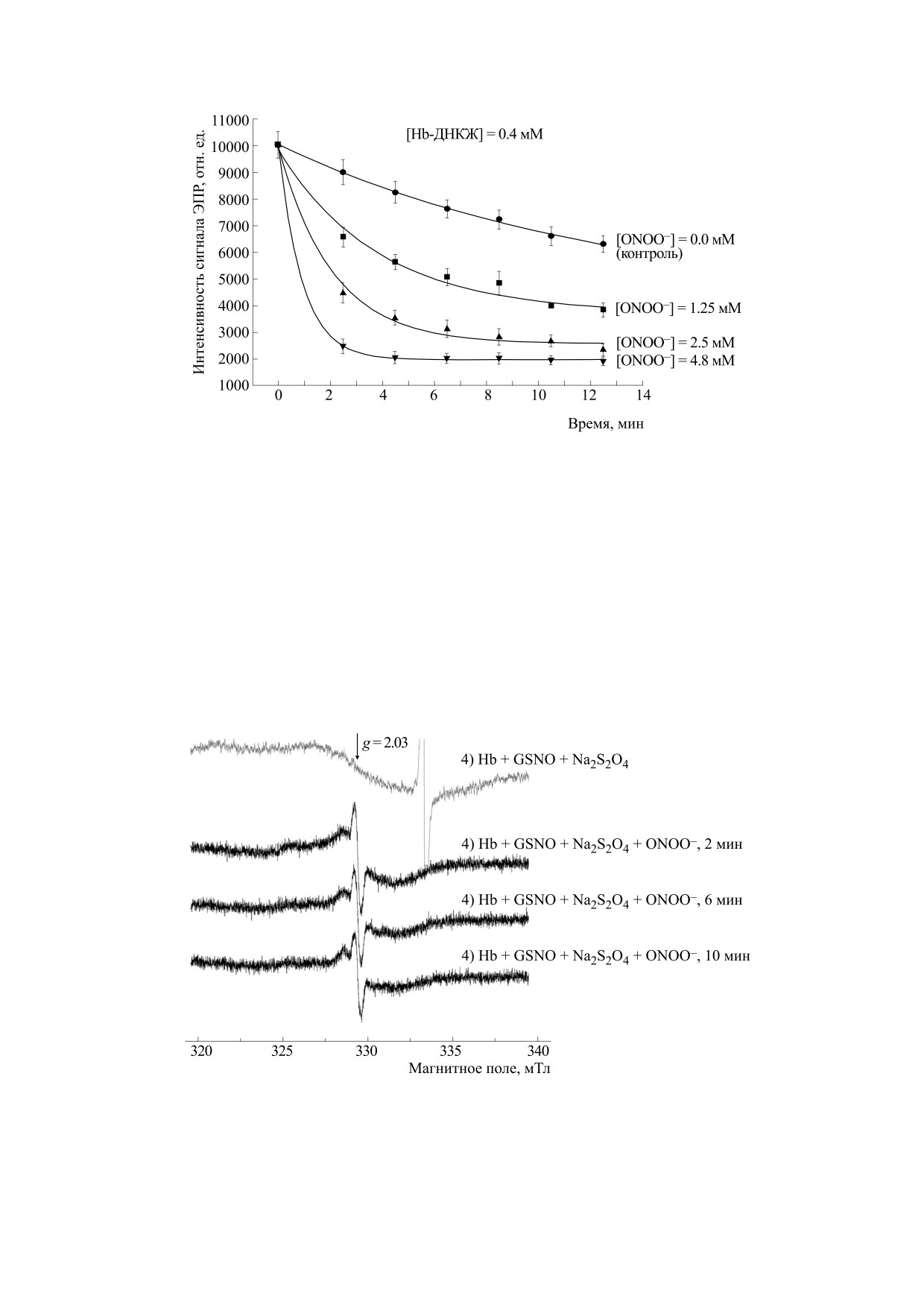
Рис. 4. Кинетические кривые дозозависимого разрушения Hb-ДНКЖ (концентрация 0.4 мМ) под действием перок-
синитрита (используемые концентрации указаны на рисунке).
Действительно, в реакционной среде, содер-
который, по-видимому, соответствует глутатион-
жащей метгемоглобин, дитионит и GSNO, мы
содержащим ДНКЖ. Вместе с тем сохраняется
наблюдали образование Hb(II)NO (рис.
5,
сигнал нитрозильного комплекса гемового желе-
спектр 1). Кроме того, на этом спектре мы видим
за, тогда как сигнал дитионита исчезает (рис. 5,
ЭПР-сигнал самого дитионита. Следует отме-
спектры 2-4). В литературе имеются данные, что
тить, что дитионит в данной системе также вос-
под действием хлорноватистой кислоты или пе-
станавливает метгемоглобин до дезоксигемогло-
роксинитрита происходит высвобождение гема в
бина. После добавления в реакционную среду пе-
гемолизате эритроцитов [7, 24]. Также ONOO-
роксинитрита мы наблюдаем появление сигнала
вызывает модификацию и деструкцию гемовых
ЭПР с g-фактором 2.03, характерного для ДНКЖ,
групп Hb и NO-синтазы [9, 25]. Можно предполо-
Рис. 5. Спектры ЭПР реакционной смеси, содержащей: 1 - 0.5 мМ гемоглобина, 12 мМ S-нитрозоглутатиона (GSNO)
и 70 мМ дитионита натрия (Na2S2O4); 2-4 - то же + пероксинитрит (8 мМ ONOO- через 2, 6 и 10 мин после
добавления пероксинитрита соответственно).
БИОФИЗИКА том 66
№ 6
2021
НИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ГЕМОГЛОБИНА
1061
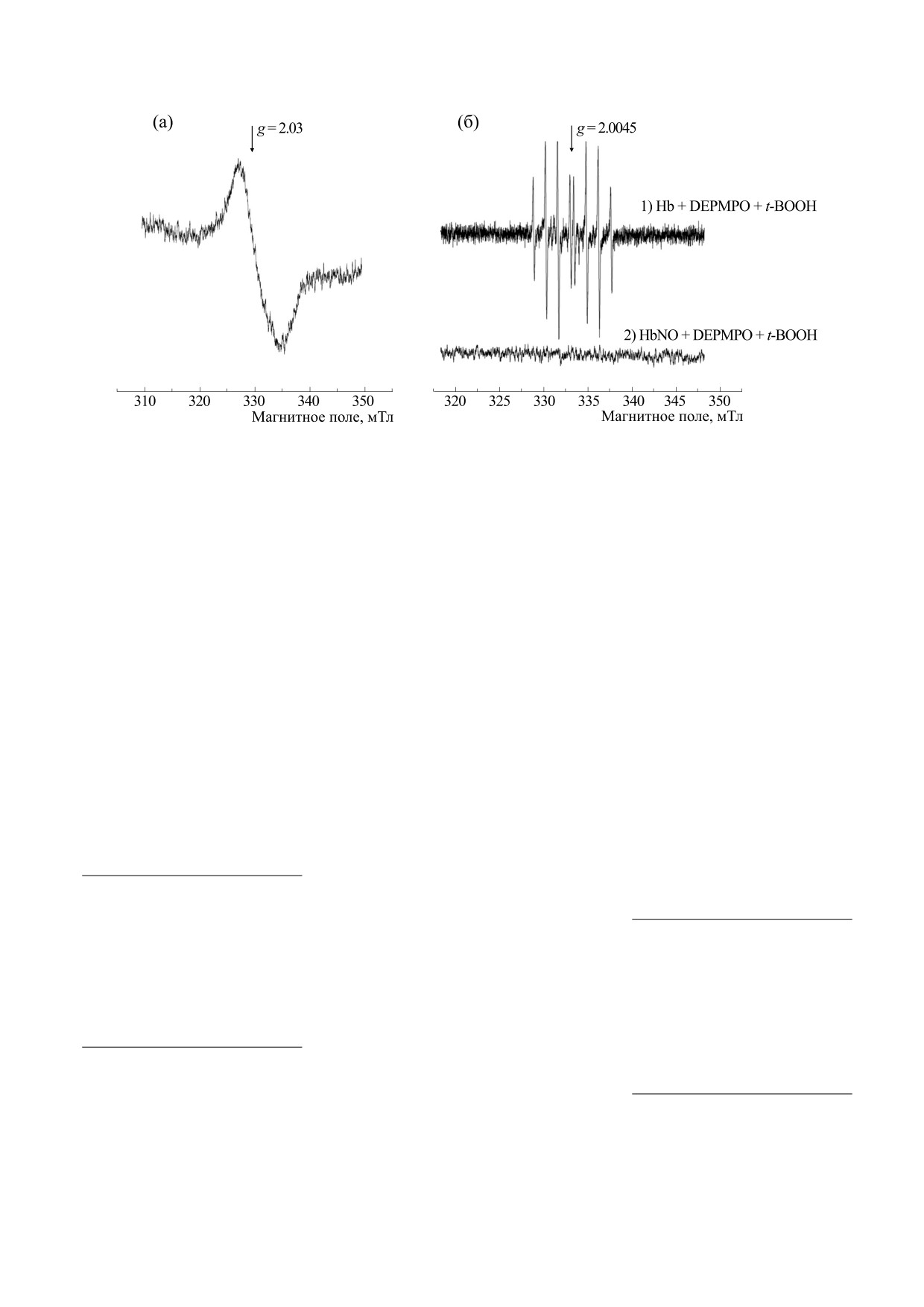
Рис. 6. Антиоксидантное действие Hb-ДНКЖ. (а) - Спектры ЭПР спинового аддукта DEPMPO, демонстрирующие
антиоксидантное действие Hb-ДНКЖ. Концентрация DEPMPO в реакционной смеси составляла 70 мМ, гидропе-
роксида трет-бутила - 1 мМ, метгемоглобина (1) или Hb-ДНКЖ (2) - 0.3 мМ. (б) - Средние значения интенсивности
сигнала ЭПР спинового аддукта DEPMPO в двух группах образцов: 1 - контрольные образцы с 0.3 мМ метгемоглоби-
на, 2 - образцы с Hb-ДНКЖ в расчетной концентрации 0.3 мМ.
жить, что S-нитрозоглутатион участвует в образо-
роксидами приводит к генерации свободных ра-
вании не только Hb(II)NO, но и ДНКЖ, причем
дикалов.
источником железа для последних является де-
Взаимодействие гемопротеидов с различными
струкция гемовой группы под действием перок-
гидропероксидами можно моделировать при по-
синитрита, а тиольный лиганд, как и NO, образу-
мощи гидропероксида трет-бутила (t-BOOH)
ется в реакции (3). В этом случае связывание же-
[11, 20]. Считается, что реакции гемопротеидов с
леза в составе ДНКЖ может ингибировать
гидропероксидом трет-бутила приводят к обра-
реакции фентоновского типа, в которых взаимо-
зованию органических свободных радикалов [8,
действие ионов переходных металлов с гидропе-
20, 26]:
порфирин-Fe(II) + t-BOOH → порфирин-Fe(III) + t-BO• + OH-,
(4)
порфирин-Fe(III) + t-BOOH → порфирин-Fe(IV)=O + t-BO• + H+,
(5)
порфирин-Fe(III) + t-BOOH → порфирин•-Fe(IV)=O + t-BOH,
(6)
порфирин•-Fe(IV)=O + t-BOOH → порфирин-Fe(IV)=O + t-BOO• + H+,
(7)
порфирин-Fe(IV)=O + t-BOOH → порфирин-Fe(III)-OH + t-BOO•,
(8)
t-BOO• → CH3• + ацетон,
(9)
CH3• + О2 → CH3ОО•.
(10)
Кроме того, продуктом этих реакций является
тила, причем для регистрации свободных радика-
такой сильный окислитель, как оксоферрильный
лов мы использовали спиновую ловушку DEPM-
гем (порфирин-Fe(IV)=O). В условиях окисли-
PO [20, 21]. На рис. 6а представлены спектры спи-
тельного стресса аналогичные реакции гемовых
новых аддуктов DEPMPO со свободно-
групп с липидными гидропероксидами стимули-
радикальными интермедиатами реакции метге-
руют перекисное окисление липидов и окисли-
моглобина и t-BOOH. Исходя из данных работы
тельную модификацию белков и других биополи-
[20], можно заключить, что основным свободным
меров.
радикалом, образующимся в исследуемой мо-
В наших экспериментах также исследовалось
дельной системе, является алкоксильный ради-
взаимодействие между гемоглобином или его
кал (трет-бутоксильный радикал, t-BO•). Кроме
комплексами с NO и гидропероксидом трет-бу-
того, в меньшей степени регистрируется метил-
БИОФИЗИКА том 66
№ 6
2021
1062
ГРАЧEВ и др.
Рис. 7. (а) - Спектр ЭПР Hb(II)NO, образованных при добавлении соли Анджели (концентрация Na2(ONNO2) в
образце - 12 мМ) к 0.3 мМ раствору метгемоглобина. (б) - Антиоксидантное действие Hb(II)NO (донор NO - соль
Анджели) в системе с гидропероксидом трет-бутила. Спектры образца 1, который содержал 0.3 мМ метгемоглобина,
70 мМ DEPMPO, 2 мМ t-BOOH; в случае образца 2 сначала получали Hb(II)NO добавлением соли Анджели к раствору
метгемоглобина, затем в образец добавляли DEPMPO и t-BOOH (конечные концентрации 70 и 2 мМ соответственно).
пероксильный радикал (CH3ОО•) (реакция 10).
бождаться при распаде ДНКЖ. Ранее мы показа-
Как видно из рис. 6, Hb-ДНКЖ достоверно сни-
ли, что ДНКЖ с глутатионовыми лигандами вос-
жают уровень свободных радикалов, формирую-
станавливают оксоферрильную гемовую группу
щихся в реакциях (4)-(10). Существенное умень-
миоглобина и перехватывают свободные радика-
шение концентрации свободнорадикальных ин-
лы, образующиеся при взаимодействии этого ге-
термедиатов наблюдалось уже при молярном
мопротеида с t-BOOH [26].
соотношении ДНКЖ : t-BOOH ~ 1 : 9 (молярное
Интересно, что нитрозилирование гемоглоби-
соотношение Hb : t-BOOH равно 1 : 4) (рис. 6б).
на по железу гема приводит к еще большему анти-
Можно предположить, что этот эффект обуслов-
оксидантному эффекту (рис. 7). Нитрозилирова-
лен реакциями алкоксильных и алкилпероксиль-
ние гема производили путем добавления донора
ных радикалов с NO-лигандами ДНКЖ [27]. Счи-
тается также, что взаимодействие NO и свобод-
нитроксильного аниона (NO-) - соли Анджели -
ных радикалов липидов приводят к терминации
к раствору метгемоглобина. В этом случае, в от-
цепных реакций перекисного окисления липидов
личие от реакции (2), происходит восстановление
и образованию нитролипидов [27]. В условиях на-
ферроформы гема и образование Hb(II)NO
ших экспериментов оксид азота может высво-
(рис. 7а):
порфирин-Fe(III) + NO- → порфирин-Fe(II)NO.
(11)
После добавления в реакционную систему
(рис. 7б). Можно предположить, что нитрозилге-
гидропероксида трет-бутила и спиновой ловуш-
моглобин восстанавливает t-BOOH, как это было
ки сигнал спинового аддукта DEPMPO не наблю-
показано для нитрозилмиоглобина в работе [15],
дался, в отличие от контрольного образца с рас-
причем при взаимодействии последнего с гидро-
твором метгемоглобина без соли Анджели
пероксидами образуется нитрит и метмиоглобин:
порфирин-Fe(II)-NO + ROOH + H2O → порфирин-Fe(III) + ROH + HNO2 + OH-.
(12)
Вместе с тем подобный механизм взаимодей- для нитрозильных комплексов негемового желе-
ствия с гидропероксидами предлагается и за [11, 17].
БИОФИЗИКА том 66
№ 6
2021
НИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ГЕМОГЛОБИНА
1063
ВЫВОДЫ
2.
О. М. Панасенко, Т. И. Торховская, А. В. Соколов
и др., Успехи биол. химии 60, 75 (2020).
Деструкция ДНКЖ в условиях, моделирую-
3.
P. R. Gardner, Scientifica 2012 (50), 683729 (2012).
щих галогенирующий и нитрозилирующий
стресс, может быть важным элементом регуляции
4.
C. Helms and D. B. Kim-Shapiro, Free Radic. Biol.
метаболизма оксида азота, а также влиять на сиг-
Med. 61, 464 (2013).
нальную функцию этой важнейшей молекулы.
5.
E. Nagababu and J. M. Rifkind, Cell Biochem. Bio-
Кроме того, взаимодействие комплексов NO c ге-
phys. 67 (2), 385 (2013).
моглобином c прооксидантными и антиокси-
6.
E. Faassen and A. F. Vanin, Radicals for Life. The Vari-
дантными системами в системе кровообращения
ous Forms of Nitric Oxide (Elsevier Science, Amster-
требует дальнейшего исследования. Нужно отме-
dam, 2007).
тить, что нарушение функционирования различ-
7.
K. B. Shumaev, A. A. Gubkin, V. A. Serezhenkov, et al.,
ных форм NO играет ключевую роль в развитии
Nitric Oxide 18, 37 (2008).
многих патологий сердечно-сосудистой системы.
8.
K. B. Shumaev, O. V. Kosmachevskaya, A. A. Ti-
Также не исключено, что ДНКЖ предотвращают
moshin, et al., Methods Enzymol. 436, 445 (2008).
модификацию гемоглобина, перехватывая актив-
ные формы азота и галогенов, а также свободные
9.
O. V. Kosmachevskaya, K. B. Shumaev, E. I. Nasybul-
радикалы, образующиеся при распаде органиче-
lina, et al., Clin. Chem. Lab. Med. 52 (1), 161 (2014).
ских гидропероксидов. Действительно, в предше-
10.
О. В. Космачевская, Э. И. Насыбуллина, К. Б. Шу-
ствующих работах нами было установлено, что
маев и др., Прикл. биохим. микробиол. 56 (5), 436
комплексы железа с NO способны ингибировать
(2020).
окислительную модификацию гемоглобина [7, 8,
11.
N. V. Gorbunov, J. C. Yalowich, A. Gaddam, et al., J.
10]. В настоящей работе подтверждаются основ-
Biol. Chem. 272 (19), 12328 (1997).
ные выводы наших предыдущих работ об антиок-
12.
J. C. Yalowich, N. V. Gorbunov, A. V. Kozlov, et al.,
сидантном и антирадикальном действии ком-
Biochemistry 38 (33), 10691 (1999).
плексов NO.
13.
J. Kanner, I. Ben-Gera, and S. Berman, Lipids 15, 944
По мнению авторов, в данной работе новыми
(1980).
являются следующие положения и результаты:
14.
J. Kanner, S. Harel, and R. Granit, Lipids 27 (1), 46
- ДНКЖ эффективно перехватывают свобод-
(1992).
ные радикалы, образующиеся в различных систе-
15.
C. P. Baron, J. S. Mǿller, L. Skibsted, et al., Free Radic.
мах, моделирующих окислительный стресс при
Res. 41, 892 (2007).
некоторых патологиях;
16.
V. E. Kagan, A. V. Kozlov, and Y. Y. Tyurina, Antioxid.
- ДНКЖ являются одним из универсальных
Redox Signal. 3 (2), 189 (2001).
регуляторов свободнорадикальных процессов в
живых системах и в этом качестве обладают зна-
17.
C. Lu and W. H. Koppenol, J. Biol. Inorg. Chem. 10
чительным терапевтическим потенциалом.
(7), 732 (2005).
18.
K. M. Robinson and J. S. Beckman, Methods Enzy-
mol. 396, 207 (2005).
ФИНАНСИРОВАНИЕ РАБОТЫ
19. H. Karoui, N. Hogg, C. Fréjaville, et al., J. Biol. Chem.
Работа выполнена при частичной поддержке
271 (11), 6000 (1996).
Российского фонда фундаментальных исследова-
20. H. Karoui, F. Chalier, J. P. Finet, et al., Org. Biomol.
ний, гранты № 19-015-00444 и 19-29-12052.
Chem. 9 (7), 2473 (2011).
21. K. Stolze, N. Udilova, and H. Nohl, Free Radic. Biol.
КОНФЛИКТ ИНТЕРЕСОВ
Med. 29 (10), 1005 (2000).
Авторы заявляют об отсутствии конфликта
22. K. B. Shumaev, I. V. Gorudko, O. V. Kosmachevskaya,
интересов.
et al., Oxid. Med. Cell Longev. 2019, 2798154 (2019).
23. M. R. Kumar, T. Clover, A. D. Olaitan, et al., Nitric
Oxide 77, 96 (2018).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
24. J. Y. Oh, A. Williams, and R. P. Patel, Arch. Biochem.
Настоящая статья не содержит каких-либо ис-
Biophys. 662, 111 (2019).
следований с участием людей или животных в ка-
25. W. Chen, L. J. Druhan, C. A. Chen, et al., Biochemis-
честве объектов исследований.
try 49 (14), 3129 (2010).
26. К. Б. Шумаев, Н. Э. Петрова, И. В. Заббарова и др.,
СПИСОК ЛИТЕРАТУРЫ
Биохимия 69 (5), 699 (2004).
1. P. Pacher, J. S. Beckman, and L. Liaudet, Physiol. Rev.
27. К. Б. Шумаев, О. В. Космачевская, Д. И. Грачев,
87 (1), 315 (2007).
и др., Биомед. химия 67 (2), 162 (2021).
БИОФИЗИКА том 66
№ 6
2021
1064
ГРАЧEВ и др.
Nitrosyl Hemoglobin Comlexes in Various Model Systems
D.I. Grachev*, **, K.B. Shumaev**, ***, O.V. Kosmachevskaya***,
A.F. Topunov***, and E.K. Ruuge*, **
*Faculty of Physics, Lomonosov Moscow State University, Leninskie Gory 1/2, Moscow, 119991 Russia
**National Medical Research Center for Cardiology, Ministry of Health of the Russian Federation,
3rd Cherepkovskaya ul. 15a, Moscow, 121552 Russia
***Federal Research Center “Fundamentals of Biotechnology”, Russian Academy of Sciences,
Leninsky prosp. 33/2, Moscow, 119071 Russia
Complexes of nitric oxide (NO) with iron from the heme group of hemoglobin (HbNO) and dinitrosyl iron
complexes with thiols, including complexes with hemoglobin cysteine residues (Hb-DNIC), may play an im-
portant role in the processes associated with oxidative, halogenative, and nitrosative stress in the cardiovas-
cular system. In our work, in various model systems, electron paramagnetic resonance spectrum of paramag-
netic NO complexes and DEPMPO spin adducts were used to explore the interaction of these two types of
NO hemoglobin complexes with reactive halogen, oxygen, and nitrogen species, as well as with alkoxyl and
alkyl peroxide radicals. It was shown that hypochlorous acid (sodium hypochlorite) and peroxynitrite quan-
titatively destroy Hb-DNIC. In the presence of sodium dithionite, S-nitrosoglutathione can participate in
heme nitrosylation of deoxyhemoglobin with the formation of Hb(II)NO, but when this system is exposed to
peroxinitrite, dinitrosyl iron complexes are formed. At the same time, Hb(II)NO and Hb-DNIC reduce the
level of organic free radicals produced in the reaction between hemoglobin and tert-butyl hydroperoxide. The
results obtained demonstrate the ability of the nitrosyl hemoglobin complexes under study to intercept reac-
tive oxygen, nitrogen and halogen species and thereby influence the processes of free radical oxidation.
Keywords: oxidative stress, dinitrosyl iron complexes, hemoglobin, antioxidants, electron paramagnetic resonance,
spin traps
БИОФИЗИКА том 66
№ 6
2021