БИОФИЗИКА, 2021, том 66, № 6, с. 1065-1073
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.2.01:(57.052.2+577.322.23+577.322.54)
АНАЛИЗ МОДЕЛЕЙ КООПЕРАТИВНОГО СВЯЗЫВАНИЯ
КИСЛОРОДА ГЕМОГЛОБИНОМ
© 2021 г. И.А. Лавриненко*, Г.А. Вашанов*, В.Ю. Сулин*, Ю.Д. Нечипуренко**
*Воронежский государственный университет, 394018, Воронеж, Университетская площадь, 1
**Институт молекулярной биологии им. В.А. Энгельгардта РАН, 119991, Москва, ул. Вавилова, 32
E-mail: lavrinenko_ia@bio.vsu.ru
Поступила в редакцию 14.05.2021 г.
После доработки 26.07.2021 г.
Принята к публикации 27.07.2021 г.
Дан обзор наиболее известных моделей, описывающих связывание гемоглобина с кислородом.
Предложен подход, позволяющий на основе формальных критериев находить оптимальные мате-
матические и физические модели кооперативного связывания кислорода гемоглобином. При по-
мощи методов регрессионного и кластерного анализа на основе экспериментальных данных диссо-
циации оксигемоглобина проведено сравнение основных моделей оксигенации, несущих в своей
основе степенную и экспоненциальную зависимости. Показано, что модели Эдера, Бернарда и
Хилла, соответствующие степенным функциям, обладают преимуществом в описании связывания
олигомерным белком лиганда по сравнению с моделями, соответствующими экспоненциальным
функциям. Установлено, что последовательная четырехступенчатая модель Кошланда-Немети-
Филмера, которая соответствует уравнению Эдера, наилучшим образом позволяет описать экспе-
риментальные данные.
Ключевые слова: гемоглобин, аллостерический эффект, кооперативность, математическая модель
кооперативного связывания, изотермы адсорбции, связывание белков с лигандами, регрессионный
анализ, кластерный анализ.
DOI: 10.31857/S000630292106003X
гетеротетрамер может управлять базовыми функ-
Гемоглобин - одна из самых исследованных в
циями входящих в его состав мономеров за счет
молекулярной биологии макромолекул. Именно
кооперативных эффектов (см., например, работы
для гемоглобина было предложено А. Хиллом бо-
[9, 10]). Особый интерес в последнее время вызы-
лее ста лет назад знаменитое уравнение, которое
вают альтернативные и дополнительные функ-
описывает кооперативное связывание лигандов с
ции гемоглобина [11]. Однако и само явление ко-
белками [1, 2]. На примере этой молекулы Ж. Мо-
оперативного связывания кислорода гемоглоби-
но развил теорию аллостерических взаимодей-
ном, которое является классическим примером
ствий [3-6], лежащих в основе многих процессов
аллостерических взаимодействий, нельзя считать
регуляции биологической активности макромо-
изученным в должной степени, чтобы могли вы-
лекул. Под аллостерической регуляцией понима-
брать сейчас одну из многих теоретических моде-
ют такой тип регуляции, когда связывание одной
лей его описания. Согласованная работа субъеди-
молекулы лиганда в одном месте белка влияет на
ниц макромолекулы реализуется именно за счет
связывание другой молекулы в другом месте (в
их кооперативного взаимодействия. Высокая
этом смысле аллостерические взаимодействия
функциональная адаптивность гемоглобина к
можно считать частным случаем более общих ко-
условиям среды организма достигается за счет
оперативных эффектов, которые проявляются
тонкой подстройки его элементов, работающих
также и в виде «контактных» взаимодействий
как единое целое [12-14]. Формальное описание
сближенных в пространстве центров связывания
взаимодействия гемоглобина с лигандами не со-
лиганда [7, 8]). До сих пор многие аспекты функ-
ответствует уравнению Михаэлиса-Ментен [15,
ционирования гемоглобина остаются неясными.
16]. Именно благодаря кооперативности возни-
Четыре его каталитически активные субъедини-
кают нелинейные эффекты, описание которых
цы способны связывать различные лиганды. Этот
для такой системы проводится посредством са-
Сокращениe: КДО - кривая диссоциации оксигемогло-
мых разных подходов: концептуальных моделей
бина.
взаимодействия «белок-лиганд», химических ре-
1065
1066
ЛАВРИНЕНКО и др.
мощью глобально аппроксимирующих полино-
мов (массив 2) [26].
Устойчивость решения задачи моделирования
кривой диссоциации оксигемоглобина (КДО)
оценивали по вышеприведенным массивам, а
также по исходным данным (массив 3) [24].
Оптимизация параметров моделей проведена
методом наименьших квадратов [27]. Оценка сте-
пени соответствия модели экспериментальным
данным осуществлена через коэффициент детер-
минации [28]. Формальная классификация объ-
ектов-моделей реализована с помощью кластер-
ного анализа [29].
Необходимые вычисления выполнены в про-
цессоре электронных таблиц MS Excel с модулем
Visual Basic for Applications (VBA).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
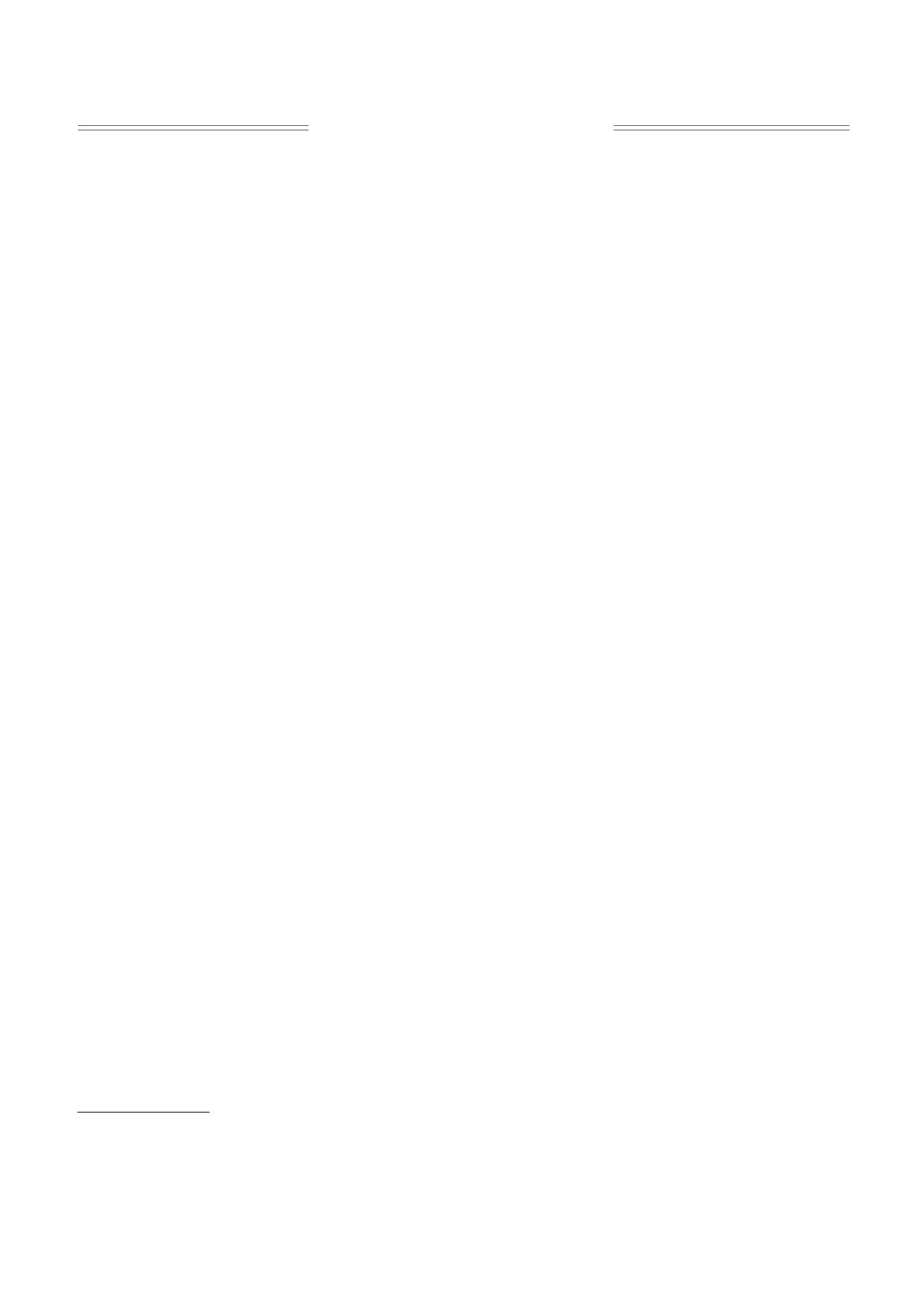
Рис. 1. Экспериментальные точки кривой диссоциа-
Описание (обзор) моделей связывания кислоро-
ции оксигемоглобина (по данным работы [24]).
да гемоглобином. Отправной точкой в хронологии
Hb4(O2)4 - тетрамер молекулы оксигемоглобина,
pO2 - парциальное давление кислорода.
построения математических моделей взаимодей-
ствия гемоглобин-кислород стало уравнение
Гюфнера (1890 г.) [30], описывающее процесс ок-
акций, а также регрессионных моделей. Заметим,
сигенации как химическую реакцию первого по-
что такие подходы в ряде случаев не имеют физи-
рядка:
ческого смысла [17-19]. Существует целый ряд
различных описаний кооперативных эффектов в
Hb+O
⎯⎯→HbO
,
(1)
2
←⎯⎯
2
β
молекуле гемоглобина, однако связь между соот-
ветствующими моделями в настоящий момент не
HbO
kp
p
p
2
y
=
=
=
=
,
(2)
выявлена и критерии, позволяющие выбрать
−1
Hb+HbO
2
1
+
kp k
+
p p
50
+
p
адекватную (или наилучшую) модель не развиты.
Этот вопрос, на наш взгляд, требует специально-
где Hb - дезоксигемоглобин, O2 - кислород,
го изучения (см. работы [20, 21]).
HbO2 - оксигемоглобин, α и β - кинетические
Ранее в работе [22] были предложены крите-
коэффициенты прямой и обратной реакции, y -
рии оценки регрессионных моделей связывания
степень насыщения гемоглобина кислородом, p -
кислорода гемоглобином [23], здесь мы рассмат-
парциальное давление кислорода, k = α/β - кон-
риваем широкий класс моделей, описывающих
станта равновесной реакции, k-1 - обозначаемая
связывание кислорода гемоглобином, и прово-
далее, как p50 - давление кислорода при y = 50%.
дим систематизацию подходов, развитых в этой
Данная модель не способна объяснить S-об-
области.
разный характер КДО и может быть использована
только при расчетах связывания кислорода мио-
глобином или отдельной субъединицей молекулы
МЕТОДЫ ИССЛЕДОВАНИЙ
гемоглобина, а также служить основой при по-
строении уравнений, учитывающих кооператив-
В качестве объектов исследования были ис-
ный эффект.
пользованы модели связывания кислорода гемо-
глобином, анализ которых проводили численны-
Следует также отметить, что уравнения Гюф-
ми методами на основе экспериментальных дан-
нера, Лэнгмюра [31] и Михаэлиса-Ментен [32,
ных, опубликованных в работе [24], как одних из
33] по сути эквиваленты друг другу, так как опи-
наиболее полных и точных известных результатов
сывают сходные физические процессы:
измерений представленной функциональной за-
висимости (рис. 1).
kp
p
k′C
C
[S]
=
=
=
=
,
(3)
1+
kp p
50
+
p
1+
k′C K′+C K
m
+[S]
Для устранения случайных ошибок измерений
эти данные были подвергнуты цифровой обра-
где k - адсорбционная константа, K - констан-
ботке с применением алгоритмов кусочно-поли-
та адсорбционного равновесия (1/k), C - равно-
номиального сглаживания (массив 1) [25] и с по-
весная концентрация адсорбата в уравнении
БИОФИЗИКА том 66
№ 6
2021
АНАЛИЗ МОДЕЛЕЙ КООПЕРАТИВНОГО СВЯЗЫВАНИЯ
1067
Лэнгмюра, [S] - концентрация субстрата и Km -
Рассматриваются альтернативные модели свя-
константа Михаэлиса в одноименном уравнении.
зывания кислорода гемоглобином, базирующие-
ся на постулировании переходного процесса, к
Уравнение Хилла (1910 г.) [1, 2] опирается на
которому неприменим данный закон [37-40].
модель, которая представляет собой молекулу ге-
При этом скорость оксигенации гемопротеида
моглобина в виде полимера, состоящего из h
определяется показательной (экспоненциаль-
субъединиц и связывающего одновременно h мо-
ной) функцией, аргументом (показателем степе-
лекул O2. В этом случае процесс оксигенации рас-
ни) которой является парциальное давление кис-
сматривается как реакция h-го порядка:
лорода.
⎯⎯→
Исходя из этих представлений, И. Высочина
(Hb)
+
hO
(HbO
)
,
(4)
h
2
←⎯⎯
2
h
β
(1963 г.) [37] предложила уравнение следующего
h
h
вида:
h
h
(kp)
p
p
(
p p
50
)
y
=
=
=
=
,(5)
2
3
h
−h
h
h
h
h
(bp)
(bp)
1+
(kp)
k
+
p
p
+
p
1
+
(
p p
)
50
50
y
=
1−
1+
bp
+
+
exp
(−bp)
,
(12)
2
3
где h - константа Хилла.
Г. Эдером (1925 г.) [34] была предложена осно-
где b - переменный кинетический коэффициент.
ванная на гипотезе промежуточного насыщения
Опираясь в своей основе на уравнение Гюфне-
гемоглобина кислородом модель, в которой свя-
ра и предполагая, что константа связывания ли-
зывание лиганда осуществляется последователь-
ганда является функцией степени деформации
но в четыре этапа:
макромолекулы белка, экспоненциально завися-
α
1
щей от pO2, П. Подрабинек и П. Каменский
Hb
+
O
⎯⎯
⎯→Hb
O
,
(6)
4
2
←⎯
⎯
⎯
4
2
β
1
(1968 г.) [38] представили свою модель:
α
2
αpexp(λp)
Hb
O
+
O
⎯⎯
⎯→Hb
(O
)
,
(7)
4
2
2
←⎯
⎯
⎯
4
2
2
y
=
,
(13)
β
2
1+αpexp(λp)
α
3
Hb
O
+
O
⎯⎯
⎯→Hb
O
,
(8)
4
(
2
)
2
2
←⎯
⎯
⎯
4
(
2
)
3
где α и λ - постоянные положительные кинетиче-
β
3
ские коэффициенты, а k = αexp(λp) - константа
α
4
равновесия реакции.
Hb
O
+
O
⎯⎯
⎯→Hb
O
,
(9)
4
(
2
)
3
2
←⎯
⎯
⎯
4
(
2
)
4
β
4
Этот подход сродни подходу Ч. Тенфорда [41],
2
3
4
на основе которого рассматриваются модели ад-
a
p
+
2
a
p
+
3
a
p
+
4a
p
1
2
3
4
y
=
,
(10)
сорбции свободных лигандов на молекуле нукле-
2
3
4
4
(
1+
a
1
p
+
a
2
p
+
a
3
p
+
a
4
p
)
иновой кислоты с ее частично заполненными
центрами связывания этих лигандов.
где a1 = k1, a2 = k1k2, a3 = k1k2k3, a4 = k1k2k3k4 -
Уравнение, представленное Ю. Кисляковым
коэффициенты Эдера, ki = αi/βi (i = 1, 2, 3 и 4) -
(1975 г.) [39], выглядит следующим образом:
константы равновесия реакций, Hb4 - тетрамер
1
гемоглобина.
bp
b
y
=
1−
exp
−
,
(14)
Основываясь на гипотезе Ваймана-Аллена
(
)
10
[35], предполагающей одновременное присоеди-
где b - кинетический коэффициент, равный a0 +
нение двух молекул кислорода к молекуле гем-
белка, С. Бернард (1960 г.) [36] предложил урав-
+ a1z + a2z2, a0, a1, a2 - постоянные кинетические
нение оксигенации вида:
коэффициенты.
2
4
Функция, предложенная М. Ханиным с соав-
0.5a
(
p p
50
)
+
(
p p
50
)
y
=
,
(11)
торами (1978 г.) [40], аналогична предыдущим и
2
4
1
+
a
(
p p
50
)
+
(
p p
50
)
имеет следующий вид:
где a - некоторый постоянный кинетический ко-
y =1+δ
exp(−δ
p
),
(15)
1
2
эффициент. Данная модель в принципе является
комбинированным вариантом уравнений Хилла
где δ1 и δ2 - постоянные кинетические коэффи-
и Эдера.
циенты.
Основой для отмеченных (и родственных с ни-
Анализ моделей кооперативного связывания
ми) математических уравнений служит представ-
кислорода гемоглобином. Можно оценить точ-
ление о взаимодействии лигандов с белком в рам-
ность аппроксимации экспериментальной кри-
ках закона действующих масс как обобщенной
вой диссоциации оксигемоглобина математиче-
химической модели, опирающейся на степенную
скими функциями, имеющими в той или иной
функцию n-го порядка.
степени физический смысл, где в качестве крите-
БИОФИЗИКА том 66
№ 6
2021
1068
ЛАВРИНЕНКО и др.
рия соответствия выступает коэффициент детер-
минации (R2).
Так как экспериментальные данные практиче-
ски всегда содержат определенную долю случай-
ных ошибок, которые в принципе могут каче-
ственно изменить трактовку результатов экспе-
римента, нами была выполнена двухступенчатая
фильтрация исходных значений КДО.
На первом этапе были устранены так называе-
мые «выбросы точек». Невязка в более чем 1% меж-
ду исходным единичными экспериментальными
точками кривой и ее аппроксимацией неоднород-
ными рациональными B-сплайнами третьего по-
рядка исключала эти точки из дальнейшей обработ-
ки [42-44]. Таких точек было всего две из 65. Следу-
ющий шаг включал в себя сглаживание кусочно-
полиномиальным фильтром Савицкого-Голея тре-
тьего порядка. Этот фильтр является развитием ме-
тода скользящего среднего, что делает его простым,
доступным и популярным инструментом при реше-
нии ряда аналогичных задач [45, 46]. Полученные
после цифровой фильтрации данные были пере-
дискретизированы к равномерному шагу сетки в
0.5 мм рт. ст. в диапазоне парциального давления O2
0-622.5 мм рт. ст. с суммарным количеством точек
1246 (массив 1).
Ранжирование функций выполнено по степе-
ни убывания значения величины R2 (табл. 1). Как
следует из представленных данных, в списке ап-
проксимаций с существенным отрывом лидиру-
ют функции, несущие в своей основе степенную
зависимость, за ожидаемым исключением урав-
нения Гюфнера, являющегося базовой моделью.
Близость величин R2 для моделей Эдера, Бер-
нарда и Хилла в совокупности с общностью в
представлении ими процесса оксигенации может
косвенно указывать на характер присоединения
кислорода гемоглобином, а именно на его сту-
пенчатость, обусловленную структурными пере-
стройками макромолекулы белка при связыва-
нии ею лигандов в ходе равновесных реакций.
При этом используемый в построении альтер-
нативных моделей подход, основанный на экспо-
ненциальной зависимости, в совокупности с раз-
бросом значений коэффициента детерминации в
группе уравнений 4-7 (табл. 1) также, на наш
взгляд, опосредованно (методом исключения)
это подтверждает.
С целью формализованного соотнесения рас-
сматриваемых аппроксимирующих функций к
тому или иному типу физических (и соответ-
ственно математических) моделей нами была
проведена классификация данных объектов по
критерию R2 методом кластерного анализа по
принципу «ближайшего соседа», где дистанция
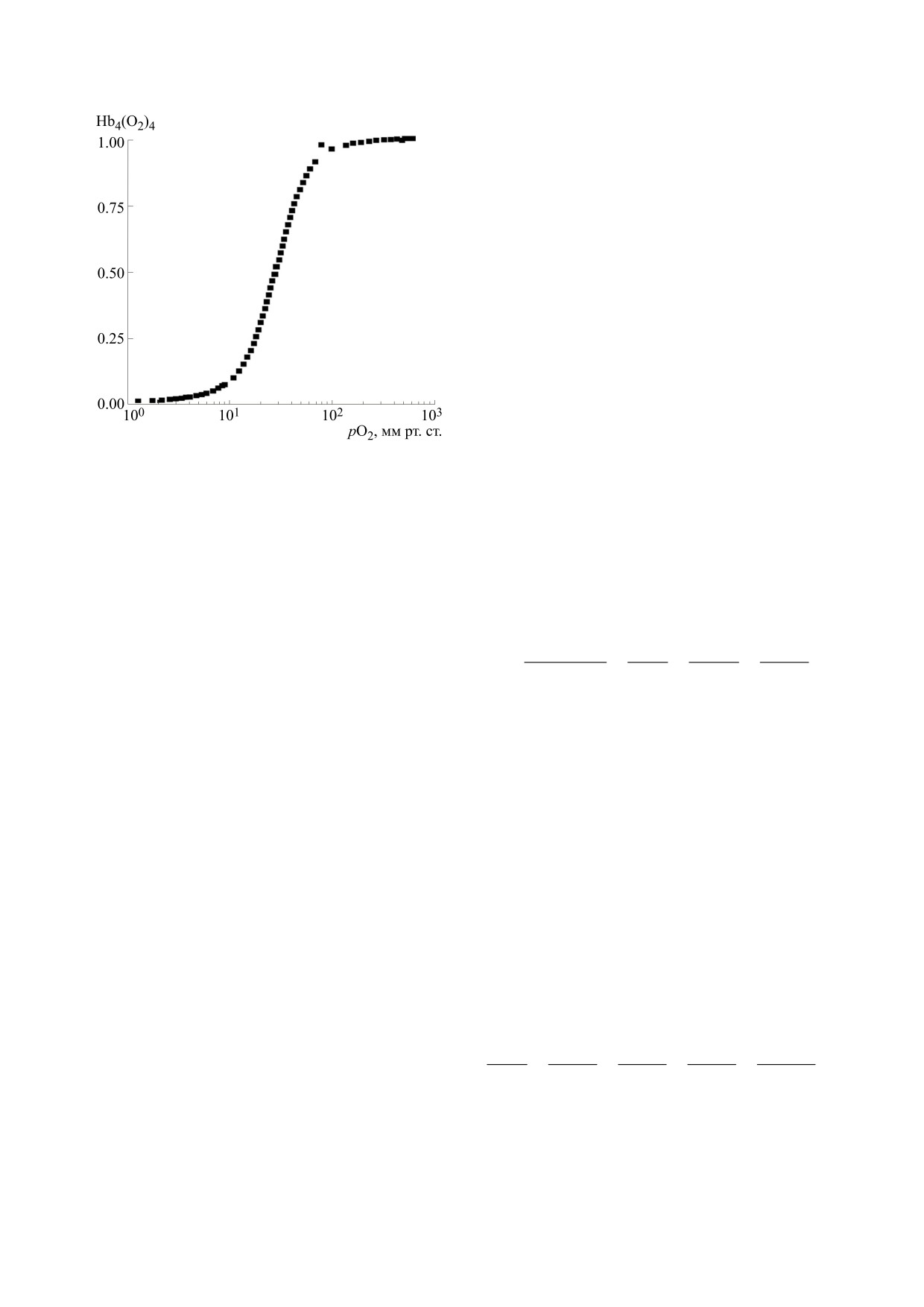
Рис. 2. Дендрограмма (матрица расстояний) распре-
между объектами определялась через обычную
деления некоторых моделей кривой диссоциации
евклидову метрику (рис. 2а). Следует также отме-
оксигемоглобина для массивов 1 (а), 2 (б) и 3 (в).
БИОФИЗИКА том 66
№ 6
2021
АНАЛИЗ МОДЕЛЕЙ КООПЕРАТИВНОГО СВЯЗЫВАНИЯ
1069
Таблица 1. Аппроксимирующие КДО функции, имеющие физический смысл (данные по массиву 1)
№
Модель (уравнение)
R2, ppm
Число констант
1
Модель Эдера
999686
4
2
Модель Бернарда
999623
2
3
Модель Хилла
999386
2
4
Модель Кислякова
996808
1
5
Модель Подрабинека-Каменского
996529
2
6
Модель Ханина
984591
2
7
Модель Высочиной
978350
1
8
Модель Гюфнера
920640
1
Примечание - здесь и далее в таблицах значения R2 приведены в миллионных долях (ppm).
тить, что анализ на основе «дальнего соседа»
Небольшая дистанция (279 точек) между объ-
принципиально не меняет картину дендрограм-
ектами-уравнениями 4 и 5 показывает на их общ-
мы, т.е. качество кластеризации при использова-
ность в части содержания в них экспоненциаль-
нии данных методов присоединения кластер-
ной составляющей, но не на высокую степень со-
объектов не страдает.
ответствия экспериментальным данным.
Нами были последовательно рассмотрены
Подкластер с дистанцией между объектами в
особенности группировки в кластеры исследуе-
237 точек представляет собой семейство степен-
мых математических моделей, исходя из характе-
ных моделей: Эдера, Бернарда и Хилла, что уси-
ра их аналитического представления по мере
ливает версию о процессах связывания лигандов
уменьшения дистанции между объектами.
как химической реакции n-го порядка.
Исходно на дистанции 57710 точек наблюдает-
Тогда возможно ассоциировать эти математи-
ся дихотомия между группами моделей 1-7 и
ческие аппроксимации с физическими моделями:
группой 8 (табл. 1), состоящей всего из одного
уравнение Эдера может быть связано с моделью
объекта (уравнение Гюфнера). И хотя известно,
Кошланда-Немети-Филмера [47], так как рас-
что данная модель не может описать кооператив-
сматривает последовательное присоединение ли-
ность процесса оксигенации, кластерный анализ
гандов (асимметричная модель), уравнение Бер-
наглядно и математически формально это под-
нарда (гибридное решение) - модель Ваймана-Ал-
тверждает (рис. 2а).
лена [48], а уравнение Хилла - модель Моно-
Уаймена-Шанжё (симметричная модель) [3].
Уменьшение дистанции до 11938 точек пока-
зывает разделение оставшихся моделей на два
Кластер из этих объектов распадается на два
подкластера (листья кластера). Кластер с рассто-
подкластера: уравнение Эдера и Бернарда (с ди-
янием между объектами в 6241 точку представля-
станцией между объектами 63 точки) и уравнение
ет собой уравнения Ханина и Высочиной. Сход-
Хилла. Уравнение Хилла проигрывает остальным
ство этих аппроксимаций обусловлено составля-
по значению R2. Аппроксимация Бернарда вхо-
ющей уравнения вида: aexp(-bp), где a и b -
дит в один кластер с аппроксимацией Эдера, что
кинетические коэффициенты, а p - парциальное
означает их сходство в описании по состояниям
давление кислорода.
последовательности присоединения лиганда. Так
Другой кластер (2578 точек) содержит в себе
как значение R2 для уравнения Эдера максималь-
модели 1-5 (табл. 1). Близость данных объектов
но из рассмотренных зависимостей, то на основа-
формально указывает на большую эффектив-
нии формального подхода преимуществом в опи-
ность применения степенных уравнений в описа-
сании связывания лигандов макромолекулой бу-
нии процесса оксигенации. Так, уравнение Кис-
дет обладать модель Кошланда-Немети-
лякова, несмотря на свою экспоненциальную
Филмера с математической проекцией в виде
уравнения Эдера.
природу, имеет показатель степени вида b-1, а мо-
дель Подрабинека-Каменского, как уже отмеча-
В следующем варианте эксперимента исход-
лось, построена на соотношении вида: kpn/(1 +
ные данные были непосредственно аппроксими-
kpn), где n = exp(λp).
рованы полиномом вида:
БИОФИЗИКА том 66
№ 6
2021
1070
ЛАВРИНЕНКО и др.
Таблица 2. Аппроксимирующие КДО функции, имеющие физический смысл (данные по массиву 2)
№
Модель (уравнение)
R2, ppm
Число констант
1
Модель Эдера
999548
4
2
Модель Бернарда
999340
2
3
Модель Хилла
999251
2
4
Модель Подрабинека-Каменского
997615
2
5
Модель Кислякова
997154
1
6
Модель Ханина
983770
2
7
Модель Высочиной
980454
1
8
Модель Гюфнера
915478
1
2
3
4
нию, является формальным подтверждением
a+ b
1
ln
p+ b
2
(ln
p)
+
b
3
(ln
p)
+
b
4
(ln
p)
y
=
,(16)
адекватности выбранного аппроксимирующего
2
3
4
1+
c
1
ln
p
+
c
2
(ln
p)
+
c
3
(ln
p)
+
c
4
(ln
p)
полинома. Увеличение степени полинома от 4 и
выше повышает, естественно, величину R2, одна-
где a, b1-4 и c1-4 - некоторые коэффициенты, а
ко в таком случае он приближается к интерполи-
p (>0) - парциальное давление кислорода. Этот
рующему полиному, аналогично, например, выс-
подход позволяет, на наш взгляд, оценить влия-
шим полиномам Фурье и Чебышёва [49].
ние как промахов эксперимента типа «выброс
точки», так и систематической ошибки аппрок-
Полученные численные значения, аналогич-
ные предыдущему эксперименту, также были пе-
симации на устойчивость решения задачи чис-
редискретизированы к равномерному шагу сетки
ленного моделирования. Полином был подобран
таким образом, чтобы не вносить значимых пре-
в 0.5 мм рт. ст. с общим количеством точек 1246
имуществ в пользу уравнений Эдера, Бернарда
(массив 2), что позволяет сопоставлять результа-
или Хилла относительно оставшихся моделей, и
ты вычислений R2 от массивов 1 и 2.
включал в себя как степенные, так и логарифми-
Как следует из представленных данных
ческие преобразования. Коэффициент детерми-
(табл. 2), наличие операции логарифмирования в
нации для него составил 999918 ppm, что выше,
составе полинома ожидаемо приводит к некото-
чем для любой из представленных регрессионных
моделей. Это обстоятельство, по нашему мне- рому уменьшению значений R2 относительно
Таблица 3. Аппроксимирующие КДО функции, имеющие физический смысл (данные по массиву 3)
№
Модель (уравнение)
R2, ppm
Число констант
1
Модель Эдера
999545
4
2
Модель Бернарда
999489
2
3
Модель Хилла
999303
2
4
Модель Подрабинека-Каменского
998690
2
5
Модель Кислякова
997430
1
6
Модель Высочиной
980780
1
7
Модель Ханина
976261
2
8
Модель Гюфнера
946291
1
БИОФИЗИКА том 66
№ 6
2021
АНАЛИЗ МОДЕЛЕЙ КООПЕРАТИВНОГО СВЯЗЫВАНИЯ
1071
предыдущих результатов для степенных уравне-
описании моделью Подрабинека-Каменского
ний и повышению для уравнений, несущих в сво-
кинетики связывания кислорода гем-белком от-
ей основе экспоненциальную функцию (табл. 1),
носительно моделей Эдера, Бернарда и Хилла,
за исключением регрессионной модели Ханина.
что уже было отмечено ранее.
Однако это практически не влияет на ранжирова-
Для степенных моделей структура кластера,
ние исследуемых регрессионных моделей. Изме-
расположение его листьев, пропорции и абсо-
нения произошли только в позициях 4 и 5 (табл. 1
лютные дистанции между объектами аналогичны
и 2). В текущем случае уравнение Подрабинека-
предыдущим исследованиям (рис. 2а,б). Следует
Каменского имеет более высокий коэффициент
отметить, что значения величин расстояний меж-
детерминации относительно уравнения Кисля-
ду объектами Эдера, Бернарда (56 точек), а также
кова. При этом дендрограмма распределения мо-
Эдера, Бернарда против Хилла (186 точек) в по-
делей КДО также не претерпевает структурных
следнем эксперименте меньше, чем для предше-
изменений (рис. 2б).
ствующих оценок: (63/89 точек) и (237/208 точек)
Следовательно, выбор кусочно-полиномиаль-
соответственно. Это обусловлено, вероятно, раз-
ного сглаживания или глобально аппроксимиру-
личием в количестве точек сравнения: 1246 точек
ющих полиномов в данном случае не меняет об-
(массив 1 и 2) против 65 (массив 3). В таком слу-
щей картины рейтинга функций и характера их
чае дистанция размерностью 613 точек для преды-
кластеризации в дендрограммах, что делает вер-
дущих экспериментов, если бы для них в объект-
сию о последовательном присоединении лиган-
модель Подрабинека-Каменского входил кла-
дов наиболее вероятной.
стер степенных моделей, могла бы быть еще более
высокой.
Вместе с тем в этих исследованиях в качестве
эталонных значений КДО были использованы
данные, прошедшие цифровую обработку, кото-
ЗАКЛЮЧЕНИЕ
рая в принципе могла внести артефакты преобра-
Опираясь на результаты исследований, пока-
зований, изменить значения коэффициентов де-
зано, что последовательная четырехступенчатая
терминации, а также расстановку объектов в кла-
модель связывания олигомерным белком лиганда
стере.
(т.е. модель Кошланда-Немети-Филмера) наи-
В связи с этим в последующем эксперименте
лучшим образом подходит для аппроксимации
были использованы исходные данные «как есть»
экспериментальных данных связывания гемогло-
(массив 3). Это также позволяет оценить устойчи-
бином кислорода.
вость предлагаемого алгоритма анализа для дан-
Предложенный в работе подход в оценке эф-
ных, содержащих случайные ошибки, и по воз-
фективности аппроксимации КДО может быть
можности отказаться от дополнительных матема-
использован также и для решения сходных по
тических преобразований.
своей постановке задач, т.е. тестирования мате-
Результаты исследования представлены в виде
матических моделей, имеющих физический
рейтинга аппроксимирующих функций (табл. 3).
смысл. В конечном итоге это позволяет, на наш
В представленном списке уравнения Высочиной
взгляд, повысить эффективность поиска наибо-
и Ханина поменялись местами, что в принципе не
лее перспективных вариантов в разработке совре-
меняет общей картины расстановок, вполне
менных молекулярных моделей, а также верифи-
предсказуемо из анализа результатов предыду-
кации существующих в исследуемой области
щих экспериментов и подтверждает коррект-
шаблонов, моделей и схем. Заметим, что анализ
ность наших оценок.
кооперативного связывания биологически ак-
По этим данным был выполнен кластерный
тивных соединений с нуклеиновыми кислотами
анализ (рис. 2в). Как следует из представленных
[6] также может проводиться подобным образом.
результатов эксперимента, структура дендро-
Модели, развитые в этой области, в значительной
граммы практически не претерпела изменений.
степени перекрываются с моделями, описанны-
На дистанции 1260 точек формируются два кла-
ми выше [50, 51]. Базовыми математическими по-
стера: объекты 1-4 (табл. 3) и объект 5 (уравнение
строениями в описании связывания лигандов
Кислякова). Относительно предыдущих исследо-
биополимерами здесь являются уравнения
ваний (массивы 1 и 2): в данном случае наблюда-
Г. Скетчарда [52], позволяющие рассчитать ход
ется переход модели Подрабинека-Каменского
изотермы адсорбции, уравнения Р. Сипса [53],
из кластера, содержащего модель Кислякова, в
где описывается гетерогенное связывание лиган-
кластер степенных моделей (Эдера, Бернарда и
дов, а также результаты теоретических исследова-
Хилла). Однако дистанция между кластером, со-
ний Ч. Тенфорда [41], Т. Хилла [54], С. Собера
держащим степенные модели, и текущим объек-
[55], Д. Крозерса [56], в которых сформулирован
том достаточно высока (613 точек). Это обстоя-
подход, позволяющий описывать адсорбцию
тельство указывает, прежде всего, как на фактор
лигандов на линейных полимерах. Следует отме-
случайной ошибки, так и некоторую близость в
тить в этой области исследований работы
БИОФИЗИКА том 66
№ 6
2021
1072
ЛАВРИНЕНКО и др.
А. Заседателева с соавторами [57-63], а также
11.
О. В. Космачевская, А. Ф. Топунов, Биохимия 84,
Ландо и Тейфа с соавторами [64-66], в которых
3 (2019). DOI: 10.1134/S0320972519010019
развит современный подход к описанию коопе-
12.
G. K. Ackers and J. M. Holt, J. Biol. Chem. 281, 11441
(2006). DOI: 10.1074/jbc.R500019200
ративного связывания протяженных лигандов на
линейных матрицах нуклеиновых кислот.
13.
N. B. Terwilliger, J. Exp. Biol. 201, 1085 (1998).
14.
A. Szabo, Proc. Nat. Acad. Sci. USA 75, 2108 (1978).
Использованный в данной работе способ
DOI: 10.1073/pnas.75.5.2108
оценки эффективности аппроксимации КДО, на
15.
R. T. K. Ariyawansha, B. F. A. Basnayake, A. K. Ka-
наш взгляд, может быть использован также и для
runarathna, et al., Sci. Rep. 8, 16586 (2018). DOI:
решения сходных по своей постановке задач ме-
10.1038/s41598-018-34675-2
дико-биологического, химического, а также фар-
16.
W. J. Deal, Biopolymers 12,
2057
(1973). DOI:
мацевтического профиля.
10.1002/bip.1973.360120912
17.
O. Siggaard-Andersen, P. D. Wimberley, I. Göthgen,
et al., Clin Chem.
30,
1646
(1984).
DOI:
БЛАГОДАРНОСТИ
10.1093/clinchem/30.10.1646
Авторы считают своим приятным долгом вы-
18.
W. Eaton, E. Henry, J. Hofrichter, et al., Nat. Struct.
Mol. Biol. 6, 351 (1999). DOI: 10.1038/7586
разить благодарность Н.Г. Есиповой, Г.Ю. Риз-
ниченко и А.Ф. Топунову за ценные замечания.
19.
M. Sharan, M. P. Singh, and A. Aminataei, BioSyste-
ms.
22,
249
(1989).
DOI:
10.1016/0303-
2647(89)90066-x
ФИНАНСИРОВАНИЕ РАБОТЫ
20.
J. Otsuka and T. Kunisawa, Adv. Biophys. 11, 53 (1978).
21.
W. G. Gutheil, Biophys. Chem. 241, 38 (2018). DOI:
Работа выполнена при финансовой поддержке
10.1016/j.bpc.2018.07.008
Программы фундаментальных исследований го-
22.
И. А. Лавриненко, Г. А. Вашанов и В. Г. Артюхов,
сударственных академий наук на 2013-2020 годы
Актуальные вопросы биологической физики и хи-
(темы № 01201363818 и № 01201363820).
мии 1, 232 (2016).
23.
Ю. А. Власов и С. М. Смирнов, От молекулы гемо-
глобина — к системе микроциркуляции (Наука, Но-
КОНФЛИКТ ИНТЕРЕСОВ
восибирск, 1993).
Авторы заявляют об отсутствии конфликта
24.
R. M. Winslow, M. Swenberg, R. L. Berger, et al., J. Bi-
интересов.
ol. Chem. 252, 2331 (1977). DOI: 10.1016/S0021-
9258(17)40559-X
25.
N. D. Dikusar, Matem. Mod. 27 (9), 89 (2015).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
26.
А. А. Амосов, Ю. А. Дубинский и Н. В. Копченова,
Вычислительные методы для инженеров (Высш.
Настоящая статья не содержит каких-либо ис-
шк., М., 1994).
следований с участием людей или животных в ка-
27.
F. M. Dekking, C. Kraaikamp, H. P. Lopuhaä, et al., A
честве объектов исследований.
Modern Introduction to Probability and Statistics: Under-
standing Why and How (Springer-Verlag, London,
2005). DOI: 10.1007/1-84628-168-7
СПИСОК ЛИТЕРАТУРЫ
28. M. H. Katz, Multivariable Analysis: A Practical Guide
1. A. V. Hill, J. Physiol. 40, i (1910).
for Clinicians and Public Health Researchers (Cam-
2. W. E. L. Brown and A. V. Hill, Proc. Roy. Soc. Biol. 94,
bridge University Press, Cambridge,
2011). DOI:
297 (1923). DOI: 10.1098/rspb.1923.0006
10.1017/CBO9780511974175
3. J. Monod, J. Wyman, and J. P. Changeux, J. Mol. Biol.
29. L. Kaufman and P. J. Rousseeuw, Finding Groups in Da-
12, 88 (1965). DOI: 10.1016/s0022-2836(65)80285-6
ta: An Introduction to Cluster Analysis (John Wiley &
Sons, Hoboken, New Jersey,
2005).
DOI:
4. M. F. Perutz, Mechanisms of cooperativity and allosteric
10.1002/9780470316801
regulation in proteins (Cambridge University Press,
Cambridge - New York, 1990).
30. G. Hüfner, Arch. ges. Physiol. 31, 28 (1890).
5. А. А. Болдырев, Биохимия. 57, 1433 (1992).
31. I. Langmuir, J. Am. Chem. Soc. 38, 2267 (1916).
6. Ю. Д. Нечипуренко, Анализ связывания биологиче-
32. L. Michaelis and M. L. Menten, Biochem. Z. 49, 333
ски активных соединений с нуклеиновыми кислота-
(1913).
ми (Ин-т компл. исслед. (ИКИ), М.-Ижевск,
33. K. A. Johnson and R. S. Goody, Biochemistry. 50,
2015).
8264 (2011). DOI: 10.1021/bi201284u
7. D. Whitford, Proteins: structure and function (John Wi-
34. G. S. Adair, A. V. Bock, and H. Jr. Field, J. Biol. Chem.
ley & Sons, Chichester, 2005).
63, 529 (1925).
8. H. Abeliovich, Biophys. J.
89,
76
(2005) DOI:
35. J. Wyman and D. W. Allen, J. Polymer Sci. 7, 499
10.1529/biophysj.105.060194
(1951). DOI: 10.1002/pol.1951.120070506
9. M. H. Ahmed, M. S. Ghatge, and M. K. Safo, Subcell.
36. S. R. Bernard, Bull. Math. Biophys. 22, 391 (1960).
Biochem. 94, 345 (2020). DOI: 10.1007/978-3-030-
DOI: 10.1007/BF02476722
41769-7_14
37. И. В. Высочина, Биофизика 8, 361 (1963).
10. H. A. Saroff, J. Phys. Chem. 76, 1597 (1972). DOI:
38. П. А. Подрабенек и И. И. Каменский, Молекуляр.
10.1021/j100655a020
биология 2, 120 (1968).
БИОФИЗИКА том 66
№ 6
2021
АНАЛИЗ МОДЕЛЕЙ КООПЕРАТИВНОГО СВЯЗЫВАНИЯ
1073
39. Ю. А. Кисляков, Математическое моделирование
51. А. Б. Рубин, Биофизика (Наука, М., 2004).
кровообращения и газообмена в мозгу (Наука, Ле-
52. G. Scatchard, Ann. N.Y. Acad. Sci. 15, 660 (1949).
нингр. отд-ние, Л., 1975).
53. R. Sips, J. Chem. Phys. 16, 490 (1948).
40. М. А. Ханин, Н. Л. Дорфман, И. Б. Бухаров и др.,
54. T.L. Hill, J. Polymer Sci. 23,
549
(1957). DOI:
Экстремальные принципы в биологии и физиологии
10.1002/pol.1957.1202310403
(Наука, М., 1978).
55. S. A. Latt and L. H. Sober, Biochemistry 6, 3293
41. Ч. Тенфорд, Физическая химия полимеров (Химия,
(1967). DOI: 10.1021/bi00862a040
М., 1975).
56. D. Crothers, Biopolymers
6,
575
(1968). DOI:
42. C. T. Kelley, Iterative Methods for Linear and Nonlinear
10.1002/bip.1968.360060411
Equations (Society for Industrial and Applied Mathe-
57. А. С. Заседателев, Г. В. Гурский и М. В. Волькен-
matics (SIAM), Philadelphia,
1995).
DOI:
штейн, Молекуляр. биология 5, 245 (1971).
10.1137/1.9781611970944
58. Г. В. Гурский, А. С. Заседателев и М. В. Волькен-
43. J. H. Ahlberg, E. N. Nilson, and J. L. Walsh, The The-
штейн, Молекуляр. биология 6, 479 (1972).
ory of Splines and Their Applications (Academic Press,
59. G. V. Gursky and A. S. Zasedatelev, Sov. Sci. Rev. D.
New York - London, 1967).
Physicochem. Biol. 5, 53 (1984).
44. L. Piegl, Computer-Aided Design 21, 509 (1989). DOI:
60. Ю. Д. Нечипуренко, А. С. Заседателев и Г. В. Гур-
10.1016/0010-4485(89)90059-6
ский, Биофизика 24, 351 (1979).
45. A. Savitzky and M. J. E. Golay, Anal. Chem. 36, 1627
61. Ю. Д. Нечипуренко, А. С. Заседателев и Г. В. Гур-
(1964). DOI: 10.1021/ac60214a047
ский, Молекуляр. биология 18, 798 (1984).
46. A. Gorry, Anal. Chem.
62,
570
(1990). DOI:
62. Yu. D. Nechipurenko and G. V. Gursky, Bioph. Chem.
10.1021/ac00205a007
24, 195 (1986). DOI: 10.1016/0301-4622(86)85025-6
47. D. E. Jr. Koshland, G. Némethy, and D. Filmer, Bio-
63. Ю. Д. Нечипуренко и Г. В. Гурский, Биофизика
chemistry 5, 365 (1966). DOI: 10.1021/bi00865a047
48, 773 (2003).
48. J. Jr. Wyman and D. W. Allen, J. Polym. Sci. 7, 499
64. D. Y. Lando and V. B. Teif, J. Biomol. Struct. Dyn. 17,
(1951). DOI: 10.1002/pol.1951.120070506
903 (2000). DOI: 10.1080/07391102.2000.10506578
49. В. К. Дзядык, Введение в теорию равномерного при-
65. В. Б. Тейф, Д. Ю. Ландо, Молекуляр. биология 35,
ближения функций полиномами (Наука, М., 1977).
117 (2001).
50. Ч. Кантор и П. Шиммел, Биофизическая химия
66. V. B. Teif, K. Rippe, Brief Bioinform. 13, 187 (2012).
(Мир, М., 1984).
DOI: 10.1093/bib/bbr03.
Analysis of Models of Cooperative Oxygen Binding by Hemoglobin
I.A. Lavrinenko*, G.A. Vashanov*, V.Yu. Sulin*, and Yu.D. Nechipurenko**
*Voronezh State University, Universitetskaya pl. 1, Voronezh, 394018 Russia
**Engelhardt Institute of Molecular Biology, Russian Academy of Sciences, ul. Vavilova 32, Moscow, 119991 Russia
This paper presents an overview of the most well-known models which describe the binding of oxygen to he-
moglobin. This study attempts to provide a formal criteria-based approach that can be used to find optimal
mathematical and physical models of cooperative oxygen binding by hemoglobin. Using the methods of re-
gression and cluster analysis based on experimental data of oxyhemoglobin dissociation, the main models of
oxygenation, which are based on power and exponential dependencies, are compared. It is shown that the
models proposed by Eder, Bernard, and Hill which correspond to power-law models are more accurate for
describing ligand binding by an oligomeric protein than exponential models. It is established that the sequen-
tial four-stage Koshland-Nemeti-Filmer model, which corresponds to the Eder equation, is the most accu-
rate model for describing the experimental data.
Keywords: hemoglobin, allosteric effects, cooperative binding, binding curve, protein-ligand binding, isotherm of
adsorption, mathematical model, , regression analysis, cluster analysis
БИОФИЗИКА том 66
№ 6
2021