БИОФИЗИКА, 2021, том 66, № 6, с. 1217-1222
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.3
КАТИОН НИТРОЗОНИЯ КАК КОМПОНЕНТ ДИНИТРОЗИЛЬНЫХ
КОМПЛЕКСОВ ЖЕЛЕЗА,
ОПРЕДЕЛЯЮЩИЙ ИХ ПРОТИВООПУХОЛЕВЫЙ ЭФФЕКТ
© 2021 г. А.Ф. Ванин*, **, Л.А. Островская***, Д.Б. Корман***, Н.В. Блюхтерова***,
В.А. Рыкова***, М.М. Фомина***
*Федеральный исследовательский центр химической физики им. Н.Н. Семёнова РАН, 119991, Москва, ул. Косыгина, 4
**Институт регенеративной медицины Первого Московского государственного медицинского университета
имени И.М. Сеченова Минздрава России, 119991, Москва, ул.Трубецкая, 8/2
***Институт биохимической физики им. Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
Е mail: larros@list.ru
Поступила в редакцию 05.08.2021 г.
После доработки 16.09.2021 г.
Принята к публикации 17.09.2021 г.
Исследована противоопухолевая эффективность сочетанного применения экзогенного донора ци-
тотоксических катионов нитрозония, биядерных динитрозильных комплексов железа с глутатио-
ном и диэтилдитиокарбамата натрия на модели карциномы легких Льюис мышей. Установлено, что
торможение роста опухоли под влиянием динитрозильных комплексов железа (2 мкМ/кг, внутри-
венно), диэтилдитиокарбамата натрия (250 мкМ/кг, внутрибрюшинно) и при их совместном при-
менении составило 48, 76 и 57% соответственно. Предполагается, что этот эффект обусловлен спо-
собностью диэтилдитиокарбамата натрия разрушать в опухолях эндогенные динитрозильные ком-
плексы железа с высвобождением из них катионов нитрозония, что и приводило к некоторому
усилению противоопухолевого действия препаратов при их совместном применении.
Ключевые слова: биядерный динитрозильный комплекс железа с глутатионом, диэтилдитиокарбамат
натрия, противоопухолевая активность in vivo, карцинома легких Льюис мышей.
DOI: 10.31857/S0006302921060181
[1-8]. Показан также определенный цитотокси-
Ранее нами было обнаружено, что генерирую-
ческий эффект некоторых из комплексов Б-ДН-
щие оксид азота моно- и биядеpные формы ди-
КЖ в отношении клеток опухоли человека (куль-
нитрозильныx комплексов железа с различными
тура МСF7) [8, 9].
тиолсодержащими лигандами (М- и Б-ДНКЖ,
формулы их основных резонансных структур соот-
В принципе противоопухолевое и цитотокси-
ческое действие ДНКЖ с тиолсодержащими ли-
ветственно ([RS-)2Fe2+(NO, NO+)] и
[(RS-)2Fe2+2-
гандами может определяться их способностью
(NO+)2(NO)2]) обладают способностью задержи-
высвобождать при распаде как нейтральные мо-
вать развитие ряда cолидных опуxолей мышей
лекулы NO, так и катионы нитрозония (NO+)
(каpцинома легкиx Льюиc, аденокарциномы Ака-
[10].
тол и Са-755). Противоопухолевый эффект изу-
Нейтральные молекулы NO, связываясь с
ченных препаратов проявлялся при их введении
ионами супероксида, продуцируют анионы пе-
как внутрибрюшинно (в/б), так и внутривенно
роксинитрита, продукты распада протонирован-
(в/в) и колебался в пределах от 60 до 90% тормо-
ной формы которых - гидроксильные радикалы
жения роста опухоли, изменяясь в зависимости
и диоксид азота - оказывают токсическое дей-
от дозового режима, схемы применения, времени
ствие на клетки и ткани.
оценки эффекта и природы опухолевого штамма
Катионы нитрозония NO+ могут оказывать
цитотоксическое действие, благодаря способно-
Сокращения: М- и Б-ДНКЖ - моно- и биядерные фоpмы
динитрозильныx комплексов железа, в/б - внутрибрю- сти инициировать S-нитрозирование тиолсодер-
шинное введение, в/в - внутривенное введение, ДЭТК -
жащих белков, нарушающее нормальное функ-
диэтилдитиокарбамат натрия, Б-ДНКЖ-GSH - биядер-
ные динитрозильные комплексы железа с глутатионом,
ционирование этих белков, что и приводит к не-
GS-NO - S-нитрозоглутатион.
гативным для клеток и тканей последствиям.
1217
1218
ВАНИН и др.
Выяснение вопроса о том, какой из указанных
котемпературной сублимации жидкой смеси этих
компонентов ДНКЖ - молекулы оксида азота
газов в вакуумированной системе [8, 9].
NO или катионы нитрозония NO+ - может ока-
Синтез Б-ДНКЖ-GSH проводили согласно
зывать решающее цитотоксическое действие на
описанному ранее «простейшему» методу синтеза
опухолевые клетки, требует специальных иссле-
ДНКЖ с тиолсодержащими лиганадами [8, 9, 12].
дований.
В соответствии с этим методом синтез 5 мМ рас-
Как было показано в работах [9, 11], ответить на
твора ДНКЖ с глутатионом проходил следую-
этот вопрос можно, проводя изучение влияния про-
щим образом. К 10 мл дистиллированной воды на
изводных дитиокарбамата, в частности диэтилди-
воздухе добавляли 62 мг глутатиона (20 мМ), вы-
тиокарбамата (ДЭТК, формула [C2H5)2=N-CS2]),
зывавшего подкисление раствора до рН 4.0, с по-
следующим введением в него 28 мг (10 мМ) сер-
на цитотоксическое действие ДНКЖ.
нокислого железа, приводившего к дальнейшему
При контакте с биядерными динитрозильны-
снижению рН до 3.8. После этого в раствор добав-
ми комплексами железа с глутатионом (Б-
ляли 6.9 мг (10 мМ) нитрита натрия, что приводи-
ДНКЖ-GSH) ДЭТК перехватывает на себя из
ло к розовому окрашиванию раствора, обуслов-
железо-динитрозильной группы комплекса желе-
ленного образованием S-нитрозоглутатиона (GS-
зо-мононитрозильный фрагмент с образованием
NO). Судя по интенсивности оптического погло-
устойчивых ЭПР-регистрируемых мононитро-
щения на 334 нм, характерного для GS-NO, реак-
зильных комплексов железа с ДЭТК, практиче-
ция заканчивалась через 1.5 ч с образованием
ски не высвобождающих нейтральные молекулы
10 мМ этого соединения. После этого рН раство-
NO. Что касается судьбы второго нитрозильного
ра повышали до 7.2, что приводило к оранжевому
лиганда в железо-динитрозильной группе - он
окрашиванию раствора, обусловленному начав-
высвобождается в форме катиона нитрозония
шимся процессом образования Б-ДНКЖ-GSH в
NO+, связывающегося с тиолами различного
растворе при участии GS-NO, Fe2+ и глутатиона
происхождения с образованием соответствую-
[12]. Для полного превращения GS-NO в Б-
щих S-нитрозотиолов, что и может определять
ДНКЖ-GSH требовалось несколько часов. По-
цитотоксическое действие ДНКЖ с тиолсодер-
сле удаления образовавшегося за это время осад-
жащими лигандами в присутствии ДЭТК.
ка гидроокиси трехвалентного железа путем
Именно таким путем было показано, что цито-
фильтрования раствора через фильтровальную
токсическое действие Б-ДНКЖ-GSH или Б-
бумагу полученный раствор замораживали в жид-
ДНКЖ с меркаптосукцинатом на опухолевые
ком азоте и использовали (после разморажива-
клетки MCF7 [8, 9], а также цитотоксическое дей-
ния) в экспериментах на животных. Оценку полу-
ствие Б-ДНКЖ-GSH на бактерии Escherichia coli
ченного количества Б-ДНКЖ-GSH (мол. масса
[11] определяется способностью этих комплексов
846 Да) проводили оптическим методом по ин-
выступать в качестве доноров катиона нитрозо-
тенсивности характерных для этого комплекса
полос поглощения на 310 и 360 нм, характеризую-
ния NO+.
щихся коэффициентами экстинкции ε, равными
Задача предпринятого нами исследования со-
соответственно 9200 и 7400 М-1см-1 [9]. Соглас-
стояла в исследовании роли катионов нитрозо-
но этой оценке концентрация Б-ДНКЖ-GSH в
ния NO+ (c использованием вышеописанного
растворе составляла ∼2.5 мМ (или 5 мМ в пере-
подхода) в реализации противоопухолевого эф-
счете на один атом железа в комплексе).
фекта Б-ДНКЖ-GSH в условиях in vivo. С этой
целью проведено изучение противоопухолевой
Противоопухолевая активность in vivo. Экспе-
эффективности сочетанного применения Б-
рименты проведены на 50 инбредных мышах ли-
ДНКЖ-GSH и ДЭТК на модели карциномы лег-
нии BDF1
- гибридах первого поколения
ких Льюис.
f
1(C57Bl/6 × DBA2), самках с массой тела 18-20 г,
разведения питомника
«Филиал
«Столбовая»
НЦБМТ ФМБА России». В качестве опухолевой
МАТЕРИАЛЫ И МЕТОДЫ
тест-системы служила солидная опухоль мышей -
Препараты. В экспериментах использовали
карцинома легких Льюис, перевиваемая подкож-
конвенциальный препарат диэтилкарбамата на-
но в соответствии со стандартной методикой [13].
трия (Sigma, США), ферросульфат железа (Fe-
Препараты Б-ДНКЖ-GSH вводили живот-
SO4⋅7H2O) (Fluka, Швейцария), восстановлен-
ным в виде водных растворов пятикратно в/в (в
ный глутатион и нитрит натрия (Sigma, США).
хвостовую вену мышей) на первые, четвертые,
Газообразный NO получали в реакции ферро-
седьмые, десятые и тринадцатые сутки после пе-
сульфата железа с нитритом натрия в 0.1 М рас-
ревивки опухоли в суточной дозе 2 мкМ/кг. Рас-
творе HCl с последующим разделением NO и
творы ДЭТК вводили в суточной дозе 50 мг/кг в/б
примесного диоксида азота (NO2) методом низ-
через один час после введения Б-ДНКЖ-GSH.
БИОФИЗИКА том 66
№ 6
2021
КАТИОН НИТРОЗОНИЯ КАК КОМПОНЕНТ
1219
числяли в соответствии с формулой для эллипсо-
ида как V = ab2/2, где a - длина, b - ширина и вы-
сота опухолевого узла. При оценке массы опухо-
ли использовали величину плотности опухолевой
ткани, равную 1 г/см3 [13].
Каждая группа животных, получавших тера-
певтическое воздействие, состояла из шести-
восьми мышей при 8-10 животных в контроле.
Наблюдение за животными продолжалось в тече-
ние всего периода развития опухоли, вплоть до
гибели животных.
Статистическая обработка данных проведена
путем оценки размеров опухолей (массы опухо-
лей) у контрольных и леченых животных с ис-
пользованием пакета компьютерных программ
Statistica 6.0.
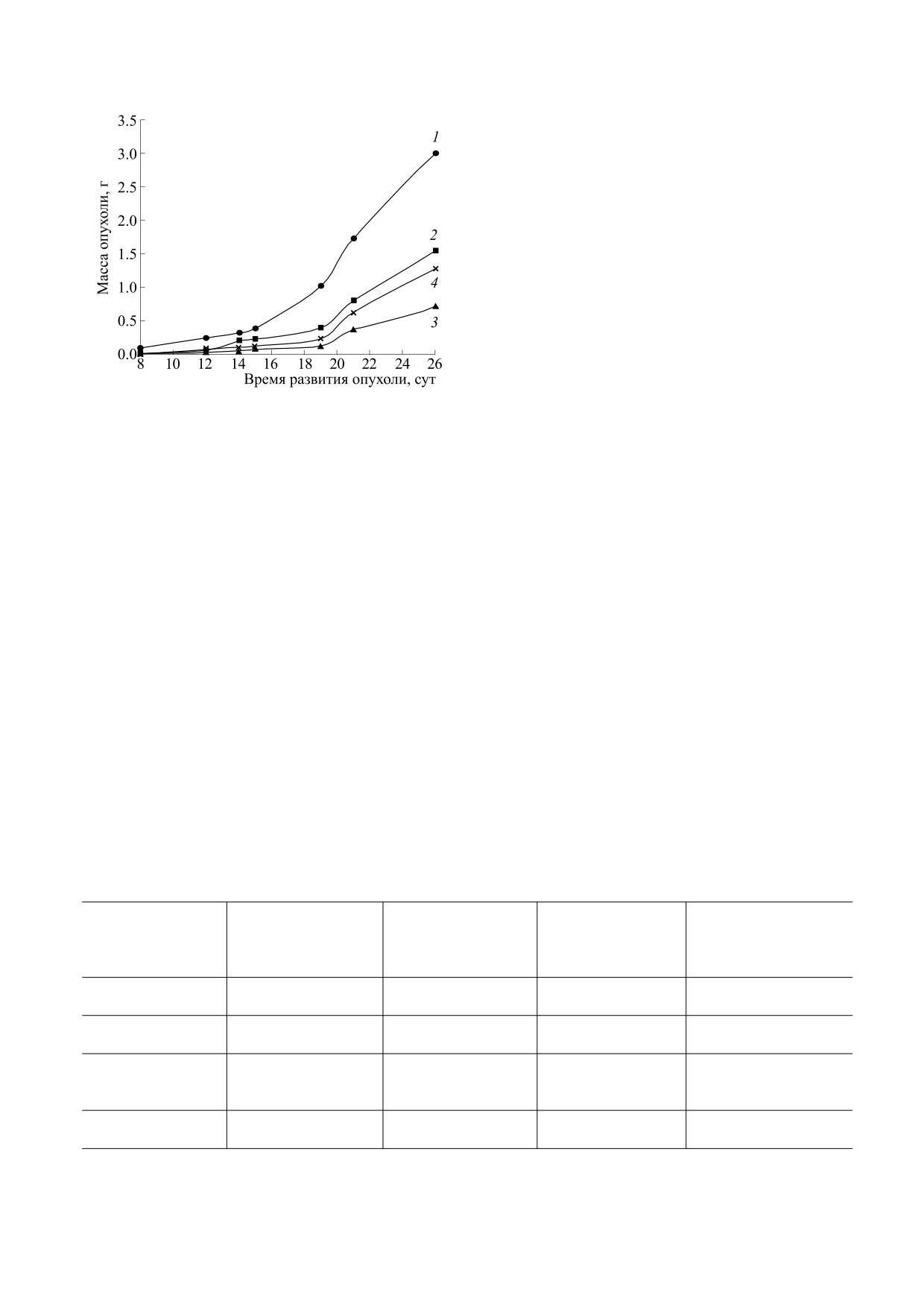
РЕЗУЛЬТАТЫ
Влияние сочетанного применения Б-ДНКЖ и ДЭТК
на кинетику развития карциномы легких Льюис: 1 -
Влияние Б-ДНКЖ-GSH и ДЭТК на развитие
контроль; 2 - Б-ДНКЖ, 2 мкМ/ кг, в/в; 3 - ДЭТК,
карциномы легких Льюис при отдельном и соче-
50 мг/кг (250 мкМ/кг), в/б; 4 - ДНКЖ, 2 мкМ/кг,
танном введении мышам характеризуют данные,
в/в + ДЭТК, 50 мг/кг, в/б с интервалом в 1 ч. Введе-
представленные на рисунке и в таблице.
ние препаратов пятикратно на первые, четвертые,
Как видно, Б-ДНКЖ-GSH при пятикратном
седьмые, десятые и тринадцатые сутки после пере-
(на первые, четвертые, седьмые, десятые и трина-
вивки опухоли.
дцатые сутки после перевивки опухоли) введе-
нии, в/в, в суточной дозе 2 мкМ/кг вызывал
50%-е торможение роста по сравнению с контро-
Оценка противоопухолевой активности пре-
лем. ДТЭК, введенный пятикратно, в/б, в суточ-
паратов проведена при сопоставлении кинетики
ной дозе 50 мг/кг, вызывал торможение роста
роста опухолей в группах контрольных и леченых
опухоли почти на 80% по сравнению с контролем.
животных. Показателем ростингибирующего эф-
Эффект совместного применения Б-ДНКЖ-
фекта препарата служил коэффициент торможе-
GSH и ДЭТК (через один час после введения
ния роста опухоли (ТРО, %), который определял-
Б-ДНКЖ-GSH) соответствовал 60%-му ингиби-
ся из соотношения: ТРО = (РС - РТ)/РС, где РС и
рованию опухолевого роста по сравнению с кон-
РТ - объем (или масса) опухоли в группах кон-
тролем (рисунок, таблица).
трольных и леченых животных соответственно.
Таким образом, сочетанное применение
Для изучения кинетики роста опухолей проводи-
ДЭТК и Б-ДНКЖ в условиях наших опытов при-
ли измерение двух взаимно перпендикулярных
водило лишь к незначительному повышению
размеров опухолевого узла на протяжении всего
противоопухолевого эффекта Б-ДНКЖ (с 50 до
периода развития опухолей. Объем опухоли вы-
60%). При этом введение одного ДЭТК оказалось
Влияние сочетанного применения ДНКЖ и ДЭТК на развитие карциномы легких Льюис
Коэффициент
Время оценки
Средняя масса
Препарат
Доза
торможения роста
эффекта, сут
опухоли, г
опухоли (ТРО, %)
ДНКЖ
2 мкМ/ кг в/в
26
1.55 ± 0.1
48
ДЭТК
50 мг/кг в/б
26
0.72 ± 0.2
76
2 мкМ/ кг в/в +
ДНКЖ + ДЭТК
26
1.28 ± 0.3
57
+ 50 мг/кг в/б
Контроль
-
26
3.00 ± 0.3
-
БИОФИЗИКА том 66
№ 6
2021
1220
ВАНИН и др.
наиболее эффективным (80%) по сравнению с
ет только одно - в организме животных сохра-
влиянием других воздействий. Во всех этих слу-
нялся клон опухолевых клеток, устойчивых к
чаях подавление роста опухоли наблюдалось в те-
действию Б-ДНКЖ-GSH, как самих по себе, так
чение недели после окончания введения живот-
и полностью распадающихся под действием
ным указанных агентов (тринадцатые сутки по-
ДЭТК. Такими клетками могли оказаться злока-
сле перевивки опухоли), после чего начинался
чественные клетки с делецией гена апоптоза, так
постепенный рост опухоли.
что было бы интересно проверить, не приведет ли
последующее введение животным Б-ДНКЖ-
ОБСУЖДЕНИЕ
GSH, особенно в присутствии ДЭТК, к гибели и
этих клеток. Тем самым будет получен ответ на
Прежде чем перейти к обсуждению получен-
вопрос, способны ли цитотоксические компо-
ных результатов, следует отметить существенное
ненты ДНКЖ - катионы нитрозония - полно-
различие в концентрации Б-ДНКЖ-GSH, при
стью подавлять пролиферацию злокачественных
котором достигалось подавление роста опухоли
опухолей.
на начальной его стадии в экспериментах, прово-
Такого рода эксперимент можно было бы про-
дившихся in vivo (на мышах) в настоящей работе,
вести, исходя из обнаруженного в настоящей ра-
а также в наших предыдущих исследованиях [5-
боте факта противоопухолевого действия ДЭТК
8], с одной стороны, и в экспериментах in vitro,
на развитие опухоли in vivo при в/б введении мы-
проводившихся нами на культуре опухолевых
шам только одного этого агента (кривая 3 на ри-
клеток MCF7, с другой стороны [8, 9].
сунке).
В экспериментах in vivo рост карциномы Лью-
ис полностью блокировался на несколько недель
Дело в том, что факт временного совпадения
при пятикратном в/в введении Б-ДНКЖ-GSH в
противоопухолевых эффектов Б-ДНКЖ-GSH и
дозе 2 мкМ/кг, тогда как 50%-я гибель клеток в
Б-ДНКЖ-GSH + ДЭТК, с одной стороны, и
культуре (в экспериментах in vitro) достигалась
ДЭТК, с другой стороны (кривые 2-4 на рисунке)
при концентрации Б-ДНКЖ-GSH более 2 мМ.
дает основание предполагать, что при действии
Очевидно, что это различие было обусловлено
на животных только одного ДЭТК его цитотокси-
влиянием на противоопухолевое действие Б-ДН-
ческое действие, так же как при введении и Б-
КЖ-GSH функционирующей в организме мы-
ДНКЖ-GSH, и Б-ДНКЖ-GSH + ДЭТК, обу-
шей иммунной системы - иммунокомпетентных
словлено катионами нитрозония.
клеток, опосредовавших действие Б-ДНКЖ-
Последнее, естественно, должно было бы
GSH на развитие перевиваемой опухоли. Эти
обеспечиваться появлением в опухолях динитро-
клетки, поглощая вводившиеся комплексы, обес-
зильныx комплексов железа эндогенного проис-
печивали их концентрированное, избирательное
хождения. О том, что такое вполне возможно,
поступление в опухоль, чем и достигалось инги-
свидетельствуют зарегистрированные многими
бирующее действие Б-ДНКЖ-GSH на опухоль в
исследователями [16-19], в том числе и нами в
сравнительно низких дозах.
опытах с карциномой Льюис [2], факты обнару-
Предположение о том, что иммунокомпетент-
жения в образцах злокачественных опухолей сиг-
ные клетки способны эффективно поглощать
налов ЭПР нитрозильных комплексов гемопро-
ДНКЖ с тиолсодержащими лигандами, основы-
теинов. Появление последних свидетельствует об
вается на результатах исследования польских уче-
усиленной генерации оксида азота иммунноком-
ных, продемонстрировавших включение ДНКЖ
петентными клетками как реакции организма на
в макрофаги RAW 264,7 [14]. Что касается переда-
появление у мышей злокачественных клеток.
чи ДНКЖ в опухолевые клетки, этот эффект был
В работе американских исследователей [20]
продемонстрирован французскими исследовате-
было показано, что при появлении NO в клетках
лями, обнаружившими накопление этих ком-
макрофагов в них в первую очередь формируются
плексов при сокультивировании клеток лейкоза
ДНКЖ с тиолсодержащими лигандами, как пара-
L1210 с макрофагами мышей, генерировавших
магнитные (ЭПР-регистрируемые, М-ДНКЖ),
ДНКЖ после их обработки бактериальными ли-
так и диамагнитные (ЭПР-нерегистрируемые, Б-
пополисахаридами [15].
ДНКЖ). Из макрофагов эти комплексы могут пе-
Встает вопрос, почему примерно через неделю
реходить в опухолевые клетки, в которых они
после окончания в/в введения мышам Б-ДНКЖ-
способны прочно связываться с экспрессируемой
GSH, как в отсутствие, так и при дополнительном
в присутствии NO глутатион-S-трансферазой [21,
введении животным ДЭТК, начинался рост опу-
22]. Это связывание стабилизирует динитрозиль-
холи? Ответ на этот вопрос очевиден: это означа-
ные комплексы железа, предотвращая их распад и
БИОФИЗИКА том 66
№ 6
2021
КАТИОН НИТРОЗОНИЯ КАК КОМПОНЕНТ
1221
тем самым высвобождение из этих комплексов
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
катионов нитрозония NO+, способных вызывать
Все применимые международные, националь-
гибель опухолевых клеток. Такой распад могли
ные и институциональные принципы ухода и ис-
пользования животных при выполнении работы
инициировать молекулы ДЭТК, образующие, как
были соблюдены.
об этом мы говорили во введении, прочно связан-
ные мононитрозильные комплексы железа с
ДЭТК, с одновременным высвобождением из
СПИСОК ЛИТЕРАТУРЫ
ДНКЖ катионов нитрозония NO+.
1. А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
Биофизика 59, 508 (2014).
Таким образом, если в предполагаемых экспе-
2. А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
Биофизика 60, 152 (2015).
риментах при повторной серии введения ДЭТК
3. А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
мышам-опухоленосителям (например, на девят-
Биофизика 60, 1157 (2015).
надцатые-двадцатые сутки после перевивки опу-
4. A. F. Vanin, L. A. Ostrovskaya, and D. B. Korman,
холи, как это следует из данных, представленных
Austin J. Reprod. Medicine & Infertility 2, 1109 (2015)
рисунке) окажется, что рост опухоли будет забло-
5. А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
кирован, это будет означать, что сохранившиеся
Биофизика 62, 591 (2017).
после первой серии введения мышам ДЭТК клет-
6. А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
ки, в действительности, чувствительны к губи-
Биофизика 64 (6), 1216 (2019).
тельному действию на них катионов нитрозония
7. А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
Биофизика 65 (1), 1 (2020)
NO+. Исходя из этого, можно ожидать, что при
8. А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
таких последовательно повторяющихся сериях
Биофизика 65 (5), 1009 (2020).
введения ДЭТК мышам-опухоленосителям, по-
9. A. F. Vanin, V. A. Tronov, and R. R. Borodulin, Cell
лучившим ранее Б-ДНКЖ-GSH, опухоль может
Biochem. Biophys. 79 (1), 93 (2021)
быть полностью ликвидирована.
10. A. F. Vanin, Dinitrosyl Iron Complexes as a “Working
Form”of Nitric Oxide in Living Оrganisms (Cambridge
Это ожидание подкрепляется еще и специфи-
Scholars Publishing, Cambridge, UK, 2019).
ческим характером апоптотических процессов,
11. A. F. Vanin, D. I. Telegina, V. D. Mikoyan, and
S. V. Vasilieva, Cell Biochem. Biophys. (2021), in
вызываемых в клетках ДНКЖ с тиолсодержащи-
press.
ми лигандами. Как следует из работы российских
12. R. R. Borodulin, L. N. Kubrina, V. O. Shvydkiy, et al.,
и немецких исследователей [23], один из предста-
Nitric Oxide Biol. Chem. 35, 110 (2013).
вителей таких комплексов - М-ДНКЖ с тиосуль-
13. Е. М. Трещалина, О. С. Жукова, Г. К. Герасимова
фатом - инициировал в клетках лейкоза человека
и др., в кн. Руководство по проведению доклиниче-
(линия Jurkat) апоптоз по непонятному пока ме-
ских исследований лекарственных средств. Часть
первая, под ред. А. Н. Миронова и др. («Гриф и К»,
ханизму. Инициированный этим комплексом
М., гл. 39 (2012), сс. 642-657.
апоптоз не подавлялся ни антиапоптотическим
14. H. Lewandowska, T. M. Stepkowski, S. Meszynska-
белком Bcl-2, ни ингибиторами каспазы-3, -6 или
Wielgosz, et al. J. Inorg. Biochem. 188, 29 (2018)
-8. Такое подавление характерно, как известно,
15. J. C. Drapier, C. Pellat, and Y. Henry, J. Biol. Chem.
для большинства индукторов апоптоза.
266, 10162 (1991).
16. N. M. Emanuel, A. N. Saprin, V. A. Shabalkin, et al.,
В заключение отметим, что обнаруженный в
Nature 222, 165 (1969).
данной работе факт сохранения и даже некоторо-
17. T. Maruyama, N. Kataoka, S. Nagase, et al., Cancer
го повышения противоопухолевой активности Б-
Res. 31, 179 (1971)
ДНКЖ-GSH при совместном применении с ДТ-
18. N. R. Bastian, C. Y. Yim, J. B. Hibbs, et al., J. Biol.
ЭК, являющимся «ловушкой» для молекул NO,
Chem. 269, 5127 (1994)
можно рассматривать как свидетельство того, что
19. M. C. R. Symons and I. J. Rowland, Free Rad. Res.
Comms. 21, 197 (1994)
эффект ингибирования роста опухоли обуслов-
20. J. R. Hickok, S. Sahni, H. Shen, et al., Free Rad. Biol.
лен присутствием катионов нитрозония (NO+).
Med. 51, 1559 (2011)
21. H. C. Lok, Y. S. Rahmanto, C. L. Hawkins, et al., J.
Biol. Chem. 287, 507 (2012)
КОНФЛИКТ ИНТЕРЕСОВ
22. H. C. Lok, S. Sahni, P.J. Jansson, et al., J. Biol. Chem.
291, 27042 (2016)
Авторы заявляют об отсутствии конфликта
23. A. L. Kleschyov, S. Strand, S. Schmitt, et al., Free Rad.
интересов.
Biol. Med. 40, 1340 (2006).
БИОФИЗИКА том 66
№ 6
2021
1222
ВАНИН и др.
Nitrosonium Cation as a Component of Dinitrosyl Iron Complexes Acts
as an Inducer of the Antitumor Effect
A.F Vanin*, **, L.A. Ostrovskaya***, D.B. Korman***, N.V. Bluhterova***,
V.A. Rykova***, and M.M. Fomina***
*Semenov Federal Research Center of Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119991 Russia
**Institute of Regenerative Medicine, Sechenov First Moscow State Medical University, Ministry of Health of the Russian
Federation, Trubetskaya ul. 8/2, Moscow, 119991 Russia
***Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
In this study, we explored the antitumor efficacy of combined use of an exogenous donor of cytotoxic nitro-
sonium cations of biuclear dinitrosyl iron complexes with glutathione and sodium diethyldithiocarbamate in
a mouse model with Lewis lung carcinoma cell lines. It was found that the inhibitory effect of dinitrosyl iron
complex (2 μM/kg, i/v), sodium diethyldithiocarbamate (250 μM/kg, i/p) and their combination on tumor
growth was 48%, 76% and 57%, respectively. These results suggest that the inhibitory effect was observed due
to the ability of sodium diethyldithiocarbamate to decompose endogenous dinitrosyl iron complexes in tu-
mors leading to a release of nitrosonium cations from these complexes, thereby enhancing to some extent the
antitumor effect of drugs when they were given together.
Keywords: binuclear dinitrosyl iron complexes with glutathione, sodium diethyldithiocarbamate, in vivo antitumor
activity, murine Lewis lung carcinoma
БИОФИЗИКА том 66
№ 6
2021