БИОФИЗИКА, 2022, том 67, № 1, с. 5-13
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.32; 57.03
К МЕХАНИЗМУ АКТИВАЦИИ КИСЛОРОДА
В ХИМИЧЕСКИХ И БИОЛОГИЧЕСКИХ СИСТЕМАХ
© 2022 г. Т.В. Сирота, Н.П. Сирота
Институт теоретической и экспериментальной биофизики РАН,
142290, Пущино Московской области, ул. Институтская, 3
E-mail: sirotatv@rambler.ru
Поступила в редакцию 18.10.2021 г.
После доработки 18.10.2021 г.
Принята к публикации 27.10.2021 г.
Показано, что при активации кислорода в модельных химических и биологических системах, свя-
занных с образованием супероксидных анион-радикалов (О●─), происходит снижение содержания
молекулярного кислорода в буфере. Рассмотрены следующие химические и ферментативные реак-
ции: автоокисление адреналина в щелочной среде, система феназинметасульфат/НАДН, а также
ксантин-ксантиноксидазная реакция. В процессе химического превращения субстрата в каждой из
этих реакций наблюдалось потребление О2 из буфера, что приводило к созданию временных гипо-
ксических условий. Анион-радикалы О●─ идентифицировались с помощью нитросинего тетразо-
лия и супероксиддисмутазы. Впервые было установлено образование О●─ в реакции глюкоза-глю-
козооксидаза, которую не называют супероксидгенерирующей. Каталаза в исследуемых реакциях
выявляла пероксид водорода - продукт диспропорционирования О●─, и в буфере появлялся моле-
кулярный кислород. Таким образом, показаны следующие превращения кислорода в исследуемых
реакциях: О2 → О●─ → Н2О2 → О2, которые могут происходить и во внутриклеточных системах при
участии соответствующих оксидоредуктаз и антиоксидантных ферментов.
Ключевые слова: супероксид, пероксид водорода, полярография, адреналин, феназинметасуль-
фат/НАДН, ксантин-ксантиноксидаза, глюкоза-глюкозооксидаза, супероксиддисмутаза, каталаза.
DOI: 10.31857/S000630292201001X
зывают состояние окислительного стресса, вос-
В семействе активных форм кислорода су-
паление и развитие патологии [4-6]. В клетке
пероксид анион-радикалам (О●─) принадлежит
необходим баланс между генерацией активных
особая роль, поскольку это и есть первоначально
форм кислорода и активностью антиоксидантной
образующийся активированный кислород, кото-
защиты. Эти процессы регулируются на молеку-
рый отличается от молекулярного кислорода,
лярно-генетическом уровне путем экспрессии ге-
присутствующего в воздухе или растворенного в
нов и последующего синтеза соответствующих
воде и биологических жидкостях. В биологиче-
антиоксидантных белков. Баланс на метаболиче-
ских системах на клеточном уровне супероксид
ском уровне поддерживается также и низкомоле-
анионы рассматривались ранее исключительно
кулярными соединениями с антиоксидантными
как токсичные субстанции [1-4]. В настоящее
свойствами (аскорбаты, ураты и др.). Процесс об-
время установлено, что в определенных концен-
разования активных форм кислорода сопряжен с
трациях О●─ являются необходимыми компо-
происходящими в клетке окислительно-восста-
нентами процесса жизнедеятельности клетки и
новительными реакциями, которые и обеспечи-
выполняют важнейшие функции в организме -
вают окислительно-восстановительный гомео-
могут быть праймирующими соединениями, сиг-
стаз. «Редокс-состояние» клетки, ткани или орга-
нальными молекулами, запускающими каскад
на в целом - современный термин. Возниклo
биохимических и, как следствие, физиологиче-
целое научное направление, изучающее эти
процессы [10], где важная роль принадлежит
ских процессов [3-9]. Избыток О●─ и недоста-
исследованиям сигнальных путей, а именно
точность системы антиоксидантной защиты вы-
редокс-чувствительной сигнальной системe
Nrf2/Keap1/ARE, участвующей в регуляции про-
Сокращения: СОД - супероксиддисмутаза, НСТ - нитро-
синий тетразолий, ФМС - феназинметасульфат, PBS -
лиферации, дифференцировке и апоптозе клеток
калий-фосфатный буфер.
(аутофагии) [4-10]. Изучение механизма переда-
5
6
Т.В. СИРОТА, Н.П. СИРОТА
чи сигнала и роль антиоксидантов в этих процес-
фотометрических методах измерения активности
сах - актуальная проблема, поэтому важно знать,
фермента [12-15]. Мы использовали следующие
что же происходит при активации молекулярного
модельные супероксидгенерирующие системы:
кислорода. В настоящей работе, используя мо-
реакцию автоокисления адреналина в щелочной
дельные химические и ферментативные реакции,
среде [11, 12, 16-19], систему феназинметасуль-
мы показали переход молекулярного кислорода в
фат/НАДН (ФМС/НАДН) [13] и ксантин-ксан-
метаболически активное состояние: образование
тиноксидазную реакцию [14]. Такой же экспери-
супероксида и последующие его превращения.
мент был проведен и с ферментативной реакцией
глюкоза-глюкозооксидаза, которую, однако, не
Основной путь активации молекулярного кис-
называют супероксидгенерирующей, обычно она
лорода - одноэлектронное восстановление (урав-
используется как источник Н2О2 [20]. Но по-
нение 1):
скольку пероксид водорода - это продукт реак-
О2 + e- → О●─.
(1)
ции дисмутации, образующийся из
●─, вероят-
«Поставщиками» электронов являются хими-
но и в этой оксидазной реакции должен первона-
ческие и ферментативные реакции, так называе-
чально создаваться супероксид анион. Однако
мые супероксидгенерирующие системы, в кото-
такие данные в литературе не обнаружены. Ис-
рых в процессе превращения субстрата образую-
пользуя определенный подход, мы впервые иден-
щиеся электроны могут поступать на
тифицировали О●─ и в этой реакции.
растворенный в среде кислород, создавая О● ─.
МАТЕРИАЛЫ И МЕТОДЫ
Таким путем, как показано в нашей работе [11],
Полярография. Эксперименты проводили на
могут возникать и другие радикальные соедине-
полярографической установке с закрытым плати-
ния - карбонатные анион-радикалы (СО●─) и
новым электродом Кларка в термостатированной
радикалы диоксида углерода (СО●─). В организ-
кювете объемом 1 мл с фиксированной скоро-
ме активация кислорода происходит с участием
стью перемешивания. Cистема автоматической
ферментов оксидоредуктаз: электроны в основ-
регистрации потребления кислорода (АЦП и
ном поставляют электрон-транспортная цепь ми-
программное обеспечение) была разработана
тохондрий и мембранные НАД(Р)Н-оксидазы
В.А. Шлектаревым (ИТЭБ РАН) и В.С. Семено-
вым (ИБК РАН) [21]. Условия каждой модельной
[4]. Уровень О●─ в клетке контролируется фер-
реакции, описанные в литературе для спектрофо-
ментом супероксиддисмутазой (СОД), которая в
тометрических методов, были воспроизведены в
результате реакции диспропорционирования
полярографической кювете с некоторой коррек-
(дисмутации) превращает О● в пероксид водоро-
цией (например, температура, концентрации ве-
да (Н2О2), (уравнение 2), являясь, таким образом,
ществ и др.), что указано в подписях к рисункам.
первичным звеном антиоксидантной защиты:
Автоокисление адреналина. Реакцию автоокис-
-
-
+
ления адреналина в щелочном карбонатном бу-
O
+
O
+
2H
⎯⎯⎯→H
O
+
O
(2)
2
2
2
2
2
фере осуществляли по протоколу, разработанно-
Цель настоящего исследования - эксперимен-
му нами ранее [22]. Использовали 0.2 М карбо-
тально показать «судьбу» молекулярного кисло-
натный буфер, рН
10.55; температура
37°С.
рода, растворенного в буфере и участвующего в
Реакцию начинали внесением в кювету 0.23 мМ
адреналина гидрохлорида.
химических и ферментативных реакциях, где в
процессе превращения субстрата происходит со-
ФМС/НАДН реакция. Условия проведения
пряженное образование О●─ . В полярографиче-
реакции, описанные в спектрофотометрическом
ской кювете были воспроизведены реакции, ис-
исследовании [13], были соблюдены и в поляро-
пользуемые как супероксидгенерирующие мо-
графических экспериментах, исключая из среды
НСТ. Использовали калий-фосфатный буфер
дельные системы для спектрофотометрических
методов определения активности СОД [12-14]. В
(PBS) (150 мМ KCl, 20 мМ KH2PO4, рН 7.4), со-
этих реакциях для идентификации супероксид
держащий 60 мкМ ФМС, реакцию начинали вне-
анионов применяется специфический реагент
сением 150 мкМ НАДН. Температура 24°С.
нитросиний тетразолий (НСТ), который под дей-
Ферментативная супероксидгенерирующая ре-
ствием О●─ восстанавливается до цветного ди-
акция «ксантин-ксантиноксидаза». При поляро-
формазана и регистрируется при длине волны
графии были воспроизведены условия реакции,
560 нм [12-15]. СОД ингибирует этот процесс,
описанные в работе [14]: 50 мМ Na-карбонатный
количество образовавшегося диформазана в про-
буфер с 0.4 мМ ЭДТА, рН 10.2. Содержание ксан-
центном отношении служит мерой оценки актив-
тиноксидазы - 11.0 мкг белка /мл, НСТ отсут-
ности фермента. Такой подход является обще-
ствовал. Реакцию начинали внесением 100 мкМ
принятым и применяется в различных спектро-
ксантина. Температура 26°С.
БИОФИЗИКА том 67
№ 1
2022
К МЕХАНИЗМУ АКТИВАЦИИ КИСЛОРОДА
7
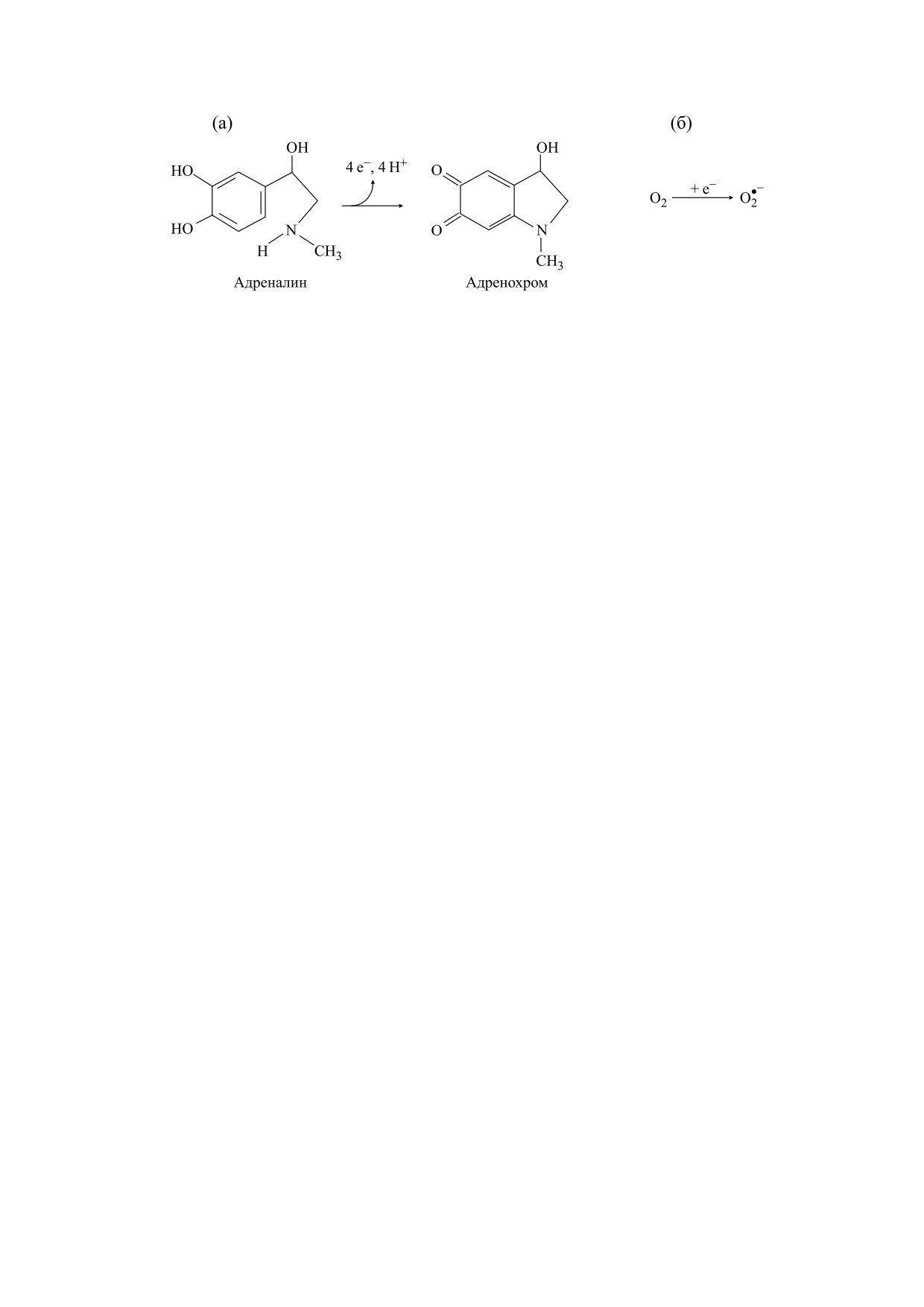
Рис. 1. Краткая схема хиноидного окисления адреналина до адренохрома (а), сопряженная с образованием супероксидных
анион-радикалов (б). Подробности см. в работах [17, 19].
Ферментативная система глюкоза-глюкозоок-
Эта реакция впервые была использована как
сидаза. Условия проведения реакции: PBS-буфер,
модельная система генерации супероксида для
рН 7.3, содержащий 5 мМ глюкозы [20, 23]. Реак-
определения активности СОД [26]. Ранее с ис-
цию начинали добавлением фермента. Количе-
пользованием полярографического метода нами
ство глюкозооксидазы в кювете 7.5 мкг белка/мл,
было показано, что происходит в кювете при ав-
температура реакции 21°С.
тоокислении адреналина в щелочном карбонат-
ном буфере [22]. Позднее мы исследовали эту ре-
Спектральные измерения осуществляли в тер-
акцию с применением НСТ [12].
мостатированной кювете на спектрофотометре
UV/VIS Uvikon-923 (Италия) в режиме «time Driv-
На рис. 2 представлена запись полярографиче-
er» при длине волны 560 нм (регистрация дифор-
ской регистрации процесса автоокисления адре-
мазана) или 347 нм (регистрация адренохрома).
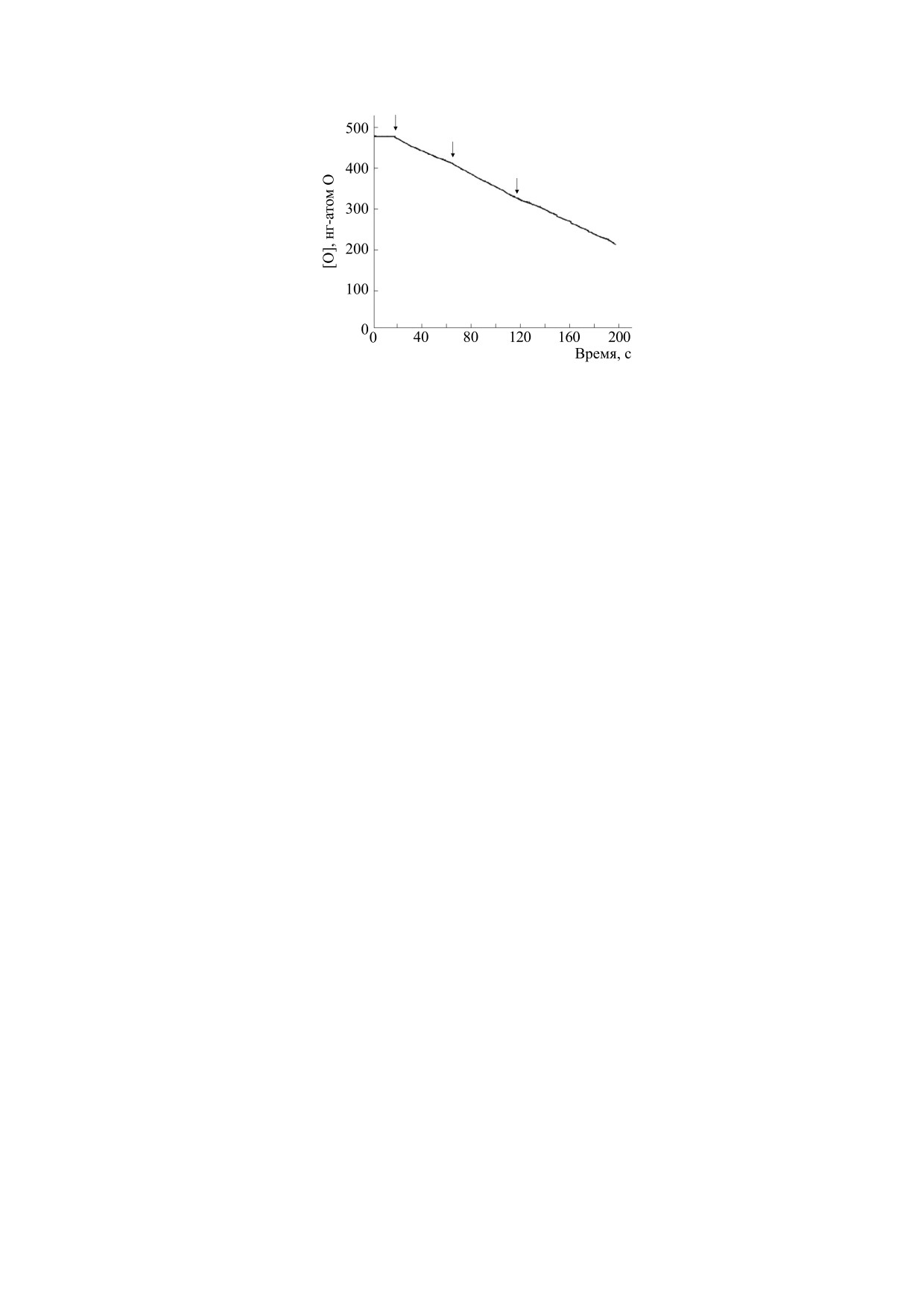
налина в щелочном буфере: наблюдается сниже-
ние концентрации кислорода в среде, связанное с
Реактивы. В работе использовали следующие
его использованием в этой химической реакции
реактивы: Na2CO3, нитросиний тетразолий,
(кривая 1). Очевидно, что происходит переход
ксантин, ксантиноксидазу (КФ 1.1.3.22), каталазу
молекулярного кислорода в форму радикала со-
(КФ 1.11.1.6), супероксиддисмутазу (КФ 1.15.1.1),
гласно уравнению (1), и эту форму кислорода
глюкозооксидазу (КФ 1.1.3.4) - все от компании
платиновый электрод не регистрирует. Образо-
Sigma (США); NaHCO3 (J.T. Baker, Нидерланды);
вавшийся в среде супероксид анион выявляется
ФМС и НАДН (Sigma-Aldrich, Fluka, Германия);
внесенным в полярографическую кювету НСТ:
фармакопейную форму 0.1% адреналина гидро-
обнаруживается диформазан - цветной продукт
хлорида (Московский эндокринный завод).
реакции восстановления НСТ супероксидом (ка-
чественная оценка). Добавленная по ходу реак-
Статистика. Статистическую обработку ре-
ции СОД тормозит потребление кислорода
зультатов проводили с использованием t-крите-
(рис. 2, кривая 2), что также указывает на появле-
рия Стьюдента в программе MS Excel: определяли
ние в кювете супероксида. Если СОД находится в
среднее значение (M) и стандартное отклонение
буфере, то после внесения адреналина наблюда-
(s.d.). Представленные графики являются кон-
ется увеличенный лаг-период и значительно сни-
кретными экспериментальными кривыми, вы-
женная скорость потребления кислорода (рис. 2,
бранными из независимых многократно прове-
кривая
3). Наличие индукционного периода
денных при четырех-шести параллельных изме-
определяется временем инициации цепной реак-
рениях в каждом опыте.
ции, что характерно для подобных сопряженных
процессов. В присутствии СОД, вероятно, замед-
ляется инициирование цепи и потому снижается
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
потребление кислорода. Возможно и такое объяс-
нение: СОД катализирует реакцию дисмутации,
Активация кислорода в реакции автоокисления
продуктом которой кроме пероксида водорода
адреналина. Эта система известна как процесс
является и молекулярный кислород; платиновый
многостадийного химического превращения ка-
электрод, регистрирующий именно молекуляр-
техоламина адреналина до конечного продукта
ный кислород, отображает как появление кисло-
адренохрома и сопряжена с образованием су-
рода в кювете, так и одновременно убыль его в
пероксида [24-26]. Упрощенная схема окисления
процессе автоокисления адреналина.
адреналина представлена на рис. 1, детально эта
химическая реакция описана в литературе [24, 25]
Наличие лаг-периода и снижение скорости
и наших работах [11, 12, 16, 17, 19].
потребление кислорода регистрируются и в при-
БИОФИЗИКА том 67
№ 1
2022
8
Т.В. СИРОТА, Н.П. СИРОТА
Рис. 2. Полярографическая регистрация потребления кислорода в процессе автоокисления 0.23 мМ адреналина в 0.2 М
карбонатном буфере, рН 10.55: 1 - адреналин внесен в буфер; 2 - то же, но по ходу реакции добавлена СОД (5.5 мкг/мл);
3 - СОД добавлена в буфер до внесения адреналина. Температура 37°С.
сутствии различных материалов, обладающих ан-
зование диформазана, продукта восстановления
тиоксидантными свойствами, что позволяет ко-
НСТ супероксидом, образующимся в этой систе-
личественно оценивать их антиоксидантную ак-
ме. Полярографические исследования этой реак-
тивность [22].
ции в литературе не обнаружены.
В предыдущих наших работах методического
На рис. 3 представлена полярографическая ре-
характера вопрос об активации кислорода в этой
гистрация процесса, происходящего в этой реак-
реакции не обсуждался [14, 18-22].
ции: ФМС находится в буфере, добавка НАДН
Активация кислорода в химической реакции
вызывает интенсивное потребление кислорода и
ФМС/НАДН. Реакция известна как супероксид-
убыль его из среды. На каждую последующую до-
генерирующая система; она проводится в присут-
бавку НАДН при достаточной концентрации
ствии НСТ и лежит в основе разработанного
ФМС в буфере происходит очередное исчерпание
спектрофотометрического метода определения
молекулярного кислорода. Такая картина имеет
активности СОД [13]: измеряют при 560 нм обра-
место и при добавлении ФМС, если НАДН нахо-
Рис. 3. Регистрация потребления кислорода в химической супероксидгенерирующей системе ФМС/НАДН. Условия реак-
ции: PBS-буфер, рН 7.4; 60 мкМ ФМС в буфере. Стрелкой указано внесение НАДН (дважды по 150 мкМ): 1 - самопроиз-
вольный выход кислорода; 2 - эффект от добавки каталазы (50 мкг/мл). Температура 24°С.
БИОФИЗИКА том 67
№ 1
2022
К МЕХАНИЗМУ АКТИВАЦИИ КИСЛОРОДА
9
Рис. 4. Регистрация потребления кислорода в ферментативной супероксидгенерирующей реакции ксантин-ксантинокси-
даза. Условия реакции: 50 мМ карбонатный буфер, рН 10.2, 0.4 мМ ЭДТА. Реакцию начинали внесением 100 мкМ ксан-
тина, стрелками указаны повторные добавки субстрата. Концентрация фермента в среде инкубации 11.0 мкг/мл. Темпера-
тура 26°С.
дится в буфере (данные не приводятся). В процес-
В действительности же эта реакция проходит в
се потребления кислорода в этой реакции про-
два этапа, именно на первом этапе НСТ и выяв-
ляет
●─:
исходит образование
●─. В оригинальном
спектрофотометрическом методе супероксид
идентифицируется присутствующим в среде НСТ
ксантин + O2 + 2H2O →
[15]. В нашем эксперименте при внесении в поля-
→ мочевая кислота + 2О●─ + 4Н+.
(4)
рографическую кювету НСТ в процессе реакции
наблюдается интенсивное образование фиолето-
На рис. 4 представлена полярографическая
во-синего диформазана. На рис. 3 (кривая 2) по-
кривая, иллюстрирующая процесс использова-
казано, что добавленная каталаза выявляет пе-
ния кислорода при функционировании фермен-
роксид водорода, который образуется в кювете в
та. Ксантиноксидаза присутствует в буфере, до-
результате реакции диспропорционирования со-
бавление субстрата в кювету «запускает» фермен-
гласно уравнению (2): в буфере появляется кис-
тативную реакцию и сопряженный с нею процесс
лород в количестве 177 н-г атом О/мл. Также на-
образования супероксида, который происходит
блюдается и спонтанное появление кислорода в
согласно уравнению (1). Платиновый электрод
среде - 115 н-г атом О/мл (рис. 3, кривая 1).
регистрирует убыль молекулярного кислорода из
среды. Повторные добавки ксантина в представ-
Таким образом, в модельной системе
ленном эксперименте не стимулируют скорость
ФМС/НАДН происходит активация кислорода,
реакции, что указывает на достаточность субстра-
возникает
●─ с последующим образованием пе-
та для данного количества фермента. При других
соотношениях количества фермента и субстрата
роксида водорода.
отмечалась активация потребления кислорода и
Активация кислорода в ферментативной реакции
на повторные внесения субстрата (данные не
ксантин-ксантиноксидаза. Как супероксидгене-
приводятся). Образование супероксида в этом
рирующая модель эта реакция часто применяется
процессе также выявляется с помощью НСТ, ко-
торый используется в оригинальном методе [14].
для определения активности СОД известным
спектрофотометрическим методом: в присут-
Именно спектрофотометрическим методом мы
первоначально определяли активность фермента,
ствии НСТ идентифицируется образующийся су-
подбирая необходимые соотношения фермента и
пероксид [14]. Фермент ксантиноксидаза - хоро-
субстрата, и затем проводили полярографические
шо изученный флавопротеид, катализирующий
эксперименты.
реакцию, которая представлена следующим урав-
нением [27]:
Таким образом, показано, что в данной су-
пероксидгенерирующей системе наблюдается
ксантин + O2 +2H2O →
убыль кислорода из среды и образование су-
→ мочевая кислота + 2H2O2.
(3)
пероксида.
БИОФИЗИКА том 67
№ 1
2022
10
Т.В. СИРОТА, Н.П. СИРОТА
Рис. 5. (а) - Регистрация потребления кислорода при функционировании глюкозооксидазы, время внесения фермента в
кювету здесь и далее указанî стрелкой; (б) - в тех же условиях по ходу реакции добавлены СОД и затем каталаза; (в) - по
ходу реакции дважды добавлена каталаза. Условия реакции: PBS-буфер, рН 7.3; 5 мМ глюкозы, концентрация
глюкозоокси-дазы - 7.5 мкг/мл. Добавки СОД - 5.5 мкг/мл, каталазы - 50 мкг/мл. Температура 21°С.
Следует отметить, что в организме в нормаль-
Активация кислорода в реакции глюкоза-глю-
ных условиях ксантиноксидаза существует как
козооксидаза. Фермент глюкозооксидаза, как и
ксантиндегидрогеназа, однако при избытке гипо-
ксантиноксидаза, относится к классу оксидоре-
ксантина и ксантина, образующихся при окисли-
дуктаз и содержит кофактор флавинаденинди-
тельном метаболизме пуринов [27], фермент при-
нуклеотид, однако, катализируемая с участием
глюкозооксидазы реакция в литературе не обсуж-
обретает функцию оксидазы и использует оба эти
дается как супероксидгенерирующая: т.е. речь не
соединения как субстрат, катализируя образова-
ние мочевой кислоты и являясь таким образом
идет об образовании О●─. Уравнение этой реак-
мощным продуцентом супероксид анионов [28].
ции представлено ниже:
(5)
Химическими формулами детально представ-
козы (уравнение (5)). В кювете одновременно с
лены этапы восстановления кислорода флавина-
окислением глюкозы до глюконовой кислоты
ми и делается предположение: «не исключено об-
происходит и сопряженный процесс активации
разование супероксидного анион-радикала
молекулярного кислорода. Рис. 5б показывает:
вместо Н2О2» [27]. Эту ферментативную систему
СОД замедляет процесс потребления кислорода,
используют в качестве модели «Н2О2-поврежде-
что связано с превращением О●─ в пероксид во-
ния» [20], т.е. как повреждающий агент рассмат-
дорода согласно уравнению (2) и каталаза обнару-
ривается именно Н2О2, а не
●─, хотя первона-
живает в кювете Н2О2. Чувствительность данной
чально, очевидно, возникает супероксид анион и
реакции к СОД, а также появление Н2О2 указыва-
затем пероксид водорода как продукт реакции
ют на существование в этой системе О●─. На-
диспропорционирования. В литературе это не об-
блюдаемое торможение реакции при внесении
суждается.
СОД связано, вероятно, с появлением в кювете
Реакция была нами воспроизведена в поляро-
молекулярного кислорода в результате реакции
графической кювете. Данные, представленные на
дисмутации, которое визуально воспринимается
рис. 5, демонстрируют убыль кислорода из среды,
как замедление процесса потребления кислорода,
что указывает на использование молекулярного
что и регистрирует платиновый электрод. Однако
кислорода в ходе химического превращения глю-
НСТ, добавленный в кювету, где происходит
БИОФИЗИКА том 67
№ 1
2022
К МЕХАНИЗМУ АКТИВАЦИИ КИСЛОРОДА
11
Образование диформазана при функционировании
окисление глюкозы, не выявляет О●─, как это
глюкозооксидазы
наблюдалось в исследованных выше реакциях.
Возможно, что условия, в которых происходит
Оптическая плотность, Е560 нм
данная реакция, не оптимальны для существова-
Время, мин
ния супероксида. Мы изменили состав буфера и
рН 7.3*
рН 10.55**
сделали щелочным его рН, поскольку известно,
что супероксид анионам необходимы карбо-
1
0.022 ± 0.003
0.0433 ± 0.003
нат/бикарбонатные ионы [11, 29] и время жизни
О●─ увеличивается в щелочной среде [30, 31]. В
5
0.022 ± 0.003
0.0838 ± 0.003
таблице представлены результаты спектрофото-
метрического измерения образования диформа-
Примечание. Условия проведения реакции: * - PBS-буфер,
зана в разных условиях проведения реакции. Не
рН 7.3,
7.5 мМ глюкозы,
125 мкМ НСТ, 6.0 мкг/мл
появляется диформазан в среде после внесения
глюкозооксидазы; ** - 0.2 М карбонатный буфер, рН 10.55,
фермента, если реакция проводится в PBS-буфе-
7.5
мМ глюкозы,
125 мкМ НСТ,
6.0
мкг/мл
ре с рН 7.3 в присутствии субстрата и НСТ, т.е.
глюкозооксидазы.
О●─ не обнаруживается. В щелочных условиях:
(0.2 М карбонатный буфер, рН 10.55) при нали-
чии субстрата и НСТ внесение глюкозооксидазы
используются как биосенсор в работе глюко-
сразу же выявляет цветной диформазан и интен-
метра.
сивность окраски в кювете увеличивается во вре-
Таким образом, в настоящем исследовании
мени (см. таблицу). Очевидно, потому и исполь-
экспериментально показано, что в химических и
зуют в супероксидгенерирующих системах ще-
ферментативных системах образуется снача-
лочные карбонатные буферы
[14,
16,
26].
ла О●─ - это и есть активированный кислород,
Подтверждение этому находим в работе [30], где
показано, что образование супероксида и выход
который далее превращается в пероксид водорода
адренохрома при автоокислении адреналина воз-
спонтанно или при участии СОД и, что особенно
растает при более высоком рН, а для реакции дис-
важно, в среду вновь поступает молекулярный
кислород. Появление молекулярного кислорода в
пропорционирования нужен Н+ и этот процесс
среде, в клетках организма, обеспечивают фер-
происходит при низком значении рН. В щелоч-
менты каталаза и пероксидаза, таким образом в
ных условиях и в присутствии карбонатных
организме сохраняется и поддерживается кисло-
ионов, вероятно, увеличивается время существо-
родный гомеостаз. Оксидазный процесс превра-
вания супероксид анион-радикалов, что и позво-
щения молекулярного кислорода в супероксид
лило нам выявить О●─ в реакции глюкоза-глю-
сопровождается убылью кислорода из среды, т.е.
козооксидаза.
возникают гипоксические условия. Появление
Следует отметить, что глюкозооксидаза широ-
кислорода при участии каталазы и/или СОД мо-
ко используется в промышленных технологиях (в
жет восстанавливать его баланс в клетке. Такие
пищевой промышленности, химической, фарма-
превращения кислорода и показаны в настоящем
цевтической, клинической химии, биотехноло-
исследовании: О2 → О●─ → Н2О2 → О2.
гии и других отраслях) для обеззараживания и со-
Следует отметить работы Тимочко и соавт.
хранности продуктов, поскольку «удаляет» кис-
лород из среды, используя эндогенную глюкозу
[33], которые сформулировали гипотезу о нали-
как субстрат и молекулярный кислород в качестве
чии в организме запасного депо кислорода в виде
акцептора электронов, с одновременным выделе-
пероксида водорода и гидропероксидов липидов,
нием Н2О2, как известно из литературы [32]. Од-
функционально связанного с системой перокси-
даза-каталаза и СОД. Эта система может высво-
нако, согласно нашим данным, первоначально
бождать молекулярный кислород и таким обра-
образуется именно супероксид, и затем уже пе-
зом поддерживать градиент кислорода в органах и
роксид водорода. Оба эти продукта обладают бак-
тканях [33]. Авторами введено понятие «эндоген-
терицидным действием и в практике, вероятно,
ный кислород». Первоначально происходит его
не так важно, чем «убивать» бактерии: суперок-
исчерпание из среды, переход в активированное
сид-радикалом О●─, который первоначально об-
состояние, затем создание «запасного депо» и по-
разуется в этой реакции, или Н2О2, который со-
следующее высвобождение кислорода из перок-
сида водорода и гидропероксидов липидов под
здается далее из О●─. В научных экспериментах
действием соответствующих ферментов [33].
необходимо учитывать, что первичным продук-
том реакции при функционировании глюкозоок-
Также важно отметить, что намного раньше
сидазы являются именно супероксид анионы.
термин «активированный кислород» или «метабо-
Иммобилизованные препараты этого фермента
лически активный кислород» впервые был введен
БИОФИЗИКА том 67
№ 1
2022
12
Т.В. СИРОТА, Н.П. СИРОТА
А.Н. Бахом [34, 35]. Однако в его работах речь ве-
5.
Е. Е. Дубинина, Продукты метаболизма кислорода
лась исключительно о пероксиде водорода, из ко-
в функциональной активности клеток («Мед. прес-
торого под действием каталазы или пероксидазы и
са», Санкт-Петербург, 2006), сс. 111-135.
образуется «активированный кислород». В совре-
6.
Е. Б. Меньщикова, В. З. Ланкин, Н. К. Зенков
менном понимании расстановка акцентов не-
и др., Окислительный стресс. Прооксиданты и ан-
сколько иная: первоначально в химических и фер-
тиоксиданты («Слово», М., 2006), сс. 35-40.
ментативных (оксидазных) реакциях в клетке и ор-
7.
B. Halliwell, Trends Biochem Sci, 31 (9), 509 (2006).
ганизме образуется супероксид и затем пероксид
DOI: 10.1016/j.tibs.2006.07.005
водорода, уровень которого контролируется пе-
8.
P. D. Ray, B.W. Huang, and Y. Tsuji, Cell. Signal. 24,
роксидазой и каталазой. Также А.Н. Бахом
981 (2012). DOI: 10.1016/j.cellsig.2012.01.008
впервые был сделан вывод о важной положитель-
9.
Н. К. Зенков, А. Р. Колпаков и Е. Б. Менщикова,
ной роли пероксида водорода в жизни живых орга-
Сибирский науч. мед. журн. 35 (5), 5 (2015).
низмов [35].
10.
11.
Т. В. Сирота, Биомед. химия 61 (1), 115 (2015).
ЗАКЛЮЧЕНИЕ
12.
Т. В. Сирота, Биомед. химия 59 (4), 399 (2013).
В исследованных модельных системах экспе-
13.
M. Nishikimi, N. A. Rao, and K. Yagi, Biochem. Bio-
риментально показано, что в химических реакци-
phys. Res. Commun.
46
(2),
849
(1972). DOI:
ях и в процессе функционирования ферментов
10.1016/s0006-291x(72)80218-3
класса оксидоредуктаз (оксидаз), изначально об-
14.
C. Beauchamp and I. Fridovich, Anal. Biochem. 44,
разуются супероксид анионы, которые и являют-
276 (1971).
ся метаболическим активированным кислоро-
15.
F. P. Altman, Progr. Histochem. Cytochem. 9, 1
дом. Происходящие превращения кислорода
(1976).
(О2 → О2●─ → Н2О2 → О2) могут иметь место во
16.
Т. В. Сирота, Вопр. мед. химии 45, 263 (1999).
внутриклеточных системах при участии соответ-
17.
Т. В. Сирота, Патент РФ на изобретение
ствующих оксидоредуктаз и антиоксидантных
№ 2144674, Б.И. № 2 (2000).
ферментов.
18.
Т. В. Сирота, Биомед. химия 62, 650 (2016). DOI:
10.18097/PBMC20166206650
ФИНАНСИРОВАНИЕ РАБОТЫ
19.
Т. В. Сирота, Биофизика 65 (4), 648 (2020). DOI:
10.31857/S0006302920040031
Работа проведена в рамках бюджетного фи-
20.
M. Tenopoulou, P. T. Doulias, A. Barbouti, et al.,
нансирования ИТЭБ РАН по теме 04, направле-
Biochem. J.,
387,
703
(2005). DOI:
10.1042/
ние 63.
BJ20041650
21.
Т. В. Сирота, О. П. Елисеева, Н. В. Хундерякова и
КОНФЛИКТ ИНТЕРЕСОВ
др., Укр. биохим. журн. 79 (5), 196 (2007).
22.
Т. В. Сирота, Биомед. химия, 58 (1), 77 (2012).
Авторы заявляют об отсутствии конфликта
23.
Л. И. Казакова, Н. П. Сирота, Т. В. Сирота и
интересов.
Л. И. Шабарчина, Журн. физ. химии 91 (9), 1613
(2017). DOI: 10.7868/S0044453717090187
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
24.
A. Bindoli, M. P. Rigobello, and L. Galzigna, Toxicol.
Lett. 48, 3 (1989). DOI: 10.1016/0378-4274(89)90180-X
Настоящая работа не содержит описания ис-
25.
F. Marques, R. O. Duarte, J. J. Moura, and M. P. Bi-
следований с использованием людей и животных
cho, Biol. Signals 5,
275
(1996). DOI: 10.1159/
в качестве объектов.
000109200
26.
H. P. Misra and I. Fridovich, J. Biol. Chem. 247, 3170
СПИСОК ЛИТЕРАТУРЫ
(1972).
27.
Д. Мецлер. Биохимия: химические реакции в живой
1. R. Gerschman, D. L. Gilbert, S. W. Nye, et al., Sci-
клетке (Мир, М., 1980), т. 2, сс. 256-257, 265-268,
ence 119 (3097), 623 (1954).
274.
2. В. Г. Колпаков, Журн. невропатологии и психиат-
28.
R. Fried, L. W. Fried, and D. R. Babin, Eur. J. Bio-
рии им. С. С. Корсакова 74 (8), 1254 (1974).
chem.
33,
439
(1973). DOI:
10.1111/j.1432-
3. A. Bindoli, M. P. Rigobello, D. J. Deeble, Free Radic.
1033.1973.tb02701.x
Biol. Med., 13, 391 (1992).
29.
В. Л. Воейков, Н. Д. Виленская, До Минь Ха и др.,
4. M. Valko, D. Leibfritz, J. Moncol, et al., Int. J. Bio-
Журн. физ. химии 86 (9), 1518 (2012).
chem. Cell Biol. 39 (1), 44 (2007). DOI: 10.1016/j.bio-
30.
R. Alhasan and D. Njus, Anal. Biochem. 381 (1), 142
cel.2006.07.001
(2008). DOI: 10.1016/j.ab.2008.06.030
БИОФИЗИКА том 67
№ 1
2022
К МЕХАНИЗМУ АКТИВАЦИИ КИСЛОРОДА
13
31. Н. К. Зенков и Е. Б. Меньщикова, Успехи соврем.
33. М. Т. Тимочко, Л. И. Кобылинская и Я. И. Алек-
биологии 113 (3), 286 (1993).
сеевич, Hypoxia Med. J. 6 (4), 154 (1998).
32. S. B. Bankar, M. V. Bule, R. S. Singhal, and L. Anan-
34. А. Н. Бах, Журн. физ.-хим. общества 29 (6), 373 (1897).
thanarayan, Biotechnol. Adv. 27 (4), 489 (2009). DOI:
35. А. Н. Бах, Сборник избранных трудов (ОНТИ Хим-
10.1016/j.biotechadv.2009.04.003
Теорет, Л., 1937), сс. 181-196.
On the Mechanism of Oxygen Activation in Chemical and Biological Systems
T.V. Sirota and N.P. Sirota
Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
It has been shown that activation of oxygen in model chemical and biological systems associated with the for-
mation of superoxide anion radicals (O●─) leads to a decrease in the content of molecular oxygen in the buf-
fer. The following chemical and enzymatic reactions have been considered: autooxidation of adrenaline in an
alkaline medium, phenazine methosulfate/NADH, as well as xanthine-xanthine oxidase reaction. It has
been found that when the chemical transformation of the substrate occurs in each of these reactions, O2 is
consumed from the buffer, leading to temporary hypoxic conditions. Nitroblue tetrazolium and superoxide
dismutase were used to determine the production of anion radicals O●─. It has been discovered for the first
time, that O●─ is produced in the reaction of glucose-glucose oxidase, known as the reaction that does not
generate superoxide. Catalase in reactions under study reacted with the hydrogen peroxide - the product of
O●─ disproportionation, and molecular oxygen was detected in the buffer. Thus, the following oxygen trans-
formations are shown: О2 → O●─ → Н2О2 → О2, which can also occur in intracellular systems with the involve-
ment of appropriate oxidoreductases and antioxidant enzymes.
Keywords: superoxide, hydrogen peroxide, polarography, adrenaline, phenazine methosulfate/NADH, xanthine-
xanthine oxidase, glucose-glucose oxidase, superoxide dismutase, catalase
БИОФИЗИКА том 67
№ 1
2022