БИОФИЗИКА, 2022, том 67, № 1, с. 14-21
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.325:577.151
ВОЗМОЖНАЯ РОЛЬ КЛАСТЕРОВ ЗАРЯЖЕННЫХ АМИНОКИСЛОТ
НА ПОВЕРХНОСТИ ЦИСТЕИНОВЫХ ПРОТЕАЗ ДЛЯ СОХРАНЕНИЯ
АКТИВНОСТИ ПРИ СВЯЗЫВАНИИ С ПОЛИМЕРАМИ
© 2022 г. С.М. Панкова*, **, Ф.А. Сакибаев**, М.Г. Холявка**, ***, В.Г. Артюхов**
*Воронежский государственный медицинский университет им. Н.Н. Бурденко,
394036, Воронеж, Студенческая ул., 10
**Воронежский государственный университет, 394018, Воронеж, Университетская пл., 1
***Севастопольский государственный университет, 299053, Севастополь, Университетская ул., 33
E-mail: holyavka@rambler.ru
Поступила в редакцию 17.05.2021 г.
После доработки 17.06.2021 г.
Принята к публикации 23.11.2021 г.
Исследованы состав и расположение заряженных и гидрофобных аминокислотных остатков на по-
верхности молекул бромелина, фицина и папаина, определено процентное соотношение амино-
кислот разных типов. Установлено, что заряженные и гидрофобные аминокислотные остатки рас-
пределены по поверхности молекул неравномерно, образуя участки локального скопления (класте-
ры). Обосновано предположение о том, что наиболее перспективными носителями для
иммобилизации цистеиновых протеаз являются положительно заряженные полимерные материа-
лы, которые, вероятно, будут взаимодействовать с одним из участков на поверхности молекул фер-
мента, удаленных от его активного центра. Выявлено, что высокомолекулярный (350 кДа) и средне-
молекулярный (200 кДа) хитозаны являются более перспективными носителями для иммобилиза-
ции бромелина, фицина и папаина, чем ионообменные волокна ВИОН КН-1 и ВИОН АН-1.
Сорбция на хитозанах позволила сохранить от 30% (для папаина) до 70% (для фицина) активности
ферментов по сравнению с их исходной активностью в растворе.
Ключевые слова: бромелин, фицин, папаин, катионообменное волокно ВИОН КН-1, анионообменное
волокно ВИОН АН-1, хитозан, кластеры аминокислотных остатков.
DOI: 10.31857/S0006302922010021
Протеазы осуществляют высокоспецифичные
палительным, фибринолитическим, иммуномо-
и селективные модификации белков, такие как
дулирующим действием [5-8].
активация зимогенных форм ферментов путем
Фицин (КФ 3.4.22.3) является основным бел-
ограниченного протеолиза, участвуют в процес-
ковым компонентом в латексе Ficus sp. Этот фер-
сах свертывания крови и лизиса фибриновых
мент содержит одну полипептидную цепь с моле-
сгустков. Их разнообразие и высокая специфич-
кулярной массой 25 кДа, которая свернута с обра-
ность используются в медицине и фармакологии
зованием глобулярного белка с двумя доменами.
для разработки эффективных терапевтических
Активный центр фицина состоит из Cys25 и
средств.
His162. Фермент имеет довольно широкую суб-
стратную специфичность и проявляет высокую
Бромелин (КФ 3.4.22.4) - это растительная
активность в диапазоне рН 6.5-8.5. Изоэлектри-
протеаза, получаемая из стебля, сока, листьев и
ческая точка находится при pH 9.0 [9]. Фицин об-
кожуры ананаса Ananas comosus. Молекулярная
ладает антимикробной активностью против
масса бромелина составляет 23-36 кДа. Опти-
грамположительных и грамотрицательных бак-
мальные значения pH и температуры для прояв-
терий [10, 11].
ления активности бромелина расположены в диа-
Папаин (КФ 3.4.22.2) представляет собой рас-
пазоне pH 6.5-8.0 и 55-60°C. Изоэлектрическая
тительный фермент, который выделяют из латек-
точка его молекул находится при pH 9.5. Актив-
са папайи Carica papaya. Папаин относится к ци-
ный центр фермента включает Cys26 и His158 [1-
стеиновым протеазам и предпочтительно рас-
4]. Бромелин ингибирует агрегацию тромбоци-
щепляет пептидные связи с участием основных
тов, рост раковых клеток, обладает противовос-
аминокислот, в частности аргинина, лизина и
14
ВОЗМОЖНАЯ РОЛЬ КЛАСТЕРОВ ЗАРЯЖЕННЫХ АМИНОКИСЛОТ
15
остатков, следующих за фенилаланином. Он
теаз для сохранения их активности при связыва-
представляет собой одноцепочечный белок с мо-
нии с полимерами: in silico поиск потенциальных
лекулярной массой 23 кДа и состоит из 212 ами-
сайтов связывания с полимерами-носителями,
нокислот [12]. Молекула папаина содержит семь
in vitro верификация проведенных расчетов на
остатков цистеина, шесть из которых образуют
примере хитозана и ионообменных волокон
три дисульфидные связи. Активный центр фер-
ВИОН КН-1 и ВИОН АН-1.
мента состоит из Cys25 и His159 [13, 14]. Оптимум
pH для папаина варьирует в диапазоне 6.0-7.0 в
МАТЕРИАЛЫ И МЕТОДЫ
зависимости от используемого субстрата. Изо-
электрическая точка находится при pH 8.7. Папа-
В качестве объекта исследования были выбра-
ин широко применяется в медицине и фармации,
ны бромелин, фицин и папаин (Sigma, США),
так как обладает противогрибковыми, антибакте-
носителями для иммобилизации - высокомоле-
риальными и противовоспалительными свой-
кулярный
(350 кДа) и среднемолекулярный
ствами. Например, он используется для борьбы с
(200 кДа) хитозаны (ЗАО «Биопрогресс», Рос-
расстройствами пищеварения и желудочно-ки-
сия), ионообменные волокна ВИОН КН-1 и ВИ-
шечного тракта, также папаин обладает 85%-й
ОН АН-1 (ООО «ЛИРСОТ», Россия).
цитотоксичностью в отношении линии клеток
Подготовку ионообменных волокон к иммо-
рака печени HepG2 [4].
билизации осуществляли следующим методом.
Волокнистые иониты ВИОН обладают разви-
При кондиционировании их помещали в дистил-
той поверхностью и малым сопротивлением
лированную воду. После набухания волокна об-
фильтрующего слоя, что делает их перспективны-
рабатывали растворами HCl переменной концен-
ми хемосорбентами [15]. Данные свойства спо-
трации (0.5, 1.0, 1.5, 1.0, 0.5 моль/л) для удаления
собствуют их использованию в качестве матриц
ионов железа. Процесс проводили в статических
для разработки гетерогенных катализаторов на
условиях. После отмывки дистиллированной во-
основе иммобилизованных ферментов. Благода-
дой осуществляли попеременную четырехкрат-
ря своим уникальным физико-химическим свой-
ную обработку ионитов растворами 1 М NaOH и
ствам хитозан хорошо связывается со многими
1 М HCl с промежуточной промывкой дистилли-
химическими соединениями и биологическими
рованной водой [17].
системами, в том числе с холестеринами, жира-
Иммобилизацию ферментов проводили ад-
ми, белками, ионами металлов и даже опухолевы-
сорбционным методом. Для этого 1 г носителя
ми клетками. В медицине изготовленные из хито-
выдерживали на 1 ч при комнатной температуре в
зана волокна применяют в качестве рассасываю-
10 мл буфера. Оптимальные буферы для сорбции
щихся шовных материалов и средств для
цистеиновых протеаз были выявлены нами ранее
перевязки ран [16].
[18]. В частности, при иммобилизации бромелина
Ограничением для использования раствори-
на высокомолекулярном и среднемолекулярном
мых ферментов является их относительная не-
хитозанах мы использовали 0.05 М трис-глици-
стабильность. Одним из основных средств по-
новый буфер с рН 8.5 и 9.0 соответственно, на
вышения стабильности ферментов является их
ионообменных волокнах ВИОН КН-1 - 0.05 М
иммобилизация на полимерных носителях. Им-
глициновый буфер (рН 9.0), на ВИОН АН-1 -
мобилизованные биокатализаторы имеют пре-
0.2 М ацетатный буфер (рН 5.0) [19, 20]. Для ад-
имущества по сравнению с нативными протеаза-
сорбции фицина на высокомолекулярном и сред-
ми, в частности, бóльшую стабильность фермент-
немолекулярном хитозанах применяли 0.05 М
ного комплекса при воздействии экстремальных
глициновый буфер с рН 8.6 и 10.0 соответственно,
значений температуры, давления, pH среды. Де-
на ВИОН КН-1 - 0.05 М трис-HCl-буфер
тальное изучение процессов иммобилизации
(рН 7.0), на ВИОН АН-1 - 0.2 М ацетатный буфер
ферментов на различных носителях позволяет со-
(рН 5.0) [21, 22]. Для иммобилизации папаина на
здавать новые непрерывные промышленные тех-
обоих типах хитозана использовали
0.05 М
нологии производства целевых продуктов путем
глициновый буфер (рН 9.0), на ионообменных
гетерогенного катализа. Для проведения успеш-
волокнах ВИОН КН-1 - 0.05 М боратный буфер
ной иммобилизации необходимо соблюдать
с добавлением 0.1 М KCL (рН 9.0), на ВИОН
определенные условия: фермент должен быть
АН-1 - 0.05 М глициновый буфер (рН 10.0) [23,
стабилен в условиях протекания реакции, актив-
24].
20 мл раствора энзима в концентрации
ный центр фермента должен быть защищен путем
2 мг/мл добавляли к 1 г суспензии носителя и пе-
его связывания с субстратом, необходимо учиты-
ремешивали в колбе с помощью электрической
вать механическую прочность и физическую
мешалки в течение 2 ч при температуре 25°С. По-
форму носителя. По этим причинам целью нашей
лученную смесь центрифугировали в течение
работы явилось изучение возможной роли кла-
5 мин при 1500 g, осадок промывали буфером до
стеров заряженных и гидрофобных аминокислот-
отсутствия белка в промывных водах, контроль за
ных остатков на поверхности цистеиновых про-
содержанием белка осуществляли на спектрофо-
БИОФИЗИКА том 67
№ 1
2022
16
ПАНКОВА и др.
тометре СФ-2000 (ЛОМО, Россия) при 280 нм
Расстояние (r) между ближайшими атомами
[25].
аминокислотных остатков вычисляли на основе
их координат (x, y, z) по формуле
Измерение протеолитической активности
ферментов осуществляли на субстрате азоказеине
2
2
2
r=
(x
2
−x
1
)
+(y
2
−y
1
)
+(z
2
−
z
1
)
(Sigma, США). К 50 мг иммобилизованного об-
разца энзима добавляли 200 мкл трис-HCl-буфе-
Аналогичным способом были рассчитаны рас-
ра (pH 7.5), 800 мкл азоказеина (0.5% в 50 мМ
стояния от активного центра цистеиновых проте-
трис-HCl-буфере, pH 7.5) и инкубировали 2 ч при
аз до заряженных и гидрофобных аминокислот-
37°C. Далее добавляли 800 мкл трихлоруксусной
ных остатков на поверхности молекул.
кислоты в концентрации
5%, инкубировали
10 мин при 4°C, затем центрифугировали в тече-
Критерием группировки аминокислотных
ние 3 мин при 11700 g для удаления негидролизо-
остатков в локальное скопление (кластер) служи-
ванного азоказеина. К 1200 мкл супернатанта до-
ла степень их удаленности друг от друга. Остатки
бавляли 240 мкл 3% NaOH для нейтрализации
были отнесены нами к одному кластеру в случае,
кислоты, после чего измеряли оптическую плот-
если среднее расстояние от каждого из них до
ность опытной пробы при 410 нм в односантимет-
трех ближайших аминокислот из определяемого
ровой кювете. Контрольная проба содержала
скопления не превышало 10 Å. За начальное по-
800 мкл азоказеина, 800 мкл трихлоруксусной
ложение локального скопления принимали три
кислоты, 50 мг образца и 200 мкл трис-HCl-буфе-
аминокислотных остатка, среднее расстояние
ра. За единицу каталитической активности при-
между которыми также не превышало 10 Å.
нимали количество фермента, которое в условиях
эксперимента гидролизует 1 мкМ субстрата за
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1 мин. Удельную протеолитическую активность
цистеиновых протеаз рассчитывали по формуле:
На поверхности молекулы бромелина обнару-
живается 87 аминокислотных остатков, доступ-
А = D⋅1000/120/200/С,
ных для растворителя менее чем на 20%, у фицина
их 78, у папаина - 80. Среди них преобладают
где А - протеолитическая активность, мкМ/мин
гидрофобные аминокислотные остатки. Коли-
на 1 мг белка, D - оптическая плотность пробы
чество положительно заряженных превышает
при 410 нм, С - концентрация белка в пробе,
число отрицательно заряженных аминокислот на
мг/мл, измеренная по методу Лоури, 120 - время
поверхности глобул папаина и бромелина. Для
инкубации в минутах, 200 - объем пробы, 1000 -
молекулы фицина количество отрицательно за-
коэффициент для пересчета в мкМ.
ряженных остатков превосходит величину поло-
Статистическую обработку полученных ре-
жительных. Сведения об абсолютном и относи-
зультатов проводили при уровне значимости 5% с
тельном числе остатков аминокислот представле-
использованием t-критерия Стьюдента.
ны в табл. 1.
Выявление аминокислотных остатков на по-
В результате анализа моделей молекул броме-
верхности молекул ферментов с доступностью
лина, фицина и папаина было установлено, что
для растворителя не менее 20% проводили с ис-
аминокислотные остатки на их поверхности рас-
пользованием программы Swiss-Pdb Viewer 4.1.0.
пределены неравномерно с образованием класте-
Локализацию гидрофобных и заряженных ами-
ров. Обнаружено по четыре скопления заряжен-
нокислотных остатков визуализировали с помо-
ных аминокислотных остатка для молекул броме-
щью программы Maestro 10.3.
лина и фицина и три скопления для папаина.
Таблица 1. Абсолютное и относительное количество
аминокислотных остатков на поверхности молекул
цистеиновых протеаз
Тип остатков
Абсолютное количество
Относительное количество
Бромелин
Фицин
Папаин
Бромелин
Фицин
Папаин
Гидрофобные
36
24
35
41%
30%
44%
Положительно заряженные
18
16
14
21%
21%
17%
Отрицательно заряженные
7
17
6
8%
22%
8%
Незаряженные
26
21
25
30%
27%
31%
БИОФИЗИКА том 67
№ 1
2022
ВОЗМОЖНАЯ РОЛЬ КЛАСТЕРОВ ЗАРЯЖЕННЫХ АМИНОКИСЛОТ
17
Таблица 2. Состав кластеров заряженных и гидрофобных аминокислотных остатков на поверхности молекул
бромелина, фицина и папаина
Фермент
Скопления заряженных остатков
Скопления гидрофобных остатков
Бромелин
1) Lys59, Lys64, Arg70, Glu73, Lys79, Lys93
1) Val2, Pro3, Ile6, Tyr11, Tyr123
2) Lys42, Lys43, Lys127, Glu211
2) Val17, Pro22, Gly44, Ile45, Leu46, Pro48, Tyr61,
Ala85, Ile86, Pro88, Tyr89, Ala92, Gly100, Val101,
Pro102, Tyr106, Ile107
3) Arg9, Lys18, Glu47, Lys90;
3) Tyr142, Val147, Pro151, Ile171, Pro173, Trp176,
Gly177, Ala178, Trp180, Ala183
4) Lys144, Lys174, Lys175, Lys179
Фицин
1) Arg8, Lys10, Glu172, Glu191
1) Pro58, Tyr60, Leu63, Trp69
2) Asp18, Lys21, Lys61, Asp62, Lys66, Asp71, Lys72,
2) Pro117, Ala118, Val158, Ala159, Ala201, Pro203
Arg94, Lys95, Lys145, Glu146, Asp161, Lys187
3) Asp75, Lys79, Arg81, Glu114, Asp115, Asp119,
Glu212
4) Asp122, Lys126, Asp199, His202
Папаин
1)Arg58, Arg59, Glu89, Arg93, Arg98, Glu99, Lys100
1) Ile1, Pro2, Tyr4, Pro115, Tyr116, Gly119, Tyr123,
Ala137, Leu143, Ile148, Val150, Pro152, Val157,
2) Arg41, Lys106, Asp108, Arg111
Pro168, Gly192, Gly194, Tyr197
3) Lys139, Arg145, Lys156, Asp158
2) Tyr6, Pro87, Val91, Tyr94
Число скоплений гидрофобных аминокислот со-
можно сделать вывод о вероятном связывании с
ставляет три у бромелина и по два - у фицина и
ними положительно заряженного носителя без
папаина. Аминокислотный состав кластеров при-
экранирования субстрата от активного центра и,
веден в табл. 2.
как следствие, большей перспективности для фи-
цина положительно заряженных носителей для
Для молекул всех исследуемых в работе фер-
иммобилизации. Для бромелина и папаина, веро-
ментов выявлено наличие в области активного
ятно, также наиболее предпочтительными можно
центра скоплений заряженных аминокислотных
считать данный тип носителей, поскольку в не-
остатков, в составе которых преобладают поло-
посредственной близости к активному центру не
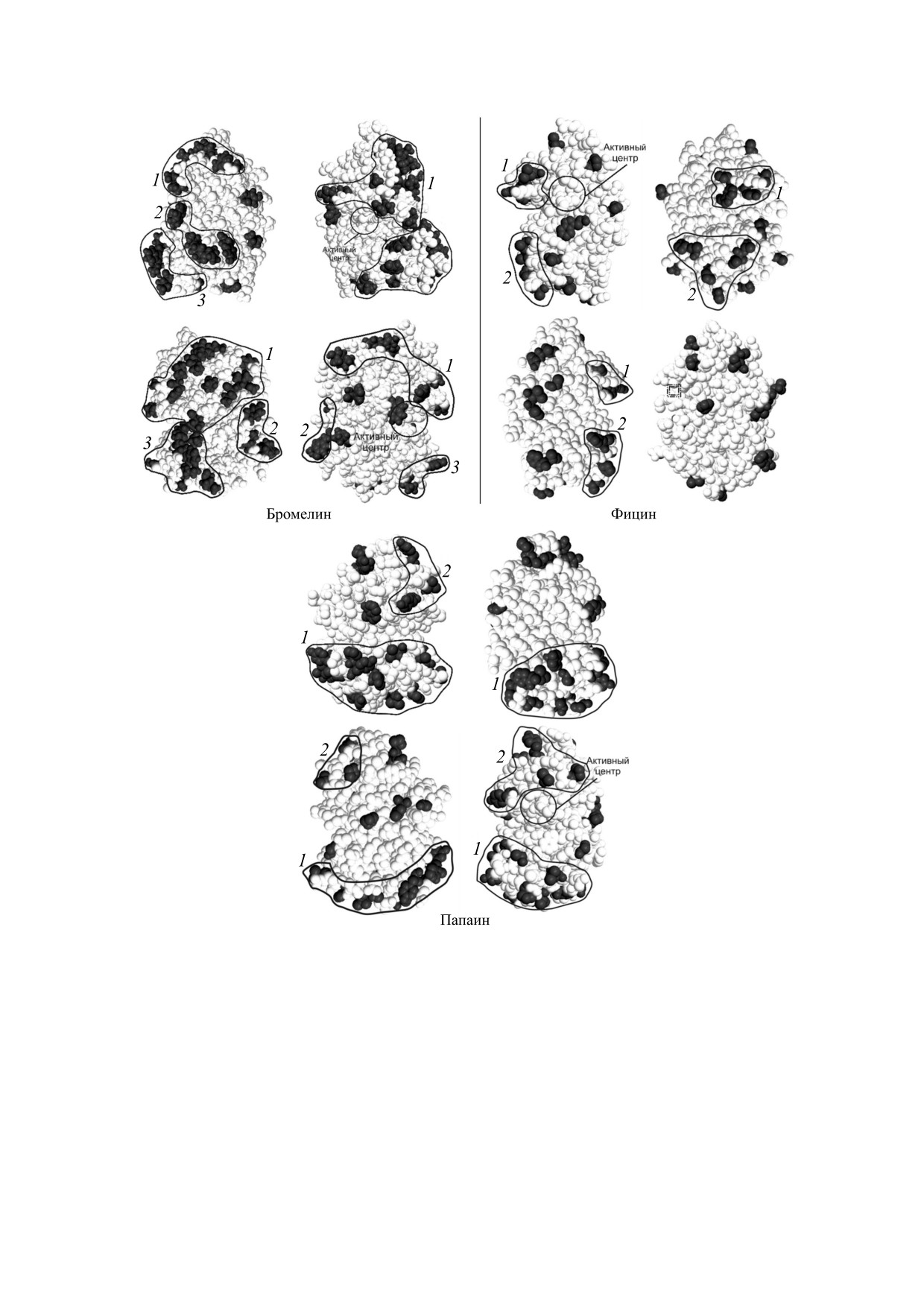
жительно заряженные аминокислоты (рис. 1).
наблюдается скоплений сайтов связывания с
Для бромелина и папаина таковыми являются
ними.
скопления 1 и 3, для фицина - скопление 2. Это
может указывать на вероятное связывание с дан-
Поскольку кластеры гидрофобных аминокис-
ными участками отрицательно заряженного но-
лот, содержащие большое количество остатков,
сителя при иммобилизации и, как следствие,
находятся в непосредственной близости к актив-
экранирование субстрата от активного центра
ному центру для всех исследуемых ферментов и
цистеиновых протеаз и значительную потерю ак-
высока вероятность их связывания с носителем с
тивности. В то же время на удаленном от актив-
перекрыванием последнего, мы можем предпо-
ного центра участке молекулы фицина имеется
ложить, что гидрофобные матрицы наименее
скопление 1, в котором преобладают отрицатель-
перспективны для иммобилизации бромелина,
но заряженные аминокислоты. В связи с этим
фицина и папаина (рис. 2).
БИОФИЗИКА том 67
№ 1
2022
18
ПАНКОВА и др.
Рис. 1. Кластеры заряженных аминокислотных остатков на поверхности молекул бромелина, фицина и папаина (1, 2, 3, 4 -
номера кластеров; кругом обозначен активный центр фермента; каждое следующее изображение представляет собой
молекулу, повернутую на 90° относительно предыдущего изображения). Серым цветом обозначены положительно
заряженные скопления, черным цветом - отрицательно заряженные.
БИОФИЗИКА том 67
№ 1
2022
ВОЗМОЖНАЯ РОЛЬ КЛАСТЕРОВ ЗАРЯЖЕННЫХ АМИНОКИСЛОТ
19
Рис. 2. Кластеры гидрофобных аминокислотных остатков на поверхности молекул бромелина, фицина и папаина (1, 2, 3 -
номера кластеров; кругом обозначен активный центр фермента; каждое следующее изображение представляет собой
молекулу, повернутую на 90° относительно предыдущего изображения).
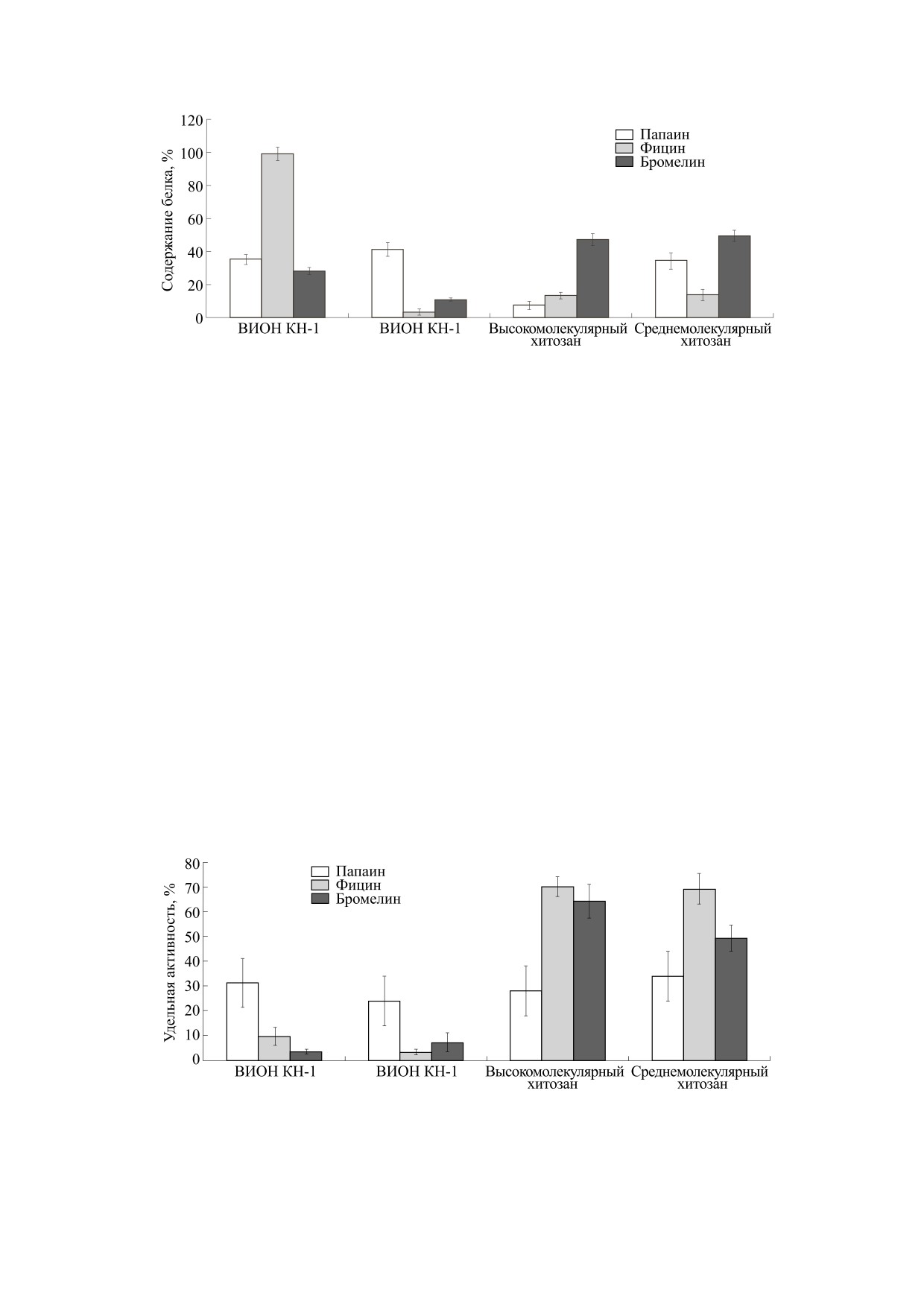
В ходе проведения эксперимента установлено,
ного на матрице ионообменных волокон ВИОН
что наибольшее содержание белка регистрирует-
КН-1 (~95%) и папаина, иммобилизованного на
ВИОН АН-1 (~40%) (рис. 3).
ся в препаратах бромелина, иммобилизованного
на высокомолекулярном и среднемолекулярном
Высокая удельная активность наблюдается у
хитозанах (~50% от количества фермента в иммо-
гетерогенных биокатализаторов на основе цисте-
билизационной среде), фицина, адсорбирован-
иновых протеаз, адсорбированных на высокомо-
БИОФИЗИКА том 67
№ 1
2022
20
ПАНКОВА и др.
Рис. 3. Содержание белка (в %) в препаратах иммобилизованных цистеиновых протеаз. За 100% принималось первоначаль-
ное содержание фермента в иммобилизационной среде (40 мг).
лекулярном и среднемолекулярном хитозанах:
иммобилизации бромелина, фицина и папаина
для бромелина - 65% от активности фермента в
на положительно заряженных полимерах будут
растворе до его иммобилизации, для фицина -
преимущественно образовываться водородные
70%, для папаина - 30% (рис. 4).
связи, а также электростатические взаимодей-
ствия.
ЗАКЛЮЧЕНИЕ
Приведенные в статье материалы могут быть
Для иммобилизации цистеиновых протеаз
использованы для решения некоторых задач в ме-
наиболее перспективны положительно заряжен-
дицине: 1) получение препаратов пролонгиро-
ные носители. В качестве такого материала могут
ванного действия, благодаря стабилизации и уве-
выступать хитозаны с молекулярными массами
личению времени полужизни фермента,
200-350 кДа, сорбция на которых позволяет со-
2) уменьшение диффузии вещества в организме,
хранить для бромелина 65% от его первоначаль-
3) направленное регулирование оптимумов
ной активности в растворе, для фицина - 70%,
функционирования препарата (температурный
для папаина - 30%.
оптимум, оптимум рН).
Положительно заряженные носители, вероят-
но, будут связываться с молекулами цистеиновых
протеаз без экранирования субстрата от активно-
ФИНАНCИPОВАНИЕ РАБОТЫ
го центра фермента, поскольку в непосредствен-
ной близости к их активному центру не наблюда-
Исследование выполнено при финансовой
ется кластеров отрицательно заряженных ами-
поддержке Российского научного фонда (проект
нокислотных остатков. При адсорбционной
№21-74-20053).
Рис. 4. Удельная активность (в %) цистеиновых протеаз при их иммобилизации на различных типах носителей. За 100%
принята удельная активность фермента до его адсорбции, наблюдаемая при оптимальных условиях гидролиза азоказеина.
БИОФИЗИКА том 67
№ 1
2022
ВОЗМОЖНАЯ РОЛЬ КЛАСТЕРОВ ЗАРЯЖЕННЫХ АМИНОКИСЛОТ
21
КОНФЛИКТ ИНТЕРЕСОВ
12.
E. Amri and F. Mamboya, Am. J. Biochem. Biotech. 8
(2), 99 (2012).
Авторы заявляют об отсутствии конфликта
13.
13. G. Lowe, Tetrahedron 32 (3), 291 (1976).
интересов.
14.
H. A. Sathish, P. R. Kumar, and V. Prakash, Int. J. Bi-
ol. Macromol. 41, 383 (2007).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
15.
M. Akila, A. Sushama, and R. Kumaresan, Int. J.
Настоящая работа не содержит описания ис-
Pharm. Sci, 6 (9), 160 (2014).
следований с использованием людей и животных
16.
Д. Р. Байдамшина, Е. Ю. Тризна, М. Г. Холявка
в качестве объектов.
и др., Вестн. ВГУ. Сер. Хим. Биол. Фарм. 3, 53
(2016).
СПИСОК ЛИТЕРАТУРЫ
17.
М. Г. Холявка, В. Г. Артюхов, С. М. Сазыкина и
М. А. Наквасина, Хим.-фарм. журн. 51 (8), 39
1. Z. I. M. Arshad, A. Amid, F. Yusof, et al., Appl. Mi-
(2017).
crobiol. Biotechnol. J. 98, 7283 (2014).
18.
M. Holyavka, D. Faizullin, V. Koroleva, et al., Int. J.
2. J. A. Ataide, E. F. Gérios, P. G. Mazzola, and
Biol. Macromol. 180, 161 (2021).
E. B. Souto, Adv. Colloid Interface Sci. 254, 48 (2018).
3. L. C. L. Novaes, A. F. Jozala, A. M. Lopes, et al.,
19.
М. Г. Холявка, В. Г. Артюхов и С. М. Сазыкина,
American Institute of Chemical Engineers Biotechnol.
патент на изобретение
№ 2677343, заявка
Prog. Received, 2017), рр. 5-13.
№ 2017123459 (2019).
4. M. E. Errasti, C. L. Natalucci, and N. O. Caffini,
20.
S. Olshannikova, V. Koroleva, M. Holyavka, et al., J.
Appl. Biochem. Biotechnol. 186, 186 (2018).
Biotech. 280, 68 (2018).
5. K. Bhui, S. Tyagi, B. Prakash, and Y. Shukla, BioFac-
21.
М. Г. Холявка, В. Г. Артюхов и В. А. Королева, па-
tors 36, 474 (2010).
тент на изобретение
№ 2677858, заявка
6. T. C. Chang, P. L. Wei, P. T. Makondi, et al., PLoS
№ 2017123462 (2017).
One 14 (1), 1 (2019).
22.
D. R. Baidamshina, V. A. Koroleva, E. Yu. Trizna,
7. N. Amini, S. Setiasih, S. Handayani, et al., AIP Conf.
et al., Int. J. Biol. Macromol. 164, 4205 (2020).
Proc., 2018, 020071 (2018).
23.
М. Г. Холявка, В. Г. Артюхов и В. А. Королева, па-
8. R. Debnatha, N. Chatterjeeb, S. Das, et al., Toxicol.
тент на изобретение
№ 2677873, заявка
in Vitro 55, 24 (2019).
№ 2017123457, (2017).
9. K. B. Devaraj, P. R. Kumar, and V. Prakash, Agric.
Food Chem. 56, 11417 (2008).
24.
V. Koroleva, M. Holyavka, S. Olshannikova, et al., in
10. L. Feijoo-Siota and T. G. Villa, Food Bioprocess
Abstr. Book 43rd FEBS Congr. (Prague, Czech Repub-
lic, 2018), р. 228.
Technol. 4, 1066 (2011).
11. A. Homaei, R. Stevanato, R. Etemadipour, and
25.
О. О. Логинова, М. Г. Холявка, В. Г. Артюхов и
R. Hemmati, Biocatal. Agricultural Biotech. 10, 360,
А. С. Беленова, Фундаментальные исследования
(2017).
11 (3), 484 (2013).
Possible Role of Charged Amino Acids Clusters on the Surface of Cysteine Proteases
for Preserving Activity when Binding with Polymers
S.M. Pankova*, **, F.A. Sakibaev**, M.G. Holyavka**, ***, V.G. Artyukhov**
*Voronezh State Medical University named after N.N. Burdenko, Studencheskaya ul. 10, Voronezh, 394036 Russia
**Voronezh State University, Universitskaya pl. 1, Voronezh, 394018 Russia
***Sevastopol State University, Universitetskaya ul. 33, Sevastopol, 299053 Russia
The composition and arrangement of charged and hydrophobic amino acid residues on the surface of brome-
lain, ficin, and papain molecules have been investigated, the percentage ratio of different types of amino acids
has been determined. It was found that charged and hydrophobic amino acid residues are unevenly distribut-
ed over the surface of molecules, forming areas of local accumulation (clusters). The assumption that the
most promising carriers for the immobilization of cysteine proteases are positively charged polymeric mate-
rials, which are likely to interact with one of the sites on the enzyme molecules surface located far from its
active center, is substantiated. It was revealed that the chitosans of high molecular weight (350 kDa) and me-
dium molecular weight (200 kDa) are more promising carriers for the immobilization of bromelain, ficin, and
papain than ion-exchange fibers VION KN-1 and VION AN-1. Sorption on chitosans made it possible to
preserve from 30% (for papain) to 70% (for ficin) of the enzyme activity in comparison with their initial ac-
tivity in solution.
Keywords: bromelain, ficin, papain, cation-exchange fiber VION KN-1, anion-exchange fiber VION AN-1, chi-
tosan, clusters of amino acids
БИОФИЗИКА том 67
№ 1
2022