БИОФИЗИКА, 2022, том 67, № 1, с. 37-72
БИОФИЗИКА КЛЕТКИ
УДК 577.3: 535.379
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
БИОЛОГИЧЕСКИХ ОБЪЕКТОВ. III. ФИЗИЧЕСКИЕ МЕТОДЫ
© 2022 г. Е.В. Наумова*, Ю.А. Владимиров**, В.В. Тучин***, ****, *****, ******,
В.А. Намиот**, И.В. Володяев**
*Институт физики полупроводников им. А.В. Ржанова СО РАН,
630090, Новосибирск, просп. Академика Лавpентьева, 13
**Московский государственный университет имени М.В. Ломоносова, 119991, Москва, Ленинские горы, 1
***Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского,
410012, Саратов, ул. Астраханская, 83
****Национальный исследовательский Томский государственный университет, 634050, Томск, просп. Ленина, 36
*****Институт проблем точной механики и управления РАН - обособленное подразделение ФИЦ «Саратовский
научный центр РАН», 410028, Саратов, ул. Рабочая, 24
******Институт биохимии им. А.Н. Баха ФИЦ «Фундаментальные основы биотехнологии» РАН,
119071, Москва, Ленинский проспект, 33/2
E-mail: naumova@yandex.ru
Поступила в редакцию 23.08.2021 г.
После доработки 25.10.2021 г.
Принята к публикации 27.10.2021 г.
Статья является третьей, завершающей частью обзора методов исследования сверхслабого свечения
биологических объектов. В первой части были рассмотрены общие вопросы (история исследова-
ний, основная терминология и т.п.), во второй представлен анализ методик биологического детек-
тирования. Третья часть обзора посвящена физическим методам исследований сверхслабого свече-
ния биологических объектов: кратко описаны основные устройства и принципы детектирования, а
также способы повышения соотношения сигнал/шум, приведены схемы ряда установок и особен-
ности различных методов исследования с примерами результатов, рассмотрены перспективы даль-
нейшего развития техники и направлений исследований сверхслабого свечения биологических
объектов.
Ключевые слова: сверхслабое свечение биологических объектов, хемилюминесценция, техника
регистрации сверхслабых излучений в оптическом диапазоне, спектральный анализ, биофотоника,
фотоэлектронные умножители, CCD-камеры.
DOI: 10.31857/S0006302922010057
Сверхслабое свечение (ССС) биологических
естественной вариабельности биологических де-
текторов, необходимо было многократно повто-
объектов было обнаружено А.Г. Гурвичем благо-
рять эксперименты, причем в каждой серии ин-
даря стимулирующему воздействию его ультра-
дивидуально подбирать продолжительность экс-
фиолетовой (УФ) компоненты на деление клеток.
понирования; биологические детекторы не
Первые годы для детектирования этой компонен-
позволяли оценить интенсивность излучения.
ты, получившей название митогенетического из-
Подробнее проблемы методик биологического
лучения, использовали только биологические
детектирования, в том числе их недостаточная
объекты. Использование в качестве детекторов
воспроизводимость и доказательность, были рас-
биологических объектов имело целый ряд недо-
смотрены в ч. 2 настоящего обзора [1].
статков: оно было чрезвычайно трудоемким и
длительным, требовало очень тщательного со-
В первые годы после открытия А.Г. Гурвича
блюдения методики; чтобы преодолеть проблемы начались активные попытки зарегистрировать
сверхслабое свечение биологических объектов
без применения биологических детекторов - фи-
Сокращения: ССС - сверхслабое свечение, УФ - ультра-
фиолетовый, ФЭУ - фотоэлектронный умножитель, ИК - зическими и физико-химическими методами.
инфракрасный, АФК
- активные формы кислорода,
Ряд предложенных методов - по нарушению
МКП - микроканальные пластины, ОПА - оптические
просветляющие агенты, ОПТ - оптическое просветление
формирования колец Лизеганга [2-4], по измене-
ткани, ПП - показатель преломления.
нию скорости флокуляции [5, 6], разложения пе-
37
38
НАУМОВА и др.
рекиси водорода [4, 7] - обладали теми же недо-
ку поглощение фотона вызывает генерацию не
статками, в первую очередь, чувствительностью к
более чем одного фотоэлектрона. Например, в
многочисленным факторам, которые невозмож-
ФЭУ лавина на выходе фотоумножительного
но было нормировать или устранить. Чувстви-
блока, созданная одним фотоэлектроном, состав-
тельность фотографических методов в
1920-
ляет 106-109 электронов.
1930-х гг. также была недостаточной для реги-
страции излучения столь низкой интенсивности
Наиболее важно при регистрации сверхслабых
[8, 9], даже при экспонировании в течение не-
излучений соотношение «сигнал/шум». Эффек-
скольких суток [10].
тивность фотоэлектрического преобразования
характеризуется квантовым выходом, т.е. сред-
Первыми физическими приборами, с помо-
ним количеством эмитируемых фотоэлектронов
щью которых было зарегистрировано ССС био-
на падающий фотон. Квантовый выход представ-
логических объектов, стали модифицированные
ляет собой произведение коэффициента погло-
счетчики Гейгера-Мюллера [11-14] (см. ниже
щения фотонов и коэффициента, характеризую-
раздел «Исследование ультрафиолетовой компо-
щего количество фотоэлектронов, эмитируемых
ненты сверхслабого свечения с помощью моди-
при поглощении фотона. Максимальный кванто-
фицированных счетчиков Гейгера-Мюллера»), с
вый выход современных ФЭУ, т.е. квантовый вы-
их помощью было обнаружено также ССС ряда
ход на длине волны, соответствующей макси-
модельных химических систем [15], причем ис-
мальной чувствительности, достигает для некото-
следования проводились только в среднем УФ-
рых материалов фотокатодов 50%, у твердо-
диапазоне, в соответствии с чувствительностью
тельных устройств максимальный квантовый вы-
используемых фотокатодов.
ход выше. Например, для CCD- и EMCCD-камер
По ряду причин, во многом историко-полити-
он достигает значений более 90%. Близкой харак-
ческого характера (подробнее см. ч. 1 данного об-
теристикой является спектральная чувствитель-
зора [16], а также обзоры [17-20]) работы по ис-
ность, выражаемая в мА/Вт, которая показывает
следованию митогенетического излучения пол-
отношение регистрируемого тока к мощности па-
ностью прекратились в Европе и США с началом
дающего излучения в зависимости от длины вол-
Второй мировой войны, а в СССР были закрыты
ны. Темновой ток (темновой счет), который
после августовской сессии ВАСХНИЛ 1948 г.
показывает интенсивность потока электронов,
регистрируемого в отсутствие освещения, обу-
В середине 1950-х годов явление сверхслабого
словлен в основном тепловой генерацией носите-
свечения биологических объектов было «переот-
лей заряда (которую можно снизить на несколько
крыто» с помощью фотоэлектронных умножите-
лей (ФЭУ) [21, 22], и далее почти все работы в
порядков за счет охлаждения), а также наличием
радиации, космических излучений и т.п. В CCD-
этом направлении были посвящены ССС в диа-
матрицах существенное значение имеют еще шу-
пазоне 370-1270 нм, т.е. в области видимого,
мы считывания (их снижение за счет аппаратного
ближнего инфракрасного (ИК) и ближнего уль-
и программного биннинга будет описано в разде-
трафиолетового диапазонов, где по сравнению со
средним УФ-диапазоном одновременно выше
ле «Системы 2D-изображения сверхслабых све-
чений»). Шумы, возникающие при умножении
интенсивность ССС биообъектов и модельных
электронного потока в ФЭУ, т.е. как колебания
химических систем, прозрачность биологических
коэффициента усиления полезного сигнала, так
сред и чувствительность большинства используе-
и импульсы, порождаемые лавинами, образовав-
мых детекторов (см. обзоры [23-27]).
шимися за счет термоэлектронов, эмитирован-
Практически все технические устройства, ко-
ных в блоке усиления, в режиме счета фотонов
торые применялись и применяются в настоящее
достаточно эффективно можно убрать на аппа-
время для регистрации ССС, основаны на ис-
ратном уровне. Кроме того, само ССС имеет есте-
пользовании внешнего фотоэффекта (например,
ственные флуктуации, так называемый дробовой
газоразрядные счетчики и ФЭУ) или внутреннего
шум, и аналогичный шум возникает за счет веро-
фотоэффекта (например, CCD-камеры (CCD -
ятностного характера процессов поглощения
charge-coupled device), однофотонные лавинные
фотонов и генерации носителей заряда.
фотодиоды). Каждый такой прибор обеспечивает
фотоэлектрическое преобразование, т.е. образова-
Устройства с внутренним фотоэффектом поз-
ние носителей электрического заряда за счет
воляют обеспечить более высокий квантовый вы-
энергии поглощенных фотонов, усиление потока
ход, но обычно имеют более высокие собствен-
зарядов или их длительное накопление, и регистра-
ные шумы, чем устройства с внешним фотоэф-
цию с помощью электронных схем, которая часто
фектом, например, для ФЭУ минимальный
сопровождается обработкой, направленной на
уровень темнового счета примерно на четыре по-
подавление шумов. Усиление или длительное на-
рядка ниже, чем у однофотонных лавинных дио-
копление необходимо, чтобы получить достаточ-
дов при сравнимых температурах. Сами твердо-
ный для регистрации поток электронов, посколь-
тельные детекторы с внутренним фотоэффектом
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
39
как правило компактнее и легче вакуумных элек-
HPD), в которых электроны, вылетевшие из фо-
тронных детекторов, т.е. устройств с внешним
токатода, разгоняются в вакууме сильным элек-
фотоэффектом; они не требуют источника высо-
трическим полем между фотокатодом и лавин-
кого напряжения, но часто не менее громоздки за
ным диодом и бомбардируют полупроводник, по-
счет системы охлаждения.
рождая лавину электронов за счет ударной
ионизации [35].
В настоящее время наиболее распространен-
В настоящее время для прикладных биомеди-
ными устройствами для регистрации ССС биоло-
цинских задач, не требующих спектрального и
гических объектов без пространственного разре-
пространственного разрешения, для регистрации
шения являются ФЭУ (см. раздел «Исследования
ССС обычно используют портативные хемилю-
сверхслабого свечения с помощью ФЭУ без про-
минометры с ФЭУ без охлаждения. Иногда для
странственного и спектрального разрешения»), а
регистрации ССС биологических объектов при-
для получения двумерных изображений - CCD-
меняют серийные устройства другого назначе-
камеры, см. раздел «Получение изображений с
ния, которые могут использоваться в режиме хе-
помощью твердотельных устройств (CCD-ка-
милюминометра, например, жидкостные сцин-
мер)». Лавинные фотодиоды, работающие в ре-
тилляционные счетчики с ФЭУ
[36]. Для
жиме Гейгера (Geiger mode avalanche photo diode,
исследовательских целей обычно используют
GmAPD), иначе называемые однофотонными ла-
специально сконструированные лабораторные
винными диодами (single photon avalanche diode,
установки.
SPAD) [28], широко применяются в технике, но
для исследования ССС биологических объектов
Хотя светочувствительность современных фо-
они использовались очень редко [29-31]. Их пре-
томатериалов позволяет регистрировать сверх-
имуществами по сравнению с ФЭУ являются де-
слабые излучения (см., например, убедительную
шевизна и высокий квантовый выход (до 90%), а
серию работ по регистрации ССС биообъектов с
недостатками - существенно более высокие шу-
помощью фотопленок, выполненную А.П. Бой-
мы на единицу площади фоточувствительной по-
ченко [37-40], и рис. 13 в разделе «Системы 2D-
изображения сверхслабых свечений»), фотогра-
верхности (обычно >105 квантов⋅см-2⋅с-1) и ма-
фические методы не получили широкого распро-
лая, менее 1 мм2, рабочая площадь (последнее яв-
странения. В первую очередь это связано с про-
ляется существенным недостатком в связи с
блемами количественной характеризации интен-
проблемами фокусировки ССС и его низкой ин-
сивности излучения фотографическим методом.
тенсивностью). Вместе с тем отдельные работы
СПЕЦИФИКА И ТЕХНИЧЕСКИЕ ОСО-
продемонстрировали приемлемый уровень соот-
БЕННОСТИ ИССЛЕДОВАНИЙ СВЕРХСЛА-
ношения сигнал/шум. Например, в работе [29]
БОГО СВЕЧЕНИЯ, КЛАССИФИКАЦИЯ МЕ-
для регистрации ССС срезов мозга с помощью
ТОДИК
кремниевого лавинного диода диаметром 50 мкм
использовали коническое оптоволокно с вход-
Специфика исследований ССС связана в
ным диаметром 975 мкм и выходным диаметром
первую очередь с низкой интенсивностью и рас-
50 мкм, что позволило многократно увеличить
сеянным характером излучения, а также с необ-
светосбор. При этом темновой счет и общий
ходимостью поддерживать исследуемые биообъ-
квантовый выход устройства при охлаждении
екты в определенных физиологических условиях.
жидким азотом (77 К) составили 0.08 счетов в се-
Для повышения соотношения «сигнал/шум» ис-
кунду и 5%, соответственно заявленная чувстви-
пользуется как снижение шумов устройств реги-
страции излучения, так и повышение сигнала за
тельность составляла порядка 10-19 Вт [29], а со-
счет эффективного светосбора, причем возмож-
отношение «сигнал/шум» - около 0.6. Устрой-
ности фокусировки ограничены из-за рассеянно-
ства формирования изображений на основе
го характера излучения.
массивов однофотонных лавинных диодов, кото-
рые уже нашли многочисленные применения в
Охлаждение детекторов. Основной причиной
других областях биофотоники [32] (см. обзор по
темновых шумов являются термоэмиссионные
технике этих устройств [33], а также некоторые
электроны, и для большинства используемых фо-
сравнения технических характеристик в работе
точувствительных материалов термоэмиссия рез-
[34]), насколько нам известно, пока не использо-
ко уменьшается с понижением температуры.
вались для исследований ССС, основными при-
Охлаждение ФЭУ в некоторых отдельных работах
чинами этого являются высокие шумы и относи-
проводили с помощью твердой углекислоты [21,
тельно малый коэффициент заполнения поверх-
22, 41], но основная масса научных исследований
ности. Также нам неизвестны работы, в которых
ССС с помощью ФЭУ в первые десятилетия была
для регистрации ССС используются гибридные
выполнена с охлаждением жидким азотом ([42],
устройства, т.е. сочетающие электронно-вакуум-
см. также обзоры [23-25]). Разработки в области
ные и твердотельные элементы, например, ги-
фотокатодов привели к повышению соотноше-
бридные фотодетекторы (hybrid photo-detectors,
ния сигнал/шум и обеспечили возможность при-
БИОФИЗИКА том 67
№ 1
2022
40
НАУМОВА и др.
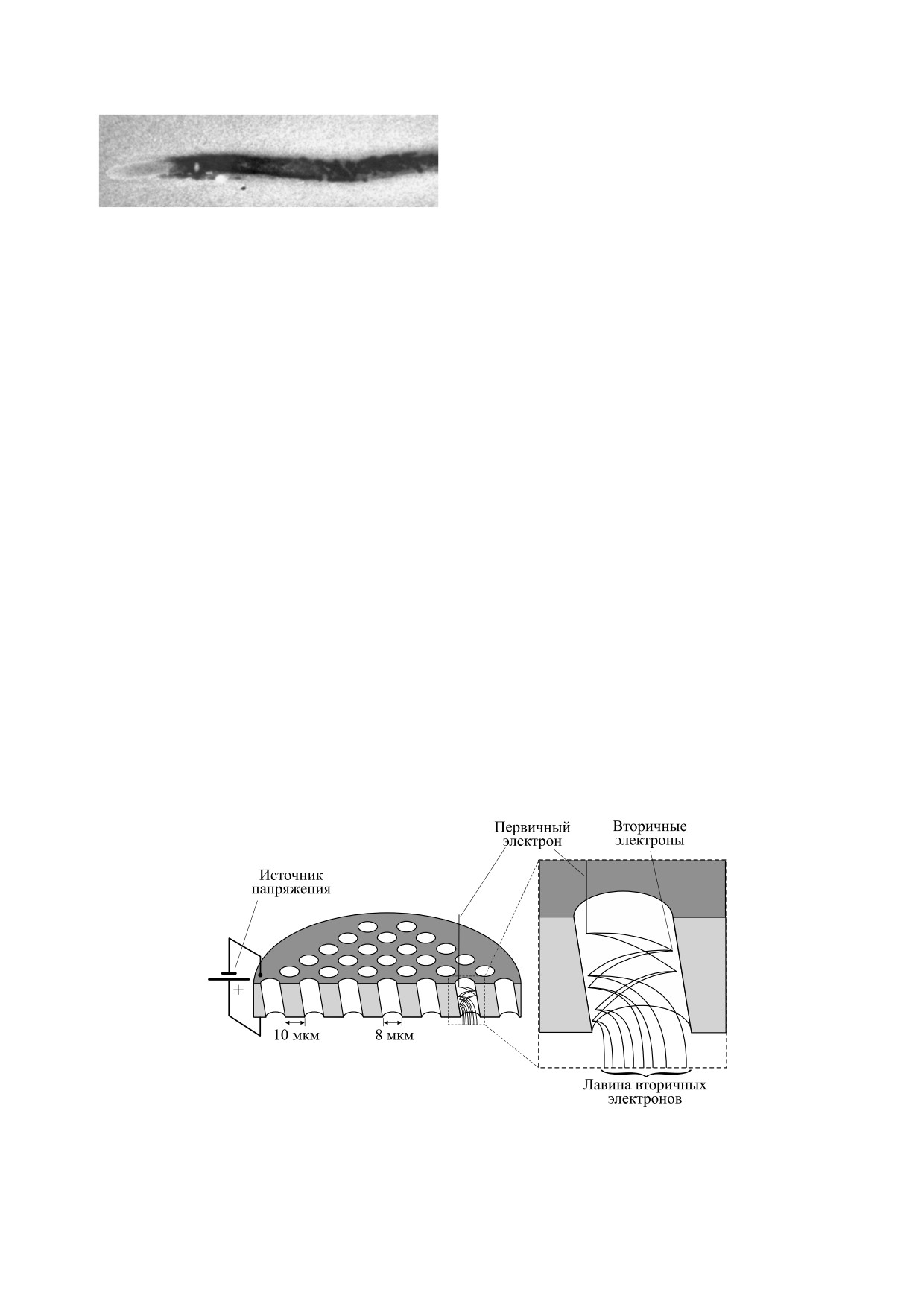
Рис. 1. Схемы установок для измерения ССС: (a) - установка групп Ю.А. Владимирова [50, 54] и Р.Ф. Васильева [55, 58];
(б) - установка группы Б.Н. Тарусова [56, 57]. (Из работы [59].)
менения ФЭУ с менее глубоким охлаждением
площадь окна. Такое расположение, во-первых,
(например, в конце 1960-х годов уже использова-
максимально снижает нагрев ФЭУ от кюветы, а
ли ФЭУ с охлаждением проточной холодной во-
во-вторых, обеспечивает максимальный свето-
дой, в настоящее время из компактных вариантов
сбор при минимальном объеме исследуемого об-
охлаждения обычно используются элементы
разца. Кроме того, используются схемы с боко-
Пельтье) и без охлаждения, что упростило экспе-
вым расположением кюветы и ФЭУ (см., напри-
рименты и уменьшило размеры установок, при-
мер, работу [50] и рис. 1), в частности, такой
годных для решения большинства практических
выбор бывает связан с конструктивными особен-
задач. В научных исследованиях, предъявляющих
ностями системы охлаждения (например, сосуд
повышенные требования к соотношению «сиг-
Дьюара). Используются также и многокюветные
нал/шум», например, при спектральных исследо-
схемы c автоматической сменой эксперименталь-
ваниях ССС, продолжает использоваться умерен-
ных и контрольных образцов. При исследованиях
ное охлаждение ФЭУ; CCD -камеры, тепловые
биообъектов сложной геометрии (растений, жи-
шумы у которых выше, практически всегда охла-
вотных, человека) их размещение относительно
ждают до криогенных температур или близких к
детектора в значительной мере определяется
ним, обычно -(100-120)°С [43-47], интенсифи-
удобством доступа к исследуемой поверхности.
цированные CCD-камеры (Intensified CCD -cam-
Иногда используют световоды [51] или оптиче-
era, ICCD) для получения изображений охлажда-
ские волокна [52], и тогда расположение объекта
ют до -(45-50)°С [48, 49].
относительно детектора не играет существенной
роли. При этом, чтобы уменьшить количество
При исследованиях ССС биологических объ-
границ отражения, иногда жидкие образцы рас-
ектов и модельных химических систем, как пра-
полагают непосредственно на световоде, без кю-
вило, требуется поддержание определенного тем-
вет [53].
пературного режима. Термостатирование биоло-
гических объектов в установках обычно
Важное значение оптического пропускания
предусматривается в пределах 0-50°С, при этом
элементов, расположенных между источником и
разница температур между охлаждаемым детекто-
детектором, демонстрирует пример из ранней ис-
ром и нагреваемым до физиологических темпера-
тории применения ФЭУ для исследований ССС.
тур образцом может составлять порядка 150 гра-
Переход от схемы, в которой ФЭУ размещался в
дусов. С учетом того, что образец и детектор же-
сосуде Дьюара с жидким азотом, а излучение вы-
лательно размещать на предельно близком
ходило через кварцевое окно напротив окна ФЭУ
расстоянии для максимального светосбора и раз-
(рис. 1а) [50, 54, 55], к схеме на рис. 1б, когда ФЭУ
делять минимальным количеством поверхностей
размещался в пенопластовом термосе с жидким
для снижения потерь на отражение, поддержание
азотом, и отверстие в пенопласте плотно прилега-
такой значительной разности температур и ис-
ло к входному окну ФЭУ [56, 57], позволил
ключение конденсации на поверхностях, разде-
уменьшить светопотери за счет устранения двух
ляющих образец и детектор, представляет собой
стекол (стенки сосуда Дьюара) и слоя жидкого
непростую задачу.
азота (между окном ФЭУ и окном в стенке сосуда
Оптические схемы, режим освещения. ФЭУ
Дьюара) и приблизить источник к детектору.
обычно располагается под кюветой для образцов
Именно это простое техническое решение повы-
с плоским дном, перекрывающим всю рабочую
сило чувствительность установок почти на два
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
41
порядка, что позволило зарегистрировать спон-
после предварительного облучения светом (т.е.
танное ССС животных клеток и тканей и привело
задержанной люминесценции тоже требуется
к началу масштабных исследований ССС. Обнару-
освещение образцов, часто это реализуют с помо-
женное прижизненное ССС поверхности органов -
щью оптоволокна [51, 52] или световода [65]. Для
мозга, мышц и печени крыс и кроликов в диапазоне
освещения образцов используют широкополос-
360-1200 нм было значительно слабее по интенсив-
ный источник, например, ксеноновую лампу с
фильтрами[65], фотодиоды или лазер [51, 52].
ности (порядка 40-50 квантов⋅см-2⋅с-1), чем ССС
исследованных ранее растительных объектов.
Классификация методик исследований. Мето-
дики исследования ССС биообъектов можно
При исследованиях без временного и про-
классифицировать по различным принципам:
странственного разрешения с помощью ФЭУ об-
разец, как правило, размещают по возможности
- по использованию факторов, непосред-
ближе к рабочей поверхности фотокатода для
ственно влияющих на хемилюминесценцию
увеличения светосбора, а специальные оптиче-
(спонтанная - индуцированная - активирован-
ские элементы не используют.
ная/усиленная хемилюминесценция);
- по временному разрешению - исследования
Повышенные требования к оптической систе-
ССС в динамике и без (из исследований динами-
ме предъявляются при исследованиях спектров
ки ССС следует выделить исследования статисти-
(см. раздел «Спектральный анализ сверхслабых
ческих особенностей распределения потока фо-
свечений») и при получении 2D-изображений
ССС (раздел «Cистемы 2D-изображения сверх-
тонов по времени, анализ шумовой компоненты
ССС);
слабых свечений»). Для получения качественного
изображения ССС требуются высокое пропуска-
- по пространственному разрешению - с про-
ние и большая числовая апертура, поэтому опти-
странственным разрешением и без него;
ческая часть разрабатывается специально, напри-
- по типам биообъектов - in vitro и in vivo; жид-
мер, в группе Х. Инабы (H. Inaba) были разрабо-
кие среды (культуры клеток, физиологические
таны три оптические системы, предназначенные
жидкости), ткани, многоклеточные организмы;
для получения изображений объектов разных
- по цели: исследования свойств самого ССС,
размеров, - от размера тела человека до соевого
в том числе при различных состояниях биообъек-
боба с увеличением 1/20, 1/3, и 1.0. Для повыше-
та, либо применение анализа ССС как инстру-
ния пропускания оптические системы проекти-
мента для характеризации состояния биологиче-
руются с минимальным количеством элементов.
ского объекта (например, определения функцио-
Для повышения светосбора при работе с детекто-
нальной активности нейтрофилов).
рами малой площади иногда используют кониче-
ские световоды [29].
ИССЛЕДОВАНИЕ УЛЬТРАФИОЛЕТОВОЙ
КОМПОНЕНТЫ СВЕРХСЛАБОГО СВЕЧЕ-
Следует отметить, что некоторым веществам, в
НИЯ С ПОМОЩЬЮ МОДИФИЦИРОВАН-
частности некоторым стеклам, свойственна до-
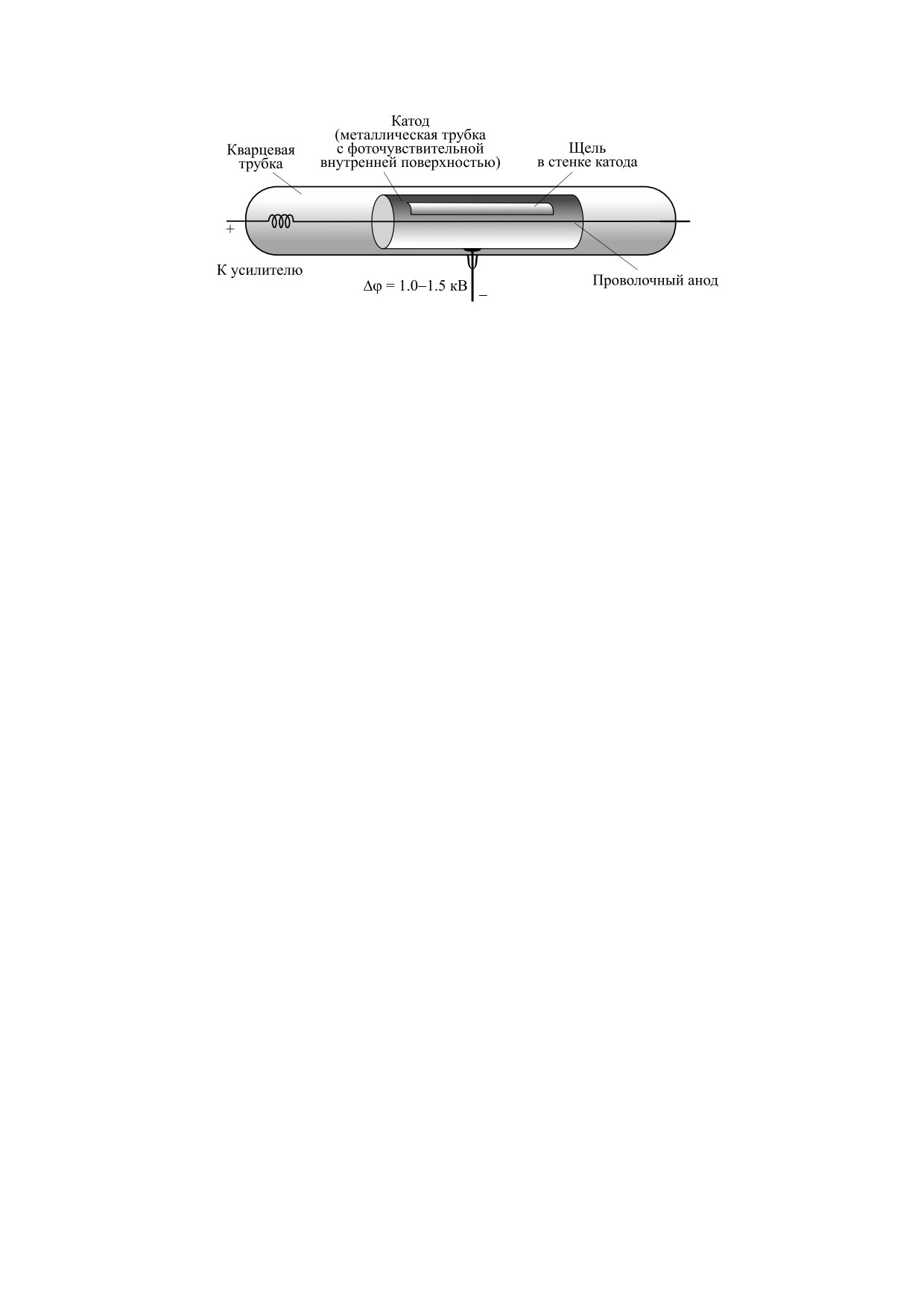
НЫХ СЧЕТЧИКОВ ГЕЙГЕРА-МЮЛЛЕРА
вольно продолжительная фосфоресценция, ин-
Первые применения модифицированных счетчи-
тенсивность которой может быть существенной в
ков ГейгераМюллера для регистрации сверхсла-
сравнении с ССС, поэтому необходимо избегать
бого свечения. Впервые зарегистрировать ССС с
попадания на исследуемые объекты и содержи-
помощью физического устройства удалось
мое камеры прямых солнечных лучей и яркого
Б. Раевскому [11] в 1930 г. Для этого он сконстру-
света. Проводить эксперименты желательно в
ировал УФ-чувствительную модификацию газо-
тщательно затемненном помещении, кроме того,
разрядного счетчика [66, 67] (рис. 2), разработан-
перед началом исследования необходимо изме-
ного Г. Гейгером и В. Мюллером [68, 69]. Катод
рять фон кюветы, который может быть достаточ-
счетчика представлял собой металлический ци-
но значимым. Обычно перед началом измерений
линдр с прорезанным окошком, на внутреннюю
рекомендуется некоторое время выдерживать ис-
поверхность цилиндра был нанесен фоточувстви-
следуемые объекты и кюветы в темноте, напри-
тельный слой. В центре цилиндра размещали
мер, в закрытой камере измерительного прибора
анод в виде тонкой проволоки, покрытой полу-
(рекомендуемое время составляет от нескольких
проводниковым слоем, соединенный с сопротив-
[60] до 15 мин [61]), камера должна быть полно-
стью светоизолированной. Следует учитывать,
лением ~1010 Ом. Разность потенциалов между
что световой режим может существенно влиять на
катодом и анодом достигала 1.5 кВ. Вся конструк-
само ССС, например, свечение в среднем УФ-
ция размещалась в кварцевой колбе, заполнен-
диапазоне некоторых биообъектов [62, 63] и мо-
ной инертным газом. Источник митогенетиче-
дельных биохимических систем [64] требует по-
ского излучения располагали снаружи колбы на-
стоянного присутствия слабого видимого света,
против окошка в катоде, так что излучение
что значительно затрудняет измерения. В экспе-
попадало через окошко на фоточувствительный
риментах, направленных на исследование ССС
слой. Квант света, попавший на фотослой, выби-
БИОФИЗИКА том 67
№ 1
2022
42
НАУМОВА и др.
Рис. 2. Фоточувствительная модификация счетчика Гейгера-Мюллера, предложенная Б. Раевским [11, 66, 67]. (Из работы
[70], с незначительными изменениями.)
вал из него электрон, который ускорялся элек-
- неправильное положение катода, приводив-
трическим полем и приводил к лавинообразной
шее к помехам со стороны электростатических
ионизации газа. Напряжение между анодом и ка-
полей счетчика [88];
тодом было меньше необходимого для дальней-
- недостаточный размер катода [86], или его
шего самостоятельного поддержания разряда, на-
неудачное положение [81], дающее малый свето-
копление более медленных ионов экранировало
сбор и соответственно низкое соотношение сиг-
анод и прерывало лавину. Электрический разряд
нал /шум;
регистрировался схемой с электрометром (в по-
- потеря чувствительности фоточувствитель-
следующих аналогичных установках других авто-
ного слоя [88];
ров иногда использовались автоматические счет-
- использование слишком большого сопро-
ные устройства [12]).
тивления, которое приводило к токам утечки по
поверхности счетчика [86];
Используя эту установку, автору удалось заре-
гистрировать излучение от корешка лука, каши-
- использование неизлучающих объектов [76,
цы лука и карциномы и оценить его интенсив-
84, 88].
ность ~10-100 квантов в секунду [11].
Негативные экспериментальные работы вы-
явили возможные источники систематических
Исследования сверхслабого свечения в период
ошибок, например, в конструкции счетчика, ис-
разработки и апробации различных модификаций
пользованного в работе [84] при приближении
счетчиков и методик измерения (1931-1935 гг.).
корня лука количество счетов возрастало на 50%
Целый ряд подобных модификаций счетчиков
из-за высокой чувствительности использованной
Гейгера-Мюллера для исследований ССС был
конструкции к влажности. В позитивных работах
выполнен известными специалистами-физиками
был получен ряд важных технических решений.
(Фр. Дессауэром [Fr. Dessauer] [71], В. Герлахом
Например, была предложена разностная схема
[W. Gerlach] [72], Г. Бартом [H. Barth] [73] и дру-
регистрации ССС [83, 89], в которой один счет-
гими, см. табл. 1). Вместе с тем в течение первых
чик измерял ССС объекта, а другой работал в тем-
пяти лет после работы Б. Раевского [67] УФ-чув-
новом режиме, вычитание шумов, связанных с
ствительные модификации счетчиков Гейгера-
космическими излучениями и другими помеха-
Мюллера были сами скорее предметом разрабо-
ми, существенно повышало соотношение «сиг-
ток, чем признанным измерительным инстру-
нал/шум». Такая схема была использована более
ментом: не только полученные результаты изме-
чем в 2000 успешных экспериментов по измере-
рений, но оценки параметров счетчиков, подхо-
нию ССС крови и мочи здоровых людей, крови
ды к их калибровке, и сама возможность
онкобольных, крови кроликов и некоторых окис-
лительных модельных систем (см. примеры ре-
применения счетчиков для детектирования мито-
зультатов на рис. 3) [89, 90].
генетического излучения ставились под сомне-
ние. Количество положительных и отрицатель-
Общей проблемой и позитивных, и негатив-
ных экспериментальных публикаций в этот пери-
ных работ первых пяти лет применения модифи-
од было сравнимо (см. табл. 1).
цированных счетчиков Гейгера-Мюллера для
исследования ССС было отсутствие должной ка-
Ниже приведены основные причины неудач
либровки. Методы калибровки находились в про-
при попытках зарегистрировать ССС с помощью
цессе развития и отличались у разных авторов на-
модифицированных счетчиков Гейгера-Мюлле-
столько, что сравнить чувствительности их при-
ра (по работе [87]):
боров между собой по этим данным практически
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
43
Таблица 1. Эксперименты 1930-1935 гг. по детектированию митогенетического излучения с помощью
модифицированных счетчиков Гейгера-Мюллера (из работы [74] с исправлениями и дополнениями)
Среднее
Оценка
Фоточувст-
Калибро-
Средства,
число
интенсив-
Публи-
вительная
вочная
исполь-
Резуль-
квантов на
Исследуемые объекты
ности,
кации
поверх-
длина
зуемые для
тат
1 регистри-
квантов·
ность
волны (нм)
калибровки
руемый счет
⋅см-2⋅с-1
Корни лука
+
Кашица из лука
+
Карцинома
+
Целлофа-
[11, 66,
Кашица из карциномы
+
Cd
102-103
265
новые
10-102
67, 75]
Яичный белок
+
фильтры
(термокоагуляция,
расщепление кислотой
и др.)
Фотоэмуль-
366
сии,
[76]
K
>104
266
скрещенные
Дрожжи
-
< 2000
254
призмы
Николя
Мышца лягушки
+
Кашица из мышцы
+
Светопогло-
Al
лягушки
[12, 77-79]
6⋅103
253.7
щающие
100-2000
Cd
Сердце лягушки
+
растворы
Химические/биохими-
+
ческие реакции
Корни лука
-
[80]
Бактерии
-
Кашица лука
-
Амальгама
5⋅102
230
Калибро-
Корни лука
-
< 5
Zn
105
340
ванная
Дрожжи
-
[81]
лампа на
Al
3⋅103
230
Куриные эмбрионы
-
< 30
расстоянии
260 м
Злокачественные опухоли
Mg
5⋅103
230
-
< 50
мышей
CuI, CuO,
Неста-
Химические
[82]
Cu2O, Cu,
+
бильно
окислительные реакции
Al
Кровь
+
Карциномы
+
[83]
Cd
Моча
+
Окислительные реакции
+
[72]
К2Cr2О7 + FeSО4
+
Яйца морского ежа
-
Сперматозоид
-
Дрожжи
-
Окислительные процессы
-
Калибро-
(кашица лука + H2O2,
[84]
Pt
6⋅103
250
ванные
<50
щели
спирт +H2O2,
бензальдегид + H2O2,
эфир+ H2O2,
эфир + Br2 + воздух)
БИОФИЗИКА том 67
№ 1
2022
44
НАУМОВА и др.
Таблица 1. Окончание
Среднее
Оценка
Фоточувст-
Калибро-
Средства,
число
интенсив-
Публи-
вительная
вочная
исполь-
Резуль-
квантов на
Исследуемые объекты
ности,
кации
поверх-
длина
зуемые для
тат
1 регистри-
квантов·
ность
волны (нм)
калибровки
руемый счет
⋅см-2⋅с-1
Кашица лука и корни
-
светофильтр
1400
230
Саркома мыши
-
[85]
Cd
(золь
<10-15
2400
253.7
Мышиные эмбрионы
-
K2Cr2O7)
Мышцы лягушки
-
Al
K2Cr2O7+FeSO4
+
[73]
Cu
Пищеварительные
+
CuI
процессы
Фильтры из
кварцевой
муки,
много-
Cd,
кратные
Дрожжи
-
[86]
Al
(2-5)⋅104
253.7
<300
отражения
Мышца лягушки
-
Zn
от гладких
кварцевых
поверх-
ностей
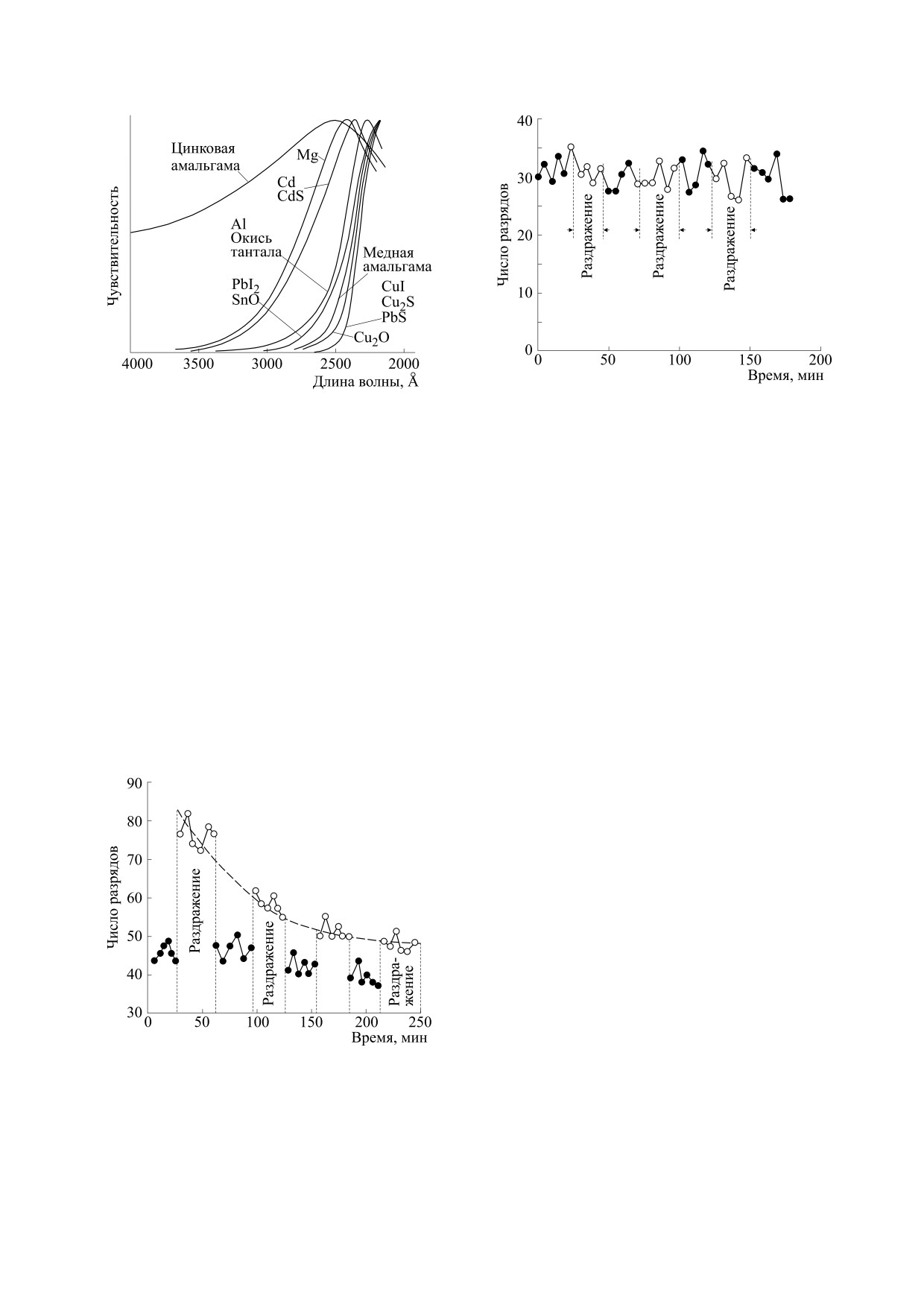
невозможно. Калибровку проводили на длинах
ния отличались по чувствительности иногда на
волн, приближенных к длинноволновой границе
два порядка, см. нормированные спектральные
спектра митогенетического излучения (см.
характеристики фотокатодов из различных мате-
риалов на рис. 4 в следующем подразделе. Осо-
табл. 1), это не позволяло даже грубо сравнить
бенности конструкций УФ-чувствительных счет-
чувствительность счетчиков в спектральной об-
чиков, методы калибровки и их применения для
ласти, на которую приходилась основная доля ре-
исследований ССС биообъектов в 1930-1935 гг.
гистрируемого излучения. Фотокатоды, обладаю-
наиболее подробно изложены в [78, 79], см. также
щие примерно одинаковой чувствительностью на
обсуждение проблем калибровки в работах [74,
калибровочных длинах волн, в середине спек-
трального диапазона митогенетического излуче-
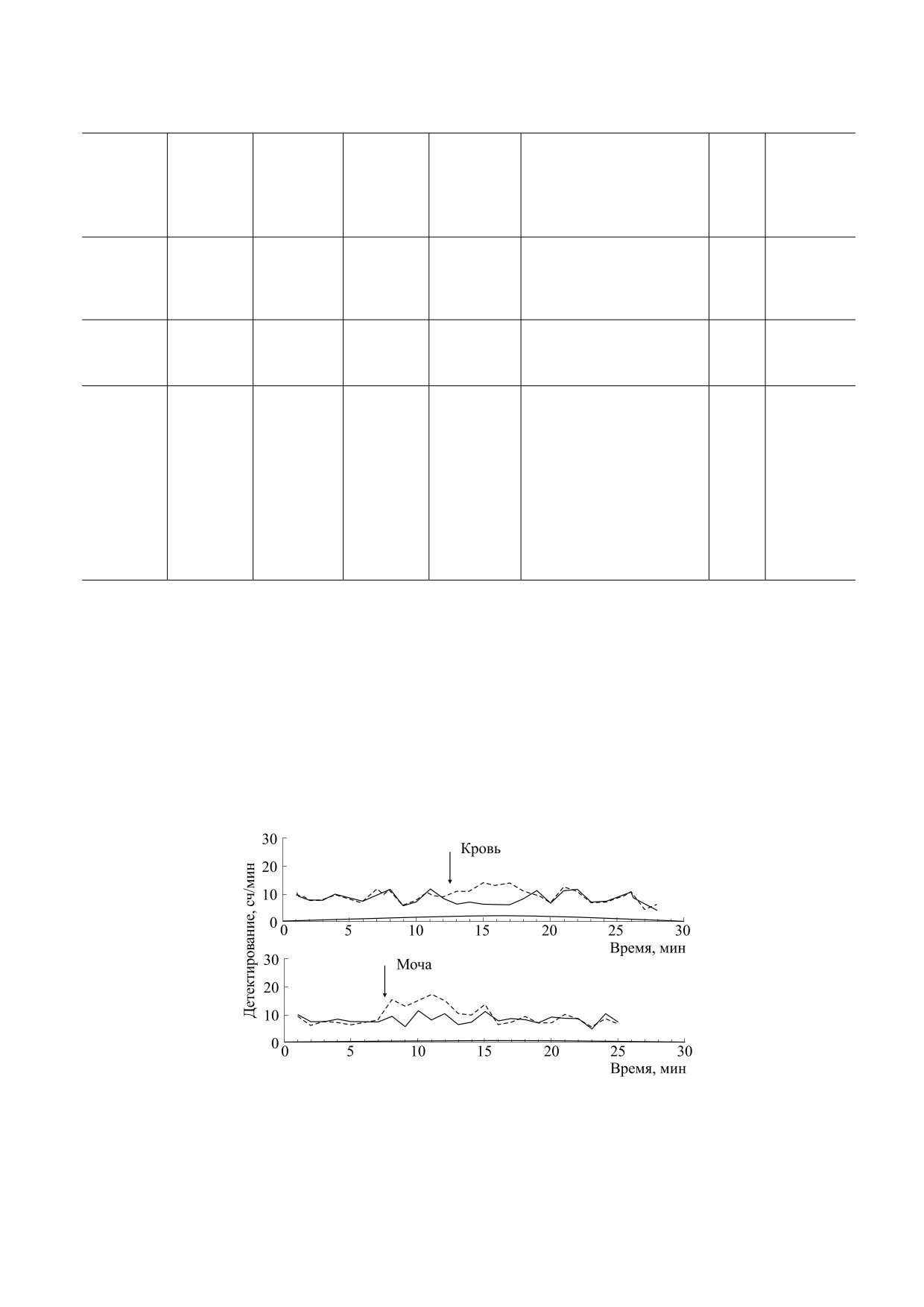
Рис. 3. Детектирование УФ-излучения с помощью разностной схемы с двумя модифицированными счетчиками Гейгера-
Мюллера: сверху - кровь здорового человека, снизу - моча здорового человека; сплошная линия - контрольный счетчик
(без образца), пунктирная линия - счетчик с образцом, стрелкой отмечено время внесения образца. (Из работы [89].)
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
45
Рис. 6. Исследование сверхслабого свечения умерщ-
Рис. 4. Нормированные спектры чувствительности мо-
вленного этанолом нерва лапы лягушки, периодически
дифицированных счетчиков Гейгера-Мюллера с раз-
раздражаемого идентично нерву на рис. 5 (см. спек-
личными материалами фотокатода. (Из работы [15], с
тральную чувствительность использованного алюми-
незначительными модификациями.)
ниевого фотокатода на рис. 4). (Из работы [15], с незна-
чительными модификациями.)
91] и некоторые технические параметры конкрет-
ных модификаций в работах [92-95].
слабому излучению нужного спектрального диа-
Усовершенствование счетчиков и признание
пазона была в достаточной мере подтверждена
метода регистрации сверхслабых свечений с помо-
(см. спектры чувствительности разных фоточув-
щью модифицированных счетчиков Гейгера-
ствительных материалов на рис. 4). С их помо-
Мюллера (1936-1939 гг.). Усовершенствование
щью было убедительно продемонстрировано
конструкций счетчиков - выбор фоточувстви-
сверхслабое свечение от биологических объек-
тельных материалов и технологии их обработки,
тов, индуцирующих митогенетический эффект,
оптимизация геометрии электродов, подбор ве-
т.е. способных влиять на митотический режим
личины сопротивления, состава газа и других
других объектов (рис. 5), при этом излучение от
параметров счетчиков, а также развитие методов
объектов, не вызывающих митогенетический
калибровки - позволили исследователям изго-
эффект, не регистрировалось (рис. 6).
товить приборы, чувствительность которых к
В работах [14, 87, 96], было доказано существо-
вание излучения у всех исследованных индукто-
ров митогенетического эффекта и приведены его
свойства:
- интенсивность 101-103 квантов⋅см-2⋅с-1;
- наличие ультрафиолетовой компоненты из-
лучения в пределах области 190-280 нм;
- корреляция митогенетического излучения
биообъектов (а также модельных систем) при
биологическом и физическом детектировании.
После 1935 г. негативных экспериментальных
работ по регистрации ССС модифицированными
газоразрядными счетчиками, насколько нам из-
вестно, не было, только положительные (следует
отметить, что эксперименты с модифицирован-
ными счетчиками Гейгера-Мюллера, описанные
Рис. 5. Исследование сверхслабого свечения периоди-
в негативной работе А. Холландера и В. Клауса
чески раздражаемого нерва лапы лягушки (алюминие-
1937 года [91], были проведены в 1935 г).
вый фотокатод, см. спектральную чувствительность на
рис. 4). (Из работы [15], с незначительными модифика-
Значение модифицированных счетчиков Гейге-
циями.)
ра-Мюллера в исследованиях ССС.
БИОФИЗИКА том 67
№ 1
2022
46
НАУМОВА и др.
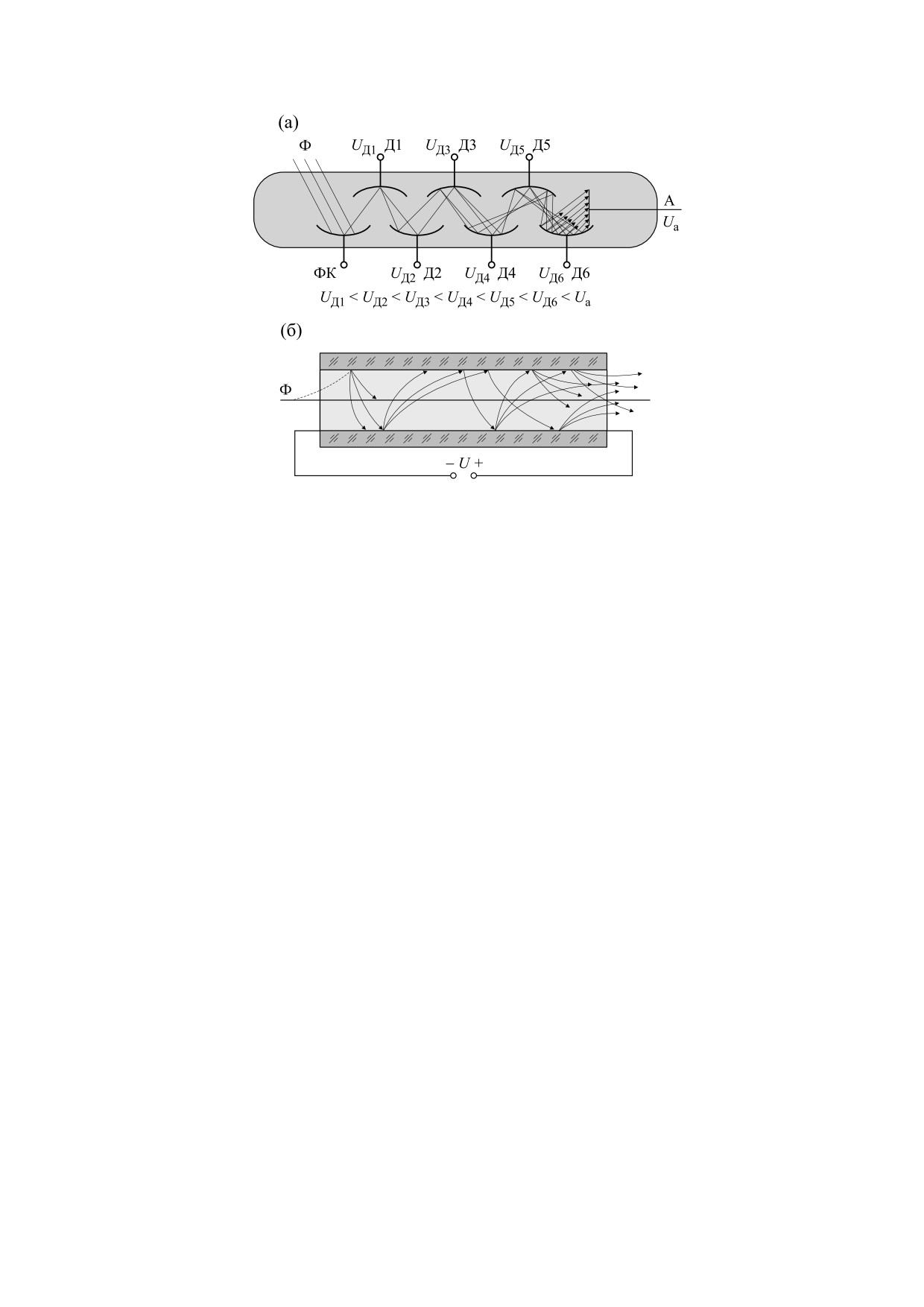
Рис. 7. Схема работы ФЭУ с различными вариантами электронного умножения: с системой динодов (а) и с канальным
умножением (б). Фотоны Ф падают на фотокатод ФК (а) или фоточувствительную стенку канала (б) и за счет внешнего
фотоэффекта выбивают из него первичные электроны. Электроны разгоняются за счет разности потенциалов между
динодами Д (а) или вдоль стенок канала (б) и при каждом столкновении с поверхностью выбивают вторичные электроны,
образуется лавина вторичных электронов, которая приходит на анод А и создает электрический импульс. (Из работы [101]
с незначительными изменениями.)
- Существование ССС было впервые подтвер-
высоким, предпринимались активные попытки
ждено физическими методами, была оценена его
применить к его исследованиям физические ме-
интенсивность;
тоды. Это широко обсуждалось на международ-
ном уровне и вряд ли прошло незамеченным для
- обнаружена и исследована УФ-хемилюми-
разработчиков и коллективов, работавших с
несценция ряда химических реакций, оценены
ФЭУ. Вместе с тем, попыток применить ФЭУ для
интенсивность и квантовый выход хемилюми-
измерений ССС не было вплоть до середины
несценции;
1950-х гг., в первую очередь это связано с высоки-
- выявлены основные проблемы физических
ми тепловыми шумами первых приборов, низким
исследований ССС, получен ряд технических ре-
уровнем интенсивности излучения и использова-
шений.
нием ФЭУ только в токовом режиме. После того
См. также обсуждение исследований УФ-ком-
как были разработаны схемы счета импульсов
поненты ССС с помощью модифицированных
ФЭУ, т.е. появилась возможность счета отдель-
счетчиков Гейгера-Мюллера в негативных
ных фотонов, эти устройства начали применять
работах [74, 97] и в позитивных работах [64, 70, 87,
для исследований CCC [21, 22, 42], что привело к
96].
стремительному развитию направления [23, 24]. В
настоящее время при исследованиях ССС биоло-
ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕ-
гических объектов ФЭУ также используются
ЧЕНИЯ С ПОМОЩЬЮ ФЭУ
только в режиме счета фотонов. Токовый режим
БЕЗ ПРОСТРАНСТВЕННОГО
работы ФЭУ, т.е. режим регистрации суммарного
И СПЕКТРАЛЬНОГО РАЗРЕШЕНИЯ
тока, при исследованиях ССС не используется.
Изобретение и принцип работы ФЭУ. Первый
Принцип работы ФЭУ поясняет рис. 7.
ФЭУ был предложен и разработан А. Кубецким в
1930-1934 гг. (результаты были продемонстриро-
Наиболее важные характеристики ФЭУ (спек-
ваны в 1934 г., но работа опубликована значи-
тральная чувствительность, термоэмиссионные
тельно позднее [98]), вскоре была предложена си-
токи, т.е. основная составляющая шумов, и их за-
стема с рядом динодов [99] и затем практически
висимость от температуры) определяются мате-
современный вариант конструкции с электроста-
риалом фотокатода. У современных ФЭУ кванто-
тической фокусировкой [100]. В это время инте-
вый выход составляет 15-50% в области макси-
рес к митогенетическому излучению был очень
мальной
спектральной
чувствительности,
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
47
стотой > 1 ГГц представляет технические сложно-
сти, более того, весь массив сырых данных имеет
очень большой объем, что затрудняет обработку
данных счета на значительном временном интер-
вале, поэтому, несмотря на принципиальную воз-
можность проведения аналого-цифрового преоб-
разования сигнала непосредственно с ФЭУ, это
на практике обычно не используется. Биологиче-
ский объект и ФЭУ располагаются в отдельных
светозащищенных отсеках, что обеспечивает воз-
можность их термостатирования при существен-
но различающихся температурах.
При измерениях жидких образцов часто ис-
пользуются многокюветные схемы c автоматиче-
ской сменой экспериментальных образцов и кон-
тролей. Для введения в исследуемую жидкую си-
стему различных дополнительных веществ
(инициаторов, активаторов, тушителей) в про-
цессе измерений, в том числе для продувания ее
газами, используются специальные инжекторы,
которые подключают к дозаторам. В некоторых
исследованиях в ходе эксперимента требуется
также отбирать пробы для химического анализа,
для этого служат пробоотборники. Довольно ча-
сто в экспериментах по исследованию ССС жид-
ких биологических или химических систем необ-
ходимо перемешивание для обеспечения одно-
Рис. 8. Схема установки для измерения сверхслабого
родного состава исследуемой жидкой системы. В
свечения жидких образцов.
этом случае применяются специальные мешалки
в виде лопаток с электроприводом, иногда для пе-
ремешивания используется встряхивание [102]. В
темновой счет - 100-104 квантов (для регистра-
современных системах для управления парамет-
ции ССС используются устройства с шумами
рами измерительной установки, смены образцов,
<100 квантов⋅см-2⋅с-1), коэффициент умноже-
дозированной дополнительной подачи веществ,
температурой, скоростью перемешивания и т.п.,
ния потока электронов 106-109, временное разре-
а также синхронизации различных воздействий
шение от единиц наносекунд до десятков пикосе-
на образец с процессом измерений и вывода ре-
кунд [35].
зультатов используется компьютерный интер-
Базовая схема регистрации сверхслабых свече-
фейс.
ний с помощью ФЭУ без пространственного и спек-
Методы исследований сверхслабых свечений
трального разрешения. Почти все исследования
биообъектов с использованием химических и физи-
ССС в диапазоне 370-1270 нм без пространствен-
ческих факторов. Обычно исследования спонтан-
ного и спектрального разрешения проводились с
ного ССС используются для оценки каких-либо
помощью ФЭУ. Стандартная схема установки
обобщенных характеристик физиологического
для исследований ССС без пространственного и
или патологического состояния биообъекта, ча-
спектрального разрешения представлена на
ще всего для оценки характеристик клеток и тка-
рис. 8: после ФЭУ последовательно располагают-
ней, связанных с окислительным (оксидатив-
ся усилитель (либо предусилитель и усилитель),
ным) стрессом и защитой от него (см. ч. 1 данного
дискриминатор для отсечки шумовых импульсов
обзора [16]). Спонтанное ССС несет информа-
с амплитудой меньшей, чем у импульсов полез-
цию о сложном комплексе происходящих в био-
ного сигнала, т.е. импульсов, обусловленных фо-
логическом объекте процессов, которая трудно
тонами, формирователь импульсов для преобра-
поддается расшифровке. Поэтому для детального
зования сигналов в прямоугольные импульсы
выяснения их механизмов часто используют мо-
одинаковой продолжительности, счетчик им-
дельные системы, имитирующие определенные
пульсов и компьютерный интерфейс. Минималь-
этапы биологических процессов. Так, в работах
ная продолжительность импульса от электронной
по ССС, сопровождающему окисление углеводо-
лавины на выходе ФЭУ составляет порядка еди-
родов [55, 58, 103-117], выяснены механизмы ре-
ниц наносекунд, и аналого-цифровое преобразо-
комбинации пероксирадикалов, приводящей к
вание исходного сигнала ФЭУ c необходимой ча-
генерации электронно-возбужденных состояний.
БИОФИЗИКА том 67
№ 1
2022
48
НАУМОВА и др.
Аналогичные процессы были показаны для жир-
люминесцентного процесса рассчитывают кине-
ных кислот и липидов [118-123].
тику концентрации участвующих веществ, кон-
станты скоростей реакций и корректируют пред-
Развернутую информацию дают исследования
ставления о возможных схемах процессов.
с использованием физических или химических
факторов, селективно влияющих на определен-
Так, в классических работах по хемилюминес-
ные стадии процесса хемилюминесценции. Ос-
ценции жирных кислот [121, 122, 135, 136], липи-
новная доля исследований как механизмов ССС
дов микросом или митохондрий [23, 118, 121, 137-
биообъектов, так и прикладных применений ис-
148], на основании подобных данных удалось вы-
следований ССС связана с внесением в исследуе-
делить несколько стадий развития ССС, вне зави-
мый материал дополнительных химических ве-
симости от индуцирующего агента [149]:
ществ - инициаторов, активаторов, тушителей и
- спонтанное излучение,
др. (см. раздел «Факторы, влияющие на хемилю-
- быстрая вспышка,
минесценцию» в ч. 1 данного обзора [16]). Среди
- стадия угнетения,
биологических материалов при этом наиболее
- латентный период,
широко исследуется кровь и ее компоненты [124-
- медленная вспышка,
127].
- стационарный уровень.
Химические факторы. Инициаторы применяют
практически при любых исследованиях биологи-
Общепринятый в настоящее время вывод о
ческого материала in vitro для запуска первой ста-
том, что в липидном слое мембран митохондрий
дии свободно-радикальных процессов -инициа-
развивается реакция цепного окисления липидов
с образованием гидропероксида цепей жирных
ции, т.е. усиленного образования в системе пер-
вичных свободных радикалов. В качестве
кислот, причем ионы Fe2+ разветвляют цепи
инициаторов хемилюминесценции in vitro ис-
окисления липидов, делая процесс самоускоряю-
пользуются перекись водорода, ионы металлов
щимся, был сделан на основании подобной слож-
переменной валентности, катализирующие одно-
ной кривой ССС суспензии митохондрий после
электронное восстановление кислорода (наибо-
добавления к ней микромолярных количеств
лее распространенный источник таких ионов -
ионов Fe2+ , а также зависимостей накопления
сульфат железа).
продукта реакции (малонового диальдегида) и
При наличии кислорода образовавшиеся в си-
окисления ионов железа (см. рис. 9) [149, 150].
стеме первичные свободные радикалы переходят
Детальное математическое моделирование про-
в перекисные радикалы, рекомбинирующие с об-
цесса [151] полностью подтвердило предполагае-
разованием квантов хемилюминесценции. При
мый механизм протекающих процессов [149].
этом интенсивность и продолжительность
Наибольшее число работ по активированной
вспышки такой хемилюминесценции определя-
хемилюминесценции крови и тканей посвящены
ется соотношением прооксидантов и антиокси-
исследованию функционального состояния фа-
дантов и характеризует, таким образом, процес-
гоцитов, т.е. их способности выделять активные
сы, протекающие в системе. В частности, методи-
формы кислорода (АФК) для защиты организма
ки с применением сульфата железа в качестве
от чужеродных агентов. В исследовательских це-
инициатора ССС плазмы крови были предложе-
лях выделение фагоцитами АФК стимулируют с
ны в качестве дополнительных диагностических
помощью различных бактерий, химических ве-
тестов различных заболеваний [128-130]. Для ди-
ществ, электрических импульсов (рис. 10) и др.
агностических тестов используется в качестве
Активность фагоцитов обычно усиливается
инициатора и перекись водорода [125, 131-133],
при возникновении в организме очагов воспале-
которая была одним из первых исследованных
ния (например, после инфаркта миокарда) и в ря-
инициаторов ССС биообъектов [134] и использу-
де других случаев. Наоборот, при длительном не-
ется в исследованиях ССС преимущественно в
достатке кислорода, связанном с общим ослабле-
качестве источника гидроксильных радикалов
нием организма, активность фагоцитов и
(OH•).
хемилюминесцентные ответы снижаются. На об-
Ценную информацию о хемилюминесценции
ширном материале была показана корреляция
биологических и модельных систем позволяет
ССС лейкоцитов крови с наличием различных за-
получить метод кинетической хемилюминесцен-
болеваний (рис. 11).
ции. Изменения интенсивности хемилюминес-
Для активации используют как химические
ценции несут в себе существенную информацию
активаторы, например, люминол и люцигенин
о функциональном состоянии исследуемого объ-
[153-155], так и физические активаторы, напри-
екта, но получить ее можно только путем матема-
мер, родамин Ж или производные кумаринов,
тического анализа кинетики процесса с исполь-
прежде всего С-525 (см. обзоры [156, 157], а также
зованием математического моделирования. При
описание и экспериментальное сравнение мето-
этом на основании составленной модели хеми-
дик активированной хемилюминесценции крови
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
49
Рис. 9. Хемилюминесценция, изменение концентрации двухвалентного железа (Fe2+) и малонового диальдегида (МДА) в
суспензии митохондрий после добавления 0.2 мМ Fe2+. Состав инкубационной смеси: 1 мл суспензии митохондрий в 10 мл
105 мМ NaCl и 20 мМ трис-буфера, pH 7.5; температура 20°С. 1-4 - стадии развития свечения: 1 - латентный период, 2 -
медленная вспышка свечения, 3 - период угнетения свечения, 4 - быстрая вспышка после введения Fe2+. По оси
абсцисс - время после помещения митохондрий в кювету; по осям ординат: [Fe2+] - концентрация ионов Fe2+, мкМ;
[МДА] - концентрация продукта липидной пероксидации, малонового диальдегида; I - интенсивность хемилюминесцен-
ции, отн. ед. Стрелками указаны моменты добавления Fe2+. (Из работы [149], подробнее см. работу [118].)
и изолированных тканей с использованием этих
определения отдельных видов радикалов. Напри-
наиболее распространенных активаторов в дис-
мер, люцигенин - специфический активатор све-
сертационной работе [102]). Традиционный акти-
чения, обусловленного супероксидными радика-
ватор люминол используется для усиления хеми-
лами, кумарин С-525 - специфический актива-
люминесценции, связанной с различными ради-
тор хемилюминесценции липидных радикалов.
калами, - радикалами гидроксила, гипохлорита и
Активированная хемилюминесценция использу-
других окислителей. Ряд активаторов обладает
ется для определения общей антиоксидантной
специфическим действием и используются для
активности различных веществ, а также плазмы и
сыворотки крови пациентов при различных забо-
леваниях [127, 156, 158]. В ряде работ изучалась
железо-индуцированная хемилюминесценция
сыворотки и плазмы крови с использованием ак-
тиваторов как метод определения окисляемости
липопротеинов. В работах [159-161] исследова-
ние спонтанного ССС цельной или разбавленной
крови, суспензий нейтрофилов, как в нативной
системе, так и с добавлением активаторов ССС -
люминола или люцигенина, позволило оценить
ряд протекающих в ней свободнорадикальных
процессов и их зависимость от температурных и
оптических параметров.
Добавление в хемилюминесцентную систему
антиоксидантов обычно осуществляется для ре-
шения двух задач: изучения действия исследуе-
мых антиоксидантов в известной хемилюминес-
центной системе [60] и определения типов сво-
Рис. 10. Хемилюминесценция клеток крови в присут-
бодных радикалов, генерируемых в изучаемой
ствии люминола после их стимуляции электрическими
системе. Например, добавление супероксиддис-
импульсами разного напряжения (около кривых указа-
ны значения амплитуды импульсов в вольтах). (Из ра-
мутазы позволяет выявить образование в биоло-
боты [152].)
гическом материале супероксидного радикала.
БИОФИЗИКА том 67
№ 1
2022
50
НАУМОВА и др.
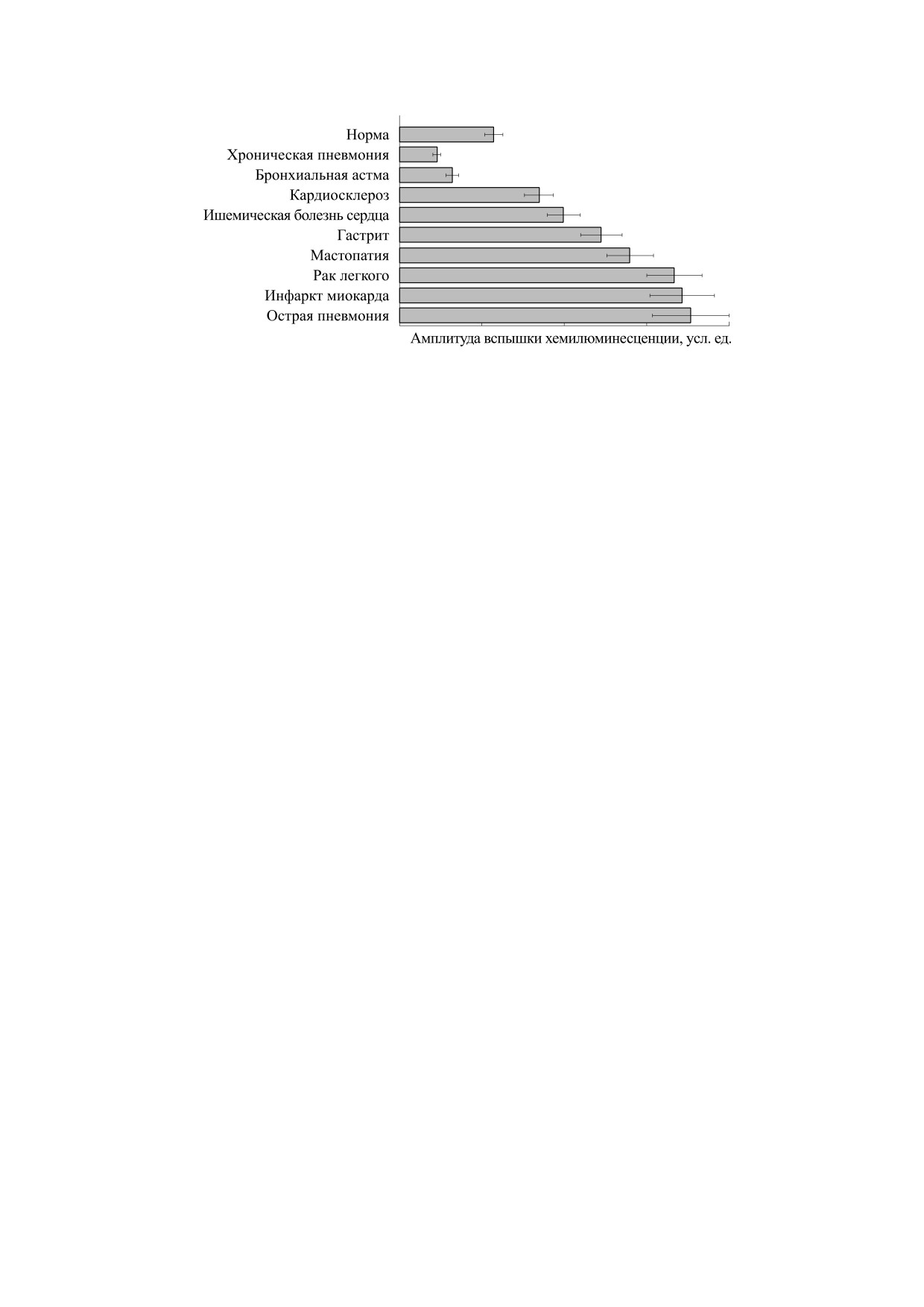
Рис. 11. Амплитуда хемилюминесцентных ответов изолированных лейкоцитов крови, полученной от больных различными
заболеваниями. Стимулирование клеток осуществляли частичками латекса. (Из работы [152].)
В первую очередь, исследования ССС с добав-
логический ответ с образованием АФК (напри-
лением химических веществ направлены на полу-
мер, [162] - в данной работе образование АФК
чение информации о процессах, связанных со
регистрируется с помощью активированной лю-
свободными радикалами. Кроме того, методы хе-
цигенином хемилюминесценции). Следует отме-
милюминесцентного анализа позволяют опреде-
тить, что электрохемилюминесценция относи-
лять следовые количества некоторых веществ в
тельно хорошо изучена на модельных средах, но в
биологическом материале сравнительно простым
случае биологических объектов задействовано
образом. К исследуемому образцу добавляется
значительно большее количество разнообразных
реагент, который при взаимодействии с опреде-
веществ, что затрудняет интерпретацию данных.
ляемым веществом приводит к хемилюминесцен-
Влияние магнитного поля на ССС связано в
ции. Например, для анализа на АТФ используют
основном с изменением концентрации свобод-
люциферин-люциферазный комплекс. Под воз-
ных радикалов [163-165].
действием фермента люциферазы люциферин
окисляется кислородом при участии молекулы
Отдельным обширным направлением явилась
АТФ, при этом образуется оксилюциферин в воз-
регистрация послесвечения биологических си-
бужденном состоянии, люминесцирующем при
стем после их облучения видимым или УФ-све-
релаксации. Даже относительно простой совре-
том, которое называют задержанной (замедлен-
менный хемилюминометр, способный регистри-
ной) люминесценцией (delayed luminescence или
delayed light emission). Этот термин объединяет
ровать световые потоки порядка 103 квантов в се-
широкий круг люминесцентных явлений разной
кунду, обеспечивает чувствительность метода
природы, возникающих при фотовозбуждении
около 10-15 моль/литр, при использовании более
разных систем. Единственным объединяющим
чувствительных хемилюминометров пороговая
свойством этих явлений служит тот факт, что вре-
чувствительность соответственно будет выше.
мя затухания замедленной люминесценции на
Физические факторы. В отличие от химических
порядки превышает время жизни возбужденного
физические факторы, которые используются для
состояния пигмента-фоторецептора. Наиболее
усиления ССС, обычно одновременно вызывают
известным примером такой люминесценции слу-
несколько эффектов: они оказывают как прямое
жит замедленная флуоресценция фотосинтезиру-
влияние, т.е. непосредственно изменяют течение
ющих организмов, открытая Б.И. Стрелером и
разных этапов процессов, обусловливающих хе-
В. Арнольдом в 1957 г. [42]. Этому явлению по-
милюминесценцию, так и непрямое влияние, т.е.
священо огромное количество работ, поскольку
обусловленное биологической реакцией исследу-
оно позволяет выявлять промежуточные продук-
емого объекта.
ты, образующиеся при фотовозбуждении моле-
Электрические импульсы вызывают повы-
кул хлорофилла в фотосинтетическом аппарате
шенное образование в клетке АФК, во-первых,
высших растений, водорослей и бактерий [166].
благодаря процессам образования радикалов на
Простейшей фотофизической моделью такой
границе электролитической среды с электродами
люминесценции является замедленная флуорес-
(прямое воздействие на повышение уровня
ценция и фосфоресценция органических пиг-
АФК), во-вторых, благодаря повышению прони-
ментов и красителей, связанных с прямой дезак-
цаемости биологических мембран (электропора-
тивацией их низших триплетных состояний (Т1).
ция), которое стрессирует клетку и вызывает био-
Фосфоресценция возникает при прямой излуча-
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
51
тельной дезактивации триплетного состояния,
цессов существенно меньше, чем у ИК-свечения
простейший тип замедленной флуоресценции
синглетного кислорода на длине волны 1270 нм.
(так называемый E-тип) сопровождает термоак-
Добавление в растворы красителей окисляе-
тивированный переход триплетного состояния в
мых субстратов, таких как липиды, белки и др.,
возбужденное синглетное состояние [167, 168].
приводит к их окислению синглетным кислоро-
Например, замедленная флуоресценция E-типа
дом и появлению перекисей и свободных радика-
наблюдается в жидких растворах хлорофилла и
лов, которые являются источником хемилюми-
других пигментов при комнатной температуре в
несценции. При действии видимого света на
анаэробных условиях [169-172]. ИК-фосфорес-
аэробные системы первичное образование син-
ценция хлорофилла наблюдается в твердых сре-
глетного кислорода является универсальным
дах, например, в замороженных растворах при
процессом.
низких температурах или при комнатной темпе-
При действии УФ света инициирование фото-
ратуре в твердых полимерных пленках [173-176].
хемилюминесценции может идти и без синглет-
ного кислорода за счет прямого фотолиза окисля-
Детальному изучению замедленной люминес-
емых соединений, приводящего к образованию
ценции, возникающей в аэробных растворах пиг-
свободных радикалов и перекисей [194-196].
ментов и красителей в естественных условиях при
отсутствии других окисляющихся субстратов, бы-
Ниже мы приводим ряд относительно недав-
ли посвящены многолетние работы группы
них работ по этой тематике, в которых исследова-
А.А. Красновского мл. [177-187]. В этих условиях
ны различные по природе явления, относящиеся
время жизни триплетных состояний красителей
к типу замедленной люминесценции. Так, на
из-за их тушения кислородом воздуха уменьшено
рис. 12 приведена схема установки ARETUSA для
на несколько порядков величины по сравнению с
исследования задержанной люминесценции. На
анаэробными условиями, поэтому указанные вы-
этой установке с различными дополнительными
ше «триплетные свечения» также ослаблены на
техническими модификациями был выполнен
порядки величины. При этом, поскольку туше-
значительный комплекс работ (например, [197-
ние триплетных состояний кислородом сопро-
204]), в частности, для проведения спектральных
вождается эффективным образованием синглет-
исследований перед образцом размещались
ного кислорода, его инфракрасное свечение на
фильтры. Эти исследования показали, что поми-
длине волны 1270 нм становится одним из глав-
мо собственно кинетики регистрируемого свече-
ния, важную информацию может нести ее спек-
ных компонентов замедленной люминесценции
аэробных растворов. Способность синглетного
тральный состав [52, 205, 206].
кислорода к этой люминесценции в растворах
В работах [207, 208] по кинетике кривой задер-
была обнаружена в этом цикле работ впервые
жанной люминесценции оценивали степень ко-
[182-184]. Образовавшийся синглетный кисло-
герентности электромагнитного поля в образце:
род окисляет исходные молекулы красителей, ге-
когерентное электромагнитное поле должно бы-
нерируя лабильные фотоперекиси, которые рас-
ло проявляться в гиперболической кинетике по-
падаются в результате термоактивированных
слесвечения, в отличие от некогерентного, кото-
процессов, что сопровождается собственной хе-
рое должно было проявляться в экспоненциаль-
милюминесценцией (фотохемилюминесценци-
ной кривой. К сожалению, несмотря на
ей) в видимой области спектра [177-179]. Спектр
увлеченность авторов этой элегантной идеей, до-
этой фотохемилюминесценции отличается как от
стоверных результатов получено не было. В то же
спектра флуоресценции исходного красителя, так
время кинетика послесвечения биологических
и от спектра люминесценции кислорода и его ди-
объектов оказалась перспективным инструмен-
меров. Наиболее вероятным эмиттером этой лю-
том для оценки качества пищи и других приклад-
минесценции служат продукты деградации
ных исследований [198, 202, 209, 210], включая
красителей. Одновременно наблюдаются реком-
мониторинг состояния клеток и тканей [199-201,
бинационные процессы, приводящие к суммиро-
204, 211].
ванию энергии двух молекул синглетного кисло-
Наночастицы. В последнее время активно раз-
рода, что приводит к излучению света димерами
вивается применение для исследований ССС на-
синглетного кислорода или красителя. В отличие
ночастиц - они легко проникают внутрь клетки
от работ групп М. Каши и Э.А. Огризло, которые
(особенно при дополнительном повышении про-
наблюдали свечение димеров в газовой фазе или в
ницаемости мембран путем электропорации).
пузырьках кислорода, выделяющихся при экзо-
Механизмы усиления ССС плазмонными нано-
термических реакциях перекиси водорода с окис-
частицами металлов (Ag, Au и др.) довольно раз-
лителями [188-192], группе А.А. Красновского мл.
нообразны - они одновременно могут выступать
удалось обнаружить аналогичные процессы в рас-
в роли инициаторов за счет активного формиро-
творах [187, 193]. Однако в растворах при стацио-
вания АФК на их высокореакционной поверхно-
нарном возбуждении квантовый выход этих про-
сти, а также в роли физических активаторов за
БИОФИЗИКА том 67
№ 1
2022
52
НАУМОВА и др.
Рис. 12. (а) - Схема установки ARETUSA для исследований задержанной люминесценции (из работы [51]); (б) - пример
типичного результата измерений задержанной люминесценции: ромбы - питательная среда (калий-фосфатный буфер),
темные кружки - одноклеточные водоросли Scenedesmus subspicatus, светлые кружки - тот же образец после добавления
анестетика (тиопентал натрия).
счет взаимодействия электронов проводимости с
цветных фотопленок с разной спектральной чув-
возбужденными состояниями близлежащих мо-
ствительностью позволяет дополнительно при-
лекул или продуктов, возникновения локального
ближенно визуализировать и спектральные осо-
плазмонного резонанса [165, 212-215].
бенности [37-39]. Более активное применение
фотографического метода затрудняет количе-
СИСТЕМЫ 2D-ИЗОБРАЖЕНИЯ СВЕРХ-
ственная обработка результатов.
СЛАБЫХ СВЕЧЕНИЙ
Получение изображений с помощью вакуумных
Для получения изображений ССС использу-
электронных устройств. Пространственное рас-
ются как вакуумные электронные (ФЭУ), так и
пределение интенсивности ССС редко исследу-
твердотельные (CCD-матрицы) устройства. Сле-
ется путем последовательных измерений ССС на
дует отметить, что имеется несколько работ c ис-
различных участках биообъекта с помощью
пользованием фотографического метода для по-
обычных ФЭУ. Этот способ дает пространствен-
лучения 2D-изображений ССС биообъектов (см.
ное разрешение, сравнимое с размерами фотока-
рис. 13), более того, использование нескольких
тода ФЭУ, и используется только для крупных
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
53
канальных умножительных трубок малого диа-
метра (рис. 14).
МКП имеют гораздо меньшие площадь сече-
ния и длину отдельного канала электронного
умножения, более короткое время пролета элек-
тронов по сравнению с динодными и распреде-
ленными одноканальными электронными умно-
Рис. 13. Изображение ССС свежесрезанного корешка
жителями. Эти элементы позволили реализовать
лука в черно-белом негативном изображении. Экспо-
большую площадь фотоприемника, обеспечить
нирование в течение 2 мин через 3 с после отделения от
луковицы, для регистрации использованы цветные
высокое пространственное и временное разреше-
многослойные галогенсеребряные фотопленки с общей
ние, что расширило области применения счетчи-
светочувствительностью 64 ед. ГОСТ. (Из работы [38].)
ков фотонов [218-220] (см. также обзоры по исто-
рии МКП [221] и ранней истории МКП [222]), в
частности позволило получать изображения ССС
объектов, например, таким образом проводилось
[223-225]. Временное разрешение ФЭУ с МКП
картирование ССС тела человека на нескольких
достигает десятков пикосекунд, т.е. более чем на
десятках участков площадью 9 см2 [216]. Для по-
порядок лучше, чем у ФЭУ с динодами. Следует
лучения более высокого пространственного раз-
отметить, что недостатком МКП по сравнению с
решения используются координатно-чувстви-
динодами является потеря части фотоэлектро-
тельные ФЭУ, в которых в процессе умножения
нов, которые не попадают внутрь микроканалов
электронов сохраняется информация о месте по-
(у современных МКП такая потеря полезного
падания фотона на фотокатод. Для сохранения
сигнала составляет около 30%), вместе с тем шу-
координатной информации в таких ФЭУ исполь-
мы усиления у МКП тоже меньше. Обычно для
зуются динодные системы из сеток или в виде ме-
регистрации ССС используются сборки из двух-
таллических каналов, а также микроканальные
трех последовательных МКП, обеспечивающих
пластины (см., например, работу [35]). Насколь-
суммарный коэффициент усиления 106-109. Си-
ко нам известно, для исследований ССС приме-
стемы на основе МКП работают в режиме реаль-
нялись только ФЭУ на основе микроканальных
ного времени и обеспечивают возможность про-
пластин, преимуществом которых является боль-
странственно-временной характеризации ССС,
шее количество отдельных каналов в матрице,
кроме того они используются для расчета стати-
меньшая площадь сечения канала, высокий ко-
стики фотонов, корреляционного анализа [226].
эффициент заполнения, а также более простая
2D-счетчики фотонов и примеры их применения
технология изготовления.
в исследованиях сверхслабых свечений. На основе
Микроканальные пластины: принцип действия и
МКП были реализованы два основных типа схем,
технические особенности. Микроканальные пла-
которые использовались для получения изобра-
стины (МКП), устройства умножения потока
жений ССС (рис. 15) [44]. В одном из них
электронов с пространственным разрешением,
электронное изображение в виде лавин, локали-
можно представить как матрицы коротких одно-
зованных в микроканалах МКП, принимает по-
Рис. 14. Схема умножения потока электронов в МКП [217].
БИОФИЗИКА том 67
№ 1
2022
54
НАУМОВА и др.
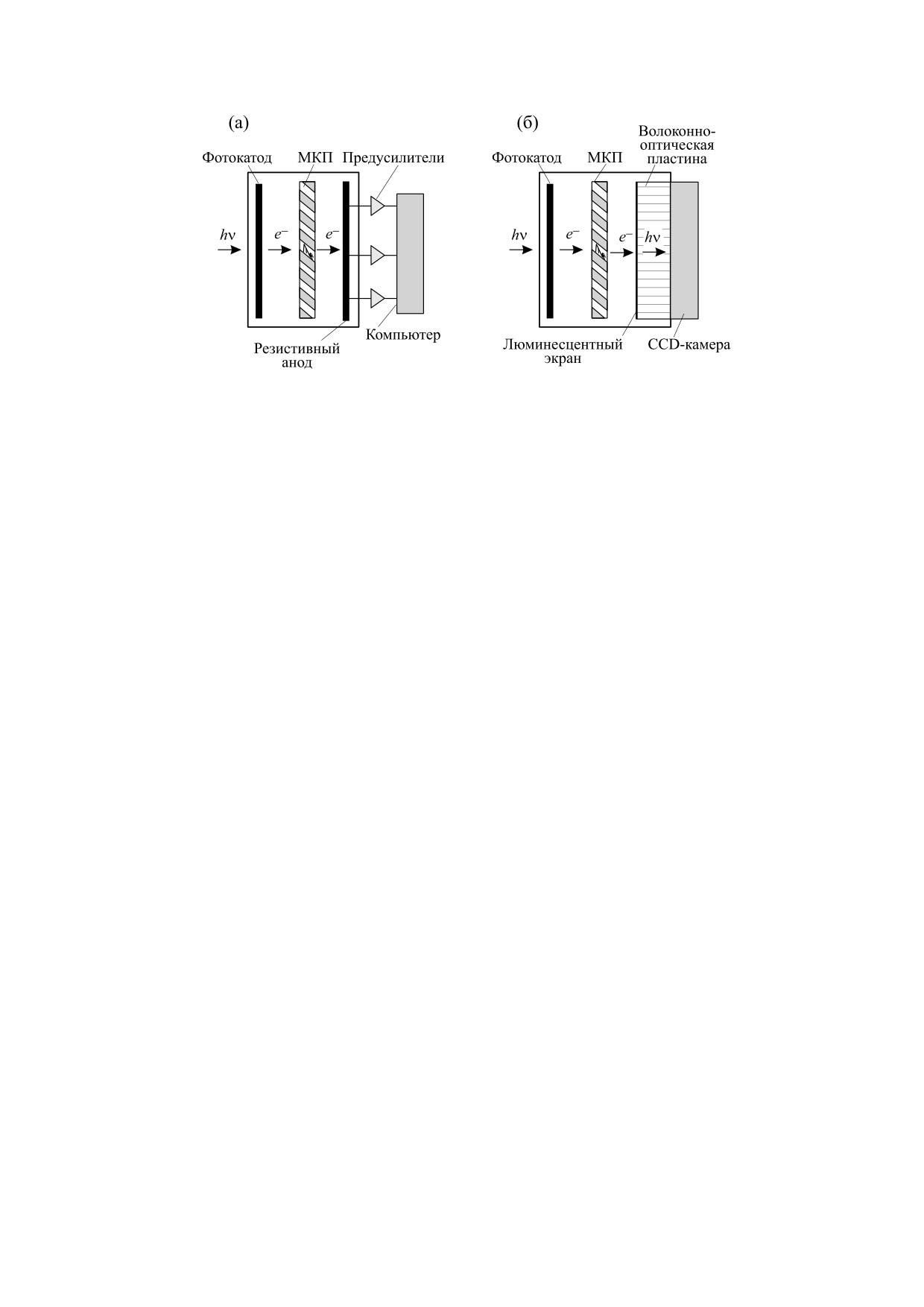
Рис. 15. Схемы 2D счетчиков фотонов: (а) - с позиционно-чувствительным анодом; (б) - с люминесцентным экраном и
оптической камерой, т.е. с электронно-оптическим преобразованием (МКП на схеме обозначает сборку из нескольких
МКП).
зиционно-чувствительный анод (наиболее рас-
ния вирусом мозаики огурца, полученные с по-
пространенный вариант - резистивный анод)
мощью устройства типа приведенного на рис. 15а.
(рис. 15а). Пространственное 2D-распределение
Временная последовательность изображений
падающих фотонов рассчитывается по сигналам с
ССС демонстрирует развитие реакции гиперчув-
анода, и при накоплении достаточного количе-
ствительности растения (реакция гиперчувстви-
ства счетов на пиксель формируется изображе-
тельности растения - один из способов защиты
ние. С помощью такого устройства были получе-
растений от инфекций, он связан с образованием
ны первые изображения ССС растений, на кото-
АФК) [232] (рис. 16). Внешние симптомы зараже-
рых было показано, что интенсивность
ния (см. рис. 16б) проявляются значительно позд-
специфично зависит от тканей [223, 224, 227]. В
нее и коррелируют с изображениями ССС. Изоб-
другой схеме (рис. 15б) лавина на выходе из мик-
ражения ССС на рис. 17 показывают подавление
роканала попадает на люминесцентный экран и
реакции гиперчувствительности растений ловуш-
вызывает яркую вспышку. Таким образом, на
ками АФК (тироном) [232].
экране в режиме реального времени возникает
Получение изображений с помощью твердотель-
многократно усиленное по интенсивности изоб-
ных устройств (CCD-камер). Технические осо-
ражение ССС, но в спектральном диапазоне све-
бенности CCD-камер. В настоящее время для по-
чения люминофора. Это изображение регистри-
лучения
2D-изображений ССС в основном
руется обычными камерами, на которые фокуси-
используются полупроводниковые приборы -
руется с помощью системы линз или передается с
охлаждаемые CCD-камеры с длительным накоп-
помощью волоконно-оптической пластины как
лением заряда без блока электронного умноже-
на рис. 15б [44], подобные устройства с CCD-ка-
ния [44, 233]. CCD-камеры с электронным умно-
мерами называют также интенсифицированны-
жением (electron-multiplying CCD, EMCCD) из-
ми CCD-камерами, они использовались, напри-
за малой рабочей площади и дополнительных шу-
мер, для исследования реакции ССС растений на
мов, связанных с электронным умножением, т.е.
стрессовые воздействия [48, 49]. Пространствен-
нестабильного коэффициента усиления потока
ное разрешение определяется размерами ячеек
электронов, в этой области пока применяются от-
МКП и разрешением позиционно-чувствитель-
носительно редко [47, 234, 235]. Недавно было по-
ного анода или люминесцентного экрана и каме-
казано, что эти устройства позволяют получить
ры. Такие устройства, электронно-оптические
достаточно хорошее для исследований ССС соот-
преобразователи, использовались для изображе-
ношение «сигнал/шум» (для излучения c интен-
ния ССС корней соевых бобов [225], стрессового
сивностью
30 квантов⋅см-2⋅с-1 соотношение
ССС проростков бобовых [228], имплантирован-
«сигнал/шум» равно 3) [236]. Другой распростра-
ных раковых опухолей [229]. Изображения ССС
ненный тип полупроводниковых приборов для
целого ряда живых биообъектов получила с помо-
получения
2D-изображений, CMOS-камеры
щью электронно-оптического преобразователя
(CMOS- complementary metal-oxide-semiconduc-
группа Х. Инабы [226,230,231].
tor structure (англ.), комплементарная структура
На рис. 16 и 17 приведены примеры изображе-
металл-оксид-проводник), несмотря на значи-
ний ССС листьев коровьего гороха после зараже-
тельный прогресс в повышении квантового выхо-
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
55
Рис. 16. Листья коровьего гороха, зараженные различными штаммами вируса мозаики огурца. Правая сторона левого листа
и левая сторона правого листа заражены штаммом CMV-Y, который вызывает реакцию гиперчувствительности.
Контрольная левая сторона левого листа обработана буферным раствором, не содержащим вируса. Правая сторона правого
листа заражена штаммом CMV-L, который не вызывает реакции гиперчувствительности. (а) - Изображения ССС
показывают пораженные участки уже через 10-16 часов, когда визуальные признаки поражения еще не видны. (б) - Листья
через 24 ч после заражения, пораженные области совпадают с областями более интенсивного ССС. (Из работы [232].)
да и снижении шумов, все еще не могут обеспе-
биологических систем, хотя они иногда исполь-
чить достаточное отношение «сигнал/шум» для
зуются в полихроматической схеме спектрально-
излучения столь малых интенсивностей как ССС го анализа хемилюминесценции модельных хи-
Рис. 17. Влияние ловушек АФК на ССС листьев коровьего гороха, зараженных вирусом мозаики огурца, который вызывает
реакцию гиперчувствительности. (а) - ССС-изображение: половина каждого листа заражена вирусом, левый лист
дополнительно был обработан тироном (ловушка АФК), правый лист - контрольный. (б) - Временные зависимости ССС:
сплошная линия - ССС листа, обработанного тироном, точки - ССС контрольного листа. (Из работы [232].)
БИОФИЗИКА том 67
№ 1
2022
56
НАУМОВА и др.
мических систем, у которых интенсивность излу-
с более интенсивным метаболизмом в раковых
чения несколько выше [237].
клетках [43], повышенное ССС в области суста-
вов мыши с ревматоидным артритом свидетель-
Из-за низкой интенсивности ССС CCD-каме-
ствует о том, что это заболевание приводит к об-
ры используют с длительным временем накопле-
разованию АФК, вызывающих хроническое вос-
ния, кроме того, применяется биннинг (сумми-
паление за счет аутоиммунного процесса [241]. В
рование сигнала от соседних пикселей), который
целом ряде работ были исследованы изображения
позволяет повысить временное разрешение за
ССС человека [216, 242, 243] (см. также обзорную
счет снижения пространственного разрешения
работу [47]). Изображения спонтанного ССС
сигнала. Биннинг на физическом/аппаратном
верхней половины тела здорового человека пока-
уровне, т.е. считывание уже суммированных сиг-
зали, что интенсивность свечения максимальна в
налов, дает меньше шумов, чем программный
области лица, это было отнесено к тому, что кожа
биннинг, т.е. попиксельное считывание с после-
лица подвержена регулярному воздействию УФ-из-
дующим суммированием и усреднением сигнала
лучения и в связи с этим отличается по состоянию
от соседних пикселей с помощью компьютерной
окислительного стресса [216, 242]. При исследова-
обработки. Разница обусловлена шумами считы-
ниях изображений ССС в динамике [242] были
вания, например, при считывании суммарного
установлены суточные ритмы свечения тела чело-
сигнала от четырех пикселей шум считывания до-
века (максимальная интенсивность ССС наблюда-
бавляется однократно, а при их считывании по
ется в 16 ч дня, минимальная в 10 ч утра), самая вы-
отдельности - четырежды, потом при усреднении
сокая интенсивность была зарегистрирована в рай-
и 50%-м масштабировании он уменьшается как
оне щек, где она достигала 3000 фотонов⋅см-2⋅с-1 в
квадратный корень из 4, т.е. в 2 раза, таким обра-
зом, эти шумы при программном биннинге в два
16 ч и была примерно в два раза меньше в 10 ч.
Сравнение изображений ССС и тепловизионных
раза выше. Зависимость качества изображения
снимков показало, что распределение интенсив-
ССС от биннинга и времени накопления иллю-
ности ССС по телу не коррелирует с распределе-
стрирует рис. 18 из работы [238].
нием температуры, суточные ритмы ССС также
При длительном накоплении сигнала охла-
не были связаны с ритмами изменений темпера-
ждаемые CCD-камеры имеют шумы, сравнимые
туры тела [242]. Были проведены сравнения спон-
с вакуумными электронными устройствами. Пре-
танного ССС руки и CCC после облучения руки
имуществами CCD-камер по сравнению с по-
синим светом [244], ССС в пределах облученной
следними являются более высокий квантовый
области было примерно в три раза выше, чем в
выход и, как правило, более высокое простран-
необлученной (т.е. спонтанное ССС), это связано
ственное разрешение, к недостаткам относится
с тем, что синий свет вызывает окислительный
более низкое временное разрешение изображе-
стресс в клетках и тканях. Таким образом, изоб-
ний. Расчеты, выполненные в работе
[239]
ражения ССС перспективны для диагностики
показывают, что при достаточно глубоком охла-
различных заболеваний, связанных с окисли-
ждении и длительном накоплении сигнала CCD-
тельным стрессом. Системы изображения приме-
камеры превосходят по соотношению
«сиг-
няются также и для исследований самого явления
нал/шум» координатно-чувствительные фото-
ССС [65, 245-247].
умножители.
СПЕКТРАЛЬНЫЙ АНАЛИЗ
Примеры применения CCD-камер для исследова-
СВЕРХСЛАБЫХ СВЕЧЕНИЙ
ний ССС. Первое ССС-изображение (проростков
соевых бобов) с помощью охлаждаемой жидким
Начиная с «митогенетического» периода ис-
азотом CCD-камеры было получено М. Кобаяши
следований ССС, спектральный анализ исполь-
с соавторами [233]. В настоящее время именно
зовался для двух типов задач. Во-первых, это ис-
CCD-камеры являются основным средством ре-
следование явлений, обусловливающих ССС, т.е.
гистрации 2D-изображений ССС биообъектов. В
выяснение механизмов люминесценции, иденти-
частности, с помощью CCD-камеры были полу-
фикация веществ, образующихся в электронно-
чены изображения эндогенного ССС не обладаю-
возбужденном состоянии. Как было установлено
щих биолюминесценцией насекомых в процессе
еще в 1930-х гг. энергия, выделившаяся в химиче-
метаморфоза
[240], растущей опухоли мыши
ских реакциях, являющихся источником энергии
(привитый рак) [43, 229], мыши с индуцирован-
ССС, часто высвечивается молекулами, не при-
ным ревматоидным артритом [241]. Изображения
нимающими в них участия (например, работы
мыши с артритом и злокачественной опухолью
[248, 249], см. также подраздел «Сенсибилизиро-
демонстрируют корреляцию спонтанного ССС с
ванная флуоресценция» в ч. 2 настоящего обзора
патологическими состояниями, сопровождаю-
[1]). Во-вторых, исследование спектральных осо-
щимися окислительным стрессом, - повышен-
бенностей востребовано в целях характеризации
ное ССС в опухоли было объяснено повышением
самого биообъекта, получения информации о его
пролиферативной активности клеток, связанной
состоянии. Для исследований спектра ССС ис-
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
57
Рис. 18. Фотография (а) и ССС-изображения (б, в) дрожжевой культуры (Saccharomyces cereviseae). Изображения ССС
получены на CCD-камере в режиме программного (б) и аппаратного (в) биннинга с различными коэффициентами
биннинга (1 × 1, 2 × 2, 4 × 4) и временем накопления (10, 20, 30 мин). CCD-камера расположена в 30 см от объекта. (Из
работы [238].)
БИОФИЗИКА том 67
№ 1
2022
58
НАУМОВА и др.
пользуются как монохроматическая схема, т.е. с
Более совершенной схемой спектрального
последовательным измерением интенсивности
анализа ССС биообъектов является полихрома-
излучения в ряде спектральных областей [134],
тическая, при этом спектральное разложение ис-
так и полихроматическая, когда излучение, раз-
следуемого излучения проводится обычно с
ложенное в спектр, одновременно регистрирует-
помощью дифракционных решеток, а для реги-
ся рядом детекторов или матрицей [45, 227, 234,
страции соответствующего 2D-изображения ис-
235, 250, 251]. Следует отметить, что первые ис-
пользуются охлаждаемые CCD-камеры [45, 245],
следования спектров ССС в «митогенетический»
фотоумножители с позиционно-чувствительным
период также проводились и в полихроматиче-
анодом (рис. 15а) [227] или координатно-чувстви-
ском [252, 253], и в монохроматическом [254, 255]
тельные фотоумножители с электроннооптиче-
вариантах, кроме того из-за трудоемкости биоло-
ским преобразованием ( рис. 15б) [250]. Ширина
гических методик детектирования была исполь-
входной щели определяет баланс между интен-
зована двухстадийная схема - грубый анализ с
сивностью падающего на приемник излучения и
полихроматической схемой, затем в областях с
спектральным разрешением. Для полихромати-
ческой схемы измерений в качестве детекторов
зарегистрированным излучением - спектраль-
ный анализ с монохроматором, обеспечивающий
начали использоваться и CCD-камеры с элек-
более высокое разрешение, например, [256] (см.
тронным умножением (EMCCD) [234, 235].
также подраздел «Метод спектрального митоге-
Полихроматическая схема обеспечивает более
нетического анализа» в ч. 2 настоящего обзора
высокую чувствительность и лучшее временное
[1]). Обычно для спектрального анализа ССС в
разрешение, чем монохроматическая (см. сравне-
монохроматической схеме используются свето-
ние расчетных зависимостей отношения «сиг-
фильтры из цветного стекла (см., например, ра-
нал/шум» от интенсивности падающего излуче-
боты [257-262] и описание схемы в работе [263]),
ния для полихроматической и монохроматиче-
они хорошо подходят для фильтрации ненаправ-
ской схем с дифракционной решеткой и
ленного излучения и позволяют обеспечить све-
соответствующие экспериментальные результа-
тосбор с максимальной площади объекта. Смена
ты в работе [250]), поэтому полихроматический
светофильтров производится механически, раз-
спектральный анализ имеет существенные пре-
решение спектров составляет порядка десятков
имущества, когда требуется исследовать ССС в
нанометров (см., например, работы [257, 262,
динамике, например фотоиндуцированное ССС.
263]). Относительно низкое пропускание филь-
тров и необходимость последовательного измере-
АНАЛИЗ ОСОБЕННОСТЕЙ ВРЕМЕННОГО
ния каждой полосы значительно ухудшают воз-
РАСПРЕДЕЛЕНИЯ ФОТОНОВ СВЕРХСЛАБО-
можности временного разрешения, поэтому та-
ГО СВЕЧЕНИЯ БИОЛОГИЧЕСКИХ ОБЪЕК-
кой спектральный анализ используется обычно
ТОВ
для измерений относительно стабильного во вре-
В большинстве исследований ССС характери-
мени ССС.
зуется усредненной интенсивностью излучения -
при исследованиях изменения интенсивности в
В качестве примера техники для спектрально-
динамике, получении двумерных изображений
го анализа с фильтрами рассмотрим установку,
или спектра ССС и т.п. накопление сигнала осу-
разработанную в группе Х. Инабы для диапазона
ществляется в течение периода времени, доста-
250-850 нм [257]. Вращающийся диск с 37 свето-
точного, чтобы выделить и оценить среднюю ин-
фильтрами в виде цветных стекол с резкой грани-
тенсивность на фоне дробового шума самого
цей пропускания размещали между детектором
ССС и темновых счетов ФЭУ.
излучения и излучающим объектом, обеспечивая
пропускание ССС поочередно через каждый из
Другой подход к исследованиям ССС направ-
светофильтров, а также через открытую диафраг-
лен не на характеризацию средней интенсивно-
му. Открытая диафрагма нужна для корректиров-
сти, а на выяснение статистических характери-
ки плавных изменений полной интенсивности
стик шумовой компоненты. Толчок к развитию
ССС в течение измерений. Интенсивность излу-
этого подхода и методологии исследований вре-
чения в полосах между границами пропускания
менного распределения фотонов дала гипотеза об
фильтров определяли, вычитая соответствующие
уникальной, аномально высокой когерентности
интенсивности. При этом использовали два
ССС биообъектов [264-268]. Хотя гипотеза не
мультищелочных ФЭУ, чувствительных в диапа-
получила достаточного подтверждения [27, 269-
зонах 300-900 нм и 160-650 нм. При расчете
271], и было показано, что характерное время ко-
спектров учитывали темновые счеты для филь-
герентности сверхслабого свечения в оптическом
тров и спектральную чувствительность ФЭУ. Эта
диапазоне, по-видимому, не превышает наносе-
установка обеспечивала спектральное разреше-
кунд [272-274], но на основе развитых методов
ние 20-30 нм в диапазоне 300-700 нм и 30-50 нм
сформировалось вполне самостоятельное на-
в остальном рабочем диапазоне.
правление исследований.
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
59
Для анализа особенностей временного стати-
Один из весьма перспективных подходов к ра-
стического распределения фотонов обычно ис-
боте с оптическими свойствами живой ткани, до
пользуются так называемые сырые данные ФЭУ,
настоящего времени практически не используе-
в виде последовательностей интервалов между
мый в исследованиях ССС, - это технология оп-
импульсами - временных рядов. Техника реги-
тического просветления. Несмотря на значитель-
страции ССС при этом не имеет принципиаль-
ную отдаленность этой области, используемой в
ных отличий (кроме того, что используется счет-
микроскопических исследованиях в биологии и
чик, который регистрирует интервалы между
спектроскопических и томографических иссле-
электрическими импульсами), но при этом
дованиях в медицине, а также ее «побочные эф-
предъявляются повышенные требования к вре-
фекты» - возможное влияние на свободноради-
менному разрешению и стабильности работы де-
кальные процессы и соответственно процессы ге-
тектора фотонов. Для повышения стабильности
нерации фотонов, мы считаем ее одной из
чувствительности детектора на длительных ин-
возможных «точек роста» в исследованиях ССС.
тервалах используется высокая стабилизация
Ниже приводим краткое описание этой техно-
температуры и для питания ФЭУ применяются
логии.
источники высоковольтного напряжения с высо-
Биологические ткани представляют собой ма-
кой стабильностью и низким уровнем пульсаций.
териалы с низким уровнем поглощения и высо-
Например, в работе [275], в которой эксперимен-
кой рассеивающей способностью в видимой и
тальная установка на основе ФЭУ для регистра-
ближней ИК-области спектра со спадом величи-
ции временных рядов была описана наиболее де-
ны рассеяния по мере продвижения в ИК-об-
тально, температура фотокатода ФЭУ поддержи-
ласть, в то время как в УФ-диапазоне и рассея-
валась равной
-80°C с точностью
±0.1°C.
ние, и поглощение оказываются значительными
Значительное количество исследований посвя-
[287]. Спектральные свойства тканей как ключе-
щено статистике фотонов ССС различных биоло-
вые параметры для детектирования и визуализа-
гических объектов [276], в основном прорастаю-
ции ССС определяются индивидуальными спек-
щих семян [277-279] и поверхности тела человека
тральными характеристиками поглощающих
[280, 281] (см. также обзор [271]). Некоторые ав-
хромофоров и рассеивателей. Наиболее важными
торы предложили использовать статистику фото-
хромофорами являются вода, гемоглобин (окси-
нов и корреляционный анализ временных рядов
ССС для характеризации состояния биологиче-
генированный и деоксигенированный), меланин,
липофусцин, билирубин, липиды, каротиноиды,
ских систем [275, 278], в частности использовать
цитохромы и некоторые другие. Рассеяние опре-
их для медицинской диагностики [281]. Путем
деляется морфологией ткани, а именно размера-
корреляционного анализа в ряде работ было по-
ми отдельных микрокомпонентов ткани и их по-
казано, что CCC имеет характер вспышек (напри-
мер, работа [282]), что согласуется с результатами
казателем преломления относительно показателя
преломления окружающей их среды. Именно
ранних авторов, полученными методами биоло-
разница показателей преломления клеточных
гического детектирования [283] (методы биоло-
мембран, цитоплазмы, ядер, митохондрий, дру-
гического детектирования рассмотрены в ч. 2 на-
гих органелл, межтканевой жидкости и других
стоящего обзора [1]). Для исследования шумовых
компонент CCC применяли различные методы
компонентов тканей определяет характер упруго-
го рассеяния света в тканях.
цифровой обработки первичных данных, полу-
ченных на ФЭУ (автокорреляционный, Фурье- и
Рассеяние и поглощение определяют не толь-
вейвлет-анализ, в частности, мультифракталь-
ко спектральные свойства света, распространяю-
ный вейвлет-анализ и др.) [277, 278, 284, 285].
щегося и взаимодействующего с живыми тканя-
Развитые для исследований ССС методы на-
ми, но также глубину его проникновения и про-
шли применение и для анализа статистики фото-
странственное распределение света внутри ткани.
нов видимой глазом биолюминесценции, другого
Более того, оба явления тесно взаимосвязаны
типа свечения живых организмов, на несколько
друг с другом, потому что низкое рассеяние при-
порядков превосходящего по интенсивности
водит к меньшему пути взаимодействия для по-
ССС, например, было показано, что биолюми-
глощения фотонов, и наоборот, большее рассея-
несценция светящихся бактерий также имеет ха-
ние дает гораздо более длинные пути пробега фо-
рактер вспышек и подчиняется суперпуассонов-
тонов и поэтому эффективность поглощения
ской статистике [286].
увеличивается. Если поглощение хромофоров в
ПОТЕНЦИАЛЬНЫЕ ВОЗМОЖНОСТИ ИС-
ткани очень велико, то эмитируемые фотоны не
ПОЛЬЗОВАНИЯ ОПТИЧЕСКОГО ПРОСВЕТ-
могут распространяться внутри ткани на большие
ЛЕНИЯ БИОЛОГИЧЕСКИХ ТКАНЕЙ ДЛЯ
расстояния. В противоположном случае, когда
ЭФФЕКТИВНОГО СБОРА ПОТОКОВ СВЕРХ-
поглощение мало, а рассеяние велико, то фотоны
СЛАБЫХ СВЕЧЕНИЙ БИОЛОГИЧЕСКИХ
путешествуют внутри ткани в течение длительно-
СИСТЕМ
го времени по очень длинным ломаным траекто-
БИОФИЗИКА том 67
№ 1
2022
60
НАУМОВА и др.
риям, таким образом, свет становится диффуз-
ОПТ повышает эффективность обнаружения
ным и освещает большие объемы ткани.
слабых фотонных (люминесценция/флуоресцен-
ция) сигналов из глубины ткани, производимых
Оптические свойства живой ткани можно из-
раковыми клетками или патогенами [290, 293,
менять с помощью различных эффектов физиче-
317]. Например, в работе [293] с помощью местно-
ской или химической природы [287-320]. Одним
го применения ОПА на основе глицерина и
из привлекательных методов, широко используе-
ДМСО удалось значительно увеличить интенсив-
мым в физиотерапии, является местная обработ-
ность люминесценции Salmonella typhimurium че-
ка ткани биосовместимыми растворами, маслами
рез кожу свиньи.
или гелями. Многие из возникающих при этом
Пропускание коллимированного узкого све-
оптических явлений хорошо объясняются в рам-
тового пучка через слой ткани толщиной z описы-
ках теории дисперсных физических систем, что
вается законом Бугера-Бера-Ламберта, который
дает возможность эффективного управления оп-
справедлив для описания ослабления потока бал-
тическими свойствами таких систем, изменяя 1)
листических фотонов [287]:
показатель преломления рассеивателей или базо-
вого вещества, 2) упаковку рассеивателей и 3) их
Tc = I(z)/I0 = exp(-μtz),
размеры [287-320]. В свою очередь, изменение
где I0 и I(z) - интенсивности падающего и
этих микропараметров влечет за собой изменение
прошедшего световых потоков соответственно, μt
макропараметров, а именно толщины слоя ткани
- коэффициент экстинкции (ослабления) потока
и объемной доли таких компонентов, как вода,
излучения:
белки и липиды, которые также влияют на про-
пускание света через ткани с характерными де-
μt = μa + μs,
формациями спектров.
μa - коэффициент поглощения, а μs - коэф-
Управление оптическими свойствами ткани
фициент рассеяния.
при воздействии оптических просветляющих
Длину ослабления для потока баллистических
агентов (ОПА) - это новая технология, называе-
фотонов можно ввести как
мая иммерсионным оптическим просветлением
ткани (ОПТ) [287-320]. Многие ОПА являются
l
1.
(1)
t
гиперосмотическими агентами и широко исполь-
=μ
t
зуются в медицине, косметологии и пищевой
Ослабление в ткани диффузного светового по-
промышленности для несколько других целей.
тока с интенсивностью I0 можно описать с помо-
Одним из наиболее важных применений некото-
щью закона Бугера-Бера-Ламберта, модифици-
рых ОПА в биологии и медицине является их ис-
рованного для учета многократного рассеяния в
пользование в качестве криоконсервирующих
диффузионном приближении [287]:
(криозащитных) жидкостей для поддержания
клеток и тканей в живом состоянии при исполь-
T
d
d
=I z)
/I
0
= exp(−μ
eff
z),
(2)
зовании в клеточной терапии и для имплантации
где Id(z) - интенсивность света, переносимого
органов [306].
на расстояние z от исходного внутреннего источ-
Чаще всего используются следующие ОПА:
ника люминесценции с интенсивностью I0, μeff -
глицерин, пропиленгликоль, этиленгликоль, по-
эффективный коэффициент ослабления:
лиэтиленгликоль, глюкоза, фруктоза, а также
рентгеноконтрастные или МРТ-контрастные
μ
=
3μ
(μ
+ μ′),
(3)
eff
a
a
s
агенты [287, 317]. ОПТ является перспективной
где μs′ - приведенный коэффициент рассея-
технологией, которая благодаря своей простоте и
ния:
высокой эффективности позволяет находить но-
вые области применения в биологии и медицине
μ′
=
(
1- g)μ
(4)
s
s
на клеточном, тканевом и органном уровнях. Она
Здесь g - коэффициент анизотропии рассея-
позволяет эффективно снизить коэффициент
ния ткани, характеризующий степень анизотро-
рассеяния и увеличить коэффициент анизотро-
пии однократного рассеяния (g = 0 - полностью
пии рассеяния и, соответственно, увеличить оп-
изотропное рассеяние, а g = 1 - полностью анизо-
тическое пропускание слоя ткани; именно в этом
тропное рассеяние в направлении вперед).
состоит оптическое просветление. В результате в
ткани распространяются в основном фотоны с
Характерная длина, на которой диффузный
поток излучения в ткани спадает в e раз, опреде-
короткими зигзагообразными траекториями, и
появляется большая доля баллистических фото-
ляется уравнением (4) и равна
нов, которые не отклоняются, что позволяет до-
l = 1/μ
эфф
(5)
ставлять больше света к локализованному детек-
тору от слабых источников хемилюминесценции
Для многих тканей в широком диапазоне длин
внутри ткани.
волн от УФ до ближнего ИК μs >> μa, поэтому для
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
61
повышения оптического пропускания ткани (см.
ного вещества n можно определить как средне-
0
уравнения (1) и (4)) и увеличения характерной
взвешенное значение ПП цитоплазмы nср и ин-
длины распространения для баллистического и
терстициальной жидкости nISF с учетом их объ-
диффузного потоков фотонов (см. уравнения (3)
емных долей fcp и fISF, используя правила
и (7)) можно уменьшать коэффициент рассеяния
смешения ПП (закон Гладстона и Дейла) [287,
μs или приведенный коэффициент рассеяния
292, 306].
(также за счет уменьшения μs или за счет увеличе-
ния g, от типичного значения 0.9 для мягких тка-
n
0
= f
cp cp
n
+
(
1- f
)
cp ISF
n
(6)
ней вплоть до значений, близких к 1.0).
Типичная мягкая биоткань состоит из тонкого
Средний ПП рассеивателей
можно пред-
n
s
верхнего клеточного эпителиального слоя и под-
ставить как сумму ПП основного вещества
и
n
0
лежащей соединительной ткани (стромы) с сетью
дополнения, определяемого ПП тканевых воло-
волокон, погруженных в интерстициальную жид-
кон
n
, волокон nf, ядер клеток nnc и других
кость (ISF). Модель ткани можно представить
s
органелл nor с соответствующими объемными до-
как структуру с пространственными вариациями
показателя преломления (ПП) [287]. ПП основ-
лями ff, fnc и for [287, 292, 306]:
n
s
=n
0
+ f
f
(n
f
−n
ISF
)
+ f
(
nc nc
n
-n
cp
)
+ f
or
(
n
or
−n
cp
)
(7)
Коэффициент рассеяния ткани зависит от раз-
ческих свойств, разность ПП рассеивателей и ос-
новного вещества будет уменьшаться, таким об-
ности ПП рассеивателей n и окружающей среды
s
разом m → 1, а μs → 0 и g → 1 [287]. В свою очередь,
(основного вещества)n . Для простейшей модели
0
транспортная длина свободного пробега фотона,
ткани в виде монодисперсной системы диэлек-
определяющая среднюю длину его переноса до
трических сфер приведенный коэффициент рас-
акта поглощения или значительного изменения
сеяния μ′ описывается как [287-289]:
s
направления распространения, равная
0.37
2
2πn
0
a
2.09
1
μ′
=
3.28πa
ρ
(m
−1
)
,
(8)
l
=
(9)
s
s
tr
λ
μ
+
μ′
0
a
s
где a - радиус рассеивающих частиц (клеточ-
значительно увеличивается при согласовании
ных органелл и т. д.); ρs - объемная (числовая)
ПП рассеивателей и окружающей среды.
плотность частиц, то есть общее количество рас-
Из уравнения (10) следует, что небольшое уве-
сеивающих частиц в единице объема, fs/Vs, где fs -
личение ПП
, например от 1.35 до 1.39, а затем
n
0
объемная доля частиц по отношению к общему
и до 1.41, при постоянном значении
= 1.47,
n
s
объему, а Vs - объем отдельной рассеивающей ча-
приводит к уменьшению приведенного коэффи-
стицы, Vs = (4/3)πa3 для сферической частицы; λ0
циента рассеяния μ′ в 2.4 и 4.5 раза соответствен-
s
- длина волны света в вакууме;
m=n
/n
- от-
но (см. табл. 2). Соответственно, при постоянном
s
0
носительный ПП рассеивающих частиц и основ-
g коэффициент рассеяния μs также будет умень-
ного вещества. Уравнение (10) справедливо для
шаться в 2.4/4.5 раза. Для
n
= 1.41 поток балли-
0
следующего диапазона структурных параметров
стических фотонов через тонкий слой ткани (см.
ткани: g > 0.9, 5 < (2πa/λ) < 50, 1 <
< 1.1,
уравнение (1)) увеличивается примерно в два раза
(
)
n /ns
0
т.е. для невзаимодействующих «оптически мяг-
для слоя толщиной 0.1 мм и в 47 раз для более тол-
ких» рассеивателей Ми, что типично для многих
стого рассеивающего слоя ткани 0.5 мм, для кото-
рого до оптического просветления ослабление
мягких тканей.
было значительным, μs × z = 5. Для диффузного
Описанные модели тканей применимы к мяг-
ким тканям, таким как кожа и мышечная ткань.
света эффективность оптического просветления
По сравнению с межтканевой жидкостью и цито-
не такая высокая и может достигать 2.6 раза для
плазмой рассеивающие частицы плотнее, имеют
толстого слоя ткани с повышением коэффициен-
та пропускания Td от 17 до 44%. Следует отметить,
более высокий ПП и менее проницаемы для лю-
бых молекул, включая молекулы воды и ОПА.
что эти оценки были сделаны для фиксированно-
Для обеспечения оптического просветления тка-
го фактора анизотропии рассеяния g = 0.9, кото-
ни ПП ОПА должен быть выше, чем средний ПП
рый имеет тенденцию приближаться к единице
основного вещества n . Когда молекулы ОПА
при оптическом просветлении, поэтому эффек-
0
диффундируют в ткань или индуцируют поток
тивность для Td может быть несколько выше, чем
воды из ткани наружу за счет своих гиперосмоти-
показано в табл. 2.
БИОФИЗИКА том 67
№ 1
2022
62
НАУМОВА и др.
Таблица 2. Оценка эффективности ОПТ для ткани с начальным рассогласованием ПП
Tc
Td
μs, см-1
n
m
ltr, см
ld, см
0
μ′
s
, см-1
(g = 0.9)
Z = 0.01 см
Z = 0.05 см
Z = 0.1 см
Z = 1.0 см
Исходные
1.350
1.089
10
100
0.10
0.57
0.37
0.007
0.84
0.17
параметры
ОПТ1
1.390
1.058
4.2
42
0.23
0.88
0.66
0.12
0.89
0.32
ОПТ2
1.410
1.042
2.2
22
0.43
1.20
0.80
0.33
0.92
0.44
ОПТ1/исх
-
-
0.42
0.42
2.30
1.54
1.78
17.1
1.06
1.88
ОПТ2/исх
-
-
0.22
0.22
4.30
2.10
2.16
47.1
1.09
2.6
Примечание.
n
= 1.470,
n
=1.350, μs = 100 см-1, μa = 0.1 см-1, g = 0.9.
s
0
В случае исследований in vivo более выражен-
некоторое увеличение коэффициента рассеяния,
ными становятся и другие механизмы ОПТ [287,
в то время как для более плотных тканей всегда
291-297, 320]. Например, действие гиперосмоти-
происходит уменьшение коэффициента рассея-
ческих ОПА вызывает временную и обратимую
ния за счет этого механизма.
дегидратацию тканей, что приводит к дополни-
Концепция «оптических окон прозрачности»
тельному согласованию ПП, сжатию ткани и со-
плодотворна для оценки характера переноса оп-
ответственно установлению ближнего порядка
тического излучения определенного диапазона
компонентов ткани (рассеивателей). Временная
длин волн при обнаружении слабой люминесцен-
и обратимая диссоциация биологических моле-
ции из глубины ткани и ожидаемой деформации
кул на более мелкие фрагменты приводит к неко-
спектра детектируемого излучения за счет внут-
торому уменьшению рассеяния. Кровь как систе-
ренней фильтрации излучения структурами тка-
ма частиц, демонстрирующая ярко выраженные
ни. Обычно имеется несколько
«оптических
эффекты оптического просветления при условии
окон» в видимом и ближнем ИК-диапазонах, од-
согласования ПП, дает свой вклад в ОПТ, кото-
нако технология ОПТ позволяет открывать не-
рый может модифицироваться за счет агрегации,
сколько новых виртуальных «оптических окон» в
набухания или сжатия эритроцитов при действии
УФ-области и использовать их для доставки оп-
ОПА [292, 318].
тического сигнала [287, 292, 306, 307, 309, 316,
Чтобы учесть влияние ближнего порядка рас-
319]. Сильное рассеяние биологических тканей в
сеивателей, возникающего при действии ОПА, на
УФ-диапазоне препятствует широкому исполь-
изменение коэффициента рассеяния и соответ-
зованию УФ-технологий в биологии и медицине.
ственно на эффективность ОПТ, уравнение (10)
Следовательно, возможность временного подав-
следует модифицировать, используя простую эв-
ления сильного рассеяния света с помощью под-
ристическую модель взаимодействия частиц
ходящих ОПА, прозрачных в УФ-диапазоне, мо-
[288]:
жет значительно повысить эффективность техно-
логии ОПТ в этом диапазоне.
μ′
=
μ′
×
1−
f
(10)
(
s
)
mod
s
(
s
)
Например, в работе [316] для исследования ex
Согласно уравнениям (1) и (12), если объемная
vivo образцов альвеолярных десен свиней толщи-
доля частиц fs мала, рассеяние невелико. Оно так-
ной образцов (0.59 ± 0.08) мм в качестве ОПА ис-
же мало, когда fs приближается к единице (плот-
пользовали высококонцентрированный водный
ная упаковка). Максимальное рассеяние ожида-
раствор глицерина 87.5%. Важно, что глицерин не
ется при fs = 0.5. Для нормальных мягких тканей
имеет полос поглощения в диапазоне 150-800 нм.
объемная доля рассеивателей находится в диапа-
После погружения образцов ткани десны в 87.5%-й
зоне от 0.2 до 0.6, поэтому для некоторых из них
раствор глицерина коэффициент пропускания
дегидратация тканей на начальном этапе приме-
ткани увеличивается по сравнению с нативными
нения гиперосмотического ОПА может вызвать
образцами во всем спектральном диапазоне
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
63
Рис. 19. Спектры полного оптического пропускания образца десны свиньи, измеренные с помощью интегрирующей
сферы до (кривые 1) и после (кривые 2) аппликации 87.5%-раствора глицерина в течение 100 мин, в диапазоне длин волн:
200-800 нм (а) и 200-400 нм (б); расчетная эффективность оптического просветления по данным измерений (в) (из работы
[316]).
(рис. 19а,б), что связано с уменьшением рассея-
почти 3500% за счет очень малого начального
ния света в ткани. В областях 415-420 и 540-
пропускания из-за сильного рассеяния света в
580 нм спектральные особенности соответствуют
этой области и высокой чувствительности приве-
полосам поглощения оксигемоглобина (415, 542 и
денного коэффициента рассеяния к изменению
576 нм).
показателя преломления среды, окружающей
рассеиватели (см. уравнение (10)).
Эффективность ОПТ можно определить как
Если в слизистой оболочке десен были иден-
T t)
−T(t
=
0)
тифицированы три виртуальных «оптических ок-
QT)
=
×100%,
(11)
на» (200-250 нм, 250-300 нм и 300-400 нм)
T(t
=
0)
(рис. 19б), которые были успешно использованы
где T(t = 0) - коэффициент полного пропуска-
для повышения эффективности УФ-терапии
ния слоя ткани в начальный момент времени (до
[316], то ОПТ с помощью глицерина позволило
применения OПA), T(t) - коэффициент полного
обнаружить два «оптических окна» в УФ-области
пропускания в текущий момент времени t (после
для слизистой оболочки толстой кишки (200-
аппликации ОПА). Из рис. 19в хорошо видно, что
260 нм и 260-418 нм), что было использовано для
эффективность ОПТ выше 100% для всего спек-
идентификации патологической ткани [307, 309].
трального диапазона от 200 до 800 нм, и является
В последнем примере, два длинноволновых окна
максимальной для УФ-области, где она достигает
прозрачности слились в одно большое окно, по-
БИОФИЗИКА том 67
№ 1
2022
64
НАУМОВА и др.
скольку прозрачность ткани оказалась более вы-
SNSPD) [324, 325], а также однофотонных детек-
сокой, чем в первом примере.
торов с использованием других низкоразмерных
материалов [326-328]. Можно ожидать, что для
Таким образом, технология оптического про-
пространственно-временных и полихроматиче-
светления с использованием биологически сов-
ских спектральных исследований ССС биологи-
местимых агентов позволяет увеличить выход
ческих объектов в ближайшее время будут более
слабой люминесценции из глубины ткани, что
активно использоваться также CCD-камеры с
недавно было продемонстрировано in vivo для
электронным умножением (EMCCD), а дальней-
мышей при детектировании флуоресценции опу-
шее совершенствование технических характери-
холевых клеток [317]. В то же время в отношении
стик CMOS-камер позволит использовать для ис-
ССС биологические ткани - это не пассивные
следований ССС также и эти устройства. Элемен-
среды, пропускающие фотоны, сгенерированные
ты, способные регистрировать перенос одного
извне, а «активные участники» процесса. Как из-
электрона [329], перспективны для исследования
вестно, генерация ССС - свободно-радикальный
сверхслабых излучений [327], поскольку они ис-
процесс, сопряженный с перекисным окислени-
ключат необходимость усиления потока электро-
ем липидов, аминокислот и других биологиче-
нов (например, в ФЭУ) или длительного накоп-
ских молекул, и изменение состава окружающей
ления заряда (в CCD), что должно снизить шумы
среды может значительно влиять на его протека-
и улучшить временные характеристики счетчи-
ние. Однако это не означает невозможность ис-
ков фотонов.
пользования таких технологий, а только необхо-
димость соблюдать осторожность в интерпрета-
Область исследований ССС видимого, ближ-
ции получаемых результатов. В этом смысле
него ИК- и ближнего УФ-диапазонов хорошо
данная методика аналогична любым другим под-
развита: основные механизмы и каскады реакций
ходам, модифицирующим спонтанное ССС: фо-
уже вполне изучены, методы исследований опи-
то- или хемииндуцированной люминесценции,
саны в учебниках, ведутся активные научные ра-
активированной люминесценции и т.д. В каждом
боты, как в фундаментального, так и прикладного
из этих случаев ССС, регистрируемое от системы,
характера. Экспериментальные методы исследо-
не является ее спонтанным «природным» продук-
вания продолжают развиваться по мере совер-
том и потому требует специальных подходов в ин-
шенствования техники, методов анализа сигна-
терпретации. В то же время все эти подходы поз-
лов, развития теоретических знаний. Методики,
воляют получить много дополнительной ценной
основанные на исследованиях ССС в этом диапа-
информации об исследуемой системе, которую
зоне, уже нашли целый ряд практических приме-
не может дать регистрация только спонтанного
нений [330-333], некоторые используются уже
излучения.
несколько десятилетий в медицинских и исследо-
вательских лабораториях [334], значительное ко-
ЗАКЛЮЧЕНИЕ
личество находятся на этапе внедрения. В связи с
В настоящее время область техники детекти-
этим парадоксальным представляется состояние
рования сверхслабых излучений, в том числе с
исследований ССС в среднем ультрафиолетовом,
пространственным, временным и спектральным
т.е. в том диапазоне, с которого началось разви-
разрешением, активно развивается в связи с не-
тие всего научного направления (первые 25 лет
обходимостью решения задач биомедицинской,
все работы по тематике ССС велись только в об-
военной и космической техники. Близкие задачи
ласти среднего УФ-диапазона). За последние не-
детектирования и 2D-визуализации сверхслабых
сколько десятилетий предпринимались только
оптических излучений в широком спектральном
единичные попытки исследовать УФ-компонен-
диапазоне ставятся при разработке техники аст-
ту ССС биологических объектов [335], и сведения
рофизических исследований, при этом отличием
о ней остались практически на уровне 1940-х го-
от исследований ССС является то, что регистри-
дов. Отношение к исследованиям ССС «митоге-
руются направленные излучения. Ожидается, что
нетического» периода неоднозначно, и в массо-
разработанные для астрофизических исследова-
вом сознании они часто ассоциируются с «лжена-
ний матрицы детекторов на кинетической индук-
укой» (см. ч. 1 данного обзора [16]). Вместе с тем
тивности (Microwave Kinetic Inductance Detector,
результаты исследований ССС «митогенетиче-
MKID) [321, 322] в 2020-х годах заменят твердо-
ского» периода не опровергнуты, но и не доказа-
тельные матрицы в этой области [323], перспек-
ны, они могут и должны быть проверены с ис-
тивны они и для применения в области исследо-
пользованием арсенала современной науки. Эти
ваний ССС. Кроме детекторов на кинетической
исследования охватывали ряд важнейших фунда-
индуктивности в области исследований ССС
ментальных проблем биологии и медицины, со-
перспективно применение и других типов
хранивших актуальность и в настоящее время, та-
сверхпроводниковых детекторов, например,
ких как причины деления клетки, процессы кан-
нанопроволочных однофотонных детекторов
церогенеза и др.
[64,
283,
336,
337]. Из
(superconducting nanowire single photon detector,
прикладных результатов представляет значитель-
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
65
ный интерес проверка метода онкодиагностики,
СПИСОК ЛИТЕРАТУРЫ
основанной на исследованиях ССС в среднем
1.
И. В. Володяев, Л. В. Белоусов, И. И. Концевая
УФ-диапазоне, и идентификация заявленного
и др., Биофизика 66 (6), 1082 (2021).
универсального пептидного онкомаркера крови,
2.
W. Stempell, Biologisches Zentralblatt 9, 607 (1929).
тушащего хемилюминесценцию крови (согласно
3.
W. Stempell and G. V. Romberg, Protoplasma 13 (1),
клиническим данным 1940-х годов специфич-
28 (1931).
ность и чувствительность онкодиагностики пре-
вышали 95%) [338-342]. Это востребовано для
4.
W. Stempell, Die unsichtbare Strahlung der Lebewesen
ранней онкодиагностики, оценки эффективно-
(Mitogenetische oder Organismenstrahlung). (Verlag
сти проведенной онкотерапии и своевременного
von Gustav Fischer, Jena, 1932).
обнаружения метастазов. Появившиеся техниче-
5.
M. Heinemann, Nature 134, 701 (1934).
ские возможности детектирования сверхслабых
6.
M. Heinemann, Acta Brevia Nederland. 5, 15 (1935).
излучений среднего УФ диапазона (например,
7.
W. Stempell, Protoplasma 12, 538 (1931).
высокочувствительные малошумящие солнечно-
8.
L. Petri and R. C. Accad, Lincei Ser. VI 7, 891 (1928).
слепые ФЭУ) позволяют выполнить однознач-
ную проверку большого комплекса результатов
9.
J. Magrou, Compt. Rend. Acad. Sci. (Paris) 190, 84
исследований ССС, полученных с помощью био-
(1930).
логических детекторов. Развитие техники и мето-
10.
G. W. Taylor and E. N. Harvey, Biolog. Bull. 61 (3),
дов исследования ССС в среднем УФ и современ-
280 (1931).
ную проверку результатов «митогенетического»
11.
B. Rajewsky, in Zehn Jahre Forschung auf dem physika-
периода мы полагаем одним из наиболее важных
lisch-medizinischen Grenzgeibiet, ed. by F. Dessauer
и перспективных направлений в области иссле-
(Georg Thieme Verlag, Leipzig, 1931), pp. 244-257.
дований ССС.
12.
G. Frank and S. Rodionow, Biochemische Zeitschrift
БЛАГОДАРНОСТИ
249 (4/6), 323 (1932).
13.
H. Barth, Biochemische Zeitschrift 285, 311 (1936).
Для обзора ранних работ по ССС был исполь-
14.
L. Grebe, A. Krost, and L. Peukert, Strahlenther
зован уникальный архив научных публикаций,
Onkol. 60, 538 (1937).
собранный
А.Г. Гурвичем,
его
женой
15.
Р. Одюбер, Успехи химии 7 (12), 1858 (1938).
Л.Д. Гурвич, дочерью А.А. Гурвич и внуком
Л.В. Белоусовым, за что авторы выражают благо-
16.
Е. В. Наумова, Ю. А. Владимиров, Л. В. Белоусов
дарность их наследникам.
и др., Биофизика 66 (5), 900 (2021).
17.
Л. В. Белоусов, В. Л. Воейков и Ф.-А. Попп, При-
Авторы выражают глубокую признательность
рода, № 3, 64 (1997).
А.А. Красновскому мл. за бесценные советы,
18.
V. L. Voeikov and L. V. Beloussov, in Biophotonics and
справедливую критику и правку текста статьи, а
Coherent Systems in Biology (Springer US, Boston,
также выражают благодарность М.Б. Барнякову
MA, 2007), pp. 1-16.
за полезные замечания и дополнения, касающие-
ся счетчиков фотонов.
19.
I. V. Volodyaev and L. V. Beloussov, Front. Physiol. 6
(00241), 1 (2015).
ФИНАНСИРОВАНИЕ РАБОТЫ
20.
E. V. Naumova, A. E. Naumova, D. A. Isaev, and
Исследование выполнено при финансовой
I. V. Volodyaev, J. Biomed. Photonics & Engineering 4
(4), 040201 (2018).
поддержке Российского фонда фундаментальных
исследований в рамках научного проекта № 20-
21.
L. Colli and U. Facchini, Il Nuovo Cimento 12 (1),
12-50328.
150 (1954).
22.
L. Colli, U. Facchini, G. Guidotti, et al., Experientia
Исследования ВВТ были также поддержаны в
11 (12), 479 (1955).
рамках гранта 13.2251.21.0009 Министерства нау-
23.
Ю. А. Владимиров, Сверхслабые свечения при био-
ки и высшего образования Российской Федера-
химических реакциях (Наука, М., 1966).
ции (075-15-2021-942).
24.
Б. Н. Тарусов, И. И. Иванов и Ю. М. Петрусевич,
КОНФЛИКТ ИНТЕРЕСОВ
Сверхслабое свечение биологических систем. (Изд-
во МГУ, М., 1967).
Авторы заявляют об отсутствии конфликта
25.
Ю. А. Владимиров и Е. В. Проскурнина, Успехи
интересов.
биол. химии 49, 341 (2009).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАР-
26.
V. L. Voeikov, Riv. Biol. 103 (2-3), 321 (2010).
ТОВ
27.
M. Cifra and P. Pospisil, J. Photochem. Photobiol. B,
Настоящая работа не содержит описания ис-
Biology 139, 2 (2014).
следований с использованием людей и животных
28.
S. Cova, M. Ghioni, A. Lacaita, et al., Appl. Optics 35
в качестве объектов.
(12), 1956 (1996).
БИОФИЗИКА том 67
№ 1
2022
66
НАУМОВА и др.
29.
29. T. Isoshima, Y. Isojima, K. Hakomori, et al., Rev.
56.
Б. Н. Тарусов, А. И. Поливода и А. И. Журавлев,
Sci. Instrum. 66 (4), 2922 (1995).
Биофизика 6 (4), 490 (1961).
30.
Y. Isojima, T. Isoshima, K. Nagai, et al., Neuroreport
57.
Б. Н. Тарусов, А. Н. Поливода и А. И. Журавлев,
6 (4), 658 (1995).
Радиобиология 1 (1), 150 (1961).
31.
Y. P. Chen, Y. J. Liu, X. L. Wang, et al., J. Integr. Plant
58.
Р. Ф. Васильев, О. И. Карпухин и В. Я. Шляпин-
Biol. 47 (7), 849 (2005).
тох, Докл. АН СССР 125 (1), 106 (1959).
32.
C. Bruschini, H. Homulle, I. M. Antolovic, et al.,
59.
А. И. Журавлёв, Квантовая биофизика животных
Light, Science & Applications 8, 87 (2019).
и человека: Учеб. пособие (Бином, М., 2015).
33.
F. Ceccarelli, G. Acconcia, A. Gulinatti, et al., Adv.
60.
Ю. А. Закотеев, Хемилюминесценция. Принципы и
Quantum Technol. 4 (2), 2000102 (2021).
методики регистрации, оборудование, задачи
(Москва, 2015).
34.
R. K. Henderson, N. Johnston, F. M. D. Rocca, et al.,
IEEE J. Solid State Circuits 54 (7), 1907 (2019).
61.
P. Madl, in Fields of the Cell, Ed. by D. Fels, M. Cifra,
and F. Scholkmann (Research Signpost, Kerala, In-
35.
Photomultiplier tubes: Basics and applications, 4th ed.
dia, 2015), pp. 55-69.
(Hamamatsu Photonics, 2017).
62.
A. Potozky, Biologischen Zentralblatt 50, 712 (1930).
36.
В. Л. Воейков и И. В. Баскаков, Доклады РАН
334, 234 (1994).
63.
A. Potozky, Biologischen Zentralblatt 52 (3), 9 (1932).
37.
А. П. Бойченко, Журн. научной и прикладной фо-
64.
А. Г. Гурвич и Л. Д. Гурвич, Введение в учение о ми-
тографии 46 (6), 48 (2001).
тогенезе (Изд-во Акад. мед. наук СССР, М., 1948).
38.
А. П. Бойченко, в сб. Тезисы IV Международного
65.
R. Hagens, F. Khabiri, V. Schreiner, et al., Skin Res.
конгресса «Слабые и сверхслабые поля и излучения в
Technol. 14 (1), 112 (2008).
биологии и медицине» (2006), с. 84.
66.
B. Rajewsky, Strahlenther Onkol. 39, 194 (1930).
39.
А. П. Бойченко, Экологич. вестн. научных цен-
67.
B. Rajewsky, Zeits. f. Physik 63, 576 (1930).
тров ЧЭС 8 (4), 5 (2011).
68.
H. Geiger and W. Müller, Die Naturwissenschaften 16
40.
А. П. Бойченко, Технологии живых систем 5 (1),
(31), 617 (1928).
72 (2008).
69.
H. Geiger and W. Müller, Physikalische Zeitschrift 29,
41.
L. Colli, U. Facchini, and A. Rossi, Nuovo Cimento
839 (1928).
11 (3), 255 (1954).
70.
O. Rahn, Invisible radiations of organisms (Gebrüder
42.
B. L. Strehler and W. Arnold, J. Gen. Physiol. 34 (6),
Bornträger, Berlin, 1936).
809 (1951).
71.
F. Dessauer, Archiv für exper. Zellforschung, be-
43.
M. Takeda, M. Kobayashi, M. Takayama, et al., Can-
sonders Gewebezüchtung 11, 37 (1931).
cer Sci. 95 (8), 656 (2004).
72.
W. Gerlach, Sitzungsber. Ges. Morphol. und Physiol.
44.
M. Kobayashi, J. Photochem. Photobiol. B 139, 34
(München) 42, 1 (1933).
(2014).
73.
H. Barth, Arch. Biol. Sci. Ser B 35 (1), 29 (1934).
45.
M. Kobayashi, T. Iwasa, and M. Tada, J. Photochem.
74.
A. Hollaender and W. D. Claus, J. Optic. Soc. Amer.
Photobiol. B 159, 186 (2016).
25, 270 (1935).
46.
F. Ortega-Ojeda, M. Calcerrada, A. Ferrero, et al.,
75.
B. Rajewsky, Zeitschrift für Krebsforschung 35 (1),
Sensors (Basel) 18 (4) (2018).
387 (1932).
47.
R. Van Wijk, E. P. A. Van Wijk, Y. Schroen, and J. van
76.
H. Schreiber and W. Friedrich, Biochem. Zeitsch.
der Greef, 15, 27 (2013).
(227), 386 (1930).
48.
W. L. Chen, D. Xing, S. Tan, et al., Luminescence 18
77.
G. Frank and S. Rodionow, Die Naturwissenschaften
(1), 37 (2003).
19 (30), 659 (1931).
49.
D. Xing, S. C. Tan, Y. H. Tang, et al., Chinese Sci.
78.
С. Родионов и Г. М. Франк, Вопросы свето-биоло-
Bull. 44 (23), 2159 (1999).
гии и измерения света (Гос. техн.-теорет. изд-во,
М.-Л., 1934).
50.
Ю. А. Владимиров и Ф. Ф. Литвин, Биофизика 4
(5), 601 (1959).
79.
С. Родионов и Г. М. Франк, Архив биол. наук, сер.
Б 35 (1), 277 (1934).
51.
S. Tudisco, F. Musumeci, A. Scordino, and G. Privit-
era, Rev. Sci. Instrum. 74 (10), 4485 (2003).
80.
G. Locher, Phys. Rev. 42, 525 (1932).
52.
L. Lanzano, A. Scordino, S. Privitera, et al., Eur. Bio-
81.
F. Seyfert, Jahrb. Wiss. Bot. (76), 747 (1932).
phys. J. 36 (7), 823 (2007).
82.
R. Audubert and V. Doormaal, Comptes Rendus des
53.
H. J. Niggli, S. Tudisco, G. Privitera, et al., J. Biomed.
Sciences 196, 1883 (1933).
Opt. 10 (2), 024006 (2005).
83.
W. W. Siebert and H. Seffert, Naturwissenschaften 21
54.
Ю. А. Владимиров и Ф. Ф. Литвин, Биофизика 3
(9), 193 (1933).
(5), 606 (1958).
84.
J. Gray and C. Ouellet, Proc. Roy. Soc. Lond. Ser. B
55.
Р. Ф. Васильев, О. Н. Карпухин и В. Я. Шляпин-
114 (786), 1 (1933).
тох, Журн. физ. хим. 35, 461 (1961).
85.
E. Lorenz, J. Gen. Physiol. 17 (6), 843 (1934).
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
67
86. K. H. Kreuchen and J. B. Bateman, Protoplasma 22
115. Р. Ф. Васильев и И. Ф. Русина, Докл. АН СССР
(1), 243 (1934).
156 (6), 1402 (1964).
87. Г. Барт, Архив биол. наук 46 (1), 153 (1937).
116. Р. Ф. Васильев и И. Ф. Русина, Изв. АН СССР,
88. E. Lorentz, Phys. Rev. (44), 329 (1929).
сер. хим. 9, 1728 (1964).
89. W. W. Siebert and H. Seffert, Архив биол. наук 35,
117. R. F. Vasiljev, in Progress in Reaction Kinetics (Pergam-
177 (1934).
on, New York, 1967), V. 4, p. 305.
90. W. Siebert and H. Seffert, Biochemische Zeitschrift
118. Ю. А. Владимиров и А. И. Арчаков, Перекисное
287, 92 (1936).
окисление липидов в биологических мембранах (Нау-
ка, М., 1972).
91. A. Hollaender and W. D. Claus, An experimental study
of the problem of mitogenetic radiation (National Re-
119. О. Н. Карпухин, В. Я. Шляпинтох, Н. В. Золотова
search Council of the National Academy of Sciences,
и др., Журн. физ. химии 37, 1636 (1963).
Washington, 1937).
120. В. Я. Шляпинтох, О. Н. Карпухин, Л. М. Постни-
92. K. W. Haussert and K. H. Kreuchen, Zeits. f. tech.
ков и др., Хемилюминесцентные методы исследова-
Physik 15, 20 (1934).
ния медленных химических процессов (Наука, М.,
1966).
93. M. W. Karev and S. F. Rodionov, Zeits. f. Physik 92
(615-621) (1934).
121. Ю. А. Владимиров, М. В. Корчагина и В. И. Оле-
94. K. H. Reiss, Zeits. f. Physik 93 (411) (1935).
нев, Биофизика 16 (5), 952 (1971).
95. Е. Lorenz, Pub. Hlth. Rep. 48, 1311 (1933).
122. М. В. Корчагина и Ю. А. Владимиров, в сб. Тезисы
докл. Симп. «Свободнорадикальные состояния и их
96. R. Audubert, Trans. Faraday Soc. 35 (213), 197 (1939).
роль при лучевом поражении и злокачественном ро-
97. J. B. Bateman, Biol. Rev. 10 (1), 42 (1935).
сте» (М., 1971), с. 49.
98. L. A. Kubetsky, Proc. Institute of Radio Engineers 25
123. Ю. А. Владимиров, Т. Б. Суслова, В. И. Оленев и
(4), 421 (1937).
З. П. Черемисина, в сб. Митохондрии, биохимиче-
99. V. K. Zworykin, G. A. Morton, and L. Malter, Proc.
ские функции в системе клеточных органелл, под
IRE 24 (3), 351 (1936).
ред. С. Е. Северина (Наука, М., 1969), с. 203.
100. J. Rajchman and E. W. Pike, RCA Technical Report
124. Ю. А. Владимиров, Е. В. Проскурнина, Д. Ю. Из-
TR-362 (September 9) (1937).
майлов и др., Источники и мишени свободных ради-
101. Г. Г. Шишкин, Электроника, 2-е изд., испр. и доп.
калов в крови человека (МАКС Пресс, М., 2017).
ed. (Юрайт, Москва, 2017).
125. Я. И. Серкиз, Е. Е. Чеботарев, В. А. Барабой и др.,
102. Н. С. Матвеева, Дисс. … канд. биол. наук (МГУ,
Хемилюминесценция крови в экспериментальной и
М., 2012).
клинической онкологии (Наук. думка, Киев, 1984).
103. G. A. Russell, J. Amer. Chem. Soc. 79 (14), 3871
126. А. И. Журавлев и А. И. Журавлева, Сверхслабое
(1957).
свечение сыворотки крови и его значение в комплекс-
104. V. A. Belyakov and R. F. Vassil'ev, Photochem. Photo-
ной диагностике (Медицина, М., 1975).
biol. 11 (3), 179 (1970).
127. М. П. Шерстнев, Дисс. … д-ра мед. наук (НИИ
105. J. A. Howard and K. U. Ingold, J. Amer. Chem. Soc.
физико-химической медицины МЗ РФ, 1997).
90 (4), 1056 (1968).
128. М. Н. Молоденков и В. Н. Шилов, Труды 2-го
106. R. E. Kellogg, J. Amer. Chem. Soc. 91 (20), 5433
МОЛГМИ им. Н.И. Пирогова 9 (8), 60 (1974).
(1969).
129. А. П. Шаров, Ю. А. Владимиров, Ю. М. Лопухин
107. Р. Ф. Васильев, Дисс. … д-ра физ.-мат. наук (ЛГУ
и М. Н. Молоденков, Труды 2 МОЛГМИ, сер. Хи-
им. А. А. Жданова, Л., 1963).
рургия, № 8, 49 (1974).
108. Р. Ф. Васильев, Оптика и спектроскопия 18 (2),
130. А. П. Шаров, Ю. М. Лопухин, М. Н. Молоденков
236 (1965).
и Ю. А. Владимиров, в сб. Тезисы докл. IV Между-
народного биофизического конгресса (Москва,
109. Р. Ф. Васильев, Оптика и спектроскопия 18 (3),
1972), с. 360.
415 (1965).
110. Р. Ф. Васильев, в Биолюминесценция. Труды МО-
131. Я. И. Серкиз, Эксперим. онкология 3 (3), 67
ИП (Наука, М, 1965), т. 21, сс. 198-202.
(1980).
111. Р. Ф. Васильев и А. А. Вичутинский, Докл. АН
132. A. Shanei, Z. Alinasab, A. Kiani, and M. A. Nematol-
СССР 145 (6), 1301 (1962).
lahi, J. Biomed. Phys. Eng. 7 (4), 389 (2017).
112. Р. Ф. Васильев и А. А. Вичутинский, Докл. АН
133. F. Khabiri, R. Hagens, C. Smuda, et al., Skin Res.
СССР 142 (3), 615 (1962).
Technol. 14 (1), 103 (2008).
113. Р. Ф. Васильев, А. А. Вичутинский и А. С. Черка-
134. Ю. А. Владимиров, Ф. Ф. Литвин и Т. Мань-ци,
сов, Докл. АН СССР 149 (1), 124 (1963).
Биофизика 7 (6), 675 (1962).
114. Р. Ф. Васильев и А. А. Вичутинский, Журн. физ.
135. R. O. Recknagel and A. K. Ghoshal, Lab. Invest. 15,
химии 36 (8), 1799 (1962).
132 (1966).
БИОФИЗИКА том 67
№ 1
2022
68
НАУМОВА и др.
136. Т. Б. Суслова, В. И. Оленев и Ю. А. Владимиров,
161. V. L. Voeikov, R. Asfaramov, E. V. Bouravleva, et al.,
Биофизика 13, 723 (1968).
Ind. J. Exp. Biol. 43, 473 (2003).
137. Ю. А. Владимиров, О. Ф. Львова и З. П. Череми-
162. B. Gabriel and J. Teissie, Eur J Biochem 223 (1), 25
сина, Биохимия 31 (3), 507 (1966).
(1994).
138. Ю. А. Владимиров и О. Ф. Львова, Биофизика 9
163. B. S. Cheun, S. H. Yi, K. Y. Baik, et al., J. Environ. Bi-
(4), 506 (1964).
ol. 28 (4), 735 (2007).
139. Ю. А. Владимиров и О. Ф. Львова, в сб. Биофизика
164. M. Bereta, M. Teplan, D. E. Chafai, et al., Sci. Rep. 11
клетки, под ред. Г. М. Франка (Наука, М., 1965),
(1), 328 (2021).
сс. 74-83.
165. H. Sardarabadi, F. Zohrab, P. Vahalovac, and M. Ci-
140. О. Ф. Львова, Дисс. … канд. мед. наук (1966).
fra, in Endogenous Biophotonics (Springer, 2021), pp.
141. О. Ф. Львова и Ю. А. Владимиров, Труды МОИП
(in print).
16, 214 (1966).
166. 166. А. А. Красновский (мл.) и Ф. Ф. Литвин, ДАН
142. S. R. Forthney and W. S. Linn, Arch. Biochem. Bio-
СССР 173 (2), 451 (1967).
phys. 104 (2), 241 (1964).
167. А. Н. Теренин, Фотохимия красителей и родствен-
143. P. Hochstein and L. Ernster, Biochem. Biophys. Res.
ных органических соединений (Гостехиздат, М.-Л.,
Commun. 12, 388 (1963).
1947).
144. P. Hochstein, K. Nordenbrand, and L. Ernster, Bio-
168. 168. А. Н. Теренин, Фотоника молекул красителей
chem. Biophys. Res. Commun. 14, 323 (1964).
и родственных органических соединений (Наука, Л.,
145. F. E. Hunter, Jr., J. M. Gebicki, P. E. Hoffsten, et al.,
1967).
J. Biol. Chem. 238 (2), 828 (1963).
169. C. A. Parker and T. A. Joyce, Photochem. Photobiol.
146. F. E. Hunter, Jr., A. Scott, P. E. Hoffsten, et al., J. Bi-
6 (6), 395 (1967).
ol. Chem. 239, 604 (1964).
170. А. А. Красновский (мл.), В. А. Шувалов, Ф. Ф.
147. F. E. Hunter, Jr., A. Scott, J. Weinstein, and A.
Литвин и А. А. Красновский (старший), ДАН
Schneider, J. Biol. Chem. 239, 622 (1964).
СССР 199, 1181 (1971).
148. E. H. Thiele and J. W. Huff, Arch. Biochem. Biophys.
171. А. А. Красновский (мл.), В. А. Романюк и Ф. Ф.
88, 203 (1960).
Литвин, ДАН СССР 209 (4), 965 (1973).
149. Ю. А. Владимиров, Т. Б. Суслова и В. И. Оленев,
172. А. А. Красновский (мл.) и Ф. Ф. Литвин, Изв. АН
Биофизика 14 (5), 836 (1969).
СССP. Сер. физ. 39 (9), 1968 (1975).
150. Т. Б. Суслова, В. И. Оленев и Ю. А. Владимиров,
173. N. N. Lebedev, Y. Naus, and A. A. Krasnovsky Jr.,
Биофизика 14, 510 (1969).
Biophysics 21 (2), 382 (1976).
151. Ю. А. Владимиров, П. И. Гутенев и П. И. Кузне-
174. A. A. Krasnovsky, Photochem Photobiol 36 (6), 733
цов, Биофизика 18 (6), 1024 (1973).
(1982).
152. Ю. А. Владимиров, Соросовский образоват. журн.
175. А. А. Красновский (мл.) и Ю. В. Ковалев, Биохи-
7 (1), 16 (2001).
мия 79 (4), 443 (2014).
153. Ю. А. Владимиров, З. П. Черемисина и Т. Б. Сус-
176. A. A. Krasnovsky (Jr), in Handbook of Porphyrin Sci-
лова, Биофизика 17 (4), 702 (1972).
ence with Applications to Chemistry, Physics, Materials
154. A. J. Williams and P. J. Cole, Thorax 36 (11), 866
Science, Engineering, Biology and Medicine, Ed. by
(1981).
K. M. Kadish, K. M. Smith, and R. Guilard (World
155. V. L. Voeikov and C. N. Novikov, SPIE Proc. 3194,
Sci. Publ., Singapore, 2014), V. 33, pp. 77-165.
328 (1998).
177. А. А. Красновский (мл.) и Ф. Ф. Литвин, Молеку-
156. Ю. А. Владимиров и М. П. Шерстнев, Хемилюми-
ляр. биология 1 (5), 712 (1967).
несценция клеток животных (М., 1989).
178. А. А. Красновский (мл.) и М. Г. Шапошникова,
157. Ю. А. Владимиров и А. Я. Потапенко, Физико-хи-
Молекуляр. биология 8 (5), 666 (1974).
мические основы фотобиологических процессов:
179. A. A. Krasnovsky (Jr) and F. F. Litvin, Photochem.
учебное пособие для медицинских и биологических
Photobiol. 20, 133 (1974).
спец. вузов (Высш. школа, М., 1989).
180. A. A. Krasnovsky, Acta Phys. Chem. 23 (1), 147
158. Ю. А. Владимиров и М. П. Шерстнев, в сб. Биофи-
(1977).
зические методы диагностики, Труды 2-го Москов-
181. A. A. Красновский (мл.) и Е. А. Венедиктов, Био-
ского Медицинского института (М., 1990), сс. 3-
физика 23 (2), 387 (1978).
40.
182. А. А. Красновский (мл.), Биофизика 21 (4), 748
159. V. L. Voeikov, C. N. Novikov, and N. I. Siuch, SPIE
(1976).
Proc., 2985, 286 (1997).
183. А. А. Красновский (мл.), Биофизика 22 (5), 927
160. C. N. Novikov, V. L. Voeikov, and F.-A. Popp, Proc.
(1977).
Int. Conf. "Biophotonics. Non-equilibrium and Co-
herent Systems in Biology, Biophysics and Biotech-
184. A. A. Krasnovsky Jr., Photochem. Photobiol. 29 (1),
nology" (1995), p. 291.
29 (1979).
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
69
185. A. A. Krasnovsky Jr. and K. V. Neverov, SPIE Proc.
210. A. Triglia, G. Malfa, F. Musumeci, et al., J. Food Sci.
1890, 56 (1993).
63 (3), 512 (1998).
186. A. A. Krasnovsky, J. Photochem. Photobiol. A 196
211. R. Van Wijk, A. Scordino, A. Triglia, and F. Musume-
(2-3), 210 (2008).
ci, J. Photochem. Photobiol. B: Biology 49 (2), 142
(1999).
187. A. A. Красновский (мл.) и К. В. Неверов, Биофи-
зика 55 (3), 349 (2010).
212. T. Esmaeilpour, E. Fereydouni, F. Dehghani, et al.,
Sci. Rep. 10 (1), 463 (2020).
188. S. J. Arnold, E. A. Ogryzlo, and H. Witzke, J. Chem.
Phys. 40 (6), 1769 (1964).
213. M. Hossu, L. Ma, X. Zou, and W. Chen, Cancer Nan-
otechnol. 4 (1-3), 21 (2013).
189. K. Furukawa, E. W. Gray, and E. A. Ogryzlo, Ann. N.
Y. Acad. Sci. 171 (1), 175 (1970).
214. M. Hossu, L. Ma, and W. Chen, J. Photochem. Pho-
tobiol. B 99 (1), 44 (2010).
190. A. U. Khan and M. Kasha, J. Amer. Chem. Soc. 88
(7), 1574 (1966).
215. H. Sardarabadi, D. E. Chafai, F. Gheybi, et al., J.
Photochem. Photobiol. B. Biology 204, 111812 (2020).
191. 191. A. U. Khan, Science 168 (3930), 476 (1970).
216. R. Van Wijk, M. Kobayashi, and E. P. A. Van Wijk, J.
192. A. U. Khan, P. Gebauer, and L. P. Hager, Proc. Nat.
Photochem. Photobiol. B. Biology 83 (1), 69 (2006).
Acad. Sci. USA 80 (17), 5195 (1983).
193. A. A. Krasnovsky Jr and K. V. Neverov, Chem. Phys.
ki/Microchannel_plate_detector#/media/File:Mcp-
Lett. 167 (6), 591 (1990).
de.svg.
194. В. М. Ширяев, И. Б. Федорович, И. И. Сапежин-
218. J.-P. Boutot and G. Pietri, IEEE Trans. Electron Dev.
ский и др., Биофизика 25 (3), 439 (1980).
17 (7), 493 (1970).
195. Г. Г. Борисенко, А. Н. Осипов, К. Д. Казаринов и
219. G. Eschard and R. Polaert, Tech. Philips (Janu-
Ю. А. Владимиров, Биохимия 62, 774 (1997).
ary/February 1969), 40 (1969).
196. Ю. А. Владимиров и Д. И. Рощупкин, в сб. Тез. до-
220. Y. Tsuchiya, E. Inuzuka, T. Kurono, and M. Hosoda,
кл. XI Совещания по люминесценции «Молекулярная
in Proc. Eighth Symp. on Photo-Electronic Image Devic-
люминесценция и люминесцентный анализ» (АН
es (1986), pp. 21-31.
СССР, М., 1962), p. 16.
221. T. Gys, Nuclear Instruments and Methods in Physics
197. H. J. Niggli, S. Tudisco, G. Privitera, et al., Laser-ul-
Research Section A: Accelerators, Spectrometers, De-
traviolet-a induced biophotonic emission in cultured
tectors and Associated Equipment 787, 254 (2015).
mammalian cells (Springer, New York, 2005).
222. M. Lampton, Sci. American 245 (5), 62 (1981).
198. A. Scordino, F. Musumeci, M. Gulino, et al., J. Phys.
D 41 (15), 155507 (2008).
223. É. Hideg, R. Q. Scott, and H. Inaba, FEBS Lett. 250
(2), 275 (1989).
199. R. Grasso, M. Gulino, A. Scordino, et al., in SPIE
Proc., Ed. by J. Popp, V. V. Tuchin, D. L. Matthews,
224. R. Q. Scott, M. Usa, and H. Inaba, Appl. Phys. B 48
and F. S. Pavone (2016), Vol. 9887, pp. 988723.
(2), 183 (1989).
200. A. Scordino, I. Baran, M. Gulino, et al., J. Photo-
225. T. Ichimura, M. Hiramatsu, N. Hirai, and T. Hayaka-
chem. Photobiol. B: Biology 139, 76 (2014).
wa, Photochem. Photobiol. 50 (3), 283 (1989).
201. A. Scordino, A. Campisi, R. Grasso, et al., J. Biomed.
226. M. Kobayashi, B. Devaraj, M. Usa, et al., Front. Med.
Opt. 19 (11), 117005 (2014).
Biol. Engineer. 7 (4), 299 (1996).
202. I. Baran, C. Ganea, S. Privitera, et al., Oxidative med-
227. R. Q. Scott and H. Inaba, J. Biolumin. Chemilumin. 4
icine and cellular longevity, 498914 (2012).
(1), 507 (1989).
203. R. Grasso, M. Gulino, F. Giuffrida, et al., J. Photo-
228. S. Suzuki, M. Usa, T. Nagoshi, et al., J. Photochem.
chem. Photobiol. B. Biology 187, 126 (2018).
Photobiol. B. Biology 9 (2), 211 (1991).
204. R. Grasso, R. Pellitteri, F. Musumeci, et al., Clinical
229. T. Amano, M. Kobayashi, B. Devaraj, et al., Urol.
and Preclinical Optical Diagnostics II, Munich, 11075
Res. 23 (5), 315 (1995).
(2019).
230. M. Kobayashi, M. Takeda, T. Sato, et al., Neurosci.
205. F. Musumeci, L. A. Applegate, G. Privitera, et al., J.
Res. 34 (2), 103 (1999).
Photochem. Photobiol. B 79 (2), 93 (2005).
231. M. Kobayashi, M. Takeda, K. I. Ito, et al., J. Neurosci.
206. F. Musumeci, G. Privitera, A. Scordino, et al., Appl.
Methods 93 (2), 163 (1999).
Phys. Lett. 86 (15), 153902 (2005).
232. M. Kobayashi, K. Sasaki, M. Enomoto, and Y. Ehara,
207. W. Scholz, U. Staszkiewicz, F. A. Popp, and W. Nagl,
J. Exp. Bot. 58 (3), 465 (2007).
Cell Biophys. 13 (1), 55 (1988).
233. M. Kobayashi, B. Devaraj, M. Usa, et al., Photochem.
208. F. A. Popp and Y. Yan, Phys. Lett. A 293 (1-2), 93
Photobiol. 65 (3), 535 (1997).
(2002).
234. Z. Wang, N. Wang, Z. Li, et al., Proc. Natl. Acad. Sci.
209. P. Jursinic, in Light Emission by Plants and Bacteria,
USA 113 (31), 8753 (2016).
Ed. by I. Govindjee, J. Amesz, and D. C. Fork (Acad.
235. L. Chen, Z. Wang, and J. Dai, Brain Res. 1749, 147133
Press, New York, 1986), pp. 291-328.
(2020).
БИОФИЗИКА том 67
№ 1
2022
70
НАУМОВА и др.
236. I. Khaoua, G. Graciani, A. Kim, and F. Amblard, Sci.
265. F. A. Popp, B. Ruth, W. Bahr, et al., Collective Phe-
Rep. 11 (1), 3530 (2021).
nomena 3, 187 (1981).
237. В. П. Челибанов, Л. Н. Исаев и Г. Г. Ишанин,
266. F. A. Popp and K. H. Li, Int. J. Theor. Phys. 32 (9),
Вестн. ЛИТМО 6 (64), 14 (2009).
1573 (1993).
238. A. Prasad and P. Pospisil, Sci. Rep. 3, 1211 (2013).
267. R. P. Bajpai, J. Theor. Biol. 198 (3), 287 (1999).
239. M. Kobayashi, Biophotonics: Optical Science and En-
268. F. A. Popp, J. J. Chang, A. Herzog, et al., Phys Lett A
gineering for the 21st Century, 155 (2005).
293 (1-2), 98 (2002).
240. S. Usui, M. Tada, and M. Kobayashi, Sci. Rep. 9 (1),
269. O. Kučera and M. Cifra, Cell Commun. Signal. 11, 87
8576 (2019).
(2013).
241. E. van Wijk, M. Kobayashi, R. van Wijk, and J. van der
270. S. N. Mayburov and I. V. Volodyaev, in Proc. of Prog-
Greef, PloS One 8 (12), e84579 (2013).
ress in Electromagnetics Res. Symp. (Moscow, 2009),
242. M. Kobayashi, D. Kikuchi, and H. Okamura, PloS
p. 1937.
One 4 (7), e6256 (2009).
271. M. Cifra, C. Brouder, M. Nerudova, and O. Kucera, J.
243. K. Tsuchida and M. Kobayashi, Sci. Rep. 10 (1), 9626
Lumin. 164, 38 (2015).
(2020).
272. Л. В. Белоусов, А. Б. Бурлаков и Н. Н. Лучинская,
244. T. Iwasa and M. Kobayashi, CLEO Pacific Rim Conf.,
Онтогенез 33 (3), 213 (2002).
Hong Kong, W3A.131 (2018).
273. Л. В. Белоусов, А. Б. Бурлаков и Н. Н. Лучинская,
245. K. Tsuchida, T. Iwasa, and M. Kobayashi, J. Photo-
Онтогенез 34 (6), 453 (2003).
chem. Photobiol. B. Biology 198, 111562 (2019).
274. Л. В. Белоусов, Ф. А. Попп и Н. И. Казакова, Он-
246. A. Prasad and P. Pospisil, J. Biophotonics 4 (11-12),
тогенез 28 (5), 377 (1997).
840 (2011).
275. M. Kobayashi and H. Inaba, Appl. Optics 39 (1), 183
247. H. Ou-Yang, J. Photochem. Photobiol. B. Biology
(2000).
139, 63 (2014).
276. 276. X. Shen, F. Liu, and X. Y. Li, Experientia 49 (4),
248. A. G. Gurwitsch and L. D. Gurwitsch, Nature 143
291 (1993).
(3633), 1022 (1939).
277. N. Rafieiolhosseini, M. Poplová, P. Sasanpour, et al.,
249. А. Гурвич, Л. Д. Гурвич и А. А. Слюсарев, Архив
J. Photochem. Photobiol. B. Biology 162, 50 (2016).
биол. наук 55 (2), 104 (1939).
278. F. Scholkmann, M. Cifra, T. A. Moraes, and C. de
250. T. Nagoshi, N. Watanabe, S. Suzuki, et al., Photo-
Mello Gallep, J. Physics: Conf. Ser. 329, 012020
chem. Photobiol. 56 (1), 89 (1992).
(2011).
251. 251. M. Tada, Free Radic. Biol. Med. 112, 64 (2017).
279. H. Saeidfirozeh, A. Shafiekhani, M. Cifra, and
252. T. Reiter and D. Gabor, Zellteilung und Strahlung
A. A. Masoudi, Sci. Rep. 8 (1), 16231 (2018).
(Springer-Verlag, Berlin, 1928).
280. R. Van Wijk, E. P. A. Van Wijk, and R. P. Bajpai, J.
253. G. Frank, Biologisches Zentralblatt 49, 129 (1929).
Photochem. Photobiol. B. Biology 84 (1), 46 (2006).
254. J. Ponomarewa, Biochemische Zeitschrift 239, 424
281. E. P. Van Wijk, R. V. Wijk, R. P. Bajpai, and J. van der
(1931).
Greef, J. Photochem. Photobiol. B Biology 99 (3), 133
255. G. Decker, Protoplasma 25 (1), 515 (1936).
(2010).
256. А. Е. Браунштейн и А. П. Потоцкая, Архив биол.
282. M. D. Williams and B. Chance, J. Biol. Chem. 258
наук, Сер. Б 35 (1), 73 (1934).
(6), 3628 (1983).
257. M. Kobayashi, Trends Photochem. Photobiol. 10, 111
283. А. Г. Гурвич и Л. Д. Гурвич, Митогенетическое из-
(2003).
лучение (Изд. ВИЭМ, Л., 1934).
258. E. P. A. Van Wijk and R. Van Wijk, Compl. Med. Res.
284. J.-J. Chang, Ind. J. Exp. Biol. 46, 371 (2008).
12 (2), 96 (2005).
285. S. N. Mayburov, EPJ Web of Conferences 95, 03024
259. A. Boveris, R. A. Sanchez, A. I. Varsavsky, and E. Ca-
(2015).
denas, FEBS Lett. 113, 29 (1980).
286. M. Kobayashi, B. Devaraj, and H. Inaba, Phys. Rev. E
260. A. Boveris, A. I. Varsavsky, S. G. d. Silva, and
57 (2), 2129 (1998).
R. A. Sanchez, Photochem. Photobiol. 38, 99 (1983).
287. V. V. Tuchin, Tissue Optics: Light Scattering Methods
261. E. Cadenas, I. D. Arad, A. Boveris, et al., FEBS Lett.
and Instruments for Medical Diagnostics, Third Edition
111 (2), 413 (1980).
(SPIE PRESS, Bellingham, 2015).
262. M. Takeda, Y. Tanno, M. Kobayashi, et al., Cancer
288. H. Liu, B. Beauvoit, M. Kimura, and B. Chance, J.
Lett. 127 (1-2), 155 (1998).
Biomed. Opt. 1 (2), 200 (1996).
263. H. Inaba, Y. Shimizu, Y. Tsuji, and A. Yamaguchi,
289. V. V. Tuchin, I. L. Maksimova, D. A. Zimnyakov,
Photochem. Photobiol. 30 (1), 169 (1979).
et al., J. Biomed. Opt. 2 (4), 401 (1997).
264. F. A. Popp, Biophotonen: Ein neuer Weg zur Lösung des
290. G. Vargas, K. F. Chan, S. L. Thomsen, and
Krebsproblems, Bd. 6 (Verlag für Medizin Dr. Ewald
A. J. Welch, Lasers in Surgery and Medicine 29 (3),
Fischer, Heidelberg, 1976).
213 (2001).
БИОФИЗИКА том 67
№ 1
2022
МЕТОДЫ ИССЛЕДОВАНИЯ СВЕРХСЛАБОГО СВЕЧЕНИЯ
71
291. A. T. Yeh, B. Choi, J. S. Nelson, and B. J. Tromberg,
317. D. K. Tuchina, I. G. Meerovich, O. A. Sindeeva, et al.,
J. Invest. Dermatol. 121 (6), 1332 (2003).
J. Biophotonics 13 (11), e201960249 (2020).
292. V. V. Tuchin, Optical Clearing of Tissues and Blood
318. P. A. Dyachenko, L. E. Dolotov, E. N. Lazareva,
(SPIE PRESS, Bellingham, 2005).
et al., IEEE J. Sel. Top. Quant. 27 (4) (2021).
293. K. Moulton, F. Lovell, E. Williams, et al., J. Biomed.
319. L. M. Oliveira, K. I. Zaytsev, and V. V. Tuchin, Bio-
Opt. 11 (5), 054027 (2006).
photonics, SPIE Proc., 11585, 1158503, (2020).
294. E. A. Genina, A. N. Bashkatov, and V. V. Tuchin, Ex-
320. T. Yu, J. Zhu, D. Li, and D. Zhu, iScience 24 (3),
pert Rev. Med. Devices 7 (6), 825 (2010).
102178 (2021).
295. X. Wen, Z. Mao, Z. Han, et al., J. Biophotonics 3 (1-
321. B. A. Mazin, B. Bumble, S. R. Meeker, et al., Opt. Ex-
2), 44 (2010).
press 20 (2), 1503 (2012).
296. T. Yu, X. Wen, V. V. Tuchin, et al., J. Biomed. Opt. 16
322. B. A. Mazin, S. R. Meeker, M. J. Strader, et al., Publ.
(9), 095002 (2011).
Astronom. Soc. Pacific 125 (933), 1348 (2013).
297. D. Zhu, K. V. Larin, Q. Luo, and V. V. Tuchin, Laser
323. B. A. Mazin, J. Bailey, J. Bartlett, et al., arXiv:
Photon. Rev. 7 (5), 732 (2013).
1908.02775 [astro-ph.IM] (2019).
298. V. Hovhannisyan, P. S. Hu, S. J. Chen, et al., J.
324. I. E. Zadeh, J. Chang, J. W. N. Los, et al., Appl. Phys.
Biomed. Opt. 18 (4), 046004 (2013).
Lett. 118 (19), 190502 (2021).
299. V. Marx, Nat. Methods 11 (12), 1209 (2014).
325. E. E. Wollman, V. B. Verma, A. D. Beyer, et al., Opt.
300. D. S. Richardson and J. W. Lichtman, Cell 162 (2),
Express 25 (22), 26792 (2017).
246 (2015).
326. H. Wang, J. Guo, J. Miao, et al., Small, 2103963
301. V. V. Tuchin, J. Biomed. Photonics Eng. 2, 030201
(2021).
(2016).
327. Y. Zhang, Y. Wu, X. Wang, et al., ACS Photonics 5 (5),
302. A. Y. Sdobnov, V. V. Tuchin, J. Lademann, and
2008 (2018).
M. E. Darvin, J. Phys. D. Appl. Phys. 50, 285401
328. R. H. Hadfield, Nat. Photonics 3 (12), 696 (2009).
(2017).
329. K. K. Likharev, Proc. IEEE 87 (4), 606 (1999).
303. A. Sdobnov, M. E. Darvin, J. Lademann, and
330. Е. В. Проскурнина, А. В. Алексеев, Т. В. Жидкова
V. Tuchin, J. Biophotonics 10 (9), 1115 (2017).
и др., в Матер. научн. симп. «Проблемы медицин-
304. Y. Alexandrovskaya, K. Sadovnikov, A. Sharov, et al.,
ской биофизики» (Москва, 2012), с. 36.
J. Biophotonics 11 (2), e201700105 (2018).
331. И. В. Образцов и М. А. Годков, Молекуляр. меди-
305. A. N. Bashkatov, K. V. Berezin, K. N. Dvoretskiy,
цина, № 4, 3 (2013).
et al., J. Biomed. Opt. 23 (9), 1 (2018).
332. Г. К. Владимиров, Е. В. Сергунова, Д. Ю. Измай-
306. L. M. C. Oliveira and V. V. Tuchin, The Optical Clear-
лов и Ю. А. Владимиров, Вестн. РГМУ, № 2, 65
ing Method: A New Tool for Clinical Practice and Bio-
(2016).
medical Engineering (Springer Nature, Switzerland
333. И. В. Образцов, М. А. Годков, В. В. Кулабухов и
AG, Cham, 2019).
др., Общая реаниматология 13 (1), 40 (2017).
307. I. Carneiro, S. Carvalho, R. Henrique, et al., J. Bio-
334. В. М. Земсков, А. М. Барсуков, А. А. Безносенко
photonics 12 (12), e201900181 (2019).
и др., Изучение функционального состояния фагоци-
308. I. Costantini, R. Cicchi, L. Silvestri, et al., Biomed.
тов человека (кислородный метаболизм и подвиж-
Opt. Express 10 (10), 5251 (2019).
ность клеток). Методические рекомендации МЗ РФ
309. I. Carneiro, S. Carvalho, R. Henrique, et al., IEEE J.
(М., 1988).
Sel. Top. Quant. 27 (4), 1 (2021).
335. R. N. Tilbury and T. I. Quickenden, J. Biolumin. Che-
310. Q. Lin, E. N. Lazareva, V. I. Kochubey, et al., Laser
milumin. 7 (4), 245 (1992).
Phys. Lett. 17 (10), 105601 (2020).
336. А. Г. Гурвич и Л. Д. Гурвич, Митогенетическое из-
311. A. Y. Sdobnov, M. E. Darvin, E. A. Genina, et al.,
лучение: Физико-химические основы и приложения в
Spectrochim. Acta. Part A, Mol. Biomol. Spectrosco-
биологии и медицине (Медгиз, М., 1945).
py 197, 216 (2018).
337. А. Г. Гурвич и Л. Д. Гурвич, Митогенетический
312. P. Matryba, L. Kaczmarek, and J. Gołąb, Laser Pho-
анализ биологии раковой клетки (Изд. ВИЭМ, М,
ton. Rev. 13 (8), 1800292 (2019).
1937).
313. K. Tainaka, T. C. Murakami, E. A. Susaki, et al., Cell
338. Б. С. Песоченский, Дисс. … д-ра мед. наук (Ле-
Reports 24 (8), 2196 (2018).
нинградский онкологический институт, 1942).
314. K. Matsumoto, T. T. Mitani, S. A. Horiguchi, et al.,
339. А. Г. Гурвич, Л. Д. Гурвич, С. Я. Залкинд и
Nat. Protoc 14 (12), 3506 (2019).
Б. С. Песоченский, Учение о раковом тушителе:
315. M. V. Gómez-Gaviro, D. Sanderson, J. Ripoll, and
Теория и клиника (Изд-во АМН СССР, М., 1947).
M. Desco, iScience 23 (8), 101432 (2020).
340. В. П. Нагорянская, Дис. … канд. мед. наук (Цен-
316. A. A. Selifonov and V. V. Tuchin, J. Biomed. Photon-
тральный онкологический институт НКЗ
ics Eng. 6, 040301 (2020).
РСФСР, 1945).
БИОФИЗИКА том 67
№ 1
2022
72
НАУМОВА и др.
341. О. Е. Нудольская, Дисс. … д-ра мед. наук (2-я Аку-
342. Е. Е. Авчина, Дисс. … канд. мед. наук (Институт
шерско-гинекологическая клиника 2-го Москов-
онкологии, 1950).
ского государственного медицинского института,
1945).
Methods for the Study of Ultraweak Photon Emission from Biological Objects.
III. Physical Methods
E.V. Naumova*, Yu.A. Vladimirov**, V.V. Tuchin***, ****, *****, ******,
V.A. Namiot**, and I.V. Volodyaev**
*Rzhanov Institute of Semiconductor Physics, Siberian Branch of the Russian Academy of Sciences, prosp. Akademika
Lavrentieva 13, Novosibirsk, 630090 Russia
**Lomonosov Moscow State University, Leninskie Gory 1, Moscow, 119991 Russia
*** National Research Saratov State University named after N.G. Chernyshevsky,
ul. Astrakhanskaya 83, Saratov, 410012 Russia
****National Research Tomsk State University, prosp. Lenina 36, Tomsk, 634050 Russia
*****Institute of Precision Mechanics and Control, Federal Research Centre «Saratov Scientific Center»
of the Russian Academy of Sciences, ul. Rabochaya 24, Saratov, 410028 Russia
******Bach Institute of Biochemistry, Federal Research Centre «Fundamentals of Biotechnology»
of the Russian Academy of Sciences, Leninsky prosp. 33/2, Moscow, 119071 Russia
This paper constitutes the last third part of the review on the methods for investigation of ultraweak photon
emission from biological objects. The first part treated common questions (history of research, basic terms
and others), the second part presented analysis of biological detection methods. The third part covers phys-
ical methods for investigation of ultraweak photon emission: basic devices and principles of photon detection
are briefly described, various approaches to improve the signal/noise ratio are considered, a number of ex-
perimental schemes, specifics of different research methods and research findings obtained are presented,
prospects of further development of instrumentation and future research directions are discussed.
Keywords: ultraweak photon emission from biological objects, chemiluminescence, ultraweak optical radiation de-
tection, spectral analysis, biophotonics, photomultiplier tubes, CCD-cameras
БИОФИЗИКА том 67
№ 1
2022