БИОФИЗИКА, 2022, том 67, № 1, с. 113-120
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 577.3
ВЛИЯНИЕ ПЕРЕМЕННОГО МАГНИТНОГО ПОЛЯ
НА ХЕМИЛЮМИНЕСЦЕНЦИЮ МОНОНУКЛЕАРНЫХ КЛЕТОК
ПЕРИФЕРИЧЕСКОЙ КРОВИ ЧЕЛОВЕКА И ПРОИЗВОДСТВО
ПРОВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ
© 2022 г. Е.Е. Текуцкая*, Л.Р. Гусарук**, Г.П. Ильченко*
*Кубанский государственный университет, 350040, Краснодар, ул. Ставропольская, 149
**Кубанский государственный медицинский университет МЗ РФ, 350063, Краснодар, ул. Седина, 4
Е-mail: tekytska@mail.ru
Поступила в редакцию 18.11.2021 г.
После доработки 02.12.2021 г.
Принята к публикации 03.12.2021 г.
Показано, что воздействие переменным магнитным полем in vitro напряженностью 550 ± 30 А/м ча-
стотой 8.6 и 9.0 Гц приводит к значительному изменению хемилюминесценции взвеси мононукле-
арных клеток, выделенных из периферической крови здоровых доноров и больных буллезным эпи-
дермолизом. С помощью иммуноферментного анализа определено содержание провоспалительных
цитокинов (интерлейкина-1; интерлейкина-6 и фактора некроза опухолей) в сыворотке перифери-
ческой крови здоровых доноров и больных буллезным эпидермолизом после воздействия на образ-
цы крови in vitro переменным магнитным полем в диапазоне частот от 7.0 до 9.0 Гц. Обнаружено, что
при буллезном эпидермолизе значительно увеличено содержание интерлейкина-6 в сыворотке кро-
ви больных по сравнению со здоровыми донорами. Действие магнитного поля с частотами от 7.0 до
7.8 Гц и от 8.6 до 9.0 Гц на образцы крови больных буллезным эпидермолизом, снижает концентра-
цию этого цитокина до значений референсного интервала. Исходные показатели фактора некроза
опухолей в нативных образцах обеих групп оставались в пределах нормы: 5.2 пг/мл в контроле и 4.3
пг/мл при буллезном эпидермолизе. Воздействие магнитного поля не приводит к выходу парамет-
ров за пороговые значения, при этом наблюдается сходство ответной реакции в контрольной и
опытной группах. Так, обработка магнитным полем с частотами 7.4 и 7.8 Гц повышает концентра-
цию фактора некроза опухолей в обеих группах, а магнитным полем с частотами больше 7.8 Гц -
приводят к резкому его падению.
Ключевые слова: мононуклеарные клетки периферической крови, хемилюминесценция, провоспалитель-
ные цитокины, переменное магнитное поле, активные формы кислорода.
DOI: 10.31857/S0006302922010112
Данные по изучению функционального статуса
Исследования в области биологического дей-
системы лимфоцитов, основной в клеточном от-
ствия электромагнитного поля позволили опре-
ношении клеточной популяции периферической
делить наиболее восприимчивые системы орга-
крови, оснащенной мощными микробицидными
низма человека к такого рода воздействию: нерв-
и цитотоксическими механизмами, является ос-
ная, иммунная, эндокринная и половая.
нованием для изучения влияния электромагнит-
Отмечается, что при действии электромагнитно-
ного поля на эти иммунокомпетентные клетки.
го поля нарушаются процессы формирования
Мононуклеарные клетки (МНК) перифериче-
иммунитета, чаще в сторону его угнетения [1, 2].
ской крови согласно данным работы [4] включа-
Лимфоциты осуществляют первую линию защи-
ют в себя лимфоциты (Т-клетки и В-клетки) - от
ты, от их хемотаксической, фагоцитарной и мета-
70 до 90%, моноциты - от 10 до 30% и дентритные
болической активности во многом зависит состо-
клетки - от 1-2%.
яние иммунной системы и организма в целом [3].
Клетки иммунной системы работают в согла-
Сокращения: МНК - мононуклеарные клетки, ИЛ - ин- сованном между собой взаимодействии, которое
терлейкин, α-ФНО - фактор некроза опухолей альфа,
осуществляется цитокинами, представляющими
БЭ - буллезный эпидермолиз, МП - магнитное поле,
из себя регуляторы иммунных реакций. Набор и
АФК - активные формы кислорода, ХЛ - хемилюминес-
ценция.
количество цитокинов, действующих на рецепто-
113
114
ТЕКУЦКАЯ и др.
ры клеточной поверхности, являются организо-
Как ранее было показано, действие перемен-
ванной системой взаимодействующих между со-
ного магнитного поля (МП) на образцы крови
бой сигналов [3-5]. Провоспалительные цитоки-
здоровых доноров и больных БЭ in vitro может
ны интерлейкин-1 (ИЛ-1), интерлейкин-6
приводить к генерированию активных форм кис-
(ИЛ-6), а также фактор некроза опухолей
лорода (АФК) и инициировать окислительных
(α-ФНО) продуцируются и действуют на имму-
стресс, а также вносить свой вклад в поддержание
нокомпетентные клетки, инициируя воспали-
уже развившего окислительного стресса при БЭ
тельный ответ. Высокий уровень этих метаболи-
[8]. Одним из распространенных методов изуче-
тов отражает активность и тяжесть патологиче-
ния свободно-радикальных процессов и измене-
ского процесса. Так, ИЛ-1 принадлежит к группе
ния продукции АФК служит спонтанная и стиму-
провоспалительных цитокинов и представляет
лированная с помощью H2O2 хемилюминесцен-
собой полипептид, имеющий молекулярную мас-
ция (ХЛ).
су 15 кДа. ИЛ-1 по большей части производят
В этой связи цель работы заключалась в опре-
макрофаги и фагоциты, в меньшей степени -
делении влияния переменного МП in vitro на из-
лимфоциты. Он провоцирует начало и регулирует
менение продукции АФК взвеси мононуклеар-
иммунные реакции, запуская реакции воспали-
ных клеток, выделенных из крови больных БЭ и
тельно-регуляторного каскада, стимулирует син-
здоровых доноров, с помощью ХЛ-анализа и на
тез коллагена [5]. ИЛ-1 синтезируется кратковре-
уровень содержания провоспалительных цитоки-
менно, только в ответ на попадание в организм
нов (интерлейкина-1; интерлейкина-6; фактора
антигена, выработка его клетками продолжается
некроза опухолей) в сыворотке крови - с исполь-
около двух суток. ИЛ-6 является гликопротеином
зованием иммуноферментного анализа.
с молекулярной массой 21-28 кДа, представляет
собой плейотропный цитокин с различными био-
логическими действиями, продуцируется как
МАТЕРИАЛЫ И МЕТОДЫ
лимфоидными, так и не лимфоидными клетками.
ИЛ-6 также принято относить к провоспалитель-
Выделение чистой взвеси МНК из перифери-
ным цитокинам. Хотя роль ИЛ-6 в противовирус-
ческой крови доноров и больных БЭ осуществля-
ной защите организма до конца не ясна, он, несо-
ли путем ее центрифугирования в градиенте
мненно, наряду с α-ФНО и ИЛ-1β играет
плотности фиколл-урографина (p = 1.077 г/мл),
центральную роль в неспецифическом противо-
как описано в работе [9]. МНК промывали и ин-
вирусном иммунитете [4]. Повышенный уровень
кубировали в физиологическом растворе, конеч-
ИЛ-6 наблюдается при многих патологических
ная концентрация взвеси МНК составляла в
состояниях. Количественное определение уровня
среднем 0.87∙106 клеток/мл. Проведенный мор-
ИЛ-6 имеет большое значение при оценке им-
фологический контроль клеточной суспензии
мунного статуса организма [6]. α-ФНО относится
показал клеточный состав взвеси: содержание
к провоспалительным цитокинам, состоит из
лимфоцитов - 71-72%, моноцитов - 26-28%.
длинных вытянутых β-цепей, имеет молекуляр-
ную массу 17 кДа, проявляет избирательную ци-
Обработку взвеси МНК и образцов крови пе-
тотоксичность в отношении некоторых опухоле-
ременным МП с частотами от 7.0 до 9.0 Гц с ша-
вых клеток; как и другие цитокины, является
гом 0.2 Гц проводили в закрытой стерильной пла-
важным низкомолекулярным медиатором меж-
стиковой посуде в экранированной камере. В хо-
клеточных взаимодействий. Количественное
де экспериментов использовали специальную
определение уровня α-ФНО также играет боль-
установку, блок-схема которой приведена в ра-
шую роль при оценке иммунного статуса орга-
боте [10]. Она состояла из генератора низкоча-
низма [6].
стотных сигналов ГЗ-118, который представляет
собой источник синусоидального сигнала преци-
Повышенный уровень провоспалительных
зионной формы, и катушки индуктивности, име-
цитокинов наблюдается при многих патологиче-
ющей 1200 витков. Катушка была помещена в
ских состояниях, связанных с окислительным
экранированную камеру, которую изготовили из
стрессом, в частности, при буллезном эпидермо-
конструкционной стали толщиной 3 мм. Ослаб-
лизе (БЭ). БЭ - клинически и генетически гете-
ление внешних МП камерой в диапазоне от 3 Гц
рогенная группа орфанных заболеваний, характе-
до 300 кГц достигало около 100 раз. Сопротивле-
ризующихся врожденной склонностью к образо-
ние катушки составляло 320 Ом, напряжение на
ванию булл на коже и слизистых оболочках
катушке - 14 В. Обработку МП проводили при
пищевода, кишечника, дыхательной системы.
Эрозивно-язвенные дефекты могут сохраняться
комнатной температуре (22 ± 1оС) в течение
на коже от одного месяца до нескольких лет, яв-
15 мин на выбранной частоте. Напряженность
ляясь предрасполагающим фактором к образова-
поля в месте нахождения образца составляла
нию плоскоклеточного рака кожи - основной
550 ± 30 А/м. Контроль напряженности поля осу-
причины преждевременной смерти больных [7].
ществляли с помощью анализатора спектра «Эко-
БИОФИЗИКА том 67
№ 1
2022
ВЛИЯНИЕ ПЕРЕМЕННОГО МАГНИТНОГО ПОЛЯ
115
физика-110А» (ООО ПКФ «Цифровые приборы»,
твор конъюгата 1 (антитела к α-ФНО человека с
Москва) и антенны П6-70.
биотином), вновь закрывали пленкой и инкуби-
ровали 60 мин при температуре 37°С в шейкере,
Регистрацию спонтанной (нестимулирован-
после окончания инкубации опять пятикратно
ной) и стимулированной с помощью 20 мкл 0.3%
промывали планшет. Вносили конъюгат 2 (стреп-
H2O2 хемилюминесценции [11] проводили в тече-
тавидин с пероксидазой хрена) и вновь инкуби-
ние 900 с на хемилюминометре LUM-5773 (ООО
ровали 60 мин. После всех промывок, внесений
«ДИСофт», Москва), значения интенсивности
стоп-растворов и еще одного инкубирования из-
свечения которого соответствовали световому
меряли оптическую плотность с помощью ридера
потоку, т.е. количеству фотонов в единицу време-
Multiscan в двухволновом режиме: при 450 нм и
ни. При этом 1 мВ ≈ 1 фотон/с. Также оценивали
620-655 нм. По результатам измерения вычисля-
максимальную интенсивность ХЛ после 300 с от
ли среднее арифметическое значение оптической
начала регистрации. Одинаковость условий для
плотности в лунках с анализируемыми образца-
клеточной взвеси в контроле и опыте достигалась
ми. Таким образом, общее время инкубации со-
тем, что контрольные образцы перед регистраци-
ставило 4 ч. Воспроизводимость методики не
ей ХЛ помещали в экранированную камеру на
превышает 8%, не обнаружено перекрестной ре-
15 мин. При этом обработку образцов перемен-
акции используемых в наборе антител к α-ФНО с
ным МП не проводили. Величина постоянной
другими цитокинами и, в частности, с ИЛ-1β и
компоненты геомагнитного поля во время на-
ИЛ-6.
хождения образцов в экранированной камере и в
Набор «Интерлейкин-1бета-ИФА-БЕСТ» со-
контроле, и в опыте была одинаковой и составля-
держал планшет с иммобилизованными моно-
ла около 0.4 А/м. Направления векторов постоян-
клональными антителами к ИЛ-1β, растворы,
ного геомагнитного поля и переменного МП бы-
аналогичные вышеперечисленным, и конъюгат 1,
ли взаимно перпендикулярны.
содержащий биотинилированные антитела к
Определение уровня провоспалительных ци-
ИЛ-1β. Порядок выполнения методики аналоги-
токинов ИЛ-1, ИЛ-6 и α-ФНО в сыворотке крови
чен предыдущему. Набор «Интерлейкин-6-ИФА-
до и после обработки МП образцов крови здоро-
БЕСТ» содержал планшет с иммобилизованными
вых доноров и больных БЭ проводили с помощью
моноклональными антителами к ИЛ-6, раство-
наборов фирмы «Вектор-Бест» (Новосибирск) на
ры, аналогичные вышеперечисленным, и конъ-
микропланшетном ридере Multiskan (Thermo
югат 1, содержащий биотинилированные антите-
Fisher Scientific, Финляндия) согласно протоколу.
ла к ИЛ-6.
Метод основан на «сэндвич»-варианте твердо-
Калибровочные графики для ИЛ-1 и ИЛ-6 бы-
фазного иммуноферментного анализа с примене-
ли линейны в интервале 0-250 пг/мл, их уравне-
нием моно- и поликлональных антител к соответ-
ния имели вид: для ИЛ-1 у = 0.008х + 0.051, для
ствующему цитокину. Так, при определении кон-
ИЛ-6 у = 0.0023х + 0.0928. Для α-ФНО график
центрации α-ФНО использовали планшет с
был линеен в интервале 0-100 пг/мл, уравнение
иммобилизованными моноклональными антите-
имело вид у = 0.0073х + 0.0923.
лами к α-ФНО, калибровочные образцы, атте-
Достоверность различий средних величин
стованные относительно стандарта α-ФНО (фир-
оценивали с применением U-критерия Манна-
ма RnDSystems. Inc., США), фосфатно-солевой
Уитни, принимая различия достоверными на
буферный раствор с твином, субстратный буфер-
уровне значимости р < 0.05. Сравнение групп по
ный раствор, раствор тетраметилбензидина,
количественным признакам проводили с исполь-
конъюгаты. На первой стадии в ходе проведения
зованием двухвыборочного t-критерия Стьюден-
иммуноферментного анализа в стрипы планшета
та. Различия считали статистически значимыми
вносили разбавленные образцы сыворотки крови
при р < 0.05 [12]. Полученные данные анализиро-
человека, необходимые реагенты в рассчитанных
вали с помощью пакета статистического анализа
концентрациях, стрипы заклеивали пленкой и
Statistica 6.0.
инкубировали при температуре 37°С в течение
120 мин в термостатируемом шейкере с частотой
700 об/мин. Далее с помощью планшетного про-
РЕЗУЛЬТАТЫ
мывателя пятикратно промывали лунки планше-
та фосфатно-солевым буферным раствором с
Для взвеси МНК, выделенных из перифериче-
твином, чередуя аспирацию и немедленное за-
ской крови здоровых доноров и больных БЭ, из-
полнение лунок каждого стрипа. В каждую лунку
мерены интенсивности спонтанной ХЛ при от-
в процессе каждого цикла промывки вносили не
сутствии воздействия переменным МП. Получе-
менее 350 мкл жидкости. Время между заполне-
ны зависимости интенсивности ХЛ от времени,
нием и опорожнением лунок было не менее 30 с.
которые отражают процессы протекания экзо-
По окончании промывки остатки влаги из лунок
термических реакций окисления, происходящих
тщательно удаляли. Затем вносили в лунки рас-
на поверхности клеток и в среде. При сравнении
БИОФИЗИКА том 67
№ 1
2022
116
ТЕКУЦКАЯ и др.
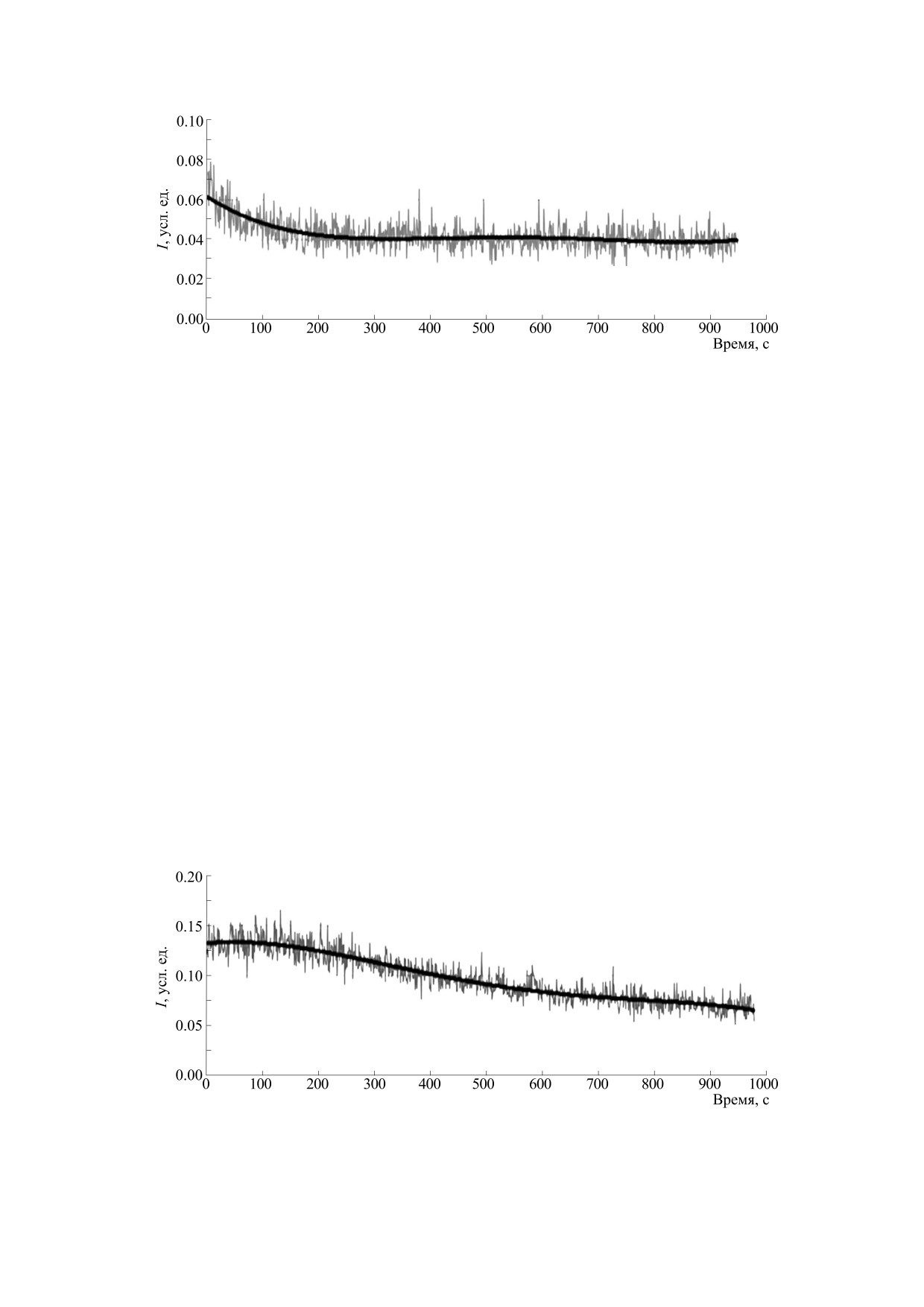
Рис. 1. Интенсивность спонтанной хемилюминесценции взвеси МНК, выделенных из периферической крови здоровых
доноров.
кривых интенсивности ХЛ нативных МНК
300 с от начала регистрации в отсутствие (рис. 4а)
(рис. 1 и 2) видно, что начальный всплеск интен-
и присутствии H2O2 (рис. 4б).
сивности ХЛ взвеси МНК, выделенных из крови
Учитывалось, что H2O2 имеет собственное
больных БЭ, имеет большую величину, чем на-
чальная интенсивность ХЛ МНК здоровых до-
свечение, среднее значение интенсивности кото-
норов.
рого лежит в диапазоне от 0.04 до 0.05 отн. ед. Пе-
рекись водорода стимулировала дополнительное
Значения флуктуаций интенсивности ХЛ взве-
свободно-радикальное окисление и повышала
си МНК больных БЭ достигали 0.16 отн. ед., тогда
ХЛ взвеси. Видно, что стимулирование ХЛ взвеси
как максимальное значение флуктуаций этого же
МНК здоровых доноров с помощью перекиси во-
параметра для МНК здоровых доноров едва до-
дорода приводит практически к двукратному уве-
стигало значения 0.09 отн. ед. Также отмечались
личению интенсивности ХЛ: с 0.039 отн. ед.
различия в характере спада кривых интенсивно-
(рис. 4а) до 0.080 отн. ед. (рис. 4б). Стимулирова-
сти ХЛ: для МНК здоровых доноров это была экс-
ние ХЛ взвеси МНК периферической крови
поненциальная зависимость, а для МНК больных
больных БЭ с помощью МП также приводит к
БЭ - практически прямолинейная (рис. 1 и 2).
увеличению начального всплеска ХЛ (рис. 4а) по
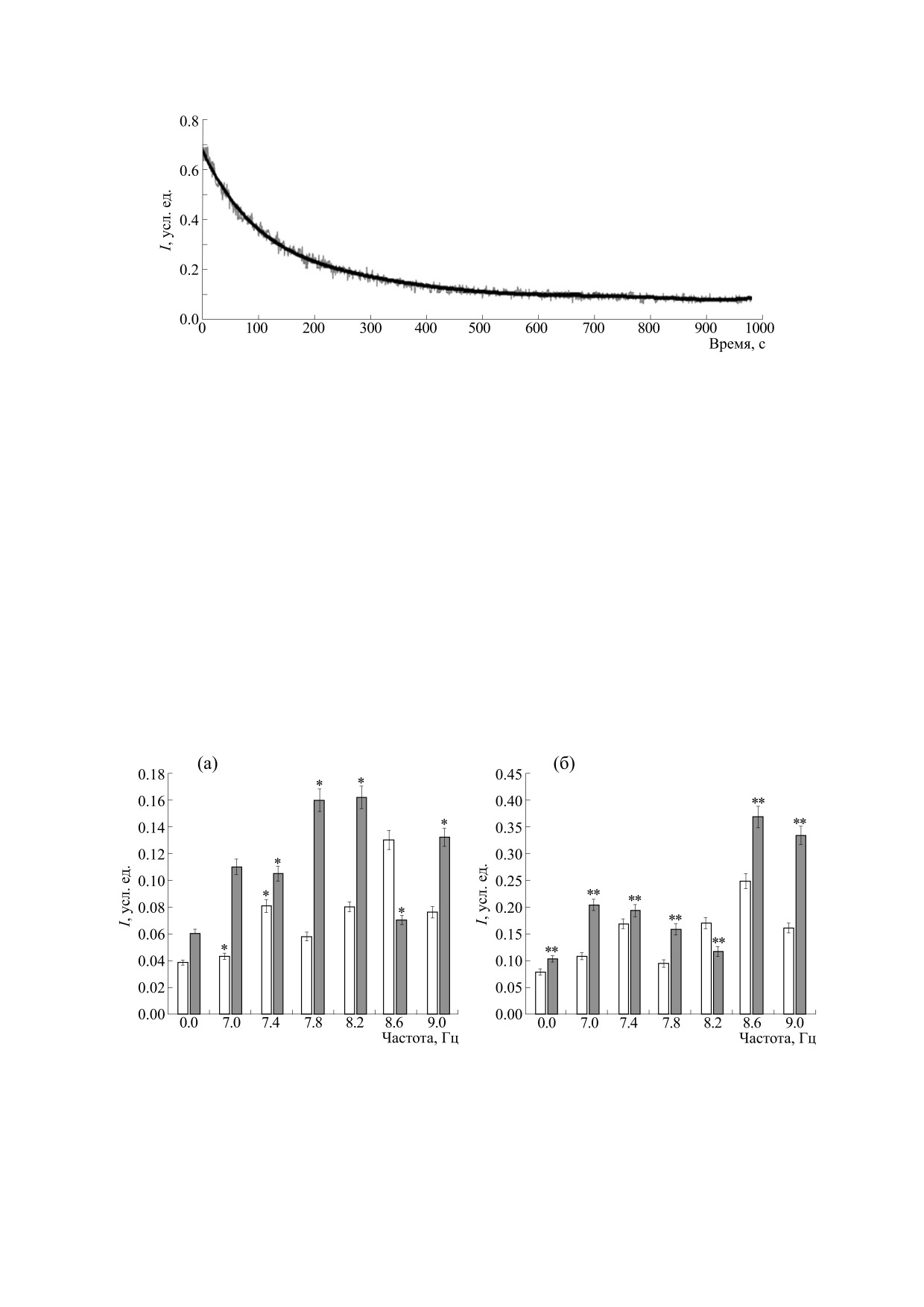
При добавлении H2O2 к взвеси МНК здоровых
сравнению с ХЛ нативных МНК (рис. 2). Наи-
доноров и воздействии in vitro МП частотой 8.6 Гц
больший всплеск интенсивности ХЛ МНК боль-
наблюдалось значительное увеличение началь-
ных БЭ наблюдалась после воздействия на них
ной ХЛ (рис. 3).
МП частотами 7.8 Гц и 8.2 Гц, причем значение
Получены зависимости интенсивности ХЛ
интенсивности стимулированной ХЛ превышало
взвеси МНК периферической крови здоровых
собственную ХЛ нативных МНК почти в
доноров от частоты воздействующего МП после
десять раз.
Рис. 2. Интенсивность спонтанной хемилюминесценции взвеси МНК, выделенных из периферической крови больных БЭ.
БИОФИЗИКА том 67
№ 1
2022
ВЛИЯНИЕ ПЕРЕМЕННОГО МАГНИТНОГО ПОЛЯ
117
Рис. 3. Интенсивность хемилюминесценции взвеси МНК периферической крови здоровых доноров после воздействия
МП с частотой 8.6 Гц и внесения 20 мкл 0.3% H2O2.
В ходе проведенных исследований были изу-
Незначительное превышение нормы наблюдает-
чены изменения уровней концентрации основ-
ся лишь при воздействии МП частотой 7.0 Гц -
ных провоспалительных цитокинов ИЛ-1, ИЛ-6
7.5 ± 0.08 пг/мл. Изменение частоты МП оказы-
и α-ФНО в сыворотке крови больных БЭ и здоро-
вает скорее подавляющий эффект, не приводя к
вых добровольцев при воздействии на образцы
выходу показателей за референсный интервал.
периферической крови переменным МП in vitro.
Это свидетельствует об устойчивости данного
Результаты содержания ИЛ-1, ИЛ-6, α-ФНО по-
биохимического параметра контрольной группы
сле проведения иммуноферментного анализа сы-
к действию МП.
воротки крови здоровых и больных доноров до и
При БЭ до воздействия МП уровень концен-
после воздействия МП разной частоты приведе-
трации ИЛ-1 сопоставим с данным показателем
ны на рис. 5-7.
контрольной группы и находится в границах нор-
Концентрация ИЛ-1 в крови в норме не пре-
мы - 5.8 пг/мл. Воздействие МП с частотами от
вышает 5 пг/мл [4], что отмечено на рис. 5 гори-
7.0 до 7.4 и 7.8 Гц не влияло на этот параметр, од-
зонтальной линией. В интактных образцах кон-
нако действие МП с частотами 8.2 и 9.0 Гц приво-
трольной группы этот показатель остается в гра-
дило к повышению концентрации метаболита
ницах референсных значений
- 5.5 пг/мл. почти вдвое - 9.6 и 8.4 пг/мл соответственно. Это
Рис. 4. Влияние переменного магнитного поля на интенсивность хемилюминесценции взвеси МНК, выделенных из
периферической крови здоровых (светлые столбики) и больных (темные столбики) доноров: (а) в отсутствии перекиси
водорода, (б) при добавлении 20 мкл 0.3% H2O2. Взвесь МНК обрабатывали МП разных частот in vitro в течение 15 мин при
температуре 22°С; * - р < 0.05 в сравнении с контролем - необработанной МП взвесью МНК здоровых доноров; ** - р < 0.05
в сравнении с контролем - необработанной МП взвесью МНК здоровых доноров с добавлением перекиси водорода.
БИОФИЗИКА том 67
№ 1
2022
118
ТЕКУЦКАЯ и др.
Рис. 5. Содержание ИЛ-1 в сыворотке крови здоровых
Рис. 6. Содержание ИЛ-6 в сыворотке крови здоровых
доноров (светлые столбики) и больных БЭ (темные
доноров и больных БЭ после воздействия in vitro
столбики) после воздействия in vitro переменным МП
переменным МП различной частоты.
различной частоты.
ство ответной реакции в контрольной и опытной
свидетельствует о том, что патологический про-
группах. Так, обработка МП со средними часто-
цесс снижает устойчивость к влиянию МП, эф-
тами (7.4 и 7.8 Гц) повышает концентрацию
фект этого воздействия сходен с провоспалитель-
α-ФНО в обеих группах, а частоты больше 7.8 Гц
ным. Таким образом, если изначальные концен-
приводят к резкому его падению. Таким образом,
трации ИЛ-1 в контроле и опыте сопоставимы, то
ответную реакцию выработки α-ФНО на воздей-
характер ответной реакции по выработке ИЛ-1 на
ствие МП при патологическом процессе можно
воздействие МП в контрольной и опытной груп-
считать сходной с контрольной.
пе различен.
Референсным интервалом для ИЛ-6 является
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
диапазон 0-300 пг/мл. Полученные нами значе-
Выяснено, что непосредственно после обра-
ния концентрации ИЛ-6 в контрольной группе
ботки взвеси МНК переменным МП в клетках
лежат в пределах референсных значений как в ин-
происходит увеличение уровня ХЛ, связанное с
тактных образцах - 6.6 пг/мл, так и при воздей-
ствии МП различной частоты (257 пг/мл при ча-
стоте 8.6 Гц). Содержание ИЛ-6 в образцах крови
больных БЭ по сравнению с контролем повыше-
но более, чем в 100 раз - 666.1 пг/мл. Это согласу-
ется с литературными данными о том, что содер-
жание этого цитокина значительно повышается
при многих патологических процессах [16]. Изу-
чение влияния переменного МП на данную экс-
периментальную модель показало, что действие
МП частотами от 7.0 до 7.8 Гц и от 8.6 до 9.0 Гц,
снижает концентрацию этого цитокина до значе-
ний референсного интервала. Сопоставимые с
воздействием патологического процесса значе-
ния концентрации ИЛ-6 (600.86 пг/мл) сохраня-
ются лишь при частоте МП 8,2 Гц.
Референсный интервал для α-ФНО составляет
0-12 пг/мл. Как видно на рис. 6, исходные пока-
затели α-ФНО в нативных образцах обеих групп
остаются в пределах нормы: 5.2 пг/мл в контроле
и 4.3 пг/мл при БЭ. Несмотря на то что воздей-
Рис. 7. Содержание фактора некроза опухоли в сыворот-
ствие МП не приводит к выходу параметров за
ке крови здоровых доноров и больных БЭ после воздей-
пороговые значения, обращает внимание сход-
ствия in vitro переменным МП различной частоты.
БИОФИЗИКА том 67
№ 1
2022
ВЛИЯНИЕ ПЕРЕМЕННОГО МАГНИТНОГО ПОЛЯ
119
образованием АФК моноцитами, присутствую-
с БЭ по сравнению с ИЛ-1 и α-ФНО в изучаемой
щими во взвеси МНК. Накопление АФК приво-
экспериментальной модели дает основание для
дит к изменению свойств как бислойных участ-
использования данного показателя в качестве мо-
ков мембраны, свободных от белковых компо-
лекулярного маркера при БЭ. Это может явиться
нентов, так и липопротеидных мембранных
важным шагом к персонализированному подходу
комплексов. Такие существенные различия меж-
прогноза течения и терапии при БЭ.
ду откликами МНК периферической крови, взя-
Характер ответной реакции рассматриваемых
тых у здоровых доноров и больных БЭ, на воздей-
метаболитов на обработку переменным МП раз-
ствие МП можно объяснить состоянием мембран
личен. Наблюдаемые нами высокие уровни кон-
и происходящими внутриклеточными процесса-
центрации ИЛ-1 и ИЛ-6 при воздействии МП с
ми [9, 13-15]; отмечается, что для больных БЭ та-
частотой 8.2 Гц и 9.0 Гц можно сопоставить с дей-
кие повреждения значительны [16, 17]. Таким об-
ствием патологического процесса, инициирую-
разом, при патологии МНК обладают повышен-
щего воспалительный ответ. Это может быть свя-
ной собственной ХЛ и отвечают на слабые
зано с влиянием МП на выработку АФК. Извест-
воздействия электромагнитного поля усилением
но, что низкочастотное электромагнитное поле
ХЛ, в отличие от МНК здоровых людей.
приводит к генерации малых доз АФК, оказывая
В целом при неспецифической стимуляции
на клеточном уровне как стимулирующее, так и
ХЛ клеток с помощью переменного МП харак-
повреждающее воздействие [9, 18, 19]. Возможно,
терно увеличение проницаемости мембран, акти-
именно с изменением содержания АФК связано
вация
«дыхательного взрыва»
- образование
и снижение концентрации ИЛ-6 при частотах
АФК и активных форм азота в клетках, в которых
МП 7.4, 7.6 и 8.6 Гц, а также содержание α-ФНО
есть ферменты NADPH-оксидазы и NO-синтазы.
при частотах от 8.2 до 9.0 Гц. Подобный эффект
Эти ферменты в большом количестве присутству-
снижения цитокинового ответа наблюдался при
ют только в нейтрофилах, их мало в моноцитах, а
изучении влияния ингибиторов сигнальных кас-
в лимфоцитах по данным литературных источни-
кадов NF-κB и SAPK/JNK на функциональную
ков они отсутствуют [2, 3]. Кроме того, в водной
активность иммунных клеток мышей [20]. Как
среде возможно образование некоторых коли-
известно, определенный уровень АФК в организ-
честв АФК, которые генерируются при воздей-
ме крайне необходим, поскольку действие мно-
ствии низкоинтенсивных факторов, например,
гих мессенджеров происходит либо через актива-
низкочастотного МП [8, 9]. Это согласуется с
цию системы генерирования АФК, либо через
данными работы [18], в которой авторы изучали
ингибирование антиоксидантной системы [19].
эффект действия слабого МП на ХЛ венозной
крови человека. Приведенные в работе [18] ре-
зультаты свидетельствуют о роли свободных ра-
ВЫВОДЫ
дикалов, генерируемых кровью, в механизмах
Усиление ХЛ при воздействии переменным
биологического действия МП.
МП на взвесь МНК, выделенных из крови как
Полученные данные показывают, что в ин-
здоровых, так и больных БЭ, по-видимому, свя-
тактных образцах концентрация ИЛ-1 и α-ФНО в
зано как с активацией «дыхательного взрыва» -
контроле и в экспериментальной группе практи-
образованием АФК в моноцитах, в которых есть
чески не отличается. Напротив, концентрация
ферменты NADPH-оксидазы, так и с образова-
ИЛ-6 в опытных образцах значительно превыше-
нием в водной фазе АФК, которые генерируются
на по сравнению с контролем. ИЛ-6 - провоспа-
при воздействии низкоинтенсивным МП. Дей-
лительный цитокин, который синтезируется в
ствие многих мессенджеров и, в частности, цито-
больших количествах Тh-2-лимфоцитами, моно-
кинов происходит либо через активацию системы
цитами и макрофагами в ответ на воспалитель-
генерирования АФК, либо через ингибирование
ный процесс и опосредует развитие гуморального
антиоксидантной системы. Способность МНК к
иммунитета. При ряде аутоиммунных заболева-
восстановлению и/или поддержанию цитокино-
ний наблюдается его избыточная экспрессия [17].
вого уровня отражает их адаптационные возмож-
Синергически взаимодействуя с ИЛ-1, α-ФНО
ности и функциональную активность. Таким об-
вызывает гиперпродукцию эпидермального фак-
разом, слабые воздействия низкочастотным МП,
тора роста и способствует гиперпролиферации
приводящие к генерации малых доз АФК, в це-
клеток эпидермиса. В изучаемой эксперимен-
лом оказывают как протекторное влияние на им-
тальной модели концентрация ИЛ-1 и α-ФНО
мунокомпетентные клетки, так и повреждающее.
остается не выше контрольных показателей. Оче-
видно, в каскаде биохимических процессов при
БЭ подобное синергетическое взаимодействие
ФИНАНСИРОВАНИЕ РАБОТЫ
выражено недостаточно. Это, возможно, являет-
ся одной из причин формирования длительно не-
Исследование выполнено при финансовой
заживающих ран на коже при данной патологии.
поддержке Кубанского научного фонда в рамках
Кроме того, более выраженная ассоциация ИЛ-6
научного проекта № 20.1/119.
БИОФИЗИКА том 67
№ 1
2022
120
ТЕКУЦКАЯ и др.
КОНФЛИКТ ИНТЕРЕСОВ
7. А. А. Кубанов, А. Э. Карамова, В. И. Альбанова и
др., Вестн. дерматологии и венерологии 4, 28
Авторы заявляют об отсутствии конфликта
(2017). DOI: 10.25208/0042-4609-2017-0-4-22-27
интересов.
8. Е. Е. Tekutskaya, M. G. Baryshev, L. R. Gusaruk, and
G. P. Ilchenko, Biophysics 65 (4), 564 (2020). DOI:
10.1134/S0006350920040247
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
9. Е. Е. Tekutskaya, S. S. Dzhimak, E. V. Barysheva,
Все процедуры, выполненные в исследовании
et al., Med. News of North Caucasus 10 (3) 287
с участием людей, соответствовали этическим
(2015)/ DOI: 10.14300/mnnc.2015.10067
стандартам Хельсинкской декларации 1964 г. и ее
10. G. P. Il’chenko, M. G. Baryshev, E. E. Tekutskaya,
последующим изменениям. От всех участников
et al., Measurement Techniques 60 (6), 632 (2017).
предварительно было получено информирован-
DOI: 10.1007/s11018-017-1247-7
ное добровольное согласие на участие в исследо-
11. Ю. А. Владимиров, Биохемилюминесценция (Нау-
ка, Москва, 2000)
вании.
12. А. Н. Герасимов, Медицинская статистика (Нау-
ка, Москва, 2007)
СПИСОК ЛИТЕРАТУРЫ
13. A. M. Khalil and W. Qassem, Mutat. Res. 2 (15), 141
1. А. М. Сташков и И. Е. Горохов, Биофизика 43 (5),
(2006).
157 (2007).
14. А. М. Лягинcкая и В. А. Григорьев, Радиац. био-
логия. Радиоэкология 50 (1), 83 (2010).
2. Р. В. Петров, Иммунология 5, 32 (2007).
15. Е. Е. Текуцкая, И. Я. Турьян, В. И. Кравцов и др.,
3. М. Г. Авдеева и М. Г. Шубич, Иммунология 7, 824
Журн. неорг. химии 35 (2), 549 (1990).
(2006).
16. S. Shinkuma, Clin. Cosmet. Investig. Dermatol. 8, 275
(2015). DOI: 10.2147/CCID.S54681
cal.sanguinebio.com/types-of-immune-cells-present-
17. С. В. Смирнова и М. В. Смольникова, Мед. имму-
in-human-pbmc/.
нология 16 (2), 127 (2014).
5. А. Н. Силков, Т. В. Ковалевская-Кучерявенко и
18. В. В. Новиков, Е. В. Яблокова и Е. Е. Фесенко,
С. В. Cенников, Цитокины и воспаление 1, 4
Биофизика 61 (1), 126 (2016).
(2012).
19. В. Г. Гривенникова и А. Д. Виноградов, Успехи
6. Т. Yoshimoto, Cytokine Frontiers: Regulation of Im-
биол. химии 53, 245 (2013).
mune Responses in Health and Disease (Springer, Ja-
20. Т. В. Новоселова, О. В. Глушкова, С. Б. Парфе-
pan, 2014)
нюк и др., Биофизика 59 (1), 112 (2014).
Effect of an Alternating Magnetic Field on the Chemiluminescence of Human Peripheral
Blood Mononuclear Cells and the Production of Pro-Inflammatory Cytokines
E.E. Tekutskaya*, L.R. Gusaruk**, and G.P. Ilchenko*
*Kuban State University, ul. Stavropol’skaya 149, Krasnodar, 350040 Russia
**Kuban State Medical University, ul. Sedina 4, Krasnodar, 350063 Russia
It has been shown that exposure to an in vitro alternating magnetic field with a strength of 550 ± 30 A/m at a
frequency of 8.6 and 9.0 Hz leads to a significant change in the chemiluminescence of a suspension of mono-
nuclear cells isolated from the peripheral blood of healthy donors and patients with epidermolysis bullosa
(EB). The enzyme-linked immunosorbent assay determined the content of pro-inflammatory cytokines (in-
terleukin-1; interleukin-6 and tumor necrosis factor) in the peripheral blood serum of healthy donors and pa-
tients with bullous epidermolysis after exposure to in vitro blood samples with variable magnetic field in the
frequency range from 7.0 to 9.0 Hz. It was found that with epidermolysis bullosa, the content of interleukin-
6 in the blood serum of patients with epidermolysis bullosa is significantly increased in comparison with
healthy donors. The action of magnetic field with frequencies from 7.0 to 7.8 Hz and from 8.6 to 9.0 Hz on
blood samples from patients with epidermolysis bullosa reduces the concentration of this cytokine to the val-
ues of the reference interval. The initial indices of tumor necrosis factor in native samples of both groups re-
mained within the normal range: 5.2 pg/ml in the control and 4.3 pg/ml in epidermolysis bullosa. The impact
of magnetic field does not lead to the parameters going beyond the threshold values, while there is a similarity
in the response in the control and experimental groups. Thus, the processing of magnetic field with frequen-
cies of 7.4 and 7.8 Hz increases the concentration of tumor necrosis factor in both groups, and magnetic field
with frequencies greater than 7.8 Hz leads to a sharp drop in it.
Keywords: peripheral blood mononuclear cells, chemiluminescence, pro-inflammatory cytokines, alternating
magnetic field, reactive oxygen species
БИОФИЗИКА том 67
№ 1
2022