БИОФИЗИКА, 2022, том 67, № 2, с. 213-221
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
КРЕМНИЕВЫЕ АНАЛОГИ L-АМИНОКИСЛОТ: СВОЙСТВА
«КИРПИЧИКОВ» ЧУЖОЙ БИОСФЕРЫ
© 2022 г. М.С. Кондратьев*, К.А. Щербаков**, А.А. Самченко*, О.В. Дегтярева*,
Е.Л. Терпугов*, Н.Н. Хечинашвили*, В.М. Комаров*
*Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, Институтская ул., 3
**Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича,
119121, Москва, ул. Погодинская, 10/8
E-mail: ma-ko@bk.ru
Поступила в редакцию 20.01.2022 г.
После доработки 20.01.2022 г.
Принята к публикации 24.01.2022 г.
При помощи полуэмпирической квантово-химической методики PM3/РМ7 впервые рассчитаны и
проанализированы геометрические особенности молекул кремниевых аналогов 20 протеиногенных
L-аминокислот и проводится их сравнение с углеродными аминокислотами. Помимо конформаци-
онных параметров определены значения энтальпий образования и дипольных моментов изученных
соединений. Показано, что длины связей в кремниевых аналогах аминокислот значительно превос-
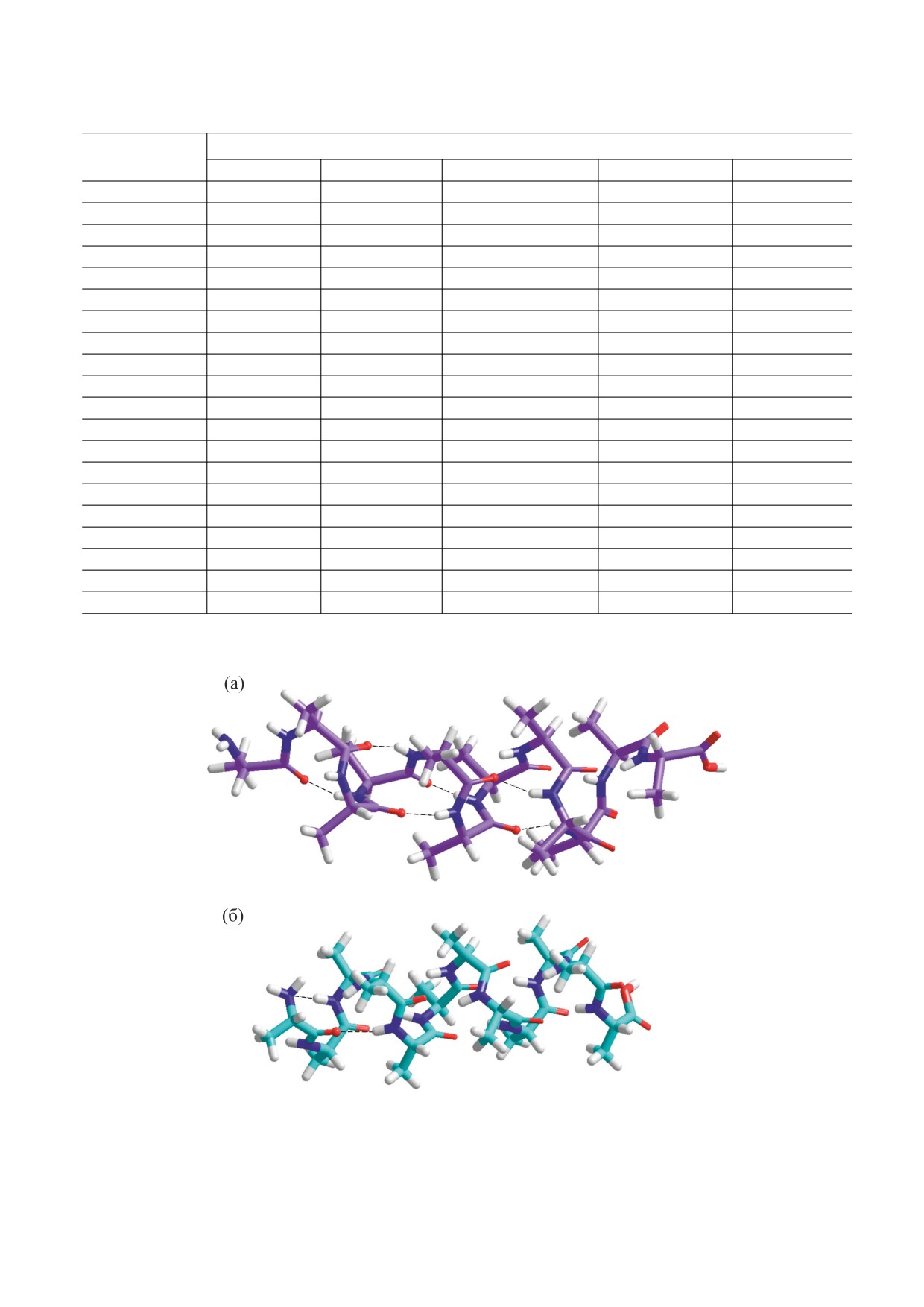
ходят длины связей в углеродных аминокислотах. В кремниевом аналоге аспартата (как и в углерод-
ном аспартате) возможно образование внутримолекулярной водородной связи. Наименьшей тер-
модинамической стабильностью характеризуются ароматические и гетероциклические аналоги
аминокислот, причем вопрос ароматичности в кремниевых соединениях носит иной характер, не-
жели в соединениях углерода, из-за более длинных межатомных расстояний и более слабого π-со-
пряжения. На модели полиаланиновой цепи показано, что как в углеродном, так и в кремниевом
пептиде глобальный минимум теплоты образования такой молекулы соответствует конформации
α-спирали.
Ключевые слова: кремний, кремниевые соединения, аминокислоты, конформеры, энтальпия образования,
квантово-химический расчет, альтернативная биохимия.
DOI: 10.31857/S0006302922020016
В гипотезах об альтернативных формах жизни
которых имеются связи между атомами углерода
(например, на других планетах) особое внимание
и кремния [4], в том числе и аминокислоты, име-
уделяется кремнию, как элементу, соединения
ющие в составе атомы кремния [5, 6], так и анало-
которого теоретически способны образовывать
ги органических соединений, в которых атомы
аналоги сложных органических веществ. Данные
углерода полностью замещены атомами кремния,
взгляды не лишены оснований. Действительно,
например, гексасилабензол [7]. Отметим также,
кремний и углерод принадлежат одному периоду
что благодаря успехам компьютерной химии в во-
периодической системы элементов и имеют схо-
просах поиска новых лекарств [8] и новых мате-
жее строение валентных электронных оболочек,
риалов [9], квантово-химических расчетов термо-
вследствие чего обладают похожими химически-
химии [10], теоретического изучения явлений
ми свойствами [1]. Можно предположить, что
ароматичности [11], стало возможным применить
кремний способен служить основой для форми-
методы драг-дизайна и квантовой-химии к со-
рования сложных, разветвленных молекул [2, 3].
единениям, которые ранее не были известны в
В связи с этим, особый интерес представляет изу-
экспериментах. Даже для самых, казалось бы, хо-
чение кремниевых аналогов известных биомоле-
рошо изученных природных L-аминокислот в
кул. В качестве объекта данного исследования на-
ми были выбраны аналоги 20 протеиногенных
последние годы получены новые эксперимен-
аминокислот, их монопептиды и короткие пепти-
тальные данные, свидетельствующие о процессах
ды, в которых все атомы углерода были замещены
их структурных ассоциаций и даже образования
атомами кремния. Важно отметить, что уже из-
подобия кристаллов в растворах под действием
вестны как кремний-органические соединения, в
видимого света или лазерного излучения [12, 13].
213
214
КОНДРАТЬЕВ и др.
Целью данной работы являлся оценочный
только максимальные по значениям теплоты об-
расчет геометрических и некоторых термодина-
разования оптимизируемых структур, но и отсут-
мических характеристик молекул-аналогов два-
ствие отрицательных значений частот в рассчи-
дцати протеиногенных аминокислот, их моно-
танных спектрах нормальных колебаний найден-
пептидов и коротких пептидов, в которых все ато-
ных конформеров. Этим достигалось исключение
мы углерода замещены атомами кремния, на
из рассмотрения большого числа промежуточ-
уровне полуэмпирического квантово-химическо-
ных, метастабильных структур. Отметим также,
го метода PM3/PM7. Основной интерес для нас
что экспериментально изучаемые нами кремние-
представлял поиск наиболее стабильных конфор-
вые молекулы пока не известны, в литературе
меров, нахождение значений длин связей и ва-
также отсутствуют данные о моделировании их
лентных углов, а также расчет энтальпий образо-
другими методами, такими, как ab initio (мы опуб-
вания гипотетических кремниевых молекул. Эти
ликуем эти данные позднее).
впервые полученные данные были приведены в
сравнении с уже известными аналогичными дан-
ными по углеродным аминокислотам, монопеп-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
тидам и пептидам [14]. Проведенный анализ поз-
Аналоги одиночных L-аминокислот. Геометри-
волил оценить схожесть и различия геометриче-
ческая оптимизация и поиск наиболее ста-
ских характеристик соединений на основе
бильных конформеров были произведены для
кремния и углерода. Отметим, что все выбранные
аналогов всех двадцати протеиногенных L-ами-
молекулы были взяты в виде L-стереоизомера,
нокислот. К сожалению, какие-либо экспери-
так как у D- и L-форм аминокислот анализируе-
ментальные данные по указанным соединениям
мые в работе соответствующие параметры досто-
отсутствуют ввиду того, что они еще не синтези-
верно не отличаются.
рованы. В связи с этим мы провели сравнение
МЕТОДЫ
геометрических характеристик кремниевых ана-
логов аминокислот с таковыми для углеродных,
Для расчетов структурных и термодинамиче-
данные по которым были взяты из литературы
ских особенностей указанных аналогов биомоле-
[20] или получены нами [21].
кул использовали полуэмпирическую квантово-
химическую MNDO-методику в вариантах пара-
Данные из табл. 1 демонстрируют, что длины
метризаций PM3 [15] и РМ7 [16]. Выбор данного
связей в кремниевых аналогах аминокислот за-
вычислительного инструмента был обусловлен
метно превосходят длины связей в углеродных
тем, что он характеризуется наилучшим соотно-
аминокислотах. Особенно это заметно на приме-
шением (для интересовавших нас задач) точности
ре связи Si-Si, длина которой фактически в пол-
расчета и требуемых вычислительных ресурсов.
тора раза превосходит длину аналогичной связи
При оптимизации геометрии всех соединений
C-C. Это объясняется тем, что ковалентный ра-
использовалось стократное усиление критериев
диус атома кремния превосходит ковалентный
сходимости и оптимизации (PRECISE), по срав-
радиус атома углерода. Ранее нами было показа-
нению со стандартными критериями, используе-
но, что в случае с углеродными полипептидами
мыми по умолчанию в этих программах [17]. Это
аспарагиновая кислота способна инициировать
позволяло учитывать возможность обнаружения
спирализацию растущей полипептидной цепи
у исследуемых соединений дополнительных
путем образования внутримолекулярной водо-
устойчивых конформеров. При помощи пакета
родной связи (рис. 1) [21]. В ее кремниевом ана-
MOPAC6 и полуэмпирической параметризации
логе тоже возможно образование Н-связи, одна-
РМ3 нам удалось получить оптимизированные
ко ее длина составляет 2.1 Å, в то время как в угле-
структуры двадцати протеиногенных аминокис-
родном варианте длина H-связи равна 1.7 Å.
лот и их кремниевых аналогов. Для соединений
Аналогичная картина наблюдается и с остатком
кремния метод РМ3 показал недостаточную при-
глутаминовой кислоты.
емлемость: некоторые валентные углы при опти-
Также нами были рассчитаны энтальпии обра-
мизации становились острыми. По этой причине
зования кремниевых аналогов всех двадцати
найденные минимумы были пересчитаны в паке-
L-аминокислот и проведено их сравнение с теп-
те МОРАС 2016 [18] с использованием парамет-
лотами образования углеродных аминокислот,
ризации РМ7, которая, к тому же, в силу своей на-
которые были вычислены нами ранее, для неко-
дежности и гибкости недавно была использована
торых из них приведены экспериментальные дан-
для моделирования ферментативного катализа
ные (табл. 2) [22-27].
[19].
На основании значений теплот образования
Особое внимание при расчетах уделялось уси-
кремниевые аналоги аминокислот были разделе-
лению критерия достижения глобального мини-
ны на несколько групп:
мума поверхности потенциальной энергии иссле-
дуемых молекул. Мы стремились получить не
1) алифатические (Gly, Ala, Val, Leu, Ile, Pro);
БИОФИЗИКА том 67
№ 2
2022
КРЕМНИЕВЫЕ АНАЛОГИ L-АМИНОКИСЛОТ
215
Таблица 1. Основные геометрические параметры молекул глицина и аланина
Gly
Ala
Si-Ala
Gly
Si-Gly
Длина связи
Длина связи
Длина связи
Тип связи
Длина связи (Sell-
Тип связи
Длина связи (наш
(наш расчет в
(наш расчет в
(наш расчет в
ers et al. [20])
расчет в PM7)
PM7 [14])
PM7)
PM7)
N-H
1.001
0.998
0.998
N-H
1.014
1.016
N-C
1.457
1.469
1.48
N-Si
1.785
1.792
C-H
1.081
1.109
1.119
Si-H
1.469
1.479
C-C
1.514
1.513
1.526
Si-Si
2.207
2.204
C=O
1.203
1.218
1.218
Si=O
1.422
1.422
C-O
1.364
1.351
1.351
Si-O
1.56
1.558
O-H
0.966
0.952
0.952
O-H
0.97
0.97
C-Cβ
-
-
1.524
Si-Siβ
-
2.22
Gly
Ala
Si-Gly
Si-Ala
Gly
Величина угла
Величина угла
Валентный
Величина угла
Величина угла
Валентный угол
Величина угла
(наш расчет в
(наш расчет в
угол
(наш расчет в
(наш расчет в
(Sellers et al. [20])
PM7 [14])
PM7 [14])
PM7)
PM7)
N-Cα-C
113.28
114.88
112.95
N-Siα-Si
117.7
114.48
Cα-C=O
126.41
128.84
128.62
Siα-Si=O
125.73
124.6
Cα-C-O
110.62
115.14
112.51
Siα-Si-O
107.4
107.98
C-O-H
112.28
110.03
110.04
Si-O-H
130.1
130.39
Cα-N-H
113.27
110.29
110.38
Siα-N-H
118.57
117.07
C-Cα-H
107.87
109.28
108.63
Si-Siα-H
108.72
108.05
H-N-H
110.29
109.24
109.57
H-N-H
108.52
107.97
H-Cα-H
107.04
106.43
-
H-Siα-H
108.65
-
N-Cα-H
110.27
108.31
106.2
N-Siα-H
106.37
105.86
N-Cα-Cβ
-
-
110.4
N-Siα-Siβ
-
106.68
H-Cα-Cβ
-
-
109.46
H-Siα-Siβ
-
107.7
C-Cα-Cβ
-
-
109.06
Si-Siα-Siβ
-
113.62
Gly
Ala
Si-Gly
Si-Ala
Gly
Величина угла
Величина угла
Двугранный
Величина угла
Величина угла
Двугранный угол
Величина угла
(наш расчет в
(наш расчет в
угол
(наш расчет в
(наш расчет в
(Sellers et al. [20])
PM7[14])
PM7[14])
PM7)
PM7)
N-Ciα-C=O
0
0.14
22.2
N-Siα-Si=O
179.76
6.14
N-Ciα-C-O
180
179.86
157.36
N-Siα-Si-O
0.25
173.78
Ciα-C-O-H
180
180
179.15
Siα-Si-O-H
179.98
179.23
C-Ciα-N-H
63.29
60.21
66.45
Si-Siα-N-H
67.69
56.6
O-C-Ciα-H
57.65
58.2
39.8
O-Si-Siα-H
120.69
68.56
H-N-Ciα-Cβ
-
-
55.97
H-N-Siα-Siβ
-
69.98
O=C-Ciα-Cβ
-
-
100.99
O=Si-Siα-Siβ
-
129.05
O-C-Ciα-Cβ
-
-
79.43
O-Si-Siα-Siβ
-
50.88
Примечание. Длины связей даны в ангстремах, величины углов - в градусах.
БИОФИЗИКА том 67
№ 2
2022
216
КОНДРАТЬЕВ и др.
3) содержащие спиртовую группу (-OH) - Ser,
Tyr, Thr. Заметно более низкой по модулю тепло-
той образования, чем Ser и Thr, обладает Tyr. Мы
полагаем, что это является следствием наличия в
этом соединении массивного ароматического
цикла;
4) серосодержащие - Cys и Met;
5) кислые - Glu, Asp;
6) оснóвные - Gln, Asn, Arg, His, Lys. В данном
ряду своими высокими теплотами образования
выделяются Gln и Asn. Очевидно, это объясняет-
ся наличием атомов кислорода в составе их боко-
вых цепей.
На основании указанных данных можно сде-
Рис. 1. Структуры аминокислоты аспартата: (а) -
лать два основных вывода:
углеродная, c внутримолекулярной водородной связью;
1) наличие циклов и гетероциклов в составе
(б) - кремниевая, c внутримолекулярной водородной
боковых цепей кремниевых аминокислот приво-
связью.
дит к понижению термодинамической стабиль-
ности;
2) ароматичеcкие и гетероциклические - Phe,
2) наличие атомов кислорода в боковой цепи
Trp. Заметно, что они отличаются довольно низ-
вызывает увеличение модуля значений теплоты
образования.
кими значениями теплот образования. Получен-
ная низкая термодинамическая стабильность у
Стоит отметить, что схожая картина наблюда-
ароматических и гетероароматическмх амино-
ется и в случае с углеродными аминокислотами
[14].
кислот не противоречит известным представле-
ниям об относительно слабой термодинамиче-
Следующей важной характеристикой молеку-
лярных систем является величина дипольного
ской устойчивости молекулярных систем с со-
момента. Значения дипольного момента были
пряженными связями. Также сюда могут быть
рассчитаны нами для кремниевых аналогов всех
отнесены His и Tyr. Однако His обладает значи-
двадцати протеиногенных L-аминокислот. Также
тельно более отрицательной теплотой образова-
было сделано сравнение данной величины с ди-
ния, чем Phe и Trp; вероятно, это может быть объ-
польными моментами углеродных аминокислот,
яснено содержанием в составе гетероцикла сразу
ранее вычисленных нами [14]. Полученные дан-
двух атомов азота. Аналогично, теплота образова-
ные представлены в табл. 3.
ния Tyr заметно выше, чем у Phe и Trp, возможно,
Табл. 3 демонстрирует, что кремниевые анало-
это объясняется наличием гидроксильной груп-
ги аминокислот в большинстве случаев обладают
пы в его боковой группе;
более высокими значениями дипольных момен-
Таблица 2. Теоретические и экспериментальные величины энтальпий образования (ΔHof) двадцати природных
L-аминокислот и их кремниевых аналогов
Углеродная
Кремниевая
Углеродная
Кремниевая
Экспери-
Амино-
Эксперимент
Амино-
(ккал/моль,
(ккал/моль,
(ккал/моль,
(ккал/моль,
мент
кислота
(ккал/моль)
кислота
PM7)
PM7)
PM7)
PM7)
(ккал/моль)
Gly
-93.3
-143.5
-93.3
Glu
-192.2
-270.4
Ala
-99.1
-137.8
-99.1
Asp
-185.0
-277.6
Val
-108.8
-128.3
-108.8
Gln
-150.7
-214.9
Leu
-114.3
-121.5
-116.3
Asn
-143.0
-270.4
Ile
-113.5
-120.8
Arg
-83.4
-161.5
Phe
-72.0
-77.2
-74.8
His
-64.2
-156.3
Tyr
-116.7
-159.5
Met
-98.92
-160.5
-98.8
Trp
-53.6
-94.84
Pro
-93.8
-144
-87.5
Ser
-138.3
-221.6
Thr
-148.2
-215.4
Cys
-92.4
-158
Lys
-114.3
-145.7
БИОФИЗИКА том 67
№ 2
2022
КРЕМНИЕВЫЕ АНАЛОГИ L-АМИНОКИСЛОТ
217
Таблица 3. Величины дипольных моментов (в дебаях) для двадцати протеиногенных аминокислот и их
кремниевых аналогов, рассчитанные в РМ7
Аминокислота
Углеродная
Кремниевая
Аминокислота
Углеродная (PM7)
Кремниевая
(PM7)
(PM7)
(PM7)
Gly
1.1
2.9
Glu
2.2
4.9
Ala
1.2
1.7
Asp
2.00
7.9
Val
1.2
1.5
Gln
4.4
6.4
Leu
1.3
2.2
Asn
3.5
9.3
Ile
1.2
3.0
Arg
2.8
3.1
Phe
1.1
1.3
His
4.3
5.9
Tyr
3.1
4.1
Met
1.1
1.9
Trp
3.9
2.5
Pro
2.4
1.8
Ser
1.6
4.1
Thr
2.2
1.7
Cys
1.8
3.6
Lys
2.3
3.7
тов, чем углеродные (исключением стали лишь
с внутримолекулярной водородной связью. Кон-
Tyr, Pro и Thr). Это говорит о том, что данный
формеры R и B отвечают конформациям правоза-
класс кремниевых соединений будет обладать бо-
крученной α-спирали и β-слоя соответственно, а
лее выраженной чувствительностью к электро-
L - левой α-спирали. Для углеродных монопеп-
статическим взаимодействиям, чем их углерод-
тидов теплоты образования указанных конфор-
ный аналог.
меров распределяются следующим образом [28,
29]:
Монопептиды на основе кремния. Монопепти-
ды, или метиламиды N-ацетил-α-аминокислот,
М > B > H > R > L.
являются известными модельными соединения-
Нами были построены и оптимизированы
ми, на которых ранее изучали конформационное
структуры двадцати кремниевых аналогов моно-
поведение каждого аминокислотного остатка в
пептидов аминокислот во всех пяти конформа-
составе простейшей цепи. Структурно данный
циях. В табл. 4 приведены значения теплот обра-
класс соединений представляет собой модифи-
зования для всех двадцати кремниевых монопеп-
цированные одиночные аминокислоты, к N-ато-
тидов в B-, H-, L-, M- и R-конформациях.
му которых присоединена метильная группа че-
рез карбонильную, а к карбонильному кислороду
Анализ и обобщение данных из табл. 4 позво-
присоединен второй метильный остаток - через
лили распределить термодинамическую стабиль-
атом азота (рис. 2) [28].
ность конформеров в следующий ряд:
Данные соединения представляют интерес по
H(M) > L(M) > R(B).
причине того, что позволяют сымитировать для
каждого конкретного аминокислотного остатка
Иными словами, глобальному минимуму теп-
взаимодействие его α-атома, с α-атомами сосед-
лоты образования монопептида соответствуют
них остатков. Всего для углеродных монопепти-
конформеры Н или М. На втором месте находят-
дов выделяют пять устойчивых конформеров: B,
ся либо L-, либо М-конформации. Конформеры
H, L, M и R. Конформеры H и M - это структуры
R и B обладают наименьшими значениями теплот
образования. Данный факт может свидетельство-
вать о том, что для линейных полимеров на осно-
ве кремниевых аминокислот наиболее выгодны-
ми могут оказываться иные вторичные структу-
ры, отличные от α-спиралей и β-слоев. Этот
вопрос требует дополнительного исследования.
Кремниевые аналоги олигопептидов. Следую-
щим объектом нашего исследования стали пеп-
тиды, состоящие из двенадцати остатков алани-
на, и их кремниевые аналоги. Были проведены
геометрическая оптимизация и расчет энтальпий
образования для данных соединений в конфор-
мациях α-спирали и β-шпильки. Полученные
структуры представлены на рис. 2 и 3. Расчетные
Рис. 2. Примеры углеродных монопептидов.
данные представлены в табл. 5 и 6.
БИОФИЗИКА том 67
№ 2
2022
218
КОНДРАТЬЕВ и др.
Таблица 4. Значения теплот образования различных конформеров кремниевых монопептидов
ΔHof конформера, ккал/моль
Si-монопептид
B
H
L
M
R
Ala
-146.8
-151.8
-148.7
-149.2
-147.3
Arg
-177.4
-182.1
-180.8
-182.1
-177.4
Asn
-236.7
-242.3
-242.6
-238.7
-240.6
Asp
-298.6
-301.7
-301.7
-301.7
-296.3
Cys
-177.8
-181.1
-179.5
-181.6
-177.1
Gln
-229.5
-241.6
-232.6
-238.7
-230.9
Glu
-289.1
-294.6
-291.6
-297.6
-290.2
Gly
-167
-167.1
-167.1
-167
-163.2
His
-174
-182.3
-178.9
-180.4
-173.8
Ile
-141.8
-147.2
-144
-143.8
-141.9
Leu
-141
-147.1
-143.2
-143.3
-141.9
Lys
-161.5
-168.6
-166.2
-163.4
-163.1
Met
-178
-183.9
-180.5
-180.2
-179.2
Phe
-97
-103.3
-103.3
-97.6
-98.7
Pro
-170.4
-167.5
-170.5
-170.5
-167.5
Ser
-243.9
-247.7
-247.2
-245.3
-242.3
Thr
-231.6
-238.2
-236.7
-237
-232.8
Trp
-116.3
-124.9
-120.7
-117.6
-116
Tyr
-179.7
-187
-183.3
-180.2
-181.6
Val
-146.8
-152.8
-148.7
-149.2
-147.3
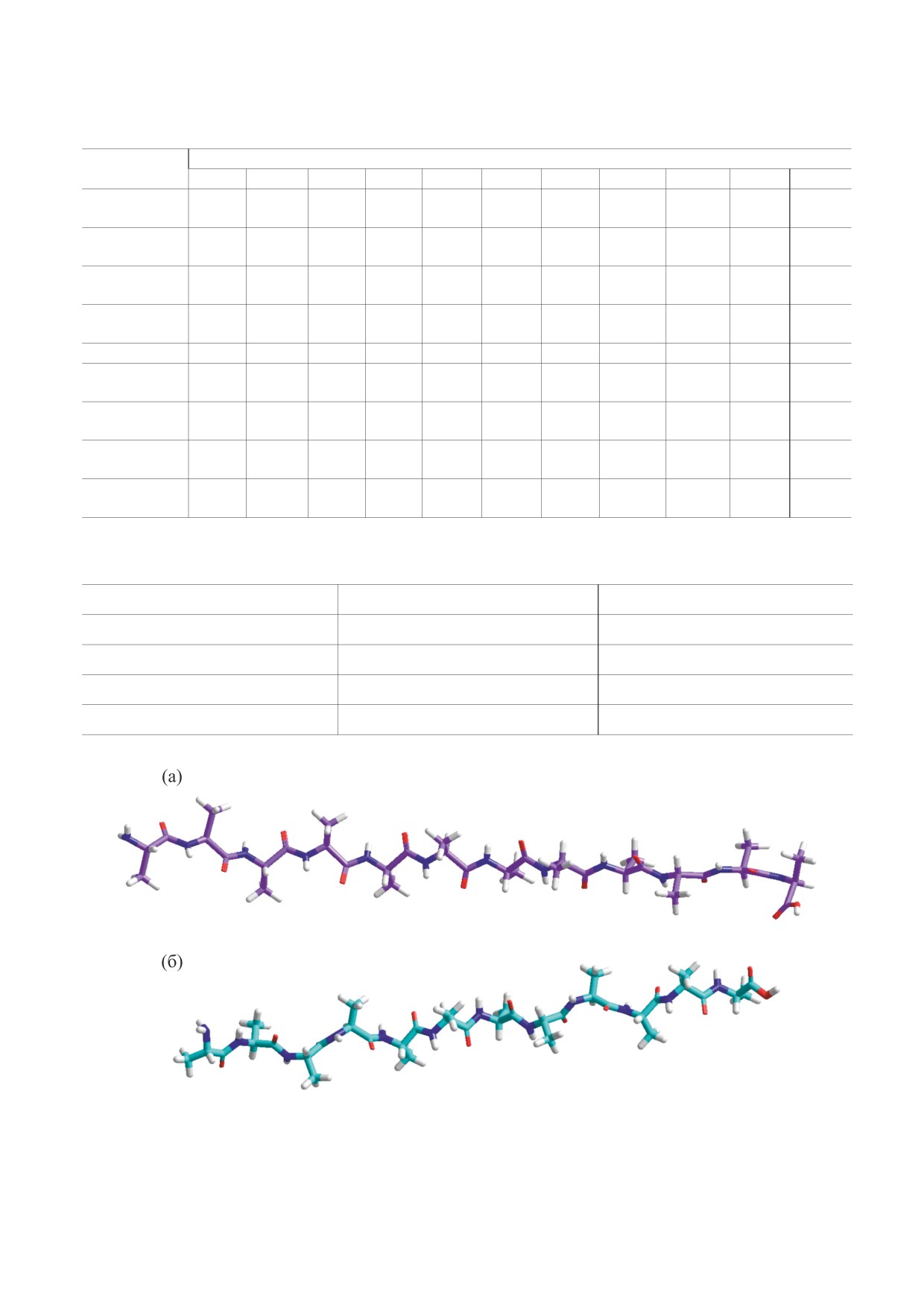
Рис. 3. (а) - РМ7-рассчитанная α-спираль из двенадцати остатков кремниевого L-аланина; (б) - РМ7-рассчитанная α-спи-
раль из двенадцати остатков углеродного L-аланина.
БИОФИЗИКА том 67
№ 2
2022
КРЕМНИЕВЫЕ АНАЛОГИ L-АМИНОКИСЛОТ
219
Таблица 5. Значения торсионных углов кремниевых и углеродных пептидов из двенадцати остатков аланина в
конформациях α-спирали и β-цепи (параметризация РМ7)
Величины торсионных углов в градусах
ψ1
ϕ2
ψ2
ϕ3
ψ3
ϕ4
ψ4
ϕ5
ψ5
ϕ6
ψ6
Углеродная
-76
-49
-33
-64
-40
-59
-46
-50
-48
-55
-46
альфа-спираль
Кремниевая
33
-130
144
-105
150
-111
154
-103
150
-119
153
бета-цепь
Кремниевая
-4
-12
-63
-2
-58
-12
-53
-9
-51
-10
-66
альфа-спираль
Кремниевая
167
-169
175
-145
163
-158
172
-147
166
-154
170
бета-цепь
ϕ7
ψ7
ϕ8
ψ8
ϕ9
ψ9
ϕ10
ψ10
ϕ11
ψ11
ϕ12
Углеродная
-55
-44
-58
-42
-58
-42
-79
-17
-82
-23
-76
альфа-спираль
Кремниевая
-105
152
-108
152
-107
152
-107
150
-104
150
-112
бета-цепь
Кремниевая
-47
-50
-63
-49
-53
-40
-92
-12
-115
-14
-27
альфа-спираль
Кремниевая
-149
167
-150
169
-150
169
-147
168
-153
169
61
бета-цепь
Таблица 6. Значения теплот образования и дипольных моментов кремниевых и углеродных пептидов в
конформациях α-спирали и β-цепи (параметризация РМ7)
ΔHof, ккал/моль
Дипольный момент, дебаи
Углеродная α-спираль
-716.3
45.2
Углеродная β-цепь
-654.4
9.1
Кремниевая α-спираль
-1094.3
43.5
Кремниевая β-цепь
-1043
30.2
Рис. 4. (а) - РМ7-рассчитанная одиночная β-цепь из двенадцати кремниевых остатков Ala; (б) - РМ7-рассчитанная оди-
ночная β-цепь из двенадцати углеродных остатков Ala.
БИОФИЗИКА том 67
№ 2
2022
220
КОНДРАТЬЕВ и др.
При рассмотрении значений двугранных углов
2. В кремниевом аналоге Asp (как и в углерод-
было выявлено следующее: в случае с α-спираля-
ном аспартате) возможно образование внутримо-
ми углеродные пептиды показали значения тор-
лекулярной водородной связи. При этом ее длина
сионных углов ϕ и ψ, соответствующие миниму-
составляет 2.1 Å (против 1.7 Å - в углеродном ас-
мам потенциальной энергии для Ala-остатков,
партате) - это позволяет предположить, что энер-
разброс величин углов составил от -50° до -80°
гия такой связи будет ниже энергии стандартной
по ϕ и от -17° до -76° по ψ. Для кремниевой a-
водородной связи. Аналогичная картина наблю-
спирали значения двугранных углов значительно
дается и с остатком глутаминовой кислоты.
отличались. Прежде всего, величины ϕ и ψ харак-
3. На основе значений энтальпий образования
теризовались более высокой вариабельностью: от
кремниевые аналоги аминокислот можно разбить
-5° до -115° по ϕ, и от -2° до -65° по ψ.
на следующие группы: алифатические, аромати-
При рассмотрении одиночных β-цепей были
ческие и гетероциклические, содержащие спир-
получены следующие значения двугранных уг-
товую группу, серосодержащие, кислые, основ-
лов: для углеродного пептида - от +144° до +150°
ные. Наименьшей термодинамической стабиль-
по ψ и от -105° до -130° по ϕ, угол ψ первого
ностью характеризуются ароматические и
остатка имел значение в +33°; для кремниевого
гетероциклические аналоги аминокислот.
пептида - от +163° до +170° по ψ и от -145° до
4. В большинстве случаев кремниевые аналоги
-169° по ϕ, угол ϕ последнего остатка имел значе-
аминокислот обладают более высокими значени-
ние в +60°. Как видно, вариабельность значений
ями дипольных моментов, чем углеродные.
углов углеродного и кремниевого пептидов при-
5. В случае с кремниевыми монопептидами
близительно одинакова.
глобальному минимуму энтальпии образования
Приведенные выше данные показывают, что
соответствуют Н- и М-конформации.
для кремниевых пептидов характерны именно те
6. Геометрия кремниевых пептидов из двена-
значения ϕ и ψ, которые для углеродных пептидов
дцати остатков аланина описывается такими зна-
описывают редкие либо вовсе запрещенные кон-
чениями двугранных углов ϕ и ψ, которые в слу-
формации. По нашим предположениям, это мо-
чае с углеродными пептидами характеризуют ред-
жет быть объяснено тем, что длины связей O- и
кие или запрещенные конформации.
N-атомов, связанных с кремнием, выше, чем
7. Как в углеродных, так и в кремниевых пеп-
длины связей тех же атомов, связанных с угле-
тидах из двенадцати остатков аланина глобаль-
родом. В данном случае бóльшая длина связи
ный минимум теплоты образования соответству-
обеспечивает и бóльшее расстояние между кова-
ет конформации α-спирали.
лентно несвязанными атомами. Вследствие этого
дисперсионные и электростатические взаимо-
действия могут способствовать притяжению этих
КОНФЛИКТ ИНТЕРЕСОВ
атомов (ковалентно несвязанных) и давать значе-
ния углов ϕ и ψ, не характерные для углеродных
Авторы заявляют об отсутствии конфликта
пептидов.
интересов.
Из данных, представленных в табл. 6, можно
сделать заключение, что конформация α-спира-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ли термодинамически более выгодна как для уг-
Настоящая работа не содержит описания ис-
леродного, так и для кремниевого пептидов. В
следований с использованием людей и животных
обоих случаях α-спираль обладает более высоким
в качестве объектов.
значением дипольного момента. Большой инте-
рес для будущих исследований будет представ-
лять моделирование ИК-спектров изучаемых со-
СПИСОК ЛИТЕРАТУРЫ
единений.
1. L. Gmelin, Gmelin handbook of inorganic and or-
ganometallic chemistry. Silicon: Suppl. Volume
ЗАКЛЮЧЕНИЕ
(Springer-Verlag, 1991).
Проведенный геометрический и термодина-
2. A. F. Davila and Ch. P. McKay, Astrobiology 14 (6),
мический анализ свойств кремниевых аминокис-
534 (2014).
лот, монопептидов и пептидов и сравнение полу-
3. M. S. Kondratyev, A. V. Kabanov, A. A. Samchenko,
ченных результатов с уже известными данными
et al., J. Biomol. Structure & Dynamics 31, 10 (2013).
по их углеродным аналогам позволили сделать
следующие выводы.
4. S. Pawlenko, Organosilicon Chemistry (Walter de
Gruyter, NY, 1986).
1. Длины связей в кремниевых аналогах ами-
нокислот значительно, до полутора раз, превос-
5. M. Mortensen, R. Husmann, E. Veri, and C. Bolm,
ходят длины связей в углеродных аминокислотах.
Chem. Soc. Rev. 38, 1002 (2009).
БИОФИЗИКА том 67
№ 2
2022
КРЕМНИЕВЫЕ АНАЛОГИ L-АМИНОКИСЛОТ
221
6. E. Remond, C. Martin, J. Martinez, and F. Cavelier,
18. J. J. P. Stewart, Stewart Computational Chemistry (Col-
Chem. Rev. 116, 11654 (2016).
orado Springs, CO, USA, 2016).
7. K. Abersfelder, A. J. P. White, H. S. Rzepa, and
19. J. J. P. Stewart, J. Mol. Model. 23 (5), 154 (2017).
D. Scheschkewitz, Science 327, 564 (2009).
20. H. L. Sellers and L. Schafer, J. Am. Chem. Soc. 78,
7728 (1978).
8. A. Roy, S. Nair, N. Sen, et al., Methods 131, 33 (2017).
21. М. С. Кондратьев, А. В. Кабанов и В. М. Комаров,
9. L. M. Yang, X. P. Li, Y. H. Ding, and C. C. Sun, J.
Компьютерные исследования и моделирование 2
Mol. Model. 15 (1), 97 (2009).
(1), 83 (2010).
10. I. S. Ignatyev, M. Montejo, and J. J. López-González,
22. J. Cox and G. Pilcher, Thermochemistry of Organic and
J. Mol. Model. 19 (12), 5439 (2013).
Organometallic Compounds (Acad. Press, NY, 1980).
11. R. Chu, X. Zhang, L. Meng, and Y. Zeng, J. Mol.
23. S. Ngauv, R. Sabbah, and M. Laffitte, Thermochim.
Model. 23 (12), 335 (2017).
Acta 20, 371 (1977).
12. E. L. Terpugov, M. S. Kondratyev, and O. V. Deg-
24. R. Sabbah and M. Laffitte, Bull. Soc. Chim. 1, 50
tyareva, J. Biomol. Structure & Dynamics 39 (1), 108
(1978).
(2021).
25. R. Sabbah and M. Laffitte, J. Chem. Thermodyn. 10,
101 (1978).
13. Е. Л. Терпугов, С. Н. Удальцов и О. В. Дегтярева,
Биофизика 66 (5), 856 (2021).
26. R. Sabbah and C. Minadakis, Thermochim. Acta 43,
269 (1981).
14. К. А. Щербаков, М. С. Кондратьев, А. А. Самчен-
ко и др., Биофизика 61 (3), 432 (2016).
15. J. J. P. Stewart, J. Mol. Model. 10 (2), 155 (2004).
28. Е. М. Попов, Проблема белка, Т. 3: Структурная
организация белка, под ред. В.Т. Иванова (Наука,
16. J. J. P. Stewart, J. Mol. Model. 19, 1 (2013).
М., 1997).
17. J. J. P. Stewart, Quant. Chem. Prog. Exch. 10, 86
29. М. С. Кондратьев, А. В. Кабанов и В. М. Комаров,
(1990).
Биофизика 52 (3), 401 (2007).
Silicon Analogs of L-Amino Acids: Properties of “Building Blocks”
of an Alien Biosphere
M.S. Kondratiev*, K.A. Shcherbakov**, A.A. Samchenko*, O.V. Degtyareva*, E.L. Terpugov*,
N.N. Khechinashvili*, and V.M. Komarov*
*Institute of Cell Biophysics, Russian Academy of Sciences, Pushchino, Moscow Region, Institutskaya ul. 3, 142290 Russia
**Orekhovich Research Institute of Biomedical Chemistry, Pogodinskaya ul. 10/8, Moscow, 119121 Russia
For the first time, semi-empirical quantum-chemical methods PM3/PM7 were used to calculate and analyze
geometric configuration of singularities for molecules of silicon analogues of 20 proteinogenic L-amino acids
given with respect to carbon amino acids. Conformational parameters as well as the values of the enthalpies
of formation and dipole moments of the studied compounds were calculated. It is shown that the bond lengths
in silicon analogues of amino acids significantly exceed the bond lengths in carbon amino acids. The forma-
tion of intramolecular hydrogen bond is possible in silicon analogue of aspartate (the same can be observed
in silicon analogue of carbon aspartate). The thermodynamic stability of aromatic and heterocyclic analogues
of amino acids is the lowest. “Aromatic analogue” may play a role in silicon compounds different from that
in carbon compounds: it is due to longer interatomic distances and weaker π-conjugation. The model of the
polyalanine chain was used to show that the global minimum for a given molecule corresponds to the confor-
mation of the α-helix both in carbon and silicon peptide.
Keywords: silicon, silicon compounds, amino acids, conformers, enthalpy of formation, quantum chemical calcu-
lation, alternative biochemistry
БИОФИЗИКА том 67
№ 2
2022