БИОФИЗИКА, 2022, том 67, № 2, с. 229-233
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.2.01:(57.052.2+577.322.23+577.322.54)
НОВАЯ ИНТЕРПРЕТАЦИЯ КОЭФФИЦИЕНТА ХИЛЛА
© 2022 г. И.А. Лавриненко*, Г.А. Вашанов*, Ю.Д. Нечипуренко**
*Воронежский государственный университет, 394018, Воронеж, Университетская пл., 1
**Институт молекулярной биологии им. В.А. Энгельгардта РАН, 119991, Москва, ул. Вавилова, 32
E-mail: lavrinenko_ia@bio.vsu.ru
Поступила в редакцию 27.12.2021 г.
После доработки 04.02.2022 г.
Принята к публикации 07.02.2022 г.
Предложена модификация уравнения Хилла, описывающего процесс кооперативного связывания
макромолекулой лиганда. Вводимый нами в это уравнение параметр «относительный коэффициент
кооперативности» позволяет обеспечить сопряжение коэффициента Хилла с числом взаимодей-
ствующих субъединиц в олигомере. Это позволяет прояснить физический смысл данного коэффи-
циента и объясняет природу его нецелочисленных значений. Нормирование относительного коэф-
фициента кооперативности даeт дополнительную возможность сопоставлять такие коэффициенты
для олигомеров с различным числом протомеров. Предлагаемый относительный коэффициент ко-
оперативности может быть полезным при решении широкого круга задач, связанных с описанием
согласованного взаимодействия элементов на всех уровнях пространственной организации белков,
нуклеиновых кислот, их комплексов, а также такого взаимодействия для рецепторов и их медиа-
торов.
Ключевые слова: кооперативное связывание лигандов, изотерма адсорбции, кривая диссоциации оксиге-
моглобина, уравнение Хилла, коэффициент Хилла, относительный коэффициент кооперативности
DOI: 10.31857/S000630292202003X
Обратимое связывание кислорода гемоглоби-
Однако высокие значения коэффициентов до-
ном является необходимым условием функцио-
стоверности аппроксимации (r2) не являются са-
нирования кислородтранспортной системы кро-
модостаточными и определяющими при подборе
ви [1, 2]. Зависимость степени оксигенации гем-
моделей оксигенации. Это объясняется тем, что
белка от парциального давления этого газа гра-
высокие значения r2 также можно достичь и по-
фически представляется в виде кривой диссоциа-
средством интерполирующих полиномов высших
ции оксигемоглобина [3, 4]. Построенные по
порядков, например Лагранжа, Ньютона, Фурье,
ограниченному дискретному набору экспери-
Чебышёва и др., которые в данном случае не име-
ментальных данных кривые диссоциации оксиге-
ют физического смысла [17-19].
моглобина могут быть в дальнейшем аппрокси-
Поэтому, несмотря на приближенное описа-
мированы рядом математических функций [5].
ние кислородсвязывающих свойств гемоглобина,
Это необходимо, прежде всего, для нахождения
уравнение Хилла не утратило своей актуальности
величин полунасыщения гемоглобина кислоро-
в силу минимума необходимых априорных зна-
дом (p50) [6, 7], зарядного напряжения (p95) [8], а
ний процесса оксигенации [20] (оно широко при-
также значений параметров, характеризующих
меняется и для описания других кооперативных
уровень оксигенации в артериальной (SaO2) [9,
процессов). Главным параметром в уравнении
10] или венозной (SvO2) крови [11, 12].
Хилла является одноименный коэффициент (h), с
Разработанные к настоящему времени мате-
помощью которого можно охарактеризовать сте-
матические модели оксигенации позволяют свя-
пень кооперативности процесса оксигенации.
зывать коэффициенты уравнений с некоторыми
Однако несоответствие числа взаимодействую-
параметрами кислородсвязывающих свойств
щих субъединиц тетрамера (n) нецелочисленному
гембелка [13-15]. Для наиболее известных моде-
значению h затрудняет понимание физического
лей связывания кислорода гемоглобином, по-
смысла этого коэффициента [21-23].
строенных на степенных и экспоненциальных за-
В настоящей работе предпринята попытка
висимостях, нами ранее была проведена оценка
снять это кажущееся противоречие путем введе-
аппроксимирующей способности [16].
ния в уравнение сопрягающего коэффициента,
229
230
ЛАВРИНЕНКО и др.
проясняющего физический смысл этого уравне-
Можно представить пул молекул гемоглобина
ния. Заметим, что переосмысление интерпрета-
в виде набора димерных и тетрамерных форм с
ции коэффициента Хилла может оказаться важ-
различной весовой долей, аналогично ассоциа-
ным при описании взаимодействия «лиганд-ре-
там гембелка. Однако в эритроцитах данный бе-
цептор»
[24], а также других кооперативных
лок находится главным образом в виде тетрамера
систем.
(99.3-99.4%), что следует из расчетов по данным
референтных значений концентрации гемогло-
бина в клетке (4300-5500 мкмоль/л) [29] и кон-
МЕТОДЫ ИССЛЕДОВАНИЙ
станты диссоциации (K4,2 = 0.2 мкмоль/л) при
В качестве объекта исследования была исполь-
нормальном атмосферном давлении, pH и темпе-
зована модель Хилла и набор экспериментальных
ратуре 7.0 и 37°C соответственно [30]. Из этого
данных, полученных в работе [25]. Оптимизация
следует, что коэффициент Хилла, равный 2.52 (и
параметров модели проведена методом наимень-
вычисленный нами по известным данным [25])
ших квадратов [26]. Необходимые вычисления
должен соответствовать доле тетраметров 25.9%.
выполнены с помощью пакета программ MS
Это возможно при концентрации белка
Excel.
0.1 мкмоль/л и явно противоречит приведенным
выше значениям.
Тем не менее уравнение Хилла получило ши-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
рокое распространение, так как наряду с просто-
Предложенное Г. Гюфнером в 1890 г. уравне-
той вычисления и хорошей аппроксимирующей
ние оксигенации, выведенное из закона действу-
способностью [31] позволяет непосредственно
ющих масс, не могло описать S-образность кри-
находить величину p50, а одноименный коэффи-
вой диссоциации оксигемоглобина [27]. Поэтому
циент этого уравнения (в аналогичных публика-
А. Хилл в 1910 г. предложил рассматривать про-
циях обозначаемый как nH [32, 33], h [34, 35] или
цесс оксигенации как взаимодействие лиганда с
некоторыми другими символами и их сочетания-
макромолекулярным ассоциатом белка, т.е. как
ми [36, 37]) дает некоторую оценку кооператив-
химическую реакцию n-го порядка [13]:
ности составляющих его субъединиц.
(Hb)
+
nO
⇌
(HbO
)
,
(1)
n
2
2
n
Для того чтобы снять противоречие между
n
способностью уравнения Хилла при минимуме
p
y
=
,
(2)
параметров хорошо аппроксимировать экспери-
n
n
p
50
+
p
ментальные данные и несоответствием показате-
ля степени этого уравнения целочисленному зна-
где Hb - дезоксигемоглобин, O2 - кислород,
чению [38], мы предлагаем представить коэффи-
HbO2 - оксигемоглобин, y - степень насыщения
циент Хилла h, как произведение числа
гемоглобина кислородом, p - парциальное давле-
взаимодействующих структурных элементов n (в
ние кислорода, p50 - давление кислорода при
частности, субъединиц гембелка) на коэффици-
y = 0.5 (50% насыщение лигандом) и n - степень
ент пропорциональности a, отождествляемый со
агрегации гемоглобина (порядок реакции по ли-
степенью кооперативного взаимодействия этих
ганду, совпадающий со стехиометрическим ко-
элементов:
эффициентом этой реакции при выполнении за-
an
кона действующих масс).
p
y
=
(3)
Так как при анализе данных показатель степе-
an
an
p
50
+
p
ни n обычно принимал нецелочисленные значе-
ния, то физический смысл данного уравнения
Однако при отсутствии кооперативности, ко-
оказался неясным. Чтобы объяснить нецелочис-
торая характеризуется коэффициентом Хилла h
ленные значения своего параметра, Хилл предло-
равным единице, коэффициент пропорциональ-
жил рассматривать n как некоторое усреднение
ности a будет принимать различные значения, за-
по множеству молекулярных ассоциатов гембел-
висящие от числа субъединиц n, что затрудняет
ка с различной степенью их агрегации [13, 28].
интерпретацию последнего.
Однако в 1925 г. Г. Эдером было показано, что
Мы предлагаем произведение an в уравнении
молекула гемоглобина представляет собой тетра-
Хилла привести к следующему виду:
мер [14]. Хотя это не противоречило представле-
h = an = θ(n)(n - 1) + 1,
(4)
ниям о существовании молекулярных ассоциа-
тов, но и не объясняло, почему коэффициент это-
где θ(n) - вводимый нами «относительный коэф-
го уравнения приобретает значения меньше
фициент кооперативности» белка, состоящего из
четырех единиц. Такое несоответствие снова
n субъединиц. Тогда θ(n) = 0 указывает на отсут-
привело к противоречиям в физической трактов-
ствие кооперативности, и коэффициент Хилла
ке модели Хилла [21-23].
будет равен единице при любых n.
БИОФИЗИКА том 67
№ 2
2022
НОВАЯ ИНТЕРПРЕТАЦИЯ КОЭФФИЦИЕНТА ХИЛЛА
231
r2 = 99.94%, что демонстрирует приведенную мо-
дель статистически значимой.
При помощи этого уравнения по приведен-
ным данным для тетрамера гемоглобина мы вы-
числили значения величин p50 и θ(4), которые со-
ставили 28.8 мм рт. ст. и 0.507 соответственно. Та-
ким образом, этот коэффициент может быть
использован для описания степени взаимодей-
ствия между субъединицами в составе олигомера.
Он показывает, насколько «необходимо» взаимо-
действовать протомерам для текущего «выполне-
ния» макромолекулой своей функциональной за-
дачи, исходя из максимальной возможности,
определяемой числом ее субъединиц.
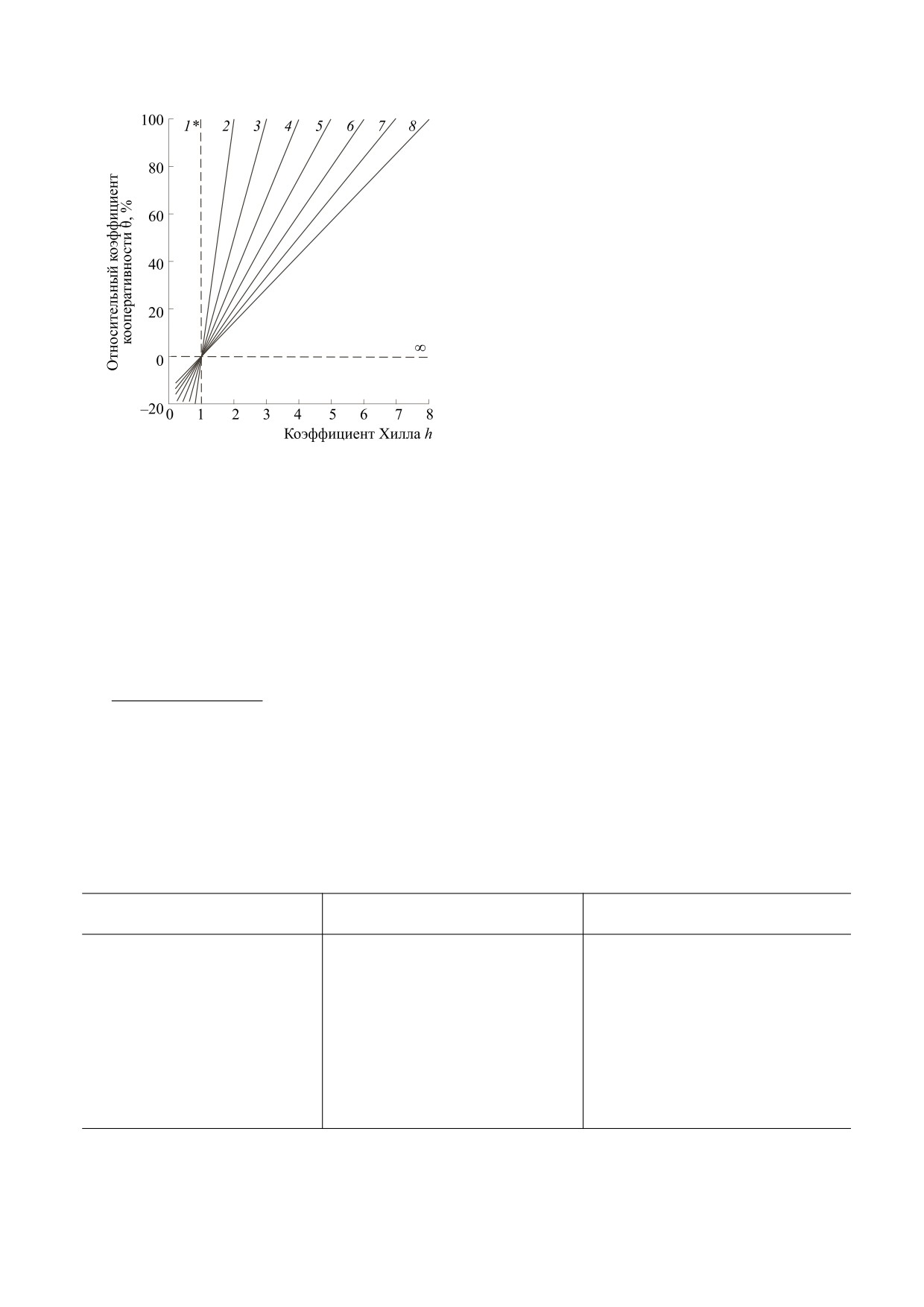
Важным применением θ(n), на наш взгляд,
также может быть сопоставление степени коопе-
ративности, например, для димерных и тетрамер-
ных форм гемоглобина, учитывающее количе-
Зависимость относительного коэффициента коопе-
ство взаимодействующих субъединиц. Если дис-
ративности от коэффициента Хилла для макромоле-
социация тетрамера гембелка на его димеры
кулы, состоящей из n субъединиц. Для молекулы ге-
приведет к ожидаемому уменьшению коэффици-
моглобина актуальными являются значения n = 2 и 4.
ента Хилла, то по нормированному значению θ(n)
Обозначения: номера линейных моделей соответ-
степень кооперативности может остаться преж-
ствуют количеству субъединиц в составе макромоле-
ней. В общем виде нормированное значение θ(n)
кулы. Примечание: для n = 1 - значение θ(n) не опре-
можно получить путем приведения к димерной,
делено, для n → ∞ и при h = const получаем θ(n) → 0.
тетрамерной или любой другой форме белка ис-
ходя из зависимостей, представленных на рисун-
В конечном варианте в нашей записи уравне-
ке. Также следует отметить граничные условия.
ние Хилла (при p > 0) будет выглядеть следующим
Для молекулы, состоящей из одной субъединицы
образом:
(n = 1), значение θ(n) не определено (пунктирная
линия 1*), так как в этом случае кооперативность
θ(n)
n−1
+1
−1
θ(n)(n−1)+1
(
)
отсутствует как физическое явление. Для θ(n) = 0
⎛
⎞
p
⎛
p
50
⎞
y
=
=
⎜1
+
⎟
(5)
коэффициент Хилла всегда будет равен единице
θ(n)(n−1)+1
θ(n)(n−1)+1
⎜
⎜
⎟
⎟
p
+
p
⎝
p
⎠
50
⎝
⎠
при любых n > 1 (см. рисунок).
Для проверки адекватности данной математи-
Для тех случаев, когда раствор гемоглобина яв-
ческой модели экспериментальным данным [25]
ляется смесью димерных и тетрамерных форм
использовали критерий Фишера. Результаты ана-
белка с усредненной величиной n, значение θ(n)
лиза однофакторной регрессии показали следую-
можно получить исходя из вычисленного значе-
щее: Fрасч (103905.36) >> Fтабл (3.99, α = 0.05), при
ния n приведенного диапазона (таблица).
Доля тетрамерных форм оксигемоглобина (χ) и среднее арифметическое число субъединиц (n
_) в составе
макромолекулы в зависимости от концентрации белка (C)
_
C, моль/л
χ, %
n
10-9
0.50
2.010
10-8
4.55
2.091
10-7
26.79
2.536
10-6
64.17
3.283
10-5
86.82
3.736
10-4
95.63
3.913
10-3
98.60
3.972
10-2
99.55
3.991
Примечание. Значения приведены для температуры 37°C, pH 7.0 и нормального атмосферного давления.
БИОФИЗИКА том 67
№ 2
2022
232
ЛАВРИНЕНКО и др.
Еще одним важным применением вводимой
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
нами в рассмотрение величины θ(n) может быть
Настоящая статья не содержит каких-либо ис-
анализ степени кооперативных взаимодействий
следований с участием людей или животных в ка-
гибридов валентности, в частности, гетеротетра-
честве объектов исследований.
меров гемоглобина, как комбинации α-, β- и дру-
гих типов субъединиц с различной степенью
СПИСОК ЛИТЕРАТУРЫ
окисления гемового железа (2+/3+).
1.
R. F. Schmidt and G. Thews, Human Physiology
(Springer-Verlag, Berlin - Heidelberg - New York,
ЗАКЛЮЧЕНИЕ
2013).
2.
W. F. Boron and E. L. Boulpaep, Medical Physiology
Предложена модификация уравнения Хилла,
(Elsevier Health Sciences, Philadelphia, 2017).
описывающего процесс кооперативного связыва-
3.
R. N. Sladen, Int. Anesthesiol. Clin. 19 (3), 39 (1981).
ния лиганда макромолекулой на примере оксиге-
DOI: 10.1097/00004311-198119030-00006
нации гемоглобина. Мы ввели в рассмотрение
параметр θ(n) - относительный коэффициент ко-
4.
E. Antonini, Crit. Care Med. 7 (360), 367 (1979).
оперативности, который позволяет обеспечить
5.
S. M. Gadrey, C. E. Lau, R. Clay, et al., Physiol.
сопряжение вычисляемого коэффициента Хилла
Meas. 40 (11), 115008 (2019). DOI: 10.1088/1361-
с числом взаимодействующих субъединиц в оли-
6579/ab5154
гомере n и устраняет проблему физического
6.
Z. Chu, Y. Wang, G. You, et al., Artif. Cells Nanomed.
смысла этого коэффициента - объясняет приро-
Biotechnol.
48
(1),
867
(2020).
DOI:
ду его нецелочисленных значений. Нормировка
относительного коэффициента кооперативности
10.1080/21691401.2020.1770272
дает дополнительную возможность сопоставлять
7.
R. M. Winslow, Artif. Cells Blood Substit. Immobil.
эти коэффициенты для олигомеров с разными
Biotechnol.
33
(1),
1
(2005). DOI: 10.1081/bio-
значениями n.
200046634
Таким образом, θ(n) может быть полезным при
8.
N. Willis, M. C. Clapham, and W. W. Mapleson, Br. J.
решении широкого круга задач, связанных с ко-
Anaesth
59
(9),
1160
(1987). DOI:
10.1093/
оперативными взаимодействиями [39-41]. Раз-
bja/59.9.1160
витый нами подход может быть применен для
9.
J.-A. Collins, A. Rudenski, J. Gibson, et al., Breathe
описания изотерм адсорбции (кривых связыва-
11 (3), 194 (2015). DOI: 10.1183/20734735.001415
ния) лигандов разного рода с макромолекулами
10.
M. A. Danish, Cureus 13 (2), e13240 (2021). DOI:
[42-45], в частности, взаимодействия рецепторов
10.7759/cureus.13240
и их медиаторов [46, 47].
11.
J. Melius, Am. J. Crit. Care 3 (5), 353 (1994).
12.
J.-L. Teboul, O. Hamzaoui, and X. Monnet, Crit.
БЛАГОДАРНОСТИ
Care 15 (6), 1005 (2011). DOI: 10.1186/cc10491
13.
A. V. Hill, J. Physiol. 40, i (1910).
Авторы считают своим приятным долгом вы-
14.
G. S. Adair, A. V. Bock, and H. Field Jr., J. Biol.
разить благодарность А. Бучельникову и А. Засе-
Chem. 63, 529 (1925).
дателеву за плодотворные дискуссии и полезные
замечания, а также рецензентам за критический
15.
S. R. Bernard, Bull. Math. Biophys. 22, 391 (1960).
анализ рукописи и ценные замечания.
DOI: 10.1007/BF02476722
16.
И. А. Лавриненко, Г. А. Вашанов, В. Ю. Сулин
и др., Биофизика
66
(6)
1065
(2021). DOI:
ФИНАНСИРОВАНИЕ РАБОТЫ
10.31857/S000630292106003X
17.
H. Bateman and A. Erdelyi, Higher Transcendental
Работа выполнена при частичной финансовой
Functions (McGraw-Hill, New York, 1953), Vol. 2.
поддержке Программы фундаментальных науч-
ных исследований в Российской Федерации на
18.
J. P. Boyd, Chebyshev and Fourier spectral methods
долгосрочный период (2021-2030 годы) (тема
(Dover Publications, New York, 2001).
121052600299-1).
19.
E. Meijering, Proc. IEEE 90 (3), 319 (2002). DOI:
10.1109/5.993400
20.
S. A. Frank, Biol. Direct 8 (1), 1 (2013). DOI:
КОНФЛИКТ ИНТЕРЕСОВ
10.1186/1745-6150-8-31
Авторы заявляют об отсутствии конфликта
21.
M. L. Coval, J. Biol. Chem. 245 (23), 6335 (1970).
интересов.
DOI: 10.1016/S0021-9258(18)62614-6
БИОФИЗИКА том 67
№ 2
2022
НОВАЯ ИНТЕРПРЕТАЦИЯ КОЭФФИЦИЕНТА ХИЛЛА
233
22.
J.-H. S. Hofmeyr and H. Cornish-Bowden, Bioinfor-
35.
C. F. S. Bonafe, D. F. L. Neto, E. A. Martínez, et al.,
matics 13 (4), 377 (1997). DOI: 10.1093/bioinformat-
Chem. Papers
74
(9),
2861
(2020). DOI:
ics/13.4.377
10.1007/s11696-020-01125-1
36.
S. Srinivasan, F. H. Waghu, S. Idicula-Thomas, et al.,
23.
S. Goutelle, M. Maurin, F. Rougier, et al., Fund. Clin.
Biochim. Biophys. Acta - Biomembranes 1862 (4),
Pharmacol. 22 (6), 633 (2008). DOI: 10.1111/j.1472-
183242 (2020). DOI: 10.1016/j.bbamem. 2020.183242
8206.2008.00633.x
37.
A. Horovitz and T. Mondal, J. Phys. Chem. B 125 (1),
24.
J. N. Weiss, FASEB J. 11 (11), 835 (1997).
70 (2021). DOI: 10.1021/acs.jpcb.0c09351
25.
R. M. Winslow, M. Swenberg, R. L. Berger, et al., J.
38.
M. Żebrowska, M. Weippert, and M. Petelczyc, Front.
Biol Chem 252, 2331 (1977). DOI: 10.1016/S0021-
Physiol.
12
(945),
(2021).
DOI:
10.3389/
9258(17)40559-X
fphys.2021.695569
26.
F. M. Dekking, C. Kraaikamp, H. P. Lopuhaä, et al.,
39.
L. Acerenza and E. Mizraji, Biochim. Biophys. Acta
A Modern Introduction to Probability and Statistics: Un-
1339
(1),
155
(1997). DOI:
10.1016/s0167-
derstanding Why and How (Springer-Verlag, London,
4838(96)00228-2
2005). DOI: 10.1007/1-84628-168-7
40.
A. Horovitz, Proc. Roy. Soc. Lond. B: Biol. Sci. 229
(1256), 315 (1986). DOI: 10.1098/rspb.1986.0088
27.
G. Hüfner, Arch. Physiol. 31, 28 (1890).
41.
T. R. Chay and C. Ho, Proc/ Natl/ Acad/ Sci/ USA 70
28.
J. T. Edsall, J. Hist. Biol. 5 (2), 205 (1972). DOI:
(12), 3914 (1973). DOI: 10.1073/pnas.70.12.3914
10.1007/BF00346659
42.
I. M. Klotz, J. Biol. Chem. 279 (1), 1 (2004). DOI:
29.
A. H. B. Wu, Tietz clinical guide to laboratory tests (El-
10.1074/jbc.X300006200
sevier Science, St. Louis, MO, 2006).
43.
H. A. Saroff, Biochemistry 30 (42), 10085 (1991).
30.
N. Griffon, V. Baudin, W. Dieryck, et al., Protein Sci
DOI: 10.1021/bi00106a004
7 (3), 673 (1998). DOI: 10.1002/pro.5560070316
44.
Ю. Д. Нечипуренко, Анализ связывания биологиче-
ски активных соединений с нуклеиновыми кислота-
31.
N. Kaihnsa, Y. Ren, M. Safey El Din, et al., J. Math.
ми (Ин-т комп. исслед. (ИКИ), М. - Ижевск,
Biol. 81 (4-5), 1169 (2020). DOI: 10.1007/s00285-
2015).
020-01540-8
45.
D. Leipply and D. E. Draper, Biochemistry 49 (9),
32.
H. Abeliovich, Biophys. J. 89 (1), 76 (2005). DOI:
1843 (2010). DOI: 10.1021/bi902036j
10.1529/biophysj.105.060194
46.
A. F. Kolodziej, T. Tan, and D. E. Koshland, Jr., Bio-
33.
O. Rapp and O. Yifrach, PLoS One 12 (8), e0182871
chemistry
35
(47),
14782
(1996). DOI: 10.1021/
(2017). DOI: 10.1371/journal.pone.0182871
bi961481v
34.
H. Dahl, S. Taudorf, D. M. Bailey, et al., Exp. Physiol.
47.
A. Whitty, Nat. Chem. Biol. 4 (8), 435 (2008). DOI:
105 (7), 1063 (2020). DOI: 10.1113/EP088615
10.1038/nchembio0808-435
New Interpretation of the Hill Coefficient
I.A. Lavrinenko*, G.A. Vashanov*, and Yu.D. Nechipurenko**
*Voronezh State University, Universitetskaya pl. 1, Voronezh, 394018 Russia
**Engelhardt Institute of Molecular Biology, Russian Academy of Sciences, ul. Vavilova str. 32, Moscow, 119991 Russia
A modification of Hill's equation describing the process of cooperative binding of a ligand by a macromole-
cule is proposed. The parameter “relative coefficient of cooperativity” introduced by us into this equation al-
lows us to ensure the conjugation of the Hill coefficient with the number of interacting subunits in the oligo-
mer. This makes it possible to clarify the physical meaning of this coefficient and explains the nature of its
non-integer values. Normalization of the relative coefficient of cooperativity gives an additional opportunity
to compare such coefficients for oligomers with different numbers of protomers. The proposed relative coef-
ficient of cooperativity can be useful in solving a wide range of problems related to the description of the co-
ordinated interaction of elements at all levels of the spatial organization of proteins, nucleic acids, their com-
plexes, as well as such interaction for receptors and their mediators.
Keywords: cooperative binding of ligands, adsorption isotherm, dissociation curve of oxyhemoglobin, Hill’s equa-
tion, Hill’s coefficient, relative coefficient of cooperativity
БИОФИЗИКА том 67
№ 2
2022