БИОФИЗИКА, 2022, том 67, № 2, с. 250-263
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ВЗАИМОДЕЙСТВИЕ АНТИМИКРОБНОГО ПЕПТИДА
ЛАЗИОГЛОССИНА III С МОДЕЛЬНЫМИ ЛИПИДНЫМИ БИСЛОЯМИ
© 2022 г. С. Саха, П. Ратрей, А. Мишра
Факультет материаловедения и инженерии материалов, Индийский Технологический Институт Гандинагара,
Паладж, Гандинагар, Гуджарат, Индия
E-mail: s.sarmistha@iitgn.ac.in
Поступила в редакцию 14.09.2021 г.
После доработки 02.11.2021 г.
Принята к публикации 15.12.2021 г.
Лазиоглоссин-III - малый катионный пептид, обнаруженный в яде пчелы Lasioglossum laticeps. Со-
общается, что он обладает сильной антимикробной активностью и слабым гемолитическим дей-
ствием. В данной работе исследована природа взаимодействий лазиоглоссина-III с липидными
бислоями в различной ориентации и его проникающая способность с помощью расчетов методом
молекулярной динамики. Были проведены молекулярно-динамические расчеты лазиоглоссина-III
на поверхности и внутри бислоев из чистых 1,2-димиристоил-sn-глицеро-3-фосфатидилхолина и 1-
пальмитоил-2-олеил-sn-глицеро-3-фосфатидилхолина для определения взаимодействий «мембра-
на-пептид» и их эффектов. Обнаружено, что лазиоглоссин-III взаимодействовал с обоими типами
бислоев с разными скоростями и демонстрировал дестабилизацию на границе раздела фаз «мембра-
на-вода» относительно стартового состояния пептида. Эти результаты позволяют говорить о нали-
чии специфических взаимодействий между остатками лизина пептида и участками головок липи-
дов, ответственных за общую стабильность пептида в липидных бислоях. Кроме того, результаты
указывают на существенно больший угол наклона пептида и более высокую свободную энергию, а
также на уменьшение толщины бислоя в случае бислоев 1,2-димиристоил-sn-глицеро-3-фосфати-
дилхолина в сравнении с 1-пальмитоил-2-олеил-sn-глицеро-3-фосфатидилхолином, вызываемые
встраиванием пептида.
Ключевые слова: лазиоглоссин-III, ПОФХ, ДМФХ, молекулярная динамика.
DOI: 10.31857/S0006302922020077
ли, что такие взаимодействия включают поверх-
Антимикробные пептиды (АМП) представля-
ностное состояние и погруженное состояние [3,
ют собой важный класс элементов врожденной
4]. Например, некоторые АМП, такие, как CM15,
иммунной системы и перспективную альтернати-
могут взаимодействовать с полярной границей
ву антибиотикам по отношению к широкому
раздела фаз и разрушать пузырьки цвиттер-ион-
спектру видов бактерий. Это короткие катионные
ного липида 1-пальмитоил-2-олеил-sn-глицеро-
амфифильные пептиды, которые могут прояв-
3-фосфатидилхолина (ПОФХ), основного ком-
лять активность против необычайно широкого
понента эукариотической мембраны [5, 6]. С дру-
диапазона микроорганизмов с множественной
гой стороны, пандинин-2, поликатионный АМП,
устойчивостью, включая бактерии, вирусы и гри-
оставался в частично свернутом состоянии на по-
бы [1]. Эффект от АМП против различных пато-
верхности ПОФХ, а ароматические остатки на его
генных микроорганзимов коррелирует с их раз-
N-конце инициировали процесс встраивания [7].
личными функциями, относящимися к взаимо-
Взаимодействия АМП с мембранами зависят от
действию с клеточными мембранами [2]. Многие
их вторичной структуры, заряда, аминокислотно-
группы ученых работают над экспериментальны-
го состава и длины пептидной последовательно-
ми и модельными (вычислительными) исследо-
сти, а также от состава мембран [8]. В дополнение
ваниями механизма встраивания и ориентации
к этому, доля α-спиралей в АМП прямо коррели-
АМП в липидных бислоях мембран. Они показа-
рует с высокой антибактериальной активностью,
Сокращения: АМП - антимикробные пептиды, ПОФХ -
а гибкость пептидной цепи также играет ключе-
1-пальмитоил-2-олеил-sn-глицеро-3-фосфатидилхолин,
вую роль в ослаблении их активности [9].
LL-III - лазиоглоссин III, МД - молекулярно-динамиче-
ский, ДМФХ - 1,2-димиристоил-sn-глицеро-3-фосфати-
Лазиоглоссины - новое семейство антимик-
дилхолин.
робных пептидов - изначально были обнаруже-
250
ВЗАИМОДЕЙСТВИЕ АНТИМИКРОБНОГО ПЕПТИДА
251
ны в яде диких пчел Lasioglossum laticeps. Для них
Биофизические эксперименты с использованием
была показана выраженная антимикробная ак-
методов ядерно-магнитного резонанса и рентге-
тивность против как грамположительных, так и
новской дифрактометрии позволяют сделать вы-
грамотрицательных микроорганизмов, а также
вод о наличии двух состояний АМП - поверх-
существенно меньшая гемолитическая актив-
ностном состоянии и погруженном в липидный
ность [10]. С помощью флуориметрических экс-
бислой состоянии [17-19]. Весь процесс анти-
периментов было выявлено, что лазиоглоссин II
микробного действия пептидов включает связы-
может взаимодействовать с поверхностью мем-
вание с поверхностью, агрегацию или образова-
браны додецилфосфохолиновой мицеллы, глубо-
ние трансмембранной тороидальной поры, что
ко погружаясь в нее, что ведет к дестабилизации
предположительно происходит на микросекунд-
мембраны [11]. Лазиоглоссин III (LL-III), пептид
ной временной шкале [20]. Вычислительное мо-
из 15 аминокислотных остатков, является наибо-
делирование всего механизма антимикробного
лее изученным представителем семейства лазио-
действия затруднительно вследствие больших
глоссинов. LL-III показал сравнительно высокую
временных промежутков для движения липидов,
антимикробную активность против Escherichia
медленной релаксации липидной фазы и ограни-
coli, Bacillus subtilis, Staphylococcus aureus при низ-
чений доступных временных диапазонов. Однако
кой гемолитической активности [10]. Недавно
грубое моделирование или усиленное сэмплиро-
были показаны такие свойства LL-III, как соле-
вание являются оптимальными методами, обыч-
устойчивость, способность образовывать ан-
но используемыми в МД-расчетах взаимодей-
тимикробную пленку и препятствовать образова-
ствия растворимых веществ с липидными бисло-
нию биопленок вследствие мембранолитическо-
ями [21]. В качестве альтернативного подхода мы
го действия против широкого спектра
применили атомистическое моделирование двух
грамположительных и грамотрицательных бак-
ключевых стадий взаимодействия пептида LL-III
терий [12]. Кроме того, синтетическое производ-
с различными моделями мембран для выяснения
ное пептида LL-III ингибирует образование
взаимодействий между пептидом и бислоем. Это
биопленки C. albicans [13].
позволяет анализировать адекватные временные
отрезки. В данном контексте были поставлены
Сходным образом N-концевая модификация
следующие цели: 1) выявить характер взаимодей-
LL-III остатком цистеина и покрытие им коммер-
ствия между липидным бислоем и АМП в двух
ческого силиконового катетера увеличили анти-
различных состояниях, поверхностном и погру-
микробную активность против грамположитель-
ных и грамотрицательных бактерий [14]. Рекомби-
женном; 2) определить эффект АМП на структуру
липидного бислоя. В похожих исследованиях вза-
нантный пептид LL-III ингибировал микробное
имодействий
«пептид-липид» высказывались
разложение пищи и показал выраженные антиок-
предположения, что пептид подходит к бислою в
сидантные свойства [15]. Его необычно высокая
состоянии неупорядоченного клубка, но во время
биологическая активность обусловлена амфи-
фильным N-концевым фрагментом [10]. Он имеет
взаимодействия с липидным бислоем сворачива-
ется в α-спиральную структуру на границе разде-
суммарный заряд +6 и приобретает α-спиральную
ла фаз «липид-вода» [20, 21]. Таким образом, бы-
структуру в трифторэтаноле и растворе додецил-
ло проведено моделирование исследованных си-
сульфата натрия [10]. Подобная последователь-
стем с α-спиральной структурой пептида, когда
ность аминокислот приводит к возможности взаи-
модействия с липидным бислоем как одиночных
он взаимодействует с липидным бислоем.
молекул, так и агрегатов пептида. В данной работе
Количество гидрофобных аминокислотных
исследован механизм связывания LL-III с мембра-
остатков и их распределение определяет взаимо-
ной методом расчета траекторий молекулярной
действие пептида с мембраной, что наглядно ил-
динамики. Результаты помогут прояснить меха-
люстрируется в схеме спирального колеса [22].
низм работы этого пептида и роль особых аспектов
Было обнаружено, что ориентация пептида внут-
его последовательности для дальнейшей разработ-
ри поры зависит от гидрофобного несоответствия
ки высокоэффективных АМП.
между гидрофобной длиной порообразующего
Молекулярно-динамические (МД) расчеты
пептида и гидрофобной толщиной липидного
обеспечивают эффективную основу для иденти-
бислоя [23]. Другое исследование показало, что
фикации различных молекулярных взаимодей-
толщина и жесткость бислоя значительно влияют
ствий на атомном уровне и таким образом до-
на свободную энергию, необходимую для образо-
полняют экспериментальные результаты
[16].
вания поры [24]. В качестве следующего шага в
Поскольку большинство экспериментальных ла-
понимании влияния гидрофобного несоответ-
бораторных подходов не могут обеспечить доста-
ствия на взаимодействие и динамику АМП в ли-
точного разрешения для определения взаимодей-
пидном бислое было проведено МД-моделирова-
ствий «мембрана-пептид» на атомном уровне,
ние пептида LL-III на поверхности и внутри (в
расчеты траекторий МД представляют собой аль-
трансмембранной ориентации) в цвиттерионных
тернативный подход для решения таких задач.
мембранных липидных бислоях - более толстом
БИОФИЗИКА том 67
№ 2
2022
252
САХА и др.
из
1-пальмитоил-2-олеил-sn-глицеро-3-фосфо-
ванием пакета программ Desmond 2012 MD (Mae-
холина и более тонком из 1,2-димиристил-sn-
stro-Desmond Interoperability Tools, версия 3.1,
глицеро-3-фосфатидилхолина (ДМФХ). В дан-
Schrödinger, Нью-Йорк, США) в силовом поле
ной работе с применением МД-расчетов были
OPLS-AA (Optimized Parameters for Liquid Simula-
проанализированы ориентация и стабильность
tions All-Atom - Оптимизированные параметры
пептида и характер взаимодействия между пепти-
для полноатомного жидкостного моделирова-
дом и системами липидных бислоев. Затем были
ния) [28, 29] с моделью воды TIP3P в изотермно-
проведены структурный и конформационный
изобарном ансамбле в периодических граничных
анализ, а также расчет параметров упорядоченно-
условиях [30]. Для МД-расчетов предварительно
сти для характеристики разрушения модельных
уравновешенные мембраны из 128 молекул липи-
мембран, взаимодействующих с пептидом.
да ПОФХ с 2460 молекулами воды и 128 молекул
липида ДМФХ с 128 ионами Na+ и 3527 молекула-
ми воды были получены из лаборатории П. Тиле-
МАТЕРИАЛЫ И МЕТОДЫ
мана (P. Tieleman, the University of Groningen).
Стартовые структуры лазиоглоссина III. LL-III
Примерно 6400 молекул воды использовали для
(VNWKKILGKIIKVVK) - это катионный анти-
сольватации систем ПОФХ и ДМФХ при распо-
микробный пептид с суммарным зарядом +5 при
ложении пептида в мембранах, для электроней-
нейтральном pH. Атомные координаты пептида
тральности системы добавлялись противоионы.
моделировались в α-спиральной конформации в
Для каждой системы проводили три расчета тра-
программе Visual Molecular Dynamics версии
екторий МД, для каждого из них задавали разные
1.9.141 [25]. Для имитации экспериментальных
начальные случайные скорости.
условий N-конец и C-конец были заряжены. При
Изначальное уравновешивание проводили в те-
нейтральных pH боковые цепи лизина в LL-III за-
чение 500 пс в изотермно-изохорных условиях,
ряжены. Структура пептида LL-III была получена
при этом тяжелые атомы пептида и фосфатных
после минимизации энергии через 1000 шагов ско-
групп липидных головок были ограничены в
рейшего спуска, после чего следовал расчет МД-
окрестности своих референсных координат гармо-
траектории длительностью 100 нс в ячейке разме-
ром 50×50×50 Å, где наряду с пептидом присут-
никами с постоянной силой 1000 кДж⋅моль-1⋅нм-2.
ствовали примерно 4000 молекул воды и три про-
Стабильная среда поддерживалась при температу-
тивоиона Cl- для поддержания электронейтраль-
ре 300 К с помощью термостата с изменением мас-
ных условий. Последние рамки траекторий были
штаба скорости [31] c раздельным сопряжением
отобраны в качестве стартовых структур для расче-
для «растворенного вещества» (пептидов и липи-
та траекторий систем пептид-липидный бислой.
дов) и «растворителя» (воды и ионов) с временной
константой 0.1 пс. Эта температура значительно
Условия подготовки системы «пептид-липид-
выше температуры перехода в жидкокристалличе-
ный бислой». Начальная позиция и ориентация
ское состояние (268 К для ПОФХ и 297 К для
пептида в мембранном бислое были выбраны на
ДМФХ). Эти системы в дальнейшем уравновеши-
основании различных стадий типичного дей-
вали в течение 1 нс в изотермно-изобарных усло-
ствия АМП. В одной серии траекторий молекула
виях в термостате Нозе-Гувера [32, 33]. Постоян-
пептида LL-III помещалась в водную фазу так,
ное давление 1 атм поддерживали полуизотроп-
что центр масс пептида находился примерно в
ным баростатом Паринелло-Рамана с временной
1 нм от границы раздела фаз «мембрана-вода»,
константой 2.0 пс [34]. Нормаль к бислою (ось Z) и
при этом ось спирали пептида была параллельна
плоскость бислоя (плоскость XY) сопрягали от-
поверхности раздела фаз. Похожую ориентацию
дельно, постоянное давление в 1 бар поддерживали
придавали пептиду в недавней работе [26]. В дру-
во всех направлениях. Затем применяли алгоритм
гой серии траекторий пептид LL-III помещали в
LINCS для ограничения всех длин связей молекул
трансмембранную связанную позицию (транс-
воды. Для дистантных электростатических взаи-
позицию, транс-связанную позицию), пронзая
модействий применяли метод частичных сумм
оба листка бислоя. После введения пептида рас-
Эвальда с радиусом обрезания 1.2 нм для кулонов-
чет вели по особому протоколу, когда с помощью
ских взаимодействий [35]. После уравновешива-
силы величиной 100 кДж/моль/м2 в транс-участ-
ния ограничения позиций пептида снимали и тра-
ке бислоя мембраны создавали отверстие, по раз-
екторию МД запускали для каждой системы на
меру и форме соответствующее пептиду, в пред-
100 нс в изотермно-изобарном ансамбле. Шаг ин-
варительно уравновешенных моделях липидного
тегрирования был равен 2 фс с сохранением коор-
бислоя. Затем пептид погружали в полученное от-
динат, а скорости сохраняли для анализа каждые
верстие, после чего следовала минимизация
20 пс. Полученные в результате траектории ис-
энергии с позиционными ограничениями [27].
пользовали для всех анализов. Программу PyMOL,
Расчеты траекторий молекулярной динамики.
созданную У.Л. ДеЛано (W.L. DeLano) и выпу-
Все вычисления и анализ проводили с использо-
щенную на рынок компанией DeLano Scientific
БИОФИЗИКА том 67
№ 2
2022
ВЗАИМОДЕЙСТВИЕ АНТИМИКРОБНОГО ПЕПТИДА
253
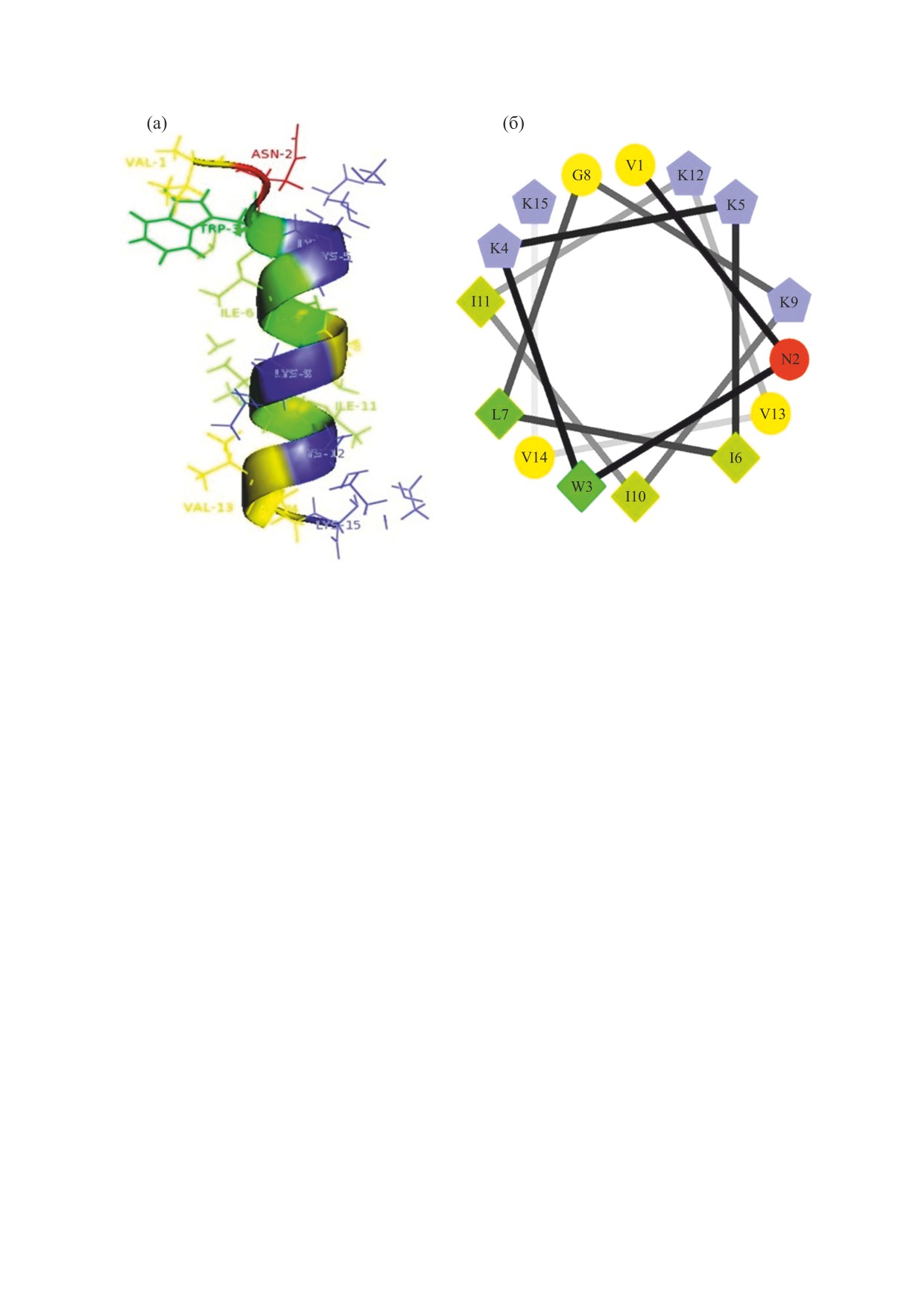
Рис. 1. Структура и схема спирального колеса для пептида LL-III. Пептид изображен в ленточном виде. Для диаграммы
«спирального колеса» последовательность аминокислот отображена по часовой стрелке. Гидрофильные остатки
изображены кружками, гидрофобные - ромбами, положительно заряженные - пятиугольниками.
Gtotal = Egas + Gsol,
лучения всех численных значений. Для каждого из
при этом в Egas входит электростатический терм
четырех расчетов МД получали три независимые
(Eele) и ван-дер-ваальсов терм (Evdw). Более того,
траектории, анализ данных проводили по всем
трем независимым траекториям. В то же время ре-
энергия сольватации также раскладывается на
зультаты расчетов опубликованных ранее работ со-
полярную энергию сольватации Gps и неполяр-
держат анализ от одной до трех независимых тра-
ную энергию сольватации Gnps согласно следую-
екторий. Также проводили временной анализ во-
щему уравнению:
дородных связей в течение всего периода
Gsol = Gps + Gnps.
моделирования. В системах D-H---A-X, где D
(донор) - это атом азота положительно заряжен-
Неполярная энергия сольватации была рас-
ных групп пептида и A (акцептор) - атом кислоро-
считана на основе площади поверхности, доступ-
да остатков глицерина и фосфатных групп головок
ной для растворителя (solvent-accessible surface
липидов, контакты с расстояниями D---A менее
area - SASA), согласно уравнению
3.5 Å и углами между H и A более 120° рассматрива-
Gnps = γ SASA + β.
ли как водородные связи.
Коэффициент поверхностного натяжения γ и
Расчеты свободной энергии связывания. Сво-
константу β принимали равными
0,00542
бодную энергию связывания пептидов с мем-
ккал/(моль·Å2) и 0.92 ккал/моль, согласно лите-
бранными системами рассчитывали через реше-
ратуре [37].
ние уравнения Пуассона-Больцмана по методу
MM/PBSA [36]. Свободную энергию связывания
оценивали как
РЕЗУЛЬТАТЫ
Gbinding = ΔGcomplex - ΔGligand,
Расчет траекторий лазиоглоссина III в липид-
где каждый терм энергии G оценивали как сумму
ных бислоях. Диаграмма Шиффера-Эдмунсона
молекулярно-механической энергии в газовой
(диаграмма α-спирального колеса) для пептида
фазе Egas и энергии сольватации Gsol по следую-
LL-III показала, что остатки Lys расположены на
щему уравнению:
одной стороне, а гидрофобные остатки Val, Leu,
БИОФИЗИКА том 67
№ 2
2022
254
САХА и др.
Ile, Trp - на другой стороне спирали (рис. 1а,б).
ного бислоя мембраны, мы также исследовали
Изначально взаимодействие LL-III с липидами
образование водородных связей в процессе моде-
ПОФХ и ДМФХ моделировалось в поверхност-
лирования. Для этого был проведен анализ водо-
но-связанном состоянии. Чистые мембраны
родных связей между ними во времени по всем
ДМФХ и ПОФХ - цвиттерионы с нейтральным
траекториям. В нашем случае атомы остова пеп-
суммарным зарядом. МД-система формирова-
тида в поверхностно-связанном состоянии на
лась с пептидом, параллельным границе раздела
границе раздела фаз «липид-вода» были более
фаз «бислой-вода», без прямого контакта с обла-
доступны для образования водородных связей,
стью головок липида. Кадры финальной конфи-
чем в случае полностью погруженного транс-свя-
гурации расчетов МД-траекторий приведены на
занного состояния в бислое.
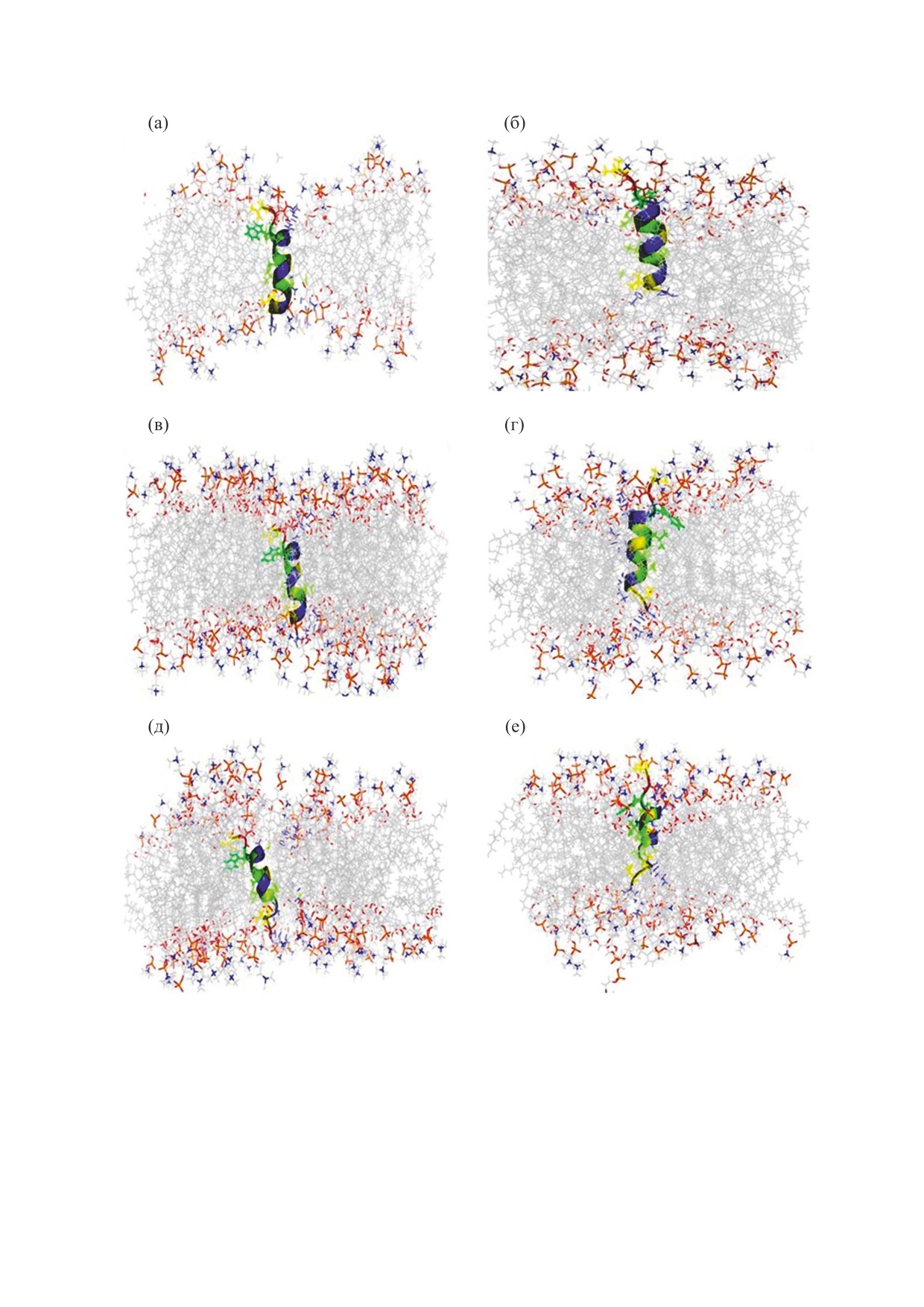
рис. 2. Во всех случаях три независимых траекто-
Как было проиллюстрировано моделировани-
рии давали сходные результаты.
ем динамики, боковая цепь лизина пептида
Рис.
2 демонстрирует структуру пептида
LL-III в транс-связанной позиции обычно взаи-
LL-III на поверхности липидных бислоев из
модействует в среднем с двумя прилежащими мо-
ДМФХ и ПОФХ через 0, 50 и 100 нс моделирова-
лекулами ДМФХ и ПОФХ на протяжении всей
ния. Как ожидалось, пептид сперва приближался
траектории. Аминокислотные остатки пептидов
к полярной поверхности, затем медленно прохо-
обычно формируют H-связи с карбонилами
дил через полярную область и наконец достигал
сложных эфиров, фосфатными группами и моле-
равновесного состояния близко к группе головок
кулами воды на границе раздела фаз «мембрана-
липидного бислоя. Мы наблюдали, что через
вода».
100 нс пептид LL-III также ориентируется в схо-
Представленные результаты также позволяют
жем, практически параллельном направлении к
говорить о снижении количества водородных
поверхности мембраны из ДМФХ (рис. 2б). Сход-
связей «вода-пептид» с соответствующим увели-
ным образом LL-III взаимодействует с мембра-
чением количества водородных связей «ПОФХ-
ной ПОФХ на границе раздела фаз «вода-липид»
пептид», во что вносят значительный вклад остат-
и ориентируется в предпочтительной позиции, в
ки лизина. Это также подтверждается расчетом
которой остатки лизина взаимодействуют с обла-
среднего количества молекул, образующих водо-
стью головок липидов (рис. 2д).
родные связи с пептидом, указывающим, что ко-
Также были проведены расчеты траекторий,
личество молекул фосфатидилхолина, образую-
когда пептид LL-III полностью погружался в
щих водородные связи, больше, чем таковых мо-
бислой в транс-связанной позиции. Кадры фи-
лекул воды (табл. 1) в поверхностно-связанном
нальной конфигурации расчета динамики пепти-
состоянии в случае обоих типов мембранных бис-
да из транс-позиции в мембранах из ДМФХ и
лоев. Показано, что в обоих случаях остатки ли-
ПОФХ показаны на рис. 3. Пептид LL-III остает-
зина присутствуют в середине липидного бислоя
ся внутри бислоев мембраны в течение всего вре-
в гидрофобной области. Однако Lys4, Lys12 и
мени расчета. Кроме того, LL-III находится в
Lys15 выступают из гидрофобной области, и
очень развернутой и наклоненной ориентации
пептид наклоняется после 100 нс моделирования
после 100 нс динамики в мембранных бислоях.
динамики. Выступание Lys15 из гидрофобной
Больший наклон пептид демонстрирует в бислое
области, как было показано, помогает предпо-
ДМФХ (рис. 3б), чем в бислое ПОФХ (рис. 3д),
чтительным взаимодействиям с липидами проти-
что вполне ожидаемо, поскольку бислои ПОФХ
воположного листка [38].
обладают большей гидрофобной шириной, чем
бислои ДМФХ.
Профили структур мембранных бислоев по взаи-
модействию «пептид-бислой». Погружение и про-
Стабильность пептида в различных окружениях.
никновение пептидов ведет к нарушению струк-
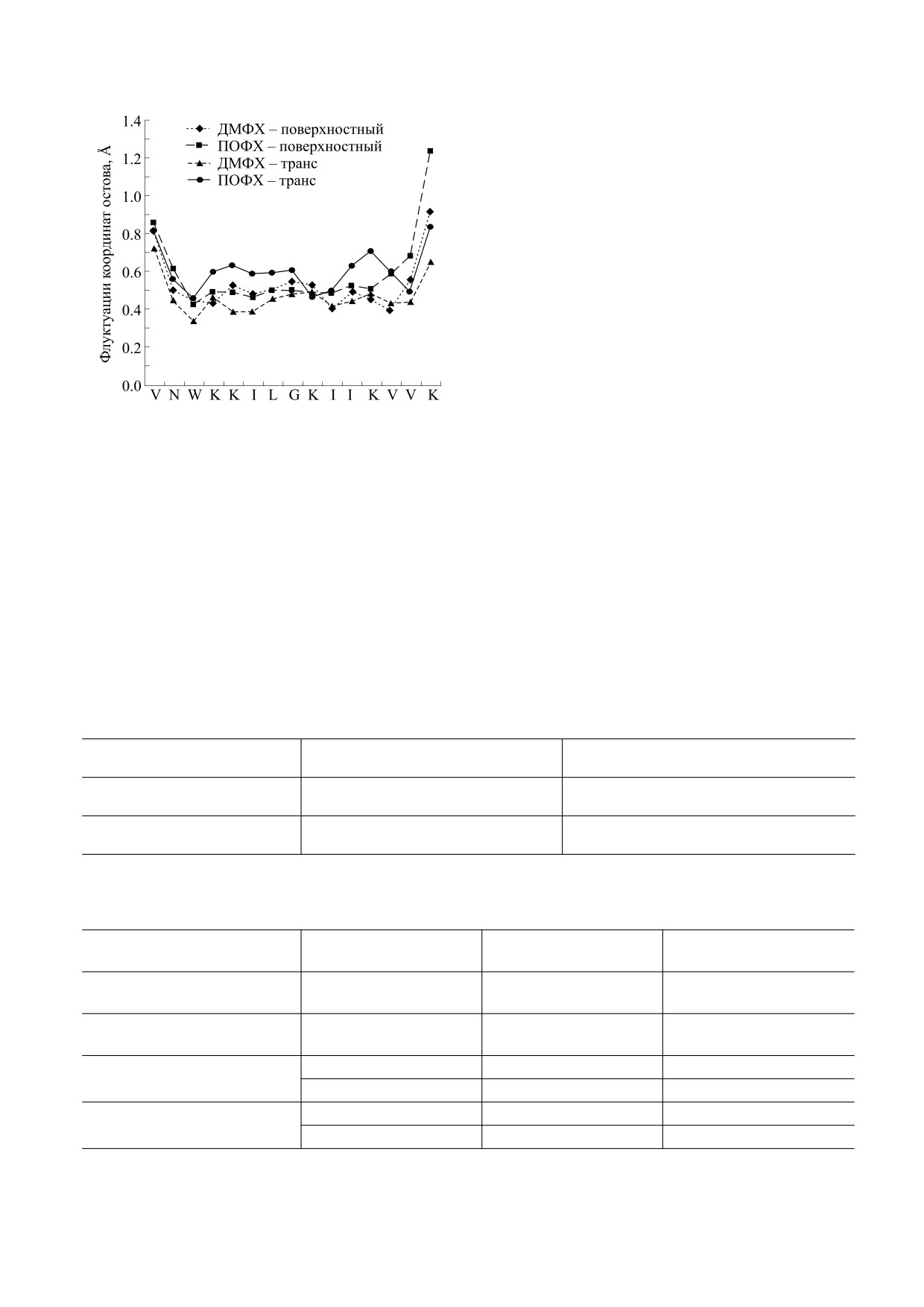
Отклонения от изначальной конфигурации в те-
туры липидов. Для дальнейшего исследования
чение динамики в основном происходят у остат-
различий во взаимодействии пептида с липида-
ков лизина в липофильных хвостах, на что указы-
ми, характеристика липидов проводилась на ос-
вает увеличение усредненной по остатку средне-
нове их близости к пептиду LL-III. Липид харак-
квадратичной флуктуации остова примерно на
теризуется как «образующий ассоциат» (ассоции-
0.6 Å (рис. 4). Также из рис. 4 ясно, что усреднен-
рованный), если он расположен на удалении
ная по остатку среднеквадратичной флуктуации
менее 5 Å от пептида в любой временной точке
остова по своим значениям относительно более
моделирования. Все другие липиды характеризу-
стабильна в бислое из ДМФХ, чем в бислое из
ются как «не образующие ассоциат» (неассоции-
ПОФХ.
рованный) [20]. Количество ассоциированных и
Профили водородных связей взаимодействия
не ассоциированных липидов в каждом листке в
«лазиоглоссин III-бислой». Поскольку межмоле-
различных траекториях приведено в табл. 2. Тен-
кулярные взаимодействия играют важную роль
денция наличия ассоциированных и не ассоции-
во взаимодействии АМП с поверхностью липид-
рованных липидов в каждом листке сходна для
БИОФИЗИКА том 67
№ 2
2022
ВЗАИМОДЕЙСТВИЕ АНТИМИКРОБНОГО ПЕПТИДА
255
Рис. 2. Характерные снимки траекторий динамики систем поверхностно-связанного пептида в бислоях ДМФХ и ПОФХ:
(а), (в), (д) - позиция пептида в точках 0, 50 и 100 нс на оси времени в бислое ДМФХ; (б), (г), (е) - позиция пептида в тех
же временных точках в бислое ПОФХ. Пептид показан в ленточном виде и окрашен соответственно схеме спирального
колеса. Молекулы воды удалены для наглядности.
БИОФИЗИКА том 67
№ 2
2022
256
САХА и др.
Рис. 3. Характерные снимки траекторий динамики транс-связанного пептида в бислоях ДМФХ и ПОФХ: (а), (в), (д) -
положение пептида в точках 0, 50 и 100 нс на оси времени в бислое ДМФХ; (б), (г), (е) - позиция пептида в тех же
временных точках в бислое ПОФХ. Пептид показан в ленточном виде и окрашен соответственно схеме спирального колеса.
Молекулы воды удалены для наглядности.
БИОФИЗИКА том 67
№ 2
2022
ВЗАИМОДЕЙСТВИЕ АНТИМИКРОБНОГО ПЕПТИДА
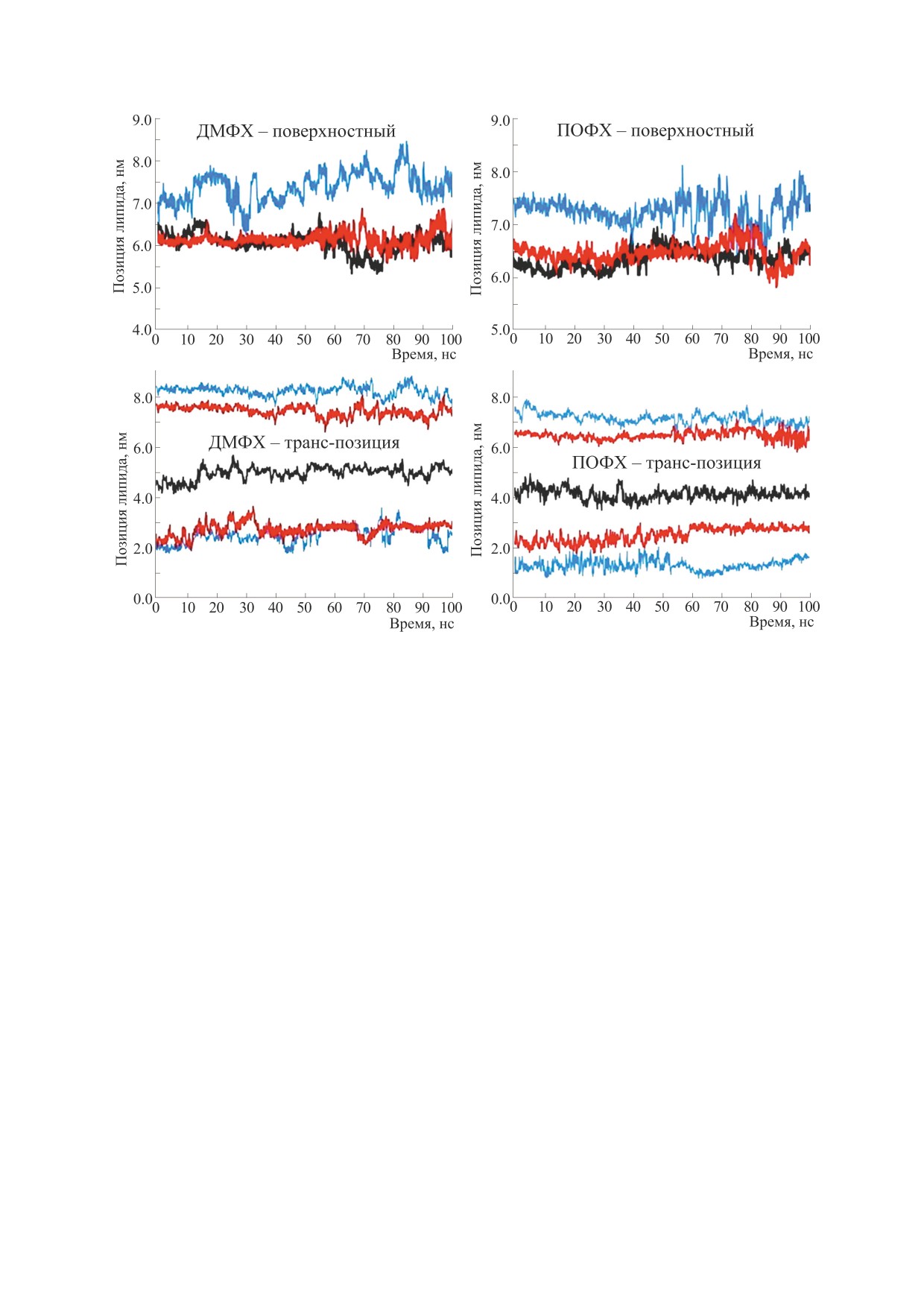
257
ния общего влияния пептида на липидный
бислой был построен график (рис. 5) позиций
центров масс фосфатных групп липидов, образу-
ющих и не образующих ассоциаты, в течение
100 нс, причем центр масс пептида был взят за ре-
ференсную точку (черный). Для пептидов в по-
верхностно-связанном и транс-связанном по-
ложениях в бислое ДМФХ нет явной разницы в
относительном положении фосфатов ассоцииро-
ванных и неассоциированных липидов в нижнем
листке (рис. 5). Однако как в бислое ДМФХ, так и
в бислое ПОФХ все другие листки демонстриру-
ют выраженную разницу в позиции ассоцииро-
ванных липидов отноcительно нормали к мем-
бране по сравнению с неассоциированными ли-
пидами (рис. 5). Таким образом, из рис. 5 можно
заключить, что ассоциированные липиды в верх-
нем листке ДМФХ и обоих листках ПОФХ ближе
Рис. 4. Среднеквадратичные флуктуации координат
к центру масс пептида, чем неассоциированные
остова в пересчете на остаток для поверхностно-
липиды.
связанного и транс-связанного пептида на траекториях
соответствующих систем в течение 100 нс МД-расчета.
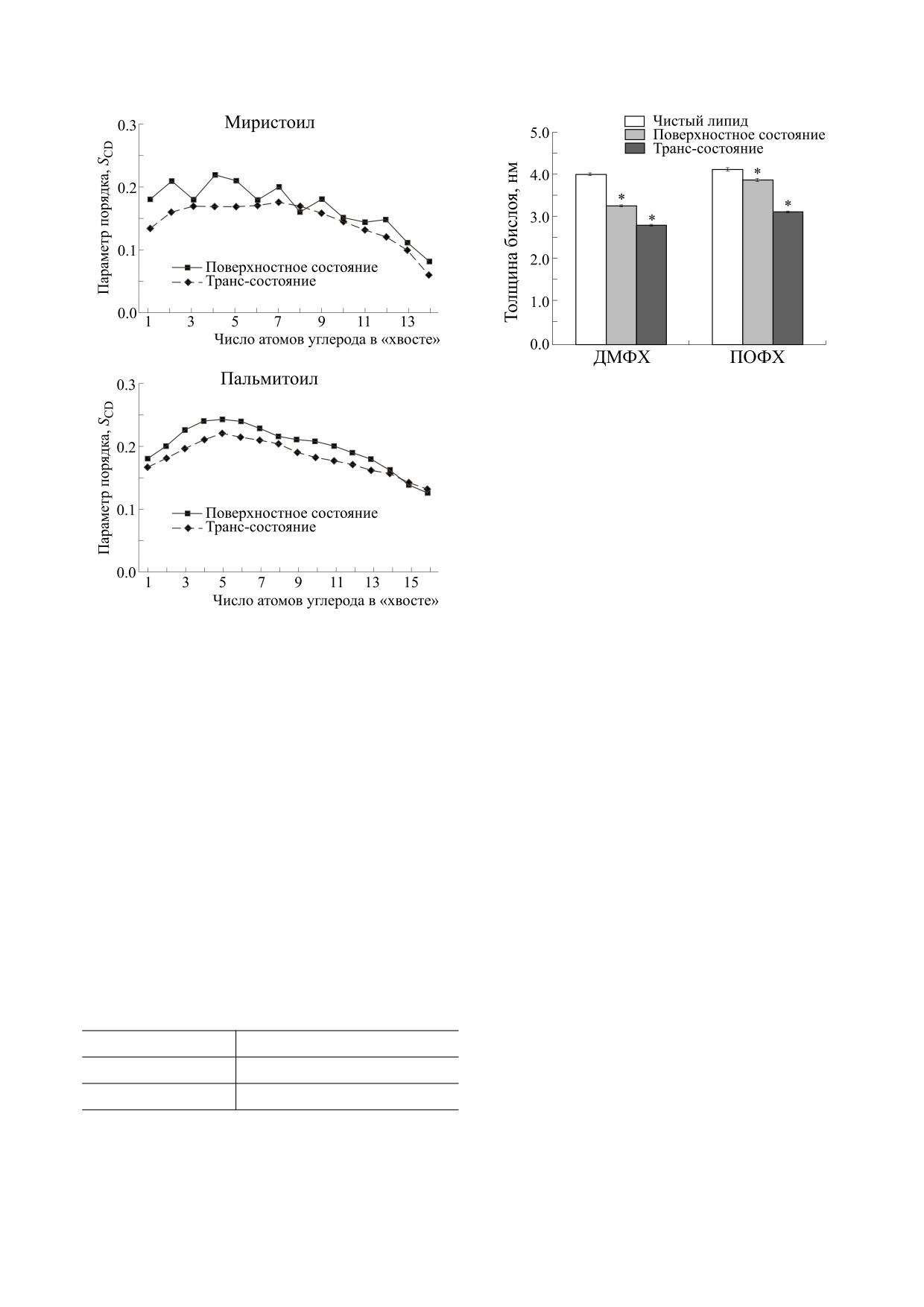
Рис. 6 показывает параметры упорядоченно-
сти миристиловых и пальмитиловых цепей ассо-
циированных липидов верхнего листка бислоя
модельных липидных бислоев ДМФХ и ПОФХ.
при моделировании пептида в поверхностно-свя-
Ассоциированные липиды находятся ближе к
занном состоянии. Пальмитиловые цепи демон-
центру бислоя в сравнении с неассоциированны-
стрируют увеличение параметра упорядоченно-
ми. В целом липидные бислои демонстрируют
сти в области головок липидов (номера атомов уг-
присутствие локальных изгибов.
лерода 0-5), затем следует крутое снижение по
При моделировании пептидов в трансмем-
следованию алкильных хвостов. Наиболее веро-
бранном связанном состоянии количество ассо-
ятно, что это изменение вызвано водородным
циированных липидов было больше, чем не ассо-
связыванием остатков лизина с молекулами ли-
циированных, что неудивительно. Для понима-
пидов, что уменьшает подвижность головок ли-
Таблица 1. Среднее количество молекул, образовавших водородные связи с пептидом
Количество молекул воды,
Количество молекул ФХ, образующих
Бислой и позиция
образующих водородные связи
водородные связи
ДМФХ - поверхностно-
13.10 ± 0.14
21.80 ± 0.25
связанный
ПОФХ - поверхностно-
14.30 ± 0.21
23.10 ± 0.30
связанный
Примечание. Все значения приведены как среднее ± стандартная ошибка среднего.
Таблица 2. Количество ассоциированных и неассоциированных липидов в системах мембранных бислоев
Ассоциированные
Неассоциированные
Бислой и позиция
Листок бислоя
липиды
липиды
ДМФХ - поверхностно-
Верхний
36.20 ± 1.91
28.00 ± 0.58
связанный
ПОФХ - поверхностно-
Верхний
38.00 ± 2.04
26.00 ± 0.94
связанный
Верхний
23.00 ± 1.85
41.00 ± 2.62
ДМФХ - транс-связанный
Нижний
27.00 ± 1.65
37.00 ± 1.52
Верхний
25.00 ± 1.12
39.00 ± 2.15
ПОФХ - транс-связанный
Нижний
29.00 ± 1.70
35.00 ± 1.70
БИОФИЗИКА том 67
№ 2
2022
258
САХА и др.
Рис. 5. Позиция асссоциированного (вблизи пептида, красный) и неассоциированного (вдали от пептида, синий) липидов
в верхнем и нижнем листках бислоя на протяжении всего времени динамики. Позиция пептида, взятая как референсное
значение, обозначена черным цветом.
пидов и таким образом увеличивает упорядочен-
Поскольку пептид LL-III приобретает наклон
ность. Интересно, что в случае пептидов в по-
после 100 нс расчета динамики в трансмембран-
верхностно-связанном состоянии изначально
ной ориентации, мы также проанализировали
имеется подъем степени упорядоченности атомов
угол наклона пептида в обеих моделях липидного
углерода миристиловых групп, но общая упоря-
бислоя. LL-III демонстрирует более выраженный
доченность значительно снижена. В случае пеп-
наклон в бислое ДМФХ по сравнению с ПОФХ,
тида в трансмембранной ориентации, пальмити-
что также может быть подтверждено из позиции и
ловые, олеиловые и миристиловые цепи ассоции-
ориентации пептида в липидном бислое. По-
рованных липидов (рис. 6) показывают намного
скольку для точной количественной оценки угла
большую неупорядоченность, чем соответствую-
наклона пептида в липидных бислоях требуется
щие липиды в поверхностно-связанном состоя-
даже большее время, стандартные ошибки угла
нии на тех же временных интервалах динамики.
наклона в наших вычислениях довольно значи-
Также это воздействует на другие структурные ха-
тельны. Расчеты МД показали, что ось спирали
рактеристики бислоя, такие как толщину (рис. 7).
пептида LL-III наклонена под углом 11.80 ± 3.9°
Толщину мембраны анализировали по расчету
относительно нормали в бислоях ПОФХ, что
проекции расстояния между центрами атомов
можно сравнить с наклоном 19.60 ± 5.6° в бислоях
фосфатов в двух листках бислоя на ось Z [39]. На-
ДМФХ (табл. 3). Толщина бислоя ДМФХ от кар-
блюдалось, что снижение толщины мембраны
бонила до карбонила составляет около 23 Å, в то
для бислоя ДМФХ существенно выше в сравне-
время как ПОФХ имеет толщину 27 Å, что может
нии с бислоем ПОФХ. Также видно, что сниже-
быть причиной более сильного наклона пептида в
ние более выражено, когда пептид находится в
мембране из ДМФХ, чем из ПОФХ [40]. Интерес-
транс-связанном состоянии, чем когда он нахо-
но, что пептид LL-III почти сохранял свою ори-
дится в поверхностно-связанном состоянии.
ентацию в бислое ПОФХ с малым углом наклона.
БИОФИЗИКА том 67
№ 2
2022
ВЗАИМОДЕЙСТВИЕ АНТИМИКРОБНОГО ПЕПТИДА
259
Рис. 7. Толщина бислоя в исследованных системах из
ДМФХ и ПОФХ. Проводили по три независимых
повторности расчетов. Все значения приведены как
среднее ± стандартная ошибка среднего; * - p < 0.05
относительно чистых бислоев ДМФХ/ПОФХ без
пептида.
связанном состоянии с бислоем из ПОФХ
(-103.42 ± 8.95 ккал/моль; табл. 4). Таким обра-
зом, пептид LL-III намного более стабилен в бис-
лое ДМФХ, чем в бислое ПОФХ. Было обнаруже-
но, что как ΔEele (-148.58 ± 11.15 ккал/моль), так и
ΔEvdw (-189.68 ± 14.35 ккал/моль) предпочтитель-
ны для стабильности пептида LL-III в поверхност-
Рис. 6. Параметры упорядоченности липидных хвостов
(вблизи пептида) верхнего листка бислоя в траекториях
но-связанном состоянии с липидным бислоем
динамики пептида в поверхностно-связанном состоя-
ДМФХ (табл. 4).
нии в липидных бислоях.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Профили свободных энергий взаимодействия
«молекула-бислой». Для получения более деталь-
Многие антимикробные пептиды с катионны-
ной информации о взаимодействии пептидов в по-
ми аминокислотными остатками функциониру-
верхностно-связанном состоянии в обоих типах
ют по механизму взаимодействия с мембраной
бислоев нами с помощью утилиты g_mmpbsa были
[41], включающему транслокацию через клеточ-
рассчитаны полные свободные энергии связыва-
ные мембраны [42], разрушение липидного бис-
ния и их различные слагаемые для взаимодействия
лоя, текучесть модельных мембранных везикул
пептида и модельного мембранного бислоя, пере-
[43]. Активность АМП обусловлена амфифиль-
численные в табл. 5. Было обнаружено, что энер-
ностью их последовательностей, и таким образом
они приобретают хорошо упорядоченную α-спи-
гия связывания пептида LL-III в состоянии связы-
ральную структуру на границе мембраны [44].
вания с поверхностью липидного бислоя из ДМФХ
Точный механизм, по которому пептид LL-III
(-124.41 ± 10.48 ккал/моль) была значительнее,
проникает в мембрану, еще предстоит выяснить.
чем энергия связывания пептида в поверхностно-
Понимание механизма взаимодействия АМП с
мембраной на молекулярном уровне интересно с
Таблица 3. Средние углы наклона в липидных бислоях
точки зрения биофизических задач. Поскольку
с пептидом LL-III в трансмембранной ориентации
активность LL-III может регулироваться взаимо-
действием с поверхностью раздела фаз «липид-
Траектории (100 нс)
Угол наклона, град
вода», как и в случае других сшитых АМП, стоит
ДМФХ
19.6 ± 5.6
продолжать исследования молекулярного меха-
низма взаимодействия и переориентации этих
ПОФХ
11.8 ± 3.9
пептидов в липидных бислоях. В данной работе
Примечание. Все значения приведены как среднее
±
для определения сложных взаимодействий между
стандартная ошибка среднего.
пептидом LL-III и липидными бислоями были
БИОФИЗИКА том 67
№ 2
2022
260
САХА и др.
Таблица 4. Свободные энергии связывания в системах LL-III-мембрана, рассчитанные методом MM/PBSA
Энергия (ккал/моль)
ДМФХ - поверхностно-связанный
ПОФХ - поверхностно-связанный
ΔEele
-148.58 ± 11.15
-121.18 ± 10.85
ΔEvdw
-189.68 ± 14.35
-164.57 ± 12.62
ΔEgas
-338.26 ± 15.40
-285.75 ± 14.06
ΔGnps
-28.63 ± 4.28
-32.59 ± 5.09
ΔGps
242.48 ± 13.53
214.92 ± 12.12
ΔGsol
213.85 ± 11.16
182.33 ± 10.75
ΔGbinding
-124.41 ± 10.48
-103.42 ± 8.95
Примечание. Все значения приведены как среднее ± стандартная ошибка среднего.
применены расчеты траекторий МД. Для этого
ствия может быть вызвана тем, что олеильный
было проведено четыре различных расчета:
хвост бислоя ПОФХ имеет меньший параметр
LL-III в поверхностном и транс-связанном со-
упорядоченности, что приводит к более высокой
стоянии с липидными бислоями из ПОФХ и
проницаемости и меньшим ограничениям на
ДМФХ, с длительностью траекторий по 100 нс. В
проникновение. В случае ДМФХ миристиловые
частности, определялся характер взаимодействия
хвосты короче, чем олеиловые и пальмитиловые,
пептида с мембраной, а также структура и свора-
что ведет к уменьшению толщины, однако, по-
чивание пептида в мембранных бислоях.
скольку эти хвосты полностью насыщенны, пара-
метр упорядоченности ДМФХ оказывается выше
Тем не менее, поскольку для LL-III показана
ПОФХ, что ведет к более упорядоченной структу-
способность сильно взаимодействовать с мем-
ре и большим затруднениям проникновения че-
бранами, он не проникал насквозь через бислои,
рез мембрану.
а его локализация ограничивалась верхним моно-
Пептид LL-III в поверхностно-связанном со-
слоем липида в поверхностно-связанном состоя-
стоянии демонстрировал более высокую дестаби-
нии в случае бислоя из ДМФХ. Такой расчет про-
лизацию вторичной структуры, чем пептид в
тиворечит предыдущим исследованиям АМП [45,
транс-связанном состоянии. Это согласуется с
46]. Однако, например, моделирование таких
предыдущими теоретическими [48] и экспери-
АМП, как магаинин и меллитин, показало обра-
ментальными исследованиями in vitro [49], кото-
зование неупорядоченных тороидальных пор в
рые демонстрировали, что стабильность вторич-
бислоях из фосфатидилхолинов в течение 10 нс
ной структуры зависит от способности боковых
[45, 46]. АМП осуществляют образование пор че-
цепей закрывать водородные связи остова. Вдо-
рез промежуточное состояние, при котором глу-
бавок чрезвычайно важно сравнивать структур-
боко погруженный пептид образует сильные вза-
ные флуктуации структуры, усредненной по
имодействия с молекулами растворителя и голов-
времени, без начальной структуры для каждой
ками липидов, в результате чего образуется пора.
траектории. Согласно среднеквадратичным
Таким образом, результаты МД-расчетов для
флуктуациям координат атомов по траекториям,
транс-погруженного состояния показывают, что
пептид ясно демонстрирует большую структур-
стабильность пептида LL-III в наблюдаемой по-
ную подвижность в бислое ПОФХ, чем в бислое
зиции и ориентации может быть вызвана межмо-
ДМФХ. Амплитуда среднеквадратичных флукту-
лекулярными взаимодействиями остатков лизина
аций выше и составляет от 0.3 до 1.2 Å. В целом
с полярными участками головок липидов мем-
значения среднеквадратичных флуктуаций под-
бранных бислоев. Сходные взаимодействия так-
тверждают, что пептид более стабилен в окруже-
же ответственны за заякоривание пептида LL-III
нии ДМФХ, чем в окружении ПОФХ, в котором
в состоянии, связанном с поверхностью, в обоих
наблюдается неупорядоченное расположение
типах липидных бислоев. Подобная тенденция
остатков лизина пептида.
согласуется с недавней работой [47], в которой
было показано, что остатки лизина выступают из
Когда пептид переходит в транс-позицию,
середины бислоя к доступному противоположно-
большое индольное кольцо гидрофобного остат-
му листку. Если принимать во внимание поведе-
ка Trp3 медленно проникает в район гидрофобно-
ние связанного с поверхностью состояния пепти-
го хвоста липида. В то же время, положительно
да в ПОФХ, то более высокая частота взаимодей-
заряженная боковая цепь Lys4 все еще взаимо-
БИОФИЗИКА том 67
№ 2
2022
ВЗАИМОДЕЙСТВИЕ АНТИМИКРОБНОГО ПЕПТИДА
261
действует с головкой липида, что нарушает взаи-
связанном состоянии, для обеих моделей бислоя,
модействие типа катион-π между остатками Trp3
а это означает большую дестабилизацию мем-
и Lys4. Такие характеристики пептида LL-III мо-
бранного бислоя. Вышеприведенные результаты
гут адекватно объяснить образование водородных
расчетов согласуются с ранними вычислениями,
связей пептидом LL-III. Эти результаты подтвер-
проведенными на MB21 и укороченном дерма-
ждают данные предыдущих расчетов с другими
септине S3 [55]. Более того, наблюдаемое утонь-
АМП, такими, как гедистин [50] или магаинин-2,
шение липидной мембраны из-за пептида согла-
чьи взаимодействия с бислоем ПОФХ были рас-
суется и с другими расчетами [56, 57]. Наивысшая
считаны на траектории 20 нс [51]. Остатки лизина
степень деформации структуры наблюдалась в
могут занимать границу раздела фаз «липид-во-
бислое ДМФХ, в котором толщина мембраны
да» как наиболее термодинамически предпочти-
уменьшалась по мере приближения к пептиду,
тельную позицию. Обнаружено, что боковые
доказывая нарушение структуры мембраны пеп-
группы лизина занимают поверхность раздела
тидом [53].
фаз, в то время как полярные остатки тирозина
Тренды наклонов в расчетах выраженно согла-
обладают селективностью к участку вблизи кар-
суются с другими расчетными и эксперименталь-
бонилов липидов [52]. Таким образом, мы можем
ными данными [58]. Стоит отметить, что гидро-
предположить механизм, по которому пептид по-
фобное несоответствие может значительно вли-
гружается в модельные липидные бислои. N-кон-
ять на мембранную ориентацию, наклон,
цевой остаток лизина пептида LL-III в изначаль-
конформацию пептида [38, 59, 60]. Более ранние
ном поверхностно-связанном состоянии может
исследования также показали, что АМП, такие
высвобождаться из верхнего листка и погружать-
как меллитин, в бислоях ДМФХ наклонены на
ся во внутренний листок, переходя в трансмем-
угол до 9° в течение нескольких нс во время моде-
бранное состояние [53]. Однако для того, чтобы
лирования динамики [55]. Однако в нашем случае
окончательно делать такой вывод, необходимо
более высокие углы наклона пептидов относятся
провести более детальный анализ. Более того,
к более длительным временам траекторий. Эти
другие остатки лизина и тирозина пептида также
результаты указывают на значительно больший
вносят вклад, предоставляя водородные связи для
наклон в бислоях ДМФХ, чем в бислоях ПОФХ,
погружения пептида в бислой мембраны [53]. Ре-
что, вероятно, вызвано большей гидрофобной
зультаты нашей работы согласуются с предыду-
шириной бислоев ПОФХ, чем бислоев ДМФХ, и,
щим исследованием, проведенным с мембрано-
следовательно, неравенство между гидрофобной
активным антимикробным пептидом в различ-
длиной LL-III и гидрофобной шириной бислоя
ных липидных бислоях [53]. Далее, тенденция
больше в случае бислоев ДМФХ [27].
наличия молекул липида, входящих и не входя-
щих в ассоциат с белком, в обеих липидных
бислойных системах отражает, что липиды, стре-
ЗАКЛЮЧЕНИЕ
мящиеся в ассоциат, находятся ближе к центру
бислоя, чем не стремящиеся. В целом липидные
Мы наблюдали амплитуду изменений, проис-
бислои демонстрируют наличие локальных из-
ходящих при связывании и погружении пептида
LL-III в мембранные бислои. Наши результаты
гибов.
убедительно показали более значительный на-
Экспериментальные и вычислительные иссле-
клон в бислоях ДМФХ, что согласуется с более
дования показали, что АМП, включая магаинин,
ранним вычислительным исследованием, указы-
мелитин и другие, нарушают позицию углерод-
вавшим на сходные изменения углов пептидов за
ных атомов липидных хвостов как в поверхност-
100 нс траектории [51]. Результаты определения
ном состоянии, так и в погруженном в мембрану
свободной энергии также согласуются с более
[45]. Относительную упорядоченность липидных
ранними данными по пептидам - производным
хвостов можно получить из параметра упорядо-
бета-дефензина человека [37]. Мы полагаем, что
наши результаты обеспечат весомое основание
ченности SCD = 3/2(cos2θ - l), где θ - угол между
для дальнейших экспериментальных исследова-
связью CD и нормалью к мембране [54]. Общая
ний пептида LL-III, а их комбинация позволит
тенденция, полученная из расчетов упорядочен-
прояснить многие вопросы структуры, сворачи-
ности, была такова, что у входящего во взаимо-
вания и мембранной ассоциации.
действие липида параметр упорядоченности
уменьшается с течением траектории более силь-
но, когда пептид находится в транс-связанном
ВЫВОДЫ
состоянии, чем когда он находится в поверхност-
но-связанном состоянии. Мы можем сделать вы-
Мы применили метод молекулярной динами-
вод, что ассоциированные липиды более возму-
ки для идентификации критически важных взаи-
щены, когда пептид находится в трансмембран-
модействий между мощным АМП LL- III и мем-
ной ориентации, чем когда он в поверхностно-
бранными бислоями, а также для исследования
БИОФИЗИКА том 67
№ 2
2022
262
САХА и др.
возможного механизма антимикробного дей-
5.
W. F. D. Bennett, C. K. Hong, Y. Wang, et al., J.
ствия. Наши результаты показывают, что:
Chem. Theor. Comput. 12, 4524 (2016).
1) остатки лизина пептида LL-III образуют во-
6.
D. E. Schlamadinger, Y. Wang, J. A. McCammon,
дородные связи с атомами кислорода головок ли-
et al., J. Phys. Chem. B. 116, 10600 (2012).
пидов в течение всего времени расчета траекто-
7.
J. L. Velasco-Bolom, G. Corzo, and R. Garduño-
рии динамики;
Juárez, J. Biomol. Struct. Dyn. 36, 2070 (2018).
2) пептид LL-III, будучи ориентирован на гра-
8.
M. Hong and Y. Su, Prot. Sci. 20, 641 (2011).
нице раздела фаз «липид-вода», связывался с го-
ловками липидов;
9.
L. Liu, Y. Fang, and J. Wu, Biochim. Biophys. Acta
3) когда пептид был ориентирован трансмем-
1828, 2479 (2018).
бранно, он оставался в таком состоянии в течение
10.
V. Cerovsky, M. Budesnsk, O. Hovorka, et al., Chem-
всего времени расчета, что может быть вызвано
BioChem 10, 2089 (2009).
заякориванием остатков лизина на наружном
11.
S. Bandyopadhyay, M. Lee, J. Sivaraman, et al., Bio-
листке липидного бислоя;
chem. Biophys. Res. Comm. 430, 1 (2013).
4) ориентация пептида в бислоях также приво-
дит к дестабилизации структуры бислоя, на что
12.
B. Mishra, A. Basu, R. Saravanan, et al., RSC Adv. 3,
указывали параметры порядка упаковки липид-
9534 (2013).
ных хвостов;
13.
Vaňková, P. Kašparová, N. Dulíčková, et al., FEMS
5) ориентация пептида в ДМФХ приводила к
Yeast Res. 20, foaa020 (2020).
большему углу наклона, чем в бислое ПОФХ.
14.
B. Mishra, A. Basu, R. R. Y. Chua, et al., J. Mater.
Таким образом, данное исследование внесло
Chem. B 2, 1706 (2014).
вклад в понимание влияния толщины бислоя на
15.
A. Tanhaeian, M. B. H. Najafi, P. Rahnama, et al.,
характер взаимодействия АМП с мембранами.
Int. J. Pep. Res. Ther. 26, 1021 (2020).
Однако необходимы дальнейшие эксперимен-
тальные исследования для выявления механизма
16.
T. Hansson, C. Oostenbrink, and W. van Gunsteren,
дестабилизации мембран из смешанных липидов
Curr. Opin. Struct. Biol. 12, 190 (2002).
пептидом LL-III.
17.
K. Hristova, C. E. Dempsey, and S. H. White, Bio-
phys. J. 80, 801 (2001).
БЛАГОДАРНОСТИ
18.
T. Wieprecht, O. Apostolov, and J. Seelig, Biophys.
Chem. 85, 187 (2000).
Авторы благодарят Совет научных и промыш-
ленных исследований (Нью-Дели, Индия) за
19.
K. J. Hallock, D. K. Lee, J. Omnaas, et al., Biophys. J.
предоставление финансовой поддержки постдок-
83, 1004 (2002).
торанту С. Сахе, а также Индийский технологи-
20.
B. S. Perrin and R. W. Pastor, Biophys J. 111, 1248
ческий институт Гандинагара - за предоставлен-
(2016).
ные вычислительные мощности.
21.
C. Neale, C. Madill, S. Rauscher, et al., J. Chem.
Theor. Comput. 9, 3686 (2013).
КОНФЛИКТ ИНТЕРЕСОВ
22.
A. Grau-Campistany, E. Strandberg, P. Wadhwani,
Авторы заявляют об отсутствии у них кон-
et al., Sci. Rep. 5, 09388 (2015).
фликта интересов.
23.
A. Tuerkova, I. Kabelka, T. Králová, et al., Elife 9,
e47946 (2020).
ЭТИЧЕСКАЯ ДЕКЛАРАЦИЯ
24.
Y. Hu, S. K. Sinha, and S. Patel, Langmuir 31, 6615
Данная статья не содержит результатов каких-
(2015).
либо исследований, проведенных на животных
25.
W. Humphrey, A. Dalke, and K. Schulten, J. Mol.
кем-либо из авторов.
Graph. 14, 33 (1996).
26.
C. M. Shepherd, H. J. Vogel, and D. P. Tieleman, Bio-
СПИСОК ЛИТЕРАТУРЫ
chem. J. 370, 233 (2003).
1. M. Zasloff, Proc. Natl. Acad. Sci. USA 84, 5449
27.
A. Ramamoorthy, S. K. Kandasamy, D. K. Lee, et al.,
(1987).
Biochemistry 46, 965 (2007).
2. A. Catte, M. R. Wilson, M. Walker, et al., Soft Matter
28.
K. J. Bowers, E. Chow, H. Xu, et al., in Proc.
14, 2796 (2018).
ACM/IEEE Conf. on Supercomputing (SC06) (Associa-
3. H. W. Huang, Biochemistry 39, 8347 (2000).
tion for Computing Machinery, Tampa, FL, 2006).
4. K. J. Hallock, D. K. Lee, and A. Ramamoorthy, Bio-
29.
A. Maciejewski, M. Pasenkiewicz-Gierula, O. Cra-
phys. J. 84, 3052 (2003).
mariuc, et al., J. Phys. Chem. B. 118, 4571 (2014).
БИОФИЗИКА том 67
№ 2
2022
ВЗАИМОДЕЙСТВИЕ АНТИМИКРОБНОГО ПЕПТИДА
263
30.
J. Aittoniemi, H. de Wet, F. M. Ashcroft, et al., PLoS
46.
A. D. Cirac, G. Moiset, J. T. Mika, et al., Biophys. J.
Comput. Biol. 6, e1000762 (2010).
100, 2422 (2011).
31.
G. Bussi, D. Donadio, and M. Parrinello, J. Chem.
47.
J. A. Killian and G. von Heijne, Trends Biol. Sci. 25,
Phys. 126, 014101 (2007).
429 (2000).
32.
S. Nosé, J. Chem. Phys. 81, 511 (1984).
48.
A. E. Garcia and K. Y. Sanbonmatsu, Proc. Natl.
33.
W. G. Hoover, Phys. Rev. A 31, 1695 (1985).
Acad. Sci. USA 99, 2782 (2002).
34.
M. Parrinello and A. Rahman, J. App. Phys. 52, 7182
49.
T. Ghosh, S. Garde, and A. E. Garcia, Biophys. J. 85,
(1981).
3187 (2003).
50.
G. Xu, M. Wu, L. Wang, et al., Biochim. Biophys. Ac-
35.
U. Essmann, L. Perera, M. L. Berkowitz, et al., J.
ta 1788, 2497 (2009).
Chem. Phys. 103, 8577 (1995).
36.
P. A. Kollman, I. Massova, C. Reyes, et al., Acc.
51.
S. K. Kandasamy and R. G. Larson, Biophys. J. 90,
Chem. Res. 33, 889 (2000).
2326 (2006).
37.
M. D. Ghafari, I. Rasooli, and K. Khajeh, Int. J. Pept.
52.
K. M. Sanchez, G. Kang, B. Wu, et al., Biophys. J.
Res. Ther. 26, 2039 (2020).
100, 2121 (2011).
38.
U. Harzer and B. Bechinger, Biochemistry 39, 13106
53.
M. Jafari, F. Mehrnejad, and F. Doustdar, PLoS One
(2000).
10, e0187216 (2017).
39.
S. Saha, E. Panieri, S. Suzen, and L. Saso, J. Membr.
54.
J. A. Lundbæk, S. A. Collingwood, and O. S. Anders-
Biol. 253, 57 (2020).
en, J. Roy. Soc. Interface 7, 373 (2010).
40.
M. Bak, R. Schultz, T. Vosegaad, et al., J. Magn.
55.
C. M. Shepherd, H. J. Vogel, and D. P. Tieleman, Bio-
Reson. 154, 28 (2002).
chem. J. 370, 233 (2003).
41.
L. T. Nguyen, E. F. Haney, and H. J. Vogel, Trends
56.
K. J. Hallock, D-K. Lee, J. Omnaas, et al., Biophys J.
Biotechnol. 29, 464 (2011).
83, 1004 (2002).
42.
M. Zorko, and U. Langel, Adv. Drug Delivery Rev. 57,
57.
A. Catte, M. R. Wilson, M. Walker et al., Soft Mat. 14,
529 (2005).
2796 (2018).
43.
W. C. Wimley, and K. Hristova, J. Membr. Biol. 239,
58.
M. Bachar and O. M. Becker, Biophys. J. 78, 1359
27 (2011).
(2000).
44.
L. Yang, T. A. Harroun, T. M. Weiss, et al., Biophys. J.
59.
T. M. Weiss, P. C. van der Wel, J. A. Killian, et al.,
81, 1475 (2001).
Biophys. J. 84, 379 (2003).
45.
D. Sengupta, H. Leontiadou, A. E. Mark, et al.,
60.
S. H. Park and S. J. Opella, J. Mol. Biol. 350, 310
Biophys. Acta Biomembr. 1778, 2308 (2008).
(2005).
Association of Antimicrobial Peptide Lasioglossin-III with Model Lipid Bilayers
S. Saha, P. Ratrey, and A. Mishra
Department of Materials Science and Engineering, Indian Institute of Technology Gandhinagar,
Palaj, Gandhinagar, Gujarat, India
Lasioglossin-III is a small cationic peptide identified in the venom of the Lasioglossum laticeps and is reported
to have a potent antimicrobial property with low hemolytic activity. Presently, we explore the nature of inter-
actions and permeability of lasioglossin-III in different orientations to lipid bilayers using molecular dynam-
ics simulations. We performed molecular dynamics simulations of lasioglossin-III at the surface and interior
of the pure DMPC and 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine bilayers to determine the mem-
brane-peptide interactions and their effects. lasioglossin-III was found to interact with both the lipid bilayers
at different rates and showed destabilization at the membrane/ water interface with respect to starting state of
the peptide. These results suggest the specific interactions between the lysine residues of the peptide with the
lipid head group regions, responsible for the overall stability of the peptide in the lipid bilayers. In addition,
the results indicate a consistently higher tilt and binding free energy with a decrease in bilayer thickness of
DMPC bilayers than in the 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine bilayers due to the peptide
insertion.
Keywords: lasioglossin-III, POPC, DMPC, molecular dynamics simulations
БИОФИЗИКА том 67
№ 2
2022