БИОФИЗИКА, 2022, том 67, № 2, с. 283-288
БИОФИЗИКА КЛЕТКИ
УДК 57.087.1
ГЛАЗНОЙ ИМАГИНАЛЬНЫЙ ДИСК ДРОЗОФИЛЫ КАК МОДЕЛЬ
ДЛЯ ОБРАБОТКИ ИЗОБРАЖЕНИЙ ЭПИТЕЛИАЛЬНЫХ ТКАНЕЙ
© 2022 г. К.Н. Козлов*, Е.В. Голубкова**, Л.А. Мамон**, М.Г. Самсонова*, С.Ю. Суркова*
*Санкт-Петербургский политехнический университет Петра Великого,
195251, Санкт-Петербург, Политехническая ул., 29
**Санкт-Петербургский государственный университет,
199034, Санкт-Петербург, Университетская наб. 7/9
E-mail: surkova_syu@spbstu.ru
Поступила в редакцию 14.01.2022 г.
После доработки 14.01.2022 г.
Принята к публикации 21.01.2022 г.
Для получения точной информации по характеру экспрессии генов на основе конфокальных изоб-
ражений нужно четко выявлять границы отдельных клеток. Помимо этого, анализ формы клеток
необходим для понимания морфогенетических процессов, таких как растяжение, сжатие и форми-
рование складок тканей. Показательной модельной системой, иллюстрирующей такие процессы,
является имагинальный зачаток глаза (глазной имагинальный диск) плодовой мушки дрозофилы.
В данной работе мы разработали ряд процедур количественного анализа клеточной структуры глаз-
ного диска на основе использования флуоресцентного мечения эпителиального слоя различными
маркерами. Все методы обработки изображений реализованы в созданной авторами программе
ProStack. Описанные в статье методы могут быть адаптированы для количественной оценки формы
клеток и анализа экспрессии генов в других эпителиальных тканях.
Ключевые слова: обработка изображений, эпителиальные клетки, имагинальный глазной диск, дрозо-
фила
DOI: 10.31857/S0006302922020119
нальный зачаток глаза (глазной имагинальный
Пласты эпителиальных клеток выстилают
диск) плодовой мушки дрозофилы. Глазной диск
многие органы и полости тела. В частности, одно-
слойный эпителий характерен для многих отде-
представляет собой эпителиальную структуру,
состоящую из двух слоев. Интерес представляет
лов пищеварительного тракта, почечных каналь-
слой, называемый disc proper [1]. Это однослой-
цев, протоков желез. Получение конфокальных
изображений высокого разрешения позволяет
ный столбчатый эпителий, который в ходе разви-
выявить патологии, связанные с изменением экс-
тия личинки дрозофилы третьего возраста преоб-
прессии генов, а также детектировать нарушения
разуется в четкую структуру будущих фоторецеп-
формы, размеров и структуры клеток в ходе раз-
торов посредством генных взаимодействий и
вития.
морфологических преобразований [2, 3]. Специ-
фикация фоторецепторов происходит в постери-
Для извлечения точной информации по харак-
орно-антериорном направлении посредством
теру экспрессии генов нужно четко определять
прохождения морфогенетической борозды (МБ),
границы отдельных клеток, составляющих слой
эпителиального впячивания вдоль диска (рис. 1).
эпителия. Очень часто в ходе морфогенеза сосед-
Недифференцированные эпителиальные клетки
ние клетки могут выполнять принципиально раз-
в антериорной части диска после прохождения
ные функции. При этом на клетки могут действо-
вать одни и те же диффундирующие морфогены,
МБ дифференцируются в различные типы фото-
однако в каждой клетке будут экспрессироваться
рецепторов и других клеток, составляющих ом-
матидий - светочувствительную единицу глаза. В
свои транскрипционные факторы.
антериорной области перед фронтом МБ проис-
Показательной модельной системой, иллю-
ходит апикальное сужение клеток, которое кон-
стрирующей такие процессы, является имаги-
тролируется геном hedgehog (hh) [4]. Широкий
Сокращения: МБ - морфогенетическая борозда, Fas III -
градиент hh способствует движению МБ, а также
фасциклин III, DAPI - 4′,6-диамидино-2-фенилиндол.
дифференцировке будущих фоторецепторов.
283
284
КОЗЛОВ и др.
Рис. 1. Примеры конфокальных изображений экспрессии генов в глазном имагинальном диске. Показана экспрессия
пронейрального гена ato и маркера латеральных клеточных стенок Fas III. Направление, в котором проходит
дифференцировка, показано белой стрелкой. МБ - морфогенетическая борозда, движущаяся в постериорно-антериорном
направлении. На изображениях в области дифференцировки видно формирование структурированного паттерна
фоторецепторов.
При этом лишь некоторые клетки экспрессируют
мРНК оценивали методом цепной реакции ги-
пронейральный ген atonal (ato) - это будущие фо-
бридизации in situ ([8], см. подробный протокол в
торецепторы R8 (рис. 1). Генная сеть, регулирую-
работе
[9]). После флуоресцентного мечения
щая ген ato, задает четкое пространственное рас-
глазные имагинальные диски заключали на стек-
положение этих клеток, что в дальнейшем опре-
ла в среду ProLong Gold Antifade Mountant (Ther-
деляет упорядоченный паттерн сложного глаза
mo Fisher). Для окрашивания ядер использовали
[5].
ProLong Gold Antifade Mountant with DAPI (Ther-
mo Fisher Scientific, США). Изображения получа-
В данной работе мы суммируем методы обра-
ли с помощью конфокального микроскопа Leica
ботки изображений глазного диска дрозофилы,
TSC SP5 (Leica Microsystems, Германия) и микро-
разработанные нами для решения различных за-
скопа Zeiss 700 (Carl Zeiss, Германия).
дач. Как описано выше, в ходе дифференцировки
глазного диска его клетки меняют форму и взаим-
ное расположение. Для анализа механизмов спе-
РЕЗУЛЬТАТЫ
цификации фоторецепторов в глазном диске
Для извлечения количественной информации
важно, во-первых, определить границы клеток и
их форму, а также, во-вторых, определить значе-
из наборов изображений развивающегося глаза
ния уровней экспрессии генов в каждой клетке с
дрозофилы был разработан ряд методов, включа-
высокой точностью. Все процедуры обработки
ющих определение контуров и формы клеток, а
также извлечение количественной информации
изображений реализованы в разработанной авто-
по экспрессии генов в каждой клетке.
рами программе ProStack [6] и могут быть адапти-
рованы для анализа морфогенеза других эпители-
Обработку изображений проводили с помо-
альных тканей.
щью разработанной авторами программы Pro-
Stack, ранее применявшийся для обработки изоб-
ражений эндоцитарных везикул в клетках HeLa и
МАТЕРИАЛЫ И МЕТОДЫ
эмбриона дрозофилы на стадии бластодермы [6,
9-11].
Флуоресцентное окрашивание белкового про-
дукта фасциклин III (Fasciclin III, Fas III) прово-
Создание маски клеточной структуры на основе
дили у личинок D. melanogaster третьего возраста
экспрессии различных маркеров. На первом этапе
методом непрямой иммунофлуоресценции с по-
строилась бинарная маска всей области глазного
мощью первичных антител anti-Fas III (Develop-
диска для приведения всех изображений трехмер-
mental Studies Hybridoma Bank, NIH, США) и вто-
ного набора к единой ориентации. Далее для
ричных антител Alexa Fluor
405 (Invitrogen,
определения точных границ и формы клеток осу-
США). F-актин
[7] метили с помощью
ществлялось построение масок клеточной струк-
фаллоидина, конъюгированного с FITC (Fluores-
туры. Точные данные о границах клеток и их вза-
cein Isothiocyanate labeled Phalloidin, Thermo Fish-
имном расположении позволяют правильно оце-
er Scientific, США) в соответствии с протоколом
нить уровни экспрессии генов в каждой клетке.
производителя. Экспрессию генов на уровне
Ниже описаны особенности сегментации изобра-
БИОФИЗИКА том 67
№ 2
2022
ГЛАЗНОЙ ИМАГИНАЛЬНЫЙ ДИСК ДРОЗОФИЛЫ
285
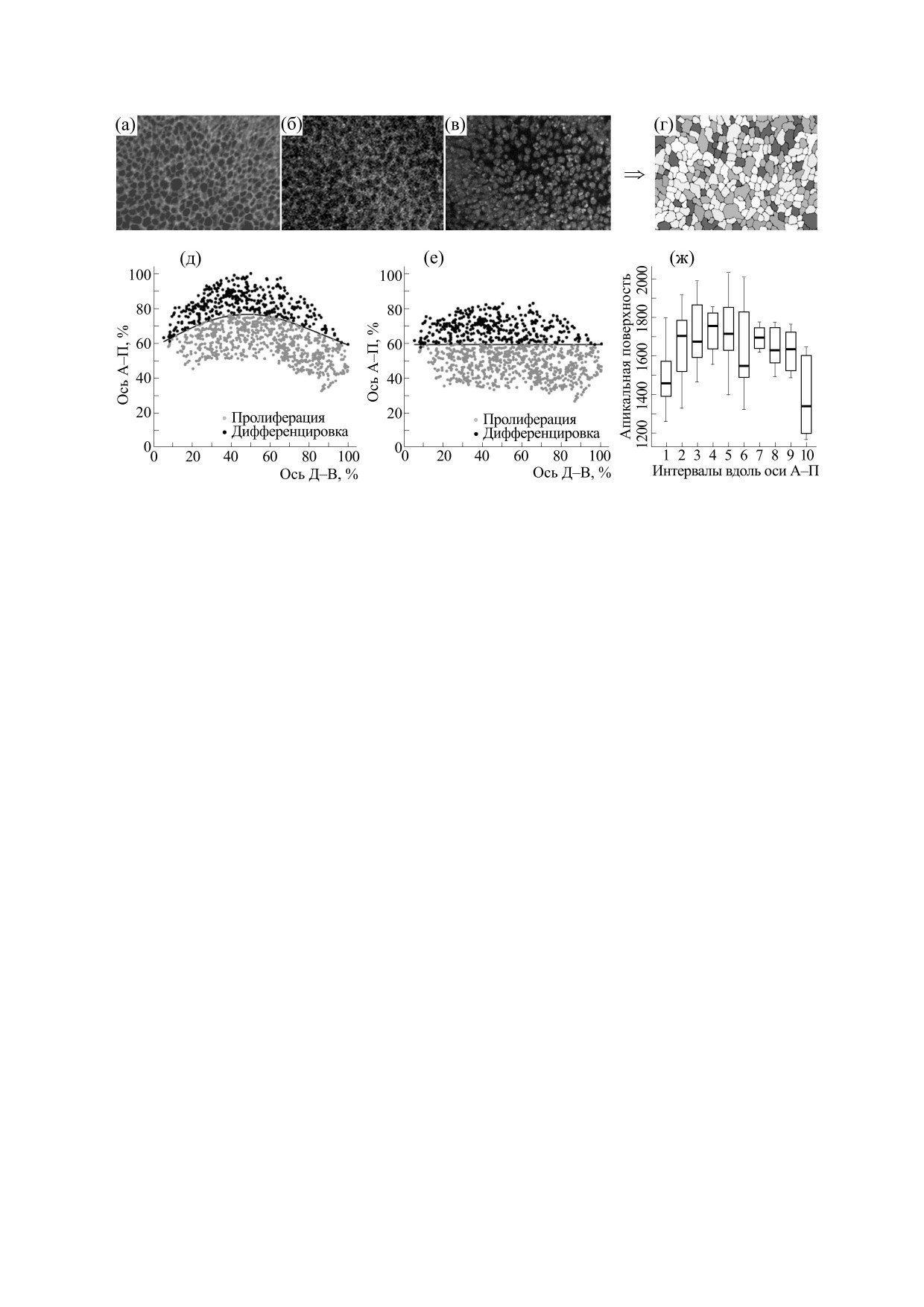
Рис. 2. Построение масок клеточной структуры и анализ формы клеток с помощью мечения глазного диска различными
маркерами. Показаны примеры конфокальных изображений клеток глазных дисков, окрашенных Fas III (а), фаллоидином
(б) и DAPI (в). В результате обработки в каждом случае получаются изображения контуров клеток (г). Различные оттенки
серого на рисунке (г) обозначают клетки, имеющие разную форму (разное число сторон). После анализа формы и
положения каждой клетки в глазном диске производится аппроксимация морфогенетической борозды квадратичными
сплайнами и пространственная регистрация всех полученных изображений (д, е). Для выявления степени апикального
сужения клеток в зависимости от их пространственного положения относительно МБ данные вдоль антериорно-
постериорной оси разделены на десять интервалов и для каждого рассчитана средняя площадь поверхности клеток (ж).
жений эпителиальных клеток на основе мечения
Мечение актинового цитоскелета при помощи
различными маркерами.
фаллоидина. Данный тип окрашивания широко
применяется в биологии è применительно к на-
Мечение глазных дисков фасциклином III.
шей задаче позволяет выявлять клетки глазного
Fas III - это мембранный гликопротеин, кото-
диска, однако их контуры обозначены нечетко
рый в ходе развития личинки дрозофилы экс-
(рис. 2б). В этом случае метод морфологической
прессируется в нейронах и имагинальных дисках,
реконструкции, упомянутый выше, наиболее
где может служить маркером латеральных клеточ-
эффективен.
ных стенок [12, 13]. В глазном диске Fas III хоро-
шо выявляет границы клеток [14] (рис. 1). Однако
Использование ДНК-маркера 4',6-диамидино-2-
при таком методе окрашивания изображения об-
фенилиндола. Этот тип окрашивания (рис. 2в) мо-
ласти дифференцировки зачатка глаза (рис. 2а)
жет быть успешно применен сразу по нескольким
различаются в апикально-базальном направле-
причинам. Во-первых, при анализе экспрессии
нии. На апикальных оптических срезах лучше
генов на уровне белка транскрипционные факто-
видны границы всего омматидия, а на базальных
ры, такие как Ato, локализуются в клеточном яд-
срезах - границы отдельных клеток, составляю-
ре. Следовательно, 4',6-диамидино-2-фенилин-
щих омматидий. При этом в области пролифера-
дол (4',6-diamidino-2-phenylindole, DAPI) может
ции границы клеток одинаково четко видны на
дать наиболее четкое представление о характере
всех срезах. В ходе обработки экспериментальные
локализации таких белков. Во-вторых, в случаях
изображения в градациях серого подвергаются
загибов и деформации клеточных стенок, обу-
преобразованию выравнивания гистограммы, за-
словленных фиксацией и заключением препара-
тем размер изображения увеличивается для более
тов глазных дисков в среду перед микроскопией,
точного определения границ объектов. Метод
окрашивание ядер помогают разделить области
морфологической реконструкции [15], применя-
соседних клеток. Помимо этого, мечение DAPI
ется к исходному и инвертированному изображе-
позволяет восстановить клеточную структуру в
нию, максимум между результирующими изобра-
отсутствие других маркеров. В этом случае изоб-
жениями используется для определения границ
ражения ядер клеток подвергаются выравнива-
объектов [11].
нию интенсивности внутри объектов с помощью
БИОФИЗИКА том 67
№ 2
2022
286
КОЗЛОВ и др.
медианной фильтрации и последовательности
Вначале проводили пространственную реги-
морфологических преобразований расширения и
страцию данных так, чтобы МБ, а также антери-
сужения с несколькими структурными элемента-
орные и постериорные полюса всех дисков совпа-
ми. Дальнейшее сглаживание включает локаль-
дали по координате. Для этого МБ аппроксими-
ное выравнивание гистограммы и морфологиче-
ровали квадратичными сплайнами (рис. 2д,е).
ское размыкание. Применение преобразования
Области пролиферации и дифференцировки раз-
водоотлива позволяет восстановить границы об-
деляли на пять интервалов каждую, что составило
ластей, примыкающих к объектам-ядрам. Дан-
по 10 интервалов на каждый диск. Интервал № 1
ные области после коррекции границ путем мор-
включал антериорный полюс диска, а интервал
фологической реконструкции инвертированного
№ 10 - постериорный полюс. Ось y на графиках,
изображения определяются как клетки.
показанных на рис. 2ж, соответствует антериор-
но-постериорной оси и перпендикулярна МБ.
Гексагональная сетка. В случае невозможности
Соответственно каждый интервал включает клет-
определить границы клеток с использованием
ки, у-координата центроида которых попадает в
биологического маркера строится искусственная
этот интервал. На этом этапе мы пренебрегаем х-
клеточная структура, отражающая биологически
координатой (вдоль дорсо-вентральной оси) и
обусловленную гексагональную форму клеток
для каждого глазного диска получаем среднюю
[16]. С помощью наложения этой структуры на
площадь апикальной поверхности клеток для
изображения глазного диска извлекается инфор-
каждого интервала. На рис. 2ж мы видим, что
мация по уровням экспрессии каждого гена.
апикальная поверхность клеток сокращается в
Анализ формы клеток. Одним из инструментов
интервале № 6, что соответствует антериорной
анализа клеточных перестроек в ходе морфогене-
области перед МБ. Сужение в интервалах № 1 и
за является создание вершинных моделей (vertex
№ 10 обусловлено погрешностями эксперимен-
models). Вершинные модели связывают измене-
тальных изображений по краям дисков.
ния формы клеток, обусловленные внутрикле-
Извлечение количественных данных по экспрес-
точными процессами, с растяжением, сжатием и
сии генов. Перед сегментацией изображений кар-
формированием складок тканей, что в итоге
тин экспрессии генов на уровне мРНК вначале
определяет форму всего организма [17].
изображения, представленные в градациях серо-
Имагинальные диски дрозофилы представля-
го, проходят несколько этапов улучшения, таких
ют собой удобную модельную систему для такого
как удаление дробового шума, медианную филь-
анализа [18]. В ходе спецификации фоторецепто-
трацию с несколькими структурными элемента-
ров глазного диска основным морфогенетиче-
ми, локальное выравнивание гистограммы, мор-
ским процессом является движение МБ вдоль
фологическое размыкание. Далее проводится де-
эпителиального пласта. Для определения степени
текция частиц, включающих одну или несколько
апикального сужения клеток в зоне МБ требуется
молекул, путем определения контуров по методу
выявлять точную площадь апикальной поверхно-
Кэнни с последующим заполнением, разделени-
сти клеток и количество соседних клеток.
ем через преобразование расстояния и пороговую
фильтрацию [16]. Особое внимание уделяется
Был разработан алгоритм для определения ко-
контролю качества сегментации, что включает
личества сторон многоугольника, наилучшим об-
цензурирование частиц по размеру и интенсив-
разом описывающего форму клетки с заданной
ности, отслеживание частиц на нескольких сре-
погрешностью. Из геометрического центра пик-
зах и определение уровня фонового сигнала.
селей клетки с шагом в один градус проводили ра-
диус-вектор до границы клетки, в результате чего
Количественные данные по экспрессии генов
получали табличную функцию с 360 отсчетами.
на уровне мРНК получают путем анализа интен-
Количество сторон многоугольника вычисляли
сивности, локализации и количества частиц в
как число максимумов этой функции, которое
каждой клетке. Для изображений, полученных
определяли как количество перемен знака ее ко-
методом иммунофлуоресцентного окрашивания,
нечно-разностной производной при условии от-
рассчитывают средний уровень флуоресценции в
личия значения в найденной точке от соседних не
каждой клетке и позицию ее центроида.
меньше, чем на величину заданной погрешности.
Положение МБ определяют на основе экс-
Таким образом, клетки были классифицированы
прессии маркеров клеточной структуры либо ге-
как имеющие от трех до девяти сторон (рис. 2г).
нов, ответственных за дифференцировку глазно-
Для выявления степени апикального сужения
го диска (например, в позиции перекрывания об-
клеток в зависимости от их пространственного
ластей экспрессии hairy (h) и ato). Форма МБ
положения относительно МБ использовали на-
аппроксимируется сплайнами, при этом число
бор количественных данных для выборки глаз-
степеней свободы и другие параметры подбирают
ных дисков (на рис. 2ж показаны усредненные
так, чтобы кривая визуально совпадала с позици-
данные для семи дисков).
ей МБ на изображениях. Для пространственной
БИОФИЗИКА том 67
№ 2
2022
ГЛАЗНОЙ ИМАГИНАЛЬНЫЙ ДИСК ДРОЗОФИЛЫ
287
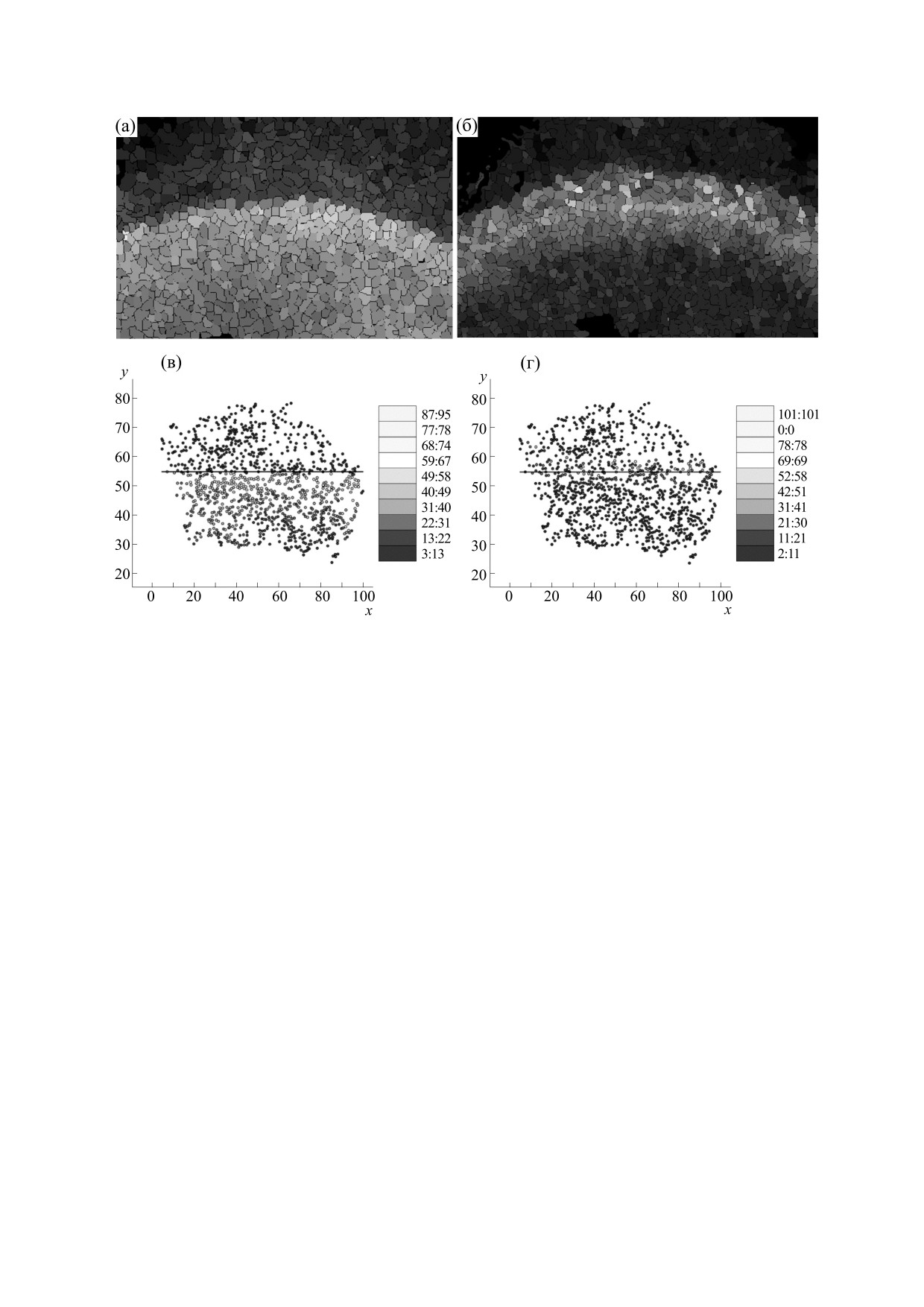
Рис. 3. Получение количественных данных по экспрессии генов. Показаны средние уровни экспрессии h (а,в) и ato (б,г) в
каждой клетке, представленные в виде реконструированных изображений (а,б) и графиков (б,г).
регистрации наборов изображений всех глазных
развивающемся имагинальном глазном диске
дисков производится выпрямление МБ путем аф-
дрозофилы.
финного преобразования (рис. 3).
Количественный анализ проводили с исполь-
На рис. 3 представлены количественные дан-
зованием ряда маркеров клеточных стенок и ядер.
ные по экспрессии h (рис. 3a,в) и ato (рис. 3б,г),
На основе этого оценивали форму и расположе-
усредненные в каждой клетке, в виде реконструи-
ние клетки, а также извлекали точную информа-
рованных изображений (рис. 3а,б) и графиков
цию по уровням экспрессии генов. Так как экс-
(рис. 3б,г).
прессия каждого из маркеров имеет свои особен-
ности, наиболее точное построение масок
ЗАКЛЮЧЕНИЕ
клеточных структур достигается путем окрашива-
ния глазных дисков одновременно и маркером
Развитие дрозофилы является широко исполь-
клеточных стенок, и DAPI.
зуемой моделью для изучения процессов проли-
ферации и дифференцировки клеток. Этот мо-
В публикациях, посвященных механизмам
дельный объект позволяет исследовать характер
формирования паттерна в имагинальных дисках,
экспрессии генов как в фиксированных, так и в
методы обработки изображений нередко нацеле-
живых тканях. Как известно, многие ключевые
ны либо на получение данных по экспрессии ге-
регуляторы морфогенетических процессов, такие
нов высокого разрешения, либо на детальное изу-
как Hedgehog и Notch, были впервые выявлены у
чение динамики клеточной структуры [16, 18].
дрозофилы.
Анализ формы клеток в сочетании с получением
В этой работе нами разработаны и реализова-
точных данных по экспрессии генов позволяет
ны процедуры анализа клеточной структуры эпи-
всесторонне исследовать механизмы формирова-
телиальной ткани на примере динамического
ния паттерна. Описанные в статье методы могут
процесса дифференцировки фоторецепторов в
быть адаптированы для количественной оценки
БИОФИЗИКА том 67
№ 2
2022
288
КОЗЛОВ и др.
клеточной структуры и анализа экспрессии генов
4.
D. Corrigall, R. F. Walther, L. Rodriguez, et al.,
в других эпителиальных тканях.
Devel. Cell 13 (5), 730 (2007). DOI: 10.1016/j.dev-
cel.2007.09.015
5.
B. J. Frankfort and G. Mardon, Development 129,
БЛАГОДАРНОСТИ
1295 (2002).
Изображения картин экспрессии генов были
6.
K. Kozlov, A. Pisarev, J. Kaandorp, et al., in Abstr.
получены в Центре коллективного пользования
Book of the 9th Int. Conf. Syst. Biol. (Goteborg, 2008),
«Хромас» СПбГУ (Санкт-Петербург, Россия) и в
p. 191.
Центре микроскопии Университета Южной Ка-
7.
V. DesMarais, R. J. Eddy, V. P. Sharma, et al., Bio-
лифорнии (Лос-Анджелес, США).
Techniques 66, 113 (2019). DOI: 10.2144/btn-2018-
0112
8.
H. M. Choi, V. A. Beck, N. A. Pierce, et al., ACS Na-
ФИНАНСИРОВАНИЕ РАБОТЫ
no 8, 4284 (2014). DOI: 10.1021/nn405717p
Работа выполнена при финансовой поддержке
9.
S. Surkova, A. Sokolkova, K. Kozlov, et al., Devel. Biol.
Российского фонда фундаментальных исследова-
448, 48 (2019). DOI: 10.1016/j.ydbio.2019.01.006
ний (грант № 20-04-01047-a).
10.
S. Surkova, E. Golubkova, Manu, et al., Devel. Biol.
376,
99
(2013).
DOI: DOI:
10.1016/j.yd-
bio.2013.01.008
КОНФЛИКТ ИНТЕРЕСОВ
11.
K. Kozlov, V. Kosheverova, R. Kamentseva, et al., J.
Авторы заявляют об отсутствии конфликта
Bioinform. Comput. Biol. 15, 1750008 (2017). DOI:
интересов.
10.1142/S0219720017500081
12.
P. M. Snow, A. J. Bieber, and C. S. Goodman, Cell 59,
313 (1989). DOI: 10.1016/0092-8674(89)90293-6
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
13.
A. Gavish, A. Shwartz, A. Weizman, et al., Nat. Com-
Настоящая работа не содержит описания ка-
mun. 7, 10461 (2016). DOI: 10.1038/ncomms10461
ких-либо исследований с использованием людей
14.
S. Surkova, J. Görne, S. Nuzhdin, et al., Devel. Biol.
и животных в качестве объектов.
476, 41 (2021). DOI: 10.1016/j.ydbio.2021.03.005.
15.
L. Vincent, IEEE Trans. Image Process. 2, 176 (1993).
DOI: 10.1109/83.217222
СПИСОК ЛИТЕРАТУРЫ
16.
S. Ali, S. A. Signor, K. Kozlov, et al., Evolution & De-
1. R. Smith-Bolton, Adv. Wound Care 5 (6), 251 (2016).
velopment 21, 157 (2019). DOI: 10.1111/ede.12283
DOI: 10.1089/wound.2014.0547
17.
S. Alt, P. Ganguly, and G. Salbreux, in Phil. Trans.
2. J. Y. Roignant and J. E Treisman, Int. J. Devel. Biol.
Roy. Soc. Lond. Ser. B, Biological Sciences 372,
53, 795 (2009). DOI: 10.1387/ijdb.072483jr
20150520 (2017). DOI: 10.1098/rstb.2015.0520
3. J. E. Treisman, WIREs Dev. Biol. 2 (4), 545 (2013).
18.
L. Sui, S. Alt, M. Weigert, et al., Nature Commun. 9,
DOI: 10.1002/wdev.100
4620 (2018). DOI: 10.1038/s41467-018-06497-3
Drosophila Eye Imaginal Disc as a Model for Processing Epithelial Tissue Images
K.N. Kozlov*, E.V. Golubkova**, L.A. Mamon**, M.G. Samsonova*, and S.Yu. Surkova*
*Peter the Great St. Petersburg Polytechnic University, Polytekhnicheskaya ul. 29, St. Petersburg, 195251 Russia
**St. Petersburg State University, Universitetskaya nab. 7/9, St. Petersburg, 199034 Russia
Extraction of quantitative information on gene expression from confocal images requires the precise detec-
tion of boundaries of the individual cells. In addition, the cell shape analysis is essential for understanding
morphogenetic processes such as tissue stretching, contraction and folding. Drosophila eye imaginal disc is
a widely used model system illustrating such processes. In this work, we developed a number of methods for
quantitative analysis of the eye disc cellular structure based on the fluorescent tissue labeling with different
markers. All image processing procedures are implemented in the ProStack package developed by the au-
thors. The methods described here can be adapted for cell shape quantification and gene expression analysis
in other epithelial tissues.
Keywords: image processing, epithelial cells, eye imaginal disc, Drosophila
БИОФИЗИКА том 67
№ 2
2022