БИОФИЗИКА, 2022, том 67, № 2, с. 343-353
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
УДК 57.07
ИССЛЕДОВАНИЕ СУММАРНОГО УРОВНЯ ГЛУТАМАТА И ГЛУТАМИНА
В ЗРИТЕЛЬНОЙ КОРЕ ЧЕЛОВЕКА ПОСЛЕ КОРОТКОЙ АКТИВАЦИИ
МЕТОДОМ ФУНКЦИОНАЛЬНОЙ МАГНИТНО-РЕЗОНАНСНОЙ
СПЕКТРОСКОПИИ
© 2022 г. А. Яковлев*, **, ***, А. Мажурцев*, ***, ****, П. Меньщиков**, *****,
М. Ублинский*, ***, И. Мельников*, Д. Куприянов*****,
Т. Ахадов*, ****, Н. Семенова*, **, ***, ****
*НИИ неотложной детской хирургии и травматологии, 119180, Москва, ул. Большая Полянка, 22
**Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН,
119991, Москва, ул. Косыгина, 4
***Институт биохимической физики им. Н.М. Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
****Московский государственный университет имени М.В. Ломоносова, 119991, Москва, Ленинские горы, 1/1
*****Philips Healthcare, 123022, Москва, ул. Сергея Макеева, 13
E-mail: yakovlevalekcej@bk.ru
Поступила в редакцию 08.09.2021 г.
После доработки 14.01.2022 г.
Принята к публикации 19.01.2022 г.
Методом функциональной магнитно-резонансной спектроскопии в магнитном поле 3 Тл с времен-
ным разрешением 2 с исследована динамика суммарного уровня глутамата и глутамина в затылоч-
ной коре мозга человека в периоде зависящего от уровня оксигенации крови ответа на короткую
(3 с) зрительную стимуляцию. Обнаружено статистически достоверное увеличение содержания глу-
тамата и глутамина на первой и пятнадцатой секундах после предъявления 25 испытуемым волон-
терам изображения шахматной доски, мерцающей с частотой 4 Гц. Корреляция между максимумом
амплитуды зависящего от уровня оксигенации крови ответа и максимумами уровня глутамата и глу-
тамина не выявлена. Изменения суммарного уровня глутамата и глутамина во времени после сти-
мула не соответствуют скорости оборота глутамин-глутаматного цикла, но согласуются с времен-
ными характеристиками везикулярного цикла: высвобождением глутамина из везикул и его обрат-
ным захватом. Таким образом, можно полагать, что обнаруженная динамика глутамата и глутамина
обусловлена не метаболическими превращениями в цикле нейромедиаторов, а изменением по-
движности глутамина при выходе из везикул и обратной упаковке.
Ключевые слова: 1H-МРС, глутамат, PRESS, зрительная стимуляция, короткий стимул.
DOI: 10.31857/S000630292202017X
щего нейромедиатора глутамата (Glu)) в мозге
Функциональная
1Н-магнитно-резонансная
человека представляет собой важнейшую харак-
спектроскопия (фМРС) представляет собой
единственный метод неинвазивной оценки изме-
теристику, необходимую при оценке функцио-
нений концентраций метаболитов в ответ на
нального состояния центральной нервной систе-
нейроактивацию. Измерение концентраций ос-
мы в норме и патологии. Основные нейромедиа-
новных нейромедиаторов (тормозного нейроме-
торы присутствуют в мозге в миллимолярных
диатора γ-аминомасляной кислоты и возбуждаю-
концентрациях, что достаточно для детектирова-
ния их методами магнитно-резонансной спек-
троскопии. Из всех аминокислот Glu имеет са-
Сокращения: фМРС - функциональная 1H-магнитно-ре-
зонансная спектроскопия, Glu - глутамат, Gln - глута- мую большую концентрацию в мозге человека [1].
мин, Glx - сумма глутамата и глутамина, BOLD-ответ -
Однако вследствие сходства его химической
ответ, зависящий от уровня оксигенации крови (от англ.
blood oxygenation level dependent), фМРТ - функциональ- структуры и структуры глутамина (Gln) 1Н-МР-
ласпартат, tNAA - сумма n-ацетиласпартата и n-ацетилас- сигналы этих соединений перекрываются в спек-
трах, регистрируемых на коммерческих МР-то-
партилглутамата, Cr - сумма креатина и фосфокреатина,
tCho - холинсодержащие соединения.
мографах, для которых разрешена напряжен-
343
344
ЯКОВЛЕВ и др.
ность постоянного магнитного поля В0 ≤ 3 Тл.
новным путем синтеза является аспартатамин-
Поэтому уровень Glu оценивают по интенсивно-
трансферазная реакция [18], в которой участвуют
сти суммарного сигнала протонов 4-СН2-группы
α-кетоглутарат и аспартат, а способом деграда-
ции - гидролиз глутаматдегидрогеназой с образо-
обоих веществ с химическим сдвигом δ в диапазо-
ванием α-кетоглутарата. Доказано, что нейроак-
не 2.3 - 2.45 м.д. [2]. Согласно работам [3-5] со-
тивация сопровождается активацией синтеза Gln
отношение интенсивностей этих сигналов Glu и
из глюкозы в астроцитах, затем в нейронах Gln
Gln, разрешающихся в поле 7 Тл, составляет в об-
превращается в Glu [19]. Изменение [Glu] под
ласти затылочной коры нормального мозга чело-
влиянием нейроактивации может происходить
века 3/1 [6].
также и другими путями [20, 21] - конверсией в
Исследования, проведенные в магнитном по-
тормозной нейромедиатор γ-аминомасляную
ле напряженностью 7 Тл, показали, что под влия-
кислоту, конденсацией с цистеином при синтезе
нием различных видов нейроактивации с исполь-
глутатиона или детоксикации аммиака через об-
зованием блочных парадигм активации наблюда-
разование Gln. Изменение содержания Glu
ется рост
[Glu]
[7-10]. Измерения
[Glu],
вследствие изменения активности метаболиче-
проведенные в поле 7 Тл при активации единич-
ских процессов, протекающих с участием Glu,
ными стимулами, отсутствуют, однако в поле 3 Тл
должно вызывать изменения концентраций дру-
показано, что единичные болевые и когнитивные
гих метаболитов, в том числе и детектируемых
стимулы увеличивают интенсивность суммарно-
методами МРС [21, 22].
го сигнала глутамата и глутамина (Glx) [11-14].
Количественно эффект зависит от длительности
Причиной изменения значений [Glu], изме-
активации и вида применяемого стимула. Напри-
ренных с помощью 1Н-МРС, может быть также
мер, при постоянной пятиминутной видеостиму-
изменение пула МР-видимого подвижного Glu,
ляции [15] посредством предъявления изображе-
вызванное высвобождением Glu из везикул и по-
ния мерцающей шахматной доски в зрительной
следующим его перемещением между различны-
коре наблюдается увеличение [Glu] на 10% по
ми компартментами. Показано, что при исполь-
сравнению с состоянием покоя, а при исследова-
зовании спинового эха для детектирования глута-
нии влияния периода зрительной стимуляции
мата везикулярный Glu, имея меньшее время
64 с эффект уменьшается - увеличение [Glu] со-
поперечной релаксации Т2, не дает вклада в сум-
ставляет от 1.5 до 3.0% [7, 9, 10]. Предъявление
марный сигнал Glu [23]. Это косвенно подтвер-
объектного стимула увеличивает в затылочной
ждается менее выраженными относительными
коре правого полушария уровень Glх на 11%
изменениями [Glu], наблюдающимся в работах с
больше, чем предъявление абстрактного стимула
использованием короткого времени эха (<20 мс)
[16]. Влияние коротких стимулов на [Glu] изуче-
[24]. Высвобождение Glu происходит из везикул,
но мало. Показано, что под действием короткого
и необходимым условием повторения этого про-
(<3 с) болевого стимула [12, 13] [Glх] увеличива-
цесса является наличие на мембране везикулы,
ется в островке по сравнению с состоянием покоя
заполненной Glu. Полный цикл, включающий в
и по разным данным либо возвращается к исход-
себя экзоцитоз Glu, эндоцитоз везикулы, ее по-
ному уровню в течение 3-6 с [13], либо нет [12].
полнение нейромедиатором и закрепление на
мембране, называется циклом синаптической ве-
Известным эффектом нейростимуляции явля-
ется ответ, зависящий от уровня оксигенации
зикулы [25].
крови (BOLD-ответ), косвенно отражающий
In vitro показано, что изменение постсинапти-
нейронную активность. Время BOLD-ответа на
ческого потенциала зависит от [Glu] в везикулах
единичный стимул составляет 20 с [17]. Приве-
[26]. Пополнение везикулярного Glu происходит
денные данные по измерению Glх после коротко-
через глутамат/глутаминовый (Glu-Gln) цикл, а
го стимула получены в условиях, когда период
также путем обратного захвата нейромедиатора
между стимулами составляет от 3 до 9 с, что суще-
из синаптической щели. Оборот Glu через цикл в
ственно меньше, чем период BOLD-ответа. Это
квазистационарном состоянии характеризуется
означает незавершенность вызванных стимулом
скоростью 0.3 мМ/мин, измеренной на длитель-
процессов, связанных с расширением сосудов,
ном промежутке времени (>10 мин) без актива-
увеличением притока оксигемоглобина и глюко-
ции методом 13C-МРС [27]. Известны быстрый и
зы. Можно ожидать, что динамика [Glх] в перио-
медленный путь обратного захвата Glu с времен-
де, превышающем период BOLD-ответа, позво-
ными константами < 1 c и 15 c соответственно
лит исследовать процесс оборота нейромедиатора
[26].
непосредственно в глутаматергических синапсах,
так как гемодинамический процесс будет за-
К настоящему времени процесс заполнения
вершен.
везикул in vivo на промежутке времени цикла си-
Изменения [Glu] зависят от соотношения ак-
наптической везикулы при активации еще не ис-
тивности процессов его синтеза и распада. Ос-
следовался.
БИОФИЗИКА том 67
№ 2
2022
ИССЛЕДОВАНИЕ СУММАРНОГО УРОВНЯ ГЛУТАМАТА И ГЛУТАМИНА
345
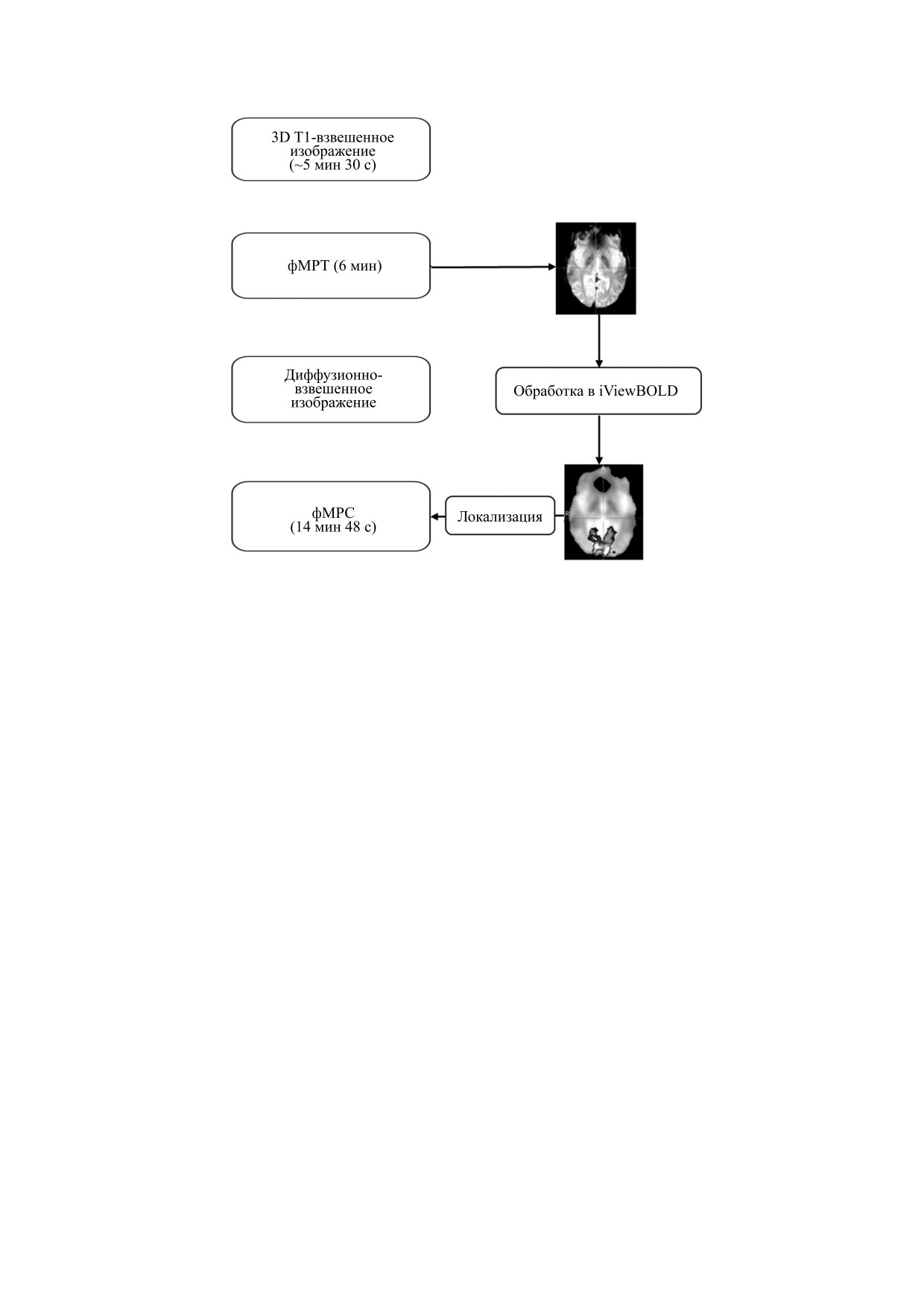
Рис. 1. Протокол исследования. Во время сбора данных DTI фМРТ-изображения обработаны на компьютере и получены
карты активации. Локализация спектроскопического вокселя проведена с учетом области активации.
BOLD, как известно, коррелирует с локальны-
ществляли при помощи системы InVivo SensaVue,
ми потенциалами поля, которые отражают элек-
позволяющей точно настраивать временные ха-
трическую активность мозга [28], а Glu является
рактеристики применяемого стимула. Стимул
основным возбуждающим нейромедиатором, ко-
предъявляли через монитор, расположенный по-
торый непосредственно деполяризует постси-
зади томографа. Изображение передавали волон-
наптические нейроны. Можно предположить,
теру через систему зеркал, прикрепляемую на ка-
что Glu динамически связан с BOLD. Целью дан-
тушку.
ной работы является измерение [Glu] в динамике
Получение данных. Сначала получены 3D-T1-
BOLD-ответа на короткий стимул на временном
взвешенные изображения (5 мин 30 с), затем -
интервале, соответствующем везикулярному
изображения, полученные методом функцио-
циклу.
нальной магнитно-резонансной томографии
(фМРТ) (6 мин 0 с). Объем интереса в фМРТ ло-
МАТЕРИАЛЫ И МЕТОДЫ
кализовали в затылочной доле по аксиальным
проекциям T2*-взвешенных изображений, полу-
Волонтеры. В исследовании участвовало
ченных с помощью градиентного эха. Использо-
28 здоровых волонтеров (23.6 ± 2.2 лет, 15 муж-
ваны следующие параметры: время повторе-
чин, 13 женщин). Для каждого волонтера выпол-
ния/время эха TR/TE = 3000/40 мс, угол отклоне-
нено предварительное диагностическое МРТ
ния FA = 90°, матрица 128 × 128 × 30, размер
(получены T1-, T2- и диффузионно-взвешенные
воксела 2.4 × 2.4 × 4.0 мм, количество накопле-
изображения). Заключение об отсутствии пато-
ний - 120, количество срезов - 30. Быстрая обра-
логии головного мозга получали от врача-радио-
ботка фМРТ выполнена для последующего пози-
лолога.
ционирования вокселя МРС (рис. 1) с использо-
Протокол исследования. Все данные получены
ванием программного обеспечения сканера
на МРТ-сканере
3Т Phillips Achieva dStream
iViewBOLD.
(Philips Health Care, Нидерланды) с использова-
нием 20-канальной приемной головной катушки
1H-МР-спектры регистрировали с помощью
SENSE HeadNeck coil, совместимой с зеркалом.
импульсной последовательности PRESS с ис-
Презентацию стимула и контроль внимания осу-
пользованием автоматического шиммирования
БИОФИЗИКА том 67
№ 2
2022
346
ЯКОВЛЕВ и др.
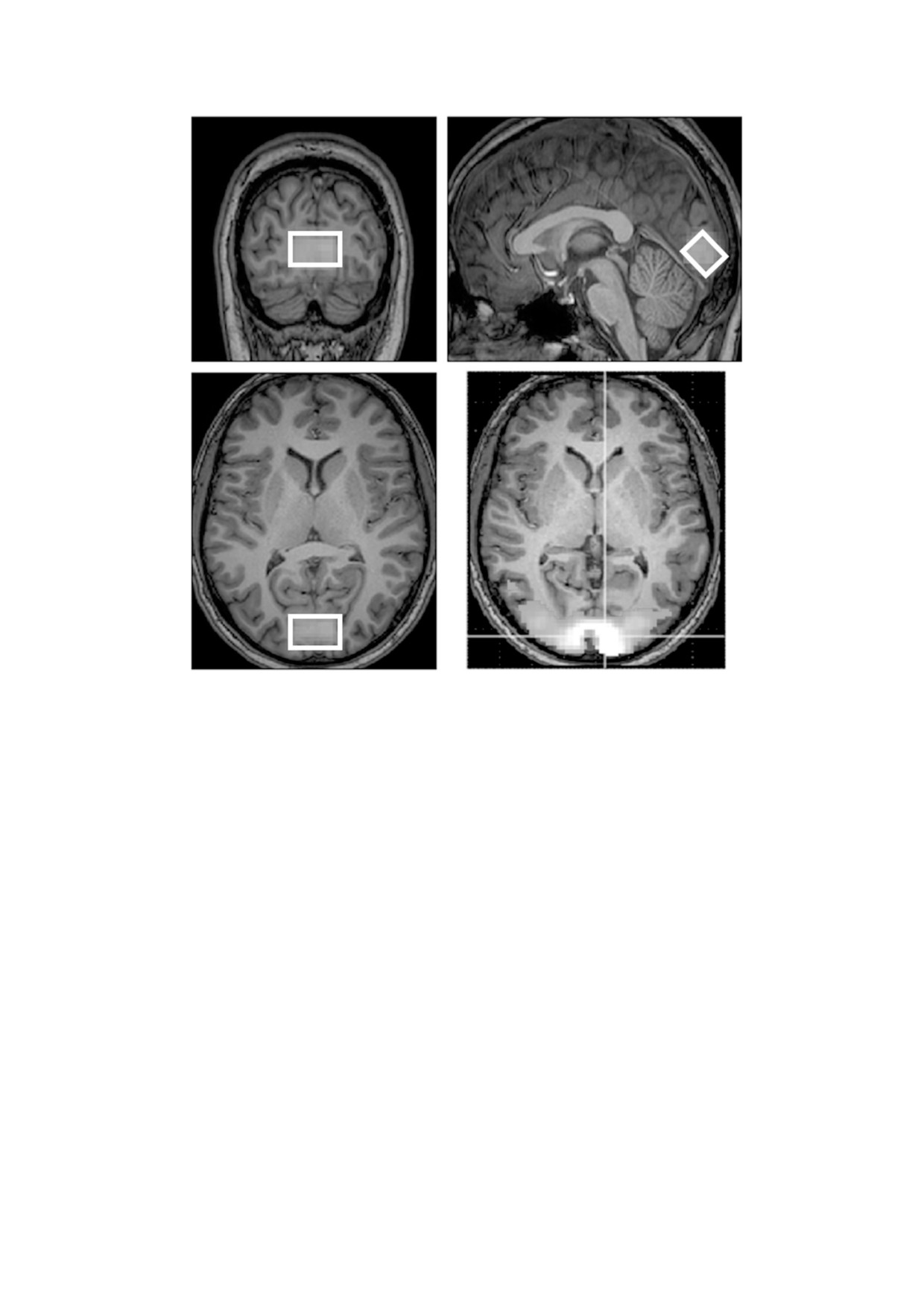
Рис. 2. Усредненная по всем участникам исследования локализация спектроскопического вокселя (прямоугольник белого
цвета). Области активации показаны в контрасте. Обе карты изображены на фоне 3D-T1-взвешенного изображения.
второго порядка, которое контролировали по
(примерно каждые две минуты). Возникающий
ширине сигнала воды (не более 16 Гц). Парамет-
при этом звуковой сигнал в аппаратной томогра-
ры регистрации спектров: TR/TE = 2000/35 мс,
фа контролировал оператор. Парадигма зритель-
количество накоплений - 444, размер вокселя -
ной стимуляции показана на рис. 3. Сначала был
20 × 30 × 20 мм (рис. 2), FA = 90°, ширина спектра
предъявлен черный экран, после чего показан
BW = 2000 Гц, подавление воды - MOIST.
стимул. За точку отсчета выбрана временная точ-
Общее время исследования составляло 40 мин.
ка за 1 с до начала предъявления стимула (-1 с).
Зрительная стимуляция. Стимуляцию проводи-
Измерение BOLD-сигнала в вокселе. Карты
ли в блоковой парадигме, предъявляемой для по-
активации получали путем обработки фМРТ-
лучения фМРТ-изображений - 15 раз (6 мин),
изображений в пакете SPM12 (SPM,
при исследовании динамики уровней метаболи-
RRID:SCR_007037). Обработка состояла в вырав-
тов - 37 раз (14 мин 48 с). Один блок зрительной
нивании изображений относительно друг друга
стимуляции состоял из трехсекундной демон-
(для исключения искажений вследствие движе-
страции изображения шахматной доски, мерцаю-
ния головы волонтера), совмещении с анатоми-
щей с частотой 4 Гц, и последующего предъявле-
ческим
3D-T1-изображением, нормировке на
ния темного экрана в течение 21 с (в сумме дли-
усредненную по времени регистрации интенсив-
тельность одного блока равнялась 24 с). Для
ность сигнала каждого вокселя, сведении к еди-
контроля внимания в процессе предъявления
ному анатомическому пространству MNI-152 и
стимула волонтеру давали задание - при каждом
сглаживании матрицей. Полученные данные
пятом появлении стимула нажимать на кнопку
подвергали статистическому анализу с примене-
БИОФИЗИКА том 67
№ 2
2022
ИССЛЕДОВАНИЕ СУММАРНОГО УРОВНЯ ГЛУТАМАТА И ГЛУТАМИНА
347
нием GLM (general linear model - общая линейная
модель) [29]. Зону, соответствующую спектро-
скопическому вокселю, фиксировали с помощью
маски, созданной в программном пакете Matlab
[30]. Маска представляет собой бинарное изобра-
жение с тем же разрешением и размерами, что
и фМРТ-изображения. Вокселям маски, попа-
дающим в объем спектроскопического вокселя,
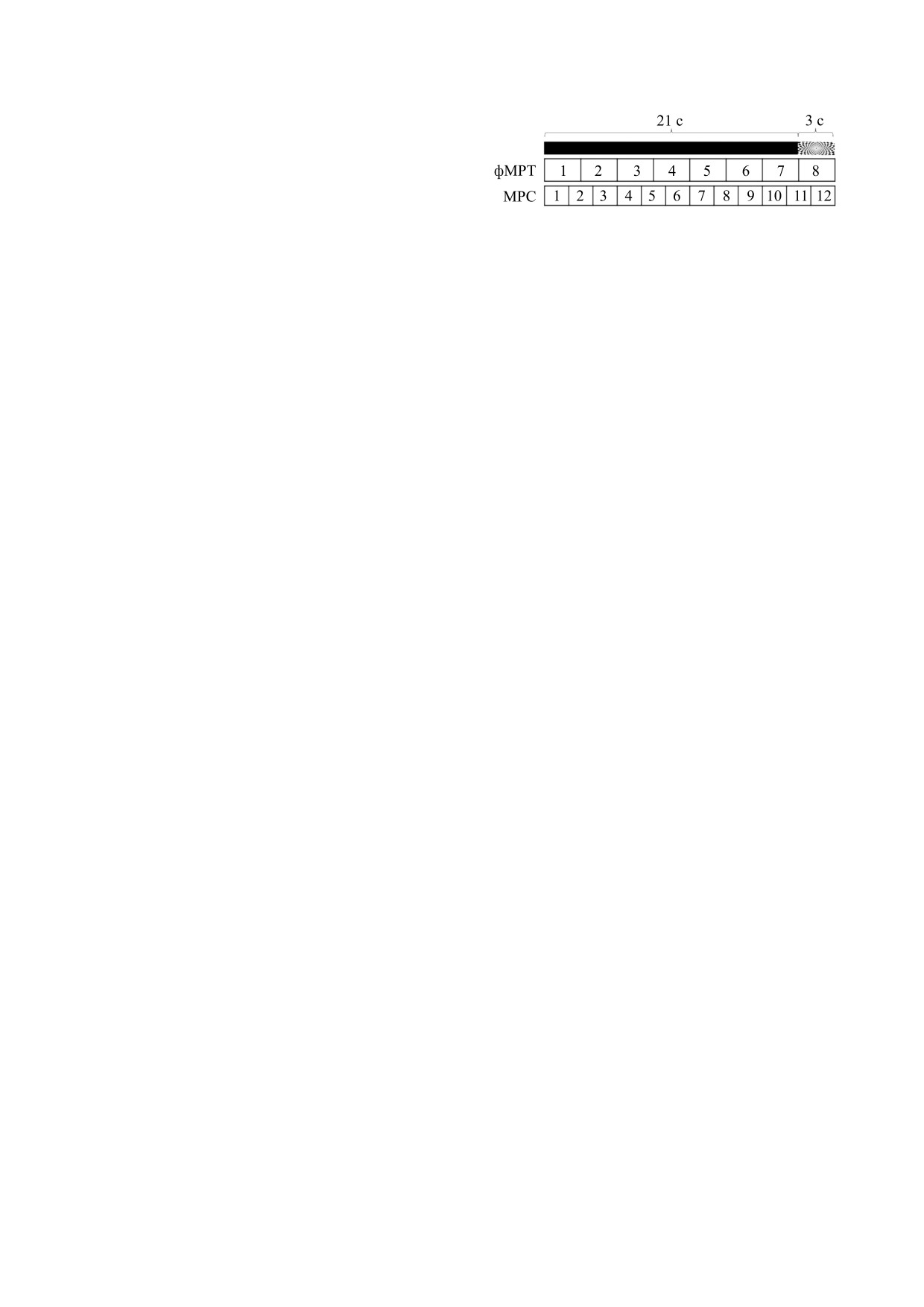
Рис. 3. Парадигма зрительной стимуляции: 3 с - шах-
присваивается интенсивность 1, а всем осталь-
матная доска, мерцающая с частотой 4 Гц; 21 с - тем-
ным - 0. Усредняя интенсивности фМРТ сигнала
ный экран; паттерн получения данных (время сбора
в спектроскопическом вокселе в анализируемой
данных) фМРТ и 1Н-МРС при покое и активации.
временной точке, получали для каждого испыту-
емого значение интенсивности BOLD-сигнала,
соответствующее времени t, прошедшему после
Процедуру повторяли до тех пор, пока ширина
стимула.
линии корректируемого спектра отличалась не
более чем на 1% относительно спектра, соответ-
Предварительная обработка спектров. Первые
ствующего исходной временной точке.
12 накоплений исключали из рассмотрения из-за
большей, чем у других накоплений, интенсивно-
Количественная обработка. Спектры обрабаты-
сти вследствие неполной Т1-релаксации. Таким
вали в LCModel [32] с набором априорных дан-
образом, спектроскопические данные каждого
ных для импульсной последовательности PRESS
испытуемого содержали
432 накопления (по
с TE = 35 мс. Набор априорных данных состоял из
36 накоплений на одну временную точку). Спек-
17 метаболитов: аланин, аспартат, креатин (Cr),
тральные данные каждого волонтера выравнива-
фосфокреатин, γ-аминомасляная кислота, Glc,
ли по частоте и фазе в программе FID-A в диа-
Gln, Glu, глицерофосфохолин, фосфохолин, глу-
пазоне значений δ = 1.85-2.15 м.д, соответствую-
татион, миоинозитол, Lac, NAA, N-ацетиласпар-
щем наиболее интенсивному сигналу n-ацетилас-
татглутамат, сциллоинозитол, таурин. Качество
партата (NAA, δ = 2.01 м.д.) в спектре.
аппроксимации оценивали по разности сырого и
обработанного спектров (рис. 4).
Далее спектральные данные каждого испытуе-
мого разделяли в соответствии с временными
При нижней границе Крамера-Рао для сигна-
точками и для каждой временной точки создава-
ла Glx более
15% данные исключали из
ли отдельный файл, содержащий 36 накоплений.
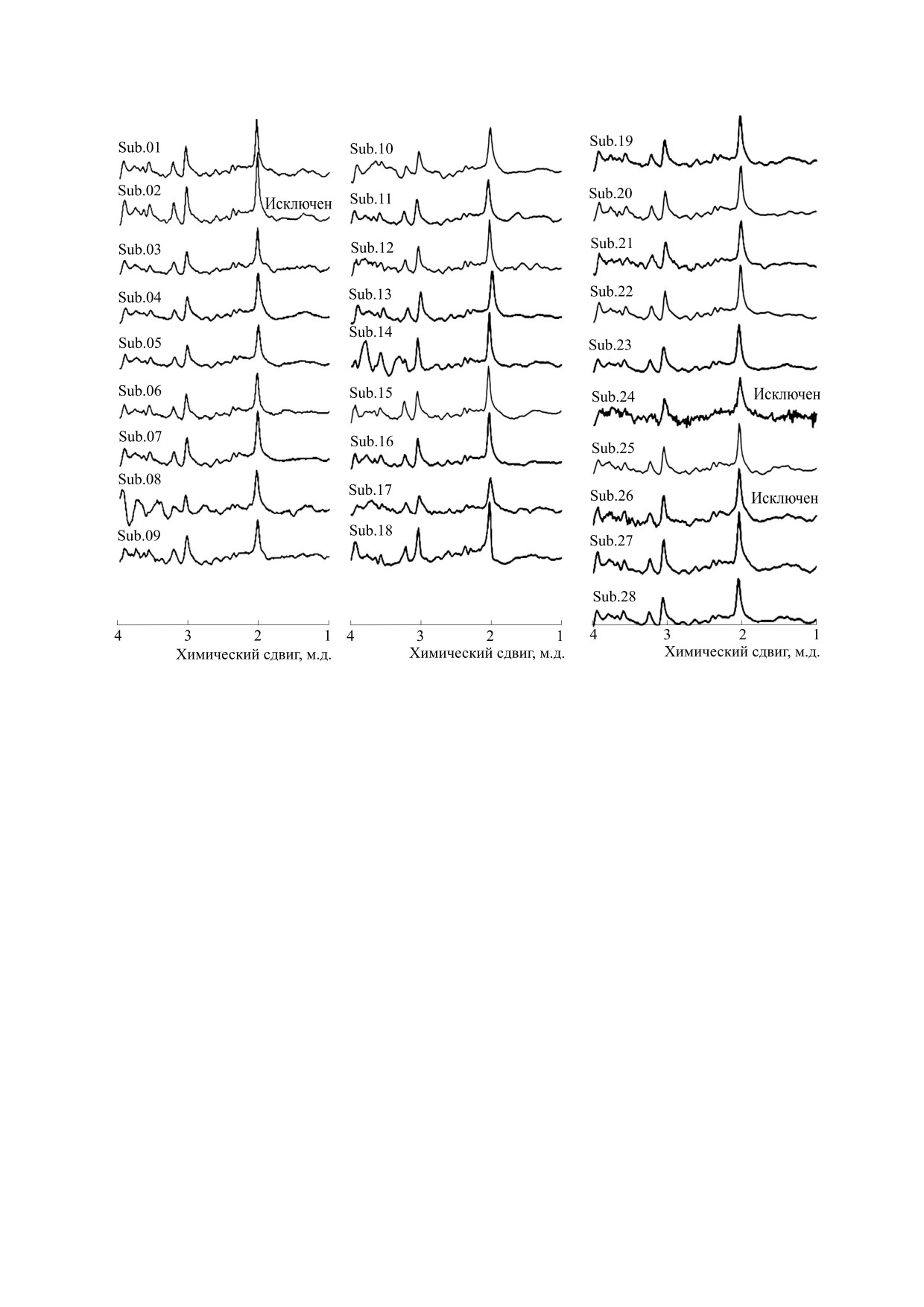
анализа (по этому критерию был исключен один
Общее количество файлов равнялось 216. Кроме
волонтер - Sub.02 (рис. 5). Еще один волонтер
того, для оценки стабильности Glx/Cr во время
был исключен из-за низкого значения отноше-
исследования фМРС спектральные данные каж-
ния сигнал/шум, которое явно наблюдается на
дого участника были разделены на три последова-
«сырых» спектрах по сравнению со спектрами
тельных временных интервала по 4 мин 28 с
других волонтеров (рис. 5, Sub.24). У одного ис-
каждый, усреднены по группе испытуемых. В ре-
пытуемого в спектрах наблюдался почти двукрат-
зультате были получены три спектра, характери-
ный разброс значений Glx, поэтому его данные
зующие соответствующие временные отрезки.
также исключили из анализа (рис. 5, Sub.26). Та-
ким образом, для последующей обработки вы-
Спектральные данные каждого испытуемого
усредняли в каждой временной точке и оценива-
борка была сокращена до 25 человек (13 мужчин и
ли ширину линии tCr (2.85-3.15 ppm, LWtCr), из-
12 женщин).
меряя ширину на половине высоты, чтобы оце-
В результате получали значения Glx/Cr,
нить влияние сужения линий, вызванное BOLD-
NAA/Cr в каждой временной точке.
эффектом, на интенсивность сигналов метаболи-
Статистический анализ. Распределение всех
тов. Измеряли разность между значением LWtCr
наборов данных проверяли на нормальность с по-
для каждой временной точки и значением в ис-
мощью теста Шапиро-Уилка. Достоверность из-
ходной точке для каждого волонтера. LWtCr изме-
менения
интенсивности
BOLD-сигнала,
ряли в программе FID-A, модифицированной ав-
[Glx]/[Cr], [NAA]/Cr, ширины линий NAA, Cr,
торами: использовали аппроксимацию tCr лорен-
Cho в динамике после стимула определяли при
цевой линией, а не прямое измерение ширины
помощи ANOVA с повторными измерениями (с
сигнала на полувысоте, что позволило исключить
уровнем значимости p < 0,05) и при обнаружении
искажения базовой линии, вносимые остаточ-
статистически значимых различий какого-либо
ным сигналом макромолекул, который может
параметра каждое среднее значение этого пара-
присутствовать в спектре при относительно ко-
метра во временной точке сравнивали со средним
ротком TE (35 мс), примененном в настоящем ис-
значением на -1 с при помощи двухэтапной ли-
следовании. Далее ширины спектральных линий
нейной процедуры Бенджамини, Кригера и Йе-
корректировали на полученную величину [31].
кутиели, учитывающей множественные сравне-
БИОФИЗИКА том 67
№ 2
2022
348
ЯКОВЛЕВ и др.
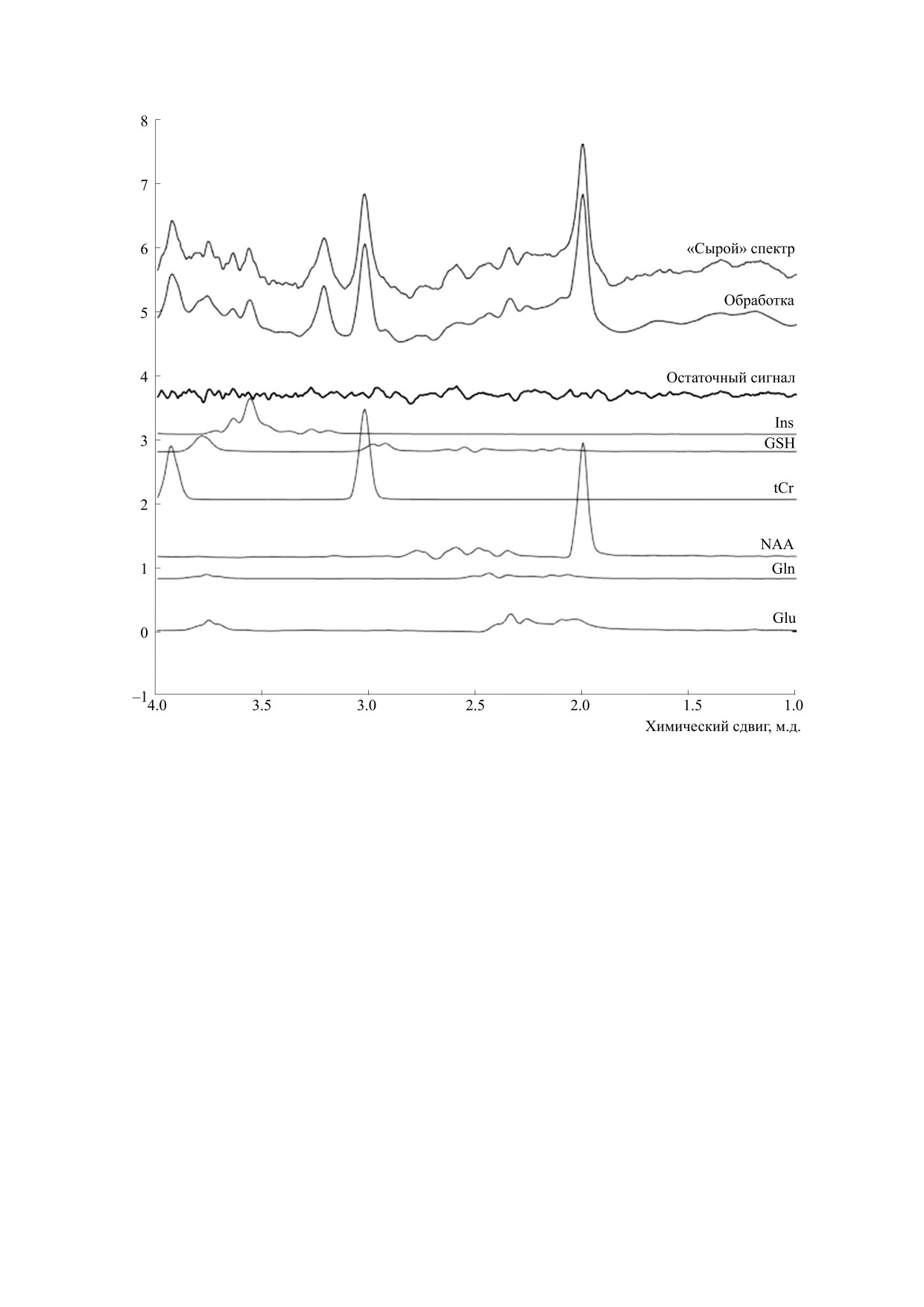
Рис. 4. Аппроксимация спектров с использованием линейной комбинации базисных спектров, выполненная в LCModel,
«сырого» (до предварительной обработки) спектра зрительной коры здорового испытуемого. Полученные данные
представлены на верхнем спектре, суммарная обработка - на втором сверху спектре, остаточный спектр после
аппроксимации - третий сверху. Ниже показаны спектральные вклады каждого элемента в суммарный спектр.
ния. Статистические тесты выполняли в про-
лученная динамика BOLD-сигнала характеризу-
грамме GraphPad Prism (GraphPad Prism,
ется одним пиком с максимумом примерно на 6 с,
RRID:SCR_002798).
что соответствует стандартному гемодинамиче-
скому ответу [17].
Определили коэффициент корреляции между
значениями максимума BOLD и разностью
Динамика [Glx] и [NAA] в ответ на короткий
[Glx]/[Cr] значений на -1 с и 1 с.
стимул. Влияние видеостимуляции на уровень
Glu представлено динамикой значений
[Glx]/[Cr], нормированных на исходное значение
РЕЗУЛЬТАТЫ
(см. рис. 6). Дисперсионный анализ с повторны-
Активация по данным фМРТ. Анализ фМРТ-
ми измерениями показал статистически значи-
изображений при помощи общей линейной мо-
мое отличие (p
= 0.0267) средних значений
дели выявил статистически значимый эффект
[Glx]/[Cr] в группе как минимум в одной из вре-
зрительной стимуляции у всех волонтеров -
менных точек. Последующий тест двухэтапной
большой кластер BOLD-активации, включаю-
линейной повышающей процедуры Бенджами-
щий в себя первичную и экстрастриарную (в ос-
ни, Кригера и Йекутиели (контролирующий ко-
новном V2) зрительные коры билатерально. По-
эффициент ложного обнаружения) зафиксировал
БИОФИЗИКА том 67
№ 2
2022
ИССЛЕДОВАНИЕ СУММАРНОГО УРОВНЯ ГЛУТАМАТА И ГЛУТАМИНА
349
Рис. 5. «Сырые» спектры всех волонтеров, участвовавших в исследовании. Исключенные из обработки спектры волонтеров
отмечены надписью «исключен» (причины исключения спектров см. в тексте).
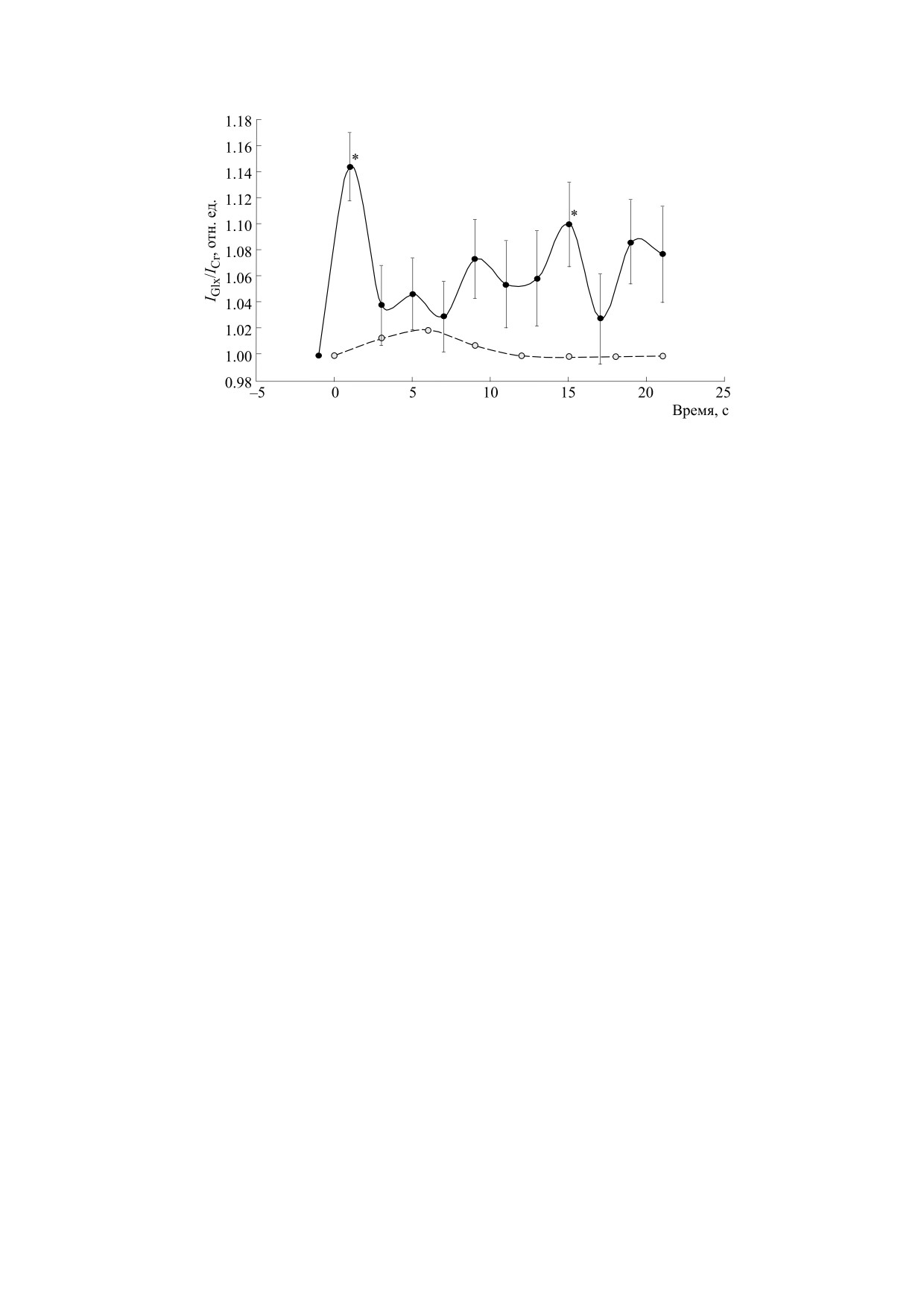
увеличение [Glx]/[Cr] на 1 с (14 ± 3%, p = 0.0006)
ОБСУЖДЕНИЕ
и 15 с (10 ± 3%, p = 0.04) по сравнению с исход-
ным значением. Статистически значимое увели-
Динамика [Glx]/[Cr] и скорость везикулярного
чение [Glx]/[Cr] соответствует изменению сум-
цикла. Из измерения динамики [Glx]/[Cr] мы об-
наружили статистически значимое увеличение
марной концентрации
[Glu] + [Gln] на
1.7 и
этого отношения уже на первой секунде после на-
1.2 мМ (на первой и пятнадцатой секунде соот-
чала предъявления стимула, указывающее на вы-
ветственно), если принять их суммарную концен-
сокую скорость изменения концентрации Glx
трацию в зрительной коре мозга человека равной
(~1.7 мМ/с, см. раздел «Результаты»). Предполо-
12 мМ [33].
жим, что полученное нами увеличение [Glx] обу-
Анализ временных рядов концентрации дру-
словлено синтезом Glu или Gln. Поскольку Gln
гих метаболитов не выявил статистически значи-
синтезируется из Glu, можно полагать, что изме-
мых изменений
[NAA]/[Cr] и
[Cho]/[Cr]
нение [Glx] происходит через увеличение [Glu].
(rANOVA: p = 0.53 и 0.50 соответственно).
Его синтез непосредственно связан с α-кетоглу-
таратом, интермедиатом цикла Кребса, поэтому
Средние значения [Glx]/[Cr] в начальном,
реализация этого пути повышения [Glx] возмож-
среднем и конечном временных интервалах не
на только в том случае, если скорость цикла
изменяются (ANOVA: p = 0.27), что свидетель-
Кребса превышает скорость нарастания Glx.
ствует о стабильности базового значения
Суммарная скорость потока веществ в астроцитах
[Glx]/[Cr] в течение всего исследования (среднее
и нейронах через цикл Кребса равен ~0.8 мМ/мин
значение ± ошибка среднего Glx/Cr в каждый из
[27], что на порядок меньше полученной нами
трех периодов равнялись соответствено 1.97 ±
оценки скорости увеличения Glx на первой се-
± 0.16, 1.92 ± 0.16, 1.85 ± 0.14).
кунде после стимула. Поэтому наблюдаемый на-
БИОФИЗИКА том 67
№ 2
2022
350
ЯКОВЛЕВ и др.
Рис. 6. Зависимость усредненных по группе испытуемых значений отношения интенсивностей Glx/Cr (± ошибка среднего,
сплошная линия) и BOLD-сигнала (пунктирная линия), нормированные на исходное значение для каждого волонтера; * -
p < 0.05.
ми рост [Glx] не является следствием его синтеза
следовании на первой секунде. Следовательно,
из интермедиатов цикла Кребса.
значительная его доля нейромедиаторного Glu
возвращается в нейрон не через Glu-Gln-цикл, а
Другой причиной увеличения [Glx]/[Cr] может
посредством обратного захвата. Возможной при-
быть перемещение Glu из невидимого везикуляр-
чиной снижения подвижности является буфери-
ного пула в видимый. Быстрый рост [Glx] в ответ
зация Glu [37], процесс, в котором возвращение
на стимул может быть вызван наличием клеточных
компартментов, содержащих малоподвижный и
Glu в клетку сопровождается множественными
вследствие этого «ЯМР-невидимый» пул Glu. Ме-
взаимодействиями с транспортером EAAT. Таким
образом, этот пул Glu имеет уменьшенное время
тодом 1Н/13С-ЯМР на срезах мозга морских сви-
нок такой пул обнаружили авторы работы [23] и
релаксации T2, следовательно, интенсивность
предположили, что содержащийся в везикулах Glu
общего сигнала Glx в этой области уменьшается.
имеет низкую подвижность и в спектрах не детек-
Ко времени второго пика [Glx] (15 с после стиму-
тируется. Если принять эту гипотезу, обратимый
ла) Glu проникает в клетку и быстро упаковыва-
рост [Glx] на первых секундах после стимула явля-
ется в везикулы. Возникает вопрос, может ли Glu,
ется следствием выброса Glu из везикул в синапти-
возвращенный в нейроны путем обратного захва-
ческую щель с последующим его включением в
та, упаковываться в пузырьки за 15 с, теряя по-
цикл нейромедиаторов и возвращением в везику-
движность?
лы через 15 с посредством Glu-Gln-цикла. В таком
случае скорость Glu-Gln-цикла должна составлять
Скорость-лимитирующая стадия подготовки
6.8 ± 1.5 мМ/мин, что на порядок больше измерен-
новой везикулы, готовой к экзоцитозу, - это эн-
ного с помощью 13С-МРС в состоянии покоя зна-
доцитоз везикулы для Glu [38]. Характерное вре-
чения (0.32 ± 0.05 мМ/мин) [34].
мя эндоцитоза в зависимости от стимула состав-
ляет от ~115 мс до 8.3 с [39]. Это означает, что ко
Показано, что оборот одной молекулы Glu че-
времени второго пика [Glx] на пятнадцатой се-
рез Glu-Gln-цикл требует затраты одной молеку-
кунде новая везикула уже будет готова к заполне-
лы глюкозы [35]. Таким образом, при нейроакти-
нию Glu. Таким образом, можно полагать, что на-
вации с возрастанием потока Glu через цикл
ми впервые обнаружена динамика [Glx], характе-
можно ожидать как минимум сопоставимого уве-
личения потока глюкозы. Увеличение скорости
ризующая процесс выделения Glu из везикул,
потребления глюкозы, измеренное с помощью
последующий обратный захват и упаковку в вези-
кулы. Количественно доля высвобождающегося в
1H-МРС в мозге в ответ на постоянную зритель-
ную стимуляцию [36], составляет ~0.1 мМ/мин;
результате короткой зрительной активации вези-
это на порядок меньше скорости, необходимой
кулярного Glu относительно доли «видимого» в
для увеличения Glx, обнаруженного в нашем ис-
состоянии покоя Glu составляет 14%.
БИОФИЗИКА том 67
№ 2
2022
ИССЛЕДОВАНИЕ СУММАРНОГО УРОВНЯ ГЛУТАМАТА И ГЛУТАМИНА
351
Несомненно, предположенная интерпретация
зован скорее балансом возбуждения и торможе-
полученных результатов требует дальнейших до-
ния, чем концентрацией одного из нейромедиа-
казательств.
торов, в том числе и [Glx].
Уровни n-ацетиласпартата и холинсодержащих
Ограничения. Полученные выводы о возвра-
соединений. В данном исследовании не наблюда-
щении Glu в везикулы основаны на идее повтор-
ется изменений суммы n-ацетиласпартата и n-аце-
ной активации значительного количества одной
тиласпартилглутамата и холинсодержащих со-
и той же сети нейронов в первичной зрительной
единений, что совпадает с большинством резуль-
коре. Данное предположение строится нами на
татов по измерению этого показателя при
основании применения одного и того же стимула.
различных видах стимуляции [7, 8, 22, 40, 41]. Тем
Однако изменение положения глаз может приво-
не менее, обратимое снижение суммы n-ацети-
дить к смещению видимого волонтеру изображе-
ласпартата и n-ацетиласпартилглутамата наблю-
ния и активации других нейронов, что может за-
дали в зрительной коре при длительной видео-
нижать оценку времени обратного захвата Glu и
стимуляции [42] и в моторной коре после предъ-
заполнения везикул.
явления единичного моторного стимула
[43].
Кроме этого, в данной работе мы измеряем
Расхождение в результатах измерения содержа-
сумму Glu и Gln, поэтому не можем подтвердить
ния NAA как под влиянием длительной стимуля-
предположение о недостаточной скорости пере-
ции, так и в динамике после короткого стимула
хода Glu в Gln (через Glu-Gln-цикл).
требует дополнительных исследований и может
быть связано с различными условиями экспери-
ментов, разными типами коры, разными видами
ВЫВОДЫ
стимуляции и разной длительностью стимула.
В настоящей работе впервые показано, что по-
сле короткого трехсекундного зрительного сти-
Интенсивность BOLD-сигнала не коррелирует с
мула уровень Glu в возбужденной области мозга
интенсивностью изменения [Glx]. Корреляцион-
имеет два максимума - на первой и пятнадцатой
ный анализ наших данных не обнаружил досто-
секундах после начала предъявления стимула.
верной связи между максимальной интенсивно-
Полученный результат может быть следствием
стью BOLD-сигнала и максимальной концентра-
высвобождения Glu из везикул, обратного захва-
цией Glx. Основной вклад в расширение сосудов,
та Glu и заполнения везикул.
необходимый для возникновения BOLD, вносят
Интенсивность BOLD-сигнала не коррелиру-
производные арахидоновой кислоты, синтез ко-
ет с изменением [Glx] в периоде после короткого
торых активируется в астроцитах глутаматом,
стимула. Регуляция BOLD-эффекта может осу-
транспортирующимся из синаптической щели
ществляться балансом возбуждения и торможе-
после высвобождения из везикул [44]. Количе-
ния, что может быть предметом дальнейших ис-
ственная связь между интенсивностью BOLD-
следований.
сигнала и [Glx] не доказана. Продемонстрирова-
ны одновременные увеличения интенсивности
BOLD-сигнала и Glx при периодической видео-
ФИНАНСИРОВАНИЕ РАБОТЫ
стимуляции с равными 64 с интервалами покоя и
Работа выполнена при финансовой поддержке
активации [10]. В то же время при предъявлении
Российского фонда фундаментальных исследова-
когнитивной задачи распознавания образов кор-
ний (гранта № 19-29-10040) и Российского науч-
реляция между амплитудой BOLD-сигнала, мо-
ного фонда (грант № 18-1300030).
делируемого функцией гемодинамического отве-
та и изменением [Glx], не выявлена [14].
КОНФЛИКТ ИНТЕРЕСОВ
Взаимосвязь BOLD с нейронной активностью
Авторы заявляют об отсутствии конфликта
показана нелинейной корреляцией амплитуды
интересов.
изменения BOLD-сигнала с величиной потенци-
ала местного поля (LFP) [45]. Поскольку LFP от-
ражает синаптический входной сигнал, дендрит-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ную обработку, подпороговые мембранные коле-
Исследование было одобрено комитетом по
бания [46], изменение LFP связано не только с
этике научно-исследовательского института не-
воздействием возбуждающего нейромедиатора
отложной детской хирургии и травматологии.
Glu на постсинаптические рецепторы, но и с воз-
Участники исследования были проинформиро-
действием тормозного нейромедиатора - ГАМК.
ваны о деталях исследования и подписали согла-
Таким образом, BOLD должен быть охарактери-
сие на его проведение. Все процедуры соответ-
БИОФИЗИКА том 67
№ 2
2022
352
ЯКОВЛЕВ и др.
ствовали Хельсинкской декларации 1964 года и
23.
R. A. Kauppinen, T. R. M. Pirttila, S. O. K. Auriola,
более поздним поправкам к ней.
and S. R. Williams, Biochem. J. 298 (1), 121 (1994).
24.
P. G. Mullins, Scand. J. Psychol. 59 (1), 91 (2018).
СПИСОК ЛИТЕРАТУРЫ
25.
T. C. Südhof, Annu. Rev. Neurosci. 27, 509 (2004).
1.
N. Robinson and C. B. Williams, Clin. Chim. Acta 12
26.
T. Hori and T. Takahashi, Neuron 76 (3), 511 (2012).
(3), 311 (1965).
2.
P. G. Mullins, H. Chen, J. Xu, et al., Magn. Reson.
27.
D. L. Rothman, H. M. de Feyter, R. A. de Graaf,
Med. 60 (4), 964 (2008).
et al., NMR Biomed. 24 (8), 943 (2011).
3.
I. Tkáč and R. Gruetter, Appl. Magn. Reson. 29 (1),
28.
D. J. Heeger and D. Ress, Nat. Rev. Neurosci. 3 (2),
139 (2005).
142 (2002).
4.
M. Garwood and L. DelaBarre, J. Magn. Reson. 153
29.
J. M. Chambers, in Statistical Models in S, Ed. by
(2), 155 (2001).
J. M. Chambers & T. J. Hastie (Chapman & Hall, Bo-
5.
E. Frias-Martinez et al., in Proc. 16th Scientific Meet-
ca Raton, FL, 1992), pp. 95-144.
ing of Int. Soc. for Magnetic Resonance in Medicine (To-
30.
P. E. Menshchikov, N. A. Semenova, T. A. Akhadov,
ronto, 2008), p. 691.
et al., Biophysics 62 (6), 1009 (2017).
6.
P. O. Wyss, C. Bianchini, M. Scheidegger, et al.,
31.
J. Near, R. Edden, C. J. Evans, et al., Magn. Reson.
Magn. Reson. Med. 80 (2), 452 (2018).
Med. 73 (1), 44 (2015).
7.
P. Bednařík, I. Tkač, F. Giove, et al., J. Cereb. Blood
Flow Metab. 35, 601 (2015).
32.
S. W. Provencher, Magn. Reson. Med., 30 (6), 672
(1993).
8.
R. Mekle, S. Kühn, H. Pfeiffer, et al., NMR Biomed.
30 (2), (2017).
33.
M. Z. Goryawala, S. Sheriff, and A. A. Maudsley,
9.
I. Betina Ip, U. E. Emir, A. J. Parker, et al., J. Neuro-
NMR Biomed., 29 (8), 1108 (2016).
sci. 39 (40), 7968 (2019).
34.
J. Shen, K. F. Petersen, K. L. Behar, et al., Proc. Natl.
10.
I. Betina Ip, A. Berrington, A. T. Hess, et al., Neuro-
Acad. Sci. USA 96 (14), 8235 (1999).
image 155, 113 (2017).
35.
L. Hertz and Y. Chen, Front. Integr. Neurosci. 11, 18
11.
N. Lally, P. G. Mullins, M. V. Roberts, et al., Neuro-
(2017).
image 85, 823 (2014).
36.
W. Chen, E. J. Novotny, X. H. Zhu, et al., Proc. Natl.
12.
M. Cleve, A. Gussew, and J. R. Reichenbach, Neuro-
Acad. Sci. USA 90 (21), 9896 (1993).
image 105, 67 (2015).
13.
A. Gussew, R. Rzanny, M. Erdtel, et al., Neuroimage
37.
A. V. Tzingounis and J. I. Wadiche, Nat. Rev. Neuro-
49 (2), 1895 (2010).
sci., 8 (12), 935 (2007).
14.
D. Apšvalka, A. Gadie, M. Clemence, and P. G. Mul-
38.
S. P. Gandhl and C. F. Stevens, Nature 423 (6940),
lins, Neuroimage 118, 292 (2015).
607 (2003).
15.
K. Kurcyus, E. Annac, N. M. Hanning, et al., J. Neu-
39.
J. Y. Sun, X. S. Wu, and L. G. Wu, Nature 417 (6888),
rosci. 38 (46), 9967 (2018).
555 (2002).
16.
N. Lally, P. G. Mullins, M. V. Roberts, et al., Neuro-
40.
B. Schaller, R. Mekle, L. Xin, et al., J. Neurosci. Res.
image 85, 823 (2014).
91 (8), 1076 (2013).
17.
S. A. Huettel, A. W. Song, and G. McCarthy, Funct.
Magn. Reson. Imaging, 3rd ed. (Oxford University
41.
Y. Boillat, L. Xin, W. van der Zwaag, and R. Gruetter,
Press, 2014).
J. Cereb. Blood Flow Metab. 40 (3), 488 (2020).
18.
A. Schousboe, S. Scafidi, L. K. Bak, et al., in Gluta-
42.
M. H. Baslow, J. Hrabe, and D. N. Guilfoyle, J. Mol.
mate and ATP at the Interface of Metabolism and Signal-
Neurosci. 32 (3), 235 (2007).
ing in the Brain (Springer, Cham, 2014), pp. 13-30.
43.
A. V. Manzhurtsev, N. A. Semenova, M. V. Ublinskii,
19.
L. K. Bak, A. Schousboe, and H. S. Waagepetersen, J.
et al., Russ. Chem. Bull. 65 (6), 1630 (2016).
Neurochem. 98 (3), 641 (2006).
44.
D. Attwell, A. M. Buchan, S. Charpak, et al., Nature
20.
S. Mangia, F. Giove, and M. DiNuzzo, Neurochem.
468 (7321), 232 (2010).
Res. 37 (11), 2554 (2012).
45.
X. Zhang, W. J. Pan, and S. Keilholz, Front. Neurosci.
21.
M. C. McKenna, J. Neurosci. Res. 85 (15), 3347
13, 1126 (2019).
(2007).
22.
S. Mangia, I. Tkáč, R. Gruetter, et al., J. Cereb. Blood
46.
G. Buzsáki, C. A. Anastassiou, and C. Koch, Nat.
Flow Metab. 27 (5), 1055 (2007).
Rev. Neurosci. 13 (6), 407 (2012).
БИОФИЗИКА том 67
№ 2
2022
ИССЛЕДОВАНИЕ СУММАРНОГО УРОВНЯ ГЛУТАМАТА И ГЛУТАМИНА
353
Study of the Total Glutamate plus Glutamine Concentrations in the Human Visual
Cortex Activated Areas Detected by Functional Magnetic Resonance Imaging
upon Short Visual Stimulation
A. Yakovlev*, **, ***, A. Manzhurtsev*, ***, ****, P. Menshchikov**, *****, M. Ublinskiy*, ***,
I. Melnikov*, D. Kupriyanov*****, T. Akhadov*, ****, and N. Semenova*, **, ***, ****
*Clinical and Research Institute of Emergency Pediatric Surgery and Traumatology,
ul. Bolshaya Polyanka 22, Moscow, 119180 Russia
**Semenov Federal Research Center for Chemical Physics, Russian Academy of Sciences,
ul. Kosygina 4, Moscow, 119991 Russia
***Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
****Lomonosov Moscow State University, Leninskie Gory 1/1, Moscow, 119991 Russia
*****LLC Philips Healthcare, ul. Sergeya Makeeva 13, Moscow, 123022 Russia
Functional magnetic resonance spectroscopy at 3 T with a time resolution of 2 s was used to study the dynam-
ics of the total glutamate plus glutamine concentrations in the human occipital cortex during BOLD response
upon short visual stimulation (3 s). It was found that when 25 volunteers were shown the view of chessboard
at the flickering frequency of 4 Hz, an increase in the levels of glutamate and glutamine at 1s and 15 s upon
stimulation was statistically significant. No correlation between the maximum BOLD response amplitude
and maximum glutamate and glutamine levels was found. Changes in the total glutamate plus glutamine con-
centrations in time upon stimulation do not correspond to the rate of the glutamine-glutamate turnover cycle,
but are consistent with the temporal characteristics of the vesicular cycle: the release of glutamate from the
vesicles and its reuptake. Thus, it can be assumed that the observed dynamics of glutamate and glutamine is
caused by a change in glutamate mobility upon release from vesicles and reverse packing but not metabolic
transformations in the cycle of neurotransmitters.
Keywords: 1H-MRS, glutamate, PRESS, visual activation, short stimulus
БИОФИЗИКА том 67
№ 2
2022