БИОФИЗИКА, 2022, том 67, № 3, с. 421-433
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.2.01:(57.052.2+577.322.23+577.322.54)
КООПЕРАТИВНОЕ СВЯЗЫВАНИЕ КИСЛОРОДА ГЕМОГЛОБИНОМ
КАК ОДНА ИЗ ОБОБЩАЮЩИХ МОДЕЛЕЙ
В МОЛЕКУЛЯРНОЙ БИОФИЗИКЕ
© 2022 г. И.А. Лавриненко*, Г.А. Вашанов*, А.С. Бучельников**, Ю.Д. Нечипуренко**, ***
*Воронежский государственный университет, 394018, Воронеж, Университетская пл., 1
**Севастопольский государственный университет, 299053, Севастополь, ул. Университетская, 33
***Институт молекулярной биологии им. В.А. Энгельгардта РАН, 119991, Москва, ул. Вавилова, 32
E-mail: lavrinenko_ia@bio.vsu.ru
Поступила в редакцию 07.03.2022 г.
После доработки 07.03.2022 г.
Принята к публикации 18.03.2022 г.
Изучение гемоглобина и описание его оксигенации, разработанные для этого термодинамические
и математические модели позволили биофизике сделать огромный шаг вперед, а предложенные
уравнения, в частности, уравнение Хилла, оказали влияние на развитие науки в самых разных
областях. Гемоглобин с его аллостерическим характером регуляции связывания кислорода и других
лигандов послужил моделью для огромного числа молекулярно-биологических систем. В обзоре
основное внимание уделяется формальному описанию связывания гемоглобином кислорода,
рассмотрены основные математические модели, развитые в этой области. Эволюция моделей
связывания прослеживается от подходов Хилла и Эдера, Моно-Уаймена-Шанжё и Кошланда-
Немети-Филмера до современных воззрений. Особое внимание уделено разным формальным
подходам и представлениям к описанию оксигенации как явлению физической адсорбции.
Ключевые слова: гемоглобин, кооперативность и аллостерия, уравнение Хилла, уравнение Эдера, уравне-
ние Бернарда, модель Моно-Уаймена-Шанжё, модель Кошланда-Немети-Филмера, симметричная и
последовательная модели, модели адсорбции.
DOI: 10.31857/S0006302922030012, EDN: AMUEZH
История описания связывания кислорода ге-
мическом равновесии. Эти представления были
моглобином представляет общий интерес для
развиты К. Гульдбергом и П. Вааге (1864-1867)
биофизиков, так как в ней вырабатывались моде-
[5], а также Я. Вант-Гоффом (1877) [6], сформу-
ли и формировались подходы, которые стали об-
лировавшими закон действующих масс, являю-
щими для широкого класса задач, описывающих
щийся следствием второго начала термодина-
обратимое кооперативное связывание лигандов с
мики.
макромолекулами [1]. Явление кооперативности
Г. Гюфнер (1890) [7], опираясь на этот закон,
пронизывает все уровни живой материи - от мо-
предложил уравнение, которое хорошо описыва-
лекул до сообществ организмов, и изучение этого
ет связывание кислорода мономерным белком
явления на молекулярном уровне дает возмож-
миоглобином (родственному гемоглобину, но не
ность найти ключ к пониманию механизмов, ле-
имеющим четвертичной структуры):
жащих в основе этого универсального и вместе с
kp
тем уникального феномена самосогласованности
y
=
,
(1)
составных систем (см. работы [2, 3]).
1+
kp
p
p
p
y
=
=
=
,
(2)
ПРЕДЫСТОРИЯ ИССЛЕДОВАНИЯ
-1
−1
k
+
p p
+
p
k
1
50
КООПЕРАТИВНОГО СВЯЗЫВАНИЯ
+
p
ЛИГАНДОВ: УРАВНЕНИЕ ГЮФНЕРА
k-
1
Так как оксигенация является обратимой хи-
где y - степень насыщения гембелка кислородом,
мической реакцией, то историю исследования
p - парциальное давление кислорода, k - микро-
феномена кооперативности можно вести от идеи
скопическая константа равновесия, k1, k-1 - кон-
К. Бертолле (1803) [4] об обратной реакции и хи-
станты прямой и обратной реакции соответствен-
421
422
ЛАВРИНЕНКО и др.
И. Ленгмюр (1916) [14] разработал модель мо-
номолекулярной адсорбции, исходя из следую-
щих представлений: если физическая (квазихи-
мическая) адсорбция является обратимым про-
цессом, то тогда равновесное состояние
определяется отношением констант адсорбции и
десорбции. Эта зависимость более известна, как
изотерма адсорбции Ленгмюра:
kc
θ=
,
(5)
1+
kc
c
c
c
θ=
=
=
,
(6)
-1
−1
k
k
+
c K
l
+
c
1
+
c
k-
1
где θ - доля занятых центров адсорбции, c - кон-
центрация адсорбата (или давление газа p над ад-
сорбентом), k - константа равновесия, k1, k-1 -
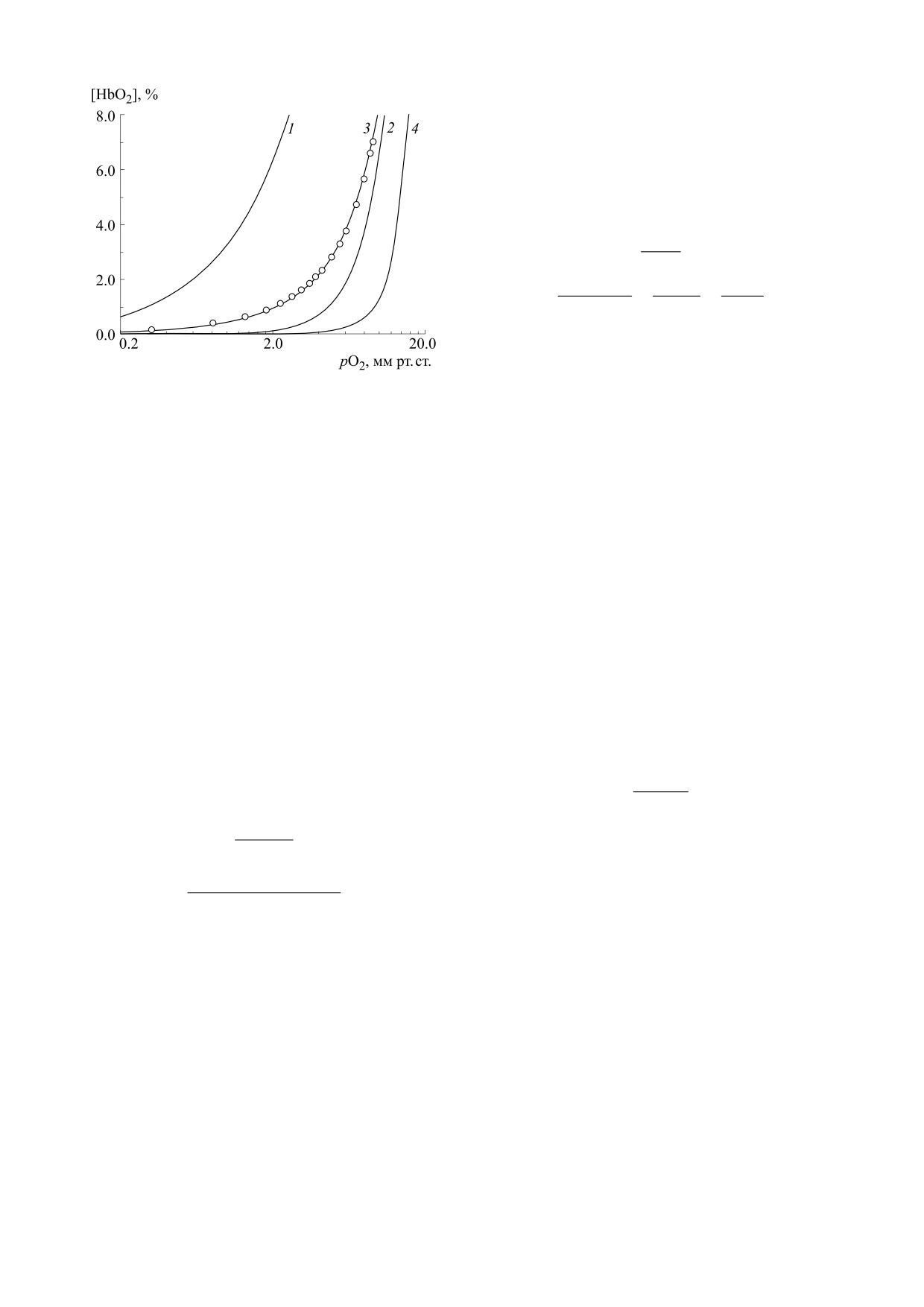
Рис. 1. Аппроксимация экспериментальных точек
кривой диссоциации оксигемоглобина (Р. Уинслоу и
константы прямой и обратной реакции (адсорб-
др. [85]) уравнением Гюфнера (кривая 1), уравнением
ции и десорбции соответственно), Kl - константа
Хилла с h = 2.5 (кривая 2) и h = 4 (соответствует числу
Ленгмюра.
субъединиц, кривая
4) и уравнением Эдера
Таким образом, уравнения Гюфнера, Миха-
(кривая 3).
элиса-Ментен и Ленгмюра описывают сходные
физико-химические процессы, формализация
но, p50 - давление кислорода, при котором поло-
которых укладывается в регрессионную матема-
тическую модель с уравнениями вида y
=
вина макромолекул насыщена лигандом.
x/(a + x). Следует также отметить, что исследова-
С. О’Салливан и Ф. Томпсон (1890) [8], осно-
ния и описания кислородсвязывающих свойств
вываясь на работах А. Харкорта (1865-1867) [9]
гемоглобина опережали аналогичные работы в
предположили, что скорость реакции пропорци-
области ферментативной кинетики и химии по-
ональна концентрации субстрата и несет в себе
верхностных явлений.
экспоненциальную зависимость. Однако в рабо-
Рассмотренная регрессионная модель на-
тах Э. Дюкло (1899) [10], В. Анри (1901) [11] и
столько универсальна, что нашла свое примене-
А. Брауна (1902) [12] эта закономерность не под-
ние и в других областях исследований, в частно-
твердилась. Л. Михаэлис и М. Ментен (1913) [13],
сти, полученной Ж. Моно (1949) эмпирической
используя в качестве теоретической базы закон
зависимости скорости роста микроорганизмов от
действующих масс и опираясь на работу Анри,
концентрации субстрата и носящей его имя
предложили одноименное уравнение (также из-
(уравнение Моно) [15]:
вестное как уравнение Михаэлиса-Анри или Ан-
ри-Михаэлиса-Ментен), ставшее основопола-
[S]
q
=
,
(7)
гающим в ферментативной кинетике:
K
s
+[S]
[S]
где q - относительная (от максимального значе-
r
=
,
(3)
ния) скорость роста микроорганизма, [S] - кон-
K
m
+[S]
центрация субстрата, Ks - константа половинной
[S]
скорости роста (аналогичная Km).
r
=
,
(4)
−1
−1
k
k
1
1
+
+[S]
k
−1
k
−2
УСПЕШНАЯ АППРОКСИМАЦИЯ КРИВОЙ
ДИССОЦИАЦИИ ГЕМОГЛОБИНА:
где r - относительная (от максимального значе-
УРАВНЕНИЕ ХИЛЛА
ния) скорость ферментативной реакции, [S] -
Предложенное Гюфнером уравнение не могло
концентрация субстрата, k1 - константа прямой
удовлетворительно описать кривую диссоциации
реакции (образование фермент-субстратного
оксигемоглобина (рис. 1, кривая 1). Возникший
комплекса), k-1 - константа обратной реакции
парадокс несоответствия признанного к тому
(распад комплекса до свободного фермента и суб-
времени закона действующих масс и экспери-
страта), k-2 - константа реакции распада ком-
мента был разрешен А. Хиллом (1910) [16]. Он
плекса до свободного фермента и продукта, Km -
предположил, что гемоглобин в растворах суще-
константа Михаэлиса.
ствует не только в виде отдельных макромолекул,
БИОФИЗИКА том 67
№ 3
2022
КООПЕРАТИВНОЕ СВЯЗЫВАНИЕ КИСЛОРОДА ГЕМОГЛОБИНОМ
423
но и в значительной степени представлен их агре-
электронных атомов и молекул, как способ при-
гатами (ассоциатами). Оксигенация при этом
ближенного решения уравнения Шредингера
происходит путем одновременного присоедине-
(1927-1928) [18]. В это же время Р. Фаулер (уче-
ния к агрегату нескольких лигандов. Тогда урав-
ник Хилла и научный руководитель Хартри) ввел
нение Гюфнера, исходя из закона действующих
в оборот термин
«кооперативные переходы»
масс, может быть приведено к следующему виду:
(1929), который изначально касался фазовых пе-
реходов в магнетиках, сплавах и растворах [19]. В
n
Kp
дальнейшем понятия «самосогласованности» и
y
=
,
(8)
n
1+
Kp
«кооперативности» найдут и расширят свое при-
менение в различных научных областях знаний, а
где n - число молекул гемоглобина в его агрегате,
модель Ленца-Изинга будет востребована при
K - макроскопическая константа равновесия.
описании кооперативных эффектов связывания
Показатель степени n (который определяли на
лигандов с макромолекулами [20, 21].
основании анализа данных) мог принимать неце-
лочисленные значения и поэтому физический
смысл его стал неясен. Хиллом было предложено
МОЛЕКУЛА ГЕМОГЛОБИНА -
рациональное объяснение, которое сводилось к
ЭТО ТЕТРАМЕР
тому, что агрегаты гемоглобина имеют перемен-
Г. Эдер (1925) [22] показал, что молекула гемо-
ный состав, а наблюдаемое значение n является
глобина
представляет
собой
тетрамер.
статистически усредненным по всем этим фор-
Т. Сведберг (1926) [23], принимая во внимание
мам (рис. 1, кривая 2).
результаты этого исследования и сопоставляя их с
Следует отметить, что приводимые в научной
собственными экспериментальными данными
литературе уравнения Гюфнера (1) и Хилла (8) хо-
(полученными методом аналитического центри-
тя и содержат константы равновесных реакций,
фугирования), также пришел к этому выводу.
имеющие одинаковое обозначение и физический
Хотя открытие олигомерной структуры макро-
смысл, но, тем не менее, обладают различной раз-
молекулы и не противоречило представлениям
мерностью, так как K может быть произведением
Хилла о существовании агрегатов гемоглобина,
ki. Это следует из приведенного уравнения для
оно не объясняло, почему показатель степени не
случая одновременного присоединения n лиган-
соответствует числу субъединиц, меньше их ко-
дов с одинаковыми равновесными константами:
личества и принимает нецелочисленные значе-
ния. Это снова привело к затруднениям физиче-
n
ской трактовки коэффициента Хилла [24].
∏
k
pi i
n
n
n
(kp)
p
Kp
i=1
Так как показатель степени в уравнении уже не
y
=
=
=
=
(9)
n
n
−1/n
n
n
отражал число субъединиц n (но был с ним сопря-
1+
(kp)
k
+
p
1+
Kp
1
k
p
жен), то, чтобы избежать путаницы в обозначени-
+∏
i i
i=1
ях, cтали использовать для этого коэффициента
Уравнение Хилла получило признание, однако
другие символы или их сочетания: nH, h, α и т.д.
каким образом молекулы гемоглобина в агрегатах
[25-30]:
синхронизировали между собой связывание мо-
h
лекул кислорода - оставалось неясным. Вместе с
p
y
=
,
(10)
тем предположение об одновременном связыва-
h
h
p50
+
p
нии лигандов подразумевало существование не-
где h - коэффициент Хилла, а p50 - величина
которой согласованности этих процессов.
50%-го насыщения гемоглобина кислородом
Теоретическое описание подобных процессов
(иногда обозначаемая как константа Хилла Kh
появилось в начале ХХ века в области статистиче-
ской физики. Исследуя ферромагнитные свой-
[31-34], аналогично константе Михаэлиса Km в
ства материалов, В. Ленц предложил модель
одноименном уравнении).
(1920), позволяющую в общем виде охарактери-
Уравнение Хилла обладает важной особенно-
зовать сильную анизотропию ферромагнетиков.
стью - по его коэффициенту h можно оценить
Под руководством Ленца Э. Изинг разработал
степень кооперативного взаимодействия субъ-
математическое описание этой модели для одно-
единиц, которую принято характеризовать как
мерного случая [17]. Модель Ленца-Изинга стала
отрицательную кооперативность (h < 1), положи-
одной из наиболее известных моделей статисти-
тельную кооперативность (h > 1) или ее отсут-
ческой физики для систем, где проявляются кол-
ствие (h = 1). Этот параметр дает общее представ-
лективные эффекты.
ление о кооперативности, согласно которому
Д. Хартри (сотрудничавший в области физио-
предполагается, что она постоянна и не зависит
логии с Хиллом) реализовал идею самосогласо-
от концентрации лиганда. Сопоставление значе-
ванного поля применительно к описанию много-
ний величин h оказалось весьма полезным в срав-
БИОФИЗИКА том 67
№ 3
2022
424
ЛАВРИНЕНКО и др.
нительном анализе олигомерных белков, а также
задачах моделирования регуляции транскрипции
оценки изменений в их структуре при воздей-
гена [44, 45], а также различных зависимостей ти-
ствии различных физико-химических агентов
па «доза-эффект» [30, 46].
[35].
Следует также отметить, что параметр h может
ОТ ИДЕИ ОДНОВРЕМЕННОГО
быть представлен в виде функции от числа субъ-
СВЯЗЫВАНИЯ ЛИГАНДОВ
единиц, подобно кажущейся молекулярной массе
К ИХ ПОСЛЕДОВАТЕЛЬНОМУ
белка или гидродинамическому радиусу макро-
ПРИСОЕДИНЕНИЮ
молекулы, величины которых также сопряжены с
массой и геометрией макромолекулы, но весьма
Уравнение Хилла не может одинаково хорошо
опосредованным образом (см. ниже).
аппроксимировать кривую оксигенации во всем
Уравнение (10) (также известное как уравне-
диапазоне парциальных давлений кислорода,
ние Хилла-Ленгмюра [36, 37]) получило широ-
особенно в области его малых значений (рис. 1,
кое распространение в силу своей простоты и хо-
кривая 2). Если предположить, что в границах
рошей аппроксимирующей способности [38-41],
предложенной модели (и формализации данным
несмотря на имеющееся сложности в соотнесе-
уравнением) происходит одновременное присо-
нии коэффициента h с числом субъединиц n, а
единение молекул кислорода к тетрамеру с разли-
также недостаточную реалистичность физиче-
чающимися равновесными константами для
ской модели одновременного присоединения ли-
каждой из четырех субъединиц, то это также не
гандов [42]. Уравнение Хилла нашло свое приме-
улучшит качество аппроксимации кривой диссо-
нение в энзимологии, фармакологии [33, 43], в
циации оксигемоглобина:
4
4
4
4
k
1
p⋅k
2
p⋅k
3
p⋅k
4
p
k
1
⋅
k
2
⋅
k
3
⋅
k
4
p
k
p
Kp
y
=
=
=
=
,
(11)
4
4
4
4
1+
k
p
⋅
k
p
⋅
k
p
⋅
k
p
1+
k
⋅
k
⋅
k
⋅
k
p
1+
k
p
1+
Kp
1
2
3
4
1
2
3
4
где k1, k2, k3 и k4 - константы равновесных реак-
где K1-K4 - равновесные макроскопические кон-
станты.
ций для каждой из субъединиц, k4 - произведе-
ние констант k1-k4, K - макроскопическая кон-
Для макроскопических констант со значения-
станта.
ми K1 = 1, K2 = 3/8, K3 = 1/16 и K4 = 1/256, выве-
Следует отметить, что когда константы k1-k4
денными из кинетической теории, уравнение (12)
равны между собой, среднее арифметическое и
сводится к частному случаю уравнения Хилла, т.е.
геометрическое для них совпадают. В противном
уравнению Гюфнера, применимому для аппрок-
случае K будет смещено в сторону меньших зна-
симации кривой оксигенации одной из субъеди-
чений относительно K для равных k1-k4. Так как
ниц гемоглобина:
в этом случае значения k1-k4 нельзя найти из их
0.25
⋅
K
1
p
произведения, то и определить, равны ли они
y
=
(13)
между собой, соответственно, не представляется
1+
0.25⋅
K
p
1
возможным.
В отличие от уравнения Хилла (8)-(10), где
На этом этапе возможности уравнения Хилла в
рассматривается одновременное присоединение
аппроксимации экспериментальных данных себя
лигандов, последовательное присоединение ли-
исчерпали [47]. Доминирующей версией в описа-
гандов осуществляется в четыре этапа. В послед-
нии оксигенации стала идея о последовательном
нем случае также могут быть рассмотрены вари-
присоединении лигандов.
анты последовательного присоединения лиган-
дов с одинаковой равновесной константой или,
УРАВНЕНИЕ ЭДЕРА И ЕГО ЭВОЛЮЦИЯ
как минимум, варианта, где хотя бы одна из рав-
новесных констант отличается от остальных.
Опираясь на закон действующих масс и идею о
последовательном присоединении молекул кис-
Г. Эдер предположил [22], что если четыре
лорода к тетрамеру, Г. Эдер (1925) [22] получил
атома гемового железа будут расположены доста-
уравнение оксигенации для идеального раствора
точно близко друг к другу, то такая система с пол-
гемоглобина:
ностью занятыми местами связывания лигандов
2
3
4
станет гораздо стабильней, чем ее промежуточ-
0.25⋅
K
p
+
0.5⋅
K
p
+
0.75
⋅
K
p
+
K
p
1
2
3
4
ные состояния, выразив это следующей зависи-
y
=
,
(12)
2
3
4
1+
K
p + K
p
+
K
p
+
K
p
мостью:
1
2
3
4
БИОФИЗИКА том 67
№ 3
2022
КООПЕРАТИВНОЕ СВЯЗЫВАНИЕ КИСЛОРОДА ГЕМОГЛОБИНОМ
425
2
3
4
Таким образом, обобщенное уравнение для
0.25⋅
Kp
+
0.25⋅(Kp)
+
0.25⋅(Kp)
+
(Kp)
y
=
.(14)
одинаковых n сайтов связывания лигандов L бу-
2
3
4
1+
Kp
+
0.5⋅(Kp)
+
0.3⋅(Kp)
+
(Kp)
дет иметь следующий вид:
n
n
В то время Эдером, вероятно, была предпри-
i
нята одна из первых попыток связать феномено-
i
k
[
L
]
∏
i
логическое уравнение с еще неизвестной про-
i=1
i=1
y
=
(18)
n
n
странственной структурой данной макромолеку-
i
n
1+
k L]
лы.
∏
i
i
=1
i
=1
Л. Полинг (1935) [48] переосмыслил уравнение
Следует отметить, что уравнение Эдера обес-
Эдера с позиции биофизической химии. Взяв за
основу геометрию макромолекулы в виде вариан-
печивает большее согласие с экспериментом не
только по причине более реалистичного пред-
тов расположения гемов по краям квадрата или в
ставления об оксигенации (рис. 1, кривая 3) как
вершинах тетраэдра, предложил свои версии
ступенчатом процессе связывания лигандов, но и
уравнения оксигенации. Уравнение, основанное
как математическая модель, имеющая четыре
на предположении о том, что макромолекула
представляет собой квадрат, оказалось ошибоч-
подгоночных параметра (K1-K4) вместо двух (p50
ным. Близкая к естественной структуре гембелка
и h), как в уравнении Хилла.
модель в виде тетраэдра привела к наиболее точ-
Однако нахождение коэффициентов Эдера за-
ному решению этой задачи:
труднено подбором исходных значений для этих
коэффициентов при их оптимизации. Это зача-
2
2
3
3
3
6
4
4
K
p
+
3⋅αK
p
+
3
⋅α
K
p
+α
K
p
(15)
e
e
e
e
стую приводит к большим ошибкам при вычисле-
y
=
,
2
2
3
3
3
6
4
4
1+
4
⋅
K
p
+
6
⋅αK
p
+
4
⋅α
K
p
+α
K
p
нии таких коэффициентов, в том числе, из-за
e
e
e
e
случайных ошибок экспериментальных данных
где Ke - константа связывания лиганда (RT∙lnKe -
[52, 53].
в представлениях термодинамики, как изменение
свободной энергии, сопровождающее присоеди-
нение кислорода к гему), α - константа (величина
МИОГЛОБИН И ГЕМОГЛОБИН - ПЕРВЫЕ
БЕЛКИ, ДЛЯ КОТОРЫХ ПОЛНОСТЬЮ
RT∙lnα трактуется в термодинамике, как дополни-
тельная свободная энергия, стабилизирующая
УСТАНОВЛЕНА ПРОСТРАНСТВЕННАЯ
две взаимодействующие группы
«кислород-
СТРУКТУРА
гем»).
Исследование структуры белков является од-
И. Клотц (1946) [49], работая с белком, имею-
ним из наиболее значимых направлений биофи-
щим множественные центры связывания каль-
зики, биохимии, молекулярной биологии, смеж-
ция, рассмотрел возможность применения зако-
ных с ними наук и является вполне самодостаточ-
на действующих масс к описанию связывания
ной задачей. Вместе с тем, более точное описание
большого количества лигандов с макромолеку-
процесса кооперативного связывания кислорода
лой. В частности, он выполнил деконволюцию
гемоглобином потребовало понимания про-
макроскопических констант до уровня микро-
странственной организации макромолекулы.
скопических констант равновесных реакций и
Предложенный М. Перутцем (1953) метод изо-
представил модифицированное уравнение Эдера
морфного замещения позволил вывести рентге-
(далее известное как уравнение Эдера-Клотца):
ноструктурный анализ на новый уровень, что да-
ло возможность впервые получить проекции рас-
2
3
4
k
p
+
2
⋅
k
k
p
+
3⋅
k
k
k
p
+
4
⋅
k
k
k
k
p
1
1
2
1
2
3
1
2
3
4
пределения электронной плотности для
y
=
,(16)
2
3
4
4
⋅
1
+
k
p
+
k
k
p
+
k
k
k
p
+
k
k
k
k
p
макромолекул миоглобина (Дж. Кендрю) и гемо-
(
1
1
2
1
2
3
1
2
3
4
)
глобина (М. Перутц). Л. Блюменфельд
(1954)
или способом, где знаменатель является стати-
обобщил свои исследования по структуре гемо-
стической суммой [50, 51]:
глобина и, предвосхищая результаты Перутца,
сделал вывод о существовании конформацион-
2
3
4
(17)
k
p
+
3
⋅
k
k
p
+
3
⋅
k
k
k
p
+
k
k
k
k
p
ных перестроек этой макромолекулы в ходе ее ок-
1
1
2
1
2
3
1
2
3
4
y
=
2
3
4
сигенации [54].
1+
4
⋅
k
1
p
+
6
⋅
k
1
k
2
p
+
4
⋅
k
1
k
2
k
3
p
+
k
1
k
2
k
3
k
4
p
Начатые Перутцем в 1937 году исследования
Из этого уравнения, зная численные значения
структуры гемоглобина при помощи дифракции
макроскопических констант K1-K4, которые мо-
рентгеновских лучей привели к определению
гут быть получены решением обратной задачи
Кендрю (1957) пространственного расположения
(т.е. аппроксимацией данной зависимости к экс-
полипептидных цепей миоглобина. Стало ясно,
периментальным данным), несложно вычислить
что молекулы белков не укладываются в суще-
(кажущиеся) константы равновесных реакций
ствующие структурные модели, основанные на
(k1-k4).
простом геометрическом порядке. С повышени-
БИОФИЗИКА том 67
№ 3
2022
426
ЛАВРИНЕНКО и др.
ем разрешающей способности получаемых изоб-
К достоинствам уравнения Бернарда следует
ражений Кендрю (1958) [55] и Перутц (1959) [56]
отнести простоту вычисления параметров (как и в
полностью установили пространственную орга-
уравнении Хилла). Однако при помощи этого
низацию этих белков.
уравнения невозможно оценить степень коопера-
тивного взаимодействия субъединиц макромоле-
Дальнейшие исследования Перутца преиму-
кулы.
щественно были направлены на понимание рабо-
ты «молекулярной машины» гемоглобина в части
стереохимии кооперативных эффектов
(1970)
НАЧАЛО СИСТЕМНЫХ ИССЛЕДОВАНИЙ
[57], а также вопросов регуляции аффинности
МЕХАНИЗМОВ РЕГУЛЯЦИИ АКТИВНОСТИ
кислорода к гембелку в контексте структурных
БИОМАКРОМОЛЕКУЛ
перестроек данной макромолекулы (1979) [58].
Исследование кооперативности белков допол-
ГИПОТЕЗА УАЙМЕНА-АЛЛЕНА
нилось изучением этого явления в нуклеиновых
И УРАВНЕНИЕ БЕРНАРДА
кислотах, что приводило к общему пониманию
механизмов регуляции синтеза белков и метабо-
Д. Аллен, К. Гуте и Дж. Уаймен (1950) провели
лических путей.
эксперименты по изучению кислородсвязываю-
щих свойств гемоглобина спектрофотометриче-
Начатые Ф. Жакобом и Ж. Моно совместно с
ским методом, отметив уникальность гемопроте-
А. Парди (1957-1959) [62] исследования по изуче-
идов, как самого разнообразного и красивого
нию лактозной системы привели к разработке
класса «молекулярных машин», известных био-
модели оперона прокариот (1961) [63], где рас-
химикам [59]. Далее Уаймен и Аллен (1951) пред-
сматривались регуляторные механизмы синтеза
приняли попытку интерпретировать связывание
белков. Расширяя область своих исследований в
кислорода с гемоглобином, а также некоторые
сторону изучения регуляции ферментативной ак-
другие родственные реакции в терминах струк-
тивности белков, Жакоб и Моно (1961-1962) от-
турных эффектов, отмечая, что этот белок может
метили следующее: «может показаться, что неко-
быть рассмотрен как фермент, расширяя тем са-
торые ферменты, действующие на критических
мым границы применимости аналитических вы-
стадиях метаболизма, избирательно наделены
водов своей работы [60].
специфическими функциями регуляции и коор-
динации, и с помощью этих белков данная биохи-
Основываясь на гипотезе Уаймена-Аллена,
мическая реакция, в конечном итоге, контроли-
предполагающей одновременное связывание
руется метаболитом, действующим скорее как
гембелком двух молекул кислорода, Бернард
физиологический «сигнал», чем как химически
(1960) предложил следующее уравнение оксиге-
необходимый компонент самой реакции»
нации [61]:
[64, 65].
2
4
2
⋅ω
(
p p
)
+
4
⋅ω
(
p p
)
50
50
Моно, Жакоб и Ж. Шанжё (1963) предлагают
y
=
14
(19)
2
4
концепцию «Аллостерические белки и системы
1+ω
(
p p
50
)
+ω
(
p p
50
)
клеточного контроля» [66], в рамках которой
где ω - некоторый постоянный кинетический
определены классы аллостерических эффектов и
коэффициент.
сформулированы общие свойства аллостериче-
ских систем.
Как следует из математических соотношений
констант, коэффициентов и переменных в этом
Основные тезисы концепции таковы:
уравнении, оно априори будет давать лучшее
приближение кривой оксигенации относительно
1) биологическая активность многих белков
уравнения Хилла. В уравнении Хилла два подго-
контролируется специфическими метаболитами,
ночных параметра - p50 и h, а уравнение Бернар-
не взаимодействующими непосредственно с суб-
да, имеющее то же самое количество параметров
стратами или продуктами реакций;
(ω и p50), также представлено в числителе суммой
2) эффект этих регуляторных агентов, по-ви-
двух слагаемых с показателями в степенях 2 и 4
димому, является результатом исключительно
(которые обоснованы как имеющие физический
конформационного изменения (аллостерическо-
смысл). Однако уравнение Бернарда менее эф-
го перехода), индуцируемого в белке, когда он
фективно в аппроксимации, чем уравнение Эде-
связывает агент;
ра, так как последнее содержит четыре подгоноч-
ных параметра K1-K4, а в числителе представлено
3) предполагается, что этот механизм играет
суммой четырех слагаемых с показателями в сте-
существенную роль в регуляции метаболической
пенях, соответствующих количеству последова-
активности, а также, возможно, специфическом
тельно присоединенных молекул кислорода.
контроле синтеза белка.
БИОФИЗИКА том 67
№ 3
2022
КООПЕРАТИВНОЕ СВЯЗЫВАНИЕ КИСЛОРОДА ГЕМОГЛОБИНОМ
427
СИММЕТРИЧНАЯ (СОГЛАСОВАННАЯ)
6) при переходе белка из одного состояния в
МОДЕЛЬ МОНО-УАЙМЕНА-ШАНЖЁ
другое его молекулярная симметрия сохраняется
(включая симметрию конформационных ограни-
Объединив усилия, Моно, Уаймен и Шанжё,
чений, налагаемых на каждую субъединицу).
рассматривая кооперативность на примере окси-
генации гемоглобина, предлагают модель (мо-
С формальной позиции функция состояния
дель MWC [67]), объясняющую аллостерические
равновесия между напряженными (Tense) и рас-
переходы в белках, состоящих из идентичных
слабленными (Relax) симметричными по субъ-
субъединиц (в оригинале статьи - протомеров).
единицам конформациям белка (доля R-форм)
Модель описывается следующими утвержде-
может описана как:
ниями [67]:
n
1) аллостерические белки представляют собой
(1 +
z)
R
=
,
(20)
олигомеры, субъединицы которых связаны таким
n
n
L(1+
kz)
+
1
(
+
z)
образом, чтобы все они занимали равнозначные
позиции (т.е. макромолекула имеет хотя бы одну
тогда степень насыщения белка лигандом будет
ось симметрии);
описана следующим уравнением:
2) каждому лиганду соответствует один и толь-
n−1
n−1
ко один сайт на каждой субъединице (т.е. симмет-
Lkz(1+
kz)
+
z(1
+
z)
рия каждого набора стереоспецифических рецеп-
y
=
,
(21)
n
n
L(1+
kz)
+
(1 +
z)
торов такая же, как симметрия молекулы);
3) конформация каждой субъединицы ограни-
где R - доля R-форм (молекул белка в R-состоя-
чена ее ассоциацией с другой субъединицей;
нии), L - равновесная константа (аллостериче-
4) по крайней мере два состояния обратимо
ская константа) для [T0]/[R0], а T0 и R0 - состоя-
доступны аллостерическим олигомерам; эти со-
ния макромолекул свободных от лигандов, k - от-
стояния отличаются распределением и/или энер-
ношение констант диссоциации KT и KR (т.е.
гией связей между субъединицами и, следова-
констант сродства к лиганду), z - нормированная
тельно, накладываемыми на них конформацион-
на KR концентрация лиганда, n - число лигандов.
ными ограничениями;
5) в результате таких взаимодействий изменя-
При L = 0 (одно состояние макромолекулы, R)
ется сродство одного (или нескольких) стерео-
и k = 1 отношение принимает вид уравнения
специфических сайтов к соответствующему ли-
Гюфнера (1) или тождественных ему уравнений
ганду при переходе из одного состояния в другое;
Ленгмюра (5) и Михаэлиса-Ментен (3):
n-1
−1
z(1+
z)
cK
p
z
R
c
y
=
=
=
=
=
(22)
n
−1
1+
z
1+
z
1+
cK
K
+
c p
+
p
(
)
R
R
50
Следует отметить, что в модели MWC (21) так-
МОДЕЛЬ ИНДУЦИРОВАННОГО
же просматриваются уравнения Хилла и Эдера,
СООТВЕТСТВИЯ (ПОСЛЕДОВАТЕЛЬНАЯ
так как все эти зависимости вытекают из закона
МОДЕЛЬ) КОШЛАНДА-НЕМЕТИ-
действующих масс [68].
ФИЛМЕРА
Как уже отмечалось, уравнение Хилла дает ра-
Модель симметричного взаимодействия Мо-
зумное приближение к экспериментальным дан-
но-Уаймена-Шанжё, так же, как и уравнение
ным и позволяет оценить величину кооператив-
Хилла, нашла свое широкое применение в энзи-
ного взаимодействия субъединиц. Уравнение
мологии и фармакологии, хорошо объясняя по-
Эдера не дает теоретического объяснения сущно-
ложительную кооперативность за счет изменения
сти этого процесса. Переосмыслив данное урав-
соотношения молекул в T и R состоянии. Вместе
нение, Полинг предпринял первую попытку свя-
с тем данная модель не позволяет выявить приро-
зать изменение этих констант с геометрией белка,
рассматривая одну константу как константу рав-
ду отрицательной кооперативности [26].
, а вторую - как константу взаимодей-
новесия Ke
В дальнейшем модель MWC была расширена и
ствия α, зависящую от геометрии макромолеку-
обобщена [25, 69, 70]. Рассматриваются более чем
лы.
два состояния макромолекулы, неидентичные
Д. Кошланд, Г. Немети и Д. Филмер (1966),
субъединицы и сайты связывания, а также присо-
опираясь на данные о структурной перестройке
единение различных по своему типу лигандов и
олигомеров, уточнили биохимический концепт
аллостерических модуляторов [27, 71-73].
механизма связывания лигандов макромолеку-
БИОФИЗИКА том 67
№ 3
2022
428
ЛАВРИНЕНКО и др.
лой, предложенного Полингом, и разработали
5) кооперативность должна возникать как
свою модель (модель KNF, известная также как
следствие взаимодействия между субъединица-
модель Полинга/Кошланда-Немети-Филмера)
ми;
[74, 75]. Модель построена на следующих допу-
6) сила такого взаимодействия варьируется и
щениях и ограничениях:
зависит от относительных конформаций вовле-
1) каждая субъединица олигомера может суще-
ченных в этот процесс субъединиц.
ствовать в одной из двух конформаций - неак-
тивной или активной, без сохранения молекуляр-
Авторы модели рассмотрели несколько вари-
ной симметрии макромолекулы;
антов взаимодействия субъединиц из использо-
2) только активная конформация способна в
ванной Полингом номенклатуры геометрических
конфигураций: тетраэдр, квадрат, линейная
значительной степени связывать лиганд;
структура и согласованная модель, в которой
3) связывание лиганда одной из субъединиц
конформации всех субъединиц меняются одно-
должно сопровождаться ее немедленным перехо-
временно. К этим конфигурациям выведены со-
дом из неактивной конформации в активную;
ответствующие уравнения связывания лигандов.
4) такой переход реализуется с помощью меха-
низма «индуцированной подгонки» («самосогла-
Уравнение для конфигурации «тетраэдр» име-
сованности»);
ет следующий вид:
3
4
2
3
3
3
K
(
AB C t
K K C])
+
3⋅
K
K
AB BB C t
(K K C])
+
3⋅
K
AB
K
(
BB C t
K K C])
+
6
4
+K
(
BB C t
K K C])
y
=
,
(23)
3
4
2
3
3
3
1+
4
⋅
K
(K K C]
)
+
6
⋅
K
K
(K K C])
+
4
⋅
K
K
(K K
[C])
+
AB C t
AB BB C t
AB
BB C t
6
4
+K
(K K C])
BB C t
где y - степень насыщения лигандом в пересчете
ми позволяют подойти к решению этого вопроса
на одну субъединицу, [A] - концентрация субъ-
[79].
единиц с неактивной конформацией, [B] - кон-
центрация субъединиц с активной конформаци-
УРАВНЕНИЯ, НЕСУЩИЕ В СВОЕЙ ОСНОВЕ
ей, [C] - концентрация лиганда, Kt - константа
ЭКСПОНЕНЦИАЛЬНЫЕ ЗАВИСИМОСТИ
равновесия [B]/[A], KC - константа равновесия
Рассмотренные ранее уравнения, соответству-
[BC]/([B][C]), KAB
- константа равновесия
ющие моделям MWC и KNF, несут в себе степен-
([AB][A])/([AA][B]), KBB - константа равновесия
ную зависимость и являются следствием закона
([ВB][A][A])/([AA][B][B]).
действующих масс. Рядом исследователей были
предприняты попытки получить альтернативные
При отсутствии взаимодействий между субъ-
модели связывания кислорода гемоглобином, ба-
единицами уравнение сводится к известной зави-
зирующиеся на постулировании переходного
симости (1):
процесса, к которому неприменим этот закон.
Скорость оксигенации гембелка в таком случае
K
C t
K C]
kp
p
y
=
=
=
(24)
определяется показательной (экспоненциаль-
1+
K
K C]
1+
kp p
+
p
ной) функцией.
50
C t
Исходя из этих представлений, И. Высочиной
Таким образом, последовательная модель сни-
(1963)
[80] предложено уравнение следующего
мает чрезмерное упрощение симметричной моде-
вида:
ли в представлении кооперативности [76, 77], как
синхронной структурной перестройки всей мак-
2
3
(bp)
(bp)
bp
ромолекулы, и учитывает конформационные из-
y
=
1
−
1+
bp
+
+
e-
,
(25)
менения отдельных сайтов связывания [78].
2
3
Тем не менее, А. Корниш-Боуден (2013) отме-
где b - переменный кинетический коэффициент.
чает, что обе модели MWC и KNF являются фе-
Опираясь в своей основе на уравнение Гюфне-
номенологическими и потому не отвечают на
ра и предполагая, что константа связывания ли-
фундаментальный вопрос о том, как связывание
ганда является функцией степени деформации
лиганда дает наблюдаемый аллостерический эф-
макромолекулы белка, экспоненциально завися-
фект. Современные программы расчетов струк-
щей от парциального давления кислорода,
тур белков в сочетании со структурными, термо-
П. Подрабинек и И. Каменский (1968) [81] пред-
динамическими и кинетическими исследования-
ставили свою модель:
БИОФИЗИКА том 67
№ 3
2022
КООПЕРАТИВНОЕ СВЯЗЫВАНИЕ КИСЛОРОДА ГЕМОГЛОБИНОМ
429
λp
менно (уравнение Хилла), комбинированно
γpe
y
=
,
(26)
(уравнение Бернарда) или последовательно
p
1+γpeλ
(уравнение Эдера).
где γ и λ - постоянные положительные кинетиче-
В работе [84] были сопоставлены разные моде-
ские коэффициенты, а k = γeλp - константа рав-
ли оксигенации с целью выяснить, какие из них
новесия реакции.
могут описать реальный эксперимент наилучшим
Уравнение, представленное Ю. Кисляковым и
образом. Был использован набор данных, полу-
соавт. (1975) [82], выглядит следующим образом:
ченных Р. Уинслоу (1977) [85], как одних из наи-
1
более полных и точных известных результатов из-
bp
b
мерений связывания кислорода гемоглобином.
y
=
1−
exp
−
,
(27)
(
)
10
Результаты проведенных исследований пока-
где b - кинетический коэффициент.
зывают, что близость высоких значений коэффи-
Функция, предложенная М. Ханиным (1978)
циентов детерминации для моделей Эдера, Бер-
[83], аналогична предыдущим и имеет следую-
нарда и Хилла в совокупности с общностью в
щий вид:
представлении ими процесса оксигенации могут
косвенно указывать на характер присоединения
2
p
y
=
1+δ
e-δ
,
(28)
кислорода гемоглобином, а именно на его сту-
1
пенчатость, обусловленную структурными пере-
где δ1 и δ2 - постоянные кинетические коэффи-
стройками макромолекулы белка при связыва-
циенты.
нии ею лигандов в ходе равновесных реакций.
Таким образом, построение уравнений окси-
При этом используемый в построении альтерна-
генации гемоглобина, в принципе, может быть
тивных моделей подход, который основан на экс-
основано как на степенных, так и на экспоненци-
поненциальной зависимости, в совокупности с
альных зависимостях.
высоким разбросом значений более низкого ко-
эффициента детерминации в этой группе уравне-
ний также, на наш взгляд, методом исключения
АНАЛИЗ МОДЕЛЕЙ КООПЕРАТИВНОГО
это подтверждает [84].
СВЯЗЫВАНИЯ КИСЛОРОДА
ГЕМОГЛОБИНОМ
Кластерный анализ показал общность в се-
Как было показано, существует ряд моделей,
мействах уравнений со степенной и экспоненци-
которые могут быть использованы для аппрокси-
альной зависимостями (рис. 2). Анализ выявил,
мации экспериментальных данных кривой дис-
что уравнение Эдера и скоррелированная с ним
социации оксигемоглобина. Также аналитически
модель Кошланда-Немети-Филмера в рамках
можно выявить взаимосвязь отношений, коэф-
формальных критериев наилучшим образом под-
фициентов и констант в приведенных уравнениях
ходят для аппроксимации и описания экспери-
оксигенации, что было выполнено ранее, и в
ментальных данных связывания гемоглобином
определенной степени, нами систематизировано.
кислорода [84].
Однако системная верификация наиболее из-
Тем не менее, следует подчеркнуть, что урав-
вестных моделей, описывающих связывание ге-
нение Эдера имеет наибольшее число подгоноч-
моглобина с кислородом, на предмет наилучшего
ных параметров относительно используемых
соответствия данным эксперимента не проводи-
уравнений, а это дает дополнительные преиму-
лась. Это обстоятельство не позволяет сравнить
щества с точки зрения качества аппроксимации
эффективность их аппроксимации, так как ранее
модели к экспериментальным данным. То же са-
проводившиеся разрозненные вычисления были
мое можно сказать и про модели MWC и KNF.
выполнены на неперекрывающихся наборах дан-
Однако если более сложная модель не давала бы
ных, имеющих различное количество экспери-
преимуществ в описании, точнее, в аппроксима-
ментальных точек, полученных с той или иной
ции экспериментальными данными, то следовало
погрешностью измерений.
бы остановиться на более простой симметричной
Для уравнений, соответствующих моделям
модели.
MWC и KNF, трудно решить обратную задачу (не
всегда можно найти значения подгоночных пара-
В итоге на вопрос, какая из моделей (или базы
метров). Вместе с тем уравнения для моделей Мо-
модели) ближе к реальному процессу оксигена-
но-Уаймена-Шанжё и Кошланда-Немети-
ции, можно ответить, оперируя методами кванто-
Филмера имеют общую основу с уравнениями
вой химии, молекулярной динамики или спосо-
Гюфнера, Хилла, Бернарда и Эдера, несущих в се-
бом, позволяющим оценить изменения на ато-
бе степенную зависимость, что позволяет также
марном уровне организации макромолекулы с
использовать их в качестве уравнений, определя-
оценкой энергии взаимодействия ее структурных
ющих способ присоединения лигандов: одновре-
элементов.
БИОФИЗИКА том 67
№ 3
2022
430
ЛАВРИНЕНКО и др.
Рис. 2. Дендрограмма (матрица расстояний) распределения некоторых моделей кривой диссоциации оксигемоглоби-
на; коэффициент детерминации (в скобках после автора модели) и дистанция между объектами указаны в миллион-
ных долях.
НОВАЯ ИНТЕРПРЕТАЦИЯ
h = θ(n)(n - 1) + 1,
(31)
КОЭФФИЦИЕНТА ХИЛЛА
где θ(n) - вводимый нами «относительный коэф-
Уравнение Хилла с h = 4 позволяет корректно
фициент кооперативности» белка, состоящего из
находить величину p50 (рис. 1, кривая 4). Однако,
n субъединиц. Тогда θ(n) = 0 указывает на отсут-
как уже отмечалось, наилучшее приближение в
ствие кооперативности, и коэффициент Хилла
описании оксигенации наблюдалось при h мень-
будет равен единице при любых n.
шем, чем число субъединиц n для этой макромо-
Число у коэффициента θ указывает на то, от
лекулы (рис. 1, кривая 2). Так как показатель сте-
какого числа субъединиц он был вычислен, что
пени в уравнении однозначно связывали с чис-
дает возможность легко находить h от θ(n) и на-
лом молекул гембелка в его агрегатах, а потом и
оборот (см. [86]).
субъединиц в макромолекуле, то, разумеется, фи-
Заметим, что подобный подход позволяет по-
зический смысл величины h стал неочевиден.
строить новую оценку кооперативности. По-ви-
Мы предприняли попытку снять это противо-
димому, явление кооперативности можно опи-
речие для h путем «разобщения» параметра, опре-
сывать при помощи разных подходов, и
деляющего силу взаимодействия субъединиц и
исследование их соотношения и связи с механиз-
числа этих субъединиц n, которое имеет очевид-
мами проявления аллостерии на молекулярном
ный физический смысл [86].
уровне - задача дальнейших исследований [87].
В самой простой модели это выглядит следую-
Мы полагаем, что подходы к описанию явления
щим образом:
кооперативности и аллостерических эффектов,
разработанные в применении к гемоглобину, мо-
h = n - b,
(29)
гут быть использованы и для других адсорбцион-
где b - разность или «дефицит» между коэффици-
ных систем (см., например, работу [21]).
ентом Хилла и числом субъединиц.
Величина b не сопряжена с n, является кон-
ЗАКЛЮЧЕНИЕ
стантой, но, в принципе, должна зависеть от n.
Можно ввести коэффициент пропорциональ-
История исследования связывания гемогло-
ности a для n, который обеспечивает сопряжение
бином кислорода с точки зрения теории адсорб-
h с n.
ции и моделей, которые приводят к различным
(30)
формальным описаниям этого явления, пред-
h
=
an
ставляет собой научную ретроспективу, которая
Однако для h = 1 a будет приобретать различ-
может быть полезна для исследователей, работа-
ные значения в зависимости от n, что затрудняет
ющих в самых разных областях молекулярной
его интерпретацию.
биофизики. Здесь мы постарались показать эту
Поэтому зависимость h от n лучше представить
историю под углом исследования феномена ко-
в виде уравнения y = ax + b:
оперативности, соединив описание классических
БИОФИЗИКА том 67
№ 3
2022
КООПЕРАТИВНОЕ СВЯЗЫВАНИЕ КИСЛОРОДА ГЕМОГЛОБИНОМ
431
работ с некоторыми из наших исследований и
10.
E. Duclaux, Traité de microbiologie: Diastases, toxines
обобщений. Отдельно следует выделить вклад в
et venins, Vol. II (Masson et Cie., Paris, 1899).
эту историю Л.А. Блюменфельда: его книга «Ге-
11.
V. Henri, Zeitschrift für physikalische Chemie 39 (1),
194 (1902). DOI: 10.1515/zpch-1902-3912
моглобин и обратимое присоединение кислоро-
да» стала для нас проводником в мир исследова-
12.
A. J. Brown, J. Chem. Society Trans. 81, 373 (1902).
DOI: 10.1039/CT9028100373
ния этой удивительной «молекулярной маши-
13.
L. Michaelis and M. L. Menten, Biochem. 49 (333-
ны», несущей кислород и дарующей жизнь [54].
369), 352 (1913).
Следует также отметить обзорную статью
14.
I. Langmuir, J. Am. Chem. Soc. 38, 2267 (1916). DOI:
М. Перутца, которая подытожила его исследова-
10.1021/ja02268a002
ния оксигенации [88], а также книгу «Мне бы рас-
15.
J. Monod, Annu. Rev. Microbiol. 3 (1), 371 (1949).
сердить вас раньше» - эссе о науке, ученых и гу-
DOI: 10.1146/annurev.mi.03.100149.002103
манизме [89].
16.
A. V. Hill, J. Physiol. 40, i (1910).
17.
E. Ising, Beitrag zur theorie des ferro-und paramagnetis-
mus (Grefe & Tiedemann, Hamburg, 1924).
БЛАГОДАРНОСТИ
18.
D. R. Hartree, In Math. Proc. of the Cambridge Phil-
Авторы считают своим приятным долгом вы-
osophical Society (Cambridge University Press, Cam-
разить благодарность рецензентам за критиче-
bridge,
1928),
pp.
111-132.
DOI:
ский анализ рукописи и ценные замечания.
10.1017/S0305004100011920
19.
R. H. Fowler, P. Kapitza, In Proc. Roy. Soc. Lond.
Ser. A, Containing Papers of a Mathematical and
ФИНАНСИРОВАНИЕ РАБОТЫ
Physical Character
124
(793),
1
(1929). DOI:
Работа выполнена при частичной финансовой
10.1098/rspa.1929.0095
20.
Yu. D. Nechipurenko and G. V. Gursky, Bioph.
поддержке Программы фундаментальных науч-
Chem.
24,
195
(1986). DOI:
10.1016/0301-
ных исследований в Российской Федерации на
4622(86)85025-6
долгосрочный период (2021-2030 годы) (тема
21.
Ю. Д. Нечипуренко, Анализ связывания биологиче-
121052600299-1).
ски активных соединений с нуклеиновыми кислота-
ми (Ин-т комп. исслед. (ИКИ), М. - Ижевск,
2015).
КОНФЛИКТ ИНТЕРЕСОВ
22.
G. S. Adair, A. V. Bock, and H. Jr. Field, J. Biol.
Авторы заявляют об отсутствии конфликта
Chem. 63, 529 (1925).
интересов.
23.
T. Svedberg and R. Fåhraeus, J. Am. Chem. Soc. 48
(2), 430 (1926). DOI: 10.1021/ja01413a019
24.
J. T. Edsall, J. Hist. Biol. 5 (2), 205 (1972). DOI:
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
10.1007/BF00346659
Настоящая статья не содержит каких-либо ис-
25.
A. Horovitz, Proc. Roy. Soc. Lond. B. Biol. Sci. 229
следований с участием людей или животных в ка-
(1256), 315 (1986).
честве объектов исследований.
26.
H. Abeliovich, Biophys. J. 89 (1), 76 (2005). DOI:
10.1529/biophysj.105.060194
СПИСОК ЛИТЕРАТУРЫ
27.
O. Rapp and O. Yifrach, PLoS One 12 (8), e0182871
(2017). DOI: 10.1371/journal.pone.0182871
1. J. Wyman and S. J. Gill, Binding and Linkage: Func-
tional Chemistry of Biological Macromolecules (Univer-
28.
C. F. S. Bonafe, D. F. L. Neto, E. A. Martínez, et al.,
sity Science Books, Mill Valley CA, 1990).
Chem. Zvesti.
74
(9),
2861
(2020). DOI:
2. A. Y. Ben-Naim, Cooperativity and regulation in bio-
10.1007/s11696-020-01125-1
chemical processes (Springer, Boston MA, 2001). DOI:
29.
R. H. Dahl, S. Taudorf, D. M. Bailey, et al., Exp.
10.1007/978-1-4757-3302-0
Physiol. 105 (7), 1063 (2020). DOI: 10.1113/EP088615
3. В. Ф. Левченко, Биосфера: этапы жизни (эволюция
30.
S. Srinivasan, F. H. Waghu, S. Idicula-Thomas, et al.,
частей и целого) (Свое издательство, СПб, 2012).
Biochim. Biophys. Acta. Biomembranes 1862 (4),
4. C.-L. Berthollet, Essai de statique chimique (Chez
183242 (2020). DOI: 10.1016/j.bbamem.2020.183242
Firmin Didot, Paris, 1803).
31.
A. M. Saleh and D. C. Batlle, J. Clin. Invest. 85 (6),
5. P. Waage and C. M. Guldberg, CM Forhandlinger: Vi-
1734 (1990). DOI: 10.1172/JCI114629
denskabs-Selskabet i Christiana
35
(1864). DOI:
32.
A. G. Marangoni, Enzyme kinetics: a modern approach
10.1021/ED063P1044
(John Wiley & Sons, 2003). DOI: 10.1002/0471267295
6. J. H. van't Hoff, Berichte der deutschen chemischen
33.
A. K. Bordbar, Z. Saadati, and N. Sohrabi, Acta Bio-
Gesellschaft
10
(1),
669
(1877).
DOI:
chim. Pol.
51
(4),
963
(2004).
DOI:
10.1002/CBER.187701001185
10.18388/abp.2004_3529
7. G. Hüfner, Arch. ges. Physiol. 31, 28 (1890).
34.
P. Messina, G. Prieto, V. Dodero, et al., Biopolymers.
8. C. O'Sullivan and F. W. Tompson, J. Chem. Society
79 (6), 300 (2005). DOI: 10.1002/bip.20353
Trans. 57, 834 (1890). DOI: 10.1039/CT8905700834
35.
L. Endrenyi, C. Fajszi, and F. H. Kwong, Eur. J. Bio-
9. A. V. Harcourt, J. Chem. Society 20, 460 (1867). DOI:
chem.
51
(2),
317
(1975). DOI:
10.1111/j.1432-
10.1039/JS8672000460
1033.1975.tb03931.x
БИОФИЗИКА том 67
№ 3
2022
432
ЛАВРИНЕНКО и др.
36.
H. P. Rang, Br. J. Pharmacol. 147 (S1), S9 (2006).
64.
J. Monod and F. Jacob, Cold Spring Harb. Symp.
DOI: 10.1038/sj.bjp.0706457
Quant.
Biol.
26,
389
(1961).
DOI:
37.
R. Cammack, T. Atwood, P. Campbell, et al., Oxford
10.1101/SQB.1961.026.01.048
Dictionary of Biochemistry and Molecular Biology (Ox-
65.
J. Monod, F. Jacob, and F. Gros, Biochem. Soc. Sym-
ford
University
Press,
2008).
DOI:
pos. (Cambridge, Engl.) (21), 104 (1962).
10.1093/acref/9780198529170.001.0001
66.
J. Monod, J.-P. Changeux, and F. Jacob, J. Mol. Biol.
38.
A. Karlin, J. Theor. Biol. 16 (2), 306 (1967). DOI:
6
(4),
306
(1963).
DOI:
10.1016/S0022-
10.1016/0022-5193(67)90011-2
2836(63)80091-1
39.
Ч. Кантор и П. Шиммел, Биофизическая химия
67.
J. Monod, J. Wyman, and J.-P. Changeux, J. Mol. Bi-
(Мир, М., 1984).
ol.
12
(1),
88
(1965). DOI:
10.1016/S0022-
40.
S. A. Frank, Biol. Direct. 8 (1), 1 (2013). DOI:
2836(65)80285-6
10.1186/1745-6150-8-31
68.
M. I. Stefan, S. J. Edelstein, and N. Le Novère, BMC
Syst. Biol. 3 (1), 68 (2009). DOI: 10.1186/1752-0509-
41.
M. I. Stefan and N. Le Novere, PLoS Comput. Biol. 9
3-68
(6), e1003106
(2013). DOI:
10.1371/journal.pc-
bi.1003106
69.
S. J. Edelstein, J. Mol. Biol. 426 (1), 39 (2014). DOI:
10.1016/j.jmb.2013.09.010
42.
Z. Konkoli, Theor. Biol. Med. Model. 8 (1), 10 (2011).
DOI: 10.1186/1742-4682-8-10
70.
A. Horovitz and T. Mondal, J. Phys. Chem. B. 125 (1),
70 (2021). DOI: 10.1021/acs.jpcb.0c09351
43.
S. Goutelle, M. Maurin, F. Rougier, et al., Fundam.
Clin. Pharmacol.
22
(6),
633
(2008). DOI:
71.
J.-H. S. Hofmeyr, and H. Cornish-Bowden, Bioinfor-
10.1111/j.1472-8206.2008.00633.x
matics. 13 (4), 377 (1997). DOI: 10.1093/BIOINFOR-
MATICS/13.4.377
44.
J. Li, X. Zhu, M. Byrnes, et al., J. Biol. Chem. 268
(33),
24599
(1993).
DOI:
10.1016/s0021-
72.
J. N. Weiss, FASEB J. 11 (11), 835 (1997). DOI:
9258(19)74508-6
10.1096/fasebj.11.11.9285481
45.
H. Aramaki, H. Kabata, S. Takeda, et al., Genes Cells
73.
N. Kaihnsa, Y. Ren, M. Safey El Din, et al., J. Math.
16
(12),
1200
(2011).
DOI:
10.1111/j.1365-
Biol. 81 (4), 1169 (2020). DOI: 10.1007/s00285-020-
2443.2011.01563.x
01540-8
46.
S. Ding and F. Sachs, J. Gen. Physiol. 113 (5), 695
74.
D. E. Koshland Jr, G. Némethy, and D. Filmer, Bio-
(1999). DOI: 10.1085/jgp.113.5.695
chemistry
5
(1),
365
(1966).
DOI:
47.
M. L. Coval, J. Biol. Chem. 245 (23), 6335 (1970).
10.1021/BI00865A047
DOI: 10.1016/S0021-9258(18)62614-6
75.
W. A. Eaton, E. R. Henry, J. Hofrichter, et al., Nat.
48.
L. Pauling, Proc. Natl. Acad Sci. USA 21 (4), 186
Struct. Biol. 6 (4), 351 (1999). DOI: 10.1038/7586
(1935). DOI: 10.1073/pnas.21.4.186
76.
G. Weber, Nature 300 (5893), 603 (1982). DOI:
49.
I. M. Klotz, Arch. Biochem. Biophys. 9 109 (1946).
10.1038/300603a0
50.
I. Tyuma, K. Imai, and K. Shimizu, Biochemistry 12
77.
L. Lee, Biophys. Physicobiol. 16, 490 (2019). DOI:
(8), 1491 (1973). DOI: 10.1021/bi00732a004
10.2142/biophysico.16.0_490
51.
T. Yonetani, S. I. Park, A. Tsuneshige, et al., J. Biol.
78.
T. R. Chay and C. Ho, Proc. Natl. Acad Sci. USA 70
Chem.
277
(37),
34508
(2002).
DOI:
(12), 3914 (1973). DOI: 10.1073/PNAS.70.12.3914
10.1074/jbc.M203135200
79.
A. Cornish-Bowden, FEBS J. 281 (2), 621 (2014).
52.
K. Imai, Biophys. Chem. 37 (1), 197 (1990). DOI:
DOI: 10.1111/febs.12469
10.1016/0301-4622(90)88019-O
80.
И. В. Высочина, Биофизика. 8, 361 (1963).
53.
J. Lópeš Fidalgo and M. M. Rodríguez-Hernández,
81.
П. А. Подрабинек и И. И. Каменский, Молеку-
Chemometr. Intell. Lab. Syst. 138 133 (2014). DOI:
ляр. биология 2, 120 (1968).
10.1016/J.CHEMOLAB.2014.07.014
82.
Ю. А. Кисляков, Математическое моделирование
54.
Л. А. Блюменфельд, Гемоглобин и обратимое при-
кровообращения и газообмена в мозгу (Наука. Ле-
соединение кислорода (Сов. наука, М., 1957).
нингр. отд-ние, Л., 1975).
55.
J. C. Kendrew, G. Bodo, H. M. Dintzis, et al., Nature
83.
М. А. Ханин, Н. Л. Дорфман, И. Б. Бухаров и др.,
181 (4610), 662 (1958). DOI: 10.1038/181662a0
Экстремальные принципы в биологии и физиологии
56.
M. F. Perutz, M. G. Rossmann, A. F. Cullis, et al.,
(Наука, М., 1978).
Nature
185
(4711),
416
(1960).
DOI:
84.
И. А. Лавриненко, Г. А. Вашанов, В. Ю. Сулин и
10.1038/185416A0
др., Биофизика
66
(6)
1065
(2021). DOI:
57.
M. F. Perutz, Nature 228 (5273), 726 (1970). DOI:
10.31857/S000630292106003X
10.1038/228726A0
58.
M. Perutz, Annu. Rev. Biochem. 48 (1), 327 (1979).
85.
R. M. Winslow, M. Swenberg, R. L. Berger, et al., J.
DOI: 10.1146/ANNUREV.BI.48.070179.001551
Biol. Chem. 252, 2331 (1977). DOI: 10.1016/S0021-
9258(17)40559-X
59.
D. W. Allen, K. F. Guthe, and J. Wyman Jr, J. Biol.
Chem. 187 (1), 393 (1950). DOI: 10.1016/s0021-
86.
И. А. Лавриненко, Г. А. Вашанов и Ю. Д. Нечипу-
9258(19)50965-6
ренко, Биофизика
67
(2),
229
(2022). DOI:
60.
J. Wyman Jr and D. W. Allen, J. Polym. Sci. 7 (5), 499
10.31857/S000630292202003X
(1951). DOI: 10.1002/POL.1951.120070506
87.
И. А. Лавриненко, Г. А. Вашанов и Ю. Д. Нечи-
61.
S. R. Bernard, Bull. Math. Biophys. 22 (4), 391 (1960).
пуренко, Биофизика 67 (3), 444 (2022).
DOI: 10.1007/BF02476569
88.
M. F. Perutz, Q. Rev. Biophys. 22 (2), 139 (1989).
62.
A. B. Pardee, F. Jacob, and J. Monod, J. Mol. Biol. 1
DOI: 10.1017/s0033583500003826
(2), 165 (1959). DOI: 10.1016/S0022-2836(59)80045-0
89.
M. F. Perutz, I Wish I’d Made You Angry Earlier: Es-
63.
F. Jacob and J. Monod, J. Mol. Biol. 3 (3), 318 (1961).
says on Science, Scientists, and Humanity (Oxford Uni-
DOI: 10.1016/S0022-2836(61)80072-7
versity Press, Oxford, 2002).
БИОФИЗИКА том 67
№ 3
2022
КООПЕРАТИВНОЕ СВЯЗЫВАНИЕ КИСЛОРОДА ГЕМОГЛОБИНОМ
433
Cooperative Oxygen Binding by Hemoglobin as a General Model
in Molecular Biophysics
I.A. Lavrinenko*, G.A. Vashanov*, A.S. Buchelnikov**, and Yu.D. Nechipurenko**, ***
*Voronezh State University, Universitetskaya pl. 1, Voronezh, 394018 Russia
**Sevastopol State University, Universitetskaya ul. 33, Sevastopol, 299053 Russia
***Engelhardt Institute of Molecular Biology, Russian Academy of Sciences, ul. Vavilova 32, Moscow, 119991 Russia
The study of hemoglobin and the description of its oxygenation, the thermodynamic and mathematical mod-
els developed for these purposes represent a very great advance in biophysics, and the proposed equations, in
particular the Hill equation, has had an impact on the development of science in different fields. Hemoglobin
and its allosteric mechanism of regulation of the binding of oxygen and other ligands served as a model for a
huge number of molecular biological systems. The review focuses on the formal description of oxygen binding
by hemoglobin and considers the main mathematical models developed in this area. The evolution of binding
models can be seen dating from the approaches proposed by Hill, Adair, Monod-Wyman-Changeux and
Koshland-Némethy-Filmer to the modern views. Particular attention is paid to different formal approaches
and ideas to the description of oxygenation as a phenomenon of physical adsorption.
Keywords: hemoglobin, cooperativity and allostery, Hill equation, Adair equation, Bernard equation, Monod-
Wyman-Changeux model, Koshland-Némethy-Filmer model, symmetric and sequential models, adsorption
models
БИОФИЗИКА том 67
№ 3
2022