БИОФИЗИКА, 2022, том 67, № 3, с. 434-443
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
КАТИОНЫ НИТРОЗОНИЯ КАК НАИБОЛЕЕ ЭФФЕКТИВНЫЕ
В ЦИТОТОКСИЧЕСКОМ ОТНОШЕНИИ КОМПОНЕНТЫ
ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА
© 2022 г. А.Ф. Ванин
Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН, 119991, Москва, ул. Косыгина, 4
E-mail: vanin@polymer.chph.ras.ru
Поступила в редакцию 04.03.2022 г.
После доработки 04.03.2022 г.
Принята к публикации 09.03.2022 г.
Суммированы экспериментальные данные, свидетельствующие о способности динитрозильных
комплексов железа выступать в качестве доноров не только молекулярного оксида азота (NO), но и
катионов нитрозония (NO+). При нейтральных («физиологических») значениях рН в отсутствие
тиолов эти катионы превращаются в результате гидролиза в анионы нитрита, тогда в присутствии
тиолов - в S-нитрозотиолы. Именно последнее определяет цитотоксическое действие динитро-
зильных комплексов железа как доноров NO+ на живые организмы.
Ключевые слова: катионы нитрозония, динитрозильные комплексы железа, оксид азота.
DOI: 10.31857/S0006302922030024, EDN: AMYDCZ
КАТИОНЫ НИТРОЗОНИЯ —
рактеризующегося сигналом ЭПР с резонансной
КОМПОНЕНТЫ ДИНИТРОЗИЛЬНЫХ
структурой [5-7].
КОМПЛЕКСОВ ЖЕЛЕЗА
Вместе с тем были получены данные о том, что
катионы нитрозония могут появляться в живых
В настоящее время установлено, что один из
организмах и в отсутствие кислорода, т.е. без уча-
универсальных регуляторов метаболических про-
стия диоксида азота, в анаэробных условиях в хо-
цессов - оксид азота (NO), функционирующий
де образования в живых организмах динитро-
во всех живых организмах, способен оказывать на
зильных комплексов железа (ДНКЖ) [8-10]. Есть
них не только позитивное, регуляторное, но и не-
основание предполагать, что включение NO в эти
гативное, цитотоксическое действие [1]. Послед-
комплексы сопровождается трансформацией по-
нее в большей степени характерно не для ней-
ловины его молекул в катионы нитрозония в ка-
тральной, молекулярной формы NO, а для его од-
честве нитрозильных лигандов в железо-динит-
ноэлектронно-окисленной формы
— катиона
розильном фрагменте ДНКЖ, одна из резонанс-
нитрозония (NO+) [2-6]. Сейчас большинством
ных структур которого описывается как
исследователей предполагается, что эта форма
Fe2+(NO)(NO+) [11-14].
появляется в живых организмах в присутствии
В основе указанной трансформации лежит ре-
кислорода, окисляющего NO до диоксида азота
акция диспропорционирования двух молекул NO
(NO2) c последующим его превращением в три-
(их взаимное одноэлектронное окисление-вос-
оксид азота (N2O3), представляющий собой ад-
становление), чему способствует попарное свя-
дукт диоксида и оксида азота. Реакция диспро-
зывание молекул NO с ионом Fe2+ на начальной
порционирования этих компонентов аддукта
стадии образования ДНКЖ в присутствии анион-
собственно и приводит к появлению донора кати-
ных (L-) лигандов (схема 1) [13, 14].
онов нитрозония (NO + NO2-) - соединения, ха-
Гидролиз аниона нитроксила, образующегося
в результате диспропорционирования молекул
Сокращения: ДНКЖ - динитрозильные комплексы железа,
NO в этих комплексах, приводит к образованию
М-ДНКЖ - моноядерные динитрозильные комплексы
молекулы нитроксила (HNO), выходящей из ли-
железа, Б-ДНКЖ - биядерные динитрозильные комплек-
сы железа, МНКЖ - мононитрозильные комплексы желе- гандного окружения железа с последующими
за, СТС - сверхтонкая структура, GSH -глутатион, NAC -
включением в освободившееся место третьей мо-
N-ацетил-L-цистеин, ДЭТК
- диэтилдитиокарбамат,
МГД - N-метил-D-глюкаминдитиокарбамат, МС - мер-
лекулы NO. завершающем синтез ДНКЖ — низ-
каптосукцинат, ТС - тиосульфат.
коспиновых (с S = 1/2) моноядерных комплексов
434
КАТИОНЫ НИТРОЗОНИЯ
435
ми, характеризующимися в соответствии со схе-
мой 3 резонансной структурой [(L)2Fe2+(NO)]
[21].
В отличие от М-ДНКЖ, МНКЖ с анионными
Cхема 1. Предполагаемый механизм синтеза М-ДНКЖ.
лигандами нетиоловой природы представляют
собой высокоспиновые (c S = 3/2) комплексы, ха-
рактеризующиеся cущественно более широкими,
чем сигналы 2.03, сигналами ЭПР с полушири-
ной ~160 мТл и тремя значениями g-фактора -
3.95, 4.00 и 2.00 (рис. 1а, спектры 1-5). В отсут-
ствие тиолсодержащих лигандов эти комплексы,
Cхема 2. Равновесие между М- и Б-ДНКЖ.
как правило, неустойчивы и при удалении газо-
образного NO из раствора быстро распадаются.
Столь же быстро распадаются и исходные ДНКЖ
с теми же лигандами, но уже не в результате вы-
свобождения из них молекул NO, а, как уже было
сказано, вследствие гидролиза катионов нитрозо-
ния, входящих наряду с молекулами NO в состав
Схема 3. Возникновение мононитрозильных ком-
плексов железа.
ДНКЖ [21].
Столь быстрый распад не характерен для
М-ДНКЖ, включающих в себя анионные, иони-
(М-ДНКЖ), одна из резонансных структур кото-
зованные по тиоловым группам тиолсодержащие
рых в соответствии со схемой 1 описывается как
лиганды. В этих комплексах из-за высокой элек-
[(L)2Fe2+(NO+)(NO)]. Вне зависимости от при-
тронной π-донорной активности атомов тиоло-
роды анионных лигандов все эти М-ДНКЖ ха-
вой серы, передающих часть электронной плот-
рактеризуются сигналами ЭПР с центром при
ности на катионы нитрозония, положительный
g = 2.03 и полушириной ~ 6-4 мТл с двумя
заряд на этих лигандах снижается и тем самым
(рис. 1в, сигналы 1-5) или тремя различными
предотвращается их связывание с анионами гид-
значениями тензора g-фактора (рис. 1а, сигналы
роксила, т. е. гидролиз этих катионов. В результа-
2'-5') - показателями соответственно аксиаль-
те резко повышается стабильность М-ДНКЖ, так
ной или более низкой ромбической симметрии
что полностью подавляется их превращение в со-
ДНКЖ (18, 15).
ответствующие МНКЖ [18, 19].
Согласно работе [19] резонансная структура
Последние, т. е. МНКЖ с тиол-содержащими
лигандами возникают, но не в ходе распада соот-
[Fe2+(NO)(NO+)], описывающая состояние же-
ветствующих М-ДНКЖ, а на начальной стадии
лезо-динитрозильного фрагмента в М-ДНКЖ,
образования этих комплексов в реакции газооб-
также характерна для тех же фрагментов, включа-
разного NO, тиолов и ионов двухвалентного же-
ющихся в биядерную форму ДНКЖ (Б-ДНКЖ,
леза, обычно при недостатке NO. Возникающие
формула [(L)2Fe2+2(NO+)2(NO)2]). Эта форма в
на этой стадии МНКЖ с тиолсодержащими ли-
соответствии co схемой 2 возникает при недо-
гандами [формула (RS)2Fe2+(NO)] представляют
статке анионных лигандов и обратимо в соответ-
собой низкоспиновые (с S = 1/2) комплексы, ха-
ствии с химическим равновесием между Б-ДН-
рактеризующиеся сигналом ЭПР со слабо выра-
КЖ и М-ДНКЖ переходит в М-ДНКЖ [20].
женной анизотропией g-фактора со средним его
Анионные лиганды включаются в Б-ДНКЖ в
значением, равным 2.04 (рис. 1б, спектр 2). При
качестве мостиков, связывающих два железо-ди-
регистрации этого сигнала при комнатной темпе-
нитрозильных фрагмента, обеспечивая спарива-
ратуре регистрируется сигнал ЭПР с триплетной
ние спинов этих фрагментов. В результате Б-ДН-
сверхтонкой структурой (СТС) с расщеплением ~
КЖ становятся диамагнитными и не дают сигна-
1.2 мТл, обусловленной взаимодействием неспа-
ла ЭПР. Основной характеристикой этих
ренного электрона с ядром азота NO-лиганда со
комплексов являются спектры оптического по-
спином I = 1 (рис. 1б, спектры 1 и 3).
глощения с четко выраженными полосами на 310
и 360 нм [20].
При последующей обработке МНКЖ с тиолсо-
держащими лигандами газообразным NO они пре-
Гидролиз катиона нитрозония в составе М-
вращаются в соответствующие М-ДНКЖ, харак-
ДНКЖ (или Б-ДНКЖ) до азотистой кислоты
(или анионов нитрита) с последующим их выхо-
теризующиеся формулой [(RS)2Fe2+(NO)(NO+)].
дом из состава этих комплексов приводит к их
Эта формула, а именно наличие в комплексах двух
превращению в мононитрозильные комплексы
нитрозильных и двух тиолсодержащих лигандов
железа (МНКЖ) с теми же анионными лиганда-
следует из анализа СТС сигнала ЭПР М-ДНКЖ с
БИОФИЗИКА том 67
№ 3
2022
436
ВАНИН
Рис. 1. Сигналы ЭПР М-ДНКЖ и МНКЖ с различными анионными лигандами. (а) - Cигналы ЭПР высокоспиновых
МНКЖ (спектры 1-5) и низкоспиновых М-ДНКЖ (спектры 2’-5’) соответственно с ЭДТА (спектр 1), цитратом
(спектры 2, 2’), аскорбатом (спектры 3, 3’), фосфатом (спектры 4, 4’) и водой (спектры 5, 5’) Запись при 77 К [15]. (б) -
Cигналы ЭПР МНКЖ с цистеином, запись при 293 K (спектр 1) и 77 К (спектр 2) [16]; сумма ЭПР-сигналов МНКЖ
и М-ДНКЖ с цистеином (спектр 3) и сигнал ЭПР М-ДНКЖ с цистеином (спектр 4); запись при 290 К [17]. (в) - Cиг-
налы ЭПР эндогенных М-ДНКЖ с тиолсодержащими лигандами при g = 2.04 и 2.014, зарегистрированные при 290 К
в печени кролика и дрожжевых клетках (спектры 1, 2); сигналы ЭПР М-ДНКЖ (14NO) с цистеином (спектры 3, 3’),
М-ДНКЖ (15NO) с цистеином (спектры 4, 4’) и М-ДНКЖ (57Fe) c цистеином (спектры 5, 5’), зарегистрированные при
77 К (спектры 1, 3-5) или 290 К (спектры 2, 3’-5’). Сигнал ЭПР при g = 2,0 на спектрах 1 и 2 обусловлен эндогенными
свободными радикалами (18).
БИОФИЗИКА том 67
№ 3
2022
КАТИОНЫ НИТРОЗОНИЯ
437
цистеином, зарегистрированного при комнатной
температуре (рис. 1в, спектры 3’-5’). Характерная
для этого сигнала тринадцатикомпонентная СТС
определяется взаимодействием неспаренного
электрона с ядрами азота 14N двух нитрозильных
лигандов, обеспечивающим появление квинтет-
ной СТС, с дополнительным пятикратным сверх-
тонким расщеплением на четырех протонах (c I =
1/2) метиленовых групп двух цистеиновых (RS-)
лигандов. При замене в нитрозильных лигандах
14N на 15N (I = 1/2) вместо тринадцатикомпонент-
ной СТС регистрируется девятикомпонентная
СТС (рис. 1в, спектры 3’ и 4’). Замена в М-ДНКЖ
обычного железа 56Fe на его изотоп 57Fe, характе-
ризующийся наличием ядерного спина с I = 1/2,
вызывает дублетное (~ 1.2 мТл) сверхтонкое рас-
щепление сигнала, свидетельствующее о наличии
в этих комплексах только одного атома железа
(рис. 1в, спектр 5’). При регистрации сигнала ЭПР
М-ДНКЖ с тиолсодержащими лигандами при
низкой температуре (в замороженных растворах)
форма сигнала определяется в основном анизотро-
пией g-фактора (g⊥ = 2.04, g|| = 2.014) (рис. 1в,
спектры 3-5).
При контакте низкомолекулярных М- и
Б-ДНКЖ с внутриклеточными белками железо-
Рис. 2. Сигналы ЭПР растворов БСА, обработанных
динитрозильные
[Fe2+(NO+)(NO)]-фрагменты
ДНКЖ с фосфатом (спектр 1); обработанных Fe2+ +
+ NO (спектр 2); после добавления цистеина к
из этих комплексов переходят на тиоловые груп-
препарату 1 (спектр 3); после вычитания сигнала ЭПР
пы белков с образованием устойчивых М- и Б-
М-ДНКЖ с цистеином (спектр 7) из спектра 3
ДНКЖ с белковыми тиолсодержащими лиганда-
(спектр
4); после осаждения белка сульфатом
ми, при этом сохраняется химическое равновесие
аммония (спектр 5); спектры 6 и 7 - сигналы ЭПР М-
между низкомолекулярными и белковыми ДН-
ДНКЖ с цистеином. Спектры
1-5 и
7
-
КЖ, как правило, резко сдвинутое в сторону бел-
зарегистрированы при 290 К, спектр 6 — при 77 К
ковых ДНКЖ. В отличие от низкомолекулярных
[22).
М-ДНКЖ с тиолсодержащими лигандами, даю-
щими при комнатной температуре узкие симмет-
ричные сигналы ЭПР с полушириной 0.7 мТл,
Как указывалось выше, в отсутствие тиолсо-
белковые ДНКЖ характеризуются анизотроп-
держащих лигандов это равновесие неустойчиво
ным сигналом ЭПР, совпадающим с сигналом
из-за быстрого гидролиза катиона нитрозония,
ЭПР замороженных растворов М-ДНКЖ с низ-
превращающегося при сохранении нейтральных
комолекулярными тиолсодержащими лиганда-
значений рН в анион нитрита. Таким образом,
ми. В качестве иллюстрации на рис. 2 приведены
инкубация ДНКЖ с анионными лигандами не-
сигналы ЭПР М-ДНКЖ, связанные с сывороточ-
тиоловой природы должна приводить к накопле-
ным альбумином быка. Точно такой же анизо-
нию в растворе анионов нитрита, а также, как уже
тропный сигнал, обусловленный белок-связан-
говорилось выше, к накоплению соответствую-
ными ДНКЖ с тиолсодержащими лигандами, об-
щих МНКЖ. При включении в М-ДНКЖ тиол-
наруженными в печени кролика и дрожжевых
содержащих лигандов, характеризующихся суще-
клетках [18], приведен на рис. 1в (спектры 1 и 2).
ственно более высоким сродством к катионам
нитрозония по сравнению с их сродством к анио-
ДИНИТРОЗИЛЬНЫЕ КОМПЛЕКСЫ ЖЕЛЕЗА
нам гидроксила [23], катионы нитрозония, вы-
КАК ДОНОРЫ КАТИОНОВ НИТРОЗОНИЯ
свобождающиеся из М-ДНКЖ, должны связы-
Как следует из резонансной структуры
[(L)2Fe2+(NO+)(NO)], характерной для М-ДНКЖ,
химическое равновесие между этими комплекса-
ми и составляющими их компонентами можно
Схема 4. Химическое равновесие между М-ДНКЖ и
представить в соответствии со схемой 4.
составляющими их компонентами.
БИОФИЗИКА том 67
№ 3
2022
438
ВАНИН
Результаты изучения такого рода кислотного
распада Б-ДНКЖ-GSH/NAC представлены на
рис. 5 и 6. Оказалось, что в отсутствие кислорода
в 1.0 мМ растворах Б-ДНКЖ-GSH/NAC при по-
Cхема 5. Химическое равновесие между М-ДНКЖ с
нижении рН этого раствора до 1-2 с последую-
тиолсодержащими лигандами и составляющими их
компонентами.
щим прогревом раствора в течение 8-9 мин при
80°С оба Б-ДНКЖ распадались, что сопровожда-
лось появлением нитрозоглутатиона или S-нит-
ваться с тиолсодержащими лигандами с образо-
розо-N-ацетил-L-цистеина, в которые включа-
ванием соответствующих устойчивых S-нитро-
лась примерно половина нитрозильных лигандов
зотиолов (RS-NO) (схема 5). Тем самым должен
комплексов. Такое соотношение количества
предотвращаться гидролиз катионов нитрозония.
S-нитрозотиолов и нитрозильных лигандов обна-
руживалось при соотношении концентрации сво-
Таким образом, если схемы 4 и 5, а соответ-
бодного (не включенного в Б-ДНКЖ/NAC) глу-
ственно и определяющая их схема 1, верны, то
татиона или NAС и концентрации Б-ДНКЖ, рав-
опыты, которые продемонстрировали бы появле-
ном 1.5 : 1.
ние RS-NO при распаде М- и Б-ДНКЖ с тиол-
Я подчеркиваю, что этот результат был полу-
содержащими лигандами, позволили бы утвер-
чен в экспериментах на растворах Б-ДНКЖ-
ждать, что приведенный на схеме 1 механизм об-
GSH/NAC в анаэробных условиях, исключавших
разования этих комплексов абсолютно верен.
окисление NO, высвобождавшегося из Б-ДНКЖ,
до диоксида азота с последующим его превраще-
Такого рода опыты, результаты которых изло-
нием в триоксид азота, способным осуществлять
жены в работах [13, 14, 24, 25], показали, что дей-
реакцию S-нитрозирования.
ствительно при кислотном распаде представите-
При повышении этого соотношения Б-ДНКЖ
лей ДНКЖ с тиолсодержащими лигандами -
и свободных тиолов в растворе до 2-3 и выше
Б-ДНКЖ с глутатионом (GSH) и Б-ДНКЖ с
уровень соответствующих S-нитрозотиолов резко
N-ацетил-L-цистеином (NAC) - обнаруживают-
снижался. Есть основание предполагать, что это
ся S-нитрозоглутатион или S-нитрозо-N-ацетил-
снижение было обусловлено восстановлением до
L-цистеин, причем в количестве, соответствую-
NO катионов нитрозония высвобождающихся из
щем включению в эти соединения примерно по-
Б-ДНКЖ - предположение, которое в работах
ловины нитрозильных лигандов. Это означает,
[13, 14] подтверждается соответствующими экс-
что в полном соответствии со схемами 4 и 5 поло-
периментами. Это восстановление, очевидно,
вина этих лигандов в Б-ДНКЖ-GSH представле-
осуществляется свободными тиолами при ката-
на в форме катионов нитрозония.
литическом действии ионов железа в растворе.
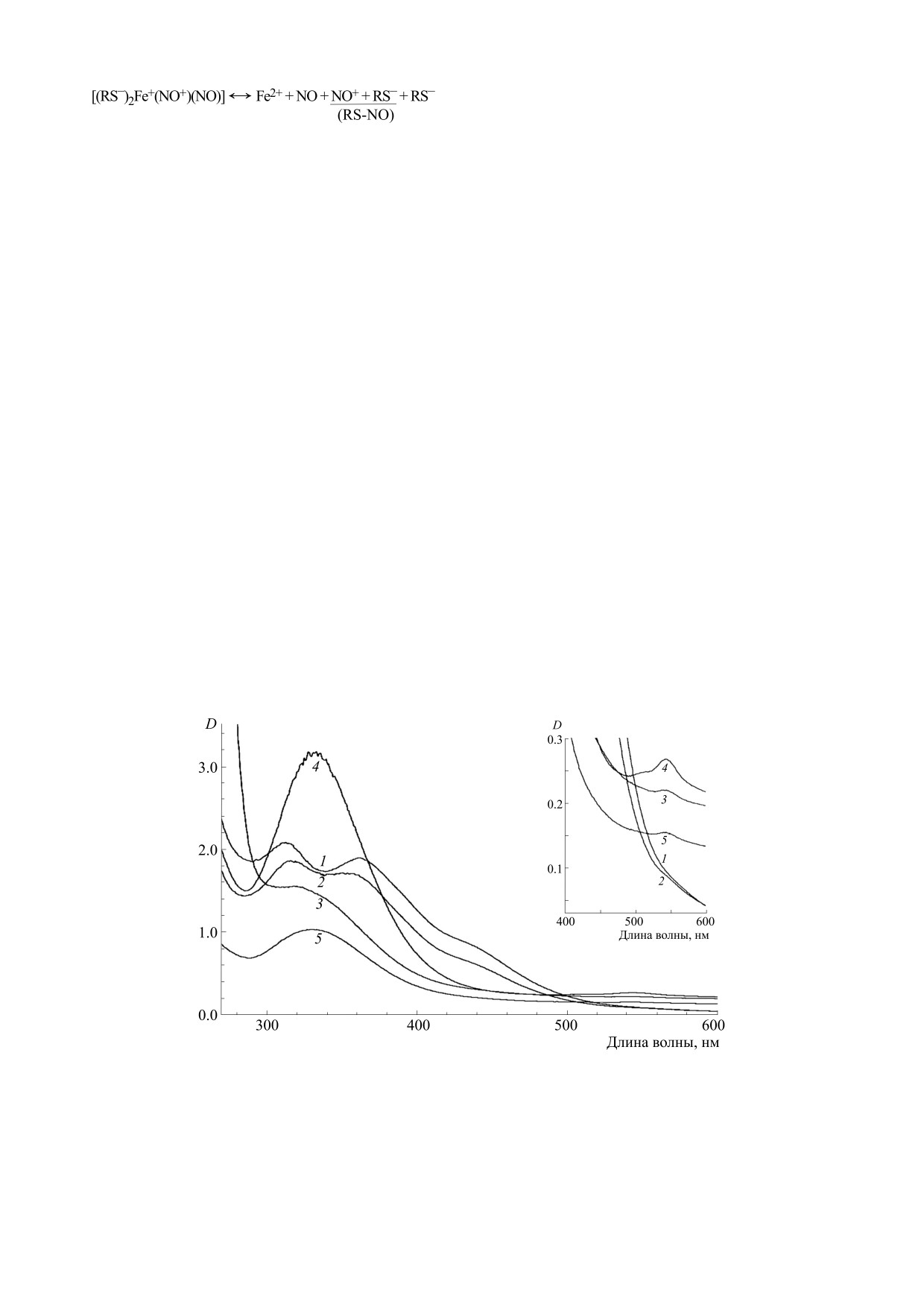
Рис. 3. Спектры поглощения 1 мМ растворов Б-ДНКЖ-GSH, синтезированных при соотношениях концентраций
NAC и Fe2+, равных 2 : 1 (кривая 1) или 1.5 : 1 (кривая 2). Кривые 3 и 4 — соответственно спектры поглощения тех же
комплексов, подвергнутых нагреванию при 80°С в анаэробных условиях в течение 8-9 мин без разбавления [13, 14].
БИОФИЗИКА том 67
№ 3
2022
КАТИОНЫ НИТРОЗОНИЯ
439
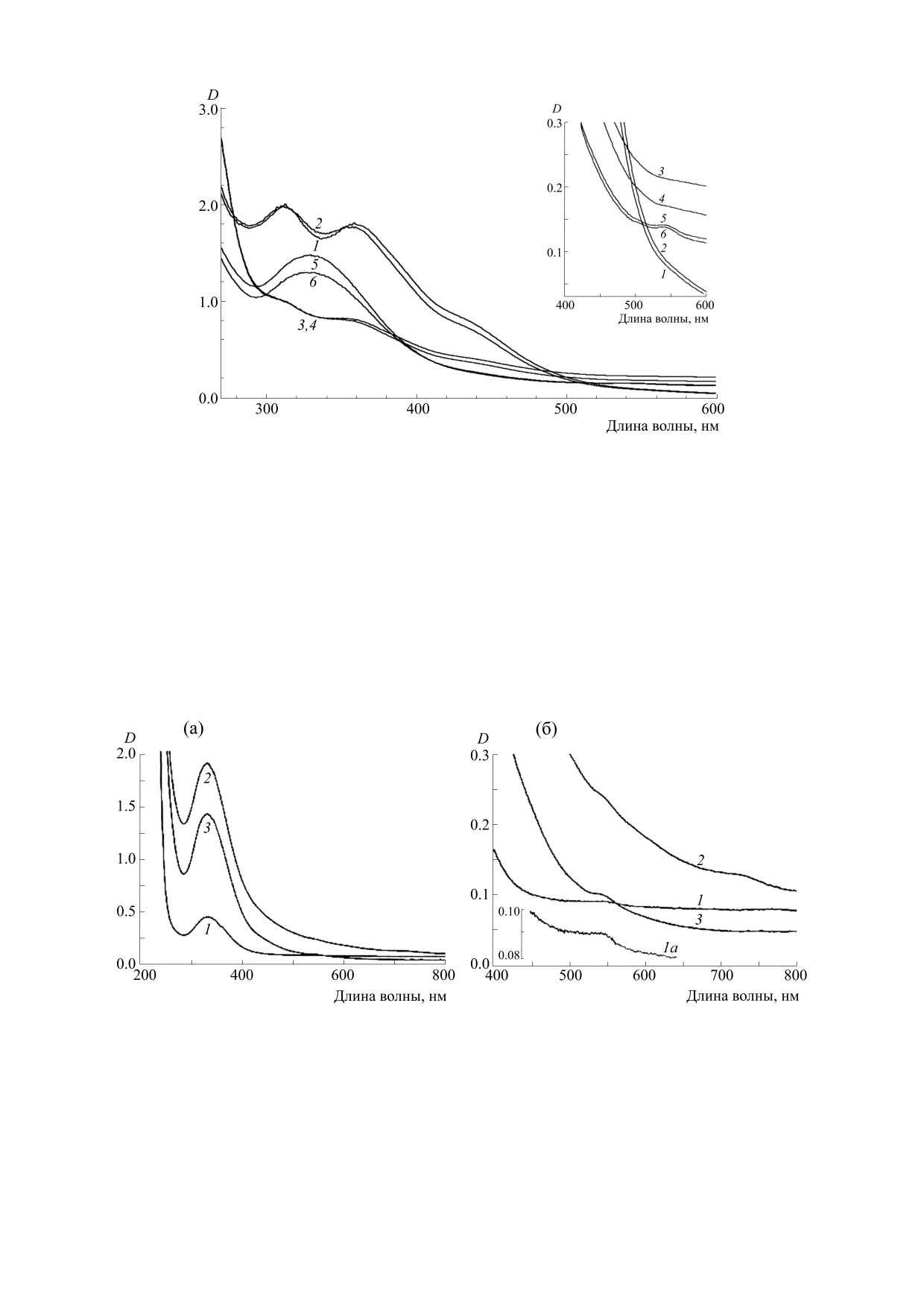
Рис. 4. Спектры поглощения растворов Б-ДНКЖ с N-ацетил-L-цистеином, синтезированных при соотношениях
концентраций NAC и Fe2+, равных 3 : 1 (кривая 1) или 1.5 : 1 (кривая 2). Кривые 3, 4 и 5, 6 - соответственно спектры
поглощения тех же комплексов, разбавленных в два раза [13, 14].
Таким образом, эти результаты однозначно
Как следует их вышесказанного, распад
свидетельствуют о наличии в ДНКЖ с тиолсодер-
ДНКЖ, не содержащих тиолсодержащих лиган-
жащими лигандами катионов нитрозония, вы-
дов, должен приводить к накоплению при ней-
свобождение которых из этих комплексов обна-
тральных значениях рН анионов нитрита как
руживается по их включению в соответствующие
продуктов гидролиза катионов нитрозония. Это
S-нитрозотиолы. Иные факты, свидетельствую-
предположение полностью согласуется с резуль-
щие об этом, приводятся в наших других работах
татами опытов, приведенных на рис. 6, на раство-
[26-28].
рах М-ДНКЖ с молекулами воды, полученных
Рис.
5. Образование нитрозоглутатиона как индикатора превращенния оксида азота в анионы нитрита,
появляющегося при распаде М-ДНКЖ с молекулами воды. Эти М-ДНКЖ были синтезированы обработкой
газообразным NO 30 мМ растворов HEPES-буфера (рН 7.0) с последующим добавлением к ним 20 мМ Fe2+ (кривые 2
и 3), затем с откачкой NO и добавлением к растворам 100 мМ глутатиона, резко подкислявшем растворы. Кривая 1
получена аналогичным образом, но при отсутствии Fe2+, (а и б) - запись спектров при разных усилениях
спектрофотометра [13, 14, 25].
БИОФИЗИКА том 67
№ 3
2022
440
ВАНИН
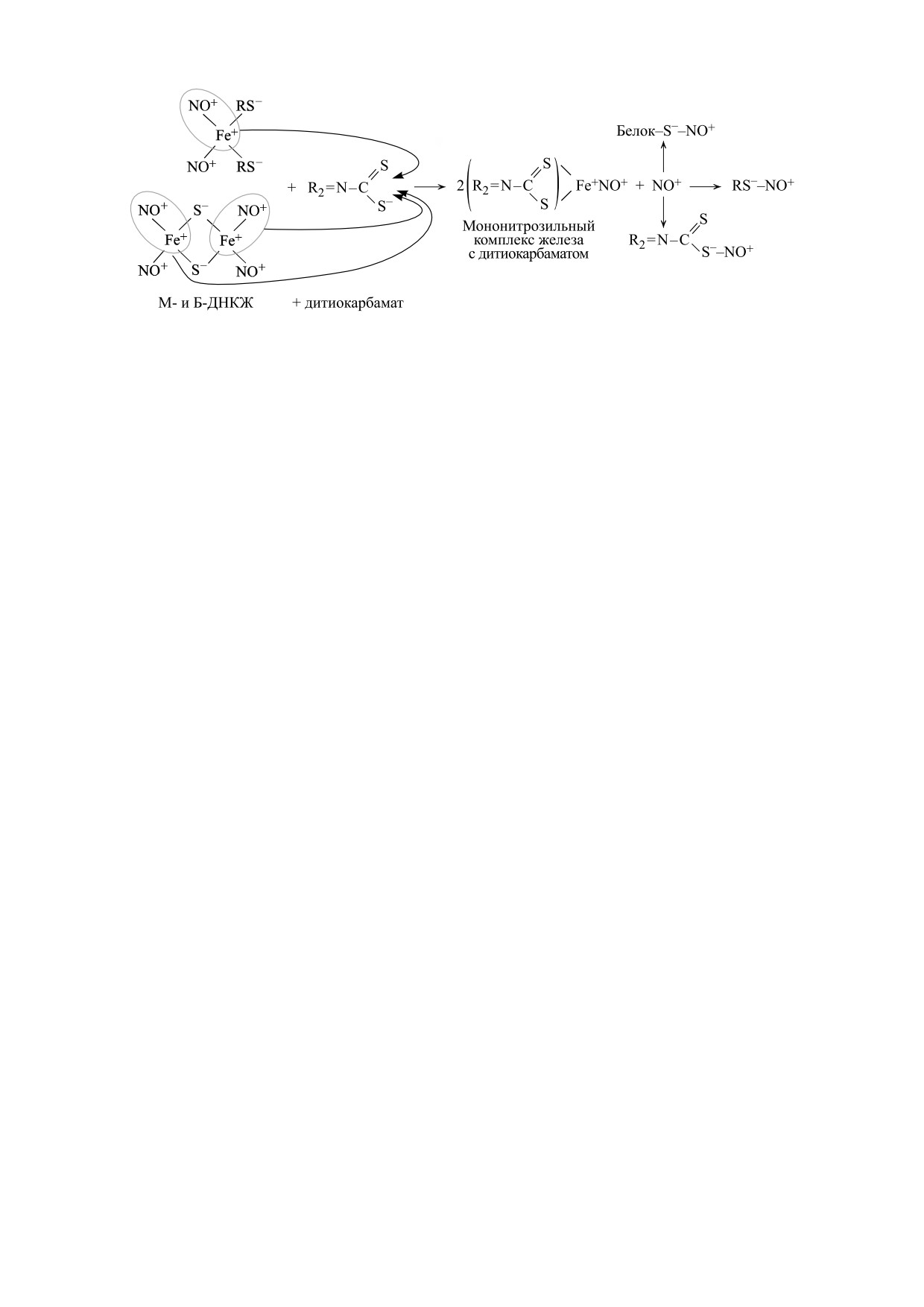
Рис. 6. Механизм превращения Б- и М-ДНКЖ с тиолсодержащими лигандами в МНКЖ с ДЭТК или МГД.
Высвобождающиеся при этом катионы нитрозония могут S-нитрозилировать низкомолекулярные и белковые тиолы,
а также тиоловую группу в составе ДЭТК или МГД [26-28].
при обработке газообразным NO 20 мМ растворах
повышают цитотоксическое действие Б-ДНКЖ с
меркаптосукцинатом (Б-ДНКЖ-МС) или Б-ДН-
Fe2+ в дистиллированной воде. Эти комплексы
КЖ-GSH соответственно на клетки MCF-7 или
полностью распадались в течение 20-30 мин по-
E. coli (рис. 7 и 8). Так, количество клеток MCF-7,
сле откачки NO, о чем свидетельствовало исчез-
подвергшихся апоптозу с последующим леталь-
новение зеленой окраски раствора и образование
ным исходом, при их контакте с
0.5 мМ
выпадающих в осадок гидроокисных комплексов
М-ДНКЖ-МС возрастало в присутствии 1 мМ
железа. Последующее добавление в этот раствор
МГД с 8 до 80% (рис. 7).
избытка глутатиона, приводившее к подкисле-
нию раствора до рН 1-2, сопровождалось появле-
Что же касается бактерий, их интактность,
нием оптического поглощения раствора на
оцениваемая по колониеобразующей активно-
334 нм, характерного для нитрозоглутатиона. Об-
сти, снижалась с 50% при введении в культуру
разование последнего, очевидно, было обуслов-
2.5 мМ ДЭТК до 5-10% после добавления 0.5 мМ
лено связыванием глутатиона с катионами нит-
Б-ДНКЖ-GSH (рис. 8, столбик 4) [28]. Это сни-
розония, возникавших в качестве компонентов
жение, очевидно, было обусловлено высвобожде-
азотистой кислоты, образующейся в результате
нием в культуральную среду только катионов
гидролиза анионов нитрита.
нитрозония. Что касается других потенциально
возможных цитотоксических компонентов
ДНКЖ - молекул NO и ионов железа, - они
КАТИОНЫ НИТРОЗОНИЯ - НАИБОЛЕЕ
оставались прочно связанными с МНКЖ-МГД
ЭФФЕКТИВНЫЕ В ЦИТОТОКСИЧЕСКОМ
или МНКЖ-ДЭТК, образующимися при разру-
ОТНОШЕНИИ КОМПОНЕНТЫ
шении Б-ДНКЖ-МС или Б-ДНКЖ-GSH соот-
ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ
ветственно под действием МГД или ДЭТК
ЖЕЛЕЗА
(рис. 6). Об устойчивости МНКЖ-МГД/ДЭТК
свидетельствует тот факт, что они в концентра-
Как было нами показано, при обработке
ции 0.5-1.0 мМ не оказывали на клетки никакого
ДНКЖ с тиолсодержащими лигандами произ-
цитотоксического действия.
водными дитиокарбамата - диэтилдитиокарба-
Могли ли молекулы NO и ионы железа, входя-
матом (ДЭТК) или N-метил-D-глюкаминдитио-
щие в состав ДНКЖ, оказывать цитотоксическое
карбаматом (МГД) эти агенты перехватывают на
действие, сопоставимое с цитотоксической ак-
себя железо-мононитрозильную [Fe2+-NO] груп-
тивностью катионов нитрозония - на этот вопрос
пу из железо-динитрозильных [Fe2+(NO+)(NO)]
ответ отрицательный. Как было показано в рабо-
фрагментов ДНКЖ с образованием сравнительно
те [29], оценка цитотоксического действия моле-
стойких (не оказывающих биологического дей-
кул NO и катионов нитрозония в экспериментах
ствия на клетки и ткани) МНКЖ с ДЭТК или
на культуре клеток фибробластов Swiss 3T3 пока-
МГД, сопровождающимся, как показано на
зала, что величина 50%-го цитотоксического дей-
рис. 6, высвобождением в раствор катионов нит-
ствия (IC50) для катионов составила 0.02 мМ про-
розония [26-28].
тив 1.0 мМ для молекул NO. Если же учесть, что в
Проведенные нами эксперименты на культуре
наших опытах на клетках MCF-7 при их обработ-
опухолевых клеток MCF-7 [27] и бактериях Esch-
ке смесью Б-ДНКЖ-MC
(0.5 mM)
+ МГД
erichia coli [28] показали, что МГД и ДЭТК резко
(1.0 мМ) (рис. 7б) оба эти агента полностью тра-
БИОФИЗИКА том 67
№ 3
2022
КАТИОНЫ НИТРОЗОНИЯ
441
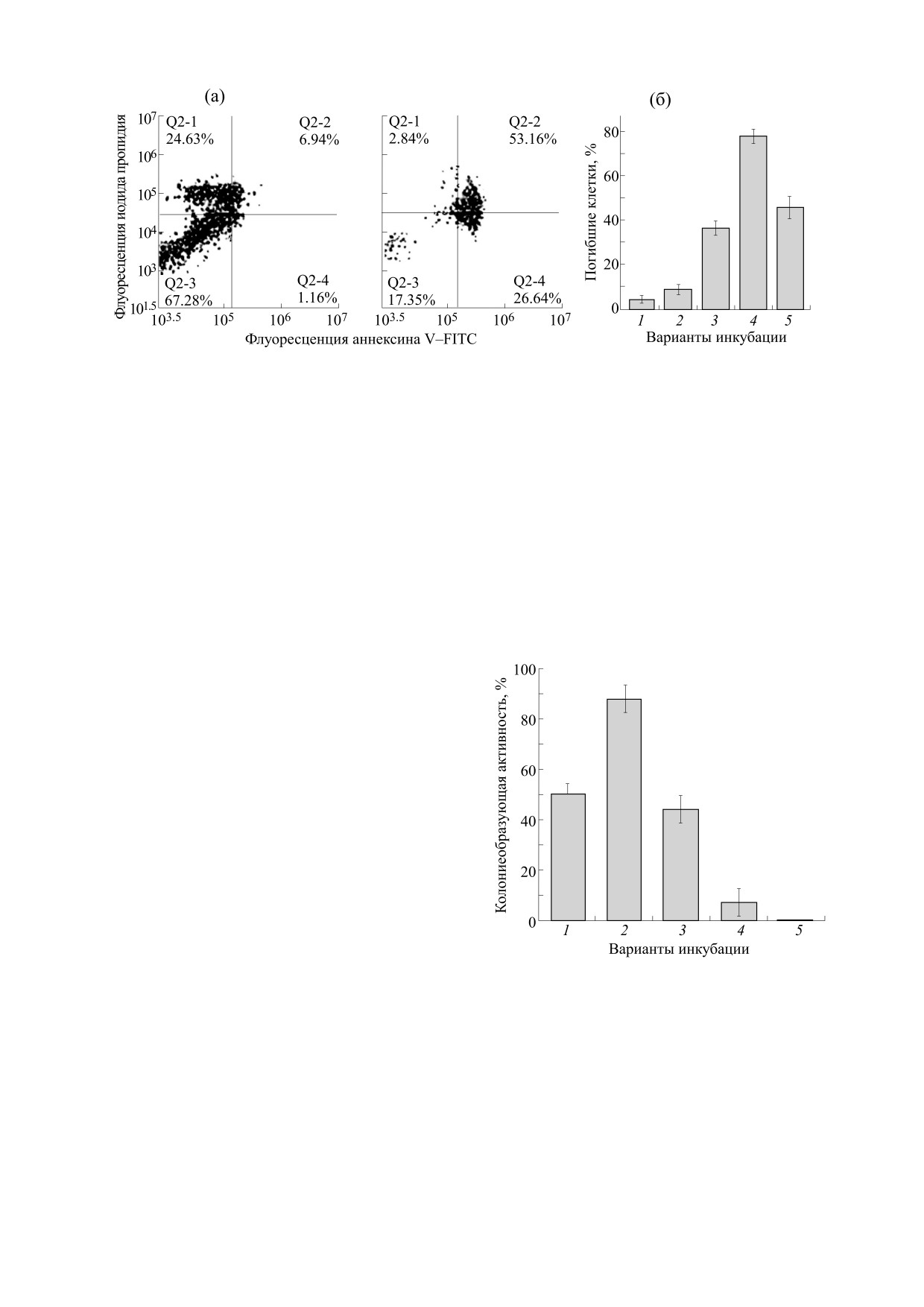
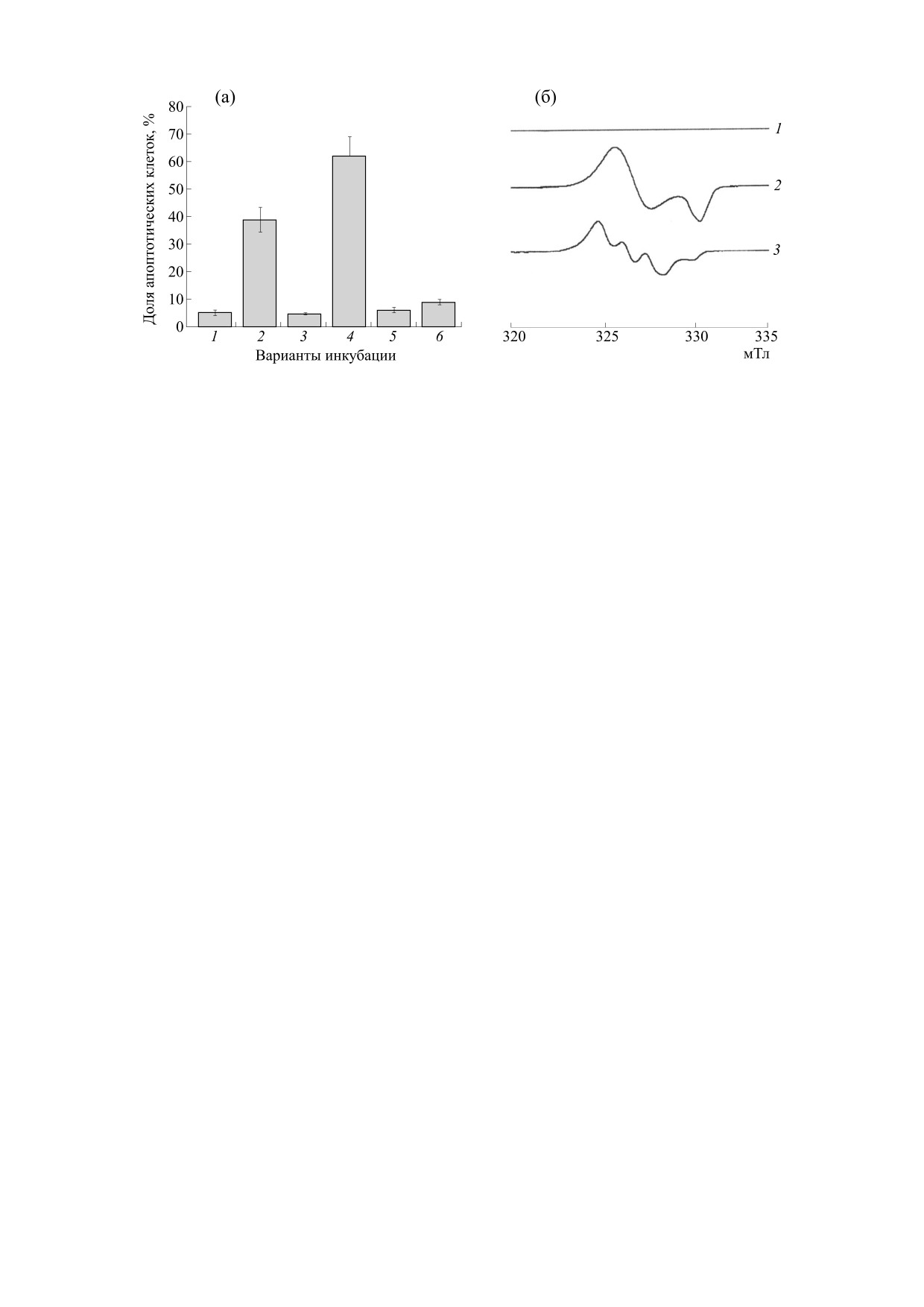
Рис. 7. Гибель клеток MCF-7 при их обработке М-ДНКЖ-МС (0.5 мМ) и МГД (1.0 мМ) (по окрашиванию смеси
«аннексин + иодид пропидия»). (а) - 2D-диаграммы, полученные методом флоуцитометрии клеточной культуры.
Клетки инкубировали или только с Б-ДНКЖ-МС или со смесью Б-ДНКЖ-МС + МГД. (б) - Гибель клеток в
процентном отношении: столбик 1 - контроль, столбик 2 - инкубация с Б-ДНКЖ-МС (0.5 мМ), столбик 3 —
инкубация с МГД (1.0 мМ), столбик 4 — инкубация со смесью Б-ДНКЖ-МС+МГД, столбик 5 - сумма эффектов
Б-ДНКЖ-МС и МГД (столбики 2 + 3) при отсутствии взаимодействия между ними [27].
тились на образование 0.5 мМ МНКЖ-МГД, то
токсическое действие катионов нитрозония, вы-
это означает, что гибель 80% клеток была обу-
свобождавшихся из М-ДНКЖ с тиосульфатом
словлена 0.5 мМ катионов нитрозония, высвобо-
(М-ДНКЖ-ТС) [31]. Как показано на рис. 9а,
дившихся из 0.5 мМ Б-ДНКЖ-МС.
взятом из их работы, при одновременном введе-
Что касается цитотоксического действия
нии в культуру клеток 0.1 мМ М-ДНКЖ-ТС и
ионов железа при его высвобождении из ДНКЖ,
0.2 мМ МГД количество клеток в состоянии апо-
то, как показали наши исследования такого дей-
птоза достигало 60%. Если же учесть, что все
ствия на клетки MCF-7, величина IC50 для него
составила 2.0 мМ против 0.86 мМ для Б-ДНКЖ-
МС (материал готовится к публикации).
Таким образом, есть основание утверждать,
что катионы нитрозония, высвобождающиеся из
ДНКЖ с тиолсодержащими лигандами, следует
рассматривать в качестве наиболее эффективных
в цитотоксическом отношении компонентов
этих комплексов. Эта активность может быть
обусловлена способностью катионов вступать,
во-первых, в качестве электрофильных агентов в
реакции S- и N-нитрозирования, влияя тем са-
мым на активность тиоловых и аминогрупп в раз-
нообразных белках, а во-вторых, в качестве до-
статочно сильного окислителя влиять на различ-
ные внутриклеточные редокс-процессы [5, 30].
ДРУГИЕ ПРИМЕРЫ ЦИТОТОКСИЧЕСКОГО
ДЕЙСТВИЯ in vitro И in vivo КАТИОНОВ
НИТРОЗОНИЯ, ВЫСВОБОЖДАЮЩИХСЯ
Рис. 8. Влияние на колониеобразующую активность
ИЗ ДИНИТРОЗИЛЬНЫХ
бактерий E. coli TN530 добавления ДЭТК (2.5 мМ,
КОМПЛЕКСОВ ЖЕЛЕЗА
столбик
1), B-DNIC-GSH
(0.5 мМ, столбик
2),
суммарного действия ДЭТК и Б-ДНКЖ-GSH при
Группа российских и немецких исследовате-
отсутствии взаимодействия между Б-ДНКЖ-GSH и
лей из университета г. Майнца (Германия) была
ДЭТК (столбик 3), при одновременном введении в
первой, кому в экспериментах на культуре опухо-
культуру Б-ДНКЖ-GSH и ДЭТК (столбик 4), при
левых клеток Jurkat человека, инициирующих
введении Б-ДНКЖ-GSH, а через 40 мин - ДЭТК
лейкемию, удалось продемонстрировать цито-
(столбик 5) [28].
БИОФИЗИКА том 67
№ 3
2022
442
ВАНИН
Рис. 9. (а) - Доля (в %) клеток Jurkat в состоянии апоптоза в контроле (столбик 1), после обработки М-ДНКЖ-ТС
(столбик 2), М-ДНКЖ+GSH (столбик 3), М-ДНКЖ-ТС + МГД (столбик 4), МГД (столбик 5) и Fe-TC (столбик 6).
(б) - трансформация сигнала ЭПР (сигнал 2), регистрируемого в культуре клеток Jurkat после добавления к ним
0.1 мМ М-ДНКЖ-ТС, в сигнал ЭПР МНКЖ-МГД (сигнал 3) при последующем добавлении к клеткам 0.2 мМ МГД.
Сигнал 1 - исходная культура клеток [31].
М-ДНКЖ-ТС при двукратном количестве МГД
незлокачественные опухоли - соответственно
переходили (как и МГД) в МНКЖ-МГД, 60%-й
перевивные злокачественные опухоли у живот-
уровень апоптоза в клеточной культуре был обу-
ных [32-34] и эндометриоидные опухоли у жи-
словлен только катионами нитрозония, высво-
вотных при экспериментальном эндометриозе
бодившимися из 0.1 мМ М-ДНКЖ-ТС. ЭПР-из-
[35-37], полученные в наших работах. Исходя из
мерения показали, что при этом М-ДНКЖ-МС
того, что указанное действие могло быть обуслов-
полностью трансформировались в МНКЖ-МГД
лено способностью ДНКЖ высвобождать катио-
(рис. 9б). Эта величина - 60%-й уровень апопто-
ны нитрозония, интересными представляются
за, вызванный 0.1 мМ катионов нитрозония, бли-
данные о способности ДЭТК самого по себе су-
зок к величине IC50, равной 0.02 мМ, полученной
щественно замедлять развитие одной из перевив-
в упомянутой выше работе [29], характеризую-
ных злокачественных опухолей - карциномы
щей цитотоксическую активность NO+.
легких Льюис. Оказалось, что ДЭТК при пяти-
В рассмотренных выше наших публикациях
кратном через каждые трое суток после перевив-
[27, 28] с использованием производных дитио-
ки опухоли внутрибрюшинном введении в дозе
карбамата для высвобождения катионов нитрозо-
250 мкМ инициировал почти шестикратное по-
ния из ДНКЖ с тиолсодержащими лигандами мы
давление роста опухоли [34]. Не исключено, что
подчеркивали приоритет авторов работы [31] в та-
этот эффект был обусловлен высвобождением ка-
ком подходе. Тем не менее, следует подчеркнуть,
тионов NO+ из эндогенных ДНКЖ, появляю-
что эти авторы только показали, что катионы
щихся в опухолях при их взаимодействии с акти-
нитрозония могут участвовать в цитотоксическом
вированными макрофагами., способными проду-
действии ДНКЖ. Результаты нашего вышеприве-
цировать такие комплексы.
денного анализа показывают, что катионы нит-
розония могут выступать как наиболее эффектив-
ные в цитотоксическом отношении компоненты
КОНФЛИКТ ИНТЕРЕСОВ
этих комплексов. Другими словами, в разнооб-
разных проявлениях цитотоксического действия
Автор заявляет об отсутствии конфликта инте-
ДНКЖ с тиолсодержащими лигандами на клетки
ресов.
и ткани определяющим это действие является не
NO, а NO+-донорная активность этих комплек-
сов.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
В свете вышесказанного следует рассматри-
вать и экспериментальные данные, демонстриру-
Настоящая работа не содержит описания ис-
ющие цитотоксическое действие ДНКЖ с тиол-
следований с использованием людей и животных
содержащими лигандами на злокачественные и
в качестве объектов.
БИОФИЗИКА том 67
№ 3
2022
КАТИОНЫ НИТРОЗОНИЯ
443
СПИСОК ЛИТЕРАТУРЫ
20.
A. F. Vanin, A. P. Poltorakov, V. D. Mikoyan, et al.,
Nitric Oxide Biol. Chem. 23, 136 (2011).
1.
L. J. Ignarro, Nitric Oxide: Biology and Pathology (Ac-
21.
A. F. Vanin, Int. J. Mol. Sci. 22 (19), 10356 (2021).
ademic Press, San Diego, USA, 2000).
DOI: 10.3390/ijms221910356
2.
S. A. Lipton, Y.-B. Choi, Z.-H. Pan, et al., Nature
364, 626 (1993).
22.
A. F. Vanin, V. A. Serezhenkov, V. D. Mikoyan, et al.,
Nitric Oxide Biol. Chem. 2, 224 (1998).
3.
S. Khan, M. Kayahara, U. Joashi, et al., J. Cell Sci.
110, 2315 (1997).
23.
V. G. Kharitonov, A. R. Sandquist, and V. S. Sharma,
J. Biol. Chem. 270, 28158 (1995).
4.
7. K. Watanabe, Y. Ishima, T. Akaike, et al., FASEB J.
27, 391 (2013).
24.
A. F. Vanin, Austin J. Analyt. Pharmaceut. Chem. 5,
1109 (2018).
5.
Г. И. Бородкин и В. Г. Шубин, Успехи химии 86,
18 (2017).
25.
A. F. Vanin, Cell Biochem. Biophys. 77, 279 (2019).
6.
M. N. Huges, Biochim. Biophys. Acta 1411, 263
26.
R. R. Borodulin, L. N. Kubrina, V. D. Mikoyan, et al.,
(1999).
Nitric Oxide Biol. Chem. 29, 4 (2013).
7.
J. S. Stamler, D. J. Singel, and J. Loscalzo, Science
27.
A. F. Vanin, V. A. Tronov, and R. R. Borodulin, Cell
258, 1898 (1992).
Biochem. Biophys.79, 93 (2021).
8.
M. Boese, P. I. Mordvintcev, A. F. Vasnin, et al., J.
28.
A. F. Vanin, D. I. Telegina, V. D. Mikoyan, et al., Cell
Biol. Chem. 270, 2924 (1995).
Biochem. Biophys. (2022), in press.
9.
C. A. Bosworth, J. C. Toledo, J. W. Zmiewski, et al.,
29.
S. Khan, M. Kayahara, U. Joashi, et al., J. Cell Sci.
Proc. Natl. Acad. Sci. USA 106, 4671 (2009).
111, 2315 (1997).
10.
M. F. Foster, L. Liu, M. Zhang, et al., Biochemistry
48, 792 (2009).
30.
D. L. H. Williams, Nitrosation Reactions and the
Chemistry of Nitric Oxide (Elsevier, Amsterdam, 2004).
11.
A. F. Vanin, Austin J. Analyt. Pharmaceut. Chem. 5,
1109 (2018).
31.
A. L. Kleschyov, S. Strand, and S. Schmitt, Free Rad.
Biol. Med. 40, 1240 (2006).
12.
A. F. Vanin, Cell Biochem. Biophys. 77, 279 (2019).
32.
А. Ф. Ванин, Л. Ф. Островская, Д. Б. Корман
13.
А. Ф. Ванин, Биофизика 65, 421 (2020).
и др., Биофизика 65, 1 (2020).
14.
A. F. Vanin, Appl. Magnet. Res. 51, 851 (2020).
33.
А. Ф. Ванин, Л. Ф. Островская, Д. Б. Корман
15.
A. F. Vanin and D. I. Aliev, Studia Biophysica 93, 63
и др., Биофизика 66, 1223 (2021).
(1983).
34.
А. Ф. Ванин, Л. Ф. Островская, Д. Б. Корман
16.
А. Ф. Ванин, Биохимия 60, 225 (1995).
и др., Биофизика 66, 1217 (2021).
17.
D. R. Truzzi, O. Augusto, and P. C. Ford, Chem.
Comm. 55, 9156 (2019).
35.
E. N. Burgova, N. A. Tkachev, O. V. Paklina, et al.,
Eur. J. Pharmacol. 741, 37 (2014).
18.
A. F. Vanin, Dinitrosyl Iron Complexes as a “Working
Form” of Nitric Oxide in Living Organisms (Cambridge
36.
A. F. Vanin, E. N. Burgova, and L. V. Adamyan, Aus-
Scholars Publishing, Cambridge, UK, 2019).
tin J. Reprod. Med. Infertil. 2, 1019 (2015).
19.
A. F. Vanin and D. Sh. Burbaev, Biophys. J. 14,
37.
E. N. Burgova, Y. I. Khristidis, A. V. Kurkov, et al.,
878236 (2011).
Cell Biochem. Biophys. 77, 69 (2019).
Nitrosonium Cations as the Most Effective Cytotoxic Components
of Dinitrosyl Iron Complexes
A.F. Vanin
Semenov Federal Research Center for Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119991 Russia
This work sums up experimental data demonstrating the ability of dinitrosyl iron complexes to donate not on-
ly molecular nitric oxide (NO) but also nitrosonium ca ions (NO+). These cations are converted via hydroly-
sis at neutral (physiological) pH values to nitrite anions in the absence of thiol-containing compounds and to
S-nitrosothiols in the presence of thiols. The formation of S-nitrosothiols is the very process that determines
cytotoxic action of dinitrosyl iron complexes as NO+ donors in living organisms.
Keywords: nitrosonium cations, dinitrosyl iron complexes, nitric oxide
БИОФИЗИКА том 67
№ 3
2022