БИОФИЗИКА, 2022, том 67, № 3, с. 477-491
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
О ХИРАЛЬНОСТИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
И СТРУКТУР БИОМАКРОМОЛЕКУЛ
© 2022 г. Е.В. Белова, Е.В. Семенова, В.А. Твердислов
Физический факультет Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы, 1/2
Поступила в редакцию 07.12.2021 г.
После доработки 07.12.2021 г.
Принята к публикации 20.12.2021 г.
Представлено развитие концепции о роли хиральности в структурообразовании биомакромолекул
на примере корреляций во взаимосвязи между хиральной формой лекарственного средства и ее
биоактивностью. Выяснение природы хирально-иерархической структуры биомакромолекул-ми-
шеней и симметрийной структуры лекарственных препаратов направлено на установление возмож-
ной системности хиральных соответствий лекарств и мишеней. Стереоспецифичность взаимодей-
ствия лекарства и молекулы-мишени важно учитывать при создании лекарственных препаратов,
так как одна хиральная форма лекарственного препарата может обладать терапевтическим эффек-
том, а другая не усваиваться, быть менее активной или даже вызывать серьезные осложнения, яв-
ляться токсичной. Обсуждается биоактивность хиральных лекарств и высказываются предположе-
ния о возможной взаимосвязи между знаком хиральной формы лекарственного препарата и его воз-
действием на конкретную хиральную молекулярную мишень.
Ключевые слова: хиральность, энантиомеры, хиральные лекарства, стереоспецифичность, структур-
ные иерархии.
DOI: 10.31857/S0006302922030073, EDN: ANMONX
Важной структурной особенностью многих
фекты. Это явление в течение многих лет привле-
биологических молекул и лекарственных веществ
кает внимание научного сообщества [1-4]. Широ-
является хиральность - способность объекта не
ко известным примером лекарственного сред-
совпадать со своим зеркальным отражением при
ства,
иллюстрирующим важность роли
любых комбинациях перемещений и вращений в
хиральности в создании лекарственных препара-
трехмерном пространстве. Две хиральные моле-
тов, является талидомид [5-8]. С 1957 г. этот пре-
кулы, являющиеся зеркальным отображением
парат использовали как транквилизатор и сно-
друг друга, называются энантиомерами, а две мо-
творное, а также назначали беременным женщи-
лекулярные структуры более высокого уровня -
нам для борьбы с утренними недомоганиями.
энантиоморфами. Энантиомеры обладают оди-
Однако уже в 1959 г. стали появляться сообщения
наковыми физико-химическими свойствами
о случаях периферической нейропатии у пациен-
(температурами кипения и плавления, плотно-
тов, длительно принимавших талидомид. Вскоре
стью и пр.), но отличаются по своей оптической
после этого было установлено, что у принимаю-
активности, характеризуемой величиной и зна-
щих это лекарственное средство беременных
ком вращения плоскости поляризации. Однако
женщин резко возрастает вероятность рождения
энантиомеры, в том числе среди лекарственных
детей с врожденными дефектами конечностей и
препаратов, могут проявлять совершенно разную
внутренних органов. Талидомид поступил в про-
химическую специфичность в процессах с уча-
дажу как рацемат, и позднее было установлено,
стием хиральных соединений, так же как и неоди-
что терапевтическим эффектом обладает только
наковую биологическую активность. При созда-
R-изомер талидомида, в то время как S-изомер
нии и использовании лекарственных средств
оказывает тератогенное действие [5, 8].
крайне важно учитывать хиральность препарата,
Среди используемых в настоящее время лекар-
так как один энантиомер лекарства может прояв-
ственных средств больше половины составляют
лять терапевтическое действие, но его противо-
хиральные препараты, в свою очередь, большая
положный энантиомер может быть менее актив-
часть этих хиральных лекарств представляет со-
ным или полностью неактивным, а в некоторых
бой рацемат [3]. Более половины разрабатывае-
случаях даже вызывать серьезные побочные эф-
мых за последние годы лекарств также состоит из
477
478
БЕЛОВА и др.
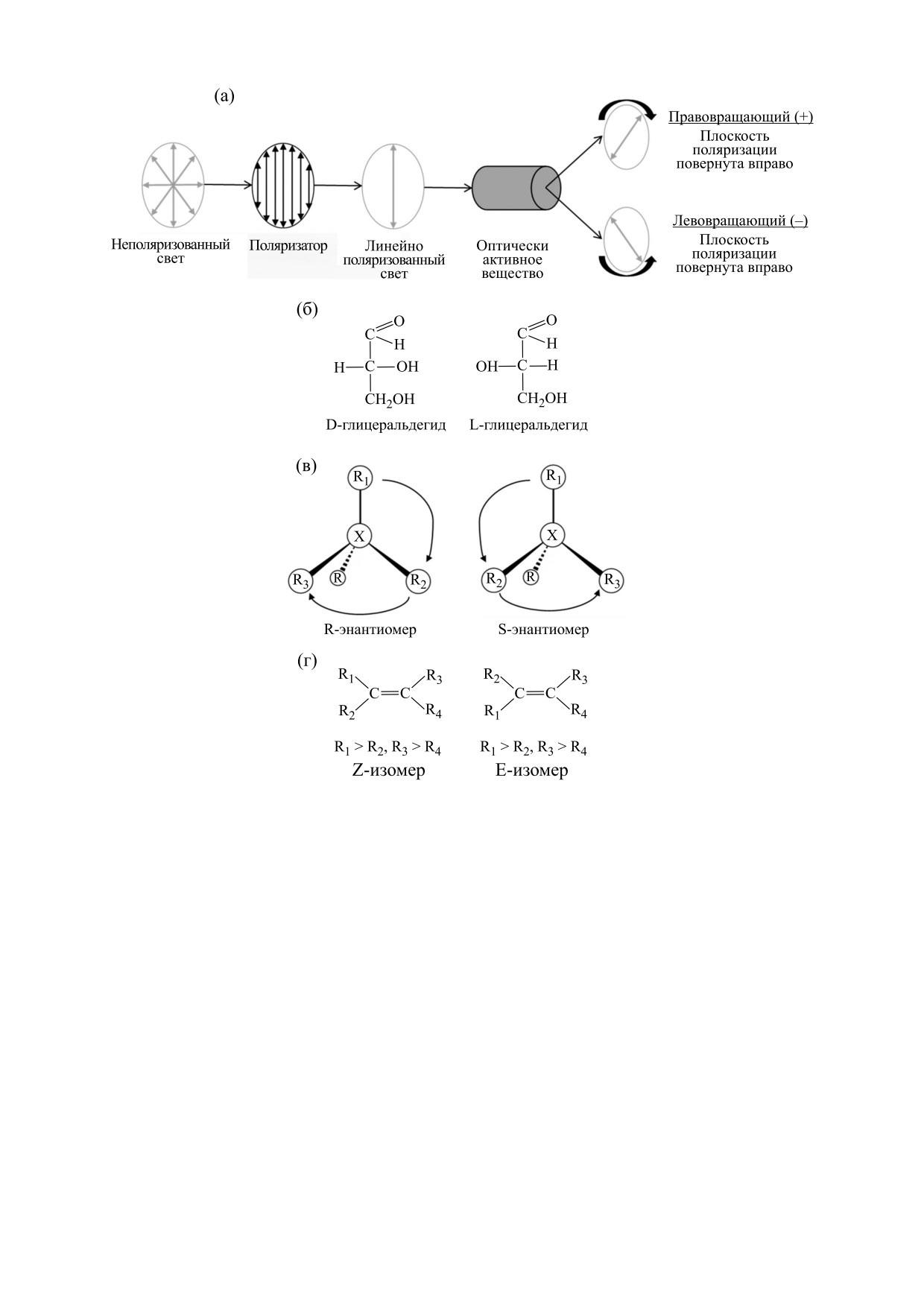
Рис. 1. Правила наименования стереоизомеров: (а) - в соответствии с оптической активностью, (б) - L/D-
номенклатура, (в) - R/S-номенклатура, (г) - E/Z-номенклатура.
хиральных молекул. Хиральные препараты ис-
структурных и функциональных уровней для бел-
пользуют в лечении широкого спектра заболева-
ков и ДНК поможет сделать шаг к лучшему пони-
ний, в том числе сердечно-сосудистых и желудоч-
манию взаимодействия хирального лекарствен-
но-кишечных. Получение оптически чистых
ного средства с хиральной мишенью [13-15].
форм вещества является сложной и дорогостоя-
щей задачей, однако их использование во многих
случаях могло бы уменьшить дозировку и количе-
НОМЕНКЛАТУРА
ство побочных действий препарата.
Существует несколько вариантов номенклату-
Биоактивность энантиомеров, их фармакоди-
ры для обозначения энантиомеров (рис. 1). Энан-
намика и фармакокинетика, процесс хиральной
инверсии оптических изомеров в живых системах
тиомеры различают по их оптической активности
интенсивно исследуются в настоящее время [9-
((+)/(-)-номенклатура), а также по принятой их
12]. Возможно, выявленная ранее нами систем-
абсолютной конфигурации (L/D- и R/S-номен-
ная тенденция чередования знака хиральности
клатуры). В связи с многочисленностью вариан-
БИОФИЗИКА том 67
№ 3
2022
О ХИРАЛЬНОСТИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
479
тов наименований может наблюдаться некоторая
В 1966 г. была опубликована система универ-
путаница.
сального описания стереоизомеров - R/S-но-
менклатура Кана-Ингольда-Прелога [20]. Для
В 1848 г. Л. Пастер сделал первое открытие,
установления абсолютной конфигурации соеди-
связанное с оптической активностью молекул.
нения проводится нумерация заместителей у
Он получил из раствора кислой натриевой соли
асимметрического центра соединения по прави-
виноградной кислоты асимметричные кристаллы
лам последовательного старшинства. Заместите-
тетрагидрата натриево-аммониевой соли [16, 17].
ли рассматриваются наблюдателем с наиболее
Оказалось, что растворы двух типов кристаллов
удаленной от самого младшего заместителя сто-
обладали противоположным оптическим враще-
роны. Если направление убывания старшинства
нием. После осаждения свинцовой или бариевой
совпадает с движением по часовой стрелке, то
соли из каждого раствора и вытеснения слабой
конфигурацию данного асимметрического цен-
органической кислоты в результате воздействия
тра обозначают символом R (от лат. rectus - пра-
на эти соли сильной серной кислотой образова-
вый), а если против часовой стрелки - символом
лись два энантиомера винной кислоты: правовра-
S (от лат. sinister - левый). Правила последова-
щающий (вращающий плоскость поляризации
тельного старшинства были специально задума-
линейно-поляризованного света в правую сторо-
ны так, чтобы оказаться в максимально близком
ну, по часовой стрелке) из одного раствора и ле-
соответствии с ранней систематикой Фишера. В
вовращающий (вращающий плоскость поляриза-
результате большинство D-стереоизомеров и, что
ции линейно-поляризованного света в левую сто-
очень важно, сам глицериновый альдегид имеют
рону, против часовой стрелки) из другого.
R-конфигурацию, а L-стереоизомеры часто при-
Правовращающую разновидность назвали d-вин-
надлежат к S-ряду. Для описания конфигураций
ной кислотой (от лат. dexter - правый, обознача-
молекул с двойными связями также используют
ется также «+»), левовращающую - l-винной (от
правила Кана-Ингольда-Прелога (E/Z-номен-
лат. laevus - левый, обозначается также «-»). Ока-
клатура).
залось, что неактивная виноградная кислота
Важно отметить, что правое или левое враще-
представляет собой смесь известной «правой»
ние энантиомера не имеет однозначной корреля-
винной кислоты и ранее не известной «левой» в
ции с фактическим взаимным расположением
равных количествах. Такую смесь стали называть
атомов в пространстве и, следовательно, не имеет
рацематом (от лат. racemus - виноград). Кроме то-
прямого отношения к правилам назначения на-
го, вскоре была получена оптически неактивная
именований D/L или R/S. Обладающие одинако-
ахиральная мезовинная кислота.
вым знаком вращения сходные соединения могут
иметь противоположные абсолютные конфигу-
Раньше определить истинную пространствен-
рации. Поэтому рядом с D/L- или R/S-наимено-
ную конфигурацию молекул оптически активно-
ваниями может указываться оптическая актив-
го вещества не представлялось возможным, но
ность соединения.
можно было выявить аналогичность конфигура-
ций разных веществ. В 1891 г. Э.Г. Фишер предло-
жил определенное изображение структур органи-
ХИРАЛЬНЫЕ ЛЕКАРСТВА
И ФАРМАКОЛОГИЯ
ческих молекул - проекции Фишера, в том числе
для глицеринового альдегида [18]. В
1906 г.
Известно, что противоположные энантиоме-
М.А. Розанов предложил выбрать глицериновый
ры лекарственных препаратов при взаимодей-
альдегид как стандарт для установления относи-
ствии с хиральными соединениями организма
тельной конфигурации оптически активных мо-
могут проявлять разную биологическую актив-
лекул [19]. Стереохимически аналогичные право-
ность, несмотря на одинаковые физико-химиче-
вращающему глицериновому альдегиду вещества
ские свойства. Данную особенность необходимо
относят к D-ряду, а родственные его оптическому
учитывать при использовании и разработке ле-
антиподу
- левовращающему глицериновому
карственных средств, так как может оказаться,
альдегиду - относят к L-ряду. Относительная
что лишь один энантиомер препарата является
конфигурация энантиомеров в системе Фишера
терапевтически эффективным, в то время как
определялась путем перехода от данной молекулы
противоположный является менее активным,
к D- или L-глицериновому альдегиду через по-
полностью неактивным, или вызывает серьезные
следовательность химических реакций, которые
побочные действия.
не затрагивают асимметрический атом углерода
На основании литературных источников в
[18]. Вместе с тем скоррелировать с конфигураци-
данной работе нами была сформирована подбор-
ей глицеринового альдегида конфигурацию мо-
ка из 100 хиральных лекарственных средств. Ото-
лекулы, сильно отличающейся по структуре, хи-
бранные препараты были классифицированы по
мическим путем бывает достаточно затрудни-
биоактивности R/S-энантиомеров и (+)/(-)-изо-
тельно.
меров. Также были определены мишени воздей-
БИОФИЗИКА том 67
№ 3
2022
480
БЕЛОВА и др.
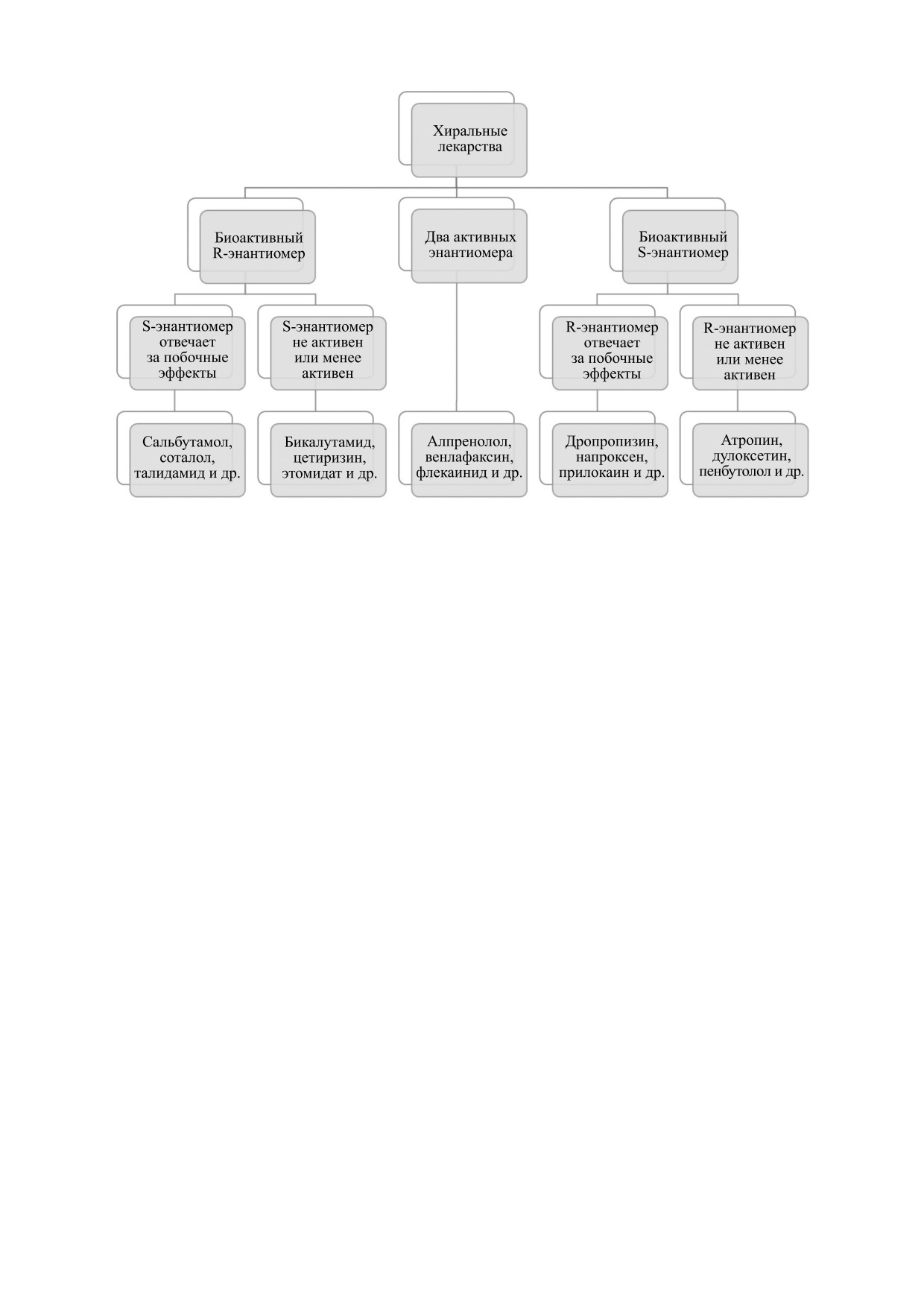
Рис. 2. Три группы лекарственных препаратов, выделенные согласно знаку хиральности биоактивного энантиомера:
с биоактивным «левым» S-энантиомером, с биоактивным «правым» R-энантиомером и с двумя биоактивными
энантиомерами.
ствия рассматриваемых препаратов. На основа-
вителем данной группы является дропропизин -
нии получившихся классификаций лекарствен-
противокашлевое средство. Данный препарат
ные средства были разделены на три группы:
долгое время использовали в терапии в виде раце-
лекарственные препараты с биоактивным «ле-
мата, однако было установлено, что S-энантио-
вым» S-энантиомером, лекарственные препара-
мер дропропизина обладает той же противо-
ты с биоактивным «правым» R-энантиомером,
кашлевой активностью, что и рацемическая
лекарственные препараты с двумя биоактивными
смесь, но в то же время меньше действует на цен-
энантиомерами (рис. 2). В первой группе были
тральную нервную систему [21]. В настоящее вре-
дополнительно выделены две подгруппы: препа-
мя существует мало безопасных и эффективных
раты, у которых R-энантиомер отвечает за побоч-
препаратов для лечения кашля, часто плохая пе-
ные эффекты, и препараты, у которых R-энан-
реносимость противокашлевых лекарственных
тиомер менее активен или неактивен. Аналогич-
средств как раз связана с побочными эффектами
ные подгруппы были выделены среди «правых»
со стороны центральной нервной системы. По-
лекарственных средств.
этому использование в терапии S-дропропизина
из-за меньшего действия на центральную нерв-
Лекарственные препараты с биоактивным «ле-
ную систему является более безопасным и хоро-
вым» S-энантиомером. Большую часть препара-
шо переносимым методом лечения кашля [22].
тов, представленных в выборке, составляют ле-
карственные средства с биоактивным «левым»
Прилокаин - местный анестетик, часто ис-
S-энантиомером. Данная группа лекарств была
пользуемый для проводниковой и местной
дополнительна разделена на две подгруппы: ле-
анестезии. Оба энантиомера имеют одинаковую
карственные препараты, у которых «правый»
биологическую активность, но S-энантиомер
R-энантиомер отвечает за побочные эффекты, и
гидролизуется медленно, а R-энантиомер гидро-
лекарственные препараты, у которых «правый»
лизуется быстро с образованием толуидина, кото-
R-энантиомер обладает меньшим терапевтиче-
рый вызывает метгемоглобинемию [23].
ским эффектом или терапевтический эффект не
Напроксен - нестероидное противовоспали-
наблюдается.
тельное средство. Данный препарат выпускается
Лекарственные препараты с биоактивным «ле-
в энантиомерно чистой форме, представленной
вым» S-энантиомером, у которых «правый» R-энан-
только S-изомером. Это связано с тем, что
тиомер отвечает за побочные эффекты. Предста-
R-энантиомер, во-первых, проявляет в 28 раз
БИОФИЗИКА том 67
№ 3
2022
О ХИРАЛЬНОСТИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
481
меньшую противовоспалительную активность,
щенного S-гиосциамином, поскольку последний
во-вторых, является токсичным для печени
обладает большинством физиологических и фар-
[24, 25].
макологических свойств, а R-гиосциамин отно-
сительно неэффективен.
К «левым» лекарственным препаратам, у кото-
рых «правый» R-энантиомер отвечает за побоч-
Лекарственные препараты с биоактивным «пра-
ные эффекты, также можно отнести такие препа-
вым» R-энантиомером. Лекарственные средства
раты, как бупивакаин [26], галотан [27], галофан-
данной группы были дополнительно разделены
трин [28], кетопрофен [29], клопидогрел [30],
на две подгруппы: лекарственные препараты с
метопролол [31], пеницилламин [32], фенфлура-
биоактивным «правым» R-энантиомером, у кото-
мин [33], этамбутол [34].
рых «левый» S-энантиомер отвечает за побочные
Лекарственные препараты с биоактивным «ле-
эффекты; лекарственные препараты с биоактив-
вым» S-энантиомером, у которых «правый» R-энан-
ным «правым» R-энантиомером, у которых «ле-
вый» S-энантиомер обладает меньшим терапев-
тиомер обладает меньшим терапевтическим эф-
тическим эффектом или терапевтический эффект
фектом или его терапевтический эффект не на-
блюдается. К лекарствам данной подгруппы в
не наблюдается.
нашей выборке относятся следующие: амло-
Лекарственные препараты с биоактивным
дипин [35, 36], атенолол [37], атропин [38], бена-
«правым» R-энантиомером, у которых «левый»
зеприл [39], бензетимид [40], бисопролол [41], бу-
S-энантиомер отвечает за побочные эффекты. Са-
нолол [10, 42], валсартан [3], варфарин [43, 44],
мым ярким и общеизвестным примером биоак-
верапамил [45], вигабатрин [46], допамин [47],
тивного «правого» лекарственного препарата, у
дулоксетин [48], зопиклон [49, 50], ибупрофен
которого «левый» энантиомер отвечает за побоч-
[51], карведилол [52], кетамин [53], кеторолак
ные эффекты, является талидомид. Этот препа-
[54], клиданак [55], мелфалан [56], мепивакаин
рат был представлен на рынке в виде рацемата. За
[57, 58], метотрексат [59], мопролол [10, 60], окса-
время продажи талидомида около 10000 детей во
зепам [3, 61], омепразол [62], офлоксацин [63],
всем мире родились с фокомелией или пороком
пантопразол [64], пенбутолол [10], пиндолол [65],
развития конечностей, из них выжила только по-
прегабалин [66, 67], пропранолол [68, 69], ропи-
ловина младенцев [5]. Через несколько лет после
вакаин [70], тетрамизол [71], тиамилал [72], тимо-
начала использования препарата было установле-
лол [73], тиопентал [74, 75], фенопрофен [76],
но, что только R-талидомид обладает терапевти-
фенпрокумон [43], хлорфенирамин [77], цели-
ческим эффектом, в то время как S-талидомид
пролол [10, 78], циталопрам [51, 79], эналаприл
является тератогенным для организма [5-8]. Со-
[80], эсмолол [81].
гласно недавним исследованиям, S-энантиомер
Оба энантиомера дулоксетина являются инги-
талидомида демонстрирует в десять раз более
биторами обратного захвата норэпинефрина и се-
сильное связывание с цереблоном (CRBN) и ин-
ротонина. Однако было обнаружено, что S-энан-
гибирование самоубиквитинирования по сравне-
тиомер дулоксетина является в два раза более
нию с R-изомером [8]. Это подтверждает тот
активным, чем R-энантиомер, поэтому впослед-
факт, что именно S-талидомид индуцирует тера-
ствии данный препарат стал вводиться в терапию
тогенные эффекты.
как энантиомер одной формы [48].
Другим представителем данной группы явля-
Пенбутолол стал первым β-блокатором, при-
ется тербуталин. Он оказывает бронхолитическое
меняемым в клинике как энантиомерно чистый
действие и используется для облегчения астмы.
S-изомер. Он был в 200 раз более активен как в
Препарат представлен в виде рацемата, где R-изо-
экспериментах in vitro, так и in vivo по сравнению
мер тербуталина избирательно возбуждает β₂-ад-
с R-энантиомером, и в пять раз более активен,
ренорецепторы, в то время как S-изомер практи-
чем пропранолол, используемый в качестве стан-
чески не имеет сродства к β₂-адренорецепторам и
дарта [10].
вызывает такие побочные эффекты, как гиперре-
активность дыхательных путей и сердечные рас-
Атропин, оказывающий холинолитическое
стройства [82]. Такие побочные эффекты связаны
действие, является М-холиноблокатором. Препа-
со способностью S-тербуталина активировать му-
рат представляет собой рацемическую смесь R- и
скариновые рецепторы, которые могут генериро-
S-гиосциамина, причем S-гиосциамин обладает
вать гиперреактивность дыхательных путей при
более мощным антимускариновым действием по
приеме рацемического тербуталина.
сравнению с R-гиосциамином или рацематом
[38]. Атропин использовался (в форме рацемата)
Сальбутамол - селективный агонист β₂-адре-
в качестве противоядия при отравлении зарином,
норецепторов короткого действия, который ис-
но его эффективность часто подвергалась сомне-
пользуется для лечения астмы и хронического об-
нию. Считается, что эффективность препарата
структивного заболевания легких. Как правило,
может быть повышена при использовании либо
препарат представлен в виде рацемической сме-
S-гиосциамина, либо образца атропина, обога-
сти, хотя известно, что R-изомер сальбутамола
БИОФИЗИКА том 67
№ 3
2022
482
БЕЛОВА и др.
имеет в 150 раз большее сродство к β₂-рецептору
кринон [73, 124], меторфан [125], миртазапин
по сравнению с S-изомером [83]. Кроме того,
[126], нимодипин [127], оксапротилин [128], про-
S-сальбутамол ассоциируется с токсичностью,
пафенон [129, 130], тироксин [131], флекаинид
так как он косвенно антагонизирует положитель-
[132], флуоксетин [133], циклофосфамид [3, 73],
ные эффекты R-сальбутамола и может давать вос-
эконазол [105], этодолак [134].
палительные эффекты.
Примером лекарственного средства данной
Препарат соталол обладает бета-блокирующей
группы является алпренолол. Данный препарат
активностью и используется в лечении различ-
применяется при лечении артериальной гипер-
ных сердечно-сосудистых заболеваний. Бета-
тензии, стенокардии и аритмии. S-изомер алпре-
блокирующая активность в основном обеспечи-
нолола имеет примерно в 100 раз большее срод-
вается R-соталолом: данный энантиомер препа-
ство к β-адренорецепторам, чем R-изомер, но в
рата в 14-50 раз эффективнее блокирует рецепто-
то же время оба изомера обладают равной эффек-
ры, чем рацемический соталол, в то время как его
тивностью в стабилизации мембран [122]. Из-за
S-энантиомер практически неактивен [10, 84]. В
этого действия оба энантиомера алпренолола мо-
то же время оба энантиомера соталола одинаково
гут оказывать прямое кардиодепрессивное дей-
эффективны в блокировании калиевых каналов.
ствие, включая антиаритмическое, не связанное с
Однако известно, что применение S-энантиоме-
их блокирующей активностью β-адренорецеп-
ра соталола влечет повышение смертности паци-
торов.
ентов с нарушением функции желудочков и по-
Оба энантиомера флекаинида оказывают
следующим инфарктом миокарда [85].
сходные электрофизиологические эффекты [132].
Лекарственные препараты с биоактивным
Введение одного энантиомера, по-видимому, не
«правым» R-энантиомером, у которых «левый»
дает преимущества по сравнению с рацемической
S-энантиомер обладает меньшим терапевтиче-
смесью.
ским эффектом или его терапевтический эффект
Венлафаксин используется для лечения пси-
не наблюдается. К лекарствам данной подгруппы
хических заболеваний, включая депрессию, и до-
в нашей выборке можно отнести следующие: ато-
ступен для клинического применения в виде ра-
рвастатин [86, 87], аценокумарол [88, 89], ацетил-
цемической смеси S- и R-энантиомеров [123].
карнитин [90], баклофен [91, 92], бикалутамид
Энантиомеры данного препарата проявляют раз-
[93], буфуранол [94], генаконазол [95], депренил
личные фармакологические свойства: S-венла-
[96, 97], изопреналин [98], лансопразол [62, 99],
факсин избирательно ингибирует обратный за-
локсиглумид [100], мексилетин [101, 102], мета-
хват серотонина, тогда как R-венлафаксин инги-
дон [43, 103], метилфенидат [104], миконазол [71,
бирует поглощение как серотонина, так и
105], никардипин [106-108], оксибутинин [109,
норадреналина.
110], пронеталол [111], рабепразол [112], ролипрам
Кроме того, произведена схожая классифика-
[113, 114], сертаконазол [105], сибутрамин [115],
ция данных лекарственных средств по биоактив-
фенибут [116], формотерол [117], цетиризин [118,
ности их (+)- и (-)-изомеров (за исключением
119], эпинефрин [120], этомидат [75, 121].
энантиомеров беназеприла, валсартана, фенибу-
Декстроцетиризин - S-энтантиомер цетири-
та и эналаприла).
зина - по-видимому, в десять раз менее эффекти-
Анализ данных по биоактивности энантиомеров
вен, чем левоцетиризин - R-энтантиомер цети-
лекарств. Приведенные данные по клинической
ризина [118, 119].
эффективности энантиомеров лекарственных
Этомидат уникален среди внутривенных ане-
препаратов суммированы в таблице.
стетиков, потому что его вводят в виде оптически
Как можно заметить, большая часть лекар-
чистого R-изомера, который является активным
ственных средств (55 препаратов из 100) из нашей
компонентом. Анестезирующий эффект прояв-
выборки - это лекарственные препараты с биоак-
ляется преимущественно у R-энантиомера, он
тивным «левым» S-энантиомером. В свою оче-
примерно в пять раз сильнее, чем у S-энантиоме-
редь, терапевтически активным «правым»R-энан-
ра этомидата [75, 121].
тиомером обладает 31 лекарственное средство,
Бикалутамид является нестероидным антиан-
14 лекарственных препаратов имеют два биоак-
дрогеном, который используется при лечении ра-
тивных энантиомера.
ка предстательной железы. R-энантиомер обла-
При рассмотрении биоактивности каждого
дает большей антиандрогенной активностью, а
энантиомера было обнаружено, что среди «пра-
антиандрогенная активность S-энантиомера зна-
вых» R-энантиомеров лекарственных средств 45
чительно меньше, если вообще имеется [93].
препаратов из 100 проявляют терапевтическое
Лекарственные препараты с двумя биоактивны-
действие, и почти такое же количество (43 препа-
ми энантиомерами. К этой группе в нашей выбор-
рата из 100) являются неактивными или менее ак-
ке относятся следующие лекарственные препара-
тивными. В свою очередь, большинство «левых»
ты: алпренолол [122], венлафаксин [123], инда-
S-энантиомеров лекарств (69 из 100) являются
БИОФИЗИКА том 67
№ 3
2022
О ХИРАЛЬНОСТИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
483
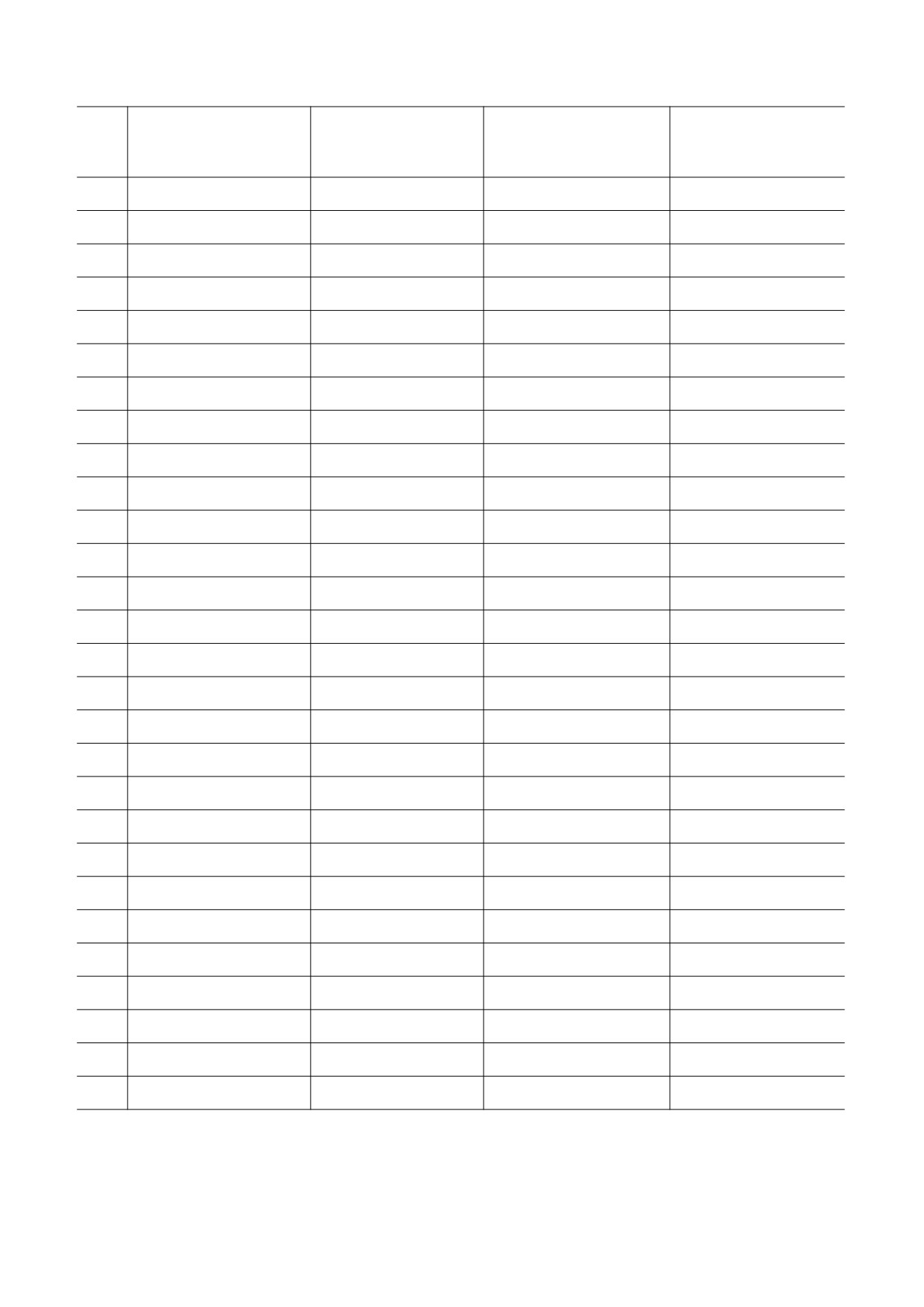
Клиническая эффективность энантиомеров лекарственных препаратов
Энантиомер с меньшим
Биоактивный
Энантиомер, отвечающий
Лекарственное средство
эффектом или
энантиомер
за побочные эффекты
отсутствием эффекта
1
Алпренолол
Оба изомера
2
Амлодипин
S(-)
R(+)
3
Атенолол
S(-)
R(+)
4
Аторвастатин
R,R(+)
S,S(-)
5
Атропин
S(-)
R(+)
6
Аценокумарол
R(+)
S(-)
7
Ацетилкарнитин
R(-)
S(+)
8
Баклофен
R(-)
S(+)
9
Беназеприл
S,S
R,R
10
Бензетимид
S(+)
R(-)
11
Бикалутамид
R(-)
S(+)
12
Бисопролол
S(-)
R(+)
13
Бунолол
S(-)
R(+)
14
Бупивакаин
S(-)
R(+)
15
Буфуранол
R(-)
S(+)
16
Валсартан
S
R
17
Варфарин
S(-)
R(+)
18
Венлафаксин
Оба изомера
19
Верапамил
S(-)
R(+)
20
Вигабатрин
S(+)
R(-)
21
Галотан
S(+)
R(-)
22
Галофантрин
S(-)
R(+)
23
Генаконазол
R,R(-)
S,S(+)
24
Депренил
R(-)
S(+)
25
Допамин
S(-)
R(+)
26
Дропропизин
S(-)
R(+)
27
Дулоксетин
S(+)
R(-)
28
Зопиклон
S(+)
R(-)
БИОФИЗИКА том 67
№ 3
2022
484
БЕЛОВА и др.
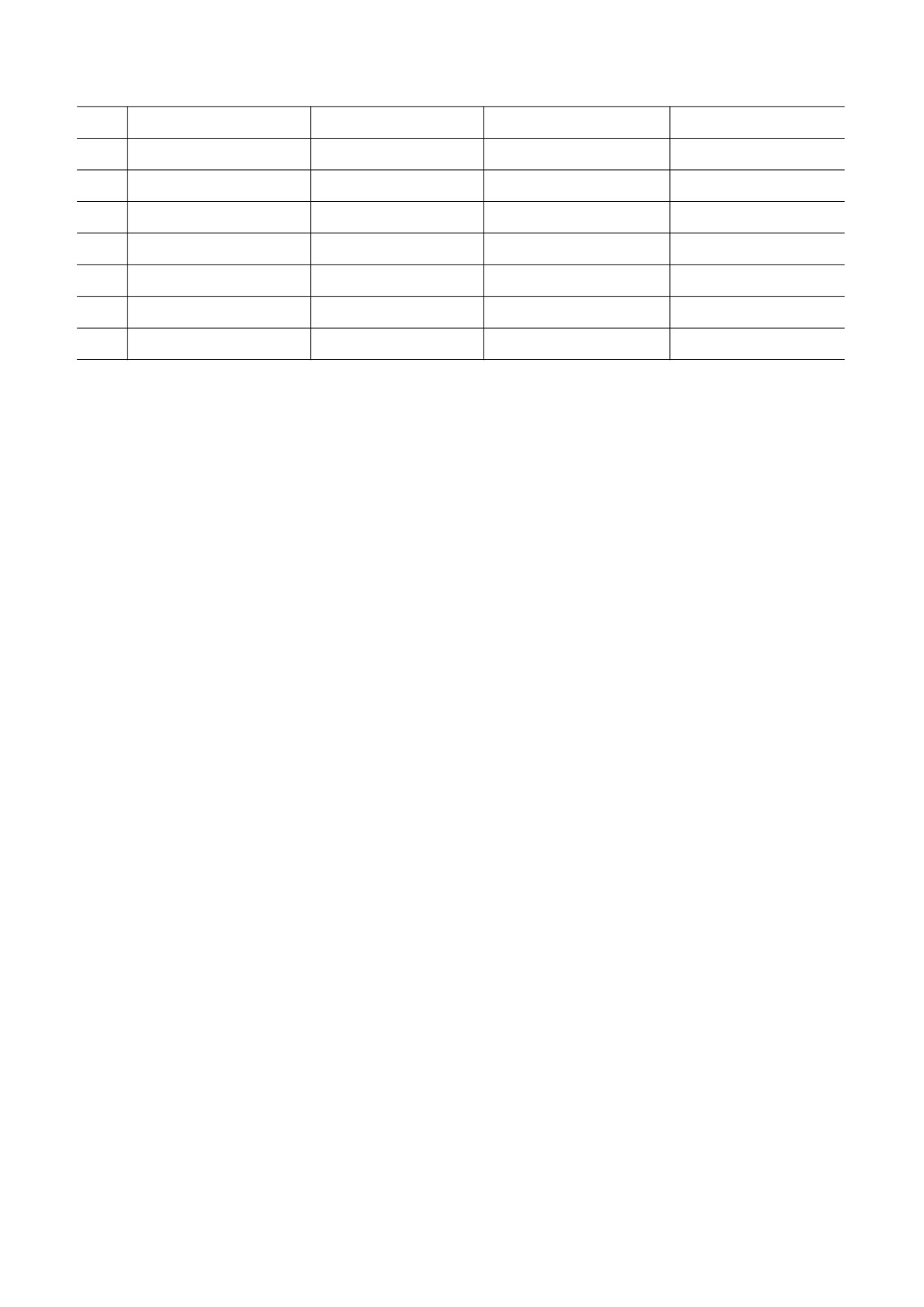
29
Ибупрофен
S(+)
R(-)
30
Изопреналин
R(-)
S(+)
31
Индакринон
Оба изомера
32
Карведилол
S(-)
R(+)
33
Кетамин
S(+)
R(-)
34
Кетопрофен
S(+)
R(-)
35
Кеторолак
S(-)
R(+)
36
Клиданак
S(+)
R(-)
37
Клопидогрел
S(+)
R(-)
38
Лансопразол
R(+)
S(-)
39
Локсиглумид
R(+)
S(-)
40
Мексилетин
R(-)
S(+)
41
Мелфалан
S(-)
R(+)
42
Мепивакаин
S(+)
R(-)
43
Метадон
R(-)
S(+)
44
Метилфенидат
R,R(-)
S,S(+)
45
Метопролол
S(-)
R(+)
46
Меторфан
Оба изомера
47
Метотрексат
S(-)
R(+)
48
Миконазол
R(-)
S(+)
49
Миртазапин
Оба изомера
50
Мопролол
S(-)
R(+)
51
Напроксен
S(+)
R(-)
52
Никардипин
R(+)
S(-)
53
Нимодипин
Оба изомера
54
Оксазепам
S(+)
R(-)
55
Оксапротилин
Оба изомера
56
Оксибутинин
R(-)
S(+)
57
Омепразол
S(-)
R(+)
58
Офлоксацин
S(-)
R(+)
59
Пантопразол
S(-)
R(+)
60
Пенбутолол
S(-)
R(+)
БИОФИЗИКА том 67
№ 3
2022
О ХИРАЛЬНОСТИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
485
61
Пеницилламин
S(-)
R(+)
62
Пиндолол
S(-)
R(+)
63
Прегабалин
S(+)
R(-)
64
Прилокаин
S(+)
R(-)
65
Пронеталол
R(-)
S(+)
66
Пропафенон
Оба изомера
67
Пропранолол
S(-)
R(+)
68
Рабепразол
R(+)
S(-)
69
Ролипрам
R(-)
S(+)
70
Ропивакаин
S(-)
R(+)
71
Сальбутамол
R(-)
S(+)
72
Сертаконазол
R(-)
S(+)
73
Сибутрамин
R(+)
S(-)
74
Соталол
R(-)
S(+)
75
Талидомид
R(+)
S(-)
76
Тербуталин
R(-)
S(+)
77
Тетрамизол
S(-)
R(+)
78
Тиамилал
S(-)
R(+)
79
Тимолол
S(-)
R(+)
80
Тиопентал
S(-)
R(+)
81
Тироксин
Оба изомера
82
Фенибут
R
S
83
Фенопрофен
S(+)
R(-)
84
Фенпрокумон
S(-)
R(+)
85
Фенфлурамин
S(+)
R(-)
86
Флекаинид
Оба изомера
87
Флуоксетин
Оба изомера
88
Формотерол
R,R(-)
S,S(+)
89
Хлорфенирамин
S(+)
R(-)
90
Целипролол
S(-)
R(+)
91
Цетиризин
R(-)
S(+)
92
Циклофосфамид
Оба изомера
БИОФИЗИКА том 67
№ 3
2022
486
БЕЛОВА и др.
93
Циталопрам
S(+)
R(-)
94
Эконазол
Оба изомера
95
Эналаприл
S
R
96
Эпинефрин
R(-)
S(+)
97
Эсмолол
S(-)
R(+)
98
Этамбутол
S,S(+)
R,R(-)
99
Этодолак
Оба изомера
100
Этомидат
R(+)
S(-)
биоактивными и демонстрируют терапевтиче-
шенях воздействия индакринона. Данное лекар-
ский эффект. К изомерам, вызывающим побоч-
ственное средство относится к классу петлевых
ные действия, чаще относятся R-энантиомеры
диуретиков [124]. Препарат используется в виде
препаратов (12 из 100 «правых» энантиомеров по
рацемата, где R-энантиомер проявляет мочегон-
сравнению с 4 из 100 «левых»).
ную активность, а S-энантиомер индуцирует сек-
рецию мочевой кислоты [73].
При анализе классификации биоактивности
(+)/(-)-изомеров были получены похожие соот-
ношения. Стоит обратить внимание на то, что
ЗНАКОПЕРЕМЕННЫЕ ХИРАЛЬНЫЕ
среди изомеров, вызывающих побочные дей-
ИЕРАРХИИ СТРУКТУР
ствия, в равных долях встречаются (+)- и (-)-изо-
В МОЛЕКУЛЯРНОЙ БИОЛОГИИ
меры (по 8 изомеров из 96). Исходя из получен-
ных данных, можно было бы предположить, что
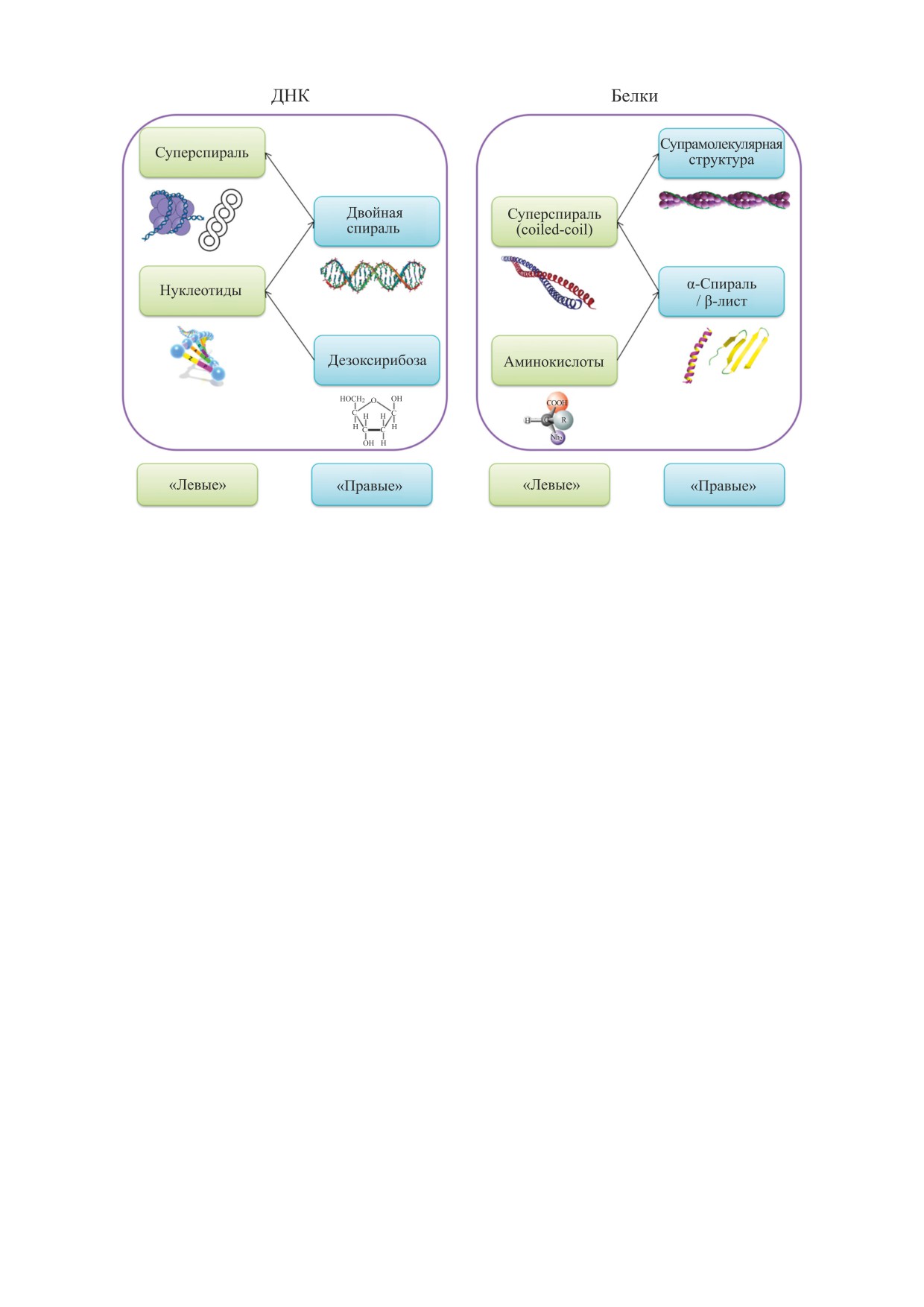
Явление хиральности (гомохиральности)
-
большинство S-энантиомеров рассматриваемых
важнейший признак биологических молекул:
препаратов обладают левовращающей оптиче-
белки сформированы из «левых» (L) аминокис-
ской активностью, а большинство R-энантиоме-
лотных остатков, нуклеиновые кислоты содержат
ров - правовращающей. Однако в нашей подбор-
«правые» (D)-сахара - рибозу и дезоксирибозу
ке чаще встречаются S(+)- и R(-)-энантиомеры,
[138]. В перспективе нам предстоит выяснить со-
то есть корреляция между оптической активно-
ответствие между активными формами хираль-
стью и расположением заместителей в простран-
ных лекарств и знаками хиральности структур
стве не наблюдается, что согласуется со сведени-
разного уровня биомакромолекул, являющихся
ями из литературы.
непосредственными мишенями препаратов.
Подготовленная нами выборка хиральных ле-
Ранее нами впервые были выделены как хи-
карственных препаратов также была классифи-
ральные инварианты знакопеременные иерархии
цирована по типу лекарственного средства. Пре-
хиральных структур в последовательностях от
параты с биоактивным «левым» S-энантиомером
«нижнего» асимметричного атома углерода в sp3-
чаще проявляют гипотензивное, антиангиналь-
гибридизации до суперспиралей и надмолекуляр-
ное, антиаритмическое и анальгезирующее дей-
ных структур в макромолекулярных системах - от
ствие, в то время как препараты с биоактивным
энантиомеров к энантиоморфам, где проявлени-
«правым» R-энантиомером чаще являются брон-
ями хиральности выступают спиральность и су-
холитическими и противогрибковыми сред-
перспиральность [13-15]. Отмечено чередование
ствами.
знака хиральности при переходе на более высо-
С помощью баз данных лекарственных препа-
кий уровень структурно-функциональной орга-
ратов [135-137] были установлены мишени воз-
низации ДНК в А- и В-форме (рис. 3).
действия для большинства рассмотренных ле-
карств. Белки являются мишенями для 94 лекар-
Следует отметить, что ранжирование структур
ственных средств, для трех препаратов мишенью
через знакопеременную хиральность не всегда
является молекула ДНК, для двух лекарственных
буквально совпадает с традиционным их описа-
средств мишенями воздействия являются такие
нием, выявляя
«тонкую структуру» уровней
небольшие молекулы, как протопорфирин IX и
иерархической организации. Возвращаясь к бел-
ион меди. К сожалению, в использованных в дан-
кам, заметим, что тривиальное «право-левое» че-
ной работе базах данных нет информации о ми-
редование знака хиральности в иерархиях их
БИОФИЗИКА том 67
№ 3
2022
О ХИРАЛЬНОСТИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
487
Рис. 3. Чередование знака хиральности при переходе на более высокий уровень структурно-функциональной органи-
зации ДНК и белков.
структур не является абсолютным, но всегда име-
систему соответствий хиральных лекарств и хи-
ет разумное объяснение.
ральных молекулярно-биологических структур.
Кроме того, в процессе хиральной системати-
зации молекулярной биологии проявляется и
ОБСУЖДЕНИЕ
другая тенденция - межмолекулярные взаимо-
действия макромолекул одного и разных классов,
Стереоспецифические взаимодействия проти-
воположных энантиомеров с хиральными био-
по-видимому, зависят не только от непосред-
макромолекулами определяют различия в фарма-
ственного комплементарного соответствия в зоне
кодинамических и фармакокинетических свой-
их контакта, но и от симметрийных (хиральных)
ствах энантиомеров. Рассмотреть связь данных
соответствий, вовлеченных во взаимодействие
свойств энантиомеров с их хиральными характе-
энантиоморфов - крупномасштабных внутримо-
ристиками можно на примере одной из групп
лекулярных и надмолекулярных структур. Так,
наиболее тщательно исследованных в этом отно-
правозакрученные микрофиламенты ориентиро-
шении фармакологических препаратов - β-адре-
ваны на взаимодействие с левыми фосфолипида-
ноблокаторов. По химическому строению эти
ми мембраны клетки. Левозакрученные ламины
препараты можно разделить на две группы: арил-
и микротрубочки направлены на взаимодействие
аминоэтанолы и арилоксиаминопропанолы [10].
с ДНК - правыми двойными спиралями. При
В обеих группах (-)-изомеры проявляют боль-
взаимодействии между однотипными макромо-
шую β-адренолитическую активность, при этом в
лекулами на разных структурных уровнях, как мы
ариламиноэтанольную группу входят энантиоме-
предполагаем, сродство характеризуется одина-
ры с абсолютной R-конфигурацией (например,
ковым знаком хиральности (белок-белок - «ле-
соталол), а в арилоксиаминопропанольную груп-
вый»-«левый», нуклеиновые кислоты
-
пу - с S-конфигурацией (например, метопролол,
ДНК,РНК - «правый»-«правый»).
пенбутолол, пропранолол, тимолол и др.).
Вслед за тем, как нами были выявлены и си-
Считается, что более активный энантиомер
стематизированы определенные закономерности
β-адреноблокатора более эффективно связывает-
в структурообразовании и взаимодействиях важ-
ся с рецептором в строго определенных стереохи-
нейших хиральных биомолекулярных структур,
мических условиях. Кроме того, полагают, что
представляется логичным рассмотреть также и
решающую роль в связывании с рецептором иг-
БИОФИЗИКА том 67
№ 3
2022
488
БЕЛОВА и др.
рают специфические функциональные группы,
вательной школы МГУ имени М.В. Ломоносова
присутствующие в молекуле блокатора. Мы счи-
«Фундаментальные и прикладные исследования
таем, что в дополнение в этом рассмотрении нуж-
космоса» и при поддержке Фонда развития теоре-
но учитывать хиральность как самого лиганда,
тической физики и математики «БАЗИС» в рам-
так и рецептора.
ках гранта
№
21-2-9-42-1 (стипендиат
Е.В. Семенова).
β-адренорецепторы относятся к рецепторам,
сопряженным с G-белком, - интегральным мем-
бранным белкам, которые содержат семь доме-
КОНФЛИКТ ИНТЕРЕСОВ
нов, пронизывающих мембрану (трансмембран-
Авторы заявляют об отсутствии конфликта
ных спиралей). У β-адренорецепторов наблюда-
интересов.
ется преимущественно α-спиральная (т.е.
правозакрученная) конформация [139]. Амино-
кислотные остатки обеспечивают специфические
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
взаимодействия с молекулами β-адреноблокато-
Настоящая работа не содержит описания ис-
ра, но, на наш взгляд, важна и хиральность струк-
следований с использованием людей и животных
тур самого рецептора. Пока не представляется од-
в качестве объектов.
нозначно понятным, важно ли соответствие зна-
ков хиральности абсолютных конфигураций или
оптической активности (правозакрученных
СПИСОК ЛИТЕРАТУРЫ
α-спиралей и «левовращающих» R-энантиомеров
1.
W. H. Brooks, W. C. Guida, and K. G. Daniel, Curr.
ариламиноэтанольной группы или более актив-
Top. Med. Chem. 11, 760 (2011).
ных S-энантиомеров арилоксиаминопропаноль-
2.
R. L. Nation, Clin. Pharmacokinet. 27, 249 (1994).
ной группы). Этот подход к рассмотрению взаи-
модействия хирального препарата и мишени по-
3.
L. A. Nguyen, H. He, and C. Pham-Huy, Int. J.
Biomed. Sci. 2, 85 (2006).
может усовершенствовать подходы к открытию и
разработке лекарств с заданным знаком хираль-
4.
S. W. Smith, Toxicol. Sci. 110, 4 (2009).
ности.
5.
M. E. Franks, G. R. Macpherson, and W. D. Figg,
Lancet 363, 1802 (2004).
Полученные в настоящей работе результаты
6.
J. Knobloch, D. Jungck, and A. Koch, Curr. Mol.
могут быть использованы для выработки системы
Med. 17, 108 (2017).
корреляций во взаимосвязи между хиральной
7.
E. Tokunaga, T. Yamamoto, E. Ito, and N. Shibata,
формой лекарственного средства и ее воздей-
Sci. Rep. 8, 17131 (2018).
ствием на конкретную молекулярную мишень. В
дальнейшем настоящая работа может помочь в
8.
T. Mori, T. Ito, S. Liu, et al., Sci. Rep. 8, 1294 (2018).
установлении природы различий в воздействии
9.
M. Budău, G. Hancu, A. Rusu, et al., Adv. Pharm.
противоположных энантиомеров на живой орга-
Bull. 7, 495 (2017).
низм, что, в свою очередь, может быть использо-
10.
R. Čižmáriková, L. Habala, J. Valentová, and
вано при разработке лекарственных средств.
M. Markuliak, Appl. Sci. 9, 625 (2019).
11.
P. Raikar, B. Gurupadayya, and V. S. Koganti, Curr.
Настоящая работа является поисковой, фено-
Drug Deliv. 15, 1393 (2018).
менологический уровень исследования предпо-
лагает дальнейшее понимание симметрийных ос-
12.
F. Qin, X. Wang, L. Jing, et al., Chirality 25, 934
нов специфического взаимодействия биомакро-
(2013).
молекул. В перспективе нам предстоит выяснить
13.
V. A. Tverdislov, Biophysics 58, 128 (2013).
соответствие между активными формами хираль-
14.
V. A. Tverdislov and E. V. Malyshko, Physics Uspekhi
ных лекарств и знаками хиральности структур
62, 354 (2019).
разного уровня биомакромолекул, являющихся
15.
V. A. Tverdislov and E. V. Malyshko, Symmetry 12,
непосредственными мишенями препаратов или
587 (2020).
же элементами конструкций этих макромолекул-
16.
D. E. Drayer, in Drug Stereochemistry: Analytical
машин. Систематизированные в данной статье по
Methods and Pharmacology, 3rd Edition, Ed. by K. Joz-
знаку хиральности данные по сотне лекарств да-
wiak, W. J. Lough, and I. W. Wainer (CRC Press, New
ют возможность развить данное направление
York, 2012), pp. 1-17.
биофизической фармакологии для более целена-
17.
L. Pasteur, Ann. Chim. Phys. 24, 442 (1848).
правленного и успешного конструирования ле-
18.
K. Jozwiak, in Drug Stereochemistry: Analytical Meth-
карственных препаратов.
ods and Pharmacology, 3rd Edition, Ed. by K. Jozwiak,
W. J. Lough, and I. W. Wainer (CRC Press, New York,
2012), pp. 17-29.
ФИНАНСИРОВАНИЕ РАБОТЫ
19.
M. A. Rosanoff, J. Am. Chem. Soc. 28, 114 (1906).
Исследование выполнено при финансовой
20.
L. C. Cross and W. Klyne, Pure Appl. Chem. 45, 11
поддержке Междисциплинарной научно-образо-
(1976).
БИОФИЗИКА том 67
№ 3
2022
О ХИРАЛЬНОСТИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
489
21.
M. M. Salunkhe and R. V. Nair, Enzyme Microb.
Eadie and F. J. E. Vajda (Springer, Berlin, Heidelberg,
Technol. 28, 333 (2001).
1999), pp. 375-394.
22.
S. Birring, F. de Blasio, P. V. Dicpinigaitis, et al.,
47.
O. Hornykiewicz, Amino Acids 23, 65 (2002).
Pulm. Pharmacol. Ther. 56, 79 (2019).
48.
F. A. Larik, A. Saeed, P. A. Channar, and H. Meh-
23.
M. Siluveru and J. T. Stewart, J. Pharm. Biomed.
fooz, Tetrahedron Asymmetry 27, 1101 (2016).
Anal. 15, 389 (1996).
49.
N. N. Salama, H. E. Zaazaa, L. M. Abd El Halim, et
24.
H. S. Smith, in Encyclopedia of the Neurological Sci-
al., J. Planar. Chromat. 27, 166 (2014).
ences,
2nd Edition, Ed. by M. J. Aminoff and
50.
S. Sangaraju, M. Lakshmi Kanth, B. M. Rao, and
R. B. Daroff (Acad. Press, London, Waltham, San Di-
N. Someswararao, Die Pharmazie 64, 717 (2009).
ego, 2014), pp. 610-613.
51.
C. Sánchez, K. P. Bøgesø, B. Ebert, et al., Psycho-
25.
B. Petrie and D. Camacho-Muñoz, Environ. Chem.
pharmacology 174, 163 (2004).
Lett. 19, 43 (2021).
52.
P. A. van Zwieten, Cardiology 82 (Suppl. 3), 19
26.
M. Souza, M. P. Marques, G. Duarte, and V. L. Lan-
(1993).
chote, J. Pharm. Biomed. Anal. 164, 268 (2019).
53.
J. Muller, S. Pentyala, J. Dilger, and S. Pentyala, Ther.
27.
R. D. Miller, L. I. Eriksson, L. A. Fleisher, et al., in
Adv. Psychopharmacol. 6, 185 (2016).
Miller's Textbook of Anesthesia, 7th edition (Elsevier,
54.
A. Kulo, A. Smits, S. Maleškić, et al., Bosn. J. Basic
Philadelphia, 2009).
Med. Sci. 17, 54 (2017).
28.
J. M. Karle, Antimicrob. Agents Chemother. 41, 791
55.
S. Tamura, S. Kuzuna, and K. Kawai, J. Pharm. Phar-
(1997).
macol. 33, 29 (1981).
29.
F. Główka, M. Karaźniewicz-Łada, E. Grześkowiak,
56.
J. Brook, J. R. Bateman, and J. L. Steinfeld, Cancer
et al., Eur. J. Drug Metab. Pharmacokinet. 36, 167
Chemother. Rep. 36, 25 (1964).
(2011).
57.
W. M. Goebel and D. F. Mitchell, Oral Surg. Oral
30.
R. Vardanyan and V. Hruby, in Synthesis of Best-Seller
Med. Oral Pathol. 40, 471 (1975).
Drugs, Ed. by R. Vardanyan and V. Hruby (Acad.
58.
B. F. Tullar, J. Med. Chem. 14, 891 (1971).
Press, Amsterdam, 2016), pp. 383-412.
59.
S. M. Cramer, J. H. Schornagel, K. K. Kalghatgi,
31.
A. Mozayani, P. Singer, and G. Jones, J. Anal. Toxi-
et al., Cancer Res. 44, 1843 (1984).
col. 19, 519 (1995).
60.
I. K. Morton and J. M. Hall, in Concise Dictionary of
32.
Y. Wang, J. Zhou, Q. Han, et al., Electroanalysis 24,
Pharmacological Agents (Springer, Netherlands, Hei-
1561 (2012) .
delberg, 1999), pp. 185.
33.
R. Pool, in Fat: Fighting the Obesity Epidemic (Oxford
61.
G. Hancu, A. Gáspár, and A. Gyéresi, Farmacia 56,
University Press, Oxford, 2001), pp. 183-212.
381 (2008).
34.
N. Chhabra, M. L. Aseri, and D. Padmanabhan, Int.
62.
A. Novotna, A. Srovnalova, M. Svecarova, et al.,
J. Appl. Basic Med. Res. 3, 16 (2013).
PLoS One 9, e98711 (2014).
35.
G. Hancu, M. Budău, L. K. Kántor, and A. Cârje,
63.
L. Rabbaa, S. Dautrey, N. Colas-Linhart, et al., Anti-
Adv. Pharm. Bull. 5, 35 (2015).
microb. Agents Chemother. 41, 2274 (1977).
36.
J. Dalal, J. C. Mohan, S. S. Iyengar, et al., Int. J. Hy-
64.
Y. K. Cho, M. G. Choi, Y. T. Bak, et al., Dig. Dis. Sci.
pertens. 2018, 8681792 (2018).
57, 3189 (2012).
37.
R. Mehvar, M. E. Gross, and R. N. Kreamer, J.
65.
H. Wang and Z. Shen, Rapid Commun. Mass Spec-
Pharm. Sci. 79, 881 (1990).
trom. 20, 291 (2006).
38.
R. Kumar, J. Martens, and R. Bhushan, J. Liq. Chro-
66.
X. Chen, D. Zhang, J. Deng, and X. Fu, J. Chromato-
matogr. Relat. Technol. 38, 111 (2015).
gr. Sci. 46, 42 (2008).
39.
E. Kublin, K. Czerwińska, E. Wyszomirska, et al., Ac-
67.
L. N. Chennuru, T. Choppari, R. P. Nandula, et al.,
ta Pol. Pharm. 72, 219 (2015).
Molecules 21, 1578 (2016).
40.
J. J. Li, in Imides: Medicinal, Agricultural, Synthetic
68.
A. M. Barrett and V. A. Cullum, Br. J. Pharmacol. 34,
Applications and Natural Products Chemistry, Ed. by F.
43 (1968).
A. Luzzio (Elsevier, Amsterdam, 2019), pp. 353-366.
69.
K. Stoschitzky, W. Lindner, and W. Kiowski, J. Car-
41.
Y. Horikiri, T. Suzuki, and M. Mizobe, J. Pharm. Sci.
diovasc. Pharmacol. 25, 268 (1995).
87, 289 (1998).
70.
J. H. McClure, Br. J. Anaesth. 76, 300 (1996).
42.
J. P. Gonzalez and S. P. Clissold, Drugs 34, 648
71.
X. J. Cai, X. Z. Xu, and C. X. Pan, Anal. Lett. 38, 1149
(1987).
(2005).
43.
K. M. Rentsch, J. Biochem. Biophys. Methods 54, 1
72.
M. Sueyasu, K. Fujito, K. Makino, et al., J. Chro-
(2002).
matogr. B. Biomed. Sci. Appl. 723, 307 (1999).
44.
D. S. Hewick and J. McEwen, J. Pharm. Pharmacol.
73.
N. M. Davies and X. W. Teng, Adv. Pharm. 1, 242
25, 458 (1973).
(2003).
45.
K. Häussermann, B. Benz, V. Gekeler, et al., Eur. J.
74.
D. L. Downie, N. P. Franks, and W. R. Lieb, Anesthe-
Clin. Pharmacol. 40, 53 (1991).
siology 93, 774 (2000).
46.
E. Ben-Menachem, in Antiepileptic Drugs. Handbook
75.
S. Mitra and P. Chopra, Ind. J. Anaesth. 55, 556
of Experimental Pharmacology, vol. 138, Ed. by M. J.
(2011).
БИОФИЗИКА том 67
№ 3
2022
490
БЕЛОВА и др.
76.
A. M. Evans, Eur. J. Clin. Pharmacol. 42, 237 (1992).
106. M. Lin, O. Aladejebi, and G. H. Hockerman, Eur. J.
77.
H. Alkadi and R. Jbeily, Infect. Disord. Drug Targets
Pharmacol. 670, 105 (2011).
18, 88 (2018).
107. I. Mak, J. Kramer, and W. Weglicki, Coronary Artery
78.
M. H. Perrone and J. A. Barrett, Am. Heart J. 121, 677
Disease 3, 1095 (1992).
(1991).
108. T. Takenaka, I. Miyazaki, M. Asano, et al., Jpn. J.
79.
C. Sánchez, Basic Clin. Pharmacol. Toxicol. 99, 91
Pharmacol. 32, 665 (1982).
(2006).
109. M. J. Kennelly, Rev. Urol. 12, 12 (2010).
80.
R. I. Stefan, H. Y. Aboul-Enein, and G. L. Radu,
110. L. Noronha-Blob and J. F. Kachur, J. Pharmacol.
Prep. Biochem. Biotechnol. 28, 305 (1998).
Exp. Ther. 256, 562 (1991).
81.
R. Gorczynski, C. Quon, R. Krasula, and W. Matier,
111. R. Howe and B. S. Rao, J. Med. Chem. 11, 1118
Cardiovasc. Drug Rev. 3, 99 (2007).
(1968).
82.
H. Beng, H. Zhang, R. Jayachandra, et al., Chirality
112. T. Andersson and L. Weidolf, Clin. Drug Investig. 28,
30, 759 (2018).
263 (2008).
83.
G. A. Jacobson, S. Raidal, K. Robson, et al., Br. J.
113. D. R. Brocks, M. Vakily, and R. Mehvar, in Chirality
Clin. Pharmacol. 83, 1436 (2017).
in drug design and development, Ed. by I. K. Reddy and
84.
C. Funck-Brentano, Eur. Heart J. 14, 30 (1993).
R. Mehvar (Marcel Dekker, New York,
2004),
85.
A. L. Waldo, A. J. Camm, H. deRuyter, et al., Lancet
pp. 191-280.
348, 7 (1996).
114. H. Wachtel, J. Pharm. Pharmacol. 35, 440 (1983).
86.
M. Korhonova, A. Doricakova, and Z. Dvorak, PLoS
115. M. Link, R. Novotná, B. Suchanova, et al., J. Pharm.
One 10, e0137720 (2015).
Pharmacol. 57, 405 (2005).
87.
B. D. Roth, Prog. Med. Chem. 40, 1 (2002).
116. M. Dambrova, L. Zvejniece, E. Liepinsh, et al., Eur. J.
88.
J. Godbillon, J. Richard, A. Gerardin, et al., Br. J.
Pharmacol. 583, 128 (2008).
Clin. Pharmac. 12, 621 (1981).
117. D. Schmidt, B. L. Källström, B. Waldeck, et al., Arch.
89.
T. Meinertz, W. Kasper, C. Kahl, and E. Jähnchen, Br.
Pharmacol. 361, 405 (2000).
J. Clin. Pharmacol. 5, 187 (1978).
118. M. S. Benedetti, M. Plisnier, J. Kaise, et al., Eur. J.
90.
M. Kagawa, Y. Machida, and H. Nishi, J. Chromato-
Clin. Pharmacol. 57, 571 (2001).
gr. A 857, 127 (1999).
119. K. Blake and H. Raissy, Pediatr. Allergy Immunol.
91.
H. Müller, J. Zierski, D. Dralle, et al., in: Local-spinal
Pulmonol. 26, 157 (2013).
Therapy of Spasticity, Ed. by H. Müller, J. Zierski, and
120. D. Kirkpatrick, J. Yang, and M. Trehy, J. Liq. Chro-
R.D. Penn (Springer, Berlin, Heidelberg, 1988), pp.
matogr. Relat. Technol. 40, 556 (2017).
223-226.
121. S. L. Tomlin, A. Jenkins, W. R. Lieb, and N. P. Franks,
92.
M. Singh, P. Malik, and R. Bhushan, J. Chromatogr.
Anesthesiology. 88, 708 (1998).
Sci. 54, 842 (2016).
122. M. Ebadi, in CRC Desk reference of clinical pharmaco-
93.
I. D. Cockshott, S. D. Oliver, J. J. Young, et al., Bio-
logy (CRC Press, Boca Raton, 1997), pp. 37-38.
pharm. Drug Dispos. 18, 499 (1997).
123. A. L. P. C. Godoy, A. Rocha, C. da Silva Souza, and
94.
B. Nagy, N. Dima, C. Paizs, et al., Tetrahedron Asym-
V. L. Lanchote, J. Clin. Pharmacol. 56, 567 (2016).
metry 25, 1316 (2014).
124. P. H. Vlasses, H. H. Rotmensch, B. N. Swanson, et al.,
95.
H. Kim, E. Radwanski, R. Lovey, et al., Chirality 14,
Pharmacotherapy 4, 272 (1984).
436 (2002).
125. D. Tedesco, A. Pietra, F. Rossi, et al., J. Pharm.
96.
K. Magyar, B. Szende, V. Jenei, et al., Neurochem.
Biomed. Anal. 81-82,76 (2013).
Res. 35, 1922 (2010).
126. S. A. Anttila and E. V. Leinonen, CNS Drug Rev. 7,
97.
E. Szökö, H. Kalász, and K. Magyar, Eur. J. Drug Me-
249 (2001).
tab. Pharmacokinet. 24, 315 (1999).
127. H. Wanner-Olsen, F. B. Gaarskaer, E. O. Mikkelsen,
98.
J. Pagadala, K. Williams-Guy, M. M. Nooh, et al.,
et al., Chirality 12, 660 (2000).
Med. Chem. Commun. 2, 726 (2011).
128. R. J. Crossley, in Chirality and Biological Activity of
99.
H. Katsuki, H. Yagi, K. Arimori, et al., Pharm. Res.
Drugs (CRC Press, Bosa Roca, 1995).
13, 611 (1996).
129. H. K. Kroemer, C. Funck-Brentano, D. J. Silberstein,
100. G. Varga, Curr. Opin. Investig Drugs 3, 621 (2002).
et al., Circulation 79, 1068 (1989).
101. A. De Luca, F. Natuzzi, G. Lentini, et al., Arch. Phar-
130. Q. Zhou, T. W. Yao, and S. Zeng, World J. Gastroen-
macol. 352, 653 (1995).
terol. 7, 830 (2001).
102. Z. Gurabi, B. Patocskai, B. Györe, et al., Can. J.
131. D. Jin, A. P. Kumar, G. Song, and Y. Lee, Microchem
Physiol. Pharmacol. 95, 830 (2017).
J. 88, 62 (2008).
103. K. Kristensen, C. B. Christensen, and L. L. Christrup,
132. H. K. Kroemer, J. Turgeon, R. A. Parker, and
Life Sci. 56, PL45 (1995).
D. M. Roden, Clin. Pharmacol. Ther. 46, 584 (1989).
104. D. J. Heal and D. M. Pierce, CNS Drugs 20, 713
133. M. Cârcu-Dobrin, M. Budău, G. Hancu, et al., Saudi
(2006).
Pharm. J. 25, 397 (2017).
105. J. Mangas-Sánchez, E. Busto, V. Gotor-Fernández,
134. N. Inoue, M. Nogawa, S. Ito, et al., Biol. Pharm. Bull.
et al., J. Org. Chem. 76, 2115 (2011).
34, 655 (2011).
БИОФИЗИКА том 67
№ 3
2022
О ХИРАЛЬНОСТИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
491
135. D. S. Wishart, Y. D. Feunang, A. C. Guo, et al., Nucl.
138. B. Alberts, A. Johnson, J. Lewis, et al., Molecular Bi-
Acids Res. 46, D1074 (2017).
ology of the Cell, 4th Edition (Garland Science, New
136. J. Tang, Z. U. Tanoli, B. Ravikumar, et al., Cell Chem.
York, 2002).
Biol., 25, 224 (2018).
137. Y. Wang, S. Zhang, F. Li, et al., Nucl. Acids Res. 48,
139. H. Jung, R. Windhaber, D. Palm, and K. D. Schnack-
D1031 (2020).
erz, Biochemistry 35, 6399 (1996).
On the Chirality of Drugs and Biomacromolecule Structures
E.V. Belova, E.V. Semenova, and V.A. Tverdislov
Faculty of Physics, Lomonosov Moscow State University, Leninskie Gory 1/2, Moscow, 119991 Russia
The development of the concept of a role of chirality in the structure formation of biomacromolecules is
demonstrated using correlations between the chiral form of a drug and its bioactivity as an example. Under-
standing the nature of the chiral-hierarchical structure of biomacromolecules as targets and the symmetry
structure of drugs is of great importance for establishing the possible systematic character of chiral correspon-
dences between drugs and targets. It is crucial to take the stereoselectivity of drug-target molecule interactions
into account when creating drugs, since one chiral form of the drug may have a therapeutic effect but the oth-
er one may be non-digestible, weakly active, or even cause severe side effects, and be toxic. The bioactivity of
chiral drugs is discussed and assumptions about the possible relationship between the drug chirality and the
drug effect on a specific chiral molecular target are made.
Keywords: chirality, enantiomers, chiral drugs, stereoselectivity, structure hierarchies
БИОФИЗИКА том 67
№ 3
2022