БИОФИЗИКА, 2022, том 67, № 3, с. 531-539
БИОФИЗИКА КЛЕТКИ
УДК 577.34
МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ БАКТЕРИЙ Salmonella typhimurium
И Staphylococcus aureus ПРИ ИМПУЛЬСНОМ ФОТОВОЗБУЖДЕНИИ
МОЛЕКУЛЯРНЫХ СЕНСИБИЛИЗАТОРОВ
© 2022 г. С.Н. Летута, А.Т. Ишемгулов, А.Н. Никиян, Д.А. Раздобреев, Л.В. Галактионова,
Д.В. Дорофеев, Д.Е. Цюрко
Оренбургский государственный университет, 460018, Оренбург, просп. Победы, 13
E-mail: azamat.ischemgulov@yandex.ru
Поступила в редакцию 10.03.2022 г.
После доработки 01.04.2022 г.
Принята к публикации 05.04.2022 г.
Обсуждаются механизмы инактивации планктонных культур бактерий Salmonella typhimurium и
Staphylococcus aureus при возбуждении сенсибилизаторов мощными импульсами лазерного излуче-
ния длительностью 10 нс. Показано, что в зависимости от типа сенсибилизаторов и характера их
взаимодействия с бактериями в растворах имеют место фотодинамическая инактивация активными
формами кислорода и локальная гипертермия клеток. При высокой плотности мощности возбуж-
дающего излучения (выше 10 МВт/см2) доминирующим механизмом повреждения бактерий стано-
вится деструкция клеток ударными акустическими волнами, возникающими в результате быстрого
локального нагрева среды при трансформации сенсибилизаторами световой энергии в тепловую.
Ключевые слова: молекулярные сенсибилизаторы, бактериальная инактивация, фотодинамическое
действие, гипертермия, ударные волны.
DOI: 10.31857/S0006302922030115, EDN: AOCQTJ
Для воздействия на микроорганизмы в глубо-
Непрерывное увеличение количества штам-
ких слоях непрозрачных сред можно использо-
мов, устойчивых к традиционным антимикроб-
вать ударные волны [11, 14, 15]. Воздействие будет
ным препаратам, рискует обернуться значитель-
эффективным, если ударная волна создает доста-
ными гуманитарными и экономическими по-
точный для разрушения клеток перепад давления
следствиями. Способность патогенных бактерий
в масштабе, сравнимом с размерами микроорга-
вырабатывать устойчивость к антибиотикам ини-
низма. Если ударную волну возбуждать путем
циирует поиск новых способов инактивации, к
быстрого локального нагрева среды за время
которым они не смогут выработать иммунитет
~1 нс, то протяженность фронта волны составит
[1-3].
~1.5 мкм, что соизмеримо с размерами бактерий
(порядка 1-5 мкм) и при достаточной амплитуде
Таким требованиям воздействия на живые
окажется губительным для микроорганизмов.
микроорганизмы удовлетворяет фотодинамиче-
Ударные волны могут образовываться при уча-
ская обработка с участием активных форм кисло-
стии ФС, если возбуждение будет осуществляться
рода (АФК) [4-13]. Однако фотодинамическое
короткими, но мощными импульсами лазерного
действие эффективно только в высоко аэриро-
излучения [15]. В задаче инактивации микроорга-
ванных прозрачных средах, в которых возбужда-
низмов можно сформулировать следующие тре-
ющий свет проникает в глубокие слои. Среды, со-
бования к ФС:
держащие микроорганизмы, как правило, мут-
- высокий коэффициент поглощения на дли-
ные и сильно рассеивающие. В таких средах
не волны возбуждающего света;
фотосенсибилизаторы (ФС) эффективны только
- хорошая растворимость в среде с микроорга-
в периферийных приповерхностных слоях.
низмами;
Сокращения: АФК - активные формы кислорода, ФС - фо-
- эффективное превращение лучистой энер-
тосенсибилизаторы, ВЭВС - высокие электронно-возбуж-
гии в тепло.
денные состояния (молекул), КОЕ - колониеобразующие
единицы, ДРС - динамическое рассеяние света, АСМ -
Таким требованиям удовлетворяют молекулы
атомно-силовая микроскопия.
органических красителей. Для обеспечения се-
531
532
ЛЕТУТА и др.
лективности локального нагрева возбуждение
тивным генератором АФК. Родамин С является
молекул красителей целесообразно производить
катионным красителем. Его квантовый выход в
видимым светом в основной полосе S0→S1 погло-
триплетное состояние низкий (близок к нулю), и
щения. Показано [14-19], что при высокой плот-
он не является генератором АФК. Заметим, что
ности мощности возбуждения (больше чем 8-
вместо этой пары красителей можно было ис-
пользовать любые другие соединения. Настоящая
10 МВт/см2) молекулы способны поглощать два и
статья посвящена не конкретным сенсибилизато-
более кванта падающего излучения и ступенчато
рам процессов, а различным механизмам фото-
переходить через нижние синглетные S1- или
повреждения бактерий.
триплетные T1-уровни в высокие электронно-
возбужденные состояния (ВЭВС) Sn и Tm. Время
Для фотоинактивации бактерий суспензию с
жизни ВЭВС практически всех многоатомных
красителем через торцевую стенку кюветы (5 мм)
молекул не превышает несколько пикосекунд, а
возбуждали импульсами сфокусированного ла-
релаксация их ВЭВС осуществляется посред-
зерного излучения. Источником возбуждения
ством безызлучательной внутренней конверсии.
служил импульсно-периодический YAG:Nd лазер
Таким образом, фактически вся запасенная энер-
LQ-215 (SolarLS, Беларусь). Параметры возбуж-
гия ВЭВС трансформируется в нагрев среды [20,
дения: длина волны λ = 532 нм, длительность им-
21]. Если в качестве термосенсибилизаторов ис-
пульса
10 нс, частота следования импульсов
пользовать красители с высоким квантовым вы-
10 Гц. С помощью цилиндрической собирающей
ходом в триплетное состояние, то одновременно
линзы в кювете создавали зону возбуждения с
с нагревом такие молекулы могут обеспечивать
апертурой 3.5×0.35 мм2. Плотность мощности
эффективную генерацию АФК. В случае связыва-
возбуждения была максимальной в фокусе линзы
ния молекул красителей со стенками бактерий
и регулировалась в пределах 0.1-30 МВт/cм2.
или их проникновения внутрь клеток, возможна
Часть света за фокусом линзы проникала в рас-
гипертермия клеток. В настоящей работе пред-
твор. В зависимости от концентрации красителей
ставлены результаты исследований различных
и интенсивности накачки возбуждающее излуче-
механизмов повреждения бактерий Salmonella ty-
ние проникало вглубь раствора на расстояние не
phimurium и Staphylococcus aureus в присутствии
более 5-6 мм. Перемешивание образцов в кювете
анионных и катионных сенсибилизаторов.
во время облучения, а также после облучения не
проводилось.
МАТЕРИАЛЫ И МЕТОДЫ
Выбранные красители очень эффективно по-
Объектами исследования служили штаммы
глощают излучение длины волны λ = 532 нм.
Salmonella typhimurium LT2 и Staphylococcus aureus.
Безызлучательная релаксация электронно-воз-
Бактерии S. typhimurium предварительно культи-
бужденных состояний молекул красителей со-
вировали в течение суток на висмут-сульфитном
провождается локальным нагревом среды. В ре-
агаре при 37°C. Затем клетки суспендировали в
зультате в зоне фокусировки возникают ударные
0.9%-м стерильном растворе NaCl до значения
волны аксиальной симметрии. Распространение
оптической плотности 0.1 на длине волны 625 нм,
волн по объему кюветы фиксировалось по рассе-
которую измеряли на спектрофотометре Immu-
янию зондирующего луча сечением менее 1 мм от
noChem-2100 (High Technology Inc., США). Куль-
невозмущающего He-Ne-лазера. Зондирующий
туру S. aureus выращивали на LB-агаре (Sigma-Al-
луч пересекал кювету в направлении перпендику-
drich, США) в течение 18-24 ч при 30°С. Полу-
лярном возбуждающему лучу на регулируемом
ченную бактериальную массу суспендировали в
расстоянии от фокуса линзы. Детально экспери-
0.9%-м растворе NaCl и доводили оптическую
ментальная установка и методика регистрации
плотность до 0.015 на длине волны 450 нм.
ударных волн представлены в работе [22].
Суспензию в объеме 200 мкл помещали в квар-
Инактивирующее действие лазерного излуче-
цевую кювету сечением 5 ⋅ 24 мм2 и высотой
ния на S. typhimurium оценивали путем подсчета
37 мм, добавляли от 0.2 до 0.5 мл красителя-сен-
колониеобразующих единиц (КОЕ). До и после
сибилизатора в исходной концентрации (1 мМ) и
облучения из кюветы отбирали 0.3 мл суспензии
доливали 0.9%-й раствор NaCl до общего объема
и проводили серию разведений в растворе NaCl с
2 мл. Красители растворяли в том же физиологи-
последующим высевом из двух параллельных раз-
ческом растворе, что и бактерии.
ведений (10-2 и 10-3) на висмут-сульфитный агар
В качестве сенсибилизаторов использовали
(для получения достоверно значимых результатов
красители эритрозин и родамин С. Ксантеновый
исследования проводили в пятикратной повтор-
анионный краситель эритрозин обладает высо-
ности). Полученную среду инкубировали при
ким (близким к единице) квантовым выходом в
37°C в течение 24 ч с последующим подсчетом
триплетное состояние и является очень эффек-
КОЕ.
БИОФИЗИКА том 67
№ 3
2022
МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ БАКТЕРИЙ
533
(ОАО «Завод ПРОТОН-МИЭТ», Зеленоград), ра-
ботающий в атомно-силовом режиме.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Взаимодействие красителей с бактериями. Из-
вестно [23], что на поверхности бактерий распре-
делен отрицательный заряд, сформированный
анионными полимерами клеточных стенок, в
первую очередь, пептидогликаном со встроенны-
ми карбоксильными группами γ-глютаминовой и
мезо-диаминопимелиновой кислот, а также тер-
минальные остатки D-Ala пептидных субъеди-
ниц. Наличие отрицательного заряда у бактерий
приводит к тому, что в растворах за счет электро-
статического взаимодействия молекулы-катионы
связываются с клетками, что сопровождается из-
менениями их спектрально-люминесцентных
свойств. Поэтому взаимодействие родамина С и
эритрозина с бактериями исследовано методами
электронной абсорбционной и флуоресцентной
спектроскопии.
В электронных спектрах поглощения и флуо-
ресценции эритрозина в физиологическом рас-
творе при добавлении бактерий S. typhimurium су-
щественные изменения не зафиксированы. Не-
значительное уменьшение пропускания света
растворами и падение интенсивности флуорес-
ценции обусловлено рассеянием зондирующего
(возбуждающего) света микроорганизмами.
Напротив, родамин С активно взаимодейству-
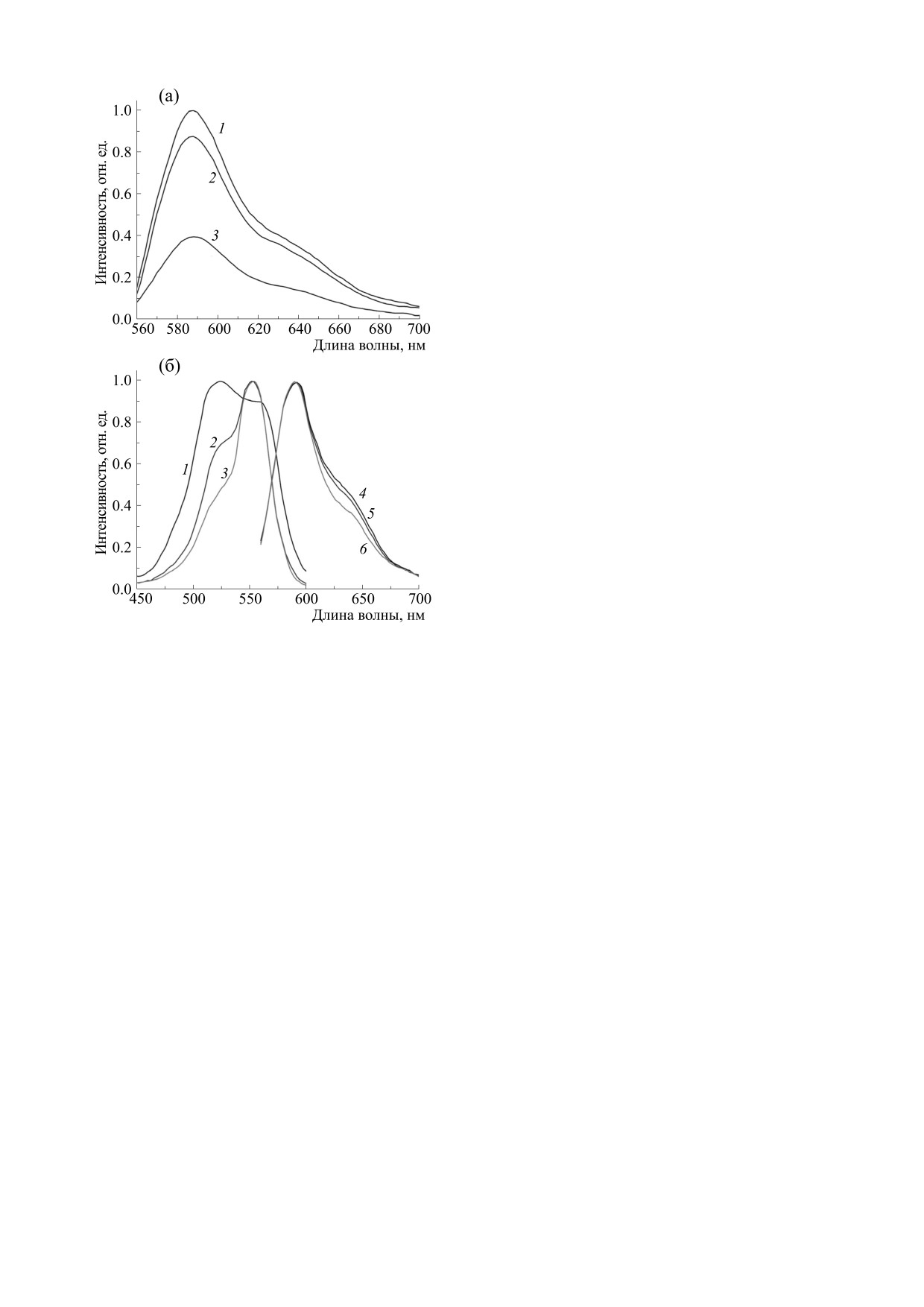
ет с бактериями. На рис. 1а представлены спек-
Рис. 1. (а) - Спектры флуоресценции родамина С в
физрастворе (0.25 мМ) при различном содержании
тры флуоресценции родамина С (0.25 мМ) в фи-
S. typhimurium: 0.25·106 КОЕ/мл (1); 0.5·106 КОЕ/мл
зиологическом растворе при различной концен-
(2), и 107 КОЕ/мл (3). (б) - Спектры поглощения
трации бактерий S. typhimurium. С ростом
(1, 2, 3) и люминесценции (4, 5, 6) родамина С в
концентрации бактерий интенсивность флуорес-
физрастворе. Концентрация красителя: 1 ммоль/л
ценции красителя уменьшается. Это обусловлено
(1, 4), 0.5 ммоль/л (2, 5) и 0.1 ммоль/л (3, 6).
связыванием молекул красителя со стенками кле-
ток. При этом катионы красителя восстанавлива-
ются, а отрицательный заряд стенки S. typhimuri-
Для оценки повреждения S. aureus пробы сус-
um частично нейтрализуется.
пензии бактерий с красителями до и после облу-
чения вносили в 1 мл LB-бульона, и инкубирова-
Анализ спектров поглощения и флуоресцен-
ли при 30°С в течение 16-18 ч, после чего перено-
ции родамина С (рис. 1б) указывает на присут-
сили в лунки прозрачного планшета и измеряли
ствие в растворе (даже без бактерий) ассоциатов
оптическую плотность на длинах волн 450 и
красителя уже при концентрации молекул выше
630 нм.
10-4 моль/л. В спектрах поглощения и флуорес-
ценции красителя появляются максимумы в об-
Размеры частиц и их распределения по разме-
ласти 510 нм и 640 нм соответственно. Это важно
рам определяли методом динамического рассея-
потому, что при образовании ассоциатов тепло-
ния света (ДРС) с помощью наносайзера Photocor
выделение в растворе после фотовозбуждения
(ООО «Фотокор», Москва) и программы DynaLS.
увеличивается, поскольку квантовый выход флу-
Подвижность частиц и их среднее число в объеме
оресценции ассоциатов красителя ниже, чем мо-
рассеяния оценивали визуально с помощью мик-
номеров [24]. Однако в бактериальных растворах
роскопа Altami (ООО «Альтами», Санкт-Петер-
ни в спектрах поглощения, ни в спектрах флуо-
бург).
ресценции не обнаружены новые максимумы,
Для установления характера повреждения бак-
свидетельствующие об образовании ассоциатов
терий и изменения их топографии использовали
красителя. Мономеры родамина С относительно
зондовый сканирующий микроскоп ССМ-2000
равномерно распределяются по поверхности бак-
БИОФИЗИКА том 67
№ 3
2022
534
ЛЕТУТА и др.
ствие бактерий друг с другом. Нейтрализация за-
ряда внешней стенки клеток приводит к тому, что
они «слипаются» в крупные агрегаты размером
около 5-10 мкм. Такие крупные объекты нетруд-
но наблюдать в оптический микроскоп. Для
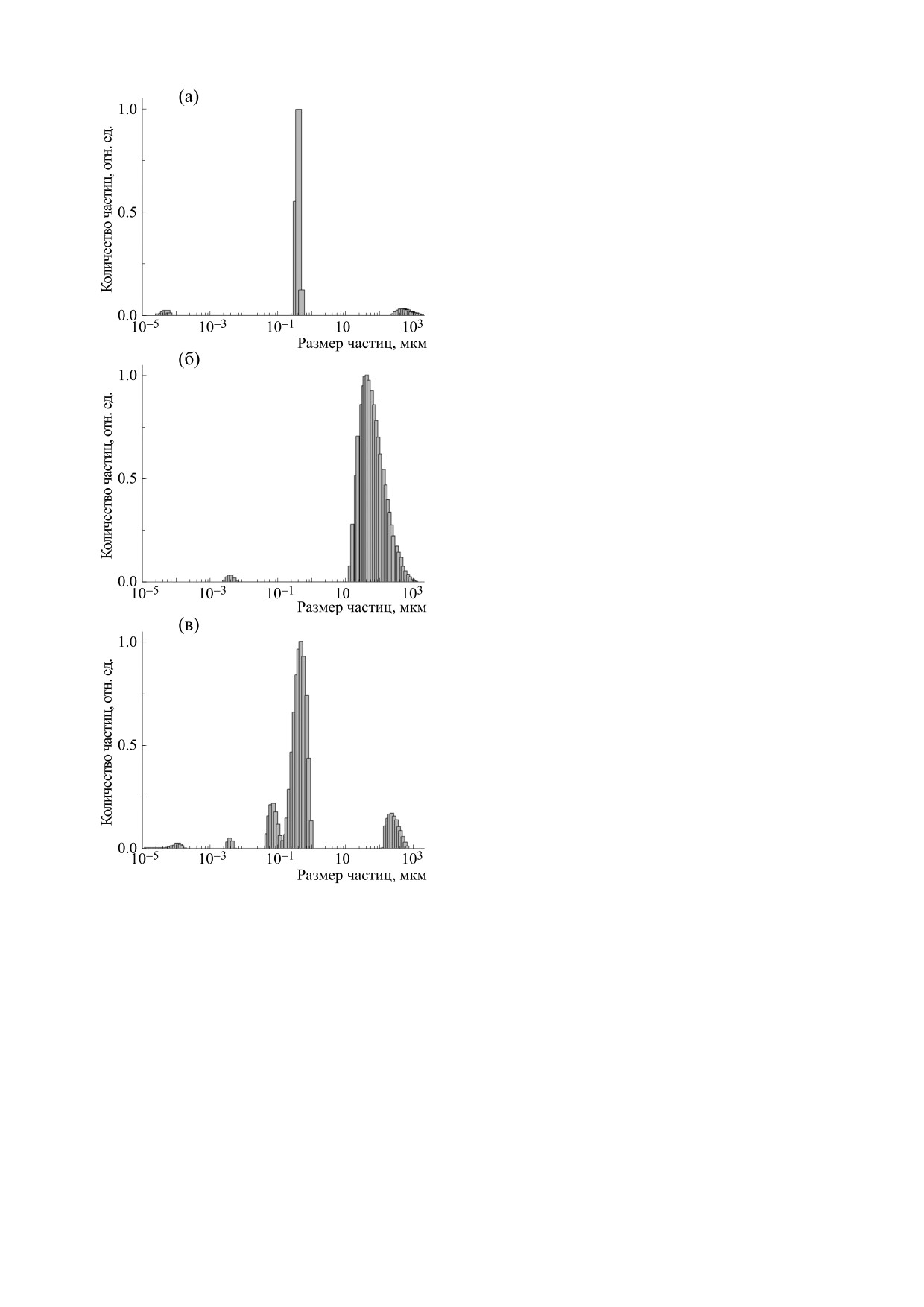
оценки распределения частиц по размерам по-
строены гистограммы ДРС растворами бактерий
до и после добавления родамина С, представлен-
ные на рис. 2а,б. В растворах без красителя эф-
фективный гидродинамический радиус у 85.4%
бактерий составлял 0.594 мкм, а у 11.6% - 6.4 мкм
(рис. 2а). После добавления родамина С одиноч-
ных бактерий в растворе практически не остается.
Эффективный радиус образующихся скоплений
микроорганизмов на порядок больше (рис. 2б).
Обоснованием достоверности определения
размеров частиц методом ДРС служит достаточно
большая концентрация частиц в объеме рассея-
ния (не менее 200 бактерий) и незначительная до-
ля (около 5% от общего числа) активно двигаю-
щихся бактерий (можно надежно считать, что ос-
новная масса бактерий совершает броуновское
движение). Время корреляции, связанное с ре-
лаксацией флуктуаций концентрации бактерий
за счет их собственного перемещения, более
быстрого, чем тепловое броуновское движение,
можно оценить по левому пику на рис. 2а.
Форму и размеры образующихся агрегатов
клеток S. typhimurium определяли с помощью ска-
нирующей зондовой микроскопии. Форма бакте-
риальных агрегатов, образующихся после добав-
ления родамина С (рис. 3а), не обязательно сфе-
рическая. При этом размеры агрегатов совпадают
с размерами, полученными методом ДРС
(рис. 2б). Следует обратить внимание, что при до-
бавлении в суспензию с бактериями эритрозина
крупные агрегаты клеток не наблюдаются
(рис. 3б).
Фотоинактивация бактерий связанными и не-
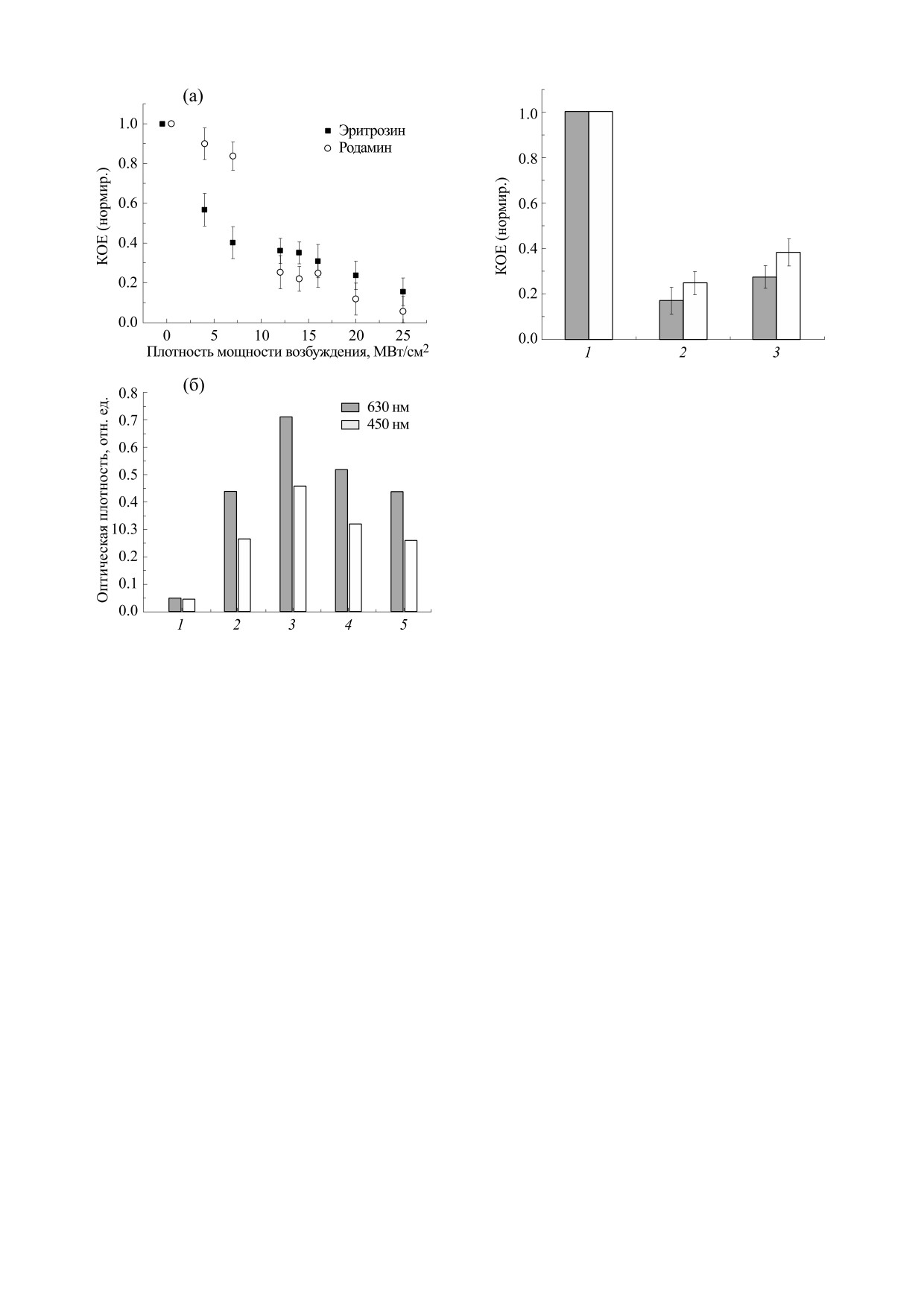
связанными красителями. На рис. 4а показаны
значения КОЕ S. aureus до и после облучения в
присутствии родамина С и эритрозина при облу-
чении растворов импульсным излучением раз-
личной плотности мощности.
На рис. 4б представлены результаты измере-
ния оптической плотности необлученных и облу-
Рис. 2. Распределение частиц в бактериальной сус-
ченных суспензий со стафилококками.
пензии S. typhimurium по размерам, полученное мето-
дом ДРС: (a) - бактерии в чистом физрастворе; (б) -
Из рис. 4 видно, что жизнеспособность бакте-
бактерии в растворе родамина С (0.1 ммоль/л в физ-
риальных клеток, помещенных в раствор краси-
растворе); (в) - то же после облучения.
теля, существенно снижается после облучения.
При этом в присутствии эритрозина это сниже-
ние наблюдается уже при плотности мощности
терий, то есть при связывании красителя со стен-
возбуждения Р ≤ 1 МВт/см2, в то время как в рас-
ками клеток не проявляется кооперативный эф-
творах родамина заметная инактивация наблюда-
фект.
. Это может быть
ется при Р около 8-10 МВт/см2
Связывание родамина С микроорганизмами
связано с вкладом либо фотодинамических про-
оказывает существенное влияние на взаимодей-
цессов, либо ударных волн.
БИОФИЗИКА том 67
№ 3
2022
МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ БАКТЕРИЙ
535
Рис. 3. АСМ-изображения клеток S. typhimurium. Бактерии в растворе родамина С (а) и эритрозина (б) (0,1 ммоль/л в
физрастворе). То же после облучения для раствора родамина С (в) и эритрозина (г).
Для оценки вклада фотодинамических про-
ния. Это указывает на то, что фотодинамическое
цессов в повреждение микроорганизмов сравни-
повреждение бактерий имеет место, но данный
вались КОЕ бактерий, взятых из растворов, со-
механизм не является доминирующим. В основ-
держащих кислород, и из бескислородных рас-
ном инактивация микроорганизмов происходит
творов. Для вытеснения кислорода суспензию с
под действием ударных волн.
красителем и бактериями продували газообраз-
ным азотом. Уменьшение содержания кислорода
Квантовый выход в триплетное состояние у
в растворе контролировали по увеличению вре-
эритрозина в физрастворе ~ 0.99, а константа
мени жизни триплетных состояний эритрозина,
скорости S1 → T1 интеркомбинационной конвер-
измеряемого по кинетике фосфоресценции. По-
сии ~ 109 c-1 [24]. Поэтому даже при плотности
сле продувания раствора азотом в течение 10 мин
мощности возбуждающего света
1.0 МВт/см2
время жизни фосфоресценции эритрозина увели-
практически каждая молекула после возбуждения
чивалось с 5 до 600 мкс. Посев бактерий из обес-
в основной полосе S0 → S1 за время примерно 1 нс
кислороженных растворов и определение КОЕ до
облучения показало, что анаэробные S. typhimuri-
переходит в долгоживущее триплетное T1 состоя-
um и S. aureus хорошо переносят эту процедуру.
ние, и становится источником тепловыделения за
счет циклических безызлучательных переходов
В кислородных растворах, содержащих
T1 ↔ Tm, или T1 → Tm → S1 → T1. У родамина С кван-
эритрозин, выживаемость бактерий после облу-
товый выход S1 → T1 интеркомбинационной кон-
чения оказалась на 10-20% ниже, чем в дезаэри-
рованных растворах при тех же условиях облуче-
версии в триплетное состояние ~ 0.01, а основной
БИОФИЗИКА том 67
№ 3
2022
536
ЛЕТУТА и др.
Рис. 5. Гистограммы КОЕ клеток S. typhimurium, взя-
тых из растворов в присутствии эритрозина (темные
столбики) и родамина С (светлые столбики): 1 - до
облучения; 2 - после облучения лазерными импуль-
сами, образцы КОЕ собраны непосредственно в зоне
возбуждения; 3 - то же, образцы КОЕ собраны на
расстоянии 10 мм от зоны возбуждения. Параметры
возбуждения: длина волны 532 нм, длительность каж-
дого импульса 10 нс, частота следования импульсов
10 Гц, плотность мощности в фокусе линзы
15 МВт/см2, продолжительность облучения 20 с.
сибилизаторами. КОЕ бактерий взятых непо-
средственно из зоны возбуждения (на рис. 5 обо-
значены цифрой 2) как в случае использования
эритрозина, так и родамина С, заметно уменьша-
ются по сравнению с необлученным раствором.
Рис. 4. (a) - КОЕ S. aureus после импульсного
лазерного облучения при различной плотности
Цифрой 3 на рис. 5 обозначены КОЕ клеток, взя-
мощности в растворах родамина С и эритрозина.
тых из тех же растворов на расстоянии 10 мм от
Продолжительность облучения 20 с. Концентрация
зоны возбуждения. В эту область возбуждающий
красителей
0.25 ммоль/л в физрастворе. (б)
-
свет не проникал, и повреждение бактерий воз-
Оптическая плотность растворов эритрозина
(0.25 ммоль/л в физрастворе) на длине волны 450 и
можно исключительно ударными волнами. При
630 нм: 1 - оптическая плотность пустой лунки, 2 -
увеличении дозы облучения или повышении
чистый физраствор, 3 - бактерии до облучения, 4 -
плотности мощности излучения в фокусе линзы
бактерии после облучения (образцы взяты на
до 20 МВт/см2 в образцах вообще не остается
расстоянии 10 мм от зоны облучения), 5 - бактерии
жизнеспособных бактерий.
после облучения (образцы взяты непосредственно из
зоны облучения).
Повреждение бактерий ударными волнами
можно зарегистрировать методом ДРС. На рис. 2в
представлены гистограммы ДРС облученных рас-
канал релаксации S1-состояний - S1 → S0 флуо-
творов S. thyphimurium в присутствии родамина С.
ресценция [25]. Для родамина С процесс погло-
После облучения 73.2% частиц имеют радиус
щения становится двухквантовым только при
0.414 мкм, 13.4% - 2.5 мкм и 11.1% - 0.07 мкм.
плотности мощности возбуждения около
8-
Ударные волны разрушают не только большие
кластеры бактерий, но и повреждают отдельные
10 МВт/см2, при этом высокие Sn-состояния мо-
бактерии. На полученных методом атомно-сило-
hν
hν
вой микроскопии (АСМ) изображениях бактерий
лекул заселяются по схеме
S
0
→
S
1
→
S
n
[16-19].
после облучения (рис. 3в,г) видно, что линейный
Ударные волны могут распространяться в тем-
размер частиц сокращается на порядок вплоть до
0.05-0.1 мкм.
ные зоны, куда возбуждающий свет не проникает.
На рис. 5 показаны гистограммы КОЕ клеток
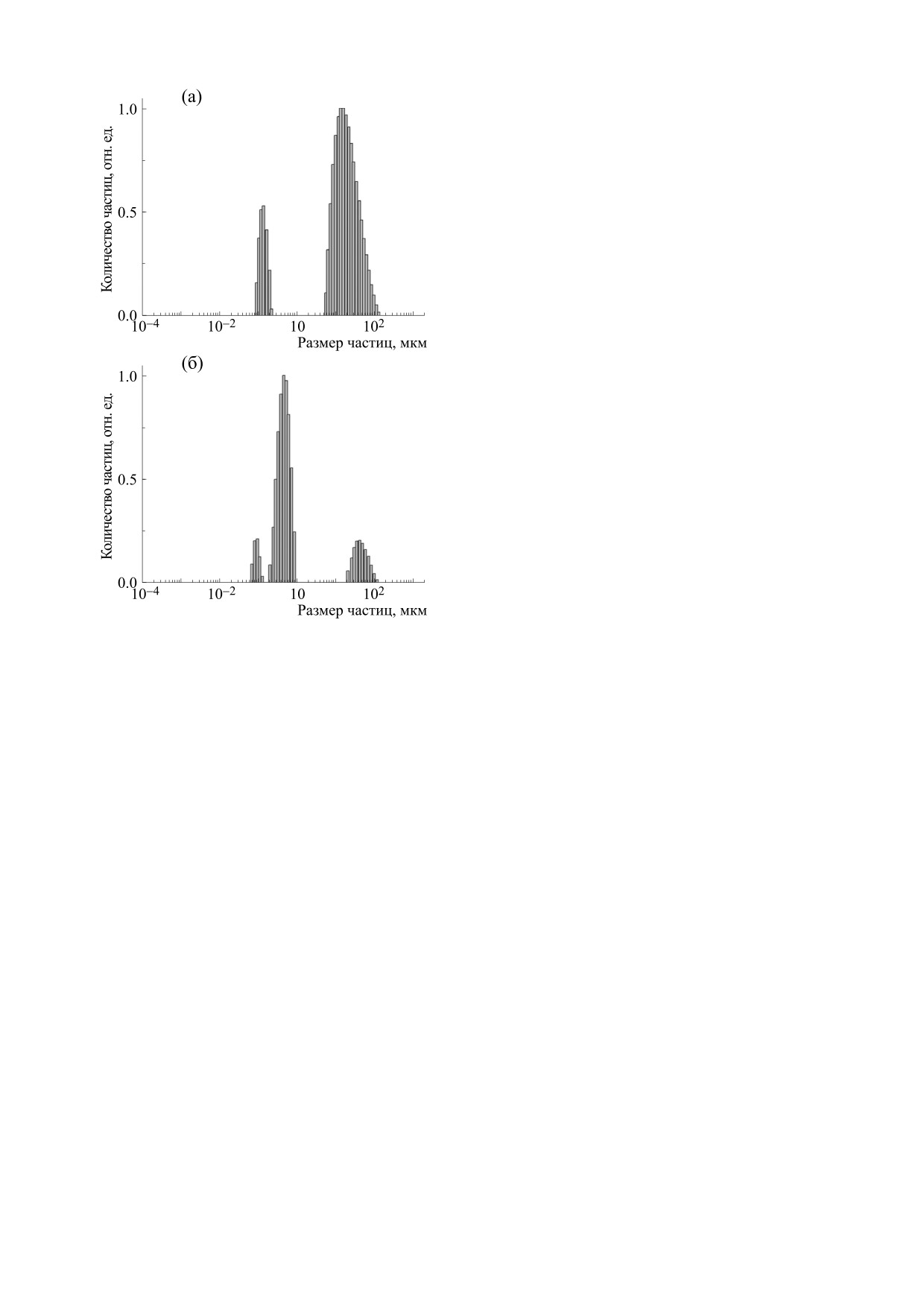
На рис. 6 показаны гистограммы ДРС раство-
S. typhimurium до и после облучения лазерными
рами бактерий S. aureus. До облучения в присут-
импульсами растворов бактерий с разными сен-
ствии эритрозина в растворе присутствуют части-
БИОФИЗИКА том 67
№ 3
2022
МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ БАКТЕРИЙ
537
Чтобы выявить характер повреждений отдель-
ных бактерий ударными волнами анализирова-
лись УФ спектры поглощения растворов до и по-
сле облучения. Обнаружено увеличение оптиче-
ской плотности растворов на длине волны
λ = 260 нм (максимум поглощения ДНК) от 0.01
до 0.20 и на длине волны λ = 280 нм (максимум
поглощения белков) от 0.01 до 0.18, что свиде-
тельствует о присутствие внутриклеточных ком-
понентов в среде. Таким образом, в результате об-
лучения стафилококков в присутствие красите-
лей в растворе не только разрушаются гроздья
бактерий, но и происходит разрушение мембран
отдельных клеток.
В растворе эритрозина непосредственно в зоне
возбуждения бактерии дополнительно (кроме
ударных волн) повреждаются действием АФК, а в
растворе родамина С свой вклад в инактивацию
бактерий дает локальная гипертермия клеток.
Поэтому, выживаемость бактерий, взятых из зо-
ны возбуждения, заметно ниже, чем на расстоя-
нии 10 мм, где клетки повреждаются только удар-
ными волнами (рис. 5).
При повреждении стафилококков прослежи-
ваются те же закономерности, что и для клеток
S. typhimurium. Заметим, что выживаемость ста-
филококков превышает выживаемость сальмо-
нелл. Хорошо известно, что фотодинамическое
повреждение грамотрицательных бактерий ани-
онными сенсибилизаторами малоэффективно
из-за более сложной структуры клеточной стенки
Рис. 6. Гистограмма распределения Staphylococcus au-
у таких микроорганизмов по сравнению с грам-
reus по размерам в физиологическом растворе до (а) и
положительными бактериями [26]. Однако, как
после (б) облучения импульсами света длины волны
видно из рис. 2-5, успешно инактивировать гра-
λ = 532 нм в присутствии эритрозина (0.25 ммоль/л).
мотрицательные бактерии можно с помощью
ударных волн, используя для этого как анионные,
так и катионные сенсибилизаторы. При этом со-
цы в основном двух размеров - 84.1% частиц
вершенно не важно, связан ли сенсибилизатор с
(рис. 6а) имеют размер примерно 4-5 мкм, и око-
бактерией или нет.
ло 15.0% частиц - 0.9-1.0 мкм. Таким образом, до
Заметим, что повреждение бактерий теорети-
облучения в растворе стафилококки в основном
чески возможно в результате безызлучательного
объединены в гроздья, но имеются и одиночные
переноса энергии с высоких электронно-возбуж-
бактерии.
денных уровней сенсибилизаторов на молекулы
После облучения растворов распределение
окружения. После поглощения двух квантов
S. aureus по размерам кардинально изменяется
света с длиной волны 532 нм ФС накапливает
(рис. 6б). Примерно 84% частиц имеют эффек-
энергию около 5 эВ, что превышает энергию лю-
тивный гидродинамический радиус 0.447 мкм,
бой химической связи. Однако в работах [27, 28]
около 12% рассеивающих частиц имеют радиус
было показано, что эффективность переноса
2.2 мкм и около 4% - 0.09 мкм. Гроздья стафило-
энергии с высоких электронных уровней молекул
красителей на молекулы окружения в бактери-
кокков в основном разрушаются, и кроме оди-
альных растворах очень низкая и этот канал
ночных бактерий появляются мелкие рассеиваю-
инактивации бактерий можно не учитывать.
щие объекты, которые, по-видимому, представ-
ляют собой фрагменты разрушенных бактерий.
Воздействие на растворы с красителями све-
Эти предположения подтверждаются АСМ-изоб-
том высокой интенсивности может сопровож-
ражениями. На АСМ-снимках до облучения бак-
даться образованием радикалов. При исследова-
терии представляли собой гроздья в основном из
нии кинетики и спектров наведенного поглоще-
12-15 единиц. После облучения гроздьев S. aureus
ния в диапазоне 300-800 нм не обнаружено
в растворе практически не остается.
новых полос, ответственных за появление ради-
БИОФИЗИКА том 67
№ 3
2022
538
ЛЕТУТА и др.
калов. Это свидетельствует об отсутствии в рас-
ФИНАНСИРОВАНИЕ РАБОТЫ
творах активных фотопродуктов, потенциально
Работа выполнена при финансовой поддержке
способных инактивировать микроорганизмы.
Минобрнауки Российской Федерации (проект
№ FSGU-2020-0003).
ЗАКЛЮЧЕНИЕ
КОНФЛИКТ ИНТЕРЕСОВ
Механизм повреждения бактерий зависит от
Авторы заявляют об отсутствии конфликта
типа ФС и характера его взаимодействия с мик-
интересов.
роорганизмами.
Если ФС имеет большой квантовый выход в
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
триплетное состояние, но не связывается с бакте-
Настоящая работа не содержит описания ис-
риальными клетками (в нашем случае эритро-
следований с использованием людей и животных
зин), то непосредственно в зоне облучения по-
в качестве объектов.
вреждение бактерий возможно в результате фото-
динамического действия. При двухквантовом
СПИСОК ЛИТЕРАТУРЫ
поглощении и заселении ВЭВС сенсибилизатора
возможна инактивация организмов ударными
1.
J. O’Neill (chair). Review on antimicrobial resistance.
волнами, образующимися при быстром локаль-
ном нагреве среды в результате безызлучательной
2.
P. W. Taylor, P. D. Stapleton, and J. Luzio, Drug Dis-
cov. Today. 7,
1086
(2002). DOI: 10.1016/s1359-
релаксации ВЭВС.
6446(02)02498-4
3.
C. A. Arias and B. E. Murray, N. Engl. J. Med. 360,
Если ФС не генерируют химически активные
439 (2009). DOI: 10.1056/NEJMp0804651
формы кислорода, но связываются с клеточными
4.
M. Wilson, J. Photochem. Photobiol. 3, 412 (2004).
стенками (в нашем случае родамин С), поврежде-
DOI: 10.1039/b211266c
ние бактерий происходит либо при прямом пере-
5.
M. R. Hamblin, Curr. Opin. Microbiol. 33, 67 (2016).
греве клеток, либо в результате действия на них
DOI: 10.1016/j.mib.2016.06.008
ударных волн. Оба этих механизма становятся
6.
L. Huang, T. Dai, and M. R. Hamblin, Methods Mol.
эффективными при заселении ВЭВС молекул
Biol. 635, 155 (2010). DOI: 10.1007/978-1-60761-
сенсибилизаторов.
697-9_12
7.
N. Kashef, Y.-Y. Huang, and M. R. Hamblin, Nano-
Разумеется, при одновременном соблюдении
photonics 6 (5), 853 (2017). DOI: 10.1515/nanoph-
двух условий, когда ФС прикрепляется к бакте-
2016-0189
риям и генерирует АФК, все перечисленные ме-
8.
M.-J. Kim, Food Control.
82,
205
(2017).
ханизмы могут иметь место. Однако эффектив-
9.
R. S. Adriele, Antibiotics
8
(4),
1
(2019).
ность фотодинамического механизма будет зави-
сеть от содержания кислорода в облучаемой среде
10.
F. Vatansever, W. de Melo, P. Avci, et al. FEMS Mi-
[29].
crobiol. Rev. 37,
955
(2013). DOI: 10.1111/1574-
6976.12026
Наиболее эффективно бактерии в суспензиях
11.
S. N. Letuta, U. G. Letuta, and S. N. Pashkevich, Bio-
инактивируются ударными волнами, которые ге-
physics
64
(4)
576
(2019). DOI:
10.1134/
нерируются при заселении ВЭВС молекул. Для
S0006350919040092
этого требуется плотность мощности возбужде-
12.
O. Planas, N. Macia, M. Agut, et al., J. Am. Chem.
Soc. 138 (8), 2762 (2016). DOI: 10.1021/jacs.5b12704
ния выше 8-10 МВт/см2. Ударные волны не толь-
13.
S. N. Letuta, S. N. Pashkevich, A. T. Ishemgulov,
ко разрушают естественные образования бакте-
et al., J. Photochem. Photobiol. B 163, 232 (2016).
рий (гроздья стафилококков) и конгломераты,
DOI: 10.1016/j.jphotobiol.2016.08.036
возникающие при «слипании» бактерий при ней-
14.
Y. Ito, D. Veysset, S. E. Kooi, et al., Commun. Physics
трализации заряда внешней стенки, но и с высо-
3, 124 (2020). DOI: 10.1038/s42005-020-0394-3
кой эффективностью разрушают стенки клеток.
15.
A. G. Doukas and T. J. Flotte, Ultrasound in Medi-
Ударные волны в растворах могут инактивиро-
cine & Biology 22 (2), 151 (1996). DOI: 10.1016/0301-
5629(95)02026-8
вать клетки на большом удалении от зоны воз-
16.
P. Sperber and A. Penzkofer, Opt. Quantum. Elec-
буждения. Данный механизм уничтожения бакте-
tron., 18, 381 (1986). DOI: 10.1007/BF02032565
рий в растворах может быть эффективным в слу-
17.
S. Tobita, Y. Kaisu, H. Kobayashi, and I. Tanaka, J.
чае недостаточного проникновения света или
Chem. Phys.
81
(7),
2962
(1984).
DOI:
кислорода в среду. Полученные результаты могут
10.1063/1.448046
быть полезны при разработке новых антибакте-
18.
G. C. Orner and M. R. Topp, Chem. Phys. Lett. 32 (3)
риальных методов.
407 (1975). DOI: 10.1016/0009-2614(75)85204-3
БИОФИЗИКА том 67
№ 3
2022
МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ БАКТЕРИЙ
539
19. H.-B. Lin and M. R. Topp, Chem. Phys. Lett., 48 (2),
25. K. K. Rohatgi-Mukherjee, Fundamentals of Photo-
251 (1977). DOI: 10.1016/0009-2614(77)80309-6
chemistry (Wiley Eastern Ltd., New Delhi, Bangalore,
20. V. L. Ermolaev, Russ. Chem. Rev. 70, 471 (2001).
Bombay, 1978). DOI: 10.1002/bbpc.19790830824
DOI: 10.1070/RC2001v070n06аBEH000657
26. M. R. Hamblin and G. Jori Photodynamic Inactivation
21. C. Nagaoka, M. Fujita, T. Takemura, and H. Baba,
of Microbial Phathogens: Medical and Environmental
Chem. Phys. Lett.
123
(6),
489
(1986). DOI:
Applications (Royal Society of Chemistry, UK, 2011).
10.1016/0009-2614(86)80048-3
DOI: 10.1039/9781849733083
22. S. N. Letuta, S. N. Pashkevich, A. T. Ishemgulov, and
27. R. P. Steer, Can. J. Chem. 95 (10), 1025 (2017). DOI:
A. N. Nikiyan, Russ. J. Phys. Chem. A 95 (4), 848
10.1139/cjc-2017-0369
(2021). DOI: 10.1134/S0036024421040142.
28. D. V. Dorofeev, S. N. Letuta, and D. E. Tsyurko, Russ.
23. B. J. Gottenbos, Antimicrob. Chomother. 48 (1), 7
Chem. Bull. 70, 427 (2021). DOI: 10.1007/s11172-021-
(2001). DOI: 10.1093/jac/48.1.7
3104-8
24. M. J. Snare, F. E. Treloar, K. P. Ghiggino, and
29. F. Cieplik, D. Deng, W. Crielaard, et al., Crit. Rev.
P. J. Thistlethwaite, J. Photochem. 18 (4), 335 (1982).
Microbiol.
44
(5),
571
(2018).
DOI:
DOI: 10.1016/0047-2670(82)87023-8
10.1080/1040841X.2018.1467876
Mechanisms of Damage in Salmonella typhimurium and Staphylococcus aureus
upon Pulse Photoexcitation of Molecular Sensitizers
S.N. Letuta, A.T. Ishemgulov, A.N. Nikiyan, D. A. Razdobreev, L.V. Galaktionova,
D.V. Dorofeev, and D.E. Tsurko
Orenburg State University, prosp. Pobedy 13, Orenburg, 460018 Russia
This paper is dedicated to discussing the mechanisms of inactivation of bacterial planktonic cultures Salmo-
nella typhimurium and Staphylococcus aureus upon excitation of molecular sensitizers with high-energy pulsed
laser source at 10-ns pulse duration. It was shown that depending on the types of sensitizers and the mecha-
nisms of sensitizer-bacterial interactions in suspensions, photodynamic inactivation mediated by reactive ox-
ygen species and local hyperthermia of cells occur. At high power density excitation light (greater than
10 MW/cm2), the dominant mechanism of cell damage is cell destruction by shock waves as the results of rap-
id local heating of the suspension due to the light energy being transformed into heat by the sensitizers.
Keywords: molecular sensitizers, bacterial inactivation, photodynamic action, hyperthermia, shock waves
БИОФИЗИКА том 67
№ 3
2022