БИОФИЗИКА, 2022, том 67, № 4, с. 652-657
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.353.2
ИССЛЕДОВАНИЕ in vitro АГРЕГАЦИОННЫХ СВОЙСТВ
МЫШЕЧНОГО X-БЕЛКА
© 2022 г. Л.Г. Бобылёва*, А.Г. Габдулхаков**, Н.Н. Салмов*,
И.М. Вихлянцев*, А.Г. Бобылёв*, #
*Институт теоретической и экспериментальной биофизики РАН,
Институтская ул., 3, Пущино Московской области, 142290, Россия
#E-mail: bobylev1982@gmail.com
**Институт белка РАН, Институтская ул., 4, Пущино Московской области, 142290, Россия
Поступила в редакцию 31.05.2022 г.
После доработки 31.05.2022 г.
Принята к публикации 06.06.2022 г.
Особенностью агрегации Х-белка (паралога миозин-связывающего С-белка) скелетных мышц яв-
ляется образование спирально-скрученных ленточных фибрилл, которые были ранее показаны ме-
тодом электронной микроскопии. Для изучения полиморфизма агрегатов Х-белка мы провели
электронно-микроскопические исследования его агрегации в различных условиях. Был обнаружен
агрегационный полиморфизм Х-белка, формировавшего различные типы агрегатов - аморфные,
протофибриллы, пучки линейных фибрилл, спирально-скрученные ленточные фибриллы, имею-
щие, предположительно, амилоидную природу. Для проверки этого предположения были проведе-
ны структурные исследования спирально-скрученных ленточных фибрилл Х-белка методом рент-
геновской дифракции, которые выявили наличие сильно размытых рефлексов 4.6 и 10 Å. Получен-
ные результаты свидетельствует о том, что фибриллы Х-белка не имеют четвертичной кросс-β
структуры, свойственной амилоидным фибриллам известных белков и пептидов, таких как, напри-
мер, инсулин, амилоидный β-пептид и титин. Эти результаты противоречат полученным ранее дан-
ным об амилоидной природе агрегатов Х-белка, интерпретация которых была основана на резуль-
татах о связывании с его фибриллами «амилоидных» красителей Конго красного и тиофлавина Т.
Обнаруженная способность Х-белка формировать неамилоидные агрегаты in vitro является, воз-
можно, следствием защитного механизма, выработанного в ходе эволюции и направленного на
предотвращение формирования в клетках токсичных нерастворимых амилоидных агрегатов.
Ключевые слова: мультидоменные мышечные белки, миозин-связывающий белок С, Х-белок, агрегация,
амилоиды.
DOI: 10.31857/S0006302922040032, EDN: ISNWQL
Известно, что пептиды и белки обладают спо-
щают клетки от токсического действия предше-
собностью переходить из нативной формы, обес-
ственников меланина [4].
печивающей заложенную в них функцию, в ами-
К настоящему времени механизмы формиро-
лоидную форму [1]. На сегодняшний день амило-
вания амилоидных агрегатов в организме изуче-
иды определяются как агрегаты «неправильно»
ны недостаточно. Модели амилоидообразования
свернутого пептида или белка, которые имеют
in vitro являются хорошим инструментом для изу-
кросс-β-структуру, что способствует их повы-
чения процесса амилоидной агрегации, посколь-
шенной устойчивости к протеолитической дегра-
ку формирование белками и пептидами амилои-
дации [1, 2]. Такие белковые агрегаты могут обра-
до-подобных структур является универсальным
зовываться в различных тканях человека и живот-
свойством полипептидных цепей [5, 6]. Выявлен
ных, что связывают с развитием целого ряда
целый ряд белков, способных при определенных
заболеваний, включая болезнь Альцгеймера,
условиях in vitro образовывать амилоидо-подоб-
Паркинсона, диабет II типа и другие [1]. Однако
ные агрегаты или фибриллы, которые не обнару-
амилоиды привлекают внимание не только из-за
живаются in vivo [7, 8]. Такими белками являются
связи с болезнями, но также благодаря их функ-
гладкомышечный титин и миозин-связывающий
циональной роли в организме [3]. Например,
белок С (С-белок), формирующие амилоидо-по-
амилоиды, формируемые протеолитическими
добные агрегаты in vitro [9]. Учитывая ряд особен-
фрагментами белка Pmel17 в меланосомах, защи-
ностей агрегации титина и С-белка, таких как вы-
652
ИССЛЕДОВАНИЕ in vitro АГРЕГАЦИОННЫХ СВОЙСТВ
653
сокая скорость образования агрегатов, отсутствие
фосфатный буфер, 1 мМ ЭДТА, 0.1 мM NaN3, pH
изменений во вторичной структуре, данные бел-
7.0, до концентрации белка 12 мг/мл для последу-
ки представляют интерес для изучения механиз-
ющего фракционирования сульфатом аммония.
мов агрегации.
К белковому раствору добавляли равный объ-
Известно, что три паралога миозин-связываю-
ем охлажденного до 4°С 2.8 М сульфата аммония
щего белка С кодируются отдельными генами с
(до 36%-го насыщения) в растворе, содержащем
разными профилями экспрессии в поперечнопо-
0.5 М KCl, 0.05 М K-фосфатный буфер, 1 мМ
лосатых мышцах. Так называемый медленный
ЭДТА, pH 7.0, оставляли на 20-30 мин для фор-
скелетный миозин-связывающий белок С (Х-бе-
мирования актомиозинового осадка и затем цен-
лок) кодируется MYBPC1, а быстрый скелетный
трифугировали в течение 1 ч при 2500 g. Осадок
миозин-связывающий белок С (С-белок) кодиру-
отбрасывали, а к супернатанту добавляли насы-
ется MYBPC2, в то время как MYBPC3 кодирует
щенный при 4°С раствор сульфата аммония до
миозин-связывающий белок С сердечной мыш-
достижения 43%-го насыщения. Через 30 мин об-
цы [10]. Данные паралоги имеют значительную
разовавшийся осадок, содержащий преимуще-
гомологию последовательностей и состоят из им-
ственно миозин и два паралога миозин-связыва-
муноглобулин-подобных и фибронектин III-по-
ющего белка С (С-белок и Х-белок) собирали
добных доменов [10, 11]. Основной отличитель-
центрифугированием в течение 1 ч при 2500 g. За-
ной особенностью гена MYBPC1 по сравнению с
тем осадок растворяли в 0.15 М К-фосфатном бу-
MYBPC2 и MYBPC3 является высокий уровень
фере, рН 7.5, содержащем 10 мМ ЭДТА, 0.1 мM
сплайсинга, которому может подвергаться его
ДТТ и 0.1 мM NaN3 («колоночный» буфер), и
транскрипт [12]. У людей и мышей описано не
диализовали против этого же буфера до полного
менее 14 транскриптов, кодирующих Х-белок,
удаления сульфата аммония.
при этом молекулярные массы его изоформ со-
Миозин, полученный после осветления цен-
ставляют ~126 кДа и 132 кДа [12, 13].
трифугированием в течение 1 ч при 100000 g («до-
В данной работе методом электронной микро-
колоночный» миозин), содержал около 5% Х-бел-
скопии изучены агрегационные свойства Х-белка -
ка и С-белка. Для их разделения от миозина «до-
наиболее высокомолекулярного паралога миозин-
колоночный» миозин подвергали ионообменной
связывающего белка С. Для выявления амилоид-
хроматографии на колонке с носителем DEAE-
ной природы агрегатов Х-белка проведены струк-
Sephadex А-50, уравновешенным колоночным бу-
турные исследования его спирально-скрученных
фером. Х-белок и С-белок элюировали в свобод-
ленточных фибрилл методом рентгеновской ди-
ном объеме колонки и собирали для последую-
фракции с целью выявления кросс-β-структуры.
щей очистки. В дальнейшем фракции этих двух
белков концентрировали сульфатом аммония до
степени насыщения 2.08 М и осаждали центри-
МАТЕРИАЛЫ И МЕТОДЫ
фугированием в течение 1 ч при 3000 g. Осадок
растворяли в буфере, содержащем 0.3 M KCl,
Выделение и очистка Х-белка. Х-белок был
4.8 мM K2HPO4, 5.2 мM KH2PO4, 0.1 мM ДТТ,
очищен из скелетных мышц кролика (мышцы ту-
ловища и задних конечностей) согласно методу,
0.1 мM NaN3, pH 7.0, и диализовали против этого
описанному в работе [14]. Мышцы гомогенизи-
же буфера до полного удаления сульфата аммо-
ровали и миозин экстрагировали трехкратным
ния. Разделение Х-белка и С-белка проводили на
(по отношению к весу мышц) объемом раствора
колонке с гидроксиапатитом, уравновешенным в
Губа-Штрауба, содержащего 0.3 М KCl, 0.15 М
этом же буфере. Для снятия белков с колонки ис-
K-фосфатный буфер, 1 мM фенилметилсульфо-
пользовали фосфатный градиент.
нилфторида, 20 мкг/мл ингибитора трипсина,
Концентрацию Х-белка определяли спектро-
pH 6.5. Экстракцию проводили при 4°C в течение
фотометрически на спектрофотометре Cary 100
10-15 мин при непрерывном перемешивании, за-
(Varian, США), используя значение коэффици-
тем центрифугировали в течение 15 мин при
ента экстинкции (Е2801 мг/мл), равное 1.09 [15].
5000 g. Супернатант переосаждали 14-кратным
объемом охлажденной бидистиллированной во-
ДСН-гель-электрофорез. Чистоту Х-белка про-
ды, содержащей 0.1 мM ДТТ и 0.1 мM NaN3. Че-
веряли с помощью ДСН-электрофореза в полиа-
рез 40-60 мин осадок миозина собирали центри-
криламидном геле по методу [16] с модификаци-
фугированием в течение 30 мин при 2500 g. К
ями. Согласно нашей методике, разделяющий
осадку добавляли раствор, содержащий 2 М KCl,
гель содержал 7% полиакриламида вместо 15%
0.2 М K-фосфатный буфер, 4 мМ ЭДТА, pH 7.0,
(соотношение акриламида к бис-акриламиду
до достижения конечной концентрации в 0.5 М
199:1), а также 0.75 М трис-HCl буфер, pH 8.8,
KCl, 0.05 М K-фосфатного буфера, 1 мМ ЭДТА,
0.1% ДСН, 10% глицерина, 0.05% тетраметилэти-
pH 7.0. После растворения осадка его разбавляли
лендиамина и 0.05% персульфата аммония. Кро-
раствором, содержащим 0.5 М KCl, 0.05 М K-
ме этого, вместо концентрирующего геля с содер-
БИОФИЗИКА том 67
№ 4
2022
654
БОБЫЛЁВА и др.
зола, pH 7.0; 4) 10 мМ KCl, 10 мM имидазола,
pH 7.0; 5) 50 мМ KCl, 10 мM имидазола, pH 7.0;
6) 500 мМ KCl, 10 мM имидазола, pH 7.0. Каплю
суспензии белка в концентрации 0.1 мг/мл нано-
сили на покрытую углеродом пленку коллодия на
медной сетке и окрашивали 2%-м водным раство-
ром уранилацетата. Образцы исследовали на
электронном микроскопе JEM-100B (Jeol, Япо-
ния).
Рентгеновская дифракция. Для исследования
методом рентгеновской дифракции агрегаты
Х-белка, сформированные в растворе, содержа-
щем 30 мМ KCl, 10 мM имидазола, pH 7.0, 24 ч
при 4°С, в концентрации 0.5 мг/мл и объеме 5 мл,
были лиофилизированы с помощью лиофилиза-
тора FreeZone 1L (Labconco, США). Затем лио-
фильно высушенные образцы были растворены в
деионизированной воде до конечной концентра-
ции ~100 мг/мл и помещены между двумя стек-
лянными палочками, покрытыми парафином.
Дифракционные изображения были получены
с использованием генератора Microstar X-ray с
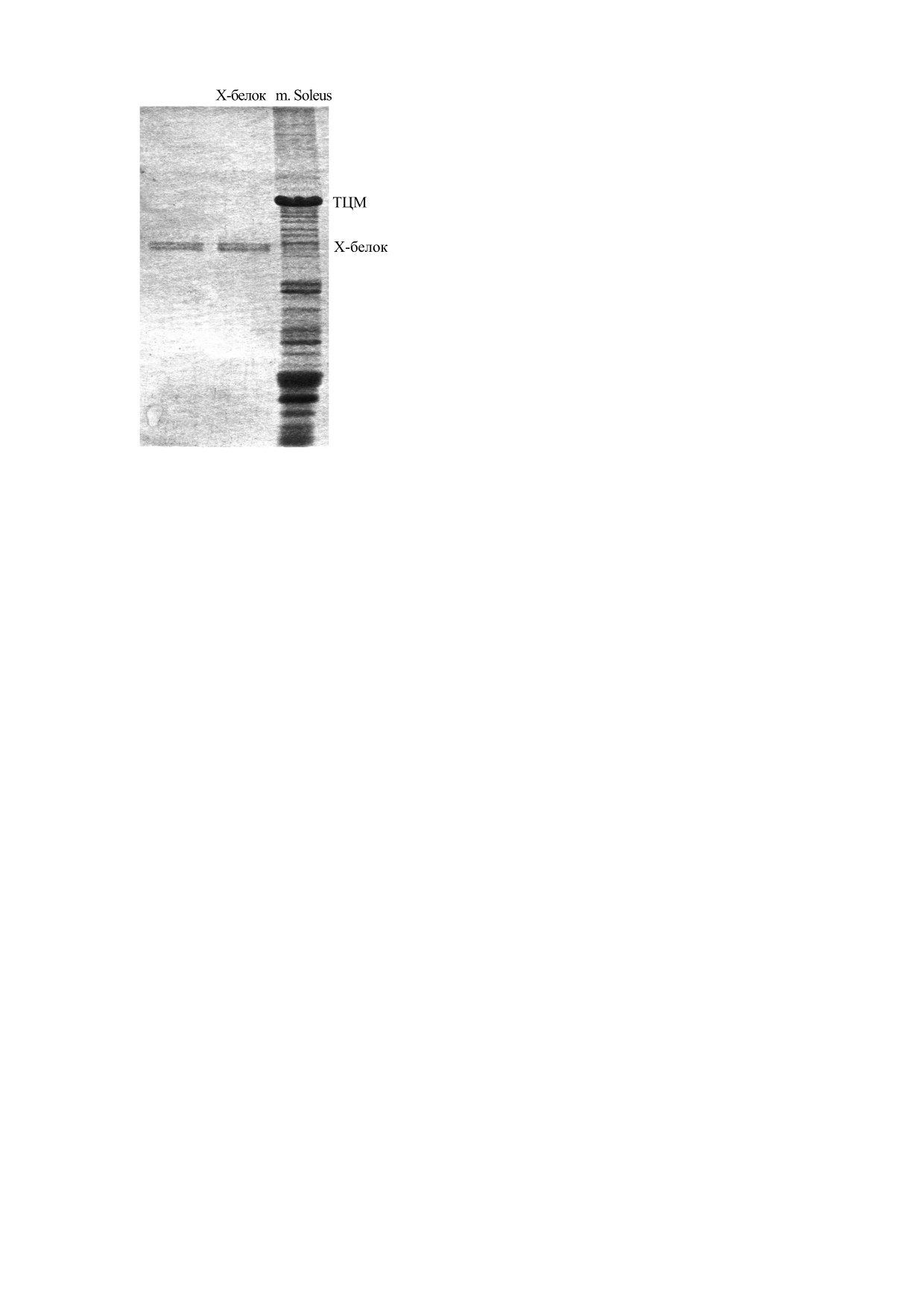
Рис. 1. ДСН-гель-электрофорез препарата очищенного
оптикой HELIOX, оснащенном детектором Plat-
Х-белка (две левые дорожки). Правая дорожка - m. so-
inun135 CCD (X8 Proteum system, Bruker, Герма-
leus кролика (контроль). Молекулярный вес Х-белка
ния). Использовали Cu Kα-излучение с λ = 1.54 Å.
скелетных мышц кролика на основании его
электрофоретической подвижности оценивается в 145-
Образцы располагали под прямым углом к рент-
152 кДа [18, 19]. ТЦМ - тяжелые цепи миозина.
геновскому лучу с применением четырехосного
каппа-гониометра.
жанием полиакриламида 5% (согласно работе
[16]), мы применяли концентрирующий гель, ис-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
пользованный в работе [17] и содержащий 2.6-
На рис. 1 представлены результаты ДСН-
2.8% полиакриламида (соотношение акриламида
ПААГ-электрофореза препаратов очищенного
к бис-акриламиду 36.5:1). Эти модификации спо-
Х-белка, а также экстракта белков m. soleus в ка-
собствовали лучшему фокусированию белковых
честве контроля. На геле видны две белковые по-
полос в геле. Концентрирующий гель также со-
лосы, которые, по всей вероятности, являются
держал 0.125 М трис-HCl буфер, pH 6.8, 0.1%
изоформами Х-белка или изоформой (верхняя
ДСН, 0.05% тетраметилэтилендиамина и 0.05%
полоса) и ее протеолитическим фрагментом
персульфата аммония.
(нижняя полоса).
Электродный буфер при проведении электро-
Известно, что Х-белок способен формировать
фореза содержал 0.192 М глицина, 0.025 М триса
высокоупорядоченные спирально-скрученные
и 0.1% ДСН, рН 8.3. Электрофорез проводили
ленточные фибриллы с осевой периодичностью ~
при токе 3-5 мА в течение первых 30-60 мин, за-
60-70 нм, шириной ~40 нм и длиной более 1 мкм
тем поднимали силу тока до 12-15 мА. По окон-
[20]. Ранее также было показано, что Х-белок
чании электрофореза гели фиксировали
20-
формирует разные типы агрегатов. В частности, в
30 мин в растворе, содержащем 10% этанола и
проведенных нами исследованиях было показа-
10% уксусной кислоты, и окрашивали в течение
но, что Х-белок формирует аморфные агрегаты,
30-40 мин в растворе, содержащем 0.1% кумасси
протофибриллы, линейные фибриллы и пучки
G-250 и R-250 (смешанных в пропорции 1:1), 45%
линейных фибрилл в следующих растворах:
этанола и 10% уксусной кислоты. Отмывку окра-
1) 50 мM NaCl, 10 мM Hepes, pH 7.0; 2) 25 мМ
шенных гелей проводили в 7%-й уксусной кисло-
NaCl, 10 мМ Hepes, pH 7.0; 3) 50 мM MgCl2, 10 мM
те при постоянном перемешивании на качалке.
имидазола, pH 7.0; 4) 30 мМ MgCl2, 10 мМ имида-
Электронная микроскопия и условия формиро-
зола, pH 7.0; 5) 0.15 М глицин-KOH, рН 7.5 [21].
вания амилоидных агрегатов. Агрегаты Х-белка
В данном исследовании мы расширили список
формировали диализом в течение 24 ч при 4°С
условий для формирования Х-белком разных ти-
против следующих растворов: 1) 30 мМ KCl,
пов агрегатов. Результаты электронно-микроско-
10 мM имидазола, pH 7.0; 2) 30 мМ CaCl2, 10 мM
пического исследования представлены на рис. 2.
имидазола, pH 7.0; 3) 30 мМ MgCl2, 10 мM имида-
Обнаружены пучки фибрилл, полученные в рас-
БИОФИЗИКА том 67
№ 4
2022
ИССЛЕДОВАНИЕ in vitro АГРЕГАЦИОННЫХ СВОЙСТВ
655
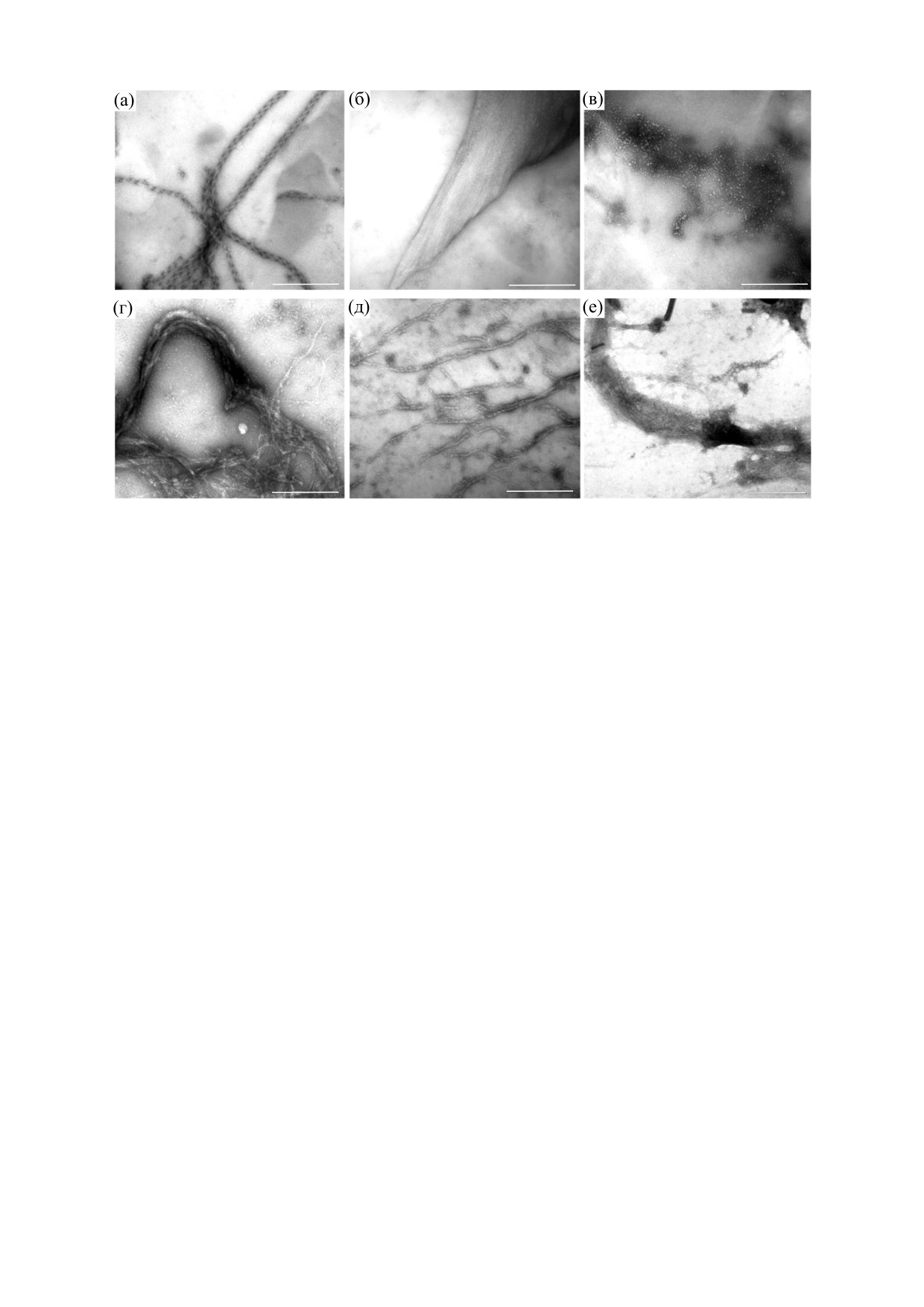
Рис. 2. Электронная микроскопия агрегатов Х-белка: (а) - спирально-скрученные ленточные фибриллы Х-белка,
полученные в растворе, содержащем 30 мМ KCl, 10 мM имидазола, pH 7.0; (б) - пучки фибрилл Х-белка, полученные в
растворе, содержащем 30 мМ CaCl2, 10 мM имидазола, pH 7.0; (в) - аморфные агрегаты Х-белка, полученные в растворе,
содержащем 30 мМ MgCl2, 10 мM имидазола, pH 7.0; (г) - пучки фибрилл Х-белка, полученные в растворе, содержащем
10 мМ KCl, 10 мM имидазола, pH 7.0; (д) - протофибриллы и отдельно лежащие нити фибрилл Х-белка, полученные в
растворе, содержащем 50 мМ KCl, 10 мM имидазола, pH 7.0; (е) - пучки фибрилл Х-белка, полученные в растворе,
содержащем 500 мМ KCl, 10 мM имидазола, pH 7.0. Время инкубации всех образцов - 24 ч при 4°С. Негативное
окрашивание 2%-м водным раствором уранилацетата, Шкала 500 нм.
творах, содержащих 30 мМ CaCl2, 10 мМ KCl и
ются амилоидными. Однако сейчас известно, что
500 мМ KCl (рис. 2б,г,е); протофибриллы и от-
для точного определения принадлежности каких-
дельно лежащие нити фибрилл, полученные в
либо фибрилл к амилоидным необходимо дока-
растворе, содержащем 50 мМ KCl (рис. 2д), а так-
зать наличие их четвертичной кросс-β-структу-
же аморфные агрегаты в растворе, содержащем
ры. Для этих целей используют метод рентгенов-
30 мМ MgCl2 (рис. 2в). На рис. 2 также представ-
ской дифракции. С помощью данного метода
четвертичная кросс-β-структура выявляется на-
лены высокоупорядоченные спирально-скручен-
личием двух рефлексов - 10.0 и 4.7 Å [22-25].
ные ленточные фибриллы, полученные в раство-
Предполагается, что рефлекс 4.6-4.8 Å возникает
ре, содержащем 30 мМ KCl (рис. 2а), впервые ви-
из-за периодичности связанных водородными
зуализированные ранее
[20]. Полиморфизм
связями β-цепей, ориентированных перпендику-
агрегатов Х-белка, его способность агрегировать
лярно оси волокна, а дифракция в области - 10-
в диапазоне значений ионной силы от 0.03 до
11 Å отображает расстояние между β-листами
0.50, а также в присутствии различных ионов
[26, 27].
(Na+, Mg2+, Ca2+) свидетельствуют о высокой
В нашем исследовании для изучения внутрен-
склонности данного белка к агрегации.
ней структуры спирально-скрученных ленточных
Проведенные ранее исследования также пока-
фибрилл Х-белка методом рентгеновской ди-
зали, что со спирально-скрученными ленточны-
фракции образцы были подготовлены по методи-
ми фибриллами Х-белка, сформированными в
ке, описанной в работе [9]. При рентгенодифрак-
растворе, содержащем 30 мМ KCl, связывались
ционном исследовании агрегатов Х-белка были
красители Конго красный и тиофлавин Т [21], ко-
выявлены круговые диффузные рентгеновские
торые применяются для выявления амилоидной
рефлексы 10.0 и 4.6 Å (рис. 3б). Полученные ре-
структуры белковых агрегатов. На основании об-
флексы имеют высокую степень размытости и, по
наруженного связывания было сделано заключе-
всей вероятности, свидетельствует только о
ние, что вышеуказанные агрегаты Х-белка явля-
β-структуре, имеющейся в иммуноглобулин- и
БИОФИЗИКА том 67
№ 4
2022
656
БОБЫЛЁВА и др.
Рис. 3. Дифракция рентгеновских лучей в препаратах частично выравненного Х-белка: (а) - препарат образца фибрилл
Х-белка, локализованный на поверхности парафиновой головки; (б) - полученные рефлексы для фибрилл Х-белка. Были
обнаружены два диффузных рефлекса (4.6 и 10.0 Å). Из-за экстремально высокого размытия рефлексов можно сделать
вывод об отсутствии четвертичной кросс-β-структуры, свойственной амилоидным белкам.
фибронектин III-подобных доменах Х-белка, а не
се агрегации для дальнейшего сворачивания в
о четвертичной кросс-β-структуре его фибрилл.
амилоидную структуру.
Таким образом, мы утверждаем, что спирально-
скрученные ленточные фибриллы Х-белка не
ФИНАНСИРОВАНИЕ РАБОТЫ
имеют четвертичной кросс-β-структуры и, следо-
вательно, не являются амилоидными.
Работа выполнена при финансовой поддержке
Российского научного фонда, грант № 22-24-
00805 (задача, касающаяся выделения миозин-
ЗАКЛЮЧЕНИЕ
связывающих белков С, подтверждение чистоты
Результаты наших исследований показывают,
выделенных препаратов методом электрофоре-
что Х-белок формирует in vitro разные по морфо-
за).
логии агрегаты. Наиболее структурированные
спирально-скрученные ленточные фибриллы
КОНФЛИКТ ИНТЕРЕСОВ
Х-белка не имеют упорядоченной кросс β-струк-
туры и, следовательно, не являются амилоид-
Авторы заявляют об отсутствии конфликта
ными.
интересов.
Таким образом, несмотря на высокую склон-
ность Х-белка к агрегации in vitro, его агрегаты не
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
являются амилоидными. Причина, которая ле-
жит в основе неамилоидной агрегации Х-белка в
Все применимые международные, националь-
отличие от амилоидной агрегации, например,
ные и институциональные принципы ухода и ис-
«родственного» миозин-связывающего белка С,
пользования животных при выполнении работы
по всей вероятности, заключается в структурных
были соблюдены.
особенностях доменов Х-белка, которые в про-
цессе эволюции утратили способность формиро-
вать в клетках токсичные нерастворимые амило-
СПИСОК ЛИТЕРАТУРЫ
идные агрегаты. Среди таких структурных осо-
1. F. Chiti and C. M. Dobson, Annu. Rev. Biochem., 86,
бенностей может быть низкая идентичность в
27 (2017).
аминокислотной последовательности [9], нали-
2. P. J. Crouch, D. J. Tew, T. Du, et al., J. Neurochem.,
чие чередующихся структурированных и не-
108, 1198 (2009).
структурированных областей в молекуле белка
3. А. А. Нижников, К. С. Антонец и С. Г. Инге-
[9], а также наличие S-S-связей, обеспечивающих
Вечтомов, Биохимия, 80 (9), 1356 (2015).
общую стабильность молекул, не позволяющих
4. D. M. Fowler, A. V. Koulov, C. Alory-Jost, et al., PLoS
произвести полный разворот молекулы в процес-
Biol. 4 (1), e6 (2006).
БИОФИЗИКА том 67
№ 4
2022
ИССЛЕДОВАНИЕ in vitro АГРЕГАЦИОННЫХ СВОЙСТВ
657
5. M. Stefani and C. M. Dobson, J. Mol. Med. (Berlin),
16. J. D. Fritz, D. R. Swartz, and M. L. Greaser, Anal. Bio-
81, 678 (2003).
chem., 180, 205 (1989).
6. C. M. Dobson, Semin. Cell Dev. Biol., 5, 3 (2004).
17. H. Laemmli, Nature, 227 (5259), 680 (1970).
7. S. M. Dorta-Estremera, J. Li, and W. Cao, J. Vis. Exp.,
18. K. Yamamoto and K. Moos, J. Biol. Chem., 258 (13),
82, 50869 (2013).
8395 (1983).
8. L. Goldschmidt, P. K. Teng, R. Riek, et al., Proc. Natl.
19. R. Starr and G. Offer, J. Mol. Biol., 170, 675 (1983).
Acad. Sci. USA, 107 (8), 3487 (2010).
20. P. Bennett, R. Starr, A. Elliott, et al., J. Mol. Biol., 184,
9. L. G. Bobyleva, S. A. Shumeyko, E. I. Yakupova, et al.,
297 (1985).
Int. J. Mol. Sci., 22, 731 (2021).
21. Л. Г. Марсагишвили, Дис. … канд. биол. наук
10. J. W. McNamara and S. Sadayappan, Arch. Biochem.
(Пущино, 2007).
Biophys., 660, 121 (2018).
22. D. M. Fowler, A. V. Koulov, C. Alory-Jost, et al., PLoS
11. A. Vydyanath, Ch. A. Gurnett, S. Marston, et al., J.
Biol., 4, e6 (2006).
Muscle Res. Cell Motil., 33, 61 (2012).
23. H. Ramshini, C. Parrini, A. Relini, et al., PLoS One, 6,
12. M. A. Ackermann and A. Kontrogianni-Konstan-
e16075 (2011).
topoulos, Front. Physiol., 4, 391 (2013).
24. E. D. Eanes and G. G. Glenner, J. Histochem. Cyto-
13. M. A. Ackermann and A. Kontrogianni-Konstan-
chem., 16, 673 (1968).
topoulos, J. Biomed. Biotechnol.,
2010,
652065
(2010).
25. J. C. Stroud, C. Liu, P. K. Teng, et al., Proc. Natl.
14. G. Offer, C. Moos, and R. Starr, J. Mol. Biol., 74, 653
Acad. Sci. USA, 109, 7717 (2012).
(1973).
26. D. Eisenberg and M. Jucker, Cell, 148 (6), 1188 (2012).
15. R. Starr and G. Offer, Methods Enzymol., 85 (Part B),
27. H. Wille, W. Bian, M. McDonald, et al., Proc. Natl.
130 (1982).
Acad. Sci. USA, 106 (40), 16990 (2009).
In vitro Study of Aggregation Properties of Muscle X-Protein
L.G. Bobyleva*, A.G. Gabdulkhakov**, N.N. Salmov*, I.M. Vikhlyantsev*, and A.G. Bobylev*
*Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Institute of Protein Research, Russian Academy of Sciences, Institutskaya ul. 4, Pushchino, Moscow Region, 142290 Russia
A feature of skeletal muscle X-protein aggregation is the formation of helical fibrils from twisted ribbons,
which were previously observed by electron microscopy. To get a deeper understanding of polymorphism of
X-protein aggregates, electron microscopy was used to study X-protein aggregation under various conditions.
It was found that X-protein formed various types of aggregates: amorphous, protofibrils, bundles of linear fi-
brils, helical fibrils formed from twisted ribbons, presumably of amyloid nature. In order to confirm this as-
sumption, structural studies of X-protein helical fibrils assembled from twisted ribbons were carried out using
information from X-ray diffraction. The analysis revealed the presence of strongly blurred reflections at 4.6
and 10 Å. The results obtained indicate that the fibrils of X-protein do not possess a quaternary cross-β-struc-
ture that is characteristic for amyloid fibrils of known proteins and peptides, such as, for example, insulin,
amyloid β-peptide and titin. These results contradict the previously obtained data on amyloid-like X-protein
aggregation, the findings suggested that fibrils of X protein can bind "amyloid" dyes Congo red and thioflavin
T. The ability of X-protein to form non-amyloid aggregates in vitro may be due to a defense mechanism de-
veloped through evolution that prevents the formation of toxic insoluble amyloid aggregates in cells.
Keywords: multidomain muscle proteins, myosin-binding protein C, X-protein, aggregation, amyloids
БИОФИЗИКА том 67
№ 4
2022