БИОФИЗИКА, 2022, том 67, № 4, с. 671-679
БИОФИЗИКА КЛЕТКИ
УДК 544.43
НАТРИЙ-μ2-ДИТИОСУЛЬФАТО-ТЕТРАНИТРОЗИЛДИФЕРРАТА
ТЕТРАГИДРАТ ПОВЫШАЕТ ЭФФЕКТИВНОСТЬ РАБОТЫ
ДЫХАТЕЛЬНОЙ ЦЕПИ МИТОХОНДРИЙ ПРОРОСТКОВ ГОРОХА
© 2022 г. И.В. Жигачева*, #, Н.И. Крикунова*, И.П. Генерозова**, ##, П.А. Буцанец**,
Н.Ю. Герасимов*, О.В. Неврова*, С.В. Васильев**, А.Н. Голощапов*
*Институт биохимической физики им. Н.М. Эмануэля РАН, ул. Косыгина, 4, Москва, 119334, Россия
#E-mail: zhigacheva@mail.ru
**Институт физиологии растений им. К.А. Тимирязева РАН, Ботаническая ул., 35, Москва, 127276, Россия
##E-mail: igenerozova@mail.ru
Поступила в редакцию 21.04.2022 г.
После доработки 11.05.2022 г.
Принята к публикации 13.05.2022 г.
Исследуя антистрессовые свойства донора оксида азота железо-тиосульфатного комплекса натрий-
μ2-дитиосульфато-тетранитозилдиферрата тетрагидрата Na2([Fe2(S2O3)2(NO)4]2·4H2O), изучали
влияние различных его концентраций на функциональное состояние изолированных митохондрий
проростков гороха. Инкубация митохондрий с 10-4 М препарата приводила к резкому уменьшению
микровязкости свободного липидного бислоя, обусловленному увеличением содержания ненасы-
щенных жирных кислот в липидной фракции мембран митохондрий. При этом препарат разобщал
процессы окисления и фосфорилирования. Обработка митохондрий 10-8 М железо-тиосульфатно-
го комплекса сопровождалась повышенным содержанием ненасыщенных С20 жирных кислот, ко-
торое возрастало на 25-45%, что, вероятно, обусловливало 15%-е снижение микровязкости свобод-
ного липидного бислоя. В то же время микровязкость в области аннулярных липидов мембран воз-
растала на 20%, что могло свидетельствовать об изменении активности ферментов дыхательной
цепи митохондрий. Действительно, препарат влиял на скорости окисления НАД-зависимых суб-
стратов и сукцината и повышал эффективность окислительного фосфорилирования. Эта концен-
трация препарата была выбрана для исследования способности железо-тиосульфатного комплекса
повышать устойчивость проростков гороха к дефициту воды. Железо-тиосульфатный комплекс
предотвращал изменения жирнокислотного состава мембран митохондрий в условиях дефицита
воды и обусловленные стрессом изменения биоэнергетических характеристик митохондрий. Полу-
ченные данные могут свидетельствовать, что протекторные свойства препарата реализуются на
мембранном уровне за счет сохранения/увеличения пула ненасыщенных жирных кислот, способ-
ствующих поддержанию текучести мембран.
Ключевые слова: митохондрии, оксид азота, микровязкость, свободный липидный бислой, аннулярные
липиды, жирные кислоты.
DOI: 10.31857/S0006302922040056, EDN: ISYKJS
нарушение метаболизма клетки [2]. При этом ми-
Митохондрии занимают ключевые позиции в
тохондрии являются источником и мишенью
энергетических, окислительно-восстановитель-
этих интермедиатов.
ных и обменных процессах в клетке. Тем не ме-
нее, в условиях стресса эти органеллы являются
Взаимодействие АФК с полиненасыщенными
одним из основных источников активных форм
жирными кислотами (ЖК), такими как арахидо-
кислорода (АФК) [1], которые в зависимости от
новая, линолевая и линоленовая, входящими в
силы стрессового воздействия могут служить ин-
состав липидов мембран митохондрий, возмож-
но, имеет следствием активацию перекисного
дукторами процессов адаптации, либо вызывать
окисления липидов. При этом, вероятно, проис-
Сокращения: АФК - активные формы кислорода, ЖК -
ходит нарушение осмотического баланса между
жирные кислоты, ТНКЖ-тио - железо-тиосульфатный матриксом и межмембранным пространством
комплекс (μ2-дитиосульфато-тетранитозилдиферрат тет-
рагидрат), БСА
- бычий сывороточный альбумин,
митохондрий. В результате происходит набуха-
МЭЖК - метиловые эфиры жирных кислот.
ние митохондрий. Следствием «перекисного» на-
671
672
ЖИГАЧЕВА и др.
бухания митохондрий (или образования больших
рованию реакций свободнорадикального окисле-
пор во внешней мембране), вероятно, является
ния, катализируемых редокс-активными ионами
высвобождение апоптогенных белков из ме-
железа [10]. Следовательно, NO может действо-
жмембранного пространства в цитоплазму и ак-
вать как антиоксидант, хотя возможен и синер-
тивация митохондриального пути апоптоза.
гизм в действии NO и H2O2 [11]. Оксид азота так-
Можно предположить, что препараты, снижаю-
же может запускать экспрессию антиоксидант-
щие генерацию АФК митохондриями, будут по-
ных генов или активировать антиоксидантные
вышать устойчивость организма к действию
ферменты, например, путем посттрансляцион-
стрессовых факторов. На эту роль в первую оче-
ных модификаций [12]. Он стимулирует рост при-
редь претендуют антиоксиданты, ингибирующие
даточных корней и регулирует синтез абсцизовой
свободнорадикальное окисление. Однако сни-
кислоты [7]. Однако, в ряде случаев быстрое на-
зить генерацию активных форм кислорода мито-
копление NO в ответ на стрессовые воздействия
хондриями можно за счет других механизмов.
вызывает ингибирование антиоксидантных фер-
Так, снижение генерации АФК митохондриями
ментов и последующее повышение уровня пере-
на 80% возможно за счет «мягкого разобщения»,
киси водорода [12]. Кроме того, реакция между
т.е. увеличения протонной проводимости, не на-
генерируемыми митохондриями O2• и NO влечет
рушающей синтез АТФ, но приводящий к сниже-
за собой образование пероксинитрита (ONOO-),
нию редокс-потенциала внутренней мембраны
окисляющего липидный компонент мембран,
митохондрий на 13-15% [3]. Сокращение генера-
ДНК и тиоловые группы белков. Это приводит к
ции АФК может быть достигнуто также за счет
нарушению ферментативной активности
[13].
повышения концентрации эндогенных жирных
Адаптогенное или стрессовое действие NO, веро-
кислот, либо за счет работы разобщающих белков
ятно, определяется его концентрацией, возрас-
митохондрий (например, белки холодового и теп-
том растения, и видом стресса (дефицит воды, со-
лового шока) [4]. Кроме того, вклад в защиту
левой, температурный стресс или действие тяже-
клетки от окислительного стресса вносит также
лых металлов и т.д.).
митохондриальный АТФ-зависимый калиевый
(mitoКАТФ) канал. Функционирование Pmito-
Отметим, что для молекулы NO кластеры же-
лезо-серных белков [Fe-S] являются наиболее
KATP тесно связано с К+/Н+-обменом. Это поз-
предпочтительными мишенями в клетке. При
воляет осуществлять «калиевый цикл», который
этом митохондрии растений могут быть как ис-
обеспечивает возвращение Н+ в матрикс мито-
точниками, так и мишенью для оксида азота [14].
хондрий, т.е. снижение мембранного потенциала
Почти все комплексы электрон-транспортной
[5]. Уменьшение генерации АФК митохондриями
цепи митохондрий являются мишенью для NO
также может быть достигнуто в результате актива-
или участвуют в его метаболизме. Показано, что
ции альтернативных путей транспорта элек-
комплекс IV является основным сайтом генера-
тронов в дыхательной цепи митохондрий, прежде
ции NO и способствует поддержанию уровня ATP
всего при активации альтернативной оксидазы
в условиях дефицита кислорода. В условиях нор-
[6].
моксии восстановление нитрита до NO в клетках
растений нарушается при действии ингибиторов
Таким образом существуют самые разнообраз-
альтернативной оксидазы или ингибиторов ком-
ные механизмы защиты клетки и организма от
плексов III и IV электрон-транспортной цепи ми-
окислительного стресса. Эту функцию могут вы-
тохондрий, что указывает на участие в синтезе
полнять биологически активные вещества, влия-
NO альтернативной оксидазы, а также III и IV
ющие на функциональное состояние митохон-
комплексов дыхательной цепи митохондрий
дрий. Показано, что ряд таких веществ накапли-
[15, 16].
вался в органах и тканях растений при стрессовых
воздействиях. К ним, например, относится оксид
Поскольку реализация антистрессовых про-
азота [7]. Более того, показано, что обработка
грамм требует больших энергетических трат [17],
растений экзогенными донорами NO повышает
а митохондрии играют одну из ключевых ролей в
их устойчивость к действию стрессовых факто-
ответе организма на действие стрессовых факто-
ров, в том числе и к дефициту воды [8, 9]. Способ-
ров, в том числе и на дефицит воды, особый инте-
ность оксида азота осуществлять протекторное
рес представляет изучение влияния доноров ок-
действие в условиях абиотического стресса может
сида азота на биоэнергетические характеристики
быть обусловлена его способностью связывать
митохондрий, определяющие устойчивость рас-
свободные ионы железа в составе нитрозильных
тений к водному дефициту. В своей работе в каче-
комплексов, что, возможно, приводит к ингиби-
стве донора оксида азота мы использовали
БИОФИЗИКА том 67
№ 4
2022
НАТРИЙ-μ2-ДИТИОСУЛЬФАТО-ТЕТРАНИТРОЗИЛДИФЕРРАТА
673
натрий μ2-дитиосульфат-тетранитозилдиферрат
+ ТНКЖ-тио), переносили на сухую фильтро-
тетрагидрат (кристаллический ТНКЖ-тио, или
вальную бумагу. Через сутки проростки перено-
железо-тиосульфатный комплекс). Преимуще-
сили на влажную фильтровальную бумагу, где
ство этого донора NO перед другими донорами
они находились в течение последующих трех су-
оксида азота связано с тем, что при растворении в
ток. Вторая половина проростков контрольной
воде он выделяет монооксид азота при физиоло-
группы оставалась на влажной фильтровальной
гических значениях рН без какой-либо (термиче-
бумаге в течение семи суток. На седьмые сутки
ской, окислительно-восстановительной или фо-
выделяли митохондрии из эпикотилей пророст-
то) активации, а при его разложении не образуют-
ков гороха.
ся токсические вещества, что обеспечивает
Выделение митохондрий из семисуточных эпи-
экологическую безопасность [18]. Ранее мы пока-
котилей проростков гороха. Выделение митохон-
зали [19], что обработка семян гороха ТНКЖ-тио
дрий проводили методом дифференциального
повышала устойчивость проростков гороха к де-
центрифугирования [21]. Эпикотили гороха дли-
фициту воды. Интересно было исследовать меха-
ной 3-6 см (25 г) гомогенизировали со 100 мл сре-
низмы защитного действия этого препарата и
ды выделения, содержащей: 0.4 М сахарозы, 5 мМ
прежде всего изучить связь функционального со-
EDTA, 20 мМ КН2РО4 (рН 8.0), 10 мМ KCl, 2 мМ
стояния митохондрий с протекторным эффектом
дитиоэритрита и 0.1% бычьего сывороточного
препарата. В связи с этим целью нашей работы
альбумина (БСА), свободного от жирных кислот.
было изучение влияния различных концентраций
Гомогенат центрифугировали при 25000 g в тече-
ТНКЖ-тио на биоэнергетические характеристи-
ние 5 мин. Второе центрифугирование - в тече-
ки митохондрий этиолированных проростков го-
ние 3 мин при 3000 g. Осаждение митохондрий
роха в опытах in vitro, а также исследовать влия-
проводили в течение 10 мин при 11000 g. Осадок
ние обработки семян гороха раствором препарата
ресуспендировали в 2-3 мл среды, содержащей
в той концентрации, которая оказалась наиболее
0.4 М сахарозы, 20 мМ КН2РО4 (рН 7.4), 0.1%
эффективной в опытах с выделенными митохон-
БСА, и вновь осаждали митохондрии при 11000 g
дриями, на функциональное состояние этих ор-
в течение 10 мин.
ганелл.
Скорости дыхания митохондрий этиолирова-
ных проростков гороха регистрировали с помо-
МАТЕРИАЛЫ И МЕТОДЫ
щью электрода Кларка, используя полярограф
LP-7 (Чехия). Среда инкубации митохондрий со-
Работу проводили на митохондриях этиолиро-
держала 0.4 М сахарозы, 20 мМ HEPES-Tris
ванных проростков гороха (Pisum sativum L.), сорт
(рН 7.2), 5 мм КН2РО4, 4 мм MgCl2 и 0.1% БСА
Немчиновский 100.
(26°С). Скорость дыхания выражали в нг·атом
Натрий-μ2-дитиосульфатотетранитозилдифер-
O2/(мг белка в минуту).
рат тетрагидрат. Кристаллический водораствори-
мый донор оксида азота натрий-μ2-дитиосульфа-
Метиловые эфиры жирных кислот. Метиловые
тотетранитозилдиферрат
тетрагидрат
эфиры жирных кислот (МЭЖК) были получены
([Na2[Fe2(S2O3)2(NO)4]2·4H2O) был синтезиро-
путем кислотного метанолиза липидов мембран
митохондрий [22, 23]. МЭЖК экстрагировали
ван в Институте проблем химической физики
гексаном, полученные растворы анализировали.
РАН (Черноголовка, Московская обл.). Генера-
ция NO и образование мононитрозильного ин-
Определение количественного состава метило-
термедиата и частицы [Fe(S2O3)] из ТНКЖ-тио
вых эфиров жирных кислот. Определение состава
МЭЖК проводили на хроматографе Кристалл
начинается только через 40 мин после растворе-
2000М (Россия) с пламенно-ионизационным де-
ния комплекса [20].
тектором и кварцевой капиллярной колонкой
Проращивание семян гороха. Семена гороха
DB-1 (60 м × 0.32 мм, слой 0.25 мкм; J&W Scientif-
(Pisum sativum L.) сорта Немчиновский 100 про-
ic, США). Анализ МЭЖК выполняли при про-
мывали мыльной водой и 0.01% KMnO4. Затем
граммировании температуры от 120 до 270°С со
контрольные семена замачивали в воде, опытные
скоростью 4°С/мин. Температура инжектора и
семена - в 10-8 М ТНКЖ-тио в течение 1 ч. Затем
детектора - 270°С; скорость газа-носителя гелия
семена переносили на влажную фильтровальную
составляла 2.0 мл/мин, деление потока на входе в
бумагу, где они находились в темноте в течение
колонку - 1:40. Идентификацию МЭЖК осу-
трех суток. После этого половину проростков
ществляли по величинам индексов удерживания
контрольной группы (дефицит воды) и пророст-
[24]. Содержание МЭЖК в образцах рассчитыва-
ков, обработанных ТНКЖ-тио (дефицит воды +
ли как площади пика соответствующей кислоты к
БИОФИЗИКА том 67
№ 4
2022
674
ЖИГАЧЕВА и др.
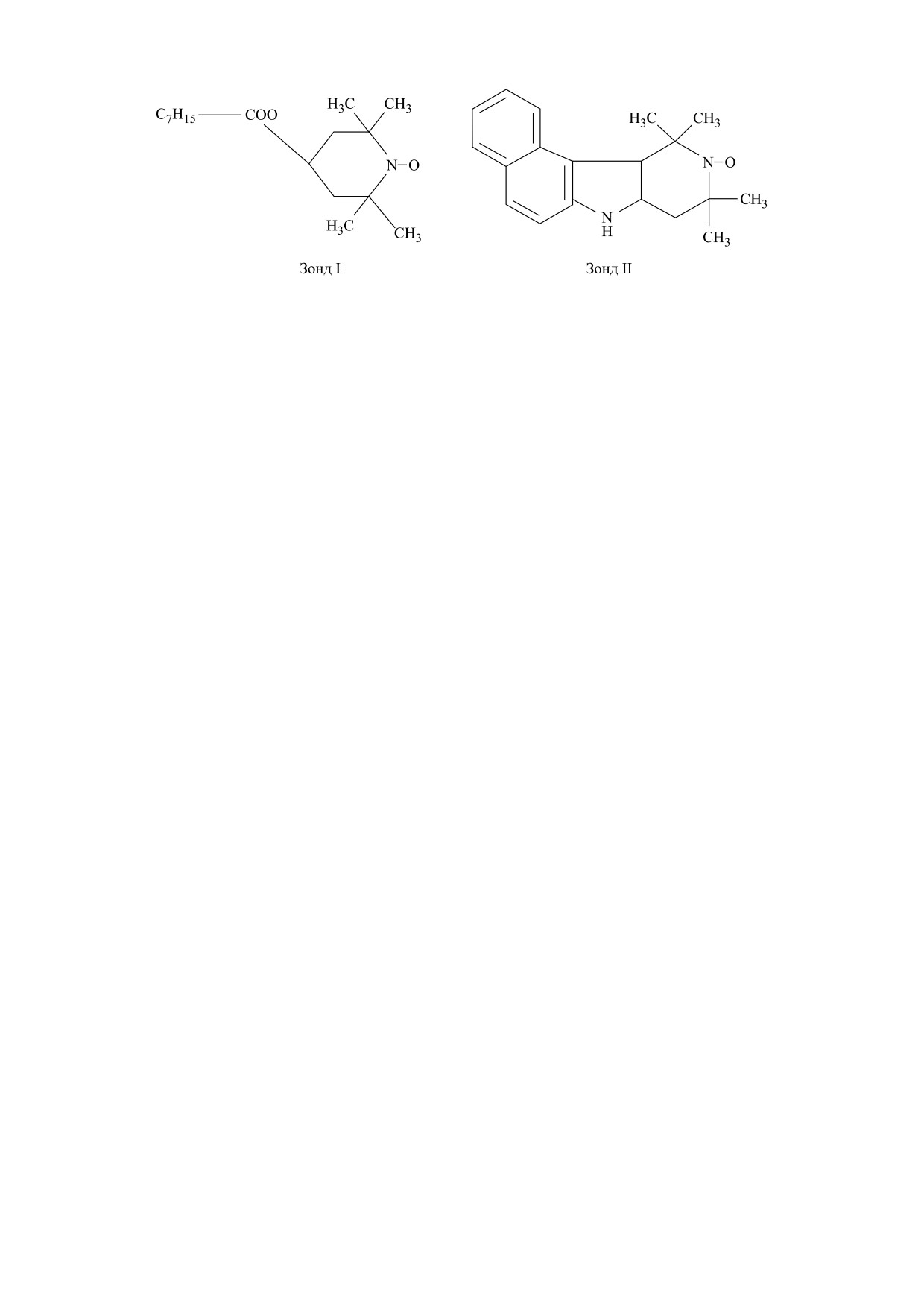
Рис. 1. Структурные формулы зондов.
сумме площадей пиков, соответствующих най-
Статистическую обработку экспериментальных
денным МЭЖК. Стандартное отклонение сред-
данных проводили определением средних ариф-
них значений площадей пиков, полученных в
метических и их стандартных ошибок. Достовер-
трех измерениях, не превышало 5% (относитель-
ность различий между вариантами оценивали со
ное значение). Математическую обработку ре-
значимостью P ≤ 0.05. Обработку результатов
зультатов проводили с использованием пакетов
проводили с использованием пакетов программ
программ Microsoft Excel и Sigma Plot 10.
Microsoft Excel и Sigma Plot 10.
Идентификация метиловых эфиров жирных кис-
Реактивы. В работе использовали реактивы сле-
лот. Идентификацию МЭЖК в образцах осу-
дующих фирм: сахароза, Трис, ЭДТА, карбонил-
ществляли также на основе масс-спектров, полу-
цианид-п-трифлуорометоксифенилгидразон, ма-
ченных после разделения МЭЖК в условиях,
лат, глутамат, сукцинат - Sigma-Aldrich, США;
аналогичных газохроматографическому анализу,
БСА, свободный от жирных кислот - Sigma, США;
на приборе HewlettPackard-6890 (США). Масс-
HEPES - МР Biomedicals, Германия; карбонат ка-
спектры получали в режиме электронного удара
лия, метанол, хлороформ - Merck, Германия; гек-
при ионизирующем напряжении 70 эВ и скоро-
сан - Panreac, Испания; ацетилхлорид - Acros,
сти сканирования 1 с на декаду масс в области
Бельгия.
40-400 Да.
Структурные характеристики мембран митохон-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
дрий исследовали методом электронного пара-
магнитного резонанса спиновых зондов. В
Для изучения протекторных свойств ТНКЖ-
качестве зонда использовали стабильные нитрок-
тио исследовали влияние инкубации изолиро-
сильные радикалы 2,2,6,6-тетраметил-4-капри-
ванных митохондрий этиолированных пророст-
лоилоксилпиперидин-1-оксил (рис. 1, зонд I) и
ков гороха с различными концентрациями препа-
5,6-бензо-2,2,6,6-тетраметил-1,2,3,4-тетрагидро-
рата на жирнокислотный состав общей липидной
γ-карболин-3-оксил (рис. 1, зонд II), которые
фракции мембран этих органелл. Обработка ми-
различаются по своей локализации в белково-ли-
тохондрий 10-4 М препарата в течение часа при-
пидных мембранах.
водила к некоторому увеличению содержания не-
Согласно работе [25] зонд I преимущественно
насыщенных жирных кислот в мембранах мито-
локализуется в свободном липидном бислое мем-
хондрий. При этом повышалось содержание ЖК,
бран на расстоянии 2-4 Å от поверхности, а зонд
входящих в состав кардиолипина - линолевой и
II локализуется в зоне липидов, связанных с бел-
линоленовой на 4 и 40% соответственно, а содер-
ковыми доменами (аннулярными липидами).
жание 20:2ω6 возрастало на 63%. Содержание
Из полученных спектров ЭПР рассчитывали
арахиновой, эйкозотриеновой и 13- и 11-эйкозе-
время корреляции вращательной подвижности
новых кислот резко сокращалось (табл. 1), что от-
(τс), характеризующее микровязкость компонен-
ражалось на физико-химических свойствах ли-
пидной фракции мембран. Наблюдалось резкое
тов мембраны, по формуле τс
= 6.65·10-10·
уменьшение микровязкости свободного липид-
·ΔH+·((I+/I-)0.5 - 1), приведенной в работе [26].
ного бислоя, измеренной с помощью зонда I, до
Регистрацию спектров ЭПР проводили при тем-
значений, при которых мембраны находятся в
пературе 297 К (24°C) на радиоспектрометре ER
жидком, но не жидкокристаллическом состоянии
200D-SRC (Brucker, Германия).
(рис. 2а). Значительное разжижение мембран ха-
БИОФИЗИКА том 67
№ 4
2022
НАТРИЙ-μ2-ДИТИОСУЛЬФАТО-ТЕТРАНИТРОЗИЛДИФЕРРАТА
675
Таблица 1. Влияние различных концентраций ТНКЖ-тио на жирнокислотный состав общей липидной фракции
мембран митохондрий проростков гороха (отн.%)
ЖК
Контроль
ТНКЖ-тио, 10-4 М
ТНКЖ-тио, 10-6 М
14:0
0.67 ± 0,30
0.96 ± 0,20
0.91 ± 0,22
16:1ω7
0.90 ± 0,12
1.31 ± 0,09
1.13 ± 0,11
16:0
16,16 ± 0,5
22,00 ± 1,00
15.82 ± 0,80
17:0
2.14 ± 0,07
3.00 ± 0,10
1.37 ± 0,08
18:2 ω6
50.00 ± 0.21
52.00 ± 0.38
43.2 ± 0.51
18:3 ω3
5.06 ± 0.02
7.07 ± 0.02
4.52 ± 0.02
18:1 ω9
2.25 ± 0.11
2.25 ± 0.09
2.47 ± 0.08
18:1 ω7
0.60 ± 0.02
0.6 ± 0.01
1.2 ± 0.01
18:0
3.00 ± 0.21
4.5 ± 0.18
7.4 ± 0.25
20:3 ω6
2.76 ± 0.11
0.42 ± 0.14
4.00 ± 0.18
20:2 ω6
4.90 ± 0.23
8.00 ± 0.34
4.26 ± 0.21
20:1 ω9
6.72 ± 0.61
0.59 ± 0.32
8.40 ± 0.43
20:1 ω7
3.84 ± 0.18
0.10 ± 0.01
2.82 ± 0.12
20:0
1.00 ± 0.01
0.20 ± 0.01
2.50 ± 0.03
рактерно, например, при развитии патологии у
ковых областей мембран митохондрий возрастала
животных [27]. Резкое уменьшение микровязко-
на 10% относительно контроля (рис. 2б). В этом
сти липидного бислоя, вероятно, могло привести
случае, вероятно, структура мембран изменялась
к нарушению структуры мембран, что в свою оче-
так, чтобы сохранить функционирование мем-
редь могло повлечь за собой дисфункцию мито-
бранных белков за счет деструкции липидной
хондрий. В то же время микровязкость прибел-
фазы.
Рис. 2. Относительное изменение времени корреляции вращательной диффузии липидного (а) и белкового (б) зондов при
обработке проростков ТНКЖ-тио. Контрольные значения τс : для липидного зонда - 0.7∙10-10 c, для белкового зонда -
1.25∙10-10 c.
БИОФИЗИКА том 67
№ 4
2022
676
ЖИГАЧЕВА и др.
Таблица 2. Влияние различных концентраций ТНКЖ-тио на скорости окисления НАД-зависимых субстратов
митохондриями проростков гороха
Группа
V2
Концентрация
ТНКЖ-тио
АДФ
V4
ДК
ДНФ
ТНКЖ-тио, М
Контроль
31.4 ± 2.4
-
-
74.30 ± 5.8
31.4 ± 1.5
3.00 ± 0.02
95.4 ± 4.7
Контроль
28.7 ± 2.0
10-4
53.5 ± 4.0
27.1 ± 3.2
19.4 ± 1.7
1.40 ± 0.01
47.7 ± 3.0
Контроль
21.2 ± 2.1
10-5
27.7 ± 1.8
34.8 ± 3.0
19.6 ± 1.4
1.77 ± 0.02
30.3 ± 2.4
Контроль
24.7 ± 2.2
10-6
28.7 ± 1.4
23.0 ± 1.5
9.2 ± 1.0
2.5 ± 0.03
20.1 ± 2.4
Контроль
21.7 ± 2.8
10-8
20.0 ± 2.2
54.4 ± 3.7
12.6 ± 2.0
4.3 ± 0.03
57.5 ± 4.9
Примечание. Среда инкубации: 0.4 М сахарозы, 20 мМ HEPES-Tris-буфер (рН 7.2), 5 мМ КН2РО4, 4 мМ MgCl2, 0.1% БСА,
10 мМ малата,
10 мМ глутамата. Дополнительные добавки:
200 мкМ АДФ,
10-6 М карбонилцианид-п-
трифлуорометоксифенилгидразона. Скорости окисления (представлены в нг·атом О2/мг белка·мин): V2 - скорость
окисления субстратов, V4 - скорость окисления в состоянии покоя (скорость окисления субстрата при исчерпании АДФ).
Число повторов - 6.
Изменение физико-химических свойств ли-
НАД-зависимых субстратов как в фосфорилиру-
пидного компонента мембран отразилось на ак-
ющем состоянии, так и в присутствии разобщите-
тивности ферментов дыхательной цепи митохон-
ля (табл. 2). Вероятно, это обусловлено снижени-
дрий. Исследовали в основном влияние препара-
ем содержания в липидном компоненте мембран
та на скорости окисления НАД-зависимых
линолевой и линоленовой кислот, входящих в со-
субстратов. Такой выбор был обусловлен тем, что
став кардиолипина, обеспечивающего эффектив-
внешние воздействия более сильно влияют на ак-
ную работу дыхательной цепи митохондрий [30].
тивность комплекса I дыхательной цепи, чем
Однако эффективность окислительного фосфо-
на комплекс II [28-30]. Действительно, введение
рилирования менялась незначительно: дыхатель-
10-4 М ТНКЖ-тио в среду инкубации митохон-
ный контроль по Чансу уменьшался с 3.00 ± 0.02
дрий, содержащей НАД-зависимые субстраты
до 2.50 ± 0.03. Отметим, что введение в среду ин-
окисления, приводило к разобщению окисления
кубации митохондрий 10-8 М препарата приво-
и фосфорилирования. При этом величина дыха-
дило к повышению эффективности окислитель-
тельного контроля по Чансу снижалась с 3.00 ±
ного фосфорилирования при окислении НАД-за-
± 0.02 до 1.40 ± 0.01, а соотношение АДФ/О
висимых субстратов. Это увеличение было
уменьшалось с 2.20 ± 0.02 до 1.15 ± 0.01 (табл. 2).
обусловлено некоторым снижением скоростей
транспорта электронов в состоянии покоя (после
Иная картина наблюдалась при использова-
исчерпания АДФ). ТНКЖ-тио также увеличивал
нии препарата в концентрации 10-6 М. В данном
скорости окисления сукцината в присутствии
случае происходило снижение содержания нена-
АДФ, в результате чего в полтора раза возрастала
сыщенных С18-жирных кислот - линолевой и ли-
величина дыхательного контроля по Чансу, а
ноленовой, входящих в состав кардиолипина. Их
АДФ/О увеличивалось с 1.40 ± 0.02 до 1.71 ± 0.04.
содержание в липидах мембран митохондрий со-
Данные изменения биоэнергетических харак-
кратилось на 15.6 и 11.0% соответственно. При
теристик митохондрий, вероятно, были обуслов-
этом содержание ненасыщенных С20-ЖК даже
лены изменениями физико-химических свойств
несколько возрастало. Так, содержание эйкоза-
липидного компонента мембран. Инкубация ми-
триеновой кислоты возрастало на 45%, а эйкозе-
тохондрий с 10-8 М препарата вызывала 15% сни-
новой кислоты - на 25% (табл. 1). Изменения в
жение микровязкости, измеренной зондом I
жирнокислотном составе липидов мембран ми-
(свободный липидный бислой) по сравнению с
тохондрий отразились и на биоэнергетических
контролем (рис. 2а). В то же время микровяз-
характеристиках. В концентрациях 10-5 и 10-6М
кость, измеренная зондом II (зона липидов, свя-
ТНКЖ-тио проявлял небольшой разобщающий
занная с белковыми доменами), возрастала на
эффект, выражающийся в 16%-м и 30%-м увели-
20% (рис. 2б). Специфические изменения микро-
чении скоростей окисления субстратов (V2)
вязкости, наблюдаемые в области аннулярных
(табл. 2). При этом в концентрации 10-6 М препа-
липидов мембран, по-видимому свидетельствуют
рат значительно снижал скорости окисления
об изменении белок-липидного взаимодействия,
БИОФИЗИКА том 67
№ 4
2022
НАТРИЙ-μ2-ДИТИОСУЛЬФАТО-ТЕТРАНИТРОЗИЛДИФЕРРАТА
677
Рис 3. Влияние дефицита воды и ТНКЖ-тио на относительное содержание С18 жирных кислот в мембранах митохондрий
проростков гороха. Ось абсцисс: 1 - 18:2 ω6, 2 - 18:3 ω3, 3 - 18:1 ω9, 4 - 18:1 ω7, 5 - 18:0; ось ординат - относительное
содержание (в %) С18 жирных кислот в мембранах митохондрий проростков гороха.
Таблица 3. Влияние дефицита воды и ТНКЖ-тио на скорости окисления НАД-зависимых субстратов
митохондриями проростков гороха
Группа
V2
V3
V4
V3/V4
ДНФ
Контр
25.22 ± 2.21
80.53 ± 3.10
35.32 ± 1.71
2.28 ± 0.01
72.85 ± 1.95
Дефицит воды
37.35 ± 1.15
49.00 ± 2.40
27.50 ± 1.23
1.78 ± 0.01
44.00 ± 1.12
Дефицит воды + 10-8 М
41.66 ± 2.00
76.68 ± 2.91
28.01 ± 1.54
2.74 ± 0.02
68.65 ± 2.01
ТНКЖ-тио
Примечание. Среда инкубации: 0.4 М сахарозы, 20 мМ HEPES-Tris буфер (рН 7.2), 5 мМ КН2РО4, 4 мМ MgCl2, 0.1% БСА,
10 мМ малата,
10 мМ глутамата. Дополнительные добавки:
200 мкМ АДФ,
10-6 М карбонилцианид-п-
трифлуорометоксифенилгидразона. Скорости окисления (представлены в нг·атом О2/мг белка·мин): V2 - скорость
окисления субстратов, V3 - скорость окисления субстратов в присутствии АДФ; V4 - скорость окисления в состоянии покоя
(скорость окисления субстрата при исчерпании АДФ). Число повторов - 8.
что, вероятно, сказалось на активности фермен-
шение содержания насыщенных ЖК (С14:0, С17:0,
тов, ассоциированных с мембранами, а, следова-
С18:0, С20:0). В результате отношение ∑С ненасы-
тельно, на активности дыхательных ферментов
щенных ЖК / ∑С насыщенных ЖК снизилось с
митохондрий. Отметим, что разнонаправленные
2.79 ± 0.02 до 2.15 ± 0.01, что, вероятно, увеличивало
изменения микровязкости разных фаз мембран
ригидность мембран митохондрий. Изменения в
характерны при нормальном функционировании
жирнокислотном составе мембран этих органелл
органелл клеток [27].
сопровождались снижением максимальных скоро-
Учитывая влияние данной концентрации препа-
стей окисления НАД-зависимых субстратов на
рата на структурные характеристики мембран ми-
39%, а также 12%-м снижением эффективности
окислительного фосфорилирования (табл. 3). Об-
тохондрий и биоэнергетику этих органелл, 10-8 М
ТНКЖ-тио мы использовали для изучения его ан-
работка семян гороха 10-8 М препарата предотвра-
тистрессовых свойств на модели дефицита воды.
щала изменения состава ЖК мембран митохондрий
Дефицит воды приводил к снижению содержания
в условиях стресса и обусловленные этим измене-
основных ЖК, входящих в состав кардиолипина:
ния биоэнергетических характеристик митохон-
линолевой кислоты на 14,5% и линоленовой кисло-
дрий. При этом эффективность окислительного
ты - на 19% (рис. 3). При этом наблюдалось повы-
фосфорилирования возрастала на 20%.
БИОФИЗИКА том 67
№ 4
2022
678
ЖИГАЧЕВА и др.
ВЫВОДЫ
5.
D. Pastore, D. Trono, M. N. Laus, et al., J. Exp. Bot.,
58 (2), 195 (2007). DOI: 10.1093/jxb/erl273
Исходя из полученных данных можно прийти
6.
J. Jayawardhane1, D. W. Cochrane, P. Vyas, et al.,
к заключению, что ТНКЖ-тио влиял на структур-
Front. Plant Sci.
(2020). DOI:
10.3389/fpls.
ные характеристики мембран митохондрий про-
2020.00566
ростков гороха. Это влияние имело дозовую зави-
7.
R. B. SNabi., R. Tayade,A. Hussain, et al., Environ.
симость: в концентрации 10-4 М препарат вызы-
Exp. Bot., 161, 120 (2019). DOI: 10.1016/J.ENVEXP-
вал нарушение структурных характеристик
BOT.2019.02.003
мембран, что влекло за собой дисфункцию мито-
8.
P. Santisree, P. Bhatnagar-Mathur, and K. K. Sharma,
хондрий. Существенное влияние на биоэнергети-
Funct. Plant Biol.,
45
(2),
267
(2017). DOI:
ческие характеристики митохондрий оказывал
10.1071/FP16324
ТНКЖ-тио в концентрации 10-8 М. В этой кон-
9.
M. Hasanuzzaman, K. Nahar, M. M. Alam, et al., Int.
центрации препарат увеличивал эффективность
J. Mol. Sci.,
14,
9643
(2013). Doi:
10.3390/
окислительного фосфорилирования за счет неко-
ijms14059643
торого снижения скоростей транспорта электро-
10.
А. Ф. Ванин, Динитрозильные комплексы железа с
нов в состоянии покоя (после исчерпания АДФ).
тиол-содержащими лигандами: физико-химия, био-
логия, медицина (Институт компьютерных иссле-
Использование препарата в качестве адаптоге-
дований, Москва-Ижевск, 2015).
на к стрессовым воздействиям, в частности к де-
11.
M. Hasanuzzaman, K. Nahar, M. M. Alam., and
фициту воды, показало, что 10-8 М ТНКЖ-тио
M. Fujita, Austral. J. Crop Sci., 6 (8),1314 (2012)
обеспечивал эффективное функционирование
12.
F. Groß, J. Durner, and F. Gaupels, Front. Plant Sci. 4,
дыхательной цепи митохондрий за счет сохране-
419 (2013). DOI: 10.3389/fpls.2013.00419
ния/увеличения пула основных ЖК, входящих в
13.
F. Van Breusegem, E. Vranová, J. F. Dat, and D. Inze,
состав кардиолипина - линолевой и линолено-
Plant Sci. 161,
405
(2001). DOI: 10.1016/S0168-
вой кислот, а также ненасыщенных ЖК, способ-
9452(01)00452-6
ствующих поддержанию текучести мембран. Та-
14.
K. J. Gupta, A. Kumari, I. Florez-Saras, et al., J. Exp.
ким образом антистрессовые свойства препарата
Bot., 69 (14), 3413 (2018). DOI: 10.1093/jxb/ery119
в основном обусловлены его антиоксидантной
15.
K. J. Gupta and W. M. Kaiser, Plant Cell Physiol., 51,
активностью.
576 (2010). DOI: 10.1093/pcp/pcq022
16.
M. Stoimenova, A. U. Igamberdiev, K. J. Gupta, and
R. D. Hill, Planta, 226, 465 (2007). DOI: 10.1007/
БЛАГОДАРНОСТИ
s00425-007-0496-0/
Авторы выражают огромную благодарность
17.
Ф. М. Шакирова, Неспецифическая устойчивость
сотруднику Института проблем химической фи-
растений к стрессовым факторам и ее регуляция
зики РАН д.х.н. Н.А. Саниной за предоставление
(«Гилем», Уфа, 2001).
для исследований натрий-μ2-дитиосульфато-тет-
18.
A. F. Vanin, Int. J. Mol. Sci. 22 (19), 10356 (2021).
ранитозилдиферрата тетрагидрата.
DOI: 10.3390/ijms221910356
19.
I. Zhigacheva, V. Binyukov, E. Mil, et al., Curr. Chem.
Biol.,
14,
203
(2020)
DOI:
10.2174/
ФИНАНСИРОВАНИЕ РАБОТЫ
2212796814999200907162619
Работа выполнена при финансовой поддержке
20. Н. А. Санина и С. М. Алдошин, Изв. РАН. Сер.
Российской Академии наук (номер темы 44.4-
хим., 7, 1199 (2011)
1201253310).
21. В. Н. Попов, Э. К. Рууге и А. А. Старков, Биохи-
мия, 68 (7), 910 (2003).
22. J. P. Carreau and J. P. Dubacq, J. Chromatogr. A, 151,
СПИСОК ЛИТЕРАТУРЫ
384 (1979). DOI: 10.1016/S0021-9673(00)88356-9
1. E. Plotnikov, A. Chupyrkina, A. Vasileva, et al., Bio-
23. Y. Wang, H. Sunwoo, G. Cherian, and J. S. Sim, Poult
chim. Biophys. Acta, 1777, S58 (2008).
Sci. 79 (8), 1168 (2000). DOI: 10.1093/ps/79.8.1168
2. А. Е. Шиков, Т. В. Чиркова и В. В. Емельянов,
PMID: 10947186.
Экологич. генетика,
19
(4),
343
(2021). DOI:
24. R. V. Golovina and T. E. Kuzmenko, Chromatography
10.17816/ecogen75975
(Basel), 10, 545 (1977). DOI: 10.1007/BF02262915
3. A. A. Starkov, Biosci. Rep., 17 (3), 273 (1997). DOI:
25. В. И. Бинюков, С. Ф. Борунова, М. Г. Гольдфельд
10.1023/a:1027380527769
и др., Биохимия, 36 (6), 1149 (1972)
4. P. Ch. Ikwegbue, P. Masamba, B. E. Oyinloye, and
26. А. М. Вассерман, А. Л. Бучаченко, А. Л. Коварский
A. P. Kappo. Pharmaceuticals (Basel), 11 (1), 2 (2018).
и И. Б. Нейман, Высокомолекуляр. соединения,
DOI: 10.3390/ph11010002
10А, 1930 (1968).
БИОФИЗИКА том 67
№ 4
2022
НАТРИЙ-μ2-ДИТИОСУЛЬФАТО-ТЕТРАНИТРОЗИЛДИФЕРРАТА
679
27. А. Н. Голощапов, Е. Б. Бурлакова, Биофизика, 25
29. A. Navarro and A. Boveris, Am. J. Physiol. Cell
(1), 97 (1980).
Physiol., 292 (2), 670 (2007). DOI: 10.1152/ajpcell.
00213.2006
28. L. Adzigbli, E. P. Sokolov, S. Ponsuksili, and
30. G. Paradies, G. Petrosillo, M. Pistolese, et al., Circ.
I. M. Sokolova, J. Exp. Biol. 225 (1), 243304 (2022).
Res.,
94
(1),
53
(
2004). DOI:
10.1161/
DOI: 10.1242/jeb.243304
01.RES.0000109416.56608.64
Sodium μ2-Dithiosulfate-Tetranitrosyl Diferrate Tetrahydrate Increases the Efficiency
of the Respiratory Chain Activity in Mitochondria of Pea Seedlings
I.V. Zhigacheva*, N.I. Krikunova*, I.P. Generozova**, P.A. Butsanets**, N.Yu. Gerasimov*,
O.V. Nevrova*, S.V. Vasiliev**, and A.N. Goloshchapov*
*Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**Timiryazev Institute of Plant Physiology, Russian Academy of Sciences, Botanicheskaya ul. 35, Moscow, 127276 Russia
The present study was designed to investigate the antistress properties of the nitric oxide donor of the ferric-
thiosulfate complex of sodium μ2-dithiosulfate-tetranitosyl diferrate tetrahydrate Na2[Fe2(S2O3)2(NO)4]2·
·4H2O (TNIC-thio), where the effects of different concentrations of the donor on the functional state of mi-
tochondria isolated from pea seedlings were studied. Incubation of mitochondria with 10-4 M of the drug led
to a sharp decrease in microviscosity of a freestanding lipid bilayer. This is attributable to a rise in the content
of unsaturated fatty acids in the lipid fraction of mitochondrial membranes. At the same time, the drug un-
coupled the processes of oxidation and phosphorylation. Treatment of mitochondria with 10-8 M TNIC-thio
brought about an increase (by 25-45%) in the content of unsaturated C20 fatty acids, that could cause a 15%
drop in microviscosity of the freestanding lipid bilayer. However, microviscosity in the annular lipid region of
the membranes increased by 20%, thus, indicating that the activity of mitochondrial respiratory chain en-
zymes altered. Indeed, the drug affected the oxidation rates of NAD-dependent substrates and succinate and
increased the efficiency of oxidative phosphorylation. This concentration of the drug was chosen to study the
ability of TNIC-thio to improve the resistance of pea seedlings during water deficit. TNIC-thio prevented
changes in the fatty acids composition of mitochondrial membranes in the conditions of water deficit and
stress-induced changes in the bioenergetic characteristics of mitochondria. The findings of the study suggest
that the protective properties of the drug are developed at the membrane level due to the preservation/in-
crease of the pool of unsaturated fatty acids contributing to the maintenance of membrane fluidity.
Keywords: mitochondria, nitric oxide, microviscosity, freestanding lipid bilayer, annular lipids, fatty acids
БИОФИЗИКА том 67
№ 4
2022