БИОФИЗИКА, 2022, том 67, № 4, с. 680-688
БИОФИЗИКА КЛЕТКИ
УДК 577.322.9; 577.359
ИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ ВОДНОГО ИЗВЛЕЧЕНИЯ ИЗ ЙЕРБА
МАТЕ (Ilex paraguariensis) НА ПРОЦЕСС ЛИПИДНОЙ ПЕРОКСИДАЦИИ
ЛИПОСОМАЛЬНЫХ МЕМБРАН
© 2022 г. Ю.О. Теселкин*, #, И.В. Бабенкова*, А.А. Кочетова*, А.Н. Осипов*
*Российский национальный исследовательский медицинский университет им. Н.И. Пирогова Минздрава РФ,
ул. Островитянова, 1, Москва, 117997, Россия
#E-mail: teselkin-box@mail.ru
Поступила в редакцию 19.05.2022 г.
После доработки 19.05.2022 г.
Принята к публикации 26.05.2022 г.
Исследовано влияние водного извлечения из йерба мате (Ilex paraguariensis) на процесс пероксидно-
го окисления фосфолипидов липосомальных мембран, индуцированный ионами Fe2+. За процес-
сом липидной пероксидации липосом наблюдали, регистрируя кинетику хемилюминесценции, ак-
тивированной кумарином С-525. С повышением концентрации водного извлечения из мате в сус-
пензии липосом происходило дозозависимое увеличение времени достижения максимума
«медленной» вспышки хемилюминесценции и понижение ее интенсивности. Это свидетельствует
соответственно об уменьшении скорости окисления ионов Fe2+ и снижении скорости образования
липидных радикалов. Аналогичный результат был получен при добавлении к липосомам классиче-
ских радикальных ингибиторов - бутилгидрокситолуола и тролокса. Однако в отличие от радикаль-
ных ингибиторов при дальнейшем увеличении концентрации водного извлечения в суспензии ли-
посом (более 2.5 мкг сухого растительного сырья/мл) имело место постепенное уменьшение време-
ни достижения максимума «медленной» вспышки хемилюминесценции, что характерно для
действия железохелатирующих веществ (ЭДТА и дефероксамина) и обусловлено сокращением вре-
мени окисления ионов Fe2+ до критической концентрации. Можно предположить, что биологиче-
ски активные вещества, входящие в состав водного извлечения из мате, проявляют как радикалпе-
рехватывающую, так и железосвязывающую активность. Было изучено влияние на Fe2+-индуциро-
ванное свечение липосом некоторых соединений полифенольной природы из состава водных
экстрактов мате - кверцетина, рутина, кофеиновой и хлорогеновой кислот. Установлено, что в ли-
посомальной модельной системе кверцетин действовал как радикальный ингибитор. Смешанный
тип действия - радикалперехватывающий и железохелатирующий - наблюдали у рутина, кофеино-
вой и хлорогеновой кислот. Таким образом, торможение Fe2+-индуцированного пероксидного
окисления липидов биологических мембран может быть одним из механизмов антиоксидантных
эффектов йерба мате, наблюдаемых in vivo.
Ключевые слова: йерба мате, Ilex paraguariensis, липосомы, пероксидное окисление липидов, ионы железа,
полифенольные соединения, антиоксиданты, хемилюминесценция.
DOI: 10.31857/S0006302922040068, EDN: ITAUBA
из мате (водных экстрактов мате) по отношению
Водные извлечения из йерба мате (Ilex para-
к ряду известных свободных радикалов [3-6].
guariensis) обладают антиоксидантными свой-
Важный механизм антиоксидантного дей-
ствами, которые обусловлены содержанием в них
ствия водных извлечений из мате заключается в
биологически активных веществ (БАВ) полифе-
торможении реакций свободнорадикального пе-
нольной природы, в частности, кверцетина, ру-
роксидного окисления липидов (ПОЛ) [4, 7].
тина, кофеиновой и хлорогеновой кислот, а так-
Большой интерес представляет изучение влияния
же их производных [1, 2]. Во многих исследовани-
мате на процесс ПОЛ, индуцированный ионами
ях, в том числе и в наших работах, установлена
металлов переменной валентности, например
антирадикальная активность водных извлечений
ионами железа. Известно, что ионы Fe2+/Fe3+
участвуют в продукции активных форм кислоро-
Сокращения: БАВ - биологически активные вещества, да - O2•, Н2О2 и ОН• и других [8, 9]. В физиоло-
ПОЛ
- пероксидное окисление липидов, BHT
-
бутилгидрокситолуол (2,6-ди-трет-бутил-4-метилфенол).
гических условиях активные формы кислорода
680
ИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ ВОДНОГО ИЗВЛЕЧЕНИЯ ИЗ ЙЕРБА МАТЕ
681
выполняют сигнальную функцию в клетках, ока-
температуре в течение 10 мин, охлаждали в холод-
зывая регулирующее воздействие на работу раз-
ной воде, восстанавливали общий объем биди-
личных систем организма человека [8, 10, 11]. На-
стиллированной водой и фильтровали через бу-
рушение гомеостаза железа в организме приводит
мажный фильтр. Приготовленное водное извле-
к увеличению уровня каталитически активных
чение из мате хранили при
4°С в течение
эксперимента (5-6 ч).
ионов Fe2+ и, как следствие, к усилению продук-
ции радикальных интермедиатов кислорода и ак-
Однослойные липосомы из яичных фосфоли-
тивации оксидативного стресса, играющего важ-
пидов готовили по методу, описанному в работе
ную роль в патогенезе ряда заболеваний [8, 12]. В
[15]. Для этого в 13.5 мл 50 мМ трис-HCl-буфера,
этой связи изучение способности водных извле-
содержащего 100 мМ KCl, pH 7.4, быстро впрыс-
чений из мате ингибировать процесс липидной
кивали 0.5 мл раствора яичных фосфолипидов в
этаноле (56 мг/мл) при интенсивном перемеши-
пероксидации, индуцированный ионами Fe2+,
вании. Полученную суспензию липосом инкуби-
может иметь большое значение для понимания
ровали при слабом равномерном перемешивании
возможных механизмов антиоксидантных эф-
в течение 40 мин при комнатной температуре и
фектов мате in vivo.
хранили при 4°С в течение эксперимента. Значе-
Одним из методов, позволяющих исследовать
ния оптической плотности (мутности) суспензии
как антирадикальные, так и Fe2+-хелатирующие
липосом при 600 нм находились в интервале
свойства БАВ, является метод хемилюминесцен-
0.04-0.06.
ции, сопровождающей процесс Fe2+-индуциро-
Процесс ПОЛ липосом инициировали ионами
ванного ПОЛ модельных мембран (липосом).
Fe2+. За протеканием процесса пероксидации
Установлено, что вещества, перехватывающие
фосфолипидов липосом наблюдали, регистрируя
липидные радикалы (радикальные ингибиторы),
кинетику хемилюминесценции. Измерение хе-
увеличивают время достижения максимальной
милюминесценции липосом проводили на хеми-
интенсивности свечения липосом и понижают
люминометре Lum-5773 (ООО «ДиСофт», Рос-
интенсивность этого свечения, в то время как ве-
сия) с программным обеспечением PowerGraph
щества, хелатирующие ионы Fe2+, при концен-
трации этих ионов выше критической величины
ная среда имела следующий состав: липосомы
вызывают уменьшение первого показателя и в
(0.4 мг фосфолипидов на 1 мл), 1.25 мкМ С-525 в
меньшей степени влияют на второй [13, 14].
качестве активатора хемилюминесценции [14] в
Цель исследования - изучить механизм инги-
50 мМ трис-HCl-буфере, содержащем 100 мМ
бирующего действия водного извлечения из мате
KCl, pH 7.4. Концентрация этанола составляла не
на процесс липидной пероксидации липосомаль-
более 0.7% по объему. Исследуемые пробы пред-
варительно инкубировали в измерительной ячей-
ных мембран с использованием метода Fe2+-ин-
ке хемилюминометра при постоянном переме-
дуцированной хемилюминесценции.
шивании в темноте в течение 5 мин для достиже-
ния температуры
37°С. Затем индуцировали
МАТЕРИАЛЫ И МЕТОДЫ
хемилюминесценцию липосом добавлением
сульфата железа в конечной концентрации
В работе применяли кверцетин, кофеиновую
15 мкМ. Раствор сульфата железа готовили перед
кислоту, хлорогеновую кислоту, динатриевую соль
проведением исследования с использованием
ЭДТА, тролокс (6-гидрокси-2,5,7,8-тетраметилхро-
0.01 н HCl и хранили при 4°С в течение экспери-
ман-2-карбоновая кислота), дефероксамин, бутил-
мента.
гидрокситолуол (2,6-ди-трет-бутил-4-метилфенол,
При изучении влияния водных извлечений из
BHT),
2,3,5,6-lH,4H-тетрагидро-9-(2'-бензоксазо-
мате, биологически активных веществ мате, ра-
лил)-хинолизин-(9,9a,l-gh)кумарин (C-525), диме-
дикальных ингибиторов (BHT, тролокс) и хелати-
тилсульфоксид, неорганические соли (все - произ-
водства Sigma-Aldrich, США), рутин (Acros Organ-
рующих веществ (ЭДТА, дефероксамин) на Fe2+-
ics, США), яичные фосфолипиды
(60% L-α-
индуцированную хемилюминесценцию липосом
фосфатидилхолина, Fluka, Швейцария).
их добавляли в реакционную среду после внесе-
ния суспензии модельных мембран. При после-
В качестве объекта исследования использова-
довательном внесении в пробы необходимых до-
ли мате торговой марки Amanda категории Desp-
бавок (суспензии липосом, водных извлечений из
lada (La Cachuera S.A., Аргентина). Водное извле-
мате, БАВ, радикальных ингибиторов, хелаторов,
чение из мате получали, как было описано ранее
С-525, сульфата железа) осуществляли переме-
[5]. К навеске сухого растительного сырья добав-
шивание с использованием вортекса Reax top
ляли бидистиллированную воду (из расчета 1 мл
на 1 мг сырья), образец перемешивали и инкуби-
(Heidolph, Германия). Кинетику Fe2+-индуциро-
ровали в течение 30 мин на кипящей водяной ба-
ванной хемилюминесценции липосом измеряли
не. Затем образец выдерживали при комнатной
без перемешивания.
БИОФИЗИКА том 67
№ 4
2022
682
ТЕСЕЛКИН и др.
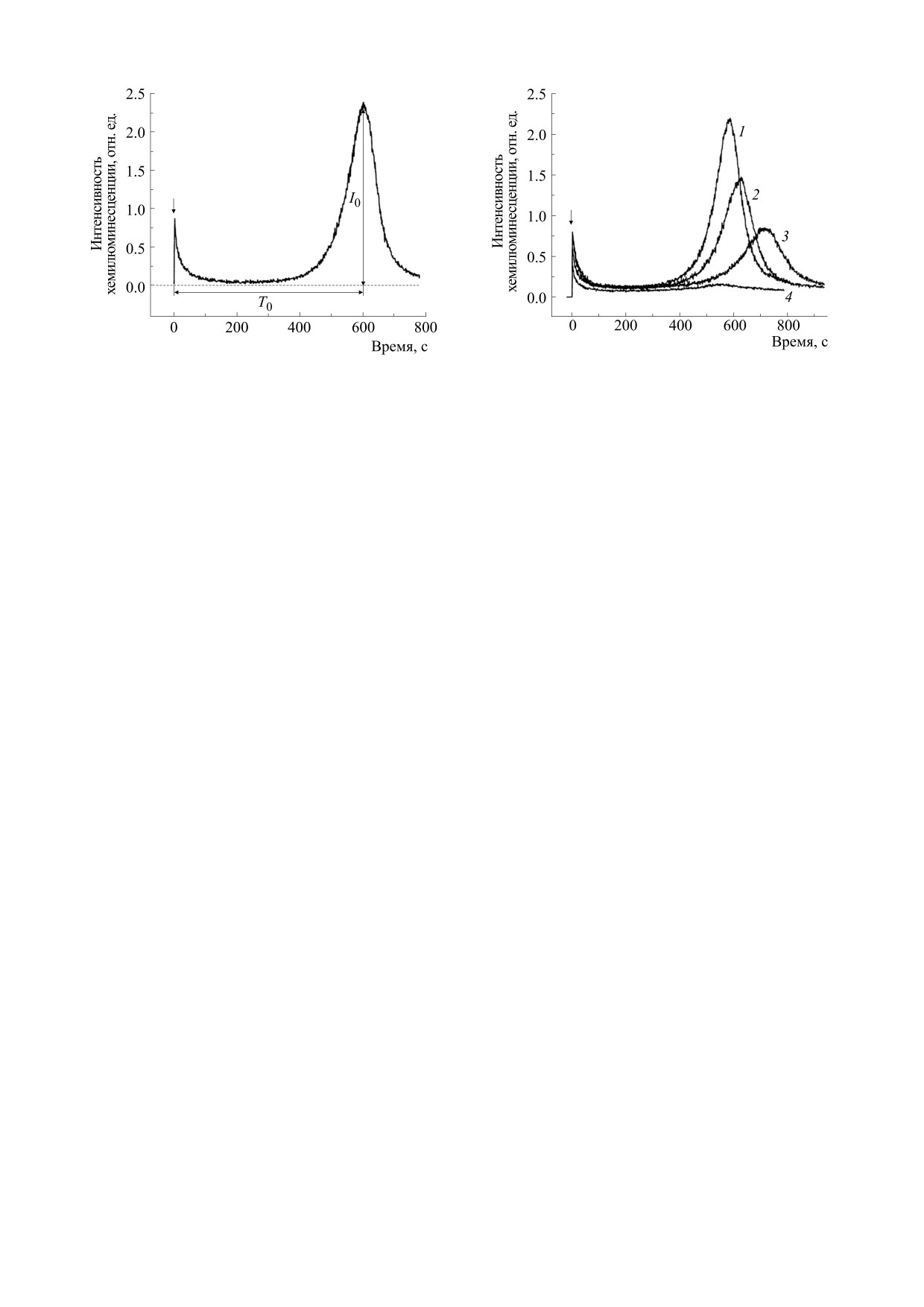
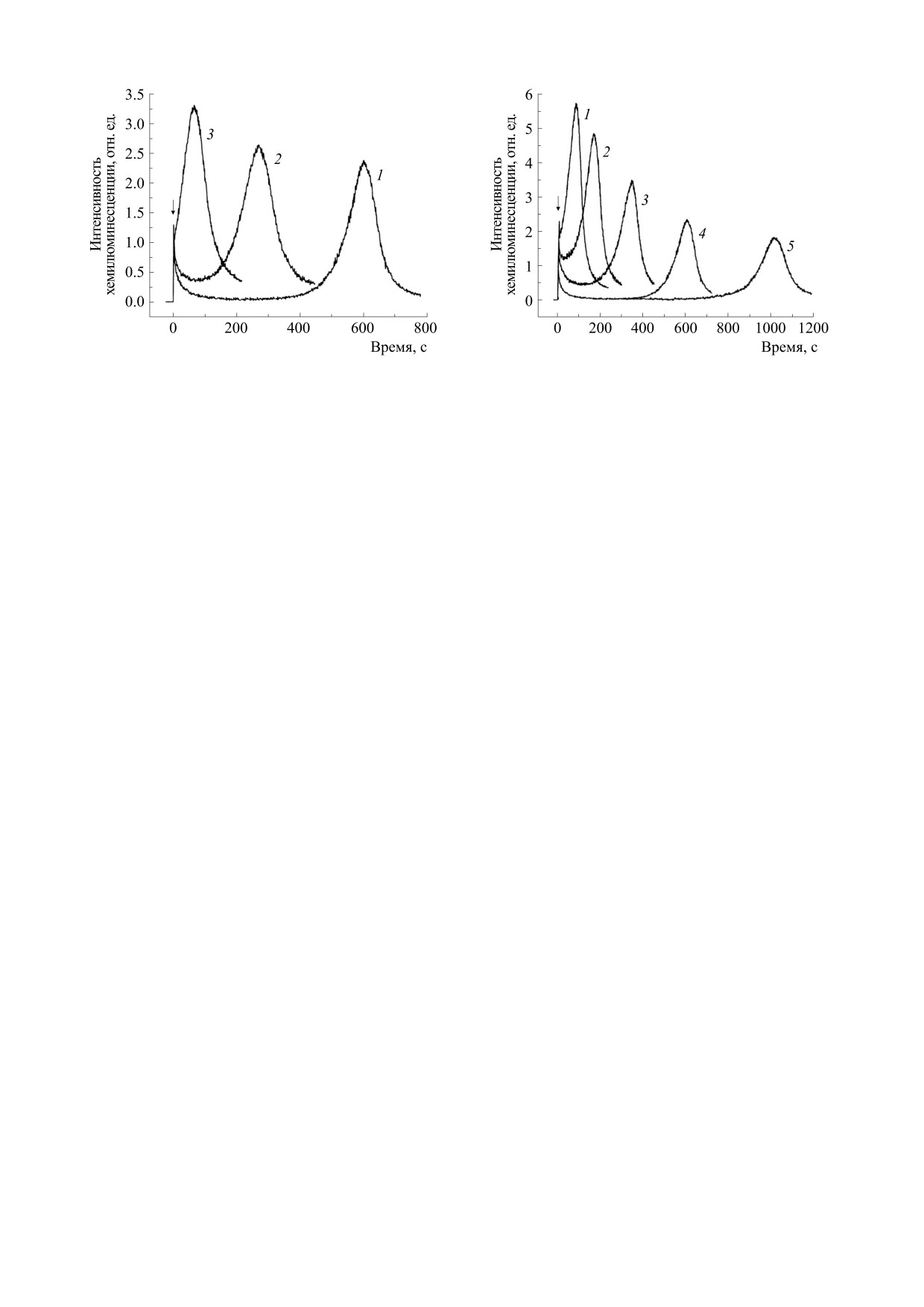
Рис. 2. Влияние водного извлечения из мате на кине-
Рис. 1. Кинетика Fe2+-индуцированной хемилюми-
тику Fe2+-индуцированной хемилюминесценции ли-
несценции липосом: I0 - максимальная интенсив-
посом: 1 - контрольная кинетика; 2, 3, 4 - в присут-
ность «медленной» вспышки хемилюминесценции;
ствии 1.25, 2.5 и 12.5 мкг сухого растительного сы-
Т0 - время достижения макcимальной интенсивно-
рья/мл соответственно. Стрелкой отмечен момент
сти
«медленной» вспышки хемилюминесценции.
введения сульфата железа.
Стрелкой отмечен момент введения сульфата железа.
роксидов, исходно содержащихся в липосомах,
Исходные растворы BHT, кверцетина, кофеи-
новой и хлорогеновой кислот готовили в этаноле
при их взаимодействии с ионами Fe2+, а «медлен-
в концентрации 10 мМ. Рабочие растворы кофеи-
ная» вспышка - развитием реакций цепного сво-
новой и хлорогеновой кислот (1 мМ) получали
боднорадикального окисления липосомальных
разведением исходных растворов 50 мМ трис-
фосфолипидов. Латентный период - это время, в
HCl-буфером, содержащим 100 мМ KCl, pH 7.4.
течение которого свечение угнетается [16]. На
При постановке контролей на этанол кинетика
практике вместо латентного периода часто
хемилюминесценции липосом не изменялась.
определяют время достижения максимальной
Растворы тролокса (1 мМ) и рутина (0.1 мМ) гото-
интенсивности «медленного» свечения, которое
вили с использованием буферного раствора.
отсчитывают от момента введения в суспензию
Результаты исследований были обработаны
липосом ионов Fe2+ [13]. Для анализа антиокси-
стандартными методами вариационной статисти-
дантных свойств водного извлечения из мате и
ки и представлены в форме средней величины и
БАВ нами были использованы относительные
стандартной ошибки средней (М ± m), рассчи-
показатели - T/T0 и I/I0, где T0 и Т - время дости-
танных по данным трех и более отдельных экспе-
жения максимальной интенсивности хемилюми-
риментов. Оценку достоверности различий меж-
несценции без и в присутствии исследуемого объ-
ду сравниваемыми показателями проводили с по-
екта, I0 и I - максимальная интенсивность «мед-
мощью t-критерия Стьюдента. Различия считали
ленной» вспышки хемилюминесценции без и в
статистически значимыми при p < 0.05.
присутствии исследуемого объекта.
Добавление водного извлечения из мате к сус-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
пензии липосом оказывало существенное влия-
В настоящем исследовании способность вод-
ние на кинетику Fe2+-индуцированной хемилю-
ного извлечения из мате ингибировать процесс
минесценции (рис. 2). В частности, изменялись
оба исследуемых показателя свечения липосом
Fe2+-индуцированого ПОЛ липосом изучали, ре-
гистрируя хемилюминесценцию, активирован-
(рис. 3). С повышением концентрации водного
ную кумариновым красителем С-525 [14, 16]. Ти-
извлечения из мате в липосомальной суспензии
до 2.5 мкг сухого растительного сырья/мл наблю-
пичная кинетика Fe2+-индуцированного свече-
далось увеличение Т/Т0. При дальнейшем повы-
ния липосом имела четко выраженные стадии -
шении концентрации водного извлечения этот
«быструю» вспышку, «медленную» вспышку и ла-
тентный период
- время между окончанием
показатель постепенно уменьшался до значений
«быстрой» вспышки и началом развития «мед-
ниже исходных (при концентрации 15 мкг сухого
растительного сырья/мл). Показатель I/I0 сни-
ленного» свечения (рис. 1). «Быстрая» вспышка
обусловлена разрушением липидных гидропе-
жался дозозависимым образом.
БИОФИЗИКА том 67
№ 4
2022
ИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ ВОДНОГО ИЗВЛЕЧЕНИЯ ИЗ ЙЕРБА МАТЕ
683
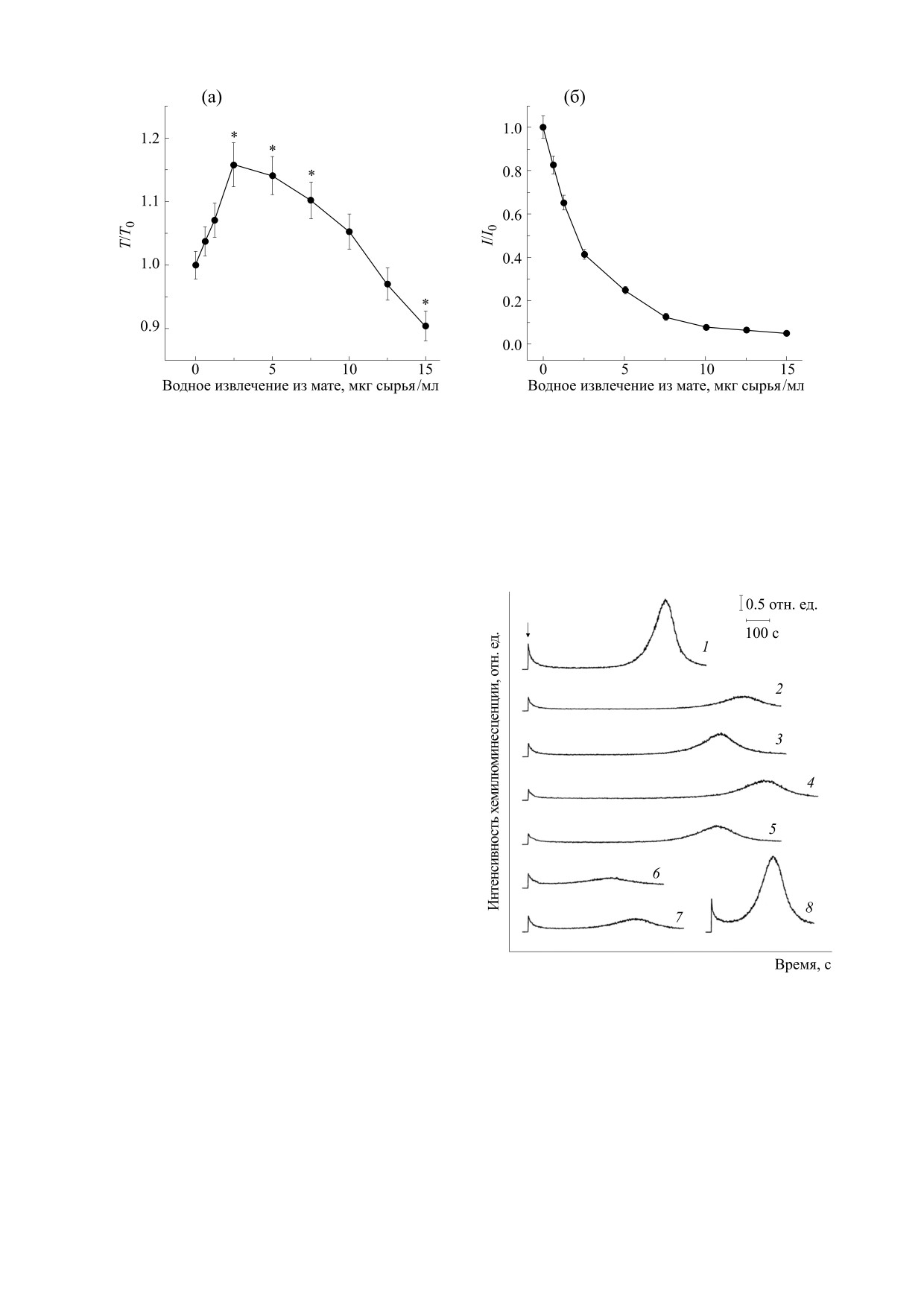
Рис. 3. Влияние водного извлечения из мате на показатели Fe2+-индуцированной хемилюминесценции липосом:
(а) - Т/Т0, (б) - I/I0; * - р < 0.05 по отношению к исходному значению показателя.
Полученный результат показывает, что влия-
показателей Т/Т0 и I/I0 в зависимости от концен-
ние водного извлечения из мате на Fe2+-инду-
трации этих полифенольных соединений. Уста-
цированное свечение липосом имеет свои
новлено, что кверцетин вызывал дозозависимое
особенности и отличается от описанного ранее
некоторыми авторами влияния радикальных ин-
гибиторов и хелаторов ионов Fe2+ [13, 14]. По-ви-
димому, эти особенности можно объяснить тем,
что БАВ, входящие в состав водного извлечения
из мате, обладают как радикалперехватывающей,
так и железосвязывающей активностью. Относи-
тельно малые количества водного извлечения
оказывают действие, аналогичное радикальным
ингибиторам - увеличивают Т/Т0 и уменьшают
I/I0. При больших концентрациях наряду с анти-
радикальными свойствами начинают проявлять-
ся и железохелатирующие свойства - значение
Т/Т0 уменьшается.
Нами изучено влияние кверцетина, рутина,
кофеиновой и хлорогеновой кислот - полифе-
нольных соединений, выявленных в водных экс-
трактах мате [4, 6, 17, 18], - на кинетику Fe2+-ин-
дуцированной хемилюминесценции липосом в
сравнении с классическими радикальными инги-
биторами (ВНТ, тролоксом) и хелатором ионов
Fe2+ (ЭДТА). Обнаружено, что кинетические
кривые в присутствии кверцетина и рутина были
аналогичны кривым (по изменению Т), получен-
ным для BHT и тролокса, тогда как кинетики хе-
Рис. 4. Влияние биологически активных веществ
милюминесценции в присутствии кофеиновой и
мате, радикальных ингибиторов и ЭДТА на Fe2+-
хлорогеновой кислот в большей мере соответ-
индуцированную хемилюминесценцию липосом: 1 -
ствовали ЭДТА (рис. 4).
контроль; 2 - 0.2 мкМ BHT; 3 - 0.5 мкМ тролокса; 4 -
0.5 мкМ кверцетина; 5 - 3 мкМ рутина; 6 - 4 мкМ
Для выяснения механизма антиоксидантного
кофеиновой кислоты;
7
- 4 мкМ хлорогеновой
действия кверцетина, рутина, кофеиновой и хло-
кислоты; 8 - 5 мкМ ЭДТА. Стрелкой отмечен момент
рогеновой кислот было исследовано изменение
введения сульфата железа.
БИОФИЗИКА том 67
№ 4
2022
684
ТЕСЕЛКИН и др.
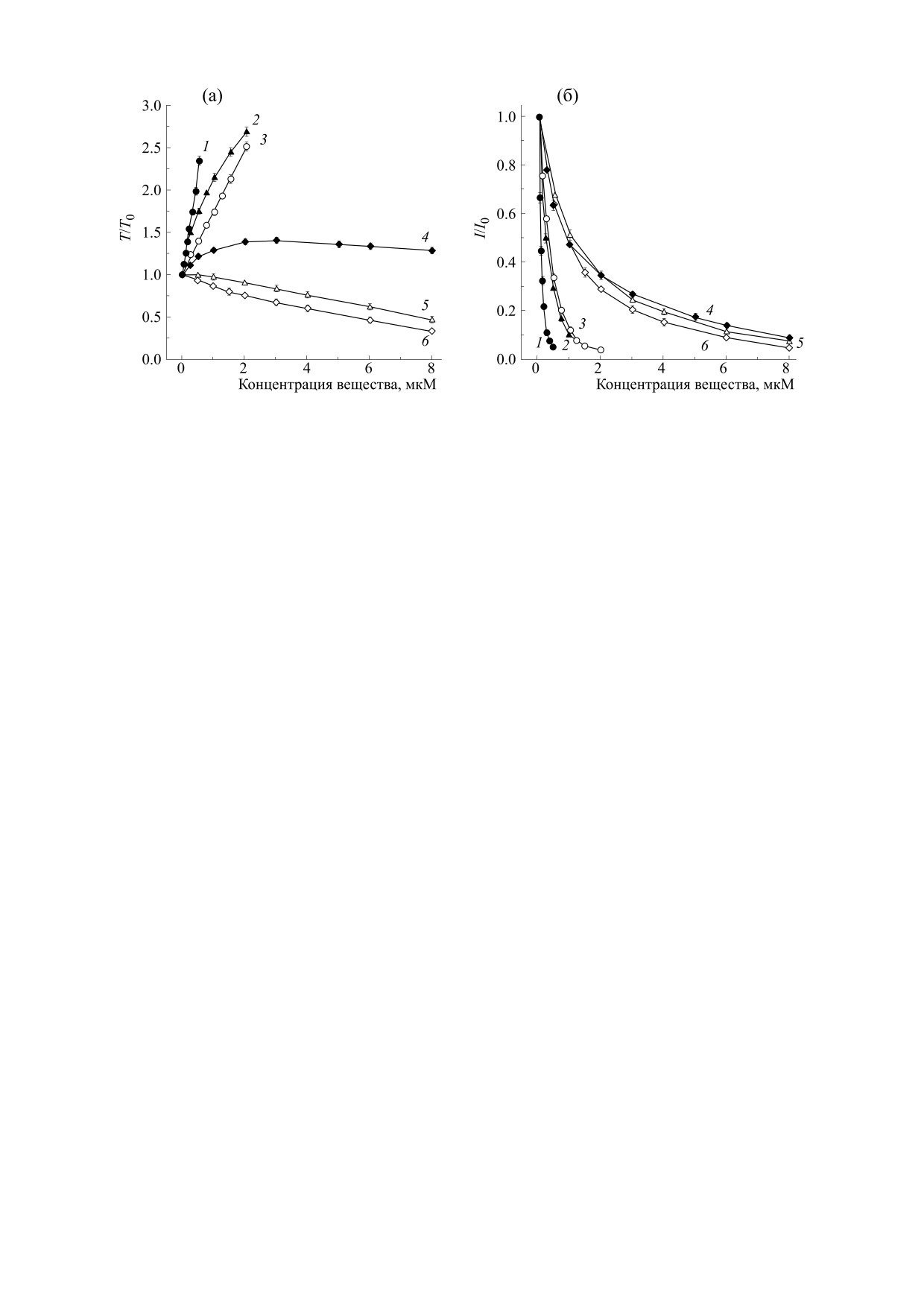
Рис.
5. Влияние биологически активных веществ мате и радикальных ингибиторов на показатели Fe2+-
индуцированной хемилюминесценции липосом: (а) - Т/Т
0, (б) - I/I0. 1 - BHT; 2 - кверцетин; 3 - тролокс; 4 - рутин;
5 - хлорогеновая кислота; 6 - кофеиновая кислота.
увеличение Т/Т0, тогда как кофеиновая и хлоро-
ние Т/Т0. При концентрациях ЭДТА более
геновая кислоты - уменьшение (рис. 5а). В случае
17 мкМ значения Т/Т0 были равны нулю, по-
рутина повышение его концентрации до 2 мкМ
скольку свечение липосом не развивалось (все
сопровождалось увеличением Т/Т0 до некоторого
двухвалентное железо связано хелатором). Что
определенного уровня, который практически не
касается изменения I/I0, то при добавлении
изменялся при дальнейшем повышении концен-
ЭДТА данная зависимость имела более сложный
трации (до 8 мкМ). Увеличение концентрации
характер. В интервале концентраций 5-13 мкМ
изучаемых веществ в суспензии липосом сопро-
интенсивность хемилюминесценции липосом
вождалось понижением I/I0 (рис. 5б). При этом
увеличивалась, превышая исходный уровень.
значения концентраций, при которых имело ме-
Дальнейшее повышение концентрации ЭДТА
сто снижение I/I0 на 50% (IС50), возрастали в сле-
приводило к уменьшению интенсивности хе-
дующем ряду: BHT < кверцетин, тролокс < кофе-
милюминесценции липосом ниже исходного
уровня (15 мкМ) и затем к полному ингибирова-
иновая, хлорогеновая кислота < рутин.
нию свечения (более 17 мкМ). Близкие зависимо-
Необходимо отметить, что регистрируемое
сти для Т/Т0 и I/I0 также были получены для дру-
уменьшение I/I0 при увеличении в данной мо-
гого хелатирующего агента - дефероксамина. Из-
дельной системе концентрации водного извлече-
вестно, что дефероксамин обладает высоким
ния из мате, а также биологически активных ве-
ществ мате нельзя объяснить поглощением ими
сродством к ионам Fe3+, которые связывает в эк-
квантов света, испускаемых С-525, который ис-
вимолярных концентрациях [19, 20]. Что касается
пользовался в качестве физического активатора
ионов Fe2+, то при взаимодействии с деферокса-
хемилюминесценции липосом. В пользу данного
мином эти ионы окисляются до трехвалентного
утверждения свидетельствует тот факт, что значе-
состояния с образованием комплекса хелатор-
ния оптической плотности растворов водного из-
Fe3+ [21]. Таким образом, добавление к суспен-
влечения из мате и исследуемых БАВ при их дей-
зии липосом дефероксамина, как и добавление
ствующих концентрациях в области длин волн,
ЭДТА, будет приводить к уменьшению концен-
соответствующих испусканию флуоресценции
трации активных ионов Fe2+.
указанного красителя в липосомах (450-580 нм),
были меньше 0.01.
Наблюдаемые изменения показателей Fe2+-
Влияние ЭДТА на Fe2+-индуцированную хе-
индуцированной хемилюминесценции липосом
милюминесценцию липосом (рис. 6) обусловле-
(Т/Т0 и I/I0) при добавлении к ним водного из-
но его железохелатирующими свойствами (одна
влечения из мате или биологически активных
веществ мате можно объяснить, если учесть, что в
молекула может связать один ион Fe2+ или Fe3+).
С повышением концентрации ЭДТА в суспензии
данной модельной системе ионы Fe2+ выполня-
липосом наблюдалось дозозависимое уменьше-
ют две противоположные функции. С одной сто-
БИОФИЗИКА том 67
№ 4
2022
ИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ ВОДНОГО ИЗВЛЕЧЕНИЯ ИЗ ЙЕРБА МАТЕ
685
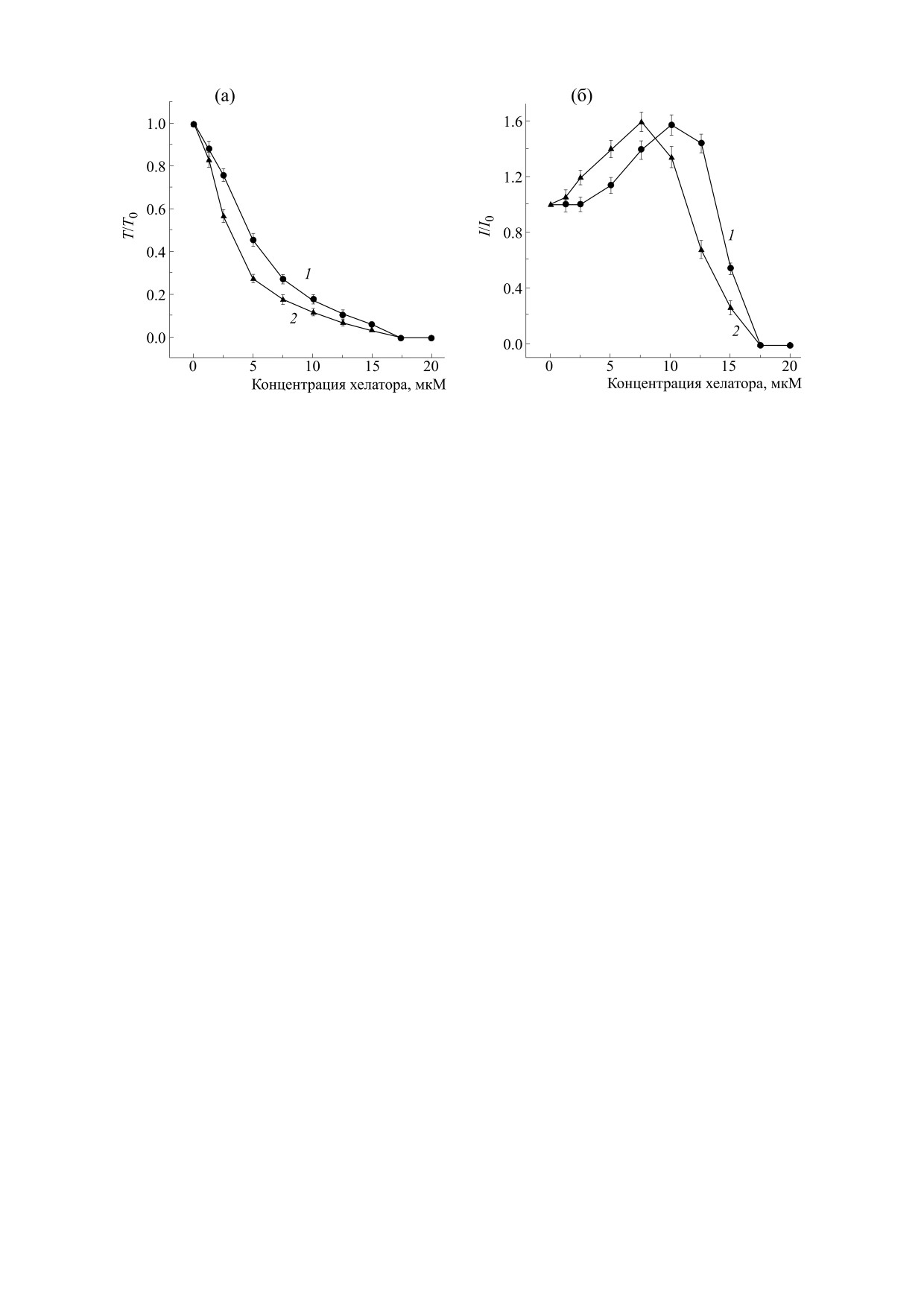
Рис. 6. Влияние хелатирующих агентов на показатели Fe2+-индуцированной хемилюминесценции липосом: (а) -
Т/Т0, (б) - I/I0. 1 - ЭДТА; 2 - дефероксамин.
роны, они выступают в качестве инициатора про-
зуются в реакции диспропорционирования двух
цесса свободнорадикального ПОЛ, катализируя
LOO•:
распад предсуществующих липидных гидропе-
роксидов (LOOH), а также липидных гидропе-
LOO• + LOO•→P∗ → P + h,
роксидов, образующихся при окислении ненасы-
щенных жирнокислотных остатков фосфолипи-
где k - константа скорости реакции диспропор-
дов липосом (LH):
ционирования LOO•, P* и Р - образующиеся мо-
лекулярные продукты в возбужденном и основ-
Fe2+ + LOOH → Fe3+ + LO• + OH-,
ном состояниях соответственно. Интенсивность
хемилюминесценции связана c концентрацией
LO• + LH → L• + LOH,
LOO• следующим образом:
L• + O2 → LOO•,
I = K ϕ k [LOO•]2,
где К - константа пропорциональности, ϕ -
LOO• + LH → LOOH + L•,
квантовый выход хемилюминесценции [14, 16,
23].
где L•, LO•, LOO• - соответственно алкильные,
алкоксильные и пероксильные радикалы липи-
При введении в суспензию липосом классиче-
ских радикальных ингибиторов, таких как BHT и
дов. С другой стороны, ионы Fe2+ ингибируют
тролокс, количество генерируемых липидных ра-
процесс липидной пероксидации, участвуя в ре-
дикалов уменьшается:
акциях обрыва цепи [22]:
LOO• (LO) + InH → LOOH (LOH) + In•,
Fe2+ + LOO• (LO•) + H+ → Fe3+ + LOOH (LOH).
где InH - радикальный ингибитор, In• - малоак-
Для возникновения «медленной» вспышки хе-
тивный радикал ингибитора. В результате ско-
милюминесценции липосом концентрация
рость окисления ионов Fe2+ до критической кон-
ионов Fe2+ должна уменьшиться до некоторой
центрации замедляется. Это приводит к увеличе-
критической величины. Окисление ионов Fe2+ до
нию Т/Т0. Что касается I/I0, то этот показатель,
критической концентрации происходит во время
наоборот, понижается. Добавление хелаторов
латентного периода. Как только концентрация
(ЭДТА, дефероксамина), удаляющих из среды
ионов Fe2+ достигнет критической, последние
часть активных ионов Fe2+, сокращает время
начинают выступать главным образом в качестве
инициатора процесса ПОЛ, что приводит к раз-
окисления оставшихся свободных ионов Fe2+ до
витию «медленной» вспышки хемилюминесцен-
критической концентрации, что вызывает умень-
ции [13, 22]. Кванты хемилюминесценции обра-
шение Т/Т0. Результаты, представленные на
БИОФИЗИКА том 67
№ 4
2022
686
ТЕСЕЛКИН и др.
Рис. 7. Влияние ЭДТА на Fe2+-индуцированную
Рис.
8. Влияние концентрации ионов Fe2+ на
хемилюминесценцию липосом: 1 - в отсутствие
кинетику хемилюминесценции липосом: 1, 2, 3, 4, 5 -
ЭДТА (контроль); 2 - 5 мкМ ЭДТА; 3 - 12.5 мкМ
7.5, 10, 12.5,
15 и 25 мкМ Fe2+ соответственно.
ЭДТА. Стрелкой отмечен момент введения сульфата
Стрелкой отмечен момент введения сульфата железа.
железа.
одну вспышку, тогда как при концентрациях 10 и
рис. 5, позволяют сделать вывод, что в пределах
12,5 мкМ происходит их разделение. При этом
исследованного диапазона концентраций квер-
время достижения максимальной интенсивности
цетин действует как радикальный ингибитор.
свечения меньше по сравнению с контролем
Другие БАВ либо увеличивали Т/Т0 до некоторой
(15 мкМ), а сама интенсивность свечения выше.
постоянной величины (рутин), либо уменьшали
Для сравнения: при концентрации ионов Fe2+,
этот показатель (кофеиновая и хлорогеновая кис-
равной 25 мкМ, интенсивность «медленного»
лоты). Полученные зависимости указывают на
свечения уменьшалась на 25%, тогда как время
то, что связывание ионов Fe2+ является одним из
достижения максимума хемилюминесценции
возможных механизмов антиоксидантного дей-
увеличивалось (необходимо больше времени для
ствия данных веществ. С другой стороны, подоб-
окисления ионов Fe2+ до критической концен-
но радикальным ингибиторам, эти вещества до-
трации). Что касается непосредственно значения
зозависимым образом понижали I/I0. Таким об-
критической концентрации ионов Fe2+, то оно
разом, в случае рутина, кофеиновой и
было определено с использованием подхода,
хлорогеновой кислот можно говорить о наложе-
предложенного в работе [13], и составило 9 мкМ
нии двух антиоксидантных эффектов.
(данные не представлены).
В отличие от рутина, кофеиновой и хлорогено-
Влияние водных извлечений из мате на про-
вой кислот, в присутствии ЭДТА и дефероксами-
цесс ПОЛ в различных биологических объектах
на в определенных диапазонах концентраций
исследовано рядом авторов. Обнаружено, что по-
значения I/I0, наоборот, повышались (рис. 6).
следние ингибируют процесс пероксидации ли-
По-видимому, это обусловлено тем, что концен-
нолевой кислоты [4], ферментативное и нефер-
трация свободных ионов Fe2+ в суспензии липо-
ментативное ПОЛ микросом печени крысы, ПОЛ
сом приближалась к критической величине. Так,
мембран эритроцитов крысы, индуцированное
при концентрации ЭДТА, равной 12.5 мкМ, на-
пероксидом водорода [7]. Наши результаты сви-
блюдалось слияние «быстрой» и «медленной»
детельствуют о том, что водное извлечение из ма-
вспышек хемилюминесценции (латентный пери-
те ингибирует процесс Fe2+-индуцированного
од отсутствует) и увеличение интенсивности све-
ПОЛ фосфолипидных липосом. Анализ измене-
чения по сравнению с контролем (рис. 7).
ний показателей хемилюминесценции липосом
Следует отметить, что при изменении началь-
(I/I0 и Т/Т0) позволяет предположить, что наблю-
ной концентрации ионов Fe2+ в суспензии липо-
даемый эффект обусловлен способностью неко-
сом можно наблюдать кинетики хемилюминес-
торых биологически активных веществ мате (на-
ценции, схожие с кинетиками, регистрируемыми
пример кверцетина, рутина, кофеиновой и хло-
при добавлении хелаторов (рис. 8). Например,
рогеновой кислот) перехватывать липидные
при концентрации ионов Fe2+, равной 7.5 мкМ,
радикалы и связывать ионы Fe2+. Антиоксидант-
«быстрая» и «медленная» вспышки сливаются в
ное действие этих БАВ на процесс ПОЛ, иниции-
БИОФИЗИКА том 67
№ 4
2022
ИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ ВОДНОГО ИЗВЛЕЧЕНИЯ ИЗ ЙЕРБА МАТЕ
687
болеваний, сопровождающихся развитием окси-
рованный in vitro ионами Fe2+, было изучено в ря-
дативного стресса [1].
де работ. В частности, установлено торможение
Таким образом, нами показано ингибирующее
Fe2+-индуцированного ПОЛ гомогенатов мозга
действие водного извлечения из мате на процесс
крысы кверцетином и рутином [24], а микросом
печени быка - хлорогеновой кислотой [25]. По-
Fe2+-индуцированной липидной пероксидации
казано ингибирование кофеиновой кислотой ли-
липосомальных мембран, которое определяется
пидной пероксидации гомогенатов печени кры-
радикалперехватывающими и железохелатирую-
щими свойствами входящих в его состав полифе-
сы в присутствии ионов Fe2+ и пероксида водоро-
да (реактив Фентона) [26]. Авторы этих работ
нольных соединений. Поскольку ионы Fe2+ рас-
продемонстрировали наличие у кверцетина, ру-
сматриваются в качестве одного из инициаторов
тина и кофеиновой кислоты не только антиради-
оксидативного стресса in vivo, можно предполо-
кальных свойств, но и способности связывать ио-
жить, что защита экстрактами мате биологиче-
ских мембран от свободнорадикального повре-
ны Fe2+, тогда как у хлорогеновой кислоты была
ждения осуществляется с участием тех же меха-
выявлена способность образовывать комплексы с
низмов.
ионами Fe3+.
Можно предположить, что при добавлении
водного извлечения из мате к суспензии липосом
КОНФЛИКТ ИНТЕРЕСОВ
входящие в их состав БАВ перераспределяются
Авторы заявляют об отсутствии конфликта
между водной и липидной фазой. БАВ, находя-
интересов.
щиеся в растворе, связывают ионы Fe2+, вызывая
эффекты, сходные с хелаторами. В то же время
БАВ, встроившиеся в липосомальные мембраны,
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
перехватывают липидные радикалы, действуя как
Настоящая работа не содержит описания ис-
цепь-обрывающие антиоксиданты. Из работы
следований с использованием людей и животных
[13] следует, что главную роль в инициировании
в качестве объектов.
ПОЛ липосом играют ионы Fe2+, которые связы-
ваются с поверхностью липидного бислоя. Нель-
СПИСОК ЛИТЕРАТУРЫ
зя исключить, что полифенольные соединения
мате, встроившиеся в липидную фазу, способны
1. A. Gawron-Gzella, J. Chanaj-Kaczmarek, and
оказывать влияние на каталитическую актив-
J. Cielecka-Piontek, Nutrients, 13 (11), 3706 (2021).
ность этих ионов. Вклад железосвязывающей ак-
2. A. T. Valduga, I. L. Gonçalves, E. Magri, and
тивности в общий механизм антиоксидантного
J. R. Delalibera Finzer, Food Res. Int., 120,
478
действия рутина, кофеиновой и хлорогеновой
(2019).
кислот в липосомальной модельной системе, по-
3. S. Dudonné, X. Vitrac, P. Coutière, et al., J. Agric.
видимому, больше, чем у кверцетина. Однако по
Food Chem., 57 (5), 1768 (2009).
сравнению с перечисленными веществами по-
следний обладает наименьшим значением IС50,
4. C. Anesini, S. Turner, L. Cogoi, and R. Filip, LWT -
что позволяет говорить о его более высокой анти-
Food Science and Technology, 45, 299 (2012).
радикальной активности.
5. Yu. O. Teselkin, I. V. Babenkova, L. A. Pavlova, et al.,
Способность водных экстрактов мате оказы-
Biophysics, 66 (1), 125 (2021).
вать антиоксидантное действие на процесс ПОЛ
6. E. Rząsa-Duran, A. Kryczyk-Poprawa, D. Drabicki,
подтверждена в экспериментах на животных, на-
et al., Antioxidants (Basel), 11 (2), 371 (2022).
пример интактных мышах [27], а также на моде-
7. G. R. Schinella, G. Troiani, V. Dávila, et al., Biochem.
лях гиперхолестеринемии [28], иммобилизаци-
Biophys. Res. Commun., 269 (2), 357 (2000).
онного стресса [29], острого инфаркта миокарда
8. M. Valko, D. Leibfritz, J. Moncol, et al., Int. J. Bio-
[30]. В исследованиях с участием здоровых добро-
chem. Cell Biol., 39 (1), 44 (2007).
вольцев установлено уменьшение содержания
продуктов липидной пероксидации в плазме/сы-
9. K. Jomova and M. Valko, Toxicology, 283 (2-3), 65
воротке крови и повышение некоторых показате-
(2011).
лей антиоксидантной системы после продолжи-
10. H. Sies and D. P. Jones, Nat. Rev. Mol. Cell Biol., 21
тельного употребления водных извлечений из ма-
(7), 363 (2020).
те [31] или капсул, содержащих сухой экстракт
11. Y. A. Hajam, R. Rani, and S. Y. Ganie, Cells, 11 (3),
мате, полученный на основе водного извлечения
552 (2022).
[32]. К настоящему времени на основании ре-
зультатов многочисленных исследований сложи-
12. E. Gammella, S. Recalcati, and G. Cairo, Oxidative
лось мнение, что водные экстракты мате могут
Medicine and Cellular Longevity, 2016,
8629024
использоваться для профилактики и лечения за-
(2016).
БИОФИЗИКА том 67
№ 4
2022
688
ТЕСЕЛКИН и др.
13. E. Driomina, V. Sharov, and Yu. A. Vladimirov, Free
23. L. A. Romodin, Acta Naturae, 13 (3), 90 (2021).
Radic. Biol. Med., 15 (3), 239 (1993).
24. A. O. Ademosun, G. Oboh, F. Bello, and P. O. Ayeni,
14. Y. A. Vladimirov, E. V. Proskurnina, and D. Yu. Izma-
J. Evid. Based Complementary Altern. Med., 21 (4),
jlov, Biophysics, 56 (6), 1055 (2011).
NP 11 (2016).
15. S. Batzri and D. E. Korn, Biochim. Biophys. Acta, 298
25. Y. Kono, S. Kashine, T. Yoneyama, et al., Biosci. Bio-
(4), 1015 (1973).
technol. Biochem., 62 (1), 22 (1998).
16. Yu. A. Vladimirov and E. V. Proskurnina, Biochemistry
26. T. C. Genaro-Mattos, Â. Q. Maurício, D. Rettori,
(Moscow), 74 (13), 1545 (2009).
et al., PloS One, 10 (6), 1 (2015).
17. K. A. Berté, M. R. Beux, P. K. Spada, et al., J. Agric.
27. F. Martins, A. J. Suzan, S. M. Cerutti, et al., Br. J.
Food Chem., 59 (10), 523 (2011).
Nutr., 101 (4), 527 (2009).
18. M. Bojić, V. Simon Haas, D. Sarić, and Z. Maleš, J.
28. L. Bravo, R. Mateos, B. Sarriá, et al., Fitoterapia, 92,
Anal. Methods Chem., 2013, 658596 (2013).
219 (2014).
19. G. Jones, S. K. Goswami, H. Kang, et al., Nanomedi-
29. A. C. Colpo, M. E. de Lima, M. Maya-López, et al.,
cine (Lond.), 15 (13), 1341 (2020).
Appl. Physiol. Nutr. Metab., 42 (11), 1172 (2017).
20. D. Bellotti and M. Remelli, Molecules, 26 (11), 3255
30. L. F. González Arbeláez, J. C. Fantinelli, A. Ciocci
(2021).
Pardo, et al., Food Funct., 7 (2), 816 (2016).
21. D. Yu. Yegorov, A. V. Kozlov, O. A. Azizova, and
31. R. L. Matsumoto, D. H. Bastos, S. Mendonça, et al., J.
Yu. A. Vladimirov, Free Radic. Biol. Med., 15 (6), 565
Agric. Food Chem., 57 (5), 1775 (2009).
(1993).
32. A. M. Becker, H. P. Cunha, A. C. Lindenberg, et al.,
22. Z. Cheng and Y. Li, Chem. Rev., 107 (3), 748 (2007).
Plant Foods Hum. Nutr., 74 (4), 495 (2019).
Inhibitory Effect of Aqueous Extract from Yerba Mate (Ilex paraguariensis)
on the Process of Lipid Peroxidation of Liposomal Membranes
Yu.O. Teselkin*, I.V. Babenkova*, A.A. Kochetova*, and A.N. Osipov*
*Pirogov Russian National Research Medical University, Ministry of Healthcare of the Russian Federation,
ul. Ostrovityanova 1, Moscow, 117997 Russia
The effect of aqueous extract from yerba mate (Ilex paraguariensis) on the Fe2+-induced lipid peroxidation in
phospholipid liposomal membranes was investigated. The process of lipid peroxidation in liposomes was ex-
plored based on the kinetic curves of chemiluminescent reactions in the presence of coumarin C-525. With
increasing concentration of aqueous extract from yerba mate in the liposome suspension, a rise in the time
period within which the “slow flash” of chemiluminescence reached its maximum value and a decrease of its
intensity were observed. This indicates a decrease in the oxidation rate of Fe2+ and a decrease in the rate form-
ing lipid radicals, respectively. Similar results were obtained after addition of classical radical inhibitors bu-
tylhydroxytoluene and trolox to liposomes. However, unlike radical inhibitors, a further increase in the con-
centration of aqueous extract from mate in the liposomal suspension (more than 2.5 μg of dry plant raw ma-
terial/ml) was accompanied by a gradual decrease in the time period within which the “slow flash” of
chemiluminescence reached its maximum value, which was typical of the action of iron chelating agents
(EDTA and deferoxamine) and caused by a decreased time of Fe2+ oxidation to the critical concentration. It
can be supposed that biologically active substances in the composition of aqueous extract from mate exhibit
both their radical scavenging activity and iron binding ability. The effects of some polyphenolic compounds
from the composition of aqueous extracts from mate (quercetin, rutin, chlorogenic acid and caffeic acid) on
the Fe2+-induced liposome chemiluminescence were studied. It has been established that quercetin in a lipo-
some-based model system acted as radical inhibitor. Our study showed that rutin, caffeic acid and chlorogen-
ic acid exhibit a mixed type of action, they can act as radical scavengers and iron binding agents. Thus, inhi-
bition of Fe2+-induced lipid peroxidation in biological membranes can be one of the mechanisms for antiox-
idant effects of yerba mate observed in vivo.
Keywords: yerba mate, Ilex paraguariensis, liposomes, lipid peroxidation, iron ions, polyphenolic compounds, an-
tioxidants, chemiluminescence
БИОФИЗИКА том 67
№ 4
2022