БИОФИЗИКА, 2022, том 67, № 4, с. 763-775
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 577.353
ЧИСЛЕННОЕ МОДЕЛИРОВАНИЕ РАБОТЫ ЛЕВОГО ЖЕЛУДОЧКА
СЕРДЦА В СИСТЕМЕ КРОВООБРАЩЕНИЯ: ЭФФЕКТЫ ИЗМЕНЕНИЯ
ЧАСТОТЫ СОКРАЩЕНИЙ И АПИКАЛЬНОГО ИНФАРКТА МИОКАРДА
© 2022 г. Ф.А. Сёмин*, #, А.Р. Хабибуллина*, А.К. Цатурян*
*Научно-исследовательский институт механики Московского государственного университета
имени М.В. Ломоносова, Мичуринский просп., 1, Москва, 119192, Россия
#E-mail: f.syomin@imec.msu.ru
Поступила в редакцию 20.04.2022 г.
После доработки 20.04.2022 г.
Принята к публикации 25.04.2022 г.
Представлена многомасштабная математическая модель работы левого желудочка сердца в системе
кровообращения. Для описания свойств миокарда левого желудочка использована новая электро-
механическая модель, объединяющая модели генерации и распространения потенциалов действия,
электромеханического сопряжения и механики. При этом были учтены пассивные и активные ме-
ханические напряжения и конечность деформаций. Сам желудочек аппроксимирован толстостен-
ным телом вращения с реалистичным распределением направления мышечных волокон в его стен-
ке. Остальные камеры сердца и элементы сосудистого русла представлены моделью с сосредоточен-
ными параметрами. Проведено численное моделирование влияния частоты сердечных
сокращений, частичной блокады проведения возбуждения от предсердий к желудочкам и апикаль-
ного инфаркта на гемодинамику и геометрию левого желудочка в сердечном цикле. Расчеты пока-
зали, что модель описывает наблюдаемые реакции насосных характеристик сердца на эти воздей-
ствия. Результаты работы позволяют понять, как особенности электромеханического сопряжения в
миокарде, реализуемые на клеточном уровне, помогают поддерживать макроскопическую насос-
ную функцию сердца при патологиях и подстраивать ее к возрастающим потребностям при физи-
ческой нагрузке.
Ключевые слова: миокард, электромеханика сердца, левый желудочек сердца, сердечно-сосудистая
система, математическое моделирование, моделирование сердца, сердечный ритм, инфаркт миокарда,
атриовентрикулярная блокада.
DOI: 10.31857/S0006302922040159, EDN: IULMNY
действия (ПД), распространяющегося по сердеч-
Несмотря на значительный прогресс в разви-
ной мышце - миокарду. Процесс электромехани-
тии методов диагностики и лечения сердечно-со-
ческого сопряжения обеспечивает потенциал-за-
судистых заболеваний, достигнутый в последние
висимое изменение концентрации различных ве-
десятилетия, именно эти заболевания по-
ществ, в первую очередь, ионов Са2+ в
прежнему являются наиболее частой причиной
смерти в развитых и развивающихся странах.
кардиомиоцитах, обратимое связывание Са2+ с
регуляторными белками, управляющее взаимо-
Трудность понимания природы заболеваний
действием сократительных белков актина и мио-
сердца и оценки эффективности различных под-
зина, и, наконец, развитие активных механиче-
ходов к их лечению в значительной степени свя-
ских напряжений и деформаций в стенках камер
зана с тем, что в основе работы сердца лежит
сердца. Активные напряжения, возникающие в
сложная цепочка процессов, происходящих на
результате актин-миозинового взаимодействия,
молекулярном, клеточном, тканевом и, наконец,
вызывают сокращение стенок камер сердца и вы-
органном уровне. Эти процессы включают в себя
брос крови в артерии малого и большого круга
ионные токи через мембраны клеток сердечной
кровообращения. В силу сложности и взаимоза-
мышцы, кардиомиоцитов, приводящие к элек-
висимости этих процессов одним из полезных
трической активации, т.е. генерации потенциала
инструментов изучения работы сердца на разных
масштабных уровнях в норме и при патологиях
Сокращения: ПД - потенциал действия, ЛЖ - левый
желудочек, ОДУ
- обыкновенные дифференциальные
оказывается математическое моделирование [1-
уравнения.
3]. Наиболее развитым направлением математи-
763
764
СЁМИН и др.
ческого моделирования, отчасти уже нашедшим
дистой системы в норме и при некоторых патоло-
применение в клинической практике, является
гиях, включая нарушения проведения волны воз-
моделирование электрофизиологических про-
буждения от предсердий к ЛЖ, стеноза или
цессов [4]. Моделирование механических про-
недостаточности аортального и митрального кла-
цессов, происходящих на уровне отдельных
панов и при нарушениях связывания ионов Са2+
кардиомиоцитов, миокардиальной ткани и серд-
с регуляторными белками в кардиомиоцитах, ха-
ца как органа, развито гораздо меньше. Наконец,
рактерных для некоторых врожденных кардио-
набор процессов и экспериментально наблюдае-
миопатий. В этих работах была использована мо-
мых явлений, описываемых существующими
дель механики сердечной мышцы [8], в которой
электромеханическими моделями миокарда, а,
концентрацию ионов Са2+ в кардиомиоцитах по-
тем более, многомасштабными моделями насос-
лагали заданной функцией времени. Процессы
ной функции сердца, как правило, весьма огра-
генерации и распространения ПД по миокарду
ничен.
ЛЖ при этом не учитывали, как и процесс элек-
Нашей группой недавно была предложена
тромеханического сопряжения. В данной работе
электромеханическая модель сердечной мышцы
насосную функцию ЛЖ сердца моделировали с
[5], которая объединяет модифицированные вер-
помощью полной электромеханической модели
сии феноменологической модели электрофизио-
[5] и исследовали влияние изменения частоты
логии миокарда [6], модели электромеханическо-
сердечных сокращений и нарушения проведения
го сопряжения [7] и модели механики миокарда
и возбуждения при апикальном инфаркте мио-
[8]. Эта новая модель описывает широкий круг
карда на системную и легочную гемодинамику и
экспериментально наблюдаемых явлений: зави-
геометрию ЛЖ в цикле сокращения-расслаб-
симость длительности ПД и амплитуды сокраще-
ления.
ний от длительности интервалов между стимула-
ми и частоты стимуляции, быстрые и медленные
ответы активного механического напряжения на
МАТЕРИАЛЫ И МЕТОДЫ
изменение длины мышцы, связь сила-скорость и
В данной работе использовали модели, ранее
жесткость-скорость в активно сокращающейся
разработанные нашей группой и другими автора-
сердечной мышце, грузозависимое расслабление
ми. Модели осесимметричной аппроксимации
и др. Вопрос о том, насколько такая модель спо-
левого желудочка сердца и сердечно-сосудистой
собна описать изменения работы сердца, в
системы подробно описаны в работах [9, 10]. Для
первую очередь, его наиболее мощного отдела,
описания электромеханики миокарда в стенке
левого желудочка (ЛЖ), при физической нагруз-
ЛЖ использовали недавно разработанную нами
ке, которая сопровождается увеличением частоты
модель [5].
сокращений и снижением периферического со-
противления, остается открытым. Также неиз-
Модель электромеханики миокарда. Для описа-
вестно, способна ли такая модель описать нару-
ния распространения волны электрической акти-
шения насосной функции левого желудочка
вации по стенке ЛЖ, его механического сокраще-
сердца в системе кровообращения, наблюдаемые
ния и электромеханического сопряжения ис-
при различных заболеваниях, например, при
пользовали модель [5]. Эта модель объединяет в
остром апикальном инфаркте ЛЖ или при ча-
себе несколько блоков. Блок модели, описываю-
стичной блокаде проведения ПД от предсердий к
щий электрофизиологию кардиомиоцита, пред-
желудочкам.
ставляет собой феноменологическую модель
Ранее мы построили многомасштабную осе-
Алиева-Панфилова [6], задаваемую двумя урав-
симметричную модель работы ЛЖ в системе кро-
нениями: уравнением в частных производных для
вообращения, которая исходно включала только
безразмерной величины разности электрическо-
большой круг кровообращения [9], а затем была
го потенциала u на мембране кардиомиоцитов и
расширена за счет добавления описания сокра-
обыкновенных дифференциальных уравнений
щений правого желудочка и предсердий, а также
(ОДУ) для кинетической переменной v, характе-
малого круга кровообращения [10]. Модель при-
ризующей ионные токи через мембрану клетки.
менили для исследования работы сердечно-сосу-
Уравнения для u и v имели следующий вид [6]:
∂u
ku(u -a)(u
−1)
+
uv
=
div(Dgrad(u))
−
+
I
stim
,
∂t
τ
(1)
dv
=
ψ
(u,v)
,
dt
БИОФИЗИКА том 67
№ 4
2022
ЧИСЛЕННОЕ МОДЕЛИРОВАНИЕ РАБОТЫ ЛЕВОГО ЖЕЛУДОЧКА
765
где D - тензор проводимости, а вид функции ψ
изотропную несжимаемую сплошную среду, в ко-
приведен в работе [6], Istim - стимулирующий
торой развиваются пассивные напряжения в от-
ток, который задавали в некоторой области ЛЖ,
вет на деформацию и активные напряжения,
чтобы промоделировать его электрическое воз-
вызванные механо-химическими процессами,
буждение, передаваемое по проводящей системе
происходящими на клеточном уровне. Ось транс-
сердца. Модель Алиева-Панфилова успешно вос-
версальной изотропии направлена вдоль мышеч-
производит основные особенности динамики
ных волокон: активные механические напряже-
ПД: порог возбуждения, период рефрактерности
ния, вызванные силами, действующими вдоль
и реституцию (уменьшение длительности ПД в
ответ на возрастание частоты стимуляции).
волокна на площадку, перпендикулярную волок-
ну, значительно превышают другие компоненты
Механический блок модели [5] основан на мо-
дели механики миокарда [8]. В рамках этой моде-
напряжений. Определяющее соотношение для
ли миокард рассматривали как трансверсально-
механического напряжения T записывали в виде
∂Φ(I
1
,I
2
)
∂Φ(I
1
,I
2
)
∂Φ(I
1
,I
2
)
2
T
=
+
I
F
−
F
−
pE
+
B(T
+T
),
(2)
1
tit
A
∂I
1
∂I
2
∂I
2
учитывая гиперупругий изотропный ответ на де-
переменных набора wj, характеризующих процес-
формацию, определяемый упругим потенциалом
сы второй и третьей групп, можно выделить кон-
Φ, и напряжения, вызванные силами, действую-
центрацию комплексов, образованных ионами
щими вдоль мышечных волокон. В уравнении (2)
кальция Ca2+ с регуляторными белками в зоне
F - тензор меры деформации Фингера, а I1 и I2 -
перекрытия нитей и вне ее, и концентрации сво-
его первый и второй инварианты; E - единичный
бодных ионов Ca2+ в цитоплазме клеток миокар-
метрический тензор, p - множитель Лагранжа,
да, которые, собственно, и связываются с регуля-
характеризующий давление, вызванное несжима-
торными белками, запуская актин-миозиновое
емостью материала; B - тензор анизотропии, рав-
взаимодействие. В свою очередь, увеличение
ный диаде единичного вектора, направленного
вдоль мышечного волокна в деформированном
концентрации Ca2+ в цитоплазме происходит в
миокарде. Ttit описывает нелинейно упругий от-
результате обмена ионами Ca2+ между различны-
вет на деформацию мышечного белка титина,
ми вне- и внутриклеточными структурами: сар-
расположенного вдоль мышечных волокон, и за-
коплазматическим ретикулумом и узким зазором
дается выражением для силы длинных полимер-
между мембранами клетки и саркоплазматиче-
ных цепей (worm-like chain) [8].
ским ретикулумом. Концентрации Ca2+ в этих
Активное напряжение TA определяли из систе-
структурах также были включены в число кинети-
мы ОДУ, записываемых для множества кинетиче-
ческих переменных wj. Описание межфазного об-
ских переменных wj. Это множество включается в
мена Ca2+, включающего пассивный и активный
себя переменные, характеризующие следующие
транспорт, было заимствовано из работы [7] с не-
группы процессов: взаимодействие сократитель-
которыми изменениями и упрощениями, позво-
ных белков актина и миозина в кардиомиоците,
лившими уменьшить жесткость системы кинети-
взаимодействие регуляторных белков кардио-
ческих ОДУ и увеличить шаг по времени при чис-
миоцита с ионами кальция Ca2+ и обмен Ca2+
ленном интегрировании уравнений [5]. Отметим,
между вне- и внутриклеточными фазами. TA зада-
что межфазный транспорт Ca2+ зависит от мем-
вали как функцию двух переменных первой груп-
бранного потенциала u. Это является одним из
пы: количества комплексов вступивших во взаи-
ключевых механизмов электромеханического со-
модействие сократительных белков, образующих
пряжения: ряда процессов, благодаря которым
так называемые поперечные мостики, и их сред-
электрическая стимуляция приводит к активации
ней микродеформации, а также длины области
сокращения ионами кальция и сокращению
перекрытия нитей актина и миозина, зависящей
мышцы. В общем случае, когда емкость клеточ-
от длины LS структурной единицы поперечно-
ной мембраны или проводимость миокарда зави-
полосатых мышц - саркомера. Необходимо отме-
сят от деформации, при решении задачи необхо-
тить, что скорость изменения микродеформации
димо решать уравнения движения (или равнове-
поперечных мостиков зависит от скорости де-
сия) для объекта, состоящего из миокардиальной
формации мышцы, а некоторые из процессов
ткани совместно с первым уравнением системы
массообмена ионов Ca2+и их взаимодействия с
(1), а в систему ОДУ для wj необходимо включать
регуляторными белками зависят от LS и u. Среди
уравнение для v из системы уравнений (1).
БИОФИЗИКА том 67
№ 4
2022
766
СЁМИН и др.
Выражение для активных напряжений TA и ки-
дель задается нежесткой системой ОДУ, что поз-
нетические уравнения для wj имеют следующий
воляет численно интегрировать уравнения явным
вид:
методом Эйлера с относительно большим шагом
по времени. Модель также включает в себя описа-
T
A
=
f
(
w
j
,L
S
),
ния механо-кальциевой и механо-электрической
dw
dL
(3)
i
s
обратных связей, что позволяет исследовать вли-
=
g
j
w
j
,L
S
,
,u
dt
dt
яние деформаций как на электромеханику кар-
Как показано в работах [5, 8], такая модель
диомиоцита, так и на сердечную функцию в
успешно воспроизводит важные эффекты повы-
целом.
шения пиковой силы и ускорения расслабления
Аппроксимация левого желудочка сердца. В
мышцы при повышении частоты электрической
рамках модели геометрию ЛЖ аппроксимирова-
стимуляции, мгновенный и медленный ответы
развиваемой силы на изменение длины мышцы
ли телом вращения, задаваемым в криволиней-
(закон сердца Франка-Старлинга). При этом, в
ных координатах γ и ψ, характеризующих поло-
отличие от детальных электрофизиологических
жение точки по толщине стенки и от основания к
моделей и ранней версии нашей модели [8], мо-
верхушке соответственно, согласно уравнениям
r
=
(r
in
+
γ(r
out
−
r
in
))(εcos ψ
+
(1
−
ε)(1
−
sin ψ)),
(4)
z
=
(h
in
+
γ(h
out
−
h
in
))(1
−
sin ψ)
+
(1 −
γ)(h
out
−
h
in
),
где rin и rout - внутренний и внешний радиус при
слагаемое, соответствующее жестким коллагено-
координате ψ = 0, а hin и hout - расстояния по оси
вым волокнам, расположенным в окружном на-
правлении. Считали, что концентрация коллаге-
симметрии между основанием желудочка и
новых волокон растет с уменьшением ψ и от
наиболее удаленной от основания точкой на
внешней границы стенки к внутренней. Кроме
внутренней и внешней поверхности желудочка
того, вводили дополнительное изотропное меха-
соответственно. Параметр ε отвечает за измене-
ническое напряжение в области верхушки, зави-
ние формы тела вращения от конуса при ε = 0 до
сящее от концентрации взаимодействующих со-
более изогнутого сечения при ε = 1. Этот пара-
кратительных белков, что позволяло грубо ап-
метр выбран больше единицы, чтобы описать
проксимировать более хаотичное расположение
сужение желудочка в области клапанного кольца,
ориентации волокон в этой области, наблюдае-
располагающегося у основания желудочка. Ха-
мое в сердцах человека и животных с помощью
рактерные размеры желудочка составляли 2-3 см
ЯМР. Детали аппроксимации ЛЖ и параметры,
по радиальной координате и 7-8 см по осевой ко-
определяющие форму желудочка, приведены в
ординате. Толщина стенки в конце систолы была
работе [9].
около 1 см. Также задавали ход мышечных воло-
кон f0 в недеформированном состоянии. Волокна
Модель сердечно-сосудистой системы. Пред-
сердия, правый желудочек и несколько разделов
были направлены по спиралям, угол наклона ко-
кровеносного русла (аорту, крупные артерии и
торых менялся при продвижении от внутренней
вены большого и малого кругов кровообращения)
поверхности стенки ЛЖ к наружной. Материал
описывали моделью с сосредоточенными пара-
стенки желудочка описывали моделью, изложен-
метрами. Для давлений в предсердиях и правом
ной выше. При этом учитывали дополнительные
желудочке выделяли пассивную PPas и активную
локальные изменения свойств материала. В обла-
сти сужения клапана вводили дополнительное
PAct части, задаваемые уравнениями вида
E
V t)
E
V t)
∂V
t)
2
2
0
P
=
E
⋅
e
−
e
+
μ
,
Pas
1
1
∂t
(5)
∂
Act
P t)
∂
V t)
τ
+
P t)
=
F e t)
,
V t))
⋅
μ
+
E
Act
Act
2
2
∂
t
∂
t
Функция FAct, зависящая от косинусоидаль-
вали как упругие резервуары с постоянными по-
ной функции активации e(t) и объема камеры V,
датливостями Cr, давлениями Pr, расходами
обеспечивала выполнение закона Франка-
крови на входе Qrin и выходе Qrout и объемами Vr
Старлинга: рост пикового систолического дав-
(тут r - номер соответствующего участка сосу-
ления с ростом конечно-диастолического объе-
дистого русла). Уравнения гемодинамики запи-
ма. Другие части сосудистого русла рассматри-
сывали в виде
БИОФИЗИКА том 67
№ 4
2022
ЧИСЛЕННОЕ МОДЕЛИРОВАНИЕ РАБОТЫ ЛЕВОГО ЖЕЛУДОЧКА
767
dP
r
dV
r
dQ
rin
C
=
=
Q
−Q
,
L
+
R
Q
=
P
−
P
,
(6)
r
rin
rout
r
r
rin
r
r+1
dt
dt
dt
где Lr и Rr - инерционное и гидравлическое со-
до -55○ на внешней стенке (γ = 1). Компоненты
противления потоку; r - индекс, характеризую-
тензора проводимости вдоль и поперек мышеч-
щий данный участок сосудистого русла. Учиты-
ных волокон составляли 65 и 7 см2/с соответ-
вали артериальный и венозные отделы большого
ственно. Проводящую систему ЛЖ моделировали
и малого кругов кровообращения и перифериче-
добавлением тонкого слоя проводящих волокон,
ские сопротивления между ними; в большом кру-
расположенных у внутренней поверхности ЛЖ и
ге раздельно учитывали аорту и более мелкие ар-
направленных вдоль этой поверхности в плоско-
терии, что позволило приблизить форму кривой
сти осевого сечения ЛЖ. Проводимость вдоль
давления в аорте к наблюдаемой у человека. Мо-
этих волокон, моделирующих волокна Пуркинье
дель гемодинамики была детально описана в ра-
в 2D-осесимметричной постановке, была увели-
боте [10].
чена до 174 см2/с, а проводимость поперек этих
волокон была такой же, как и для рабочего мио-
Постановка задачи и метод ее численного реше-
карда ЛЖ. При моделировании реакции системы
ния. Основной задачей данного исследования бы-
кровообращения на физическую нагрузку одно-
ло моделирование эффектов частоты сердечного
временно повышали частоту сердечных сокраще-
ритма и нарушений возбудимости, проводимости
ний с 1 до 2 Гц и снижали периферическое сопро-
и сократительной способности стенки ЛЖ при
верхушечном (апикальном) инфаркте на его
тивление большого круга с 1600 до 800 дин·с/см5,
функцию. При этом на данной стадии исследова-
чтобы воспроизвести так называемую «рабочую
ния не планировали изучение влияния деформа-
гиперемию», т.е. увеличение диаметров прека-
ций на процессы распространения в стенке ЛЖ
пиллярных сосудов в работающих скелетных
волн электрической активации, поскольку кор-
мышцах.
ректно описать такое влияние в рамках осесим-
Механику стенки ЛЖ описывали уравнением
метричной модели ЛЖ невозможно. В связи с
равновесия
этим в целях упрощения пренебрегали зависимо-
∇T = 0
(7)
стью емкости кардиомиоцита от деформаций и
полагали, что скорость проведения сохраняется в
для тензора механических напряжений (2). Инер-
материальных координатах деформированного
ционные силы не учитывали, поскольку они ма-
лы по сравнению с механическими напряжения-
базиса. При этих предположениях поставленную
задачу можно разбить на две отдельные задачи:
ми. Граничные условия для напряжений на внут-
задачу о распространении волны электрической
ренней и внешней поверхностях ЛЖ имели вид
активации по недеформированному ЛЖ и задачу
T·n = -PLV·n и T·n = 0 соответственно. Таким об-
о сокращении ЛЖ в системе кровообращения.
разом, напряжение на внутренней границе стен-
Постановка первой задачи включает уравнение
ки ЛЖ было равно давлению крови в его полости,
(1) с граничными условиями «непротекания»
а напряжениями на его внешней поверхности
электрического тока вида Dgrad(u)n, где n -
пренебрегали. На верхней поверхности основа-
внешняя нормаль к поверхности ЛЖ. Начальное
ния ЛЖ задавали нулевые осевые и угловые пере-
значение u во всей области стенки ЛЖ было рав-
мещения, чтобы избежать его движений как твер-
но нулю; начальное значение v во всей области
дого тела.
полагали равным ее значению, полученному при
Напряжения выражали через компоненты
решении нульмерной задачи о периодической
вектора перемещений и переменные wj, для опре-
стимуляции и однородном сокращении цилин-
деления которых решали систему обыкновенных
дрического волокна сердечной мышцы под по-
дифференциальных уравнений (3) во всех точках
стоянной нагрузкой. Активацию запускали
стенки ЛЖ. Наконец, систему уравнений замы-
внешним периодическим стимулирующим током
кали уравнения гемодинамики (5) и (6). В каче-
Istim длительностью 3 мс, приложенным к точке
стве начальных условий задавали начальные объ-
на внутренней стенке желудочка в области вер-
емы камер сердца, давление в сосудах разного ти-
хушки. Форму левого желудочка строили соглас-
па, нулевые расходы между участками сердечно-
но уравнению (4), подобрав параметры так, чтобы
сосудистой системы и однородные по простран-
объем ЛЖ был равен примерно 45 мл, что соот-
ству распределения wj, полученные при решении
ветствует его состоянию в конце систолы. Мы-
нульмерной задачи о периодической стимуляции
шечные волокна направляли вдоль спиралей, за-
и сокращении цилиндрического волокна сердеч-
кручивающихся вокруг поверхностей γ = const с
ной мышцы под постоянной нагрузкой. Так как
углом наклона к основанию, меняющимся ли-
форма желудочка, использованная в задаче об
нейно по γ от +80○ на внутренней стенке (γ = 0)
электрической активации, не соответствует нена-
БИОФИЗИКА том 67
№ 4
2022
768
СЁМИН и др.
груженному состоянию (давление в желудочке
(параметр a в уравнении (1)) в пять раз и умень-
перед началом диастолы может быть отрицатель-
шали правую часть первого уравнения (1) также в
ным), то мы находили ненагруженное состояние
пять раз, что соответствовало ухудшению прово-
следующим образом. Сначала начинали расчет с
димости ткани и снижению величин ионных то-
конечно-систолической формы ЛЖ с длинами
ков в данной области. При этом не затрагивали
саркомеров миокарда стенки желудочка, равны-
проводящую способность и возбудимость в райо-
ми 1.7 мкм, считая это исходное состояние нена-
не, в котором моделировали расположение воло-
груженным. Затем мы моделировали заполнение
кон Пуркинье. Чтобы обеспечить непрерывность
кровью расслабленного ЛЖ до тех пор, пока зна-
значений параметров модели в миокарде стенки
чение длин саркомеров в большей части его стен-
желудочка, «пораженную» область склеивали со
ки не становилось равным 1.9 мкм, что примерно
«здоровой» переходным участком, в котором ко-
соответствует началу диастолы, во время которой
эффициент повышения порога задавали выраже-
давление в ЛЖ близко к нулю. Эту форму прини-
нием
мали за ненагруженное состояние (отчетную кон-
(
1−
a
inf
0
)(
z - z
0
)
фигурацию) во всех приведенных здесь расчетах.
a
=
+1,
inf
z
0
−
z
1
Таким образом, первая задача состояла в ре-
шении системы уравнений (1) с граничными
где ainf0 = 5, а коэффициент, характеризующий
условиями непротекания тока и локальным
уменьшение величины ионных токов в правой
внешним воздействием в виде стимулирующего
части уравнения (1), выражением
тока Istim. Результаты расчета поля потенциала u в
(
1
−
b
)(
z - z
)
inf0
1
различных точках стенки ЛЖ были использованы
b
=
b
+
inf
inf0
при решении второй, механической задачи. Эта
z
0
−
z
1
задача состояла в решении уравнения равновесия
В этих выражениях z0 и z1 - осевые координа-
(7) с соответствующими граничными условиями
ты границы переходного участка с областями со-
с одновременным решением системы ОДУ (3), в
ответственно «здорового» миокарда и миокарда,
правую часть которой входит u. Систему уравне-
пораженного инфарктом, binf0 = 0.2.
ний замыкали уравнения (5) и (6), которые зада-
вали связь напряжений в стенке ЛЖ с гемодина-
микой.
РЕЗУЛЬТАТЫ
Обе задачи решали методом конечных элемен-
Расчет сокращения ЛЖ проводили до установ-
тов, сформулированным в малых приращениях.
ления периодического режима. Временной ход
На каждом шаге по времени уравнения линеари-
основных гемодинамических переменных, полу-
зовали по малым приращениям неизвестных ве-
ченный в результате решения задачи о сокраще-
личин: безразмерного потенциала u (для задачи
нии сердца в системе кровообращения с частотой
активации) и перемещений, давлений, т.е. мно-
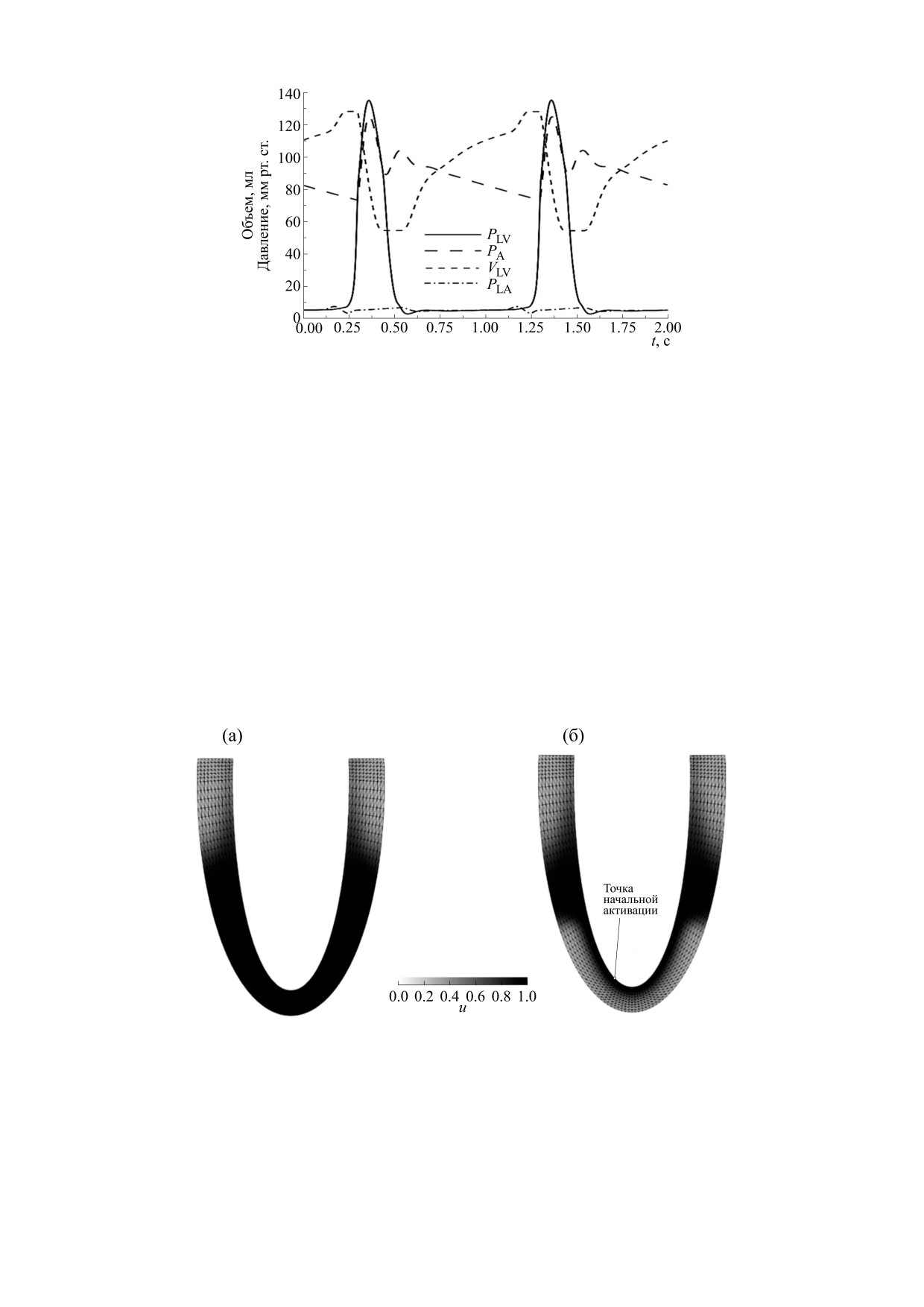
60 ударов в минуту, показан на рис. 1.
жителей Лагранжа (2) в узлах и внутри конечных
При преднагрузке (конечно-диастолическом
элементов в стенке ЛЖ, а также давления крови в
давлении в ЛЖ), равной 6.5 мм рт. ст. при объеме
ЛЖ (для задачи сокращения). Использовали тре-
128 мл и лежащей в диапазоне значений, харак-
угольную сетку с линейной аппроксимацией пе-
терном для здорового сердца человека в покое,
ремещений и потенциала и одним неизвестным
были получены величины давлений и объемов
множителем Лагранжа на каждые два треуголь-
камер сердца, также характерные для здорового
ных элемента. Первое уравнение из системы
сердца. Максимальное и минимальное давления
уравнений (1) и уравнение (7), записываемые для
в аорте, равные 125 и 73 мм рт. ст. соответствен-
каждого узла, интегрировали по всем элементам,
но, были близки к их нормальным значениям.
содержащим данный узел, методом квадратуры
Ударный объем (объем крови, выброшенный из
Гаусса по трем точкам. ОДУ на переменные wj (3)
желудочка в систолу) и фракция выброса (отно-
решали в каждой точке интегрирования явным
шение ударного объема к конечно-диастоличе-
методом Эйлера, используя полученное решение
скому) при данной преднагрузке равнялись 74 мл
на следующем шаге для вычисления компонент
и 58% соответственно.
матрицы жесткости (матрицы перед столбцом
Результаты моделирования распространения
малых неизвестных приращений переменных за-
электрической активации по ЛЖ с областью ин-
дачи).
фаркта показали отсутствие распространения ПД
Моделирование апикального инфаркта миокар-
в область верхушки за исключением области во-
да. Для моделирования острого инфаркта ЛЖ в
локон Пуркинье. На рис. 2 показана карта акти-
области верхушки выделяли область, занимаю-
вации для случаев нормального ЛЖ (рис. 2а) и
щую примерно треть высоты недеформированно-
ЛЖ с апикальным инфарктом (рис. 2б) спустя 60
го желудочка, в которой изменяли следующие па-
мс после начала очередного внешнего возбужда-
раметры модели: повышали порог возбуждения
ющего стимула. Задержка распространения ПД
БИОФИЗИКА том 67
№ 4
2022
ЧИСЛЕННОЕ МОДЕЛИРОВАНИЕ РАБОТЫ ЛЕВОГО ЖЕЛУДОЧКА
769
Рис. 1. Временной ход основных переменных левого сердца, полученный в результате моделирования сокращения
сердца с частотой 1 Гц. Показаны значения давления (PLV) и объема (VLV) левого желудочка, а также давление в левом
предсердии (PLA) и аорте (PA). Давления приведены в мм рт. ст., объемы - в мл. Расшифровка типов линий для
каждой из переменных приведена на рисунке.
по стенке ЛЖ в норме (рис. 2а) составляла 85 мс,
частотой 60 ударов в минуту в норме и в случае
что близко к длительности QRS-комплекса на
инфаркта.
кардиограмме сердца здорового человека.
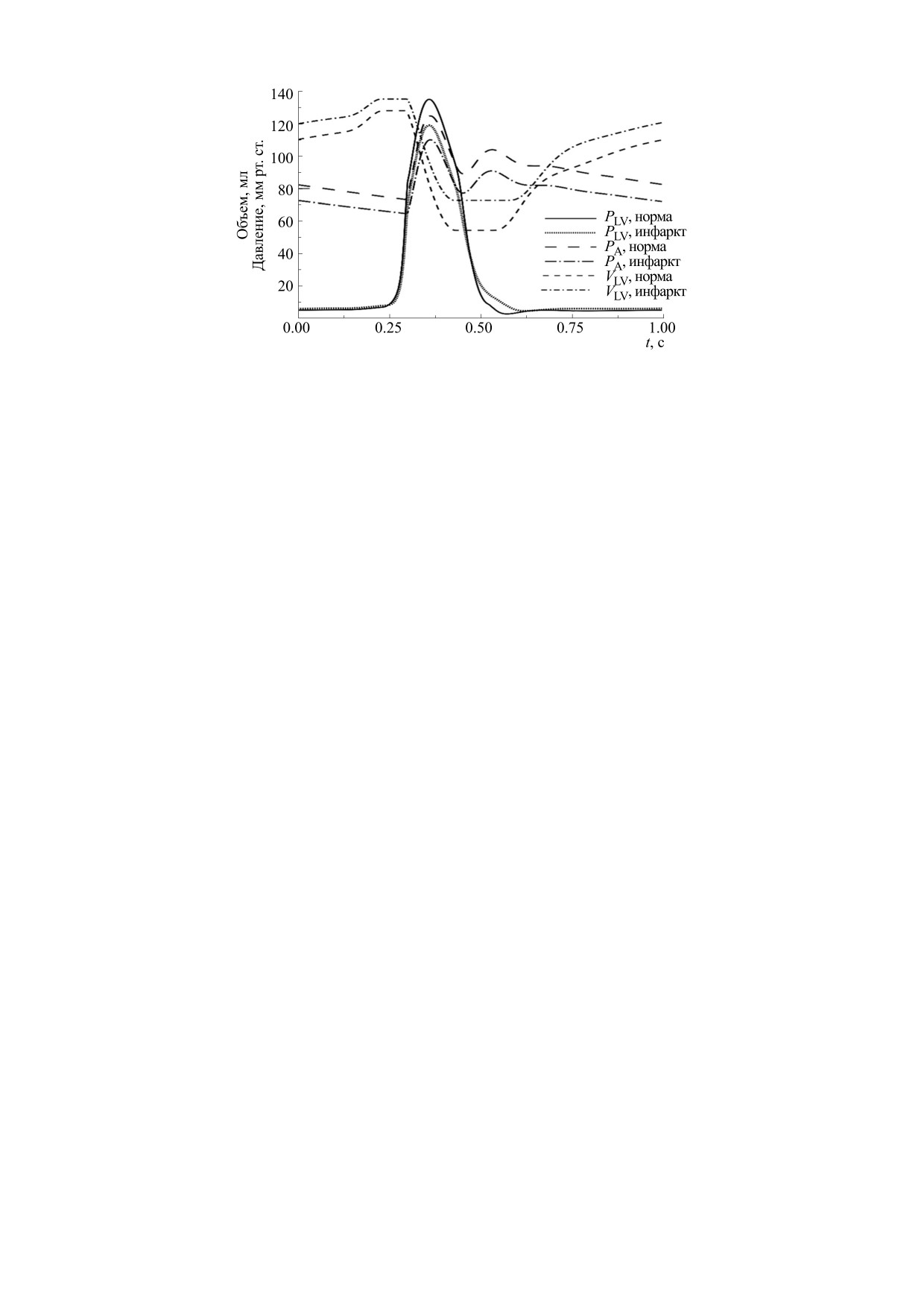
Расчеты показали падение пикового давления
Моделирование работы ЛЖ с апикальным ин-
в ЛЖ и аорте (со 135 и 125 мм рт. ст. до 119 и
фарктом при тех же значениях параметров моде-
110 мм рт. ст. соответственно) и падение ударного
ли, характеризующих другие камеры сердца и со-
объема (с 74 мл до 63 мл) в условиях повышения
судистой системы, как и при расчете работы нор-
конечно-диастолического объема, т.е. увеличе-
мального ЛЖ, показанного на рис. 1, показало
ния преднагрузки, что говорит о существенном
падение производительности сердца и значитель-
снижении сократительной функции ЛЖ. Фрак-
ное изменение деформаций ЛЖ в систолу. На
ция выброса ЛЖ также уменьшилась до 47%. На
рис. 3 приведено сравнение основных величин
рис. 4 показана форма ЛЖ в начале и конце си-
гемодинамики левого сердца при сокращении с
столы в норме и при апикальном инфаркте.
Рис. 2. Карта активации ЛЖ, полученная в результате моделирования активации ЛЖ с частотой 1 Гц в норме (а) и при
наличии инфаркта в области верхушки (б) спустя 60 мс после начала очередного внешнего возбуждающего стимула.
Показаны значения безразмерного потенциала действия u. Указана область, куда подается внешний стимулирующий ток.
На схеме распространения активации по ЛЖ с инфарктом можно заметить область волокон Пуркинье, по которой даже в
пораженной области распространяется потенциал действия.
БИОФИЗИКА том 67
№ 4
2022
770
СЁМИН и др.
Рис. 3. Временной ход основных переменных левого сердца, полученный в результате моделирования сокращения
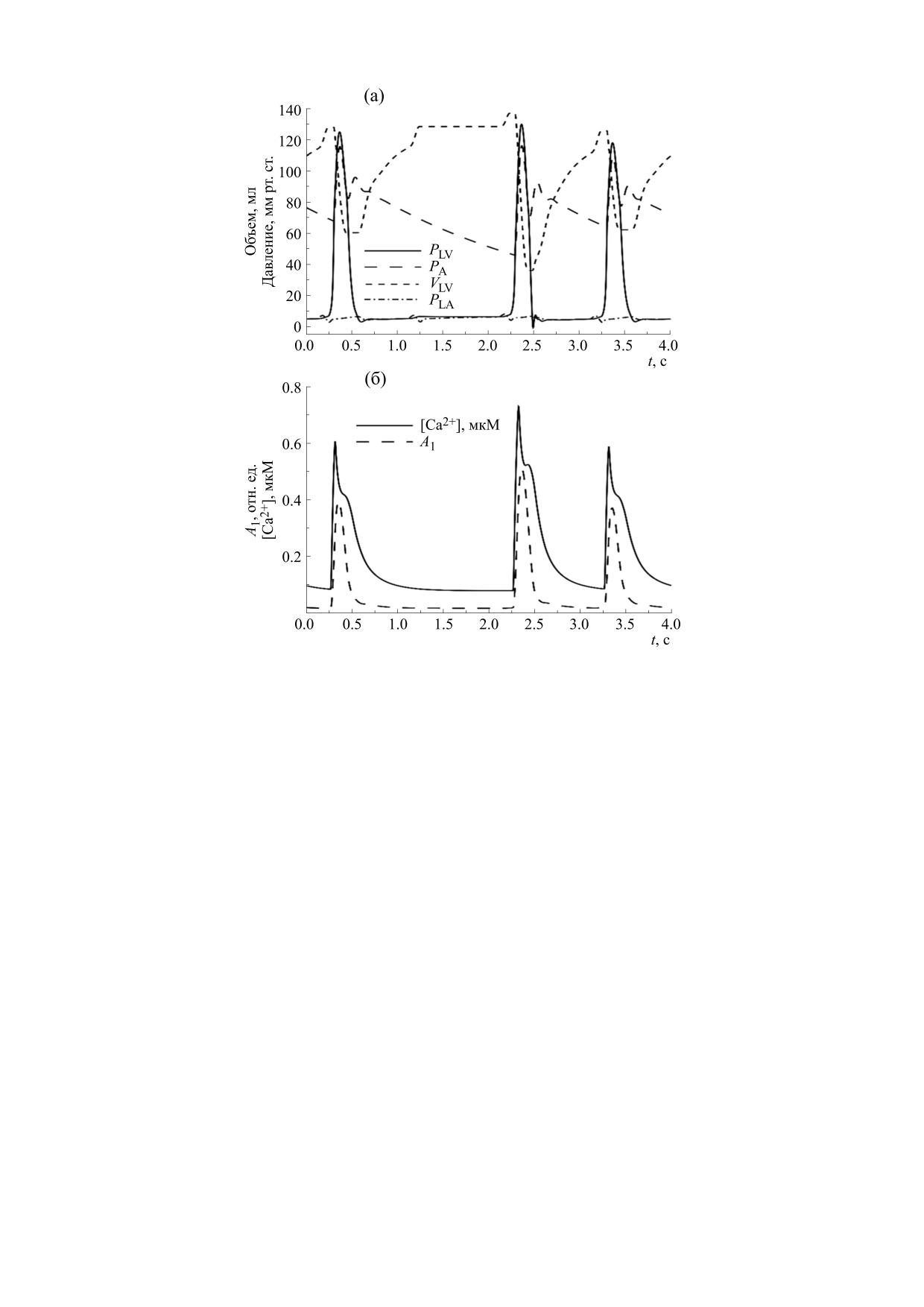
сердца с частотой 1 Гц в норме и в случае инфаркта. Показаны значения давления (PLV) и объема (VLV) левого
желудочка и давление аорте (PA). Давления приведены в мм рт. ст., объемы - в мл. Расшифровка типов линий для
каждой из переменных приведена на рисунке.
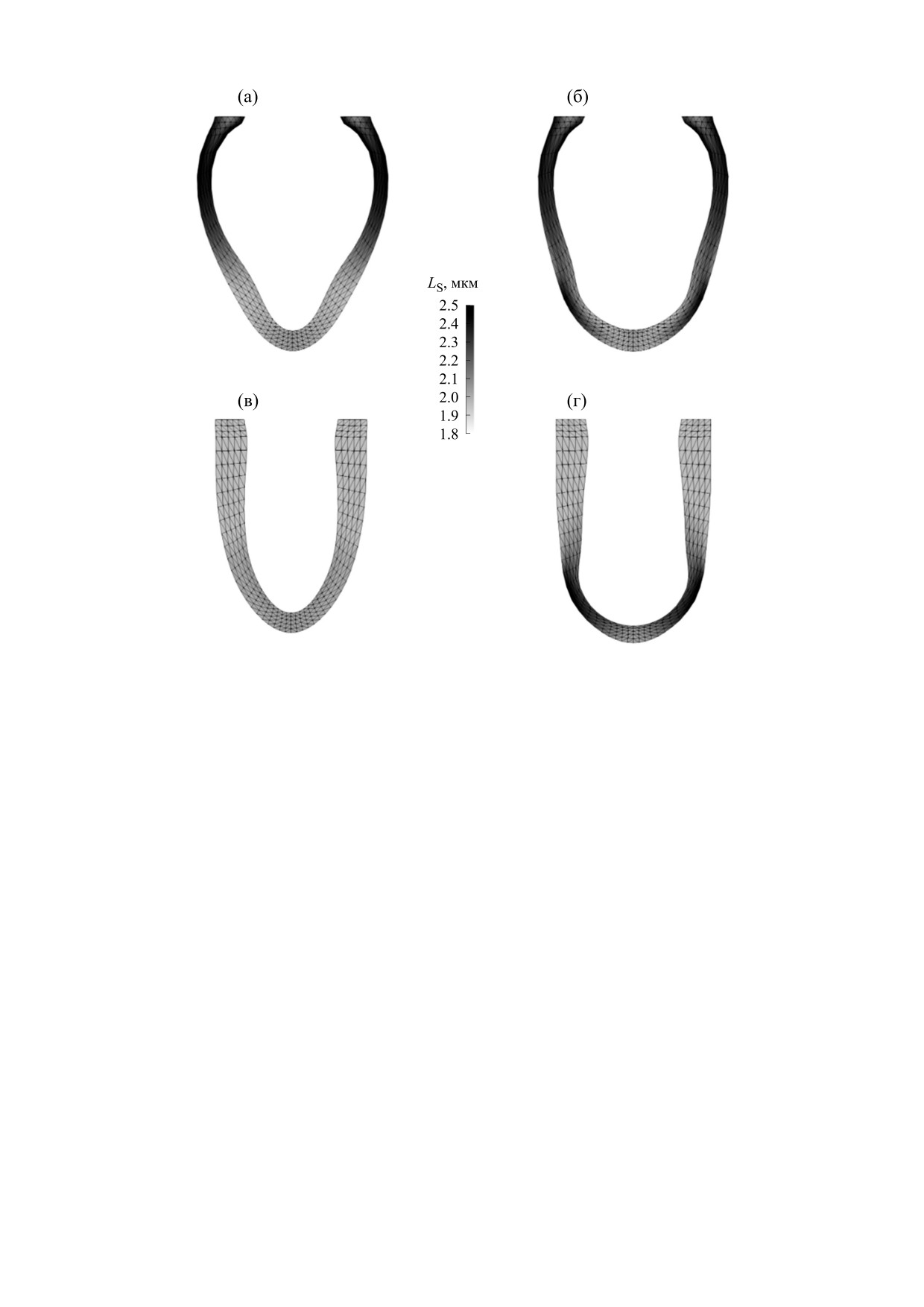
При моделировании инфаркта наблюдали
крытия нитей сократительных белков A1 при со-
концентрации деформаций и длин мышечных
кращении ЛЖ с частотами 1 и 2 Гц в центре стен-
волокон в районе верхушки и в начале (рис. 4б), и
ки желудочка в его экваториальной (самой широ-
в конце систолы (рис. 4г). Заметно, что стенка в
кой в диастолу) части показаны на рис. 6. Видно,
области верхушки не сокращается, и общая осе-
что увеличение частоты стимуляции приводило к
вая деформация желудочка существенно умень-
двукратному увеличению пиковой концентрации
шена. Такие изменения геометрии ЛЖ и распре-
Са2+ в клетках миокарда и существенному увели-
деления деформаций в его стенке наблюдаются
чению доли активированных комплексов регуля-
при эхокардиологическом обследовании пациен-
тов с апикальным инфарктом миокарда ЛЖ [11].
торных белков с ионами Са2+. Именно таким уве-
личением уровня систолической активации кле-
Чтобы исследовать проявление ответа мышцы
ток сердечной мышцы в значительной степени
на частоту стимуляции, учтенного в клеточной
модели, на работу всего сердца при физической
объясняются результаты моделирования работы
сердца при повышенной частоте сокращения, по-
нагрузке, провели моделирование работы сердеч-
но-сосудистой системы при увеличении частоты
казанные на рис. 5.
сердечного ритма до 120 ударов в минуту и одно-
Мы также провели расчет работы сердечно-со-
временном двукратном снижении перифериче-
судистой системы в условиях, моделирующих
ского сопротивления большого круга кровообра-
один из вариантов атриовентрикулярной блока-
щения. Полученные результаты для основных пе-
ды - заболевания, при котором нарушена переда-
ременных гемодинамики показаны на рис. 5.
ча электрического сигнала от предсердий к желу-
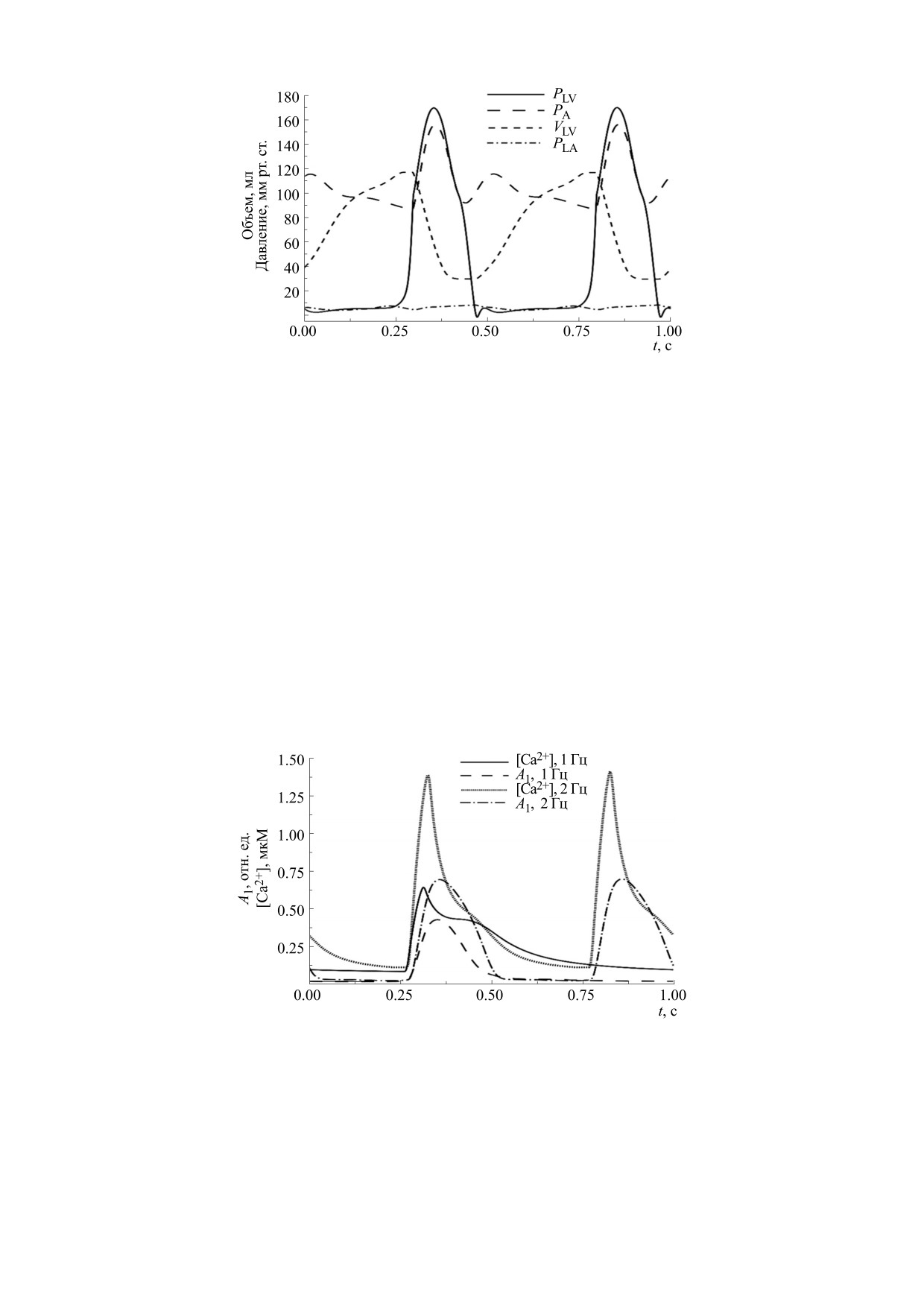
Результаты показывают значительный рост
дочкам. Сигнал может приходить в желудочки с
пиковых давлений в ЛЖ и аорте (до 170 и
задержкой, совсем не передаваться к желудочкам
156 мм рт. ст.), а также ударного объема и фрак-
или передаваться лишь периодически. Модели-
ции выброса (87 мл и 75%) при уменьшении ко-
руя блокаду последнего типа, полагали, что для
нечно-диастолического объема до 117 мл при на-
каждого четвертого сокращения с постоянной ча-
чальных условиях, задающих даже слегка боль-
стотой 1 Гц Istim = 0, в то время как предсердия
ший начальный общий объем крови, чем в
расчетах сокращения с частотой 1 Гц. Получен-
сокращались в нормальном ритме. Результаты
расчета, включая данные о гемодинамике, дина-
ный рост давлений и ударного объема, а также
снижение конечно-диастолического объема обу-
мике изменения концентрации Са2+ и уровня ак-
словлены ростом и пиковой, и диастолической
тивации тонких нитей в стенке ЛЖ в районе эква-
внутриклеточной концентрации свободных
тора, представленного как относительная кон-
ионов Ca2+ с частотой стимуляции. Динамика
центрация комплексов регуляторных белков с
Ca2+ и концентрации образованных комплексов
ионами Са2+, показаны на рис. 7, где «пропуще-
кальция с регуляторными белками в зоне пере-
но» второе из четырех сокращений ЛЖ.
БИОФИЗИКА том 67
№ 4
2022
ЧИСЛЕННОЕ МОДЕЛИРОВАНИЕ РАБОТЫ ЛЕВОГО ЖЕЛУДОЧКА
771
Рис. 4. Форма ЛЖ и распределение длины саркомеров, полученная в результате моделирования сокращения ЛЖ с частотой
1 Гц в норме (а, в) и при наличии инфаркта в области верхушки (б, г) в начале систолы желудочков (а, б) и в ее конце (в, г).
Показаны значения длин саркомеров LS в мкм.
Расчеты показали значительный рост ударного
ОБСУЖДЕНИЕ
объема до 101 мл сразу после паузы при его значе-
В данной работе мы использовали нашу новую
нии 67 мл в сокращении до паузы (рис. 7а). Такой
электромеханическую модель сердечной мышцы
ответ в расчете обусловлен тем, что используемая
[5] для многомасштабного моделирования рабо-
клеточная модель воспроизводит ответ внутри-
ты ЛЖ сердца в системе кровообращения и при-
клеточной концентрации свободного кальция
менили ее для численных расчетов эффектов фи-
Ca2+ и силы на паузу в периодической стимуля-
зической нагрузки, инфаркта в области верхушки
ЛЖ и частичной блокады проведения электриче-
ции (рис. 7б), включая зависимость этого ответа
ских импульсов от предсердий к желудочкам на
от величины паузы [5]. Несмотря на такую ком-
производительность сердца. Включение в модель
пенсацию ударного объема за счет кратковремен-
явного описания распространения волны элек-
ного повышения амплитуды первого сокращения
трического возбуждения по стенке ЛЖ и системы
после паузы, минутный ударный объем в рас-
электромеханического сопряжения, в основе ко-
смотренном случае атриовентрикулярной блока-
торой лежит изменение концентрации Са2+ в раз-
ды немного уменьшался. Кроме того, снижалась
личных компартментах клеток миокарда, позво-
сократимость ЛЖ в последующих, не пропущен-
лило получить более реалистичное описание ра-
ных из-за блокады сокращениях: при конечно-
боты ЛЖ по сравнению с ранней версией модели
диастолических объемах 126-128 мл пиковое дав-
[9, 10], в которой сокращение ЛЖ запускали, за-
ление в аорте падало до 109-115 мм рт. ст., а удар-
давая внутриклеточную концентрацию Са2+ как
ный объем снижался до 63-67 мл (рис. 7а).
однородную по всему объему стенки ЛЖ задан-
БИОФИЗИКА том 67
№ 4
2022
772
СЁМИН и др.
Рис. 5. Временной ход основных переменных левого сердца, полученный в результате моделирования сокращения
сердца с частотой 2 Гц. Показаны значения давления (PLV) и объема (VLV) левого желудочка, а также давление в левом
предсердии (PLA) и аорте (PA). Давления приведены в мм рт. ст., объемы - в мл. Расшифровка типов линий для
каждой из переменных приведена на рисунке.
ную функцию времени. Поскольку запуск ПД в
(рис. 4) и заметному падению артериального дав-
модели начинали вблизи верхушки сердца, со-
ления, фракции выброса и ударного объема ЛЖ
кращение полости ЛЖ также начиналось от вер-
(рис. 3). Изменения кинематики сокращения (в
хушки, а затем распространялось к экватору и ос-
частности, дискинезия в области верхушки), по-
нованию, как происходит при нормальной работе
лученные при моделировании апикального ин-
сердца.
фаркта, были близки к тем, которые наблюдают-
ся в клинике [11].
Чтобы промоделировать влияние инфаркта в
области верхушки сердца на геометрию ЛЖ и па-
Для моделирования влияния физической на-
раметры гемодинамики, в области инфаркта по-
грузки на работу сердца и сосудистой системы
вышали порог возбуждения и снижали ионные
частоту сердечных сокращений увеличивали до
токи и проводимость миокарда. Появление мало-
120 мин-1 и одновременно снижали перифериче-
возбудимой области привело к существенному
ское вдвое сопротивление сосудов большого кру-
изменению геометрии ЛЖ во время систолы
га кровообращения, чтобы промоделировать рас-
Рис. 6. Временной ход концентраций ионов Ca2+ внутри клетки комплексов Ca2+ с регуляторными белками в зоне
перекрытия нитей сократительных белков A1, полученные в центре стенки желудочка в его экваториальной части.
Результаты приведены для моделирования сокращения с частотами 1 и 2 Гц. По оси ординат отложены значения в
безразмерных единицах для A1 и мкМ для Ca2+. Расшифровка типов линий для каждой из переменных приведена на
рисунке.
БИОФИЗИКА том 67
№ 4
2022
ЧИСЛЕННОЕ МОДЕЛИРОВАНИЕ РАБОТЫ ЛЕВОГО ЖЕЛУДОЧКА
773
Рис. 7. Результаты моделирования атриовентрикулярной блокады: (а) - временной ход основных гемодинамических
переменных левого сердца, полученный в результате моделирования сокращения сердца с частотой 1 Гц в условиях
атриовентрикулярной блокады. Показаны значения давления (PLV) и объема (VLV) левого желудочка, а также
давление в левом предсердии (PLA) и аорте (PA); (б) - временной ход внутриклеточной концентрации ионов Са2+ и
относительной доли активированных комплексов регуляторных белков в зоне перекрытия тонких и толстых нитей в
саркомерах А1 в середине стенки ЛЖ в области экватора. Давления приведены в мм рт. ст., объемы - в мл,
концентрация Ca2+ - в мкМ. Левый желудочек «пропускает» сокращение в интервале от 1.2 до 2.2 с. Расшифровка
типов линий для каждой из переменных приведена на рисунке.
ширение сосудов мышц при рабочей гиперемии
концентрации Са2+ в цитоплазме миокардиаль-
(рис. 5). Несмотря на снижение сопротивления,
ных клеток (рис. 6), что приводит к росту изомет-
увеличение частоты сердечных сокращений при
рического напряжения в экспериментах с образ-
модельных расчетах привело к возрастанию арте-
цами миокарда человека, без признаков сердеч-
риального давления до 154/74 мм рт. ст. и более
ной недостаточности [12, 13]. Моделирование
чем двукратному росту минутного кровотока. Та-
таких экспериментов с помощью нашей электро-
кой выраженный рост производительности серд-
механической модели показало, что этот эффект
ца обусловлен двумя обстоятельствами. Во-пер-
связан с накоплением Са2+ в саркоплазматиче-
вых, с увеличением частоты сердечных
ском ретикулуме [5]. Таким образом, наши расче-
сокращений длительность систолы уменьшается
ты показали, что увеличение уровня активации
не так значительно, как длительность диастолы.
сократительных белков миокарда ЛЖ с ростом
Поэтому доля длительности сердечного цикла,
частоты сердечных сокращений является суще-
приходящаяся на систолу, возрастает, что приво-
ственным фактором, способствующим поддер-
дит к увеличению сердечного выброса. Во-вто-
жанию повышенного уровня кровоснабжения
рых, увеличение частоты приводит к увеличению
организма при физической нагрузке (рис. 5 и 6).
БИОФИЗИКА том 67
№ 4
2022
774
СЁМИН и др.
Результаты расчетов центральной гемодинамики
ФИНАНСИРОВАНИЕ РАБОТЫ
(рис. 5) согласуются с данными наблюдений [14].
Работа выполнена при поддержке РНФ, грант
Наконец, результаты моделирования работы
№ 20-74-00046.
сердца в условиях частичной атриовентрикуляр-
ной блокады, показывают, как особенности реак-
ции системы электромеханического сопряжения
КОНФЛИКТ ИНТЕРЕСОВ
в миокарде на изменения межстимульных интер-
валов помогают поддержать необходимый уро-
Авторы заявляют об отсутствии конфликта
вень кровоснабжения при этом виде нарушения
интересов.
сердечного ритма (рис. 7). Эти результаты каче-
ственно согласуются с данными наблюдений [15].
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Следует заметить, что на данном этапе мы раз-
деляли задачи электрической активации ЛЖ и его
Настоящая работа не содержит описания ис-
механического сокращения, решая их поочеред-
следований с использованием людей и животных
но, хотя модель [5] позволяет учитывать влияние
в качестве объектов.
деформаций миокарда на скорость проводимости
электрического возбуждения по стенке ЛЖ. Пол-
ная электромеханическая задача сокращения ЛЖ
СПИСОК ЛИТЕРАТУРЫ
при нормальных условиях была решена в рамках
предложенного исследования, но полученные ре-
1.
S. A. Niederer, J. Lumens, and N. A. Trayanova, Nat.
зультаты лишь незначительно отличались от при-
Rev. Cardiol., 16, 100 (2019).
веденных результатов моделирования с разделе-
нием задач. Это может быть связано с примене-
2.
M. Peirlinck, F. S. Costabal, J. Yao, et al., Biomech.
нием осесимметричной постановки, в рамках
Model. Mechanobiol., 20, 803 (2021).
которой невозможно корректно описать некото-
3.
N. A. Trayanova, Circ. Res., 108 (1), 113 (2011).
рые локальные изменения проводимости и де-
формации. В связи с тем, что для сходимости ре-
4.
N. A. Trayanova and K. C. Chang, J. Physiol., 594 (9),
шения полной электромеханической задачи тре-
2483 (2016).
буется меньший шаг сетки по пространству, было
5.
F. Syomin, A. Osepyan, and A. Tsaturyan, PLoS ONE,
решено остановиться на двухэтапной постановке.
16 (7), e0255027 (2021).
В дальнейшем планируется ставить и решать пол-
ные электромеханические задачи активации и со-
6.
R. R. Aliev and A. V. Panfilov, Chaos, Solitons & Frac-
кращения ЛЖ и других камер сердца в 3D-поста-
tals, 7 (3), 293 (1996).
новке, в том числе исследуя локальные эффекты
деформаций на электрическую активацию.
7.
K. H tenTusscher and A. V. Panfilov, Am. J. Physiol.
Heart. Circ. Physiol., 291 (3), H1088 (2006).
8.
F.A. Syomin and A. K. Tsaturyan, J. Theor. Biol., 420,
ЗАКЛЮЧЕНИЕ
105 (2017).
Представленные результаты показывают, что
9.
F. A. Syomin and A. K. Tsaturyan, Russ. J. Numer.
модель сердечно-сосудистой системы, в которой
Anal. Math. Model., 32, 327 (2017).
левый желудочек представлен телом вращения,
изготовленным из материала, описываемого на-
10.
F. A. Syomin, M. V. Zberia, and A. K. Tsaturyan, Int.
шей новой электромеханической моделью [5],
J. Numer. Method. Biomed. Eng., 35, e3216 (2019).
воспроизводит некоторые реакции сердца на уве-
11.
G. Joseph, T. Zaremba, M. B. Johansen, et al., Echo.
личение частоты сокращений, частичную атрио-
Res. Pract., 6 (4), 81 (2019).
вентрикулярную блокаду и нарушения работы ле-
вого желудочка при апикальном инфаркте. Ре-
12.
L. A. Mulieri, G. Hasenfuss, B. Leavitt, et al., Circula-
зультаты расчетов также показывают, что
tion, 85 (5), 1743 (1992).
особенности реакции уровня активации и актив-
ного механического напряжения кардиомиоци-
13.
N. R. Alpert, B. J. Leavitt, F. P. Ittleman, et al., Basic
тов на изменение межстимульных интервалов,
Res. Cardiol., 93 (Suppl. 1), 23 (1998).
наблюдаемые и исследованные на клеточном
14.
K. Wielemborek-Musial,
K. Szmigielska,
уровне, играют важную роль в поддержании не-
J. Leszczynska, et al., Biomed. Res. Int., Article ID
обходимого уровня кровоснабжения организма
5607507 (2016).
при физической нагрузке и некоторых патологи-
ях, т.е. помогают оптимизировать макроскопиче-
15.
T. Kerola, A. Eranti, A. L. Aro, et al., JAMA Netw.
скую работу сердца как насоса.
Open, 2 (5), e194176 (2019).
БИОФИЗИКА том 67
№ 4
2022
ЧИСЛЕННОЕ МОДЕЛИРОВАНИЕ РАБОТЫ ЛЕВОГО ЖЕЛУДОЧКА
775
Numerical Modeling of Heart Left Ventricle Work in the Circulatory System:
the Effects of Changes in the Frequency of Contractions
and Apical Myocardial Infarction
F.A. Syomin*, A.R. Khabibullina*, and A.K. Tsaturyan*
*Institute of Mechanics, Lomonosov Moscow State University, Michurinsky prosp. 1, Moscow, 119192 Russia
We present a multiscale mathematical model of the pumping function of the left ventricle (LV) of the heart
in the circulatory system. The properties of the LV myocardium were described with a new electromechanical
model that combines models of the generation and propagation of action potential, electromechanical cou-
pling, and mechanics, including passive and active mechanical stress and finite strain. The left ventricle was
considered being a thick-walled axisymmetric body with a realistic distribution of the muscle fibers in its wall.
Blood flow in other heart chambers and blood vessels was represented by a lumped parameter model. We car-
ried out numerical modeling of the effect of the heart rate, partial atrioventricular block, and apical LV in-
farction on the hemodynamics and geometry of the LV. The calculations showed that the model describes the
observed responses of the LV pumping characteristics to these effects. The results allow one to understand
how the cell-level peculiarities of the electromechanical coupling in cardiac muscle help the heart to maintain
its pumping function in pathologies and to adjust it to the increasing needs during physical activity.
Keywords: myocardium, electromechanics of the heart, left ventricle of the heart, cardiovascular system, mathe-
matical modeling, modeling of the heart, heart rate, myocardial infarction, atrioventricular block
БИОФИЗИКА том 67
№ 4
2022