БИОФИЗИКА, 2022, том 67, № 4, с. 776-782
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 577.334+602.6:59+616-092
ИЗМЕНЕНИЕ АНТИОКСИДАНТНЫХ СВОЙСТВ КРОВИ ПРИ ТЕРАПИИ
ТРАВМЫ АХИЛЛОВА СУХОЖИЛИЯ У КРЫС МЕЗЕНХИМАЛЬНЫМИ
СТВОЛОВЫМИ КЛЕТКАМИ
© 2022 г. С.В. Пинчук*, #, И.Б. Василевич*, А.Ю. Молчанова**,
А.А. Басалай**, И.Д. Волотовский*
*Институт биофизики и клеточной инженерии НАН Беларуси,
ул. Академическая, 27, Минск, 220072, Республика Беларусь
#E-mail: pinchuksv@mail.ru
**Институт физиологии НАН Беларуси, ул. Академическая, 28, Минск, 220072, Республика Беларусь
Поступила в редакцию 28.02.2022 г.
После доработки 14.04.2022 г.
Принята к публикации 19.04.2022 г.
Проведено исследование динамики окислительного стресса в организме крыс после механической
травмы (повреждение ахиллова сухожилия) и влияния на данный процесс мезенхимальных стволо-
вых клеток жировой ткани после их локальной инъекции в область повреждения. Полученные ре-
зультаты свидетельствуют о развитии окислительного стресса в организме животных в посттравма-
тический период, что проявляется в увеличении содержания в крови продуктов перекисного окис-
ления липидов, изменении средней интенсивности аутофлуоресценции эритроцитов по данным
проточной цитофлуориметрии, увеличении общей антиоксидантной активности плазмы крови.
Полученные результаты указывают на то, что мезенхимальные стволовые клетки оказывают защит-
ное действие при развитии окислительного стресса, что позволяет сбалансировать ответ организма
на усиление окислительных повреждений и расширяет сведения о механизмах терапевтического
действия стволовых клеток при лечении травм.
Ключевые слова: травма ахиллова сухожилия, окислительный стресс, мезенхимальные стволовые
клетки, клеточная терапия.
DOI: 10.31857/S0006302922040160, EDN: IUVDBD
Результаты применения стволовых клеток
лиза их функционального состояния. Тера-
певтическое действие МСК связывают со
в клинической практике, полученные отече-
ственными и зарубежными учеными в по-
способностью данных клеток дифференци-
следнее десятилетие, убедительно свидетель-
роваться в соматические клетки тканей и ор-
ствуют о высоком потенциале методов кле-
ганов, а также с осуществлением ими пара-
точной терапии в лечении заболеваний
кринной активности - синтезом во внекле-
точную среду цитокинов и ростовых
человека и животных [1, 2]. Наиболее широ-
кое применение получили биомедицинские
факторов, оказывающих противовоспали-
клеточные продукты на основе мезенхималь-
тельное, антиапоптотическое, иммуномоду-
ных стволовых клеток (МСК), выделенных
лирующее, стимулирующее пролиферацию
из различных тканей, прежде всего жировой
действие, способствуя тем самым восстанов-
лению клеточного пула функционально ак-
ткани, костного мозга, ткани пуповины [3, 4].
Это обусловлено доступностью донорского
тивных клеток в очаге повреждения [3, 4].
материала, высокой пролиферативной ак-
В ряде исследований показано, что примене-
тивностью МСК в условиях in vitro, отрабо-
ние МСК снижает развитие окислительного
танными методами культивирования и ана-
стресса в организме экспериментальных живот-
ных после моделирования у них патологических
Сокращения: МСК - мезенхимальные стволовые клетки, состояний: колитов [5-7], инсульта [8], дисфунк-
АФК - активные формы кислорода, ПОЛ - перекисное
ции печени [9, 10] и почек [11], астмы [12], а также
окисление липидов, ТБК - 2-тиобарбитуровая кислота,
ОАА - общая антиоксидантная активность, ABTS - 2,2'-
при действии ионизирующего излучения [13].
азино-бис-(3-этилбензотиазолин-6-сульфоновая кислота).
Предполагается, что МСК способны оказывать
776
ИЗМЕНЕНИЕ АНТИОКСИДАНТНЫХ СВОЙСТВ КРОВИ
777
регуляторное действие на прооксидантно/анти-
тельства. Однако при их использовании заживле-
оксидантный баланс в клетках в условиях актива-
ние сухожилий, как правило, происходит очень
ции окислительных повреждений клеточных
медленно, а поврежденные ткани не могут полно-
компонентов. Однако роль данного возможного
стью восстановиться до их естественного состава,
механизма терапевтического действия МСК
структуры и механических свойств, что ведет к
практически не изучена, в частности, не известен
ухудшению функционирования сухожилия и воз-
спектр патологий, при которых он проявляется.
растанию риска повторных травм [23]. В послед-
Вместе с тем, очевидно, что более полное пред-
нее время появились обнадеживающие данные о
ставление о механизмах действия МСК при раз-
перспективности применения в лечении повре-
личных патологиях имеет важное значение для
ждений сухожилий МСК [24, 25]. Проведенные
совершенствования методов клеточной терапии
нами ранее исследования [26] показали, что при-
(определение оптимальных доз клеточного мате-
менение МСК при лечении травмированного
риала, кратности инъекций, временных интерва-
ахиллова сухожилия у экспериментальных жи-
лов между инъекциями и др.).
вотных (крысы) оказывает положительное влия-
ние на восстановление поврежденной ткани, со-
Проведенные многочисленные исследования
убедительно свидетельствуют, что окислитель-
провождается проявлением выраженного анти-
ноцицептивного действия. Целью данной работы
ный стресс лежит в основе развития многих пато-
являлось исследование развития окислительного
логических состояний человека и животных, яв-
стресса в организме крыс после травмирования
ляется причиной прогрессирования их осложне-
ахиллова сухожилия и влияние на данный про-
ний, сопровождается усилением воспалительных
реакций и снижением репаративных процессов в
цесс клеточной терапии на основе МСК жировой
ткани.
организме. Развитие окислительного стресса обу-
словлено интенсификацией свободно-радикаль-
ных повреждений липидов, белков и ДНК в клет-
МАТЕРИАЛЫ И МЕТОДЫ
ках, что в конечном итоге способно приводить к
снижению их функциональной активности и, как
Исследование выполнено на половозрелых бе-
следствие, к нарушению функционирования тка-
лых крысах-самцах линии Wistar массой 230-
ней и органов. Важная роль окислительного
250 г. Моделирование травмы ахиллова сухожи-
стресса показана в патогенезе онкологических,
лия осуществляли хирургическим путем в Инсти-
сердечно-сосудистых, нейродегенеративных за-
туте физиологии НАН Беларуси, как описано ра-
болеваний, при диабете, болезнях печени и почек
нее [26].
и др. [14, 15]. Имеются данные об участии окисли-
Животные были разделены на следующие
тельного стресса в патогенезе травм опорно-дви-
группы: группа I - крысы с травмой ахиллова су-
гательного аппарата, в том числе сухожилий. На
хожилия без лечения (n = 24); группа II - крысы с
экспериментальных животных показано, что
травмой ахиллова сухожилия, которым провели
травмирование ахиллова сухожилия приводит к
однократную трансплантацию МСК в область
увеличению содержания активных форм кисло-
травмы (n = 24); группа III - интактные живот-
рода (АФК) в сыворотке крови [16], росту количе-
ные (n = 6).
ства продуктов перекисного окисления липидов
Выделение, культивирование и характеристи-
(ПОЛ) и снижению концентрации восстановлен-
ку функционального состояния МСК из жировой
ного глутатиона в тканях сухожилия [17-19]. В
ткани крыс проводили согласно использованным
условиях стимуляции окислительного стресса
ранее методам [27]. Введение суспензии МСК
(локальная инъекция перекиси водорода) эффек-
осуществляли в условиях седации животного ло-
тивность восстановления экспериментально
кально в область травмы на первые сутки после
травмированного сухожилия снижается и наблю-
нанесения механической травмы ахиллова сухо-
даются изменения, характерные для развития
жилия в дозе 250000 клеток на животное.
тендинопатии [20]. Напротив, применение таких
Перекисное окисление липидов в крови жи-
антиоксидантов как кверцетин или аскорбат ока-
вотных оценивали по образованию продуктов,
зывает позитивное влияние на процесс восста-
реагирующих с
2-тиобарбитуровой кислотой
новления травмированного сухожилия [18, 19].
(ТБК). Концентрацию ТБК-активных продуктов
Повреждения сухожилий и связок составляют
оценивали спектрофотометрически, принимая
около 50% всех травм мышечно-скелетной систе-
величину коэффициента молярной экстинкции
мы и являются одной из основных причин разви-
при λ = 535 нм равной 1.56·105 М-1см-1.
тия болевых синдромов и физической недееспо-
собности, оказывая тем самым крайне негатив-
Для измерения интенсивности автофлуорес-
ное влияние на физическое состояние пациентов
ценции эритроцитов 5 мкл цельной крови разво-
[21, 22]. Для терапии таких заболеваний в настоя-
дили в 3.5 мл изотонического фосфатно-солевого
щее время в основном применяются методы кон-
буфера (рН 7.4). Суспензию клеток анализирова-
сервативного лечения и хирургические вмеша-
ли на проточном цитофлуориметре FACSCanto II
БИОФИЗИКА том 67
№ 4
2022
778
ПИНЧУК и др.
(Becton Dickinson and Company, США), выделяли
В общем, окислительный стресс представляет
гейт эритроцитов на диаграмме прямого/боково-
собой сложный, многофакторный процесс, а
го рассеивания и определяли интенсивность флу-
адекватная его оценка является непростой зада-
оресценции эритроцитов в канале FITC. Сред-
чей. Ситуация осложняется тем, что в организме
нюю интенсивность автофлуоресценции оцени-
неизбежно запускаются ответные реакции по
вали по результатам анализа 30000 клеток.
компенсации неблагоприятного воздействия
окислительного стресса. Для оценки развития
Общую антиоксидантную активность (ОАА)
окислительного стресса регистрируют так назы-
плазмы крови определяли по обесцвечиванию ка-
ваемые маркеры данного процесса. В качестве та-
тион-радикала
2,2'-азино-бис-(3-этилбензотиа-
ких маркеров используют содержание в клетках и
золин-6-сульфоновой кислоты) (ABTS) [28]. Об-
тканях продуктов окислительной модификации
разование радикала индуцировали инкубацией
биомолекул, активность системы антиоксидант-
данного соединения (7 мМ) в дистиллированной
ной защиты или ее компонентов, оценку функ-
воде в присутствии персульфата калия (2.45 мМ)
ционального состояния клеток и др. [30]. В нашей
в течение 10 ч при комнатной температуре. Полу-
работе для оценки протекания окислительного
ченный препарат разводили в 0.02 М натрий-фос-
стресса в организме экспериментальных живот-
фатном буфере (рН 7.3) до получения рабочего
ных использовались следующие маркеры: содер-
раствора с оптической плотностью при 734 нм,
жание продуктов ПОЛ в крови, интенсивность
равной 0.70 ± 0.01. К 1.5 мл рабочего раствора до-
флуоресценции эритроцитов, общая антиокси-
бавляли 10 мкл плазмы крови и регистрировали
дантная активность плазмы крови. Такой подход
кинетику обесцвечивания радикала ABTS в тече-
позволяет охарактеризовать окислительный
ние 10 с [29] с использованием спектрофлуори-
стресс как на молекулярно-клеточном уровне,
метра СМ2203 (SOLAR, Беларусь). ОАА выража-
так и оценить реакцию на него организма в це-
ли в единицах концентрации антиоксиданта тро-
лом.
локса.
Исследование содержания продуктов перекисного
Статистическую обработку данных выполняли
окисления липидов в крови экспериментальных жи-
с использованием программы Microsoft Excel с
вотных. Определение содержания в крови продук-
определением среднего арифметического значе-
тов ПОЛ, реагирующих с ТБК (ТБК-продукты), яв-
ния и стандартной ошибки среднего. Cтатистиче-
ляется одним из наиболее часто используемых под-
скую значимость между отдельными экспери-
ходов к мониторингу развития окислительного
ментальными группами определяли с помощью
стресса в организме [30]. Проведенные нами иссле-
непарного t-критерия Стьюдента, принимая зна-
дования показали, что моделирование травмы ахил-
чение P < 0.05 как статистически достоверное
лова сухожилия приводит к увеличению содержания
различие.
в крови экспериментальных животных данных про-
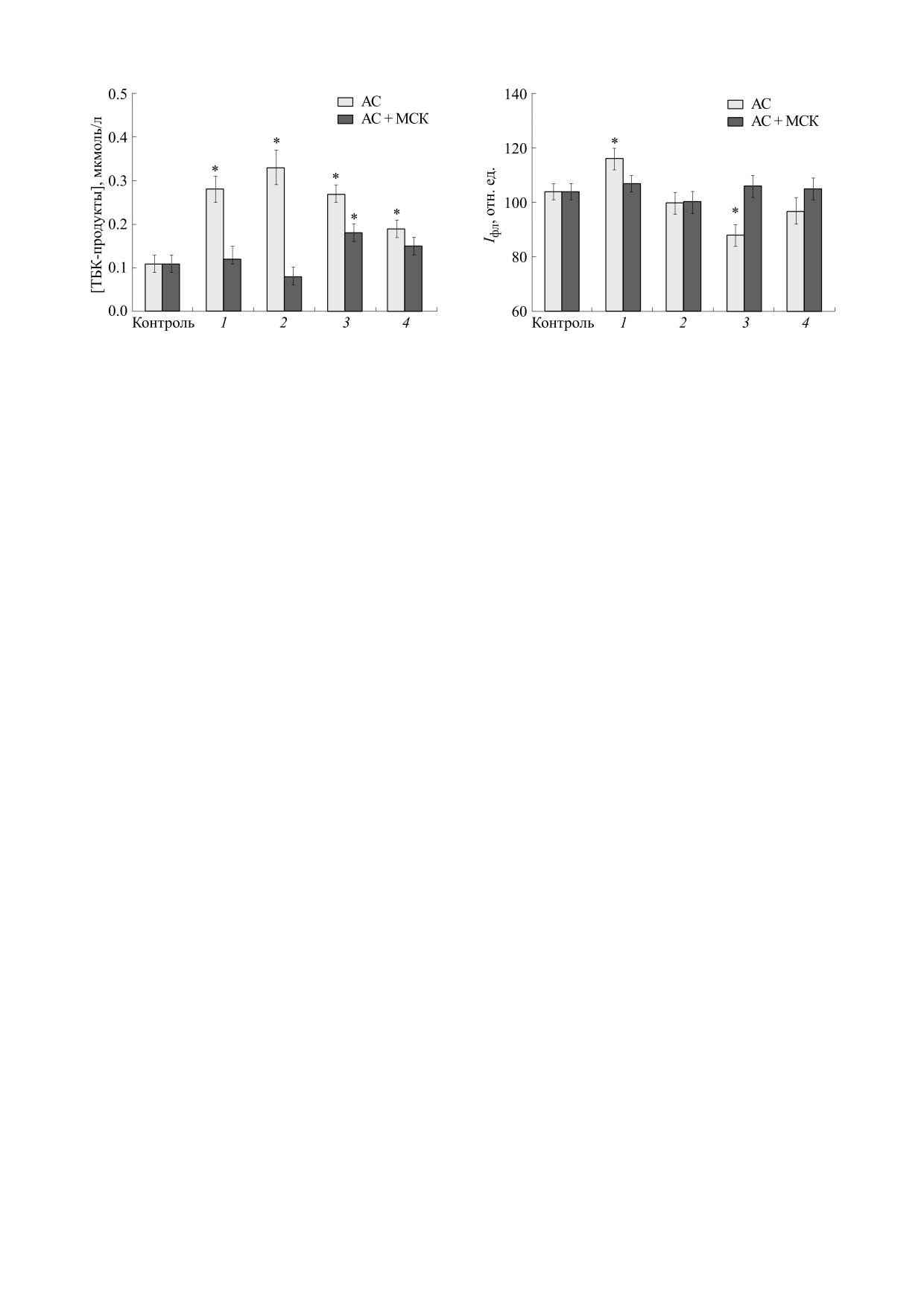
дуктов. Как видно из рис. 1, количество ТБК-про-
дуктов увеличивается более чем в два раза через не-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
делю после моделирования и составляет 0.28 ±
± 0.03 мкмоль/л крови, тогда как у контрольных
Окислительный стресс в биологических систе-
животных
данный
показатель
равен
мах индуцируется действием АФК, представляю-
0.11 ± 0.02 мкмоль/л. Через две недели наблюдений
щих собой высоко реакционноспособные соеди-
нения, вызывающих окислительные поврежде-
количество ТБК-продуктов возрастает до 0.33 ±
ния биологически важных молекул в клетках:
± 0.04 мкмоль/л и далее постепенно снижается,
приближаясь через четыре недели к значениям кон-
нуклеиновых кислот, белков и липидов. Вместе с
тем образование АФК в клетках необходимо для
трольных животных (0.19 ± 0.02 мкмоль/л). Эти
реализации ряда важных физиологических про-
данные указывают на увеличение окислительных
цессов и в условиях нормы происходит в опреде-
повреждений липидов и свидетельствуют в пользу
ленном диапазоне концентраций, что обеспечи-
развития окислительного стресса в организме жи-
вается функционированием антиоксидантной
вотных в результате моделирования травмы ахилло-
системы. Сохранение баланса между скоростью
ва сухожилия. Окислительная модификация липи-
образования АФК, их нейтрализацией и восста-
дов имеет важнейшее значение в проявлении нега-
новлением окисленных продуктов является важ-
тивных последствий окислительного стресса.
нейшим условием для обеспечения функциони-
Окисление липидов ведет к нарушению целостно-
рования клеток. Нарушение окислительно-анти-
сти мембран клеток и снижению их барьерных
оксидантного баланса может существенно
свойств, изменению активности мембранно-ассо-
увеличить содержание АФК в клетках, что ведет к
циированных белков, функционирования липопро-
окислительным повреждениям клеточных ком-
теиновых комплексов. Сами продукты окисления
понентов и, как следствие, к развитию окисли-
липидов (малоновый диальдегид) могут оказывать
тельного стресса.
токсическое действие на клетки.
БИОФИЗИКА том 67
№ 4
2022
ИЗМЕНЕНИЕ АНТИОКСИДАНТНЫХ СВОЙСТВ КРОВИ
779
Рис. 2. Средняя интенсивность автофлуоресценции в
Рис. 1. Содержание ТБК-продуктов в крови крыс в
канале FITC проточного цитофлуориметра эритроци-
разные сроки после травмы ахиллова сухожилия без
тов крови крыс в разные сроки после травмы ахиллова
(светлые столбики) и с инъекцией МСК (темные
сухожилия без (светлые столбики) и с инъекцией МСК
столбики). Период наблюдения после моделирования
(темные столбики). Период наблюдения после модели-
травмы: 1 - 1 неделя, 2 - 2 недели, 3 - 3 недели, 4 -
рования травмы: 1 - 1 неделя, 2 - 2 недели, 3 - 3 недели,
4 недели;
*
- p < 0.05 относительно интактного
4 - 4 недели; * - p < 0.05 относительно интактного кон-
контроля.
троля.
Измерение содержания продуктов ПОЛ в кро-
мофорами данной флуоресценции выступают
ви животных с травмированным ахилловым сухо-
продукты окисления липидов и белков [32, 34].
жилием и получивших инъекцию МСК в дозе
Как видно из представленных на рис. 2 данных,
250000 клеток показало, что в течение первых
интенсивность автофлуоресценции эритроцитов
двух недель постравматического периода (время
изменяется после моделирования травмы ахилло-
интенсивного роста продуктов ПОЛ в крови трав-
ва сухожилия. У контрольных животных данный
мированных крыс без клеточной терапии) дан-
показатель составляет 104 ± 3 отн. ед. Через неде-
ный параметр практически не изменяется и соот-
лю после моделирования интенсивность авто-
ветствует значениям для контрольной группы
флуоресценции при том же режиме измерения
(рис. 1). Через три и четыре недели наблюдения
возрастает до 116 ± 4 отн. ед. Однако далее она
содержание продуктов ПОЛ несколько возраста-
снижается и через три недели принимает мини-
ет, но остается ниже по сравнению с травмиро-
мальное значение (88 ± 4 отн. ед.). К концу пери-
ванными животными без введения клеток. Эти
ода наблюдения интенсивность автофлуоресцен-
данные указывают на то, что в результате введе-
ции повышается. Рост интенсивности автофлуо-
ния МСК окислительные повреждения липидов в
ресценции через неделю после моделирования
ответ на травму ахиллова сухожилия, которые на-
указывает на увеличение в эритроцитах продук-
блюдаются у травмированных животных без инъ-
тов окислительной модификации белков и липи-
екции клеток, резко снижаются.
дов и свидетельствует в пользу развития окисли-
тельного стресса в данных клетках. Наблюдаемое
Исследование интенсивности автофлуоресцен-
далее снижение интенсивности, очевидно, явля-
ции эритроцитов крови экспериментальных живот-
ется следствием изменения популяционного со-
ных. Эритроциты представляют собой основную
клеточную фракцию крови, при этом данные
става эритроцитов, отличающихся интенсивно-
стью флуоресценции. Можно полагать, что в ре-
клетки проявляют высокую чувствительность к
окислительному воздействию. В частности, пока-
зультате развития окислительного стресса в
зано, что интенсивность автофлуоресценции
период более одной недели после моделирования
эритроцитов в зеленой области (530 нм), изме-
травмы ахиллова сухожилия происходит ускоре-
ренная методом проточной цитофлуориметрии
ние элиминации старых эритроцитов из крови
при использовании синего лазера (488 нм) для
из-за накопившихся до критического уровня
возбуждения, увеличивается при развитии окис-
окислительных повреждений в данных клетках. В
лительного стресса в клетках [31, 32]. В экспери-
пользу такого предположения свидетельствуют
ментах на мышах установлено, что популяция
данные о снижении содержания эритроцитов в
молодых эритроцитов (до 40 дней) характеризует-
крови экспериментальных животных через две
ся значительно более низкой (в полтора-два раза)
недели после формирования травмы ахиллова су-
интенсивностью автофлуоресценции по сравне-
хожилия на 7.5% и восстановление к исходному
нию с популяцией старых эритроцитов [33]. Хро-
уровню к концу периода наблюдения. Очевидно,
БИОФИЗИКА том 67
№ 4
2022
780
ПИНЧУК и др.
патологических процессов, индуцирующих окис-
лительный стресс, является активность системы
антиоксидантной защиты, т.е. способность тка-
ней и органов противостоять повреждающему
действию АФК. Для характеристики антиокси-
дантной системы крови экспериментальных жи-
вотных проведено исследование по определению
ОАА плазмы крови по ее способности дезактиви-
ровать катион-радикал ABTS+. Данный радикал
можно получить в лабораторных условиях инку-
бацией ABTS в присутствии персульфата калия
[28]. Особенностью радикала является его отно-
сительно высокая стабильность в водных раство-
рах в отсутствие восстановителей, а также оп-
тическая активность в видимом диапазоне, что
позволяет определять его концентрацию, реги-
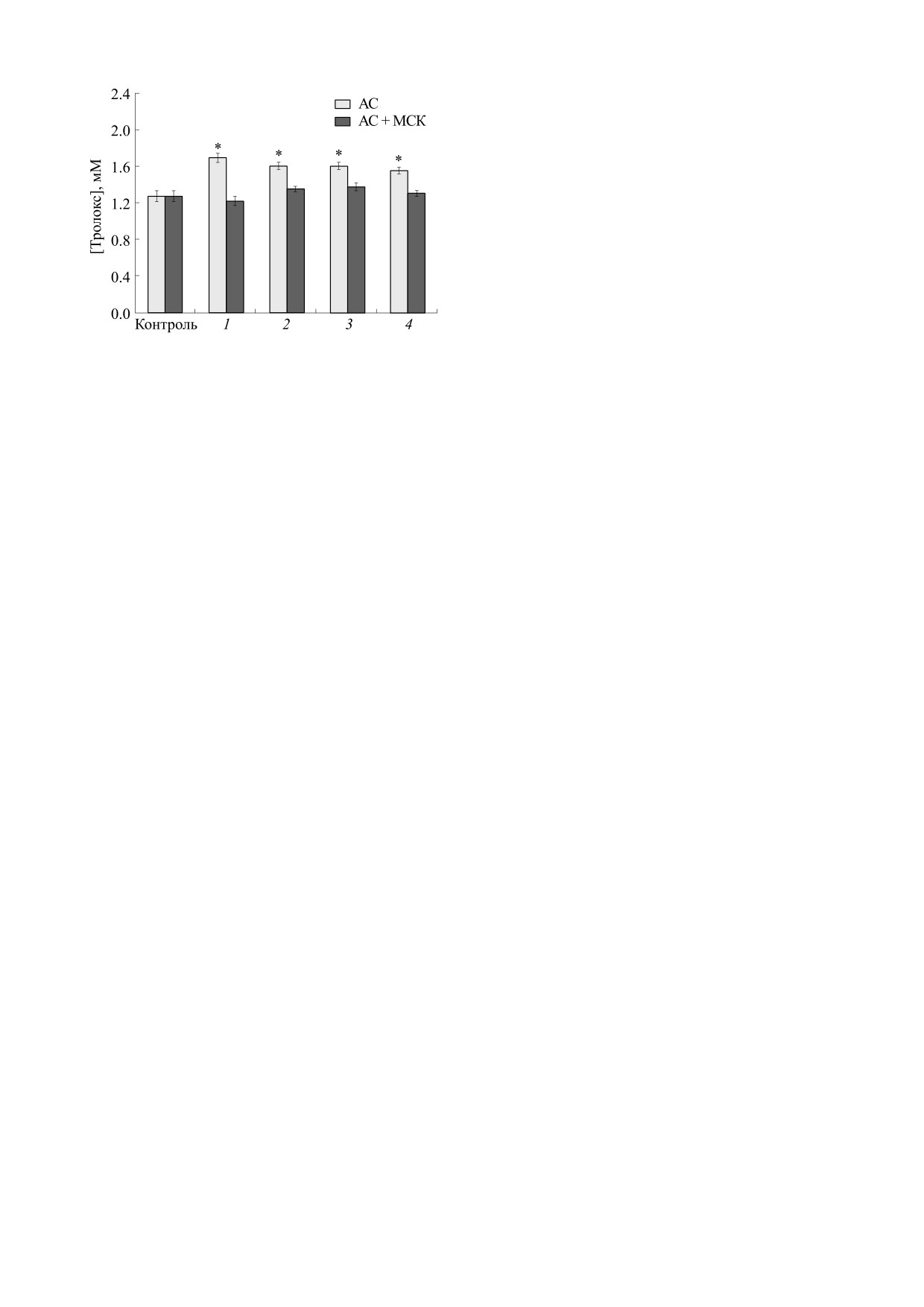
Рис. 3. Общая антиоксидантная активность в эквива-
ленте концентрации тролокса плазмы крови крыс в раз-
стрируя оптическую плотность стандартными
ные сроки после травмы ахиллова сухожилия без (свет-
фотометрами. Наиболее часто измерение прово-
лые столбики) и с инъекцией МСК (темные столбики).
дят при длине волны 734 нм, при которой элемен-
Период наблюдения после моделирования травмы: 1 -
ты крови оптически неактивны. При добавлении
1 неделя, 2 - 2 недели, 3 - 3 недели, 4 - 4 недели; * -
в растворы ABTS+ плазмы крови или таких при-
p<0.05 относительно интактного контроля.
сутствующих в крови и проявляющих антиокси-
дантную активность соединений, как токоферол,
аскорбат, восстановленный глутатион, билиру-
что ускорение элиминации старых эритроцитов
бин наблюдается обесцвечивание раствора, сви-
приведет к росту в крови доли молодых и сниже-
детельствующее о дезактивации радикала [35].
нию средней интенсивности автофлуоресценции
Проведенные нами измерения показали, что
в общем пуле клеток. Кроме этого, снижение
ОАА плазмы крови контрольных животных со-
концентрации эритроцитов в крови может стиму-
ставляет 1.27 ± 0.06 ммоль/л в эквиваленте кон-
лировать эритропоэз, что приведет к еще больше-
центрации тролокса - водорастворимого аналога
му росту доли молодых эритроцитов в крови и
антиоксиданта α-токоферола. Полученное значе-
еще большему снижению средней интенсивности
ние коррелирует с ОАА плазмы крови человека,
автофлуоресценции. Снижение оказалось макси-
измеренной с использованием данного метода
мальным на третьей неделе посттравматических
[35]. В крови животных с моделированной трав-
наблюдений - средняя интенсивность автофлуо-
мой ОАА плазмы увеличивается: через неделю
ресценции эритроцитов травмированных живот-
после травмирования активность составляет
ных оказалась даже ниже, чем у интактных.
1.69 ±
0.05 ммоль/л и далее снижается до
Изменение интенсивности автофлуоресцен-
1.55 ± 0.04 ммоль/л к концу периода наблюдения.
ции эритроцитов крови травмированных крыс
Увеличение ОАА в крови наблюдается и при дру-
после введения МСК имеет похожую динамику с
гих патологических состояниях, сопровождаю-
изменениями данного параметра у эксперимен-
щихся развитием окислительного стресса [36, 37].
тальных животных без инъекции клеток, однако
Предполагается, что увеличение активности си-
величина данных изменений значительно ниже.
стемы антиоксидантной защиты в крови или дру-
Как видно из рис. 2, через неделю после травми-
гих тканях при развитии окислительного стресса
рования ахиллова сухожилия средняя интенсив-
является ответной реакцией организма, направ-
ность автофлуоресценции эритроцитов имеет
ленной на сдерживание интенсификации окис-
лишь тенденцию к росту (107 ± 3 отн. ед.). Мини-
лительных повреждений [38]. Однако следует от-
мальная интенсивность наблюдалась через две
метить, что направленность и масштаб измене-
недели после травмирования (100 ± 4 отн. ед.). В
ния активности антиоксидантной системы
более поздний посттравматический период ин-
зависит от вида патологии, интенсивности разви-
тенсивность аутофлуоресценции практически
тия окислительного стресса, длительности его
соответствовала значениям для контрольных жи-
протекания и других факторов.
вотных. Эти результаты показывают, что после
Определение ОАА плазмы крови у травмиро-
введения МСК в крови травмированных живот-
ванных животных, получивших инъекцию МСК,
ных окислительные повреждения эритроцитов
показало, что данный параметр, как и содержа-
менее выражены, а элиминация старых эритро-
ние продуктов ПОЛ в крови и интенсивность
цитов снижена.
флуоресценции эритроцитов, мало изменяется в
Исследование ОАА плазмы крови эксперимен-
период наблюдения и остается близкой к ОАА
тальных животных. Важной характеристикой со-
контрольных животных (рис. 3). Полученные ре-
стояния организма, особенно при протекании
зультаты указывают на то, что МСК оказывают
БИОФИЗИКА том 67
№ 4
2022
ИЗМЕНЕНИЕ АНТИОКСИДАНТНЫХ СВОЙСТВ КРОВИ
781
защитное действие при развитии окислительного
8. M. L. Calió, D. S. Marinho, G. M. Ko, et al., Free
стресса после травмы ахиллова сухожилия, что
Radic. Biol. Med., 70, 141 (20140.
позволяет сбалансировать ответ организма на
9. M. Ayatollahi, Z. Hesami, A. Jamshidzadeh, and
B. Gramizadeh, Int. J. Organ Transplant. Med., 5 (4),
усиление окислительных повреждений.
166 (2014).
10. Y. Ge, Q. Zhang, Z. Jiao, et al., Life Sci., 214, 62
ЗАКЛЮЧЕНИЕ
(2018).
11. F. Zahran, A. Nabil, A. E. Karef, et al., J. Stem Cell
Полученные результаты свидетельствуют о
Res. Ther., 1 (4), 150 (2016).
развитии окислительного стресса в организме
12. M. Malaquias, L. Oyama, P. Jericó, et al., Allergol. Im-
животных после формирования травмы ахиллова
munopathol., 46 (2), 136 (2018).
сухожилия. Это проявляется в увеличении содер-
13. Y. Shen, X. Jiang, L. Meng, et al., Oxid. Med. Cell
жания в крови продуктов ПОЛ, изменении сред-
Longev., 2018, 5942916 (2018).
ней интенсивности автофлуоресценции эритро-
14. M. Valko, D. Leibfritz, J. Moncol, et al., Int. J. Bio-
цитов в зеленой области спектра, увеличении об-
chem. Cell Biol., 39 (1), 44 (2007).
щей антиоксидантной активности в плазме крови
15. A. Phaniendra, D. B. Jestadi, and L. Periyasamy Indian
в посттравматический период. Применение МСК
J. Clin. Biochem., 30 (1), 11 (2015).
при экспериментальной травме ахиллова сухожи-
16. P. Li, H. Zhou, T. Tu, and H. Lu, J. Orthop. Surg. Res.,
лия в виде локальной инъекции в область повре-
16 (1), 293 (2021).
ждения оказывает защитное действие от развития
17. L. I. Fillipin, J. L. Mauriz, K. Vedovelli, et al., Lasers
Surg. Med., 37 (4), 293 (2005).
окислительного стресса и позволяет оптимизиро-
18. L.-K. Hung, S.-C. Fu, Y.-W. Lee, et al., J. Bone Joint
вать реакцию организма в ответ на интенсифика-
Surg. Am., 95, e41(1-7) (2013).
цию окислительных процессов. Эффект проявля-
19. Y. Liang, K. Xu, P. Zhang, et al., BMC Musculoskelet.
ется в снижении индуцированных травмировани-
Disord., 21 (1), :608 (2020).
ем накопления ТБК-активных продуктов ПОЛ в
20. S.-C. Fu, M-Y. Yeung, C. G. Rolf, et al., J. Orthop.
крови, изменений интенсивности автофлуорес-
Res., 36 (12), 3268 (2018).
ценции эритроцитов и ОАА плазмы крови. В це-
21. T. A. H. Järvinen, P. Kannus, N. Maffulli, and
лом полученные результаты расширяют имею-
K. M. Khan, Foot Ankle Clin., 10 (2) 255 (2005).
щиеся сведения о механизмах терапевтического
22. S. T. Clark, M. Zhu, G. D. Gamble, et al., Inj. Epide-
действия стволовых клеток при лечении патоло-
miol., 7 (1), 5 (2020).
гических состояний травматической этиологии.
23. V. Gulati, M. Jaggard, S. S. Al-Nammari, et al., World
J. Orthop., 6 (4), 380 (2015).
24. A. de Mattos Carvalho, A. L. G. Alves, P. G. Gomes de
КОНФЛИКТ ИНТЕРЕСОВ
Oliveira, et al., J. Equine Vet. Sci., 31, 26 (2011).
Авторы заявляют об отсутствии конфликта
25. C. A. Uysal, M. Tobita, Hyakusoku, and H. Mizuno, J.
интересов.
Plast. Reconstr. Aesthet. Surg., 65 (12), 1712 (2012).
26. А.-М. В. Ерофеева, И. П. Жаворонок, О. А. Анти-
пова и др., Докл. НАН Беларуси, 64, 574 (2020).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
27. И. Б. Василевич, С. В. Пинчук, Е. С.Лобанок и др.,
Вести НАН Беларуси. Сер. биол. наук, 2, 82 (2014).
Все манипуляции с экспериментальными жи-
28. R. Re, N. Pellegrini, A. Proteggente, et al., Free Rad.
вотными проведены в соответствии с Европей-
Biol. Med., 26, 1231 (1999).
ской конвенцией по защите позвоночных живот-
29. A. Balcerczyk, A. Grzelak, A. Janaszewska, et al., Bio-
ных, используемых в научных исследованиях.
factors, 17, 75 (2003).
30. J. Frijhoff, P. G. Winyard, N. Zarkovic, et al., Antioxid.
Redox. Signal., 23 (14), 1144 (2015).
СПИСОК ЛИТЕРАТУРЫ
31. A. el-Rahman, A. M. A. Hammouda, and A. Fakeir,
1. D. E. Rodríguez-Fuentes, L. E. Fernández-Garza,
Cytometry, 20, 19 (1995).
J. A. Samia-Meza, et al., Arch. Med. Res., 52 (1), 93
32. E. Nagababu, F. J. Chrest, and J. M. Rifkind, Free
(2021).
Radic. Biol. Med., 29 (7), 659 (2000).
2. Н. И. Костюк, С. В. Пинчук, И. Б. Василевич и др.,
33. S. Khandelwal and R. K. Saxena J. Biosci., 32, 1139
Экология и животный мир, 1, 70 (2020).
(2007).
3. A. Andrzejewska, B. Lukomska, and M. Janowski,
34. E. Nagababu, J. G. Mohanty, S. Bhamidipaty, et al.,
Stem Cells, 37 (7), 855 (2019).
Life Sci., 86 (3-4), 133 (2010).
4. R. M. Samsonraj, M. Raghunath, V. Nurcombe, et al.,
35. O. Erel, Clin. Biochem., 37, 277 (2004).
Stem Cells Transl. Med., 6 (12), 2173 (2017).
36. O. Savu, C. Ionescu-Tirgoviste, V. Atanasiu, et al., J.
5. T. Sun, G. Z. Gao, R. F. Li, et al., Am. J. Transl. Res.,
Int. Med. Res., 40 (2), 709 (2012).
7 (5), 891 (2015).
37. T. A. Watson, R. Callister, and R. D. Taylor, Med. Sci.
6. F. C. Goncalves, M. Grings. N. S. Nunes, et al., Bio-
Sports Exerc., 37 (1), 63 (2005).
technol. Lett., 39 (4), 613 (2017).
7. M. Inan, E. Bakar, A. Cerkezkayabekir, et al., J. Pedi-
38. K. Fisher-Wellman, H. K. Bell, and R. J. Bloomer, Ox-
atr. Surg., 52 (7), 1196 (2017).
id. Med. Cell Longev., 2 (1), 43 (2009).
БИОФИЗИКА том 67
№ 4
2022
782
ПИНЧУК и др.
Changes in Blood Antioxidant Parameters in Rats with Achilles Tendon Injury Treated
by Mesenchymal Stem Cell Therapy
S.V. Pinchuk*, I.B. Vasilevich*, A.Y. Molchanova**, A.A. Basalai**, and I.D. Volotovski*
*Institute of Biophysics and Cellular Engineering, National Academy of Sciences of Belarus,
Akademicheskaya ul. 27, Minsk, 220072, Republic of Belarus
**Institute of Physiology, National Academy of Sciences of Belarus,
Akademicheskaya ul. 28, Minsk, 220072, Republic of Belarus
This study aimed to explore the dynamics of oxidative stress in rats after lesion induction (damage to the
Аchilles tendon) and elucidate the effects adipose-derived mesenchymal stem cells have on this process after
the local injection of these cells at the injury site. The results obtained confirm that oxidative stress is present
in animals in the post-traumatic period, as evidenced by elevated blood levels of lipid peroxidation products,
a change in the average intensity of autofluorescence of erythrocytes registered by flow cytometry, and an in-
crease in the total antioxidant activity in blood plasma. Our findings indicate that in the process of oxidative
stress, mesenchymal stem cells exert a protective effect, thus providing the possibility to balance the body’s
response to increased oxidative damages. Data collected expand the knowledge of therapeutic mechanisms
of action of stem cells in injury treatment.
Keywords: Achilles tendon injury, oxidative stress, mesenchymal stem cells, cell therapy
БИОФИЗИКА том 67
№ 4
2022