БИОФИЗИКА, 2022, том 67, № 4, с. 805-818
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 57.056
МИКРОГЕМОДИНАМИКА КОЖИ И МЕХАНИЗМЫ ЕЕ РЕГУЛЯЦИИ
ПРИ САХАРНОМ ДИАБЕТЕ 2 ТИПА
© 2022 г. И.В. Тихонова*, А.А. Гриневич*, А.В. Танканаг*, В.Г. Сафронова*, #
*Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», Институтская ул., 3, Пущино Московской области, 142290, Россия
#E-mail: safronova@icb.psn.ru
Поступила в редакцию 26.04.2022 г.
После доработки 19.05.2022 г.
Принята к публикации 20.05.2022 г.
Приведены современные представления о периферической микрогемодинамике, о подходах к ана-
лизу колебаний кожного кровотока и их диагностической значимости. Рассмотрены нарушения
кожной микрогемодинамики при сахарном диабете 2 типа и возможность их интерпретации с по-
зиций внешних и внутренних взаимосвязей между системами регуляции кожного кровотока, осно-
ванной на сравнении связей в норме и при патологиях, в том числе с использованием моделей па-
тологий на животных. Обсуждены факторы и механизмы вазомоторной регуляции, включая рецеп-
торы и сигнальные события в эндотелиальных и гладкомышечных клетках, рассматриваемых как
модели микрососудов. Обращено внимание на нарушение Ca2+-зависимой регуляции сопряжения
между клетками сосудов и NO-зависимой регуляции вазодилатации при сахарном диабете. Основ-
ными механизмами устойчивости к инсулину при сахарном диабете 2 типа считаются дефект числа
рецепторов инсулина и нарушение трансдукции сигнала от рецептора к фосфатидилинозит-3-ки-
назе и нижележащим мишеням. Важную роль в нарушении функций сосудов при гипергликемии
играют активные формы кислорода. Предполагается, что рассмотренные молекулярно-клеточные
механизмы регуляции микрогемодинамики вовлечены в формирование колебаний кожного крово-
тока. Параметры микроциркуляции крови в коже могут рассматриваться как диагностические и
прогностические маркеры для оценки состояния организма.
Ключевые слова: микроциркуляция, сахарный диабет
2 типа, амплитудно-частотный анализ,
эндотелий, рецепторы вазоактивных факторов, сигнализация.
DOI: 10.31857/S0006302922040202, EDN: IVQOPR
ИССЛЕДОВАНИЕ ПЕРИФЕРИЧЕСКОЙ
организма [9-12]. Изменения в системе микро-
ГЕМОДИНАМИКИ И АНАЛИЗ КОЛЕБАНИЙ
циркуляции кожи коррелируют со сдвигами в
КОЖНОГО КРОВОТОКА
центральной гемодинамике, что позволяет ис-
пользовать параметры микроциркуляции крови в
Для исследования периферической гемодина-
коже в качестве диагностических и прогностиче-
мики человека существует большое число как ин-
ских маркеров оценки здоровья и общего физиче-
вазивных, так и неинвазивных методик. Среди
ского состояния организма [4, 11-14].
неинвазивных методик широкое применение по-
Известно, что кожный кровоток не является
лучили видеокапилляроскопия, фотоплетизмо-
стабильным, а подвержен временным и про-
графия, термография, оптическая когерентная
странственным вариациям, которые отражают
томография, лазерная допплеровская флоумет-
важнейшие характерные особенности микроцир-
рия (ЛДФ), а также разработанные на ее основе
куляции: изменчивость и приспособляемость к
лазерная допплеровская визуализация и лазерная
постоянно меняющимся условиям гемодинами-
контрастная визуализация спеклов [1-8]. Состо-
ки и к потребности тканей в перфузии кровью [15,
яние микроциркуляторного русла кожи и слизи-
16]. Поэтому в последние годы главным предме-
стых оболочек отражает как органоспецифиче-
том исследования микроциркуляции становятся
ские особенности кровотока, так и изменения,
механизмы ее лабильности, поскольку именно
происходящие в системе микроциркуляции всего
ритмические флуктуации кровотока несут ин-
Сокpащения: ЛДФ - лазерная допплеровская флоуметрия,
формацию о состоянии систем регуляции пери-
СД - сахарный диабет, ФВК - фазовая вейвлет-когерент-
ферической микрогемодинамики.
ность, АФК - активные формы кислорода, TRP - транзи-
В полосе частот от 0.005 до 2 Гц выделяют не-
торный рецепторный потенциал, SOC - депо-зависимый
сколько неперекрывающихся частотных диапа-
кальциевый канал (Store Operated Channel), eNOS - эндоте-
зонов колебаний скорости кровотока в микро-
лиальная NO синтаза (endothelial NO synthase), NOX -
NADPH-оксидаза.
циркуляторном русле кожи человека [17]. Для
805
806
ТИХОНОВА и др.
каждого из диапазонов характерны свои частот-
Наиболее часто диагностируемые осложнения у
ные интервалы, колебания в которых отражают
больных СД связаны с нарушением микроциркуля-
влияние сердечных сокращений, движений груд-
ции, что ведет к язвам стоп, ретинопатии, нейропа-
ной клетки, миогенной активности гладкомы-
тии, диабетической дермопатии и ослабленному за-
шечных клеток сосудов, нейрогенной регуляции
живлению ран [40, 41, 45]. Эти связанные с диабетом
активности стенки сосудов и сосудодвигательной
микрососудистые дисфункции могут в конечном
активности эндотелия сосудов. Наибольший ин-
итоге привести к более тяжелым осложнениям, что
терес представляют низкочастотные колебания
указывает на необходимость выявления микрососу-
кровотока (0.005-0.2 Гц), которые отражают вли-
дистых нарушений как на ранней стадии заболева-
яние локальных регуляторных процессов, связан-
ния, когда патологические изменения еще обрати-
ных с активностью гладкомышечных клеток сте-
мы, так и на более поздних стадиях для предотвра-
нок сосудов (0.06-0.2 Гц - диапазон миогенного
щения усугубления тяжести заболевания и
ритма) [18, 19], нейрогенным контролем (0.02-
адекватной коррекции лечения. Ранее была показа-
0.06 Гц - диапазон нейрогенного ритма) [20] и
на роль микрососудистых изменений в патогенезе
эндотелиальной активностью (0.005-0.02 Гц -
СД в отношении метаболизма [46, 47], влияния ок-
диапазон эндотелиального ритма) [17, 21].
сида азота (NO) [48], изменений периферической
Регистрация колебаний кожного кровотока
микроваскуляризации [49], кожной нейроваскуляр-
методом ЛДФ с последующим амплитудно-ча-
ной дисфункции [50], микрососудистой дисфунк-
стотным анализом полученных ЛДФ-грамм поз-
ции [51-54] и венозного растяжения [55]. Наруше-
воляет исследовать миогенную, нейрогенную и
ния микроциркуляции при диабете происходят в
эндотелиальную системы регуляции микроцир-
различных органах, в том числе в почках, глазах и
куляторного русла кожи как в покое, так и при
коже. Наиболее доступным и удобным объектом не-
проведении функциональных тестов (окклюзи-
инвазивного исследования микрососудистых нару-
онная, температурная и ионофоретическая про-
шений является кожа. С использованием метода
бы). Функциональные тесты используются для
ЛДФ было показано нарушение кожной микроцир-
оценки состояния систем регуляции перифери-
куляции уже на ранних стадиях заболевания [56]. У
ческого кровотока и выявления их адаптацион-
предиабетических больных и больных СД выявлены
ных резервов к условиям кратковременной ише-
изменения кровотока и свойств сосудов [57-62].
мии [22-25], изменению температуры [4, 22, 26-
Одним из наиболее часто используемых и удобных
29], в ответ на действие вазоактивных веществ
функциональных тестов оценки реактивности мик-
(ацетилхолин, нитропруссид, кальциевые блока-
рососудов кожи у больных СД 2 типа является теп-
торы) [4, 11, 30-33] и для оценки патологических
ловая проба (локальный нагрев кожи), которая поз-
изменений при социально-значимых заболева-
воляет оценить роль механизмов, участвующих в ре-
ниях, в том числе при сахарном диабете [34].
гуляции вазодилатации, и выявить изменение
адаптационных возможностей микрососудистого
НАРУШЕНИЯ КОЖНОЙ
русла [26, 40, 63-68]. Однако в большинстве иссле-
МИКРОГЕМОДИНАМИКИ ПРИ САХАРНОМ
дований кожной микрогемодинамики методом
ДИАБЕТЕ 2 ТИПА
ЛДФ анализируются только интегральные парамет-
Сахарный диабет 2 типа (СД 2 типа) — хрониче-
ры, характеризующие перфузию кожи кровью (по-
ское метаболическое заболевание, проявляющееся
казатель микроциркуляции), и уделяется мало вни-
нарушением углеводного обмена с развитием ги-
мания спектральному составу сигналов, который
пергликемии вследствие инсулинорезистентности,
позволяет оценивать регуляторные системы крово-
секреторной дисфункции бета-клеток, а также на-
тока и его адаптационные возможности. Кроме то-
рушением липидного обмена. Эта форма охватывает
го, полученные разными авторами данные бывают
лиц с относительной (а не абсолютной) недостаточ-
порой противоречивыми. Спектральный анализ
ностью инсулина и периферической резистентно-
ЛДФ-грамм, зарегистрированных на ноге (лодыж-
стью к инсулину. Хотя конкретная этиология неиз-
ка), показал, что у больных СД относительная спек-
вестна, автоиммунного разрушения бета-клеток не
тральная мощность в частотных диапазонах эндоте-
происходит, и у пациентов нет никаких других из-
лиальной, нейрогенной и миогенной активности
вестных причин диабета. Большинство пациентов с
была значительно ниже соответствующего показа-
диабетом 2 типа имеют избыточный вес или ожире-
теля у здоровых испытуемых даже в покое [69]. В то
ние [35]. Одной из основных причин осложнений и
же время другие авторы обнаружили повышение
смертности пациентов с СД 2 типа является разви-
перфузии кожи кровью у больных СД 1 и 2 типов, а
тие макро- и микрососудистых нарушений [36, 37].
также снижение амплитуд колебаний кровотока в
Диабет сопровождается развитием сердечно-сосу-
частотном диапазоне эндотелиальной и нейроген-
дистых заболеваний и макрососудистых осложне-
ной активности относительно здоровых доброволь-
ний, таких как атеросклероз, ишемическая болезнь
цев в покое [34]. Локальный нагрев также приводил
сердца и заболевания периферических артерий, и
к уменьшению вазодилататорного ответа и ампли-
является фактором, отягощающим течение корона-
туд спектральных компонент в частотных диапазо-
вирусной болезни (COVID-19) [38-44].
нах эндотелиальной и нейрогенной активности [34].
БИОФИЗИКА том 67
№ 4
2022
МИКРОГЕМОДИНАМИКА КОЖИ И МЕХАНИЗМЫ ЕЕ РЕГУЛЯЦИИ
807
В другом исследовании, наоборот, наблюдалась ис-
верные медианные значения в сердечном, респи-
ходно более низкая микрососудистая перфузия и
раторном и миогенном интервалах [71]. Показано
больший сосудорасширяющий резерв при локаль-
изменение внешних взаимосвязей между процес-
ном нагреве у пациентов с СД по сравнению с ука-
сами регуляции кожной гемодинамики верхних и
занными параметрами в контрольной группе [29].
нижних конечностей у условно здоровых добро-
Несмотря на многообразие исследований микро-
вольцев при ортостазе [72]. У здоровых испытуе-
циркуляции у больных СД, сложно сравнивать дан-
мых ортостаз увеличивал групповую ФВК между
ные различных исследований между собой, а также
колебаниями кожного кровотока на стопе и вари-
собственные данные с результатами, полученными
абельностью сердечного ритма или дыханием, а
другими авторами. Причины могут быть в следую-
также между колебаниями кожного кровотока на
щем: 1) не всегда указывается тип СД, либо исследо-
предплечье и стопе на частоте дыхания (~0.3 Гц).
вания проводятся в смешанной группе больных СД
Изменение внешних взаимосвязей между про-
1 и 2 типов, без разделения на типы; 2) в большин-
цессами регуляции периферической микроцирку-
стве исследований методом ЛДФ оцениваются
ляции наблюдается с возрастом и при патологиях. У
только интегральные параметры кожного кровотока
больных СД 1 типа обнаружено ослабление фазовых
без проведения спектрального анализа, что не поз-
взаимосвязей между респираторной активностью и
воляет оценить изменения в функционировании ре-
периферическим пульсом, реконструированным
гуляторных систем микрогемодинамики при пато-
при помощи алгоритма мульти-гауссового модели-
логии; 3) регистрация параметров микроциркуля-
рования из экспериментальных ЛДФ-сигналов [29].
ции проводится на разных участках кожного
При исследовании взаимосвязей между вариабель-
покрова; 4) часто анализ результатов является не-
ностью сердечного ритма, дыхательным ритмом и
корректным из-за формирования групп, когда в ка-
колебаниями микрогемодинамики кожи у здоровых
честве контроля выступают условно здоровые доб-
молодых и пожилых добровольцев и пожилых паци-
ровольцы молодого возраста (до 35 лет), тогда как
ентов с гипертонической болезнью показано разли-
средний возраст больных СД 2 типа более 50 лет; 5)
чие ФВК между группами. Была выявлена направ-
при проведении тепловой пробы разными исследо-
ленность и функциональная зависимость силы свя-
вательскими группами температура, скорость и дли-
зей от частоты спектральных компонент
тельность локального нагрева сильно варьируют.
измеряемых сигналов: с возрастом сила внешних
Указанные причины объясняют противоречивость
взаимосвязей между системами регуляции кожной
результатов исследований кожной микроциркуля-
микрогемодинамики снижается, а у пациентов с ги-
ции у человека. Решением проблемы может быть
пертонической болезнью практически исчезает на
корректное планирование и стандартизация прото-
частоте 0.1 Гц [76].
колов экспериментов с целью воспроизводимости и
возможности сравнения результатов, полученных
Активность сердца и дыхательные экскурсии
разными группами.
определяют центральный механизм регуляции кож-
ной микрогемодинамики, обуславливающий высо-
ВНЕШНИЕ И ВНУТРЕННИЕ
кочастотные колебания (кардио- и респираторный
ВЗАИМОСВЯЗИ МЕЖДУ СИСТЕМАМИ
ритмы). Они формируются за счет пассивного изме-
РЕГУЛЯЦИИ КОЖНОГО КРОВОТОКА
нения давления крови в микрососудах при дыхании
В НОРМЕ, ПРИ ГИПЕРГЛИКЕМИИ
и сердечном выбросе, что приводит к эластичному
И САХАРНОМ ДИАБЕТЕ
растяжению стенок сосудов, в том числе их мышеч-
В настоящее время ряд исследований направ-
ных компонент. Пассивное растяжение гладкомы-
лен на поиск и оценку внешних и внутренних вза-
шечных клеток способствует увеличению концен-
имосвязей между системами регуляции кожного
трации Ca2+ в цитозоле ([Ca2+]i) [77, 78]. Изменение
кровотока. Оценка внешних взаимосвязей как
активности сердца характеризуется колебаниями
между регуляторными системами, так и между
вариабельности сердечного ритма. Эти колебания
процессами регуляции кожного кровотока на
формируются вегетативной и центральной нервной
различных участках микроциркуляторного русла
системой, активностью баро- и хеморецепторов, ре-
производится при помощи функции фазовой
спираторной и эндокринной регуляцией [79, 80].
вейвлет-когерентности (ФВК) [70, 71], групповой
Известно, что барорефлекс и прямое взаимодей-
ФВК [72], или нелинейного моделирования и
ствие между парасимпатической и симпатической
Байесовского метода [73, 74].
системами регуляции определяют доли низкоча-
В низкочастотной области спектра в интерва-
стотных и высокочастотных компонент в спектре
лах нейрогенного и миогенного ритмов показано
колебаний вариабельности сердечного ритма, ха-
изменение ФВК между колебаниями температу-
рактеризующих симпато-вагальный баланс [81]. На-
ры и кровотока кожи у здоровых добровольцев в
рушения симпато-вагального баланса могут проис-
ответ на холодовой стресс [70, 75]. При оценке
ходить при патологиях: у пациентов с гипертониче-
ФВК кожного кровотока на предплечьях между
ской
болезнью
за
счет
сниженной
контрлатеральными участками у здоровых добро-
барорефлекторной активности [82], у больных СД 2
вольцев в покое нами выявлены высокие досто-
типа вследствие автономной нейропатии [50, 83-
БИОФИЗИКА том 67
№ 4
2022
808
ТИХОНОВА и др.
85]. Эффекторами эндотелиального и нейрогенного
микрогемодинамики у крыс в различных условиях
воздействий являются гладкомышечные клетки
(старение, стресс, острая и хроническая гипоксия,
микрососудов [6, 13, 86-89]. Существует также взаи-
переохлаждение, синдром ишемии/реперфузии) и
модействие между эндотелиоцитами и перифериче-
на модели СД 2 типа [92-104]. Значительное коли-
скими нейронами при посредстве NO, кальцито-
чество исследований направлено на изучение влия-
нин-ген связанного пептида (CGRP) и других меди-
ния физиологически активных соединений и фар-
аторов [86, 87, 90]. Более того, гладкомышечные
макологических препаратов на процессы, протека-
клетки обладают собственной спонтанной активно-
ющие в микроциркуляторном русле кожи животных
стью, которая обуславливает миогенную регуляцию
[105-110]. Следует отметить, что в большинстве ис-
микроциркуляторного кровотока.
следований на животных изменение микроцирку-
Анализ литературы показал, что внутренние свя-
ляции под действием стимулов оценивается только
зи не исследованы, тогда как внешние связи иссле-
по общей перфузии кожи. Встречаются единичные
дованы фрагментарно только у здоровых добро-
исследования ритмических компонент перифери-
вольцев, у больных СД 2 типа они остаются неизу-
ческой кожной микрогемодинамики [102, 111]. Ве-
ченными. Нами впервые была проведена оценка
роятно, это является следствием того, что необходи-
внутренних связей, характеризующих взаимодей-
мость обездвиживания животного для измерений и
ствие между регуляторными процессами, протекаю-
проведения функциональных проб с использовани-
щими в одном участке микроциркуляторного русла
ем традиционных методов анестезии может приво-
в малом объеме ткани [91]. Обнаружены перекрыва-
дить к изменениям в механизмах регуляции кожной
ющиеся области смежных частот со средними и
гемодинамики. Использование комбинированной
сильными внутренними связями, что характеризует
инъекционно-газовой анестезии «золетил-закись
взаимосвязи между механизмами регуляции кожно-
азота» позволило адекватно оценить параметры
го кровотока: центральными (респираторным и сер-
микроциркуляции животных в условиях, прибли-
дечным) и локальными (эндотелиальным, нейро-
женных к условиям нормального сна [112, 113]. В на-
генным и миогенным). Выявлено, что с возрастом
стоящее время наблюдается значительный рост за-
происходит увеличение количества внутренних свя-
болеваемости сахарным диабетом, преимуществен-
зей как между локальными, так и между локальны-
но
2-го типа, который опасен хроническими
ми и центральными механизмами регуляции. Мы
осложнениями, что диктует необходимость прове-
предполагаем, что изменения в описанных выше
дения широких исследований для поиска эффек-
механизмах, вызванные патологическими наруше-
тивных мер его профилактики и лечения [114]. Ча-
ниями, будут приводить к изменению количества и
стично решить эту проблему позволят эксперимен-
силы внешних и внутренних связей между процес-
тальные модели на животных, наиболее
сами, регулирующими кожную перфузию. Форми-
чувствительных к развитию СД, с использованием
рование представлений о внутренних и внешних
адекватных методов его индуцирования. Существу-
связях между процессами регуляции микроцирку-
ет множество способов создания моделей диабета на
ляторного кровотока может дать основание для их
животных, например, с применением антиинсули-
рассмотрения в качестве надежных неинвазивных
новой сыворотки или антагонистов рецептора инсу-
биомаркеров функционального состояния сердеч-
лина, панкреатэктомии, инфузии глюкозы, цито-
но-сосудистой системы при патологических изме-
токсических для бета-клеток агентов и вирусов, а
нениях в организме человека.
также вызванных диабетогенными питательными и
гормональными факторами [115-117]. Однако боль-
шинство используемых в настоящее время экспери-
ИССЛЕДОВАНИЕ НАРУШЕНИЙ
ментальных моделей СД (хирургическая, химиче-
МИКРОЦИРКУЛЯЦИИ У ЖИВОТНЫХ
ская, эндокринная, иммунная, генетическая) не
НА МОДЕЛЯХ ПАТОЛОГИЙ (НА ПРИМЕРЕ
подходят для изучения СД 2 типа, поскольку связа-
САХАРНОГО ДИАБЕТА)
ны или вызывают значительную деструкцию бета-
В настоящее время основная часть работ по ис-
клеток в островках Лангерганса поджелудочной же-
следованию микроциркуляции методом ЛДФ про-
лезы, что характерно для СД 1 типа.
водится с участием добровольцев и пациентов с па-
тологиями. Однако такие исследования имеют ряд
Патофизиология СД 2 типа основана главным
этических и методических ограничений, поэтому
образом на снижении чувствительности тканей к
становится необходимым проведение исследований
инсулину, что в дальнейшем приводит к снижению
с привлечением моделей патологий на животных.
его секреции. Эти процессы вызывают гиперглике-
Исследование кожного кровотока у лабораторных
мию с последующим повреждением различных ор-
животных по соответствующим этическим прото-
ганов. Создание и использование в исследованиях
колам позволяет экспериментально подтверждать
модели СД 2 типа на животных, близкой по этиоло-
гипотезы, проверка которых невозможна в исследо-
гии и течению к СД 2 типа у человека, сложно, но
ваниях с участием добровольцев. Известны работы,
очень важно, так как это поможет понять патофи-
посвященные исследованию микроциркуляции ко-
зиологию заболевания, а также даст новые идеи для
жи у животных, преимущественно у крыс. В частно-
научных работ, связанных с терапевтическими про-
сти, исследованы особенности периферической
цедурами [118]. Как показал анализ современной
БИОФИЗИКА том 67
№ 4
2022
МИКРОГЕМОДИНАМИКА КОЖИ И МЕХАНИЗМЫ ЕЕ РЕГУЛЯЦИИ
809
литературы, для моделирования СД 2 типа наиболее
также результаты гистологии и гистохимии подже-
подходящими животными являются грызуны (пре-
лудочной железы и других органов [35].
имущественно мыши), а также мини-свиньи. Ис-
пользуются следующие подходы: моно- или поли-
ФАКТОРЫ И МЕХАНИЗМЫ
генное ожирение, диета с высоким содержанием
ВАЗОМОТОРНОЙ РЕГУЛЯЦИИ
жиров, модель без ожирения и генетически индуци-
Эндогенные и экзогенные вазоактивные факто-
рованная модель [115, 116]. В большинстве моделей
ры действуют на кровеносные сосуды, вызывая ва-
провоцируется ожирение, что отражает состояние
зоконстрикцию или вазодилатацию. Вазоактивны-
людей, у которых ожирение является одной из ос-
ми являются гормоны, пептиды, продукты липид-
новных причин развития СД 2 типа [119]. В экспе-
ного обмена, протеазы, внеклеточные везикулы,
риментальных моделях СД 2 типа используются как
низкомолекулярные вещества (например, оксид
генетически модифицированные животные (мыши
азота - NO, пероксид водорода - H2O2), факторы
С57BL/KsJYLeprdb/+, мыши db/db, мыши New
внешней и внутренней среды (температура, сдвиго-
Zealand Obese, мыши TALLYHO/Jng, крысы Obese
вый стресс, давление, рН, парциальное давление
Zucker Diabetic Fatty - OZDF), так инбредные и аут-
кислорода или CO2). Их действие опосредовано ак-
бредные линии грызунов (мыши C57BL/6 и
тивацией определенных рецепторов, сигнальных
BALB/c, крысы Wistar) [115, 116, 120-126]. Так как у
путей или действием на внутриклеточные компо-
человека в этиологии СД 2 типа (так же как и ожире-
ненты в эндотелиальных и гладкомышечных клет-
ния) основное значение имеет избыточное по кало-
ках [4, 13, 133-139].
рийности питание, наиболее адекватными пред-
В регуляции вазоактивности участвуют мембран-
ставляются индуцированные диетой модели на раз-
личных видах животных. Рацион питания оказывает
ные рецепторы и ионные каналы: Ca2+-активируе-
существенное влияние на развитие патологии. Так,
мый K+-канал высокой проводимости, потенциало-
для развития ожирения и СД 2 типа у мышей
зависимый K+-канал, механочувствительные ион-
C57BL/6 требуется высокожировой рацион пита-
ные каналы, рецепторы - ионные каналы (пурино-
ния, включающий до 60% жира, причем более быст-
вые, изоформы транзиторного рецепторного потен-
рый и выраженный эффект достигается при добав-
циала (TRP), никотиновые рецепторы ацетилхоли-
лении в рацион большого количества сахарозы или
на); рецепторы, сопряженные с гетеротримерными
фруктозы [127, 128]. Рацион с высоким содержанием
ГТФ-связывающими белками (адренорецепторы, ре-
фруктозы (35-60% ккал за счет фруктозы) был ис-
цепторы аденозина, серотонина, вазопрессина, эндо-
пользован для индукции инсулинорезистентности у
телина и другие), рецепторы - тирозиновые киназы
крыс линии Wistar [124, 129]. Для индукции СД 2 ти-
(инсулиновый рецептор, Tie1-2, рецепторы факторов
па у мини-свиней также рекомендовалось исполь-
роста) [140-142], протеин-тирозиновые фосфатазы
зовать высокожировой рацион с добавлением боль-
рецепторного типа [143-145]. Примерами принци-
шего количества сахарозы [130].
пиальных схем активации компонентов внутри- и
Таким образом, наиболее близкими по этио-
межклеточной коммуникации при действии вазоак-
логии и механизмам развития к СД 2 типа у чело-
тивных факторов могут служить следующие последо-
века являются модели, индуцированные диетами,
вательности передачи сигнала: 1) фосфолипаза А2 →
среди которых наиболее эффективны высокожи-
→ 828цитохром Р450 → эйкозаноиды → Ca2+-активи-
ровые и высокоуглеводные рационы. Некоторые
авторы для ускорения развития диет-индуциро-
руемый K+-канал высокой проводимости, активация
ванного СД 2 типа рекомендуют использовать не-
которого приводит к гиперполяризации мембраны
большие, индивидуально рассчитанные дозы
гладкомышечных клеток и последующей релаксации
стрептозотоцина, позволяющие не разрушать
сосуда (например, при сдвиговом стрессе); 2) эндоте-
полностью бета-клетки поджелудочной железы,
лиальная NO-синтаза → выброс NO → гладкомышеч-
как это имеет место при СД 1 типа [104, 116, 131].
ные клетки
- растворимая гуанилатциклаза
→
Однако инъекция стрептозотоцина является до-
→ цГМФ → протеинкиназа G → изменение концентра-
полнительным стрессовым фактором и может
ции Са2+ в цитозоле → Ca2+-активируемый K+-канал
привести к усилению тяжести и развитию более
высокой проводимости; 3) оксидазы (NADPH-окси-
поздних прогрессирующих стадий заболевания
даза, ксантиноксидаза и другие) → активные формы
[132]. Кроме того, такие модели чрезвычайно тру-
кислорода (АФК) → понижение уровня NO и/или по-
доемки и требуют постоянного мониторинга ме-
вышение уровня H2O2. Приведенные схемы могут
таболических параметров.
быть детализированы трансдукцией сигналов от
Основными критериями развития СД и эффек-
определенных рецепторов вазоактивных агентов,
тивности используемых лечебно-профилактиче-
участвующих в формировании внешних или внут-
ских мероприятий являются содержание глюкозы,
ренних связей до внутриклеточных эффекторных мо-
инсулина и гликозилированного гемоглобина в
лекул. Каждая из приведенных схем активации не яв-
плазме крови, количество бета-клеток в островках
ляется полной и в определенной степени условна, так
поджелудочной железы, результат глюкозотоле-
как представляет собой обобщение результатов ис-
рантного теста, индекс инсулинорезистентности, а
следований сосудов разных органов человека и жи-
БИОФИЗИКА том 67
№ 4
2022
810
ТИХОНОВА и др.
вотных, тогда как известно, что регуляция кровотока
под действием инозитол-1,4,5-трифосфата из эндо-
в микрососудистом русле является видо- и тканеспе-
плазматического ретикулума, не обнаружены [165].
цифичной [146-148]. В некоторых случаях ингибито-
Было показано, что каналы с транзиторным рецеп-
ры и активаторы определенных сигнальных компо-
торным потенциалом (каналы семейства TRP:
нентов вводились ионофоретическим способом, при
TRPC - канонические, TRPV - ванилоидные,
котором возможно влияние агентов на окружающие
TRPM - меластатиновые, TRPML - муколипино-
ткани [13, 149]. Кроме того, схемы построены с вклю-
вые) вовлечены в изменения и дисфункцию сосудов
чением результатов, полученных на крупных сосудах,
при диабете и ожирении или потенциально связаны
поэтому их приложение к микрососудистому руслу
с сосудистой дисфункцией [166]. Гипергликемия и
требует дальнейших исследований. Следует обратить
диабет приводили к уменьшению экспрессии кана-
внимание, что изложенные представления фактиче-
лов TRPV4 и его функциональной активности в эн-
ски не объясняют механизмы формирования колеба-
дотелиальных клетках микрососудов сетчатки глаза
ний периферического кровотока, которые характери-
[167]. Показано уменьшение экспрессии Ca2+-чув-
зуют более полно состояние микрососудистого русла
ствительного рецептора на эндотелиальных и глад-
и значительно изменяются при патологиях, в том чис-
комышечных клетках аорты у мышей с ожирением и
ле при СД 2 типа [150-153].
СД 2 типа, что может вовлекаться в развитие диабе-
тической васкулопатии [168]. Изменение активно-
ИЗМЕНЕНИЕ Ca2+-ЗАВИСИМОЙ
сти потенциало-зависимых каналов кардиомиоци-
РЕГУЛЯЦИИ СОПРЯЖЕНИЯ МЕЖДУ
тов, наблюдаемое при диабетической кардиомиопа-
ЭНДОТЕЛИАЛЬНЫМИ И МЫШЕЧНЫМИ
тии, сопровождающей СД 2 типа, приводит к
КЛЕТКАМИ СОСУДОВ ПРИ САХАРНОМ
изменению сердечного ритма и сократительной
ДИАБЕТЕ
функции сердца
[169]. Предполагается, что
Основными механизмами регуляции сократимо-
следствием этого будет изменение профиля вариа-
сти гладкомышечных клеток считаются изменения
бельности сердечного ритма, которое повлияет на
мембранного потенциала и Са2+-метаболизм. Среди
спектральные характеристики и отразится на внеш-
регуляторных факторов следует особо отметить NO,
них и внутренних связях. Также при СД 2 типа нару-
Ca2+, метаболиты арахидоновой кислоты, АФК, а
шены Са2+-зависимые механизмы активации NA-
также редокс- и потенциало-чувствительность регу-
DPH-оксидазы, связанные с нарушением полиме-
ляторных партнеров. Вопрос о Са2+-сигнализации в
ризации актина и Са2+-транспорта [170, 171]. В
эндотелиоцитах и гладкомышечных клетках микро-
нейтрофилах больных СД 2 типа наблюдается повы-
сосудов в норме и при СД 2 типа требует уточнения.
шение базового уровня [Са2+]i и снижение пика
Упомянутый выше Ca2+-активируемый K+-канал
высокой проводимости, включенный в эндотели-
Са2+-ответов на стимулы [172]. Предполагается, что
ально-мышечную коммуникацию, исследован в ос-
это связано с нарушениями либо входа Са2+, либо
новном на крупных сосудах человека или животных
его высвобождения из внутриклеточных депо или
[135, 154, 155]. В кальциевом метаболизме в эндоте-
обоих процессов. Перечисленные нарушения Са2+
лиальных клетках разных тканей участвуют: рецеп-
регуляции в сосудах при СД 2 типа исследованы
торы инозитол-1,4,5-трифосфата, ответственные за
главным образом на клетках крупных сосудов. Оста-
выброс Са2+ из эндоплазматического ретикулума,
ется неизвестным, как Са2+-регуляция участвует в
изоформы катионного канала транзиторного рецеп-
формировании ритмических процессов в микро-
торного потенциала (TRP), члены ORAI семейства
циркуляторном русле.
кальциевых каналов, депо-зависимые кальциевые
каналы (SOC), эндотелиальный T-тип потенциало-
зависимых кальциевых каналов, Ca2+-АТФаза 2a
NO-ЗАВИСИМАЯ РЕГУЛЯЦИЯ
эндоплазматического ретикулума (SERCA2a), Ca2+-
ВАЗОДИЛАТАЦИИ И ЕЕ НАРУШЕНИЯ
АТФазы плазматической мембраны (PMCA1 и PM-
ПРИ САХАРНОМ ДИАБЕТЕ
CA4), Na+/Ca2+-обменник [156-161]. В гладкомы-
Одним из универсальных трансмиттеров,
шечных и эндотелиальных клетках, а также в пери-
участвующих в вазодилатации, является NO. Он
цитах микрососудов ионные каналы вносят важный
продуцируется из L-аргинина с помощью NO
вклад в регуляцию взаимодействия клеток и функ-
синтаз в присутствии кофакторов, включая тетра-
ций микрососудов путем генерации сигналов внут-
гидробиоптерин, ФАД, СаМК и другие [173]. Ак-
риклеточного Са2+ и мембранного потенциала [162-
тивность эндотелиальной NO-синтазы (eNOS)
164]. При СД Ca2+-гомеостаз и механизмы регуля-
регулируется на транскрипционном, посттран-
ции концентрации Ca2+ в цитозоле эндотелиоцитов
скрипционном и посттрансляционном уровнях
кровеносных сосудов могут быть изменены. Так, в
[90, 174]. Одним из основных механизмов пост-
эндотелии аоpты крыс линии OZDF (тучные диабе-
трансляционной модификации eNOS является
тические крысы - Obese Zucker Diabetic Fatty rat)
фосфорилирование, которое может осуществ-
выявлено понижение SOC-зависимого входа Ca2+,
ляться протеинкиназой C, протеинкиназой B,
тогда как различия в пуле Са2+, высвобождаемого
Ca2+/кальмодулин-зависимой протеинкиназой,
БИОФИЗИКА том 67
№ 4
2022
МИКРОГЕМОДИНАМИКА КОЖИ И МЕХАНИЗМЫ ЕЕ РЕГУЛЯЦИИ
811
протеинкиназой A, PI3K/протеинкиназой B,
вает его автофосфорилирование по тирозиновым
АМФ-активируемой протеинкиназой, активиру-
остаткам и последующее фосфорилирование суб-
емыми через рецепторы - тирозиновые киназы,
страта инсулинового рецептора-1 (IRS-1), активи-
G-белок-сопряженные рецепторы или сдвиго-
рующего затем Са2+-независимый сигнальный путь
вым стрессом [135, 174]. Активация eNOS может
фосфатидилинозитол-3-киназа/фосфоинозитид-
происходить Са2+-зависимым или Са2+-незави-
зависимая киназа-1/протеинкиназа B. Дальнейши-
симым образом, например, Ca2+/кальмодулин-
ми событиями являются активация eNOS в эндоте-
лиальных клетках, транслокация транспортера глю-
зависимой протеинкиназой и сдвиговым стрес-
козы GLUT4 в плазматическую мембрану, регуля-
сом соответственно [173]. На культуре эндотели-
альных клеток микрососудов головного мозга че-
ция синтеза гликогена, белков, липидов и
потребления глюкозы [179-181]. В клетках разных
ловека показан Са2+-зависимый выброc NO,
тканей существуют особенности действия инсули-
инициированный арахидоновой кислотой [175].
на, регуляции транспорта глюкозы и метаболизма.
Роль перечисленных сигнальных компонентов
Следует отметить, что в эндотелии сигнальный путь
исследована фрагментарно в колебательных про-
фосфатидилинозитол-3-киназа/протеинкиназа B
цессах в микроциркуляторном русле. Так,
обеспечивает вазодилатацию и плейотропное дей-
спектральный анализ с применением вейвлет-
ствие инсулина на метаболизм. Инсулин через сиг-
преобразования выявил значительное снижение
нальный путь Sos/Ras/Raf/MAPK (Sos - адаптер-
амплитуд колебаний микроциркуляции поджелу-
ный белок (Son of sevenless), Ras - малая ГТФаза се-
дочной железы у спонтанно гипертензивных
мейства протоонкогенов Ras (Retrovirus associated
крыс в эндотелиальном диапазоне при развитии
DNA sequences), Raf - серин/треониновая протеин-
от 8- до 18-недельного возраста, что частично мо-
киназа семейства протоонкогенов Raf (Rapidly accel-
жет быть объяснено увеличением уровней нитри-
erated fibrosarcoma), MAPK - митогенактивируемая
та/нитрата в плазме, эндотелина-1, малонового
протеинкиназа (mitogen activated protein kinase)) ак-
диальдегида и интерлейкина-6 и снижением
тивирует продукцию эндотелина-1, молекул адгезии
уровня супероксиддисмутазы в крови [176]. В
(VCAM-1 и E-селектина), что ведет к вазоконстрик-
комплексном исследовании спектральных харак-
ции, регулирует экспрессию генов, пролиферацию и
теристик осцилляций кожной микрогемодина-
рост клеток [179-181]. У мышей, находящихся на
мики мыши и колебаний концентраций Ca2+ и
высокожировом рационе, наблюдались гипертензия
NO в цитоплазме культивируемых эндотелиоци-
и сосудистая дисфункция не в результате дефектной
тов микрососудов мыши показано наличие низ-
передачи сигналов с рецептора инсулина через
кочастотных осцилляций концентраций как
ПКВ, а из-за опосредованного свободными жирны-
ми кислотами уменьшения уровня фосфорилирова-
Ca2+, так и NO в частотном интервале, совпадаю-
ния eNOS.
щем с интервалом NO-независимой эндотели-
Устойчивость эндотелия к инсулину обычно
альной активности кожной микроциркуляции
сопровождается подавлением фосфатидилинози-
[177]. В гладкомышечных клетках NO вызывает
тол-3-киназа/NO-сигнального пути и усилением
цГМФ-зависимое уменьшение частоты агонист-
или сохранением интактного состояния сигнали-
индуцированных колебаний Са2+ за счет сниже-
зации MAPK/эндотелин-1 [182, 183]. Так, в эндо-
ния мобилизации Са2+ из внутриклеточных запа-
телиальных клетках подкожных микрососудов,
сов [178]. Таким образом, колебательные межкле-
полученных из малых биопсий больных СД 2 ти-
точные сигналы, исходящие из эндотелиальных
па, выявлено увеличение фосфорилирования
клеток, могут взаимодействовать с колебаниями
ERK1/2 и повышение уровня экспрессии мРНК
в гладкомышечных клетках. Предполагается, что
эндотелина-1, действием которого можно объяс-
такое взаимодействие осцилляторов может отра-
нить избыточную активацию MAPK (ERK1/2),
жаться на изменении силы внешних и внутрен-
наблюдаемую у больных [184].
них связей в микроциркуляторном русле.
При СД 2 типа происходит нарушение регуляции
ПАТОФИЗИОЛОГИЧЕСКИЕ ФАКТОРЫ
eNOS в связи, как минимум, с двумя факторами:
РАЗВИТИЯ УСТОЙЧИВОСТИ К ИНСУЛИНУ
инсулинорезистентностью и гипергликемией. Ин-
Считается, что причинами развития устойчиво-
сулин играет важную роль в функционировании
сти к инсулину являются липотоксичность, глюко-
микрососудов, повышая экспрессию генов eNOS и
зотоксичность, воспалительный статус, дисфунк-
фактора роста эндотелия сосудов VGEF в эндотели-
ция митохондрий, стресс эндоплазматического ре-
альных клетках, увеличивая плотность капиллярной
тикулума, гиперинсулинемия на ранних стадиях СД
сети и усиливая NO-опосредованную вазодилата-
2 типа, а в некоторых случаях - понижение экспрес-
цию [4]. Резистентность к инсулину обычно опреде-
сии рецептора инсулина или мутации [185-188]. К
ляется как снижение чувствительности к инсулину
основным механизмам устойчивости к инсулину в
или скорости реагирования на метаболическое дей-
разных тканях относят дефект числа рецепторов ин-
ствие инсулина. В различных клетках здорового ор-
сулина и нарушение трансдукции сигнала от рецеп-
ганизма связывание инсулина с рецептором вызы-
тора к PI3K и нижележащим мишеням [189]. Кроме
БИОФИЗИКА том 67
№ 4
2022
812
ТИХОНОВА и др.
того, причиной может быть нарушение фосфорили-
требует уточнения, так как в настоящее время в
рования рецептора инсулина и сигнальных компо-
эндотелии определено присутствие изоформ
нентов вследствие активации Ser/Thr протеинкиназ
NOX1, NOX2, NOX4 и NOX5 (имеет сайты связы-
[190]. «Диабетогенные» факторы, особенно свобод-
вания Cа2+) с высокой степенью гомологии, ко-
ные жирные кислоты, воспалительные цитокины,
торые отличаются по активационным механиз-
АФК, гиперинсулинемия, чрезмерно увеличивают
мам [196-201]. Например, в активации NOX4 не
активность различных сериновых протеинкиназ,
участвуют цитоплазматические компоненты, она
регулирующих гомеостаз глюкозы, в том числе
имеет высокую конститутивную активность и
N-концевой киназы c-Jun, изоформ протеинкина-
обеспечивает в сосудах базовую продукцию АФК,
зы C, Rho-ассоциированной киназы [188, 191, 192].
а NOX5 отсутствует у грызунов. Активный ком-
Однако устойчивость к инсулину, как показано, яв-
плекс NADPH-оксидазы на основе NOX2 вклю-
ляется гетерогенным патологическим признаком,
чает мембранную субъединицу p22phox, цито-
возникающим по разным причинам в различных
плазматические субъединицы p47phox, p67phox,
тканях, но первичный механизм этого эффекта
p40phox и малый ГТФ-связывающий белок Rac1.
включает единый путь инсулинорезистентности
Наиболее интенсивно супероксидные радикалы
[193]. Этот механизм остается малоисследованным в
при активации NOX2 продуцируют полиморфно-
микрососудах, и его роль в установлении внешних и
ядерные нейтрофильные гранулоциты (нейтро-
внутренних взаимосвязей между системами регуля-
филы), к тому же они генерируют вторичные
ции кожного кровотока не изучена. В то же время
окислители за счет активности миелопероксида-
сосудистые осложнения - основная причина забо-
зы. При сахарном диабете нейтрофилы, самая
леваемости и смертности у больных СД, при этом
многочисленная и крайне реактивная популяция
микрососудистые осложнения, такие как невропа-
клеток крови, играют значительную роль в нару-
тия, нефропатия и ретинопатия, способствуют зна-
шении окислительно-восстановительного балан-
чительному снижению качества жизни при СД 2 ти-
са, ведущего к окислительному стрессу [202].
па [183]. Кровеносные сосуды страдают как от про-
грессирующего повреждения симпатических и
В развитии CД 2 типа окислительный стресс иг-
парасимпатических ганглиев, так и от прямого по-
рает важную роль: повышенный уровень АФК в
вреждения эндотелиальных клеток. Последнее яв-
крови является важным патогенетическим факто-
ляется результатом уменьшения биодоступности
ром, способствующим дисфункции эндотелия сосу-
NO вследствие повреждающего действия гипергли-
дов и гладких мышечных клеток [42]. Образование
кемии на eNOS или на кальциевые каналы типа
АФК, модифицирующих состояние сосудов в раз-
TRPV-4, либо уменьшения биодоступности L-арги-
личных органах, является результатом активности
нина, субстрата eNOS. В качестве причины также
множества ферментов и биохимических путей как в
рассматривается окислительный стресс, возникаю-
самих клетках, так и в клетках крови. Основные ис-
щий вследствие избыточной продукции АФК как
точники образования АФК при гипергликемии и
эндотелиальными, так и циркулирующими иммун-
диабете - автоокисление глюкозы, полиольный
ными клетками. Образующийся при этом перокси-
путь метаболизма глюкозы, образование конечных
нитрит служит дополнительным фактором повре-
продуктов гликирования, NADPH оксидазы, мито-
ждения.
хондриальная электронная транспортная цепь, не-
сопряженная активность eNOS, ксантиноксидаза
РОЛЬ АКТИВНЫХ ФОРМ КИСЛОРОДА
[203-205]. Потенцирование эндогенной антиокси-
В НАРУШЕНИИ ФУНКЦИЙ СОСУДОВ
дантной системы и применение терапевтических
ПРИ ГИПЕРГЛИКЕМИИ
препаратов, понижающих уровень АФК, может
улучшать состояние сосудистой системы в условиях
Источниками АФК в эндотелиальных клетках
гипергликемии [206]. В частности, бетаин, способ-
считаются NADPH-оксидазы, дыхательная цепь
ствующий выработке глутатиона, ингибирует пато-
митохондрий, NOS, ксантиноксидазы, перокси-
логическую неоваскуляризацию роговицы глаза
дазы, циклооксигеназы и липоксигеназы [194-
[207]. Благоприятное действие на состояние сосудов
196]. Центральная роль при этом принадлежит
оказывает также метформин, имеющий множе-
NADPH-оксидазе, катализирующей образование
ственное терапевтическое действие при СД 2 типа, в
супероксид-анион-радикала, предшественника
том числе в качестве антиоксиданта, осуществляя
других АФК. В нормальных условиях суперок-
прямой захват гидроксильного радикала, усиливая
сид-анион-радикал и продукт его дисмутации пе-
активность глутатион редуктазы, каталазы и су-
роксид водорода регулируют эндотелий-зависи-
пероксиддисмутазы и подавляя активность NA-
мую релаксацию и сократимость гладких мышц
DPH-оксидазы [208]. NADPH-оксидаза является
сосудов. При патологиях повышенная экспрес-
мишенью гипергликемии, которая вызывает нару-
сия и активность NADPH-оксидазы приводит к
шения в механизмах активации фермента, связан-
понижению уровня NO, ослаблению функций
ные с фагоцитозом и состоянием внутриклеточных
эндотелия, значительному повышению сократи-
мости [196]. Включение в сигнальные схемы
сигнальных систем, в том числе зависимых от Ca2+
обобщенного образа NADPH-оксидазы (NOX)
[171]. Прямое окисление сульфгидрильных боковых
БИОФИЗИКА том 67
№ 4
2022
МИКРОГЕМОДИНАМИКА КОЖИ И МЕХАНИЗМЫ ЕЕ РЕГУЛЯЦИИ
813
цепей является основным механизмом модифика-
и локальный механизмы регуляции кожного кро-
ции белков при действии АФК. Мишенями стано-
вотока и влияет на взаимосвязи регуляторных си-
вятся каналы, рецепторные белки, малые G-белки,
стем. Однако связи между интегральными харак-
ферменты. Так, H2O2 активирует TRP каналы в
теристиками микроциркуляторного кровотока и
культуре эндотелиальных клеток легочных микро-
процессами их регуляции, включающими харак-
сосудов человека и мыши [209]. Кроме того, в усло-
терные режимы осцилляций концентраций вне-
виях гипергликемии при СД 2 типа на фоне увели-
и внутриклеточных сигнальных посредников
ченного уровня АФК и метаболического истощения
(Ca2+, NO, АФК и другие), остаются малоиссле-
запасов антиоксидантов наблюдается повреждение
дованными как в норме, так и при патологиях. В
ДНК и изменение транскрипции генов. Сложная
изменение баланса внешних и внутренних связей
взаимосвязь между метаболизмом и эпигенетиче-
между процессами регуляции кожной микроге-
скими изменениями может обеспечить концепту-
модинамики в норме и при СД 2 типа вносят
альную основу для понимания того, как патологиче-
вклад компоненты основных сигнальных путей в
ские стимулы управляют развитием осложнений
эндотелиальных клетках при регуляторном воз-
при СД 2 типа [210]. Исследования роли АФК в
действии лейкоцитов крови. Хотя сигнализация в
этиологии СД 2 типа перспективны в значительной
самих эндотелиальных клетках и при их взаимо-
степени для разработки фармацевтических препара-
действии с гладкомышечными клетками изучена
тов на основе ингибиторов NOX [211]. Взаимодей-
довольно подробно, обращает на себя внимание
ствие сигнальных путей, включающих активацию
то, что схемы сигнальных событий построены с
кальциевого обмена и образование АФК, может ре-
включением результатов, полученных преимуще-
ализоваться в виде синергизма кальциевых ответов
ственно на крупных сосудах. Однако требуется
эндотелиальных клеток на вазоактивные агенты
большая осторожность при экстраполяции зако-
[212]. Кроме того, АФК, генерируемые в гладкомы-
номерностей, полученных на эндотелиальных
шечных клетках сосудов с участием NOX4 и NOX5,
клетках макрососудов, на микрососуды разнооб-
могут создавать обратную связь [196, 213, 214].
разных тканей и органов. Ограничение наклады-
вает то, что, несмотря на общее мезодермальное
ЗАКЛЮЧЕНИЕ
происхождение, они имеют фенотипическую,
Сахарный диабет 2 типа сопровождается раз-
структурную и функциональную гетерогенность
витием макро- и микрососудистых осложнений
[215-218], а экспрессия генов и их продуктов в
[36, 37]. Гипергликемия, ключевая особенность
клетках, адаптированных к условиям культиви-
диабета, считается основным механизмом, созда-
рования, и в нативных эндотелиальных клетках
ющим условия для возникновения микрососуди-
может различаться вследствие различного ло-
стых нарушений, являющихся основной причи-
кального микроокружения и эпигенетической
ной развития ретинопатии, нефропатии, диабе-
модификации [159, 217, 218]. Кроме того, нет од-
тической кардиомиопатии и периферической
нозначного понимания соответствия молекуляр-
невропатии. Механизмы, способствующие раз-
но-клеточных механизмов интегральным пара-
витию диабетической микроангиопатии, включа-
метрам микроциркуляторного кровотока. Необ-
ют окислительный стресс, нарушение регуляции
ходимы комплексные исследования на целом
регенерации сосудов и функций клеток сосудов
организме и на культивируемых клетках, чтобы
(эндотелиальных, гладкомышечных и стромаль-
создать основу для понимания молекулярно-кле-
ных клеток, перицитов), а также иммунных кле-
точных механизмов регуляции ритмических про-
ток, взаимодействующих с эндотелием. Эндоте-
цессов кровотока в микроциркуляторном русле
лиальная дисфункция при СД характеризуется
кожи человека, а также оценить роль внутрикле-
ослаблением эндотелий-зависимой вазодилата-
точных мишеней вазоактивных воздействий в
ции и относительным преобладанием вазокон-
формировании колебаний периферического кро-
стрикции, гиперкоагуляцией и увеличением про-
вотока и его модуляции при СД 2 типа. Развитие
ницаемости сосудистой стенки. Все это приводит
представлений о внутренних и внешних связях
к нарушению кровотока в микрососудистой си-
между процессами регуляции микроциркулятор-
стеме и развитию диабетических осложнений.
ного кровотока может дать основание для их рас-
Поэтому в настоящее время актуален поиск эф-
смотрения в качестве надежных неинвазивных
фективных маркеров функционального состоя-
биомаркеров функционального состояния сер-
ния микрососудов для ранней диагностики со-
дечно-сосудистой системы при патологических
судистых нарушений. Анализ характерных
изменениях в организме человека.
частотных режимов осцилляций кожного микро-
циркуляторного кровотока, формируемых под
влиянием нервной системы, легких, сердца и эн-
ФИНАНСИРОВАНИЕ РАБОТЫ
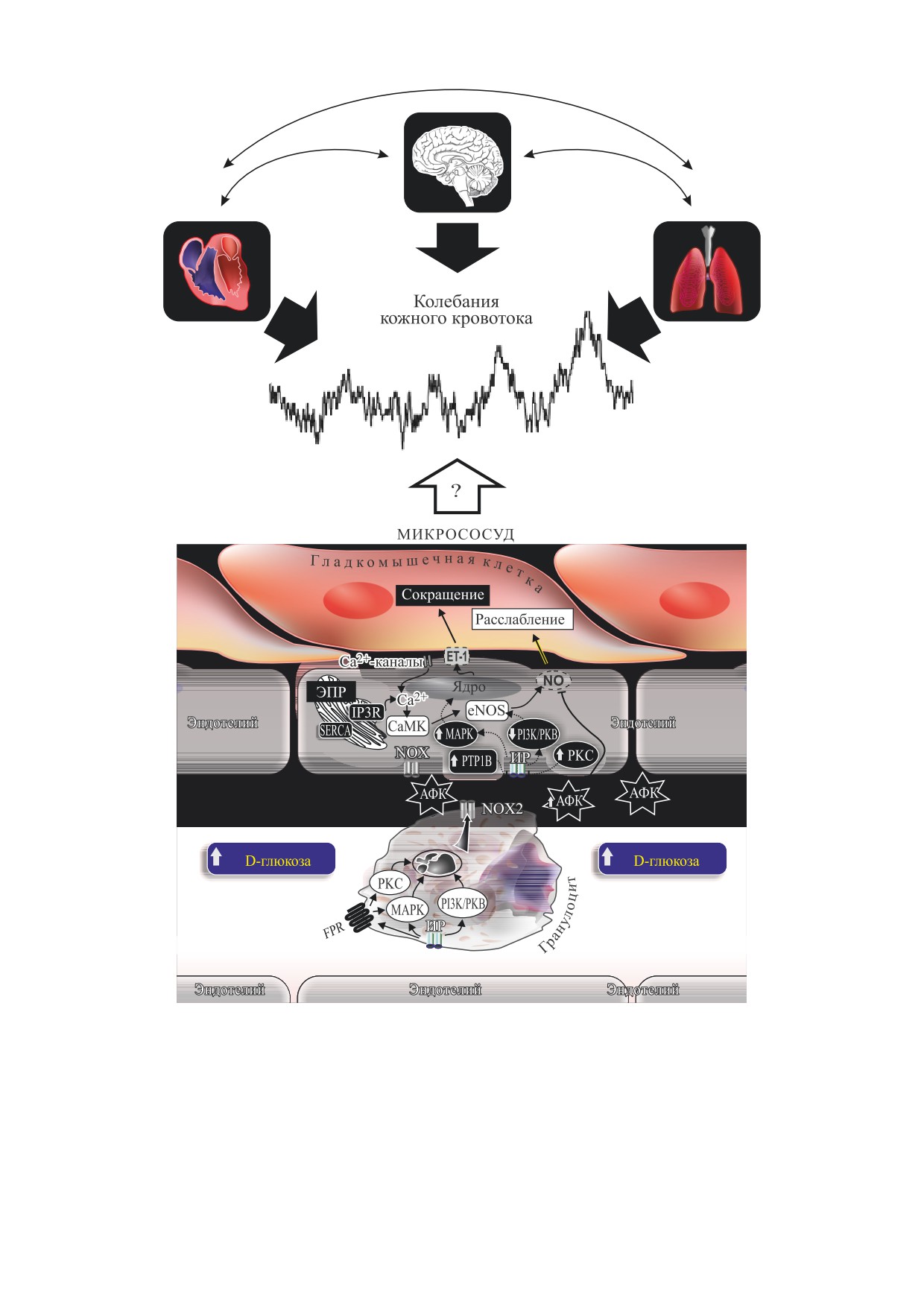
дотелия сосудов (рис. 1), может внести значи-
тельный вклад в решение этой проблемы. Симпа-
Работа выполнена при финансовой поддержке
то-вагальный баланс с участием эндогенных ва-
Российского научного фонда (грант № 22-15-
зоактивных агентов обуславливает центральный
00215).
БИОФИЗИКА том 67
№ 4
2022
814
ТИХОНОВА и др.
Рис. 1. Схема взаимосвязей в
регуляции колебаний кожного кровотока у человек
а
и животных. Белые стрелки
указывают на изменения активности ферментов или количества метаболитов при са
х
арном диабете 2 типа; черные
стрелки показывают направлен
ие передачи регуляторного сигнала.
БИОФИЗИКА том 67
№ 4
2022
МИКРОГЕМОДИНАМИКА КОЖИ И МЕХАНИЗМЫ ЕЕ РЕГУЛЯЦИИ
815
КОНФЛИКТ ИНТЕРЕСОВ
27. V. E. Brunt and C. T. Minson, J. Appl. Physiol., 111
(1), 5 (2011).
Авторы заявляют об отсутствии конфликта
28. G. A. Tew, M. Klonizakis, J. Moss, et al., Microvasc.
интересов.
Res., 81 (2), 177 (2011).
29. M. Sorelli, P. Francia, L. Bocchi, et al., Microvasc.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Res., 124, 91 (2019).
Настоящая работа не содержит описания ис-
30. M. Rossi, S. Taddei, A. Fabbri, et al., J. Cardiovasc.
следований с использованием людей и животных
Pharmacol., 29 (3), 406 (1997).
в качестве объектов.
31. S. Blaise, M. Hellmann, M. Roustit, et al., Br. J. Phar-
macol., 160 (5), 1128 (2010).
СПИСОК ЛИТЕРАТУРЫ
32. R. S. Bruning, L. Santhanam, A. E. Stanhewicz, et al.,
1.
C. Puissant, P. Abraham, S. Durand, et al., Plos One, 8
J. Appl. Physiol., 112 (12), 2019 (2012).
(4), e61320 (2013).
33. A. Jekell, M. Kalani, and T. Kahan, Heart Vessels, 34
(3), 484 (2019).
2.
P. Tafner, F. K. Chen, R. F. Rabello, et al., Rev. Bras.
Ter. Intensiva, 29 (2), 238 (2017).
34. I. Mizeva, E. Zharkikh, V. Dremin, et al., Microvasc.
3.
R. T. Junejo, C. J. Ray, and J. M. Marshall, Eur. J.
Res., 120, 13 (2018).
Appl. Physiol., 119 (3), 665 (2019).
35. American Diabetes Association, Diabetes Care, 44
4.
J. L. Cracowski and M. Roustit, Compr. Physiol., 10
(Suppl. 1), S15 (2021).
(3), 1105 (2020).
36. R. Madonna, C. R. Balistreri, Y. J. Geng, et al., Vascul.
5.
D. A. Low, H. Jones, N. T. Cable, et al., Eur. J. Appl.
Pharmacol., 90, 1 (2017).
Physiol., 120 (1), 1 (2020).
37. R. Madonna, D. Pieragostino, C. R. Balistreri, et al.,
6.
A. Dara, A. Arvanitaki, M. Theodorakopoulou, et al.,
Vascul. Pharmacol., 107, 27 (2018).
Mediterr. J. Rheumatol., 32 (1), 6 (2021).
38. М. В. Шестакова, О. К. Викулова, М. А. Исаков
7.
Y. P. Wang, R. H. Cheng, Y. He, et al., Front. Bioeng.
и др., Проблемы эндокринологии, 66 (1), 35 (2020).
Biotechnol., 9, 786615 (2021).
39. A. Al-Awar, K. Kupai, M. Veszelka, et al., J. Diabetes
8.
A. Lazaridis, A. Triantafyllou, K. Dipla, et al., Hyper-
Res., 2016, 9051426 (2016).
tens. Res., 45 (3), 445 (2022).
40. D. Fuchs, P. P. Dupon, L. A. Schaap, et al., Cardio-
9.
В. И. Козлов, в сб. Материалы III Всероссийского
vasc. Diabetol., 16 (1), 11 (2017).
симпозиума «Применение лазерной допплеровской
41. A. Carrizzo, C. Izzo, M. Oliveti, et al., Int. J. Mol. Sci.,
флоуметрии в медицинской практике» (Москва,
19 (10), 2968 (2018).
2000), сс. 5-15.
42. W. D. Strain and P. M. Paldanius, Cardiovasc. Diabe-
10.
R. G. Ijzerman, R. T. de Jongh, M. A. Beijk, et al., Eur.
tol., 17 (1), 57 (2018).
J. Clin. Invest., 33 (7), 536 (2003).
43. J. M. Gregory, J. C. Slaughter, S. H. Duffus, et al., Di-
11.
L. A. Holowatz, C. S. Thompson, C. T. Minson, et al.,
abetes Care, 44 (2), 526 (2021).
J. Physiol., 563 (Pt 3), 965 (2005).
44. A. Yonekawa and N. Shimono, Biology (Basel), 11 (3),
12.
L. A. Holowatz, C. Thompson-Torgerson, and
400 (2022).
W. L. Kenney, Front. Biosci., 15 (2), 718 (2010).
45. H. M. Murphy-Lavoie, A. Ramsey, M. Nguyen, et al.,
13.
M. Roustit and J. L. Cracowski, Trends Pharmacol.
in StatPearls [Internet] (Treasure Island (FL), Stat-
Sci., 34 (7), 373 (2013).
Pearls Publishing, 2021).
14.
Y. K. Jan, Diagnostics (Basel), 12 (3), 620 (2022).
46. N. E. Cameron, S. E. Eaton, M. A. Cotter, et al., Dia-
15.
J. A. Schmidt, P. Borgstrom, G. P. Firestone, et al., J.
betologia, 44 (11), 1973 (2001).
Vasc. Surg., 18 (2), 207 (1993).
47. R. L. Greenman, S. Panasyuk, X. Wang, et al., Lancet,
16.
A. J. Chipperfield, M. Thanaj, E. Scorletti, et al., Mi-
366 (9498), 1711 (2005).
crocirculation, 26 (5), e12538 (2019).
48. L. A. Sokolnicki, S. K. Roberts, B. W. Wilkins, et al.,
17.
A. Stefanovska, M. Bracic, and H. D. Kvernmo, IEEE
Am. J. Physiol. - Endocrinology, M 292 (1), E314
Trans. Biomed. Engineer., 46 (10), 1230 (1999).
(2007).
18.
W. Funk, B. Endrich, K. Messmer, et al., Int. J. Micro-
49. J. E. Tooke, Cardiovasc. Res., 32 (4), 764 (1996).
circ. Clin. Exp., 2 (1), 11 (1983).
50. A. I. Vinik, T. Erbas, T. S. Park, et al., Diabetes Care,
19.
J. Kastrup, J. Bulow, and N. A. Lassen, Int. J. Micro-
24 (8), 1468 (2001).
circ., 8 (2), 205 (1989).
51. I. Kozlov, E. Zherebtsov, G. Masalygina, et al., Diag-
20. M. E. Muck-Weymann, H. P. Albrecht, D. Hager,
nostics (Basel), 11 (2), 267 (2021).
et al., Microvasc. Res., 52 (1), 69 (1996).
52. R. A. S. Sancho and G. M. Pastore, Food Res. Int., 46
21. H. D. Kvernmo, A. Stefanovska, K. A. Kirkeboen,
(1), 378 (2012).
et al., Microvasc. Res., 57 (3), 298 (1999).
53. S. C. Sanka, D. C. Bennett, J. D. Rojas, et al., Proc.,
22. Функциональная диагностика состояния микроцир-
SPIE, 3924, 56 (2000).
куляторно-тканевых систем. Колебания, информа-
ция, нелинейность: Pуководcтво для вpачей, под pед.
54. M. Kalani, Vasc. Health Risk Manag., 4 (5), 1061
А. И. Кpупаткина и В. В. Cидоpова (Либроком, М.,
(2008).
2013).
55. J. D. Ward, A. J. Boulton, J. M. Simms, et al., J. Roy.
23. M. Rossi, S. Bertuglia, M. Varanini, et al., Biomed.
Soc. Med., 76 (12), 1011 (1983).
Pharmacother., 59 (5), 233 (2005).
56. A. E. Caballero, S. Arora, R. Saouaf, et al., Diabetes,
24. G. B. Yvonne-Tee, A. H. Rasool, A. S. Halim, et al., J.
48 (9), 1856 (1999).
Pharmacol. Toxicol. Methods, 52 (2), 286 (2005).
57. K. M. Azadzoi and I. Saenz de Tejada, J. Urol., 148 (5),
25. J. L. Cracowski, C. T. Minson, M. Salvat-Melis, et al.,
1587 (1992).
Trends Pharmacol. Sci., 27 (9), 503 (2006).
58. L. A. Suzuki, M. Poot, R. G. Gerrity, et al., Diabetes,
26. C. T. Minson, J. Appl. Physiol., 109 (4), 1239 (2010).
50 (4), 851 (2001).
БИОФИЗИКА том 67
№ 4
2022
816
ТИХОНОВА и др.
59. V. Urbancic-Rovan, A. Stefanovska, A. Bernjak, et al.,
90. N. Tran, T. Garcia, M. Aniqa, et al., Am. J. Biomed.
J. Vasc. Res., 41 (6), 535 (2004).
Sci. Res. 15 (2), 153 (2022).
60. J. Turner, J. J. Belch, and F. Khan, Trends Cardiovasc.
91. A. Grinevich, A. Tankanag, I. Tikhonova, et al., Mi-
Med., 18 (4), 109 (2008).
crovasc. Res. 126, 103889 (2019).
61. P. C. Sun, C. S. Chen, C. D. Kuo, et al., Microvasc.
92. Н. А. Лычева, Д.А. Макушкина и А. В. Седов, Со-
Res., 83 (2), 243 (2012).
временные проблемы науки и образования,
5
62. H. F. Hu, H. Hsiu, C. J. Sung, et al., Lasers Med. Sci.,
32 (2), 327 (2017).
view?id=26992 (дата обращения: 18.04.2022) (2017).
63. T. Forst, A. Caduff, M. Talary, et al., Diabetes Technol.
93. S. Inoue, Y. Asai, and Y. Kawai, Ann. Plast. Surg., 50
Ther., 8 (1), 94 (2006).
(1), 64 (2003).
64. D. L. Kellogg, Jr., J. L. Zhao, Y. Wu, et al., J. Appl.
94. G. J. Hodges, D. N. Jackson, L. Mattar, et al., Am. J.
Physiol., 110 (5), 1406 (2011).
Physiol. Regul. Integr. Comp. Physiol., 297 (3), R546
65. J. Petrofsky, D. Paluso, D. Anderson, et al., Diabetes
(2009).
Technol. Ther., 13 (3), 365 (2011).
95. F. Polito, A. Bitto, M. Galeano, et al., J. Vasc. Surg., 55
66. M. Roustit and J. L. Cracowski, Microcirculation, 19
(2), 479 (2012).
(1), 47 (2012).
96. J. Decorps, J. L. Saumet, P. Sommer, et al., Ageing
67. J. S. Petrofsky, F. Alshammari, G. S. Bains, et al., Med.
Res. Rev., 13, 90 (2014).
Sci. Monitor, 19, 257 (2013).
97. S. Gohin, J. Decorps, D. Sigaudo-Roussel, et al., Mi-
68. D. Lowry, M. Saeed, P. Narendran, et al., J. Diabetes
crovasc. Res., 101, 103 (2015).
Sci. Technol., 11 (5), 914 (2017).
98. Y. Q. Liu, Y. F. Liu, X. M. Ma, et al., J. Plast. Reconstr.
69. H. Hsiu, H. F. Hu, and H. C. Tsai, Microvasc. Res.,
Aesthet. Surg., 68 (7), e147 (2015).
115, 1 (2018).
99. K. X. Song, M. Z. Zhang, J. Q. Hu, et al., BMC Surg.,
70. A. Bandrivskyy, A. Bernjak, P. McClintock, et al., Car-
15, 92 (2015).
diovasc. Engineer., 4 (1), 89 (2004).
100. Y. D. Xiao, Y. Q. Liu, J. L. Li, et al., J. Surg. Res., 199
71. A. V. Tankanag, A. A. Grinevich, T. V. Kirilina, et al.,
(2), 732 (2015).
Microvasc. Res., 95, 53 (2014).
101. S. Hu, Z. L. Lin, Z. K. Zhao, et al., J. Parenter. Enter-
72. I. V. Tikhonova, A. A. Grinevich, I. E. Guseva, et al.,
al. Nutr., 40 (7), 924 (2016).
Microcirculation, 28 (1), e12655 (2021).
102. X. Yuan, Q. Wu, F. Shang, et al., Clin. Exp. Hyper-
73. Y. Shiogai, A. Stefanovska, and P. V. McClintock,
tens., 41 (4), 342 (2019).
Phys. Rep., 488 (2-3), 51 (2010).
103. J. S. Tan, C. C. Lin, and G. S. Chen, BMJ Open Dia-
74. V. Ticcinelli, T. Stankovski, P. V. McClintock, et al.,
betes Res. Care, 8 (1), e001004 (2020).
Annu. Int. Conf. IEEE Eng. Med. Biol. Soc., 2015,
104. Y. Wei, H. Chen, Q. Chi, et al., Med. Biol. Eng. Com-
7366 (2015).
put., 59 (5), 1151 (2021).
75. M. Elstad, I. Zilakos, and T. K. Bergersen, Physiol.
105. M. Amoroso, O. Ozkan, O. Ozkan, et al., Plast. Re-
Meas., 38 (5), 848 (2017).
constr. Surg., 136 (3), 512 (2015).
76. V. Ticcinelli, T. Stankovski, D. Iatsenko, et al., Front.
106. M. Aral, S. Tuncer, A. Sencan, et al., J. Reconstr. Mi-
Physiol., 8, 749 (2017).
crosurg., 31 (7), 487 (2015).
77. G. Gilbert, T. Ducret, R. Marthan, et al., Cardiovasc.
107. B. Kaya, C. Çerkez, S. E. Işılgan, et al., J. Plast. Surg.
Res., 103 (2), 313 (2014).
Hand Surg., 49 (6), 358 (2015).
78. G. Ji, R. J. Barsotti, M. E. Feldman, et al., J. Gen.
108. D. W. Lee, H. J. Hong, H. Roh, et al., Ann. Plast.
Physiol., 119 (6), 533 (2002).
Surg., 75 (1), 84 (2015).
79. F. Shaffer and J. P. Ginsberg, Front Public Health, 5,
109. Y. H. Qin, H. S. Jiao, A. S. Li, et al., J. Plast. Surg.
258 (2017).
Hand. Surg., 49 (6), 319 (2015).
80. F. Shaffer, R. McCraty, and C. L. Zerr, Front. Psychol.,
110. W. Feng, S. Liu, C. Zhang, et al., Theranostics, 9 (20),
5, 1040 (2014).
5854 (2019).
81. Heart Rate Variability. Standards of Measurement,
111. J. M. Newman, R. M. Dwyer, P. St-Pierre, et al., J.
Physiological Interpretation, and Clinical Use. Task
Physiol., 587 (Pt 11), 2579 (2009).
Force of the European Society of Cardiology and the
North American Society of Pacing Electrophysiology,
112. М. Е. Асташев, Д. А. Серов и А. В. Танканаг, Био-
Circulation, 93 (5), 1043 (1996).
физика, 63 (1), 159 (2018).
113. M. E. Astashev, D. A. Serov and A. V. Tankanag, Skin
82. T. E. Lohmeier and J. E. Hall, Circ. Res., 124 (7), 1071
Res. Technol., 25 (1), 40 (2019).
(2019).
83. A. I. Vinik, R. Freeman and T. Erbas, Semin. Neurol.,
114. И. И. Дедов, М. В. Шестакова, О. К. Викулова
23 (4), 365 (2003).
и др., Сахарный диабет, 24 (3), 204 (2021).
84. A. I. Vinik, T. Erbas and C. M. Casellini, J. Diabetes
115. S. Pandey and M. C. Dvorakova, Endocr. Metab. Im-
Investig., 4 (1), 4 (2013).
mune Disord. Drug Targets, 20 (1), 25 (2020).
85. V. L. Fisher and A. A. Tahrani, Diabetes Metab. Syndr.
116. C. P. D. Kottaisamy, D. S. Raj, V. Prasanth Kumar,
Obes., 10, 419 (2017).
et al., Lab. Anim. Res., 37 (1), 23 (2021).
86. M. Shibasaki, D. A. Low, S. L. Davis, et al., J. Appl.
117. B. Proniewski, A. Bar, A. Kieronska-Rudek, et al.,
Physiol., 105 (5), 1504 (2008).
Cells, 10 (6), 1448 (2021).
87. S. J. Smillie and S. D. Brain, Neuropeptides 45 (2), 93
118. F. Beguinot and C. Nigro, Methods Mol. Biol., 933,
(2011).
219 (2012).
88. A. G. Goodwill and J. C. Frisbee, Vascul. Pharmacol.,
119. J. H. Kim and A. M. Saxton, Methods Mol. Biol., 933,
57 (5-6), 150 (2012).
75 (2012).
89. J. L. Cracowski and M. Roustit, Microcirculation, 23
120. В. К. Мазо, Ю. С. Сидорова и А. А. Кочеткова, Во-
(5), 337 (2016).
просы питания, 84 (6), 63 (2015).
БИОФИЗИКА том 67
№ 4
2022
МИКРОГЕМОДИНАМИКА КОЖИ И МЕХАНИЗМЫ ЕЕ РЕГУЛЯЦИИ
817
121. О. И. Степанова, В. Н. Каркищенко, О. В. Барано-
152. И. В. Тихонова, Н. И. Косякова, А. В. Танканаг и
ва и др., Биомедицина, 2, 28 (2009).
др., Вестн. РАМН, 71 (3), 233 (2016).
122. J. Molnar, S. Yu, N. Mzhavia, et al., Circ. Res., 96
153. I. V. Tikhonova, N. I. Kosyakova, A. V. Tankanag, et
(11), 1178 (2005).
al., Microcirculation, 23 (1), 33 (2016).
123. K. K. Wu and Y. M. Huan, Atherosclerosis, 191 (2),
154. J. M. Hughes, M. A. Riddle, M. L. Paffett, et al., Am.
241 (2007).
J. Physiol. Heart Circ. Physiol., 299 (5), H1439 (2010).
124. H. Poudyal, S. Panchal, and L. Brown, Br, J, Nutr.,
155. Z. G. Wu, L. Gu, Y. K. Si, et al., Endocr. Metab. Im-
104 (9), 1322 (2010).
mune, 21 (7), 1270 (2021).
125. H.-G. Joost, H. Al-Hasani, and A. Schurmann, Meth-
156. M. L. Paffett, M. A. Riddle, N. L. Kanagy, et al., J.
ods Mol. Biol., 933, 325 (2012).
Pharmacol. Exp. Ther., 334 (3), 753 (2010).
126. V. R. Konda, A. Desai, G. Darland, et al., PLoS One,
157. A. Filippini, A. D'Amore, and A. D'Alessio, Int. J.
9 (1), e87848 (2014).
Mol. Sci., 20 (18), 4525 (2019).
127. М.Н. Макарова и В. Г. Макаров, Лабораторные
158. F. Moccia, S. Negri, M. Shekha, et al., Int. J. Mol.
животные для научных исследований. URL:
Sci., 20 (16), 3962 (2019).
159. P. Thakore and S. Earley, Compr. Physiol., 9 (3), 1249
ращения: 18.04.2022) (2018).
(2019).
128. R. Kohen-Avramoglu, M. A. Laplante, K. Le Quang,
160. K. S. Hong and M. G. Lee, Korean J. Physiol. Phar-
et al., Can. J. Diabetes, 37 (5), 351 (2013).
macol., 24 (4), 287 (2020).
129. A. Tominaga, N. Ishizaki, Y. Naruse, et al., Acupunct.
161. S. Negri, P. Faris and F. Moccia, Int. J. Mol. Sci., 22
Med., 29 (4), 276 (2011).
(18), 9821 (2021).
130. S. Xi, W. Yin, Z. Wang, et al., Int. J. Exp. Pathol., 85
162. W. F. Jackson, Curr. Top. Membr., 85, 1 (2020).
(4), 223 (2004).
163. L. Liu, M. Guo, X. Lv, et al., Front. Mol. Biosci., 8,
131. A. K. Azemi, S. S. Mokhtar, L. J. Hou, et al., Biotech.
677661 (2021).
Histochem., 96 (7), 498 (2021).
164. W. F. Jackson, Front. Physiol., 13, 805149 (2022).
132. A. Heydemann, J. Diabetes Res., 2016,
2902351
165. R. Berra-Romani, A. Guzman-Silva, A. Vargaz-Gua-
(2016).
darrama, et al., Int. J. Mol. Sci., 21 (1), 250 (2020).
133. В. И. Евлахов и И. З. Поясов, Ангиология и сосу-
166. R. D. A. Moraes, R. C. Webb, and D. F. Silva, Front.
дистая хирургия, 25 (3), 1 (2019).
Physiol., 12, 645109 (2021).
134. А. Н. Иванов, Э. Б. Попыхова и Н. Е. Терешкина,
167. K. Monaghan, J. McNaughten, M. K. McGahon,
Успехи физиол. наук, 51 (4), 82 (2020).
et al., PLoS One, 10 (6), e0128359 (2015).
135. C. R. Triggle, S. M. Samuel, S. Ravishankar, et al.,
168. Y. Guo, X. Yang, J. He, et al., Life Sci., 209, 217
Can. J. Physiol. Pharmacol., 90 (6), 713 (2012).
(2018).
136. W. C. Cole, G. R. Gordon, and A. P. Braun, Adv. Exp.
169. N. Ozturk, S. Uslu, and S. Ozdemir, World J. Diabe-
Med. Biol., 1124, 297 (2019).
tes, 12 (1), 1 (2021).
137. L. Jaimes, R. Vinet, M. Knox, et al., Animals (Basel),
170. A. Advani, S. M. Marshall, and T. H. Thomas, Diabe-
9 (6), 288 (2019).
tologia, 45 (5), 719 (2002).
138. N. Mendez-Barbero, C. Gutierrez-Munoz, and
171. I. V. Tikhonova, A. A. Grinevich, I. E. Guseva, et al.,
L. M. Blanco-Colio, Int. J. Mol. Sci., 22 (14), 7284
Free Radic. Biol. Med., 159, 76 (2020).
(2021).
172. S. S. Kappala, J. Espino, J. A. Pariente, et al., Mol.
139. J. L. Martin-Ventura, C. Roncal, J. Orbe, et al., Front.
Cell. Biochem., 387 (1-2), 251 (2014).
Cell Dev. Biol., 10, 813885 (2022).
173. Y. Zhao, P. M. Vanhoutte, and S. W. Leung, J. Phar-
140. K. V. Woo and H. S. Baldwin, Trends Cardiovasc.
macol. Sci., 129 (2), 83 (2015).
Med., 21 (4), 118 (2011).
174. J. Qian and D. Fulton, Front. Physiol., 4, 347 (2013).
141. K. J. Bubb, R. H. Ritchie, and G. A. Figtree, Microcir-
175. 175. R. Berra-Romani, P. Faris, S. Negri, et al., Cells,
culation, 26 (2), e12501 (2019).
8 (7), 689 (2019).
142. S. N. Baldwin, E. A. Forrester, L. McEwan, et al., Br.
J. Pharmacol., 179 (7), 1338 (2022).
176. M. Liu, X. Song, B. Wang, et al., Am. J. Hypertens., 34
143. E. Boedtkjer, K. B. Hansen, D. M. B. Boedtkjer, et al.,
(1), 100 (2021).
J. Cerebr. Blood F. Met., 36 (5), 965 (2016).
177. D. Serov, A. Tankanag, and M. Astashev, Cell Biol.
Int., 46 (3), 427 (2022).
144. K. Takahashi, R. Kim, C. Lauhan, et al., PLoS One,
12 (5), e0177192 (2017).
178. J. F. Perez-Zoghbi, Y. Bai, and M. J. Sanderson, J.
145. A. F. O. Justo and P. P. L. Afonso, J. Cell Commun.
Gen. Physiol., 135 (3), 247 (2010).
Signal., 15 (3), 467 (2021).
179. J. A. Kim, M. Montagnani, K. K. Koh, et al., Circula-
146. H. G. Augustin and G. Y. Koh, Science, 357 (6353),
tion, 113 (15), 1888 (2006).
eaal2379 (2017).
180. H. Kolb, K. Kempf, M. Rohling, et al., BMC Med., 18
147. T. Minami, M. Muramatsu, and T. Kume, Biol.
(1), 224 (2020).
Pharm. Bull., 42 (10), 1609 (2019).
181. B. A. Lazar, G. Jancso, and P. Santha, Int. J. Mol.
148. L. Gifre-Renom, M. Daems, A. Luttun, et al., Int. J.
Sci., 21 (7), 2507 (2020).
Mol. Sci., 23 (3), 1477 (2022).
182. R. Muniyappa and J. R. Sowers, Rev. Endocr. Metab.
149. Z. Melik, P. Zaletel, T. Virtic, et al., Clin. Hemorheol.
Disord., 14 (1), 5 (2013).
Microcirc., 65 (3), 205 (2017).
183. T. Maruhashi and Y. Higashi, Antioxidants (Basel), 10
150. И. В. Тихонова, А. В. Танканаг, Н. И. Косякова и
(8), 1306 (2021).
др., Пульмонология, № 1, 57 (2008).
184. S. Gogg, U. Smith, and P. A. Jansson, Diabetes, 58
151. И. В. Тихонова, А. В. Танканаг, Н. И. Косякова и
(10), 2238 (2009).
др., Фундаментальные исследования, 7 (2), 364
185. J. Boucher, A. Kleinridders, and C. R. Kahn, Cold
(2014).
Spring Harb. Perspect. Biol., 6 (1), a009191 (2014).
БИОФИЗИКА том 67
№ 4
2022
818
ТИХОНОВА и др.
186. I. S. Stafeev, A. V. Vorotnikov, E. I. Ratner, et al., Int.
202. J. Johnson, R. M. Jaggers, G. Sreejit, et al., Antioxid.
J. Endocrinol., 2017, 5076732 (2017).
Redox Signal., online ahead of print (2021).
187. A. V. Vorotnikov, I. S. Stafeev, M. Y. Menshikov, et al.,
203. S. W. Schaffer, C. J. Jong, and M. Mozaffari, Vascul.
Biochemistry (Moscow), 84 (11), 1329 (2019).
Pharmacol. 57 (5-6), 139 (2012).
188. M. Khalid, J. Alkaabi, M. A. B. Khan, et al., Int. J.
204. P. Newsholme, V. F. Cruzat, K. N. Keane, et al., Bio-
Mol. Sci., 22 (16), 8590 (2021).
chem. J., 473 (24), 4527 (2016).
189. M. C. Petersen and G. I. Shulman, Physiol. Rev., 98
205. O. O. Oguntibeju, Int. J. Physiol. Pathophysiol. Phar-
(4), 2133 (2018)
macol., 11 (3), 45 (2019).
190. G. L. King, K. Park, and Q. Li, Diabetes, 65 (6), 1462
206. J. B. de Haan and M. E. Cooper, Front. Biosci. (Schol
(2016).
Ed.), 3 (2), 709 (2011).
191. P. Geraldes and G. L. King, Circ. Res., 106 (8), 1319
207. S. W. Park, H. O. Jun, E. Kwon, et al., Vascul. Phar-
(2010).
macol., 90, 19 (2017).
192. K. C. Nandipati, S. Subramanian, and D. K. Agrawal,
208. N. Apostolova, F. Iannantuoni, A. Gruevska, et al.,
Mol. Cell. Biochem., 426 (1-2), 27 (2017).
Redox Biol., 34, 101517 (2020).
193. D. E. James, J. Stockli, and M. J. Birnbaum, Nat. Rev.
209. K. Suresh, L. Servinsky, J. Reyes, et al., Am. J.
Mol. Cell. Biol., 22 (11), 751 (2021).
Physiol. Lung C, 309 (12), L1467 (2015).
194. N. V. Goncharov, A. D. Nadeev, R. O. Jenkins, et al.,
210. G. W. Davison, R. E. Irwin, and C. P. Walsh, Free
Oxid. Med. Cell Longev., 2017, 9759735 (2017).
Radic. Biol. Med., 170, 194 (2021).
211. S. Altenhofer, K. A. Radermacher, P. W. Kleikers,
195. A. O. Kadlec and D. D. Gutterman, Compr. Physiol.,
et al., Antioxid. Redox Signal., 23 (5), 406 (2015).
10 (1), 229 (2019).
212. P. V. Avdonin, A. D. Nadeev, G. Y. Mironova, et al.,
196. G. A. Knock, Free Radic Biol. Med., 145, 385 (2019).
Oxid. Med. Cell Longev., 2019, 1701478 (2019).
197. A. C. Montezano, D. Burger, G. S. Ceravolo, et al.,
213. M. Billaud, R. Marthan, J. P. Savineau, et al., PLoS
Clin. Sci. (Lond.)., 120 (4), 131 (2011).
One, 4 (7), e6432 (2009).
198. B. K. Rodino-Janeiro, B. Paradela-Dobarro,
214. L. L. Camargo, A. C. Montezano, M. Hussain, et al.,
M. I. Castineiras-Landeira, et al., Vasc. Health Risk
Cardiovasc. Res., 118 (5), 1359 (2022).
Manag., 9, 401 (2013).
215. K. Choi, M. Kennedy, A. Kazarov, et al., Develop-
199. A. Konior, A. Schramm, M. Czesnikiewicz-Guzik,
ment, 125 (4), 725 (1998).
et al., Antioxid. Redox Signal., 20 (17), 2794 (2014).
216. W. C. Aird, Circ. Res., 100 (2), 158 (2007).
200. M. Santillo, A. Colantuoni, P. Mondola, et al., Front.
Physiol., 6, 194 (2015).
217. W. C. Aird, Circ. Res., 100 (2), 174 (2007).
201. A. Vermot, I. Petit-Hartlein, S. M. E. Smith, et al.,
218. W. C. Aird, Cold Spring Harb. Perspect. Med., 2 (1),
Antioxidants (Basel), 10 (6), 890 (2021).
a006429 (2012).
Skin Microhemodynamics and Its Regulatory Mechanisms in Type 2 Diabetes Mellitus
I.V. Tikhonova, A.A. Grinevich, A.V. Tankanag, and V.G. Safronova
Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
The paper presents modern concepts of peripheral microhemodynamics, approaches to the analysis of skin
blood flow oscillations and their diagnostic significance. This study includes analysis of the disturbances in
skin microhemodynamics in type 2 diabetes mellitus and proposes an algorithm to understand the occurrence
of these disturbances in terms of relationships between external and internal factors that control skin blood
f low, based on a comparison of relationships in normal and pathological conditions, as well as creating
models of pathologies using animals. The factors and mechanisms of vasomotor regulation, including recep-
tors and signaling events in endothelial and smooth muscle cells considered as model of microvessels, are dis-
cussed. Attention is drawn to the disorders of Ca2+-dependent regulation of coupling between vascular cells
and NO-dependent regulation of vasodilation in diabetes mellitus. The main mechanisms of insulin resis-
tance in type 2 diabetes mellitus may occur due to defects in insulin binding caused by reduced receptor num-
ber and impaired signal transduction from the receptor to PI3K and downstream targets. Reactive oxygen
species play an important role in vascular dysfunction in hyperglycemia. It is supposed that the studied mo-
lecular-cellular mechanisms that regulate microhemodynamics are involved in the formation of skin blood
f low oscillations. The parameters of skin microcirculation can be used as diagnostic and prognostic markers
for assessing the state of the organism.
Keywords: microcirculation, type 2 diabetes mellitus, amplitude-frequency analysis, endothelium receptors, vaso-
active factors, signaling
БИОФИЗИКА том 67
№ 4
2022