БИОФИЗИКА, 2022, том 67, № 4, с. 827-832
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 57.089:616.1:677.494
НЕТКАНЫЕ СОСУДИСТЫЕ ПРОТЕЗЫ МАЛОГО ДИАМЕТРА НА ОСНОВЕ
НАНОВОЛОКОН ИЗ АРОМАТИЧЕСКОГО ПОЛИИМИДА
© 2022 г. А.Е. Чирятьева*, #, Н.А. Завражных*, П.В. Попрядухин*, **, Г.Ю. Юкина*, ***,
А.В. Кривенцов****, Е.М. Иванькова**, В.Е. Юдин*, **
*Санкт-Петербургский политехнический университет Петра Великого,
ул. Политехническая, 29, Санкт-Петербург, 195251, Россия
#E-mail: chiriateva.ae@gmail.com
**Институт высокомолекулярных соединений РАН, Большой просп., 31, Санкт-Петербург, 199004, Россия
***Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова,
ул. Льва Толстого, 6-8, Санкт-Петербург, 197022, Россия
****Военно-медицинская академия имени С.М. Кирова,
ул. Академика Лебедева, 6Ж, Санкт-Петербург, 194044, Россия
Поступила в редакцию 02.12.2021 г.
После доработки 02.12.2021 г.
Принята к публикации 26.05.2022 г.
Одним из основных методов лечения сердечно-сосудистой патологии является хирургическая ре-
конструкция сосудов, в том числе с использованием протезов на основе полимерных материалов;
ведется разработка клинически приемлемого протеза малого диаметра. В данной работе протезы
кровеносных сосудов диаметром 1.2 мм были получены методом электроформования из ароматиче-
ского полиимида. Механические характеристики полученных протезов сравнимы с параметрами
нативных сосудов крыс и человека. Протезы были имплантированы в брюшную часть аорты крыс
на 1, 3 и 6 месяцев. В ходе эксперимента протезы проходимы, признаков образования аневризм и
гиперплазии интимы не наблюдается, случаи тромбоза не зафиксированы. Морфологическое ис-
следование показало образование на внутренней поверхности протеза неоинтимы, представленной
эндотелием и тонким субэндотелиальным слоем, и заключение протеза в соединительнотканную
капсулу. Протезы на основе нановолокон полиимида продемонстрировали высокую биосовмести-
мость и тромборезистентность, что позволяет рекомендовать дальнейшее их исследование в каче-
стве тканеинженерных сосудистых имплантатов.
Ключевые слова: тканевая инженерия, тканеинженерный сосудистый имплантат, полиимид, ПМ-
ДАДФЭ, электроформование.
DOI: 10.31857/S0006302922040226, EDN: IVWSHU
По данным Всемирной организации здраво-
материала естественным образом ограничивается
охранения заболевания сердечно-сосудистой си-
[2].
стемы занимают ведущую позицию среди причин
Одной из главных проблем при пластике сосу-
смерти в мире [1]. Одним из основных методов
дов с использованием синтетических протезов
лечения данной патологии, после медикаментоз-
остается протезирование артерий малого диамет-
ной терапии, является хирургическая рекон-
ра: 6 мм и менее. Ввиду раннего тромбообразова-
струкция сосудов - протезирование или шунти-
ния, гиперплазии неоинтимы в районе анастомо-
рование.
зов и других факторов до настоящего времени не
В качестве материала, замещающего нативный
разработан клинически приемлемый протез ма-
сосуд, используют аутотрансплантаты или синте-
лого диаметра, ведется активный поиск новых
тические протезы. Забор аутоматериала сосуда
полимерных материалов и разработка методов
приводит к нарушениям кровоснабжения в тка-
получения протезов [3, 4].
ни-доноре и дополнительной травматизации па-
циента; также на отдаленных сроках наблюдается
Протезы кровеносных сосудов из полимерных
дегенерация стенок аутотрансплантата. К тому же
материалов имеют ряд существенных преиму-
в случае проведения повторных или множествен-
ществ перед аутологичными: позволяют исполь-
ных операций и наличия сопутствующих заболе-
зовать все разнообразие искусственных и при-
ваний количество аутологичного оперативного
родных материалов биомедицинского назначе-
827
828
ЧИРЯТЬЕВА и др.
ния, варьировать механические характеристики и
ее использования в качестве тканеинженерного
функционализировать поверхность. В частности,
сосудистого протеза.
для задач тканевой инженерии сосудов применя-
ют протезы на основе биорезорбируемых и нере-
зорбируемых трубчатых нетканых полимерных
МАТЕРИАЛЫ И МЕТОДЫ
матриц.
Традиционный способ получения пленочных
При использовании протезов из биорезорби-
и волокнистых полиимидных материалов из рас-
руемых полимеров необходима сопряженность во
творов полиамидокислоты обладает рядом недо-
времени процессов биорезорбции и ремоделиро-
статков, среди которых необходимость использо-
вания вновь формируемого сосуда, так как ухуд-
вания токсичных растворителей, нестабильность
шение механических свойств протеза в процессе
растворов во времени и высокая температура
резорбции приводит к гиперплазии неоинтимы,
имидизации - реакции циклизации полиамидо-
возникновению аневризм, а также иммунному
кислоты до химически инертного полиимида [7].
ответу организма при высокой концентрации
В данной работе использованы более стабильные
продуктов резорбции. Протезы из нерезорбируе-
водорастворимые соли полиамидокислоты с по-
мых полимеров лишены части этих недостатков,
ниженной температурой имидизации [9].
что в перспективе способствует быстрому и
Получение материала. Для получения трубча-
эффективному восстановлению кровеносного
тых пористых матриц использовали триэтилам-
русла.
монийную соль полиамидокислоты на основе пи-
Одним из перспективных полимеров для полу-
ромеллитового диангидрида и 4,4'-диаминодифе-
чения матриц для протезирования кровеносных
нилового эфира (Sigma-Aldrich, Германия),
сосудов является полиимид. Благодаря своим
растворенную в смеси этилового спирта и воды в
механическим свойствам и биосовместимости
соотношении 70/30 масс. %. Растворы соли поли-
полиимидные материалы получили широкое
амидокислоты с весовой концентрацией 10% пе-
распространение в биомедицине в качестве ком-
ремешивали в течение 24 ч при комнатной темпе-
понентов имплантируемых микроэлектронных
ратуре.
устройств, легочных мембран-оксигенаторов, си-
стем хранения клеток, пакетов для низкотемпе-
Матрицы получали методом электроформова-
ния на установке Nanon-01A (Mecc Co., Япония).
ратурного хранения крови [5, 6]. В эксперименте
Раствор полимера подавали через электрод-фи-
in vitro было показано отсутствие цитотоксично-
сти ароматических полиимидов, что подтвержда-
льеру в электрическое поле высокого напряже-
ет перспективность использования этих материа-
ния
(25-30 кВ) с объемным расходом
0.5-
лов в сосудистой хирургии [7].
1.0 мл/ч. Осаждение волокон происходило на ци-
линдрическом металлическом электроде диамет-
Одним из перспективных методов получения
ром
1.2 мм, вращающемся со скоростью
полимерных матриц, в том числе для сосудистых
2500 об/мин на расстоянии 150 мм от фильеры.
протезов, является метод электроформования
Матрицы далее подвергали термической имиди-
(электроспиннинга), при котором из раствора
зации в фиксированном на электроде состоянии
или расплава полимера в электрическом поле вы-
в воздушной среде (нагрев до 250°C в течение 3 ч,
сокого напряжения получают нетканый матери-
выдерживание при 250°C в течение 30 мин). Пол-
ал, состоящий из микро- и нановолокон. В про-
ноту прохождения реакции циклизации поли-
цессе электроформования струя полимера с по-
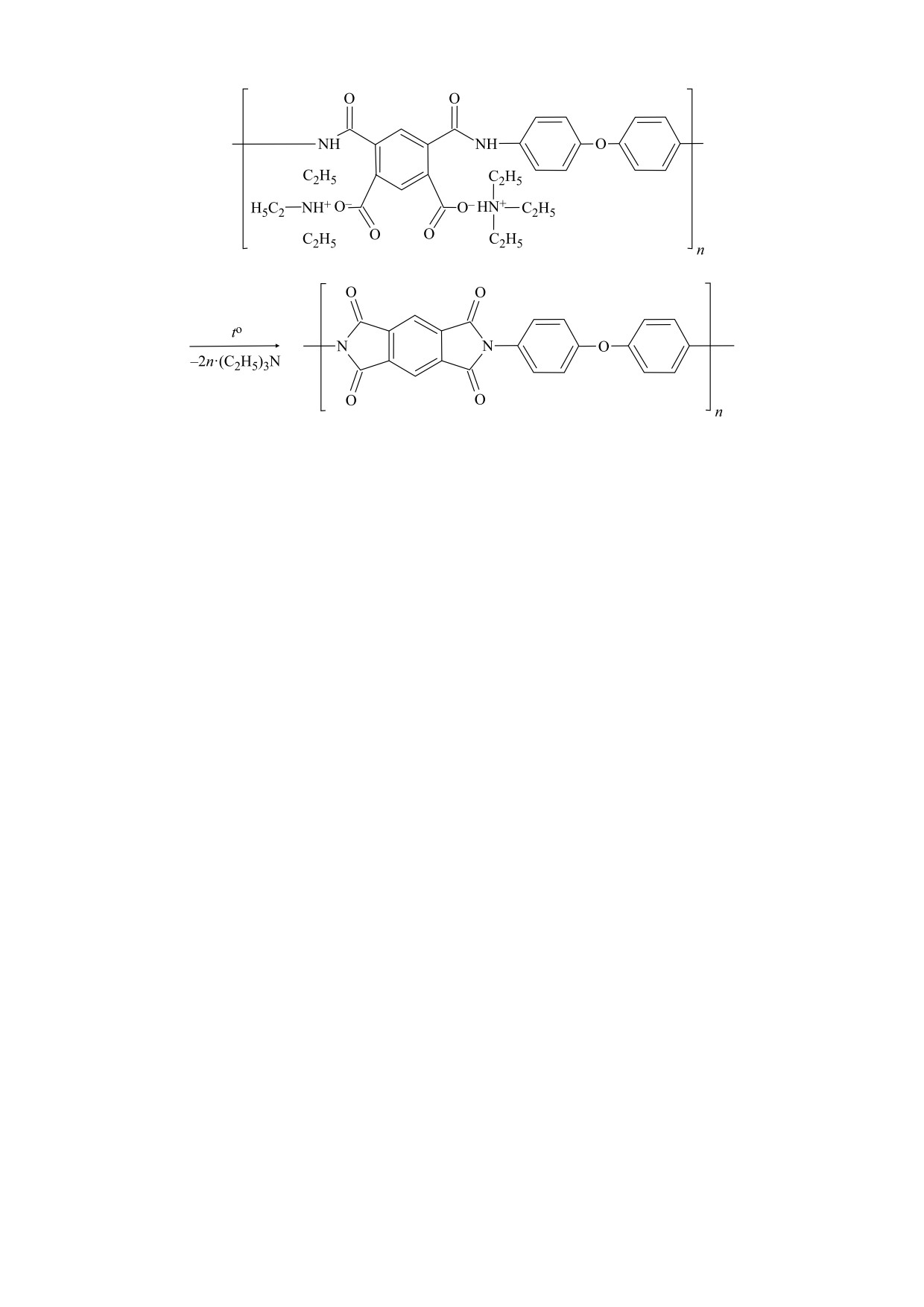
амидокислоты и удаления триэтиламина (рис. 1)
мощью инжекторного насоса подается через
контролировали методом инфракрасной спек-
электрод-фильеру (иглу) в поле высокого напря-
троскопии.
жения, где в результате поляризации происходит
деление на микроструи, отвердевающие в про-
Микроструктуру полученных протезов изуча-
цессе дрейфа до принимающего электрода (кол-
ли методом сканирующей электронной микро-
лектора). Волокна, осаждающиеся на коллектор,
скопии в режиме регистрации вторичных элек-
образуют волокнистый нетканый материал.
тронов (Supra 55VP, Carl Zeiss, Германия) с
Матрицы, полученные этим методом из биосов-
предварительным нанесением платинового про-
местимых полимеров, обладают пористой струк-
водящего слоя. По микрофотографиям оценива-
турой, способствующей интеграции полученных
ли средний диаметр полученных волокон и по-
на их основе протезов в организм реципиента, и
верхностную пористость материала.
стабильными деформационно-механическими
Механические характеристики трубчатых про-
свойствами в течение длительного времени [8].
тезов длиной 20 мм исследовали с помощью уни-
Целью данной работы является исследование
версальной испытательной машины Instron 5943
биосовместимости in vivo нетканой матрицы, по-
(Instron, Великобритания). Регистрировали зави-
лученной методом электроформования из арома-
симость механического напряжения от деформа-
тического полиимида, для оценки возможности
ции при растяжении матриц со скоростью
БИОФИЗИКА том 67
№ 4
2022
НЕТКАНЫЕ СОСУДИСТЫЕ ПРОТЕЗЫ МАЛОГО ДИАМЕТРА
829
Рис. 1. Схема термической имидизации триэтиламмонийной соли полиамидокислоты с образованием полиимида.
10 мм/мин, вычисляли модуль упругости, проч-
ном Майера и эозином («Биовитрум», Россия).
ность на разрыв и удлинение до разрыва.
Для визуализации коллагена соединительной
ткани использовали окраску по методу Маллори
Эксперименты на животных. В эксперименте
(реактивы от «Биовитрум», Россия). Микроско-
in vivo использовали девять трехмесячных самцов
пический анализ препаратов с поперечным сече-
крыс Wistar массой 200-250 г (питомник «Раппо-
нием протеза проводили на световом микроскопе
лово», Ленинградская обл.). Животных опериро-
Leica DM750 (Leica, Германия), используя окуляр
вали под общей анестезией: 0.1 мл Zoletil 100 (рас-
с увеличением 10× и объективы с увеличением 4,
творенного в 20 мл физиологического раствора) и
10 и 40×. Запись цифровых изображений выпол-
0.0125 мл Rometar (20 мг/мл) на 0.1 кг массы тела
няли с помощью фотокамеры ICC50 (Leica, Гер-
интраперитонеально, однократно. Выполняли
мания).
Y-образную лапаротомию, проводили мобилиза-
цию инфраренального отдела аорты и ее протези-
рование матрицей с наложением восьми швов на
РЕЗУЛЬТАТЫ
каждый анастомоз. Использовали атравматиче-
Физико-механические параметры трубчатых
ские иглы с нитью Prolen 9-0. Антикоагулянты и
протезов зависят от условий процесса электро-
дезагреганты не использовали. Проходимость со-
формования (продолжительности, рабочего на-
судов оценивали классической методикой [10].
пряжения, расстояния между электродами и др.).
Операционную рану брюшной стенки послойно
В данной работе использовали матрицы с толщи-
ушивали атравматическими иглами с нитью Pro-
ной стенки от 250 до 350 мкм. По данным, полу-
len 4-0. В динамике оценивали общее состояние
ченным с помощью сканирующей электронной
животных, цвет и температуру кожных покровов
микроскопии (рис. 2), средний диаметр волокон
задних конечностей, двигательную активность.
и средний размер пор в поверхностном слое мате-
Морфологическое исследование. Животных
риала составляют соответственно 0.6 ± 0.2 мкм и
5.5 ± 1.5 мкм, что сравнимо с линейными разме-
выводили из опыта через один, три и шесть меся-
рами клеток, следовательно, возможна миграция
цев. Оценивали проходимость аорты, состояние
клеток вглубь материала матрицы.
протеза и его морфологию. Для этого протезы с
фрагментами нативной аорты иссекали и фикси-
Прочность и модуль упругости полученных
ровали в 10%-м нейтральном формалине на фос-
трубчатых протезов сравнимы с параметрами на-
фатном буфере (рН 7.4) не менее 24 ч, далее об-
тивных сосудов крыс [11] и превосходят их для че-
разцы обезвоживали в серии растворов этанола
ловека [12]. Модуль упругости составляет 14-
возрастающей концентрации и заключали в пара-
19 МПа (против 17 МПа для крыс и 1.0 МПа для
финовые блоки по стандартной гистологической
человека), а прочность на разрыв — 1.8-2.2 МПа
методике. Парафиновые срезы толщиной 5 мкм
(против 2.3 МПа для крыс и 0.7 МПа для челове-
готовили с помощью микротома Accu-Cut SRT
ка). Удлинение до разрыва для полиимидных
200 (Sakura, Япония), окрашивали гематоксили-
протезов также сравнимо с удлинением нативных
БИОФИЗИКА том 67
№ 4
2022
830
ЧИРЯТЬЕВА и др.
Рис. 2. Микрофотографии поперечного среза полиимидного протеза.
человеческих сосудов — 34% против 42% соответ-
капсулы, помимо фибробластов, выявляются ги-
ственно. Следует отметить, что протезы на основе
гантские многоядерные клетки инородных тел.
полиимидов демонстрируют меньшую проч-
Через шесть месяцев после имплантации все
ность, чем биорезорбируемые протезы сосудов
протезы проходимы, аневризмы не выявлены.
аналогичного строения [11, 13]. Это можно объяс-
Микроскопически выраженная неоинтима пред-
нить необходимостью для биорезорбируемых
ставлена в основном коллагеновыми волокнами
протезов иметь значительный запас прочности,
(рис. 3д,и). На границе между неоинтимой и мат-
чтобы не допустить преждевременного разруше-
рицей в двух из трех случаев располагаются выра-
ния, так как в процессе резорбции механические
женные кальцинаты. Весь объем стенки протеза
характеристики матрицы неизбежно ухудшаются.
умеренно заселен фибробластами и макрофага-
Общее состояние и двигательная активность
ми. Соединительнотканная капсула, окружаю-
крыс-реципиентов описанных протезов вплоть
щая протезы, представлена зрелыми коллагено-
до выведения из опыта не отличались от таковых
выми волокнами, в ней определяются полно-
интактных животных.
кровные сосуды. На границе с внешней
Через месяц после имплантации все протезы
поверхностью наблюдаются гигантские много-
проходимы, аневризм не выявлено. Микроско-
ядерные клетки инородных тел.
пически в местах анастомозов наблюдается плав-
ный переход интимы нативного сосуда на протез
ОБСУЖДЕНИЕ
(рис. 3а-г). Большая часть неоинтимы представ-
лена эндотелием и тонким субэндотелиальным
Во всех экспериментах имплантация не сопро-
слоем. Однако в одном из трех случаев определя-
вождалась значимым кровотечением сквозь стен-
ется участок с выраженным субэндотелиальным
ку протеза или по линии анастомозов. На внут-
слоем, представленным сформированными кол-
ренней поверхности протезов в короткие сроки
лагеновыми волокнами. На данном участке меж-
образуется сплошной монослой эндотелиальных
ду протезом и неоинтимой наблюдаются обшир-
клеток, уменьшающий риск тромбообразования.
ные кальцинаты. Между волокнами протеза вы-
Гиперплазии интимы, сопутствующей развитию
является незначительное число клеток, в
ишемии, не наблюдается даже в районе анасто-
основном макрофаги и фибробласты. Снаружи
мозов, что является позитивным прогностиче-
протез покрыт соединительнотканной капсулой,
ским признаком. Присутствие макрофагов и ги-
в которой расположены полнокровные сосуды.
гантских многоядерных клеток инородных тел в
Через три месяца после имплантации два из
умеренном количестве говорит о средневыражен-
трех протезов проходимы, аневризмы не выявле-
ной реакции макроорганизма на инородное тело,
ны. На данном сроке эксперимента вся внутрен-
что является проявлением типичной иммунной
няя поверхность протеза выстлана неоинтимой,
реакции. Однако обращает на себя внимание по-
представленной эндотелием и тонким субэндоте-
явление в ряде случаев кальцинатов на границе
лиальным слоем. Весь объем стенки протеза засе-
между формирующейся неоинтимой и протезом в
лен умеренным числом фибробластов и макрофа-
районе анастомозов, возможной причиной кото-
гов. Между волокнами протеза определяются
рых может являться низкая скорость интеграции
тонкие коллагеновые волокна. Снаружи протезы
(врастания) тканей нативного сосуда в стенку
покрыты соединительнотканной капсулой с со-
протеза. Во всех экспериментах стенка сохраняла
судами. Среди клеток соединительнотканной
целостность, признаки появления аневризм не
БИОФИЗИКА том 67
№ 4
2022
НЕТКАНЫЕ СОСУДИСТЫЕ ПРОТЕЗЫ МАЛОГО ДИАМЕТРА
831
Рис. 3. Гистологические срезы полиимидных протезов: (а), (б), (в), (г) - через месяц после имплантации; (д), (е) - через
шесть месяцев после имплантации. (а), (б), (д), (е) - Окраска гематоксилином и эозином; (в), (г) - окраска по методу
Маллори. Увеличение общее: (а), (б), (д) - 4×; (в) - 10×; (г), (е) - 40×.
выявлены, что свидетельствует о стабильности
тельнотканную капсулу и формированием
упругих свойств материала.
неоинтимы на внутренней поверхности. Сохра-
нение проходимости сосуда в течение длительно-
го времени подтверждает тромборезистентность
ЗАКЛЮЧЕНИЕ
обсуждаемых протезов.
Биосовместимость протезов на основе микро-
Полученные результаты дают основание реко-
волокон ароматического полиимида обусловли-
мендовать сосудистые протезы, полученные ме-
вается не только химической инертностью по-
тодом электроформования из ароматического
лимера, но и заключением протеза в соедини-
полиимида, для дальнейшего их исследования в
БИОФИЗИКА том 67
№ 4
2022
832
ЧИРЯТЬЕВА и др.
качестве тканеинженерного сосудистого имплан-
тата.
healthinfo/global_burden_disease/estimates/en/
2. Г. И. Попов, П. В. Попрядухин, Г. Ю. Юкина и др.,
Цитология, 62 (1), 38 (2020).
ФИНАНСИРОВАНИЕ РАБОТЫ
3. P. C. Begovac, R. C. Thomson, J. L. Fisher, et al., Eur.
J. Vasc. Endovasc. Surg., 25 (5), 432 (2003).
Работа выполнена при финансовой поддержке
4. N. K. Awad, H. Niu, U. Ali, et al., Membranes (Basel),
Российского научного фонда (проект
№ 19-
8 (1), 1 (2018).
73-30003).
5. R. D. Rusu, M. D. Damaceanu, and P. C. Constantin,
Intelligent Polymers for Nanomedicine and Biotechnolo-
КОНФЛИКТ ИНТЕРЕСОВ
gies, Ed. by M. Aflori (Taylor & Francis, Boca Raton,
2018).
Авторы заявляют об отсутствии конфликта
6. D. Serbezeanu, T. Vlad-Bubulac, D. Rusu, et al., Ma-
интересов.
terials (Basel), 12 (19), 1 (2019).
7. P. Starr, C. M. Agrawal, and S. Bailey, J. Biomed. Ma-
ter. Res. Part A, 104 (2), 406 (2016).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
8. W. Lu, J. Sun, and X. Jiang, J. Mater. Chem. B, 2 (17),
Работа с животными выполнена в соответ-
2369 (2014).
ствии с правилами использования эксперимен-
9. V. M. Svetlichnyi, G. V. Vaganov, L. A. Myagkova,
тальных животных (согласно принципам Евро-
et al., Russ. J. Appl. Chem., 93 (1), 35 (2020).
пейской конвенции, Страсбург, 1986 г. и Хель-
10. R. Acland, Surgery, 72 (5), 744 (1972).
синской декларации Всемирной медицинской
11. P. V Popryadukhin, G. I. Popov, G. Y. Yukina, et al.,
ассоциации о гуманном обращении с животны-
Int. J. Biomater., 2017, 1 (2017).
ми, 1996 г.).
12. П. И. Бегун и П. Н. Афонин, Моделирование в био-
механике, под ред. Л. А. Савина (Высшая школа,
М., 2004).
СПИСОК ЛИТЕРАТУРЫ
13. В. Н. Александров, А. В. Кривенцов, Е. В. Михай-
1. World Health Organization. Global Health Estimates
лова и др., Вестн. Рос. воен.-мед. академии, 2 (58),
2016: Deaths by Cause, Age, Sex, by Country and by Re-
120 (2017).
Small Diameter Nonwoven Vascular Prostheses
Based on Aromatic Polyimide Nanofibers
A.E. Chiriateva*, N.A. Zavrazhnykh*, P.V. Popryadukhin*, **, G.Yu. Yukina*, ***,
A.V. Kriventsov****, E.M. Ivankova**, and V.E. Yudin*, **
*Peter the Great St. Petersburg State Polytechnic University, Polytechnicheskaya ul. 29, Saint Petersburg, 195251 Russia
**Institute of Macromolecular Compounds, Russian Academy of Sciences, Bolshoy prosp. 31, Saint Petersburg, 199004 Russia
***Pavlov First St. Petersburg State Medical University, ul. L'va Tolstogo 6-8, Saint Petersburg, 197022 Russia
****Kirov Military Medical Academy, ul. Akademika Lebedeva 6, Saint Petersburg, 194044 Russia
One of the main methods of treating cardiovascular pathology is surgical reconstruction of blood vessels, in-
cluding the use of polymer-based prostheses; a clinically acceptable small diameter prosthesis is under devel-
opment. In this work, vascular prostheses with a diameter of 1.2 mm were fabricated by electrospinning of
aromatic polyimide. The mechanical characteristics of new prostheses were comparable to the parameters of
native vessels in rats and humans. The prostheses were implanted into the abdominal aorta of rats for 1, 3 and
6 months. During the experiment, the prostheses were permeable; no signs of aneurysm or intimal hyperpla-
sia were observed, there were no symptoms of thrombosis. Morphological analysis showed the formation of
neointima with endothelium and thin subendothelial layer on the inner surface of the prostheses, and the for-
mation of connective tissue encapsulating the prostheses. Prostheses based on polyimide nanofibers have
demonstrated high biocompatibility and thromboresistance, thereby prompting further research exploring
polyimide nanofibers-based prostheses as tissue-engineered vascular implants.
Keywords: tissue engineering, tissue-engineered vascular implants, polyimide, PM-ODA, electrospinning
БИОФИЗИКА том 67
№ 4
2022