БИОФИЗИКА, 2022, том 67, № 5, с. 859-867
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.217.39
16S рРНК E. coli ЗНАЧИТЕЛЬНО СТИМУЛИРУЕТ ТРАНСЛЯЦИЮ
РЕПОРТЕРНОЙ мРНК В БЕСКЛЕТОЧНОЙ
ЭУКАРИОТИЧЕСКОЙ СИСТЕМЕ
© 2022 г. Н.В. Зырина*, **, #, С.Ч. Агаларов*
*Институт белка РАН, Институтская ул., 4, Пущино Московской области, 142290, Россия
**Институт теоретической и экспериментальной биофизики РАН,
Институтская ул., 3, Пущино Московской области, 142290, Россия
#E-mail: zyrina.nv@gmail.com
Поступила в редакцию 01.07.2022 г.
После доработки 01.07.2022 г.
Принята к публикации 20.07.2022 г.
Методом мониторинга люминесценции в режиме реального времени обнаружен эффект суще-
ственной стимуляции трансляции репортерных мРНК в бесклеточной системе WGE (бесклеточная
эукариотическая система на основе экстракта зародышей пшеницы) при добавлении 16S рибосом-
ной РНК E. coli. Эффект стимуляции трансляции мРНК люциферазы оказался специфичным имен-
но для бесклеточной системы WGE и проявлялся вне зависимости от природы 5′-нетранслируемой
области репортерной мРНК. Определен класс нетранслируемой РНК, не оказывающий стимулиру-
ющего эффекта. На величину эффекта стимуляции трансляции репортерных мРНК в системе WGE
влияли концентрация и тип 5′-нетранслируемой области репортерной мРНК, а также момент вне-
сения 16S РНК в работающую систему. Изучение явления стимуляции трансляции позволит опти-
мизировать бесклеточную систему WGE для применения в методах с использованием репортерных
генов и решения различных научно-прикладных задач.
Ключевые слова: биолюминесценция, трансляция, бесклеточная система WGE
DOI: 10.31857/S0006302922050027, EDN: JIDBYR
количественно, измеряя люминесценцию непо-
Бесклеточные системы трансляции - одна из
средственно во время трансляции мРНК
фундаментальных технологий, которая открыва-
люциферазы в системе. Анализ крайне чувствите-
ет широкие возможности в области изучения ме-
лен, так как реакция имеет высокий квантовый
ханизмов биосинтеза белка, функциональной ге-
номики, скрининга и масштабного получения ак-
выход при отсутствующей фоновой люминесцен-
ции [7]. Так, в оптимальных условиях реакции
тивных белков, разработки лекарственных
можно обнаружить около 10 фг люциферазы [8].
препаратов, изучения метаболических путей и др.
[1-3]. Для решения различных задач с примене-
Проводя мониторинг синтеза люциферазы в
нием этих систем разработан ряд методов на ос-
бесклеточной эукариотической системе трансля-
нове репортерных мРНК. Одним из таких мето-
ции на основе экстракта зародышей пшеницы
дов является метод мониторинга синтеза фермен-
(система WGE) мы обнаружили неожиданный
та люциферазы светлячка (Photinus рyralis) в
эффект стимуляции трансляции репортерной
режиме реального времени в бесклеточных систе-
мРНК люциферазы при добавлении в систему не-
мах трансляции, впервые предложенный в нашей
транслируемой 16S рибосомной РНК E.coli. Це-
лаборатории для изучения механизмов биосинте-
лью настоящей работы было определение факто-
за белка [4]. В основе метода лежит катализ люци-
ров, влияющих на обнаруженный эффект.
феразой реакции окисления люциферина, сопро-
вождаемой излучением кванта света в области
МЕТОДЫ
540-600 нм [5, 6]. Окисляемый субстрат добавля-
ют непосредственно в реакционную смесь,
Плазмиды и получение матриц для транскрип-
активность синтеза люциферазы характеризуют ции. Плазмиды pTZ10OmegaLuc [9], pSP36Tβ-glo-
bin-Luc-GAPDH-A50 [10] и pCrPV-Fluc [11], со-
Сокращениe:5′-НТО - 5′-нетранслируемая область.
держащие кодирующую последовательность лю-
859
860
ЗЫРИНА, АГАЛАРОВ
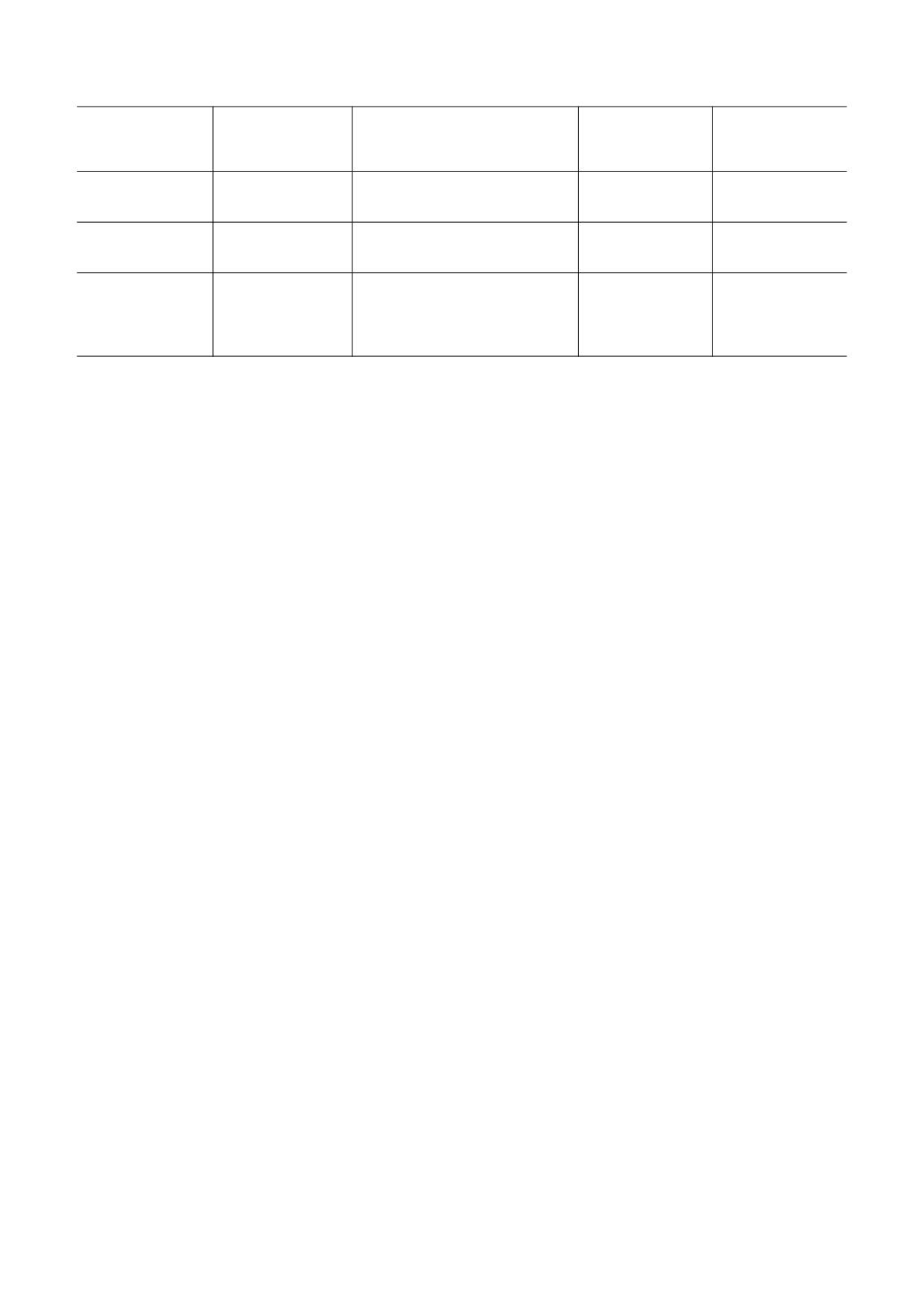
Таблица 1. ДНК и репортерные мРНК
Способ
Плазмидный
Размер
мРНК
5′-НТО (лидеры)
инициации
вектор
транскрипта, п.о.
трансляции
pTZ10Omega-Luc-
5′UTROmega-Luc-
5′-НТО РНК ВТМ (омега-
Кэп- и eIF4F-
2049
TMV
3′UTRTMV
лидер)
независимый
pSP36T-β-globin-
5′UTRβGlobin-Luc-
5′-НТО мРНК белка -глобина
Кэп-зависимый
1866
Luc-GAPDH-A50
3′UTRGAPDH-A50
лягушки Xenopus
IRES-
Межгенная последовательность
5′UTRCrPV-Luc-
опосредованный
pCrPV-Fluc
геномной РНК вируса паралича
2089
3′UTR
A50
(кэп- и фактор
сверчка (CrPV IRES)
независимый)
циферазы светлячка (Photinus pyralis) и различные
ДНК (при A260 нм), а также дополнительную
5'-НТО (табл. 1) нарабатывали в E. coli DH5α
оценку чистоты препарата (соотношение
(ThermoFisher Scientific, США) и выделяли с по-
A260/A280) определяли на спектрофотометре
мощью набора GeneJET Plasmid Miniprep Kit
SmartSpec™ Plus (Bio-Rad).
(ThermoFisher Scientific, США).
Получение мРНК. Матричные РНК, кодирую-
Для дальнейшего использования в транскрип-
щие люциферазу светлячка (Photinus pyralis)
ции плазмиду pTZ10OmegaLuc расщепляли эндо-
5′UTROmega-Luc-3'UTRTMV, и
5′UTRCrPV-Luc-
нуклеазой рестрикции Bsp120I (Psp OMI) (Ther-
moFisher Scientific, США), плазмиду pSP36T-β-
3′UTRA50, были получены транскрипцией соот-
globin-Luc-GAPDH-A50 - эндонуклеазой HpaI
ветствующих ДНК (см. табл. 1) с использованием
(ThermoFisher Scientific, США) в условиях, реко-
РНК-полимеразы фага T7 (NEB) в условиях, ре-
мендованных производителями. Плазмиду
комендованных производителем фермента, до-
pCrPV-Fluc использовали в качестве матрицы для
бавляя MgCl2 до 22 мМ и 1 ед/мкл ингибитора
синтеза ДНК-фрагмента с 5'-НТО вируса парали-
РНКазы RiboLock™ (ThermoFisher Scientific,
ча сверчка CrPV в ПЦР (см. табл. 1). Праймеры
США). Концентрация каждого NTP составляла
для реакции - T7 (прямой) 5'CGCCGTAATAC-
4 мМ, линеаризованной плазмиды pTZ10Omega-
GACTCACTATAGGGAAAGCAAAAATGTGATC-
Luc или очищенного продукта ПЦР pCrPV-Fluc -
TTGCTTG, последовательность промотора Т7
0.02 мкг/мкл. Реакционную смесь инкубировали
РНК-полимеразы подчеркнута) и FLA50a (обрат-
в течение 2 ч, после этого сразу проводили депро-
ный)
5'(T)48AACTTGTTTATTGCAGCTTAT)
-
теинизацию смесью фенол с pH 5.5 : хлороформ
были синтезированы Научно-производственной
(1 : 1) и ряд спиртовых осаждений с использова-
компанией
«Синтол» (Россия). Реакционную
нием насыщенного раствора хлорида лития
смесь объемом 100 мкл, содержащую 1.6 нг/мкл
(1/3 объема) 4 М NH4OAc (1/2 объема) и 3 М
плазмиды,
0.3 мкМ каждого из праймеров,
NaOAc с рН 5.5 (1/10 объема). Для получения
0.025 ед/мкл Taq-полимеразы (Roche, Германия),
мРНК
5′UTRcap-βGlobin-Luc-3′UTRGAPDH-A50
0.2 мМ каждого из дНТФ, 2.5 мМ MgCl₂ и 1× бу-
проводили реакцию с РНК полимеразой фага SP6
фер High Fidelity Buffer (Roche, Германия), поме-
(ThermoFisher Scientific, США) в условиях, реко-
щали в амплификатор Biometra Personal Cycler
мендованных производителем фермента. Кон-
(Analytik Jena, Германия) и амплифицировали це-
центрации добавленных MgCl2, и других компо-
левой ДНК-фрагмент в режиме: стартовая дена-
нентов реакции, а также время инкубации и
турация (1 мин), 3 цикла денатурации (15 сек,
очистка были такими же, как указано выше.
94°С), отжига (30 сек, 50°С) и элонгации (72°С,
Кэпирование полученной мРНК проводили с по-
2 мин), 29 циклов денатурации (15 сек, 94°С), от-
мощью набора ScriptCap™m7G Capping System
жига (30 сек, 65°С) и элонгации (72°С, 2 мин) и
(CellScript), после этого мРНК экстрагировали
финальная элонгация (7 мин).
смесью фенол: хлороформ 1 : 1 и очищали на ко-
После расщепления плазмидные ДНК или
лонке Illustra MicroSpin G50 (GE Healthcare) со-
продукт ПЦР очищали фенольной депротеиниза-
гласно рекомендациям производителя.
цией с последующим спиртовым осаждением.
Все этапы работы контролировали электрофоре-
Качество полученного препарата РНК анали-
зом в 1%-й агарозе в нативных условиях с визуа-
зировали в 1%-й агарозе в 0.5× TBE с визуализа-
лизацией бромистым этидием. Концентрацию
цией бромистым этидием, а также в 6% ПААГ с
БИОФИЗИКА том 67
№ 5
2022
16S рРНК E. coli ЗНАЧИТЕЛЬНО СТИМУЛИРУЕТ ТРАНСЛЯЦИЮ
861
7 М мочевиной и окрашиванием толуидиновым
по протоколу производителя. Приготовление
синим.
экстракта S-100 E. coli и трансляцию в бесклеточ-
Препараты РНК и ДНК. 16S и 23S рибосомные
ной системе на его основе 0.5 мкг/мкл мРНК лю-
РНК выделяли из препаратов 30S и 50S субчастиц
циферазы
5′UTRSD-Luc-3′UTRN64
(5′-НТО
рибосом E. сoli MRE600. К препаратам добавляли
Шайн-Дальгарно) проводили по ранее опубли-
двукратный объем деионизированной воды и
кованным протоколам [12, 13].
0.2%-й раствор SDS в объемном соотношении
Все компоненты системы, кроме мРНК, сме-
1 : 5 при интенсивном перемешивании. После
шивали при 4°С, предварительно инкубировали
этого проводили депротеинизацию РНК с ис-
при температуре реакции в течение 2 мин, затем
пользованием фенола с рН 5.5 на первой стадии.
добавляли мРНК, помещали микроцентрифуж-
Экстрагированную РНК осаждали из водной фа-
ную пробирку с реакционной смесью в термоста-
зы, добавляя 3М NaOAc и этанол, осадок раство-
тируемую ячейку 12-ячеечного роторного люми-
ряли в деионизированной воде и хранили при -
нометра Хемилюм-12 (Россия) и инкубировали в
20°C. При выделении 23S РНК не отделяли 5S
течение часа. Мониторинг синтеза люциферазы
РНК.
проводили, регистрируя интенсивность биолю-
В работе использовали тотальную нетрансли-
минесценции в непрерывном режиме в течение
руемую РНК (тРНК) E. сoli MRE600 40 мкг/мл
указанного времени с автоматическим выводом
(Roche, Германия), РНК фага MS2 0.8 мкг/мл
потока данных в виде кинетической кривой.
(Roche, Германия) и ДНК тимуса теленка, обра-
Каждое измерение проводили в трех повторно-
ботанную ультразвуком до фрагментов размером
стях.
200-6000 п.о., с конц. 500 мкг/мл (Cytiva). К
Обработка данных. Активность трансляции ре-
100 мкг каждого препарата добавляли MgCl2 до
портерной мРНК оценивали по максимальной
10 мМ, переводили в буфер, содержащий 10 мМ
скорости синтеза люциферазы, которую опреде-
трис-HCl, 100 мМ KCl, 10 мМ MgCl2 (pH 7.5) и
ляли как максимальное значение производной по
очищали на колонке NAP™5 (Amersham, Велико-
времени на участке от конца лаг-периода до нача-
британия) согласно рекомендациям производи-
ла выхода кривой на плато. Обработку и анализ
теля. РНК и ДНК осаждали добавлением 3М
данных проводили с использованием программ-
NaOAc и этанола, осадок растворяли в деионизи-
ного обеспечения OriginPro 8 SR0, результаты
рованной воде и хранили при -20°C.
представляли в виде среднего арифметического
Трансляция в бесклеточных системах с непре-
(Mean) и среднеквадратичного отклонения (SD).
рывным мониторингом синтеза люциферазы.
Трансляцию в бесклеточной системе на основе
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
экстракта зародышей пшеницы WGE проводили
в стационарном режиме при 25°С: 10 мкл реакци-
Эффект стимуляции трансляции репортерной
онной смеси содержали 1× буфер для трансляции
мРНК люциферазы в присутствии 16S РНК E. coli.
WGE (25 мМ HEPES-KOH (pH 8.0), 0.4 мМ GTP,
Проводя мониторинг синтеза люциферазы в бес-
1 мМ ATP, 0.1 мМ cпермидина, 0.05 мг/мл тоталь-
клеточной системе WGE, транслирующую не-
ной тРНК дрожжей, 1.5 мМ дитиотреитола),
большие количества (0.35-0.70 мкг/мкл) мРНК
0.2 мМ каждой аминокислоты (смесь), 1.5 мМ
люциферазы с омега-лидером вируса табачной
Mg(OAc)2 (до 3 мМ с учетом магния экстракта
мозаики 5′UTROmega-Luc-3′UTRTMV, мы обнару-
WGE), 0.02 мМ KOAc (до 65 мМ с учетом магния
жили любопытное явление: внесение в бескле-
экстракта WGE), 2% глицерина, 0.15 мМ сперми-
точную систему выделенной из экстракта зароды-
дина, 0.01 мМ NP40, 16 мМ креатинфосфата, 30%
шей пшеницы тотальной РНК значительно сти-
экстракта зародышей пшеницы, 0.1 мг/мл креат-
мулировало трансляцию (рис. 1а). Известно, что
инфосфокиназы (Boehringer Mannheim, Герма-
около 80% тотальной РНК WGE составляет рибо-
ния), 0.5 ед/мкл ингибитора РНКаз RiboLock™
сомная РНК. Мы решили проверить, будет ли ри-
(ThermoFisher Scientific, США). Для непрерывно-
босомная РНК из другого организма стимулиро-
го мониторинга синтеза люциферазы реакцион-
вать подобным образом трансляцию мРНК лю-
ная смесь содержала 0.10 мМ люциферина. Ко-
циферазы при внесении в таких же количествах,
нечные концентрации мРНК, а также добавлен-
что и в первоначальных экспериментах с тоталь-
ных
16S и других РНК указаны в разделе
ной РНК из WGE, т.е. в дипапзоне
0.38-
«Результаты». Экстракт зародышей пшеницы
2.25 мкг/мкл. Оказалось, что добавление
16S
(WGE) получали, как описано в работе [12].
РНК E. coli стимулировало синтез люциферазы в
Трансляцию мРНК люциферазы 5′UTROmega-
бесклеточной системе WGE так же существенно и
Luc-3′UTRTMV проводили также в бесклеточной
не менее эффективно (рис. 1б), значительно уве-
системе на основе лизата ретикулоцитов кролика
личивая накопление активной люциферазы.
(RRL) с использованием набора Flexi Rabbit Re-
Максимальный стимулирующий эффект дости-
ticulocyte Lysate System (Promega, США) при 30°С
гался при добавлении 0.75 мкг/мкл 16S РНК, при
БИОФИЗИКА том 67
№ 5
2022
862
ЗЫРИНА, АГАЛАРОВ
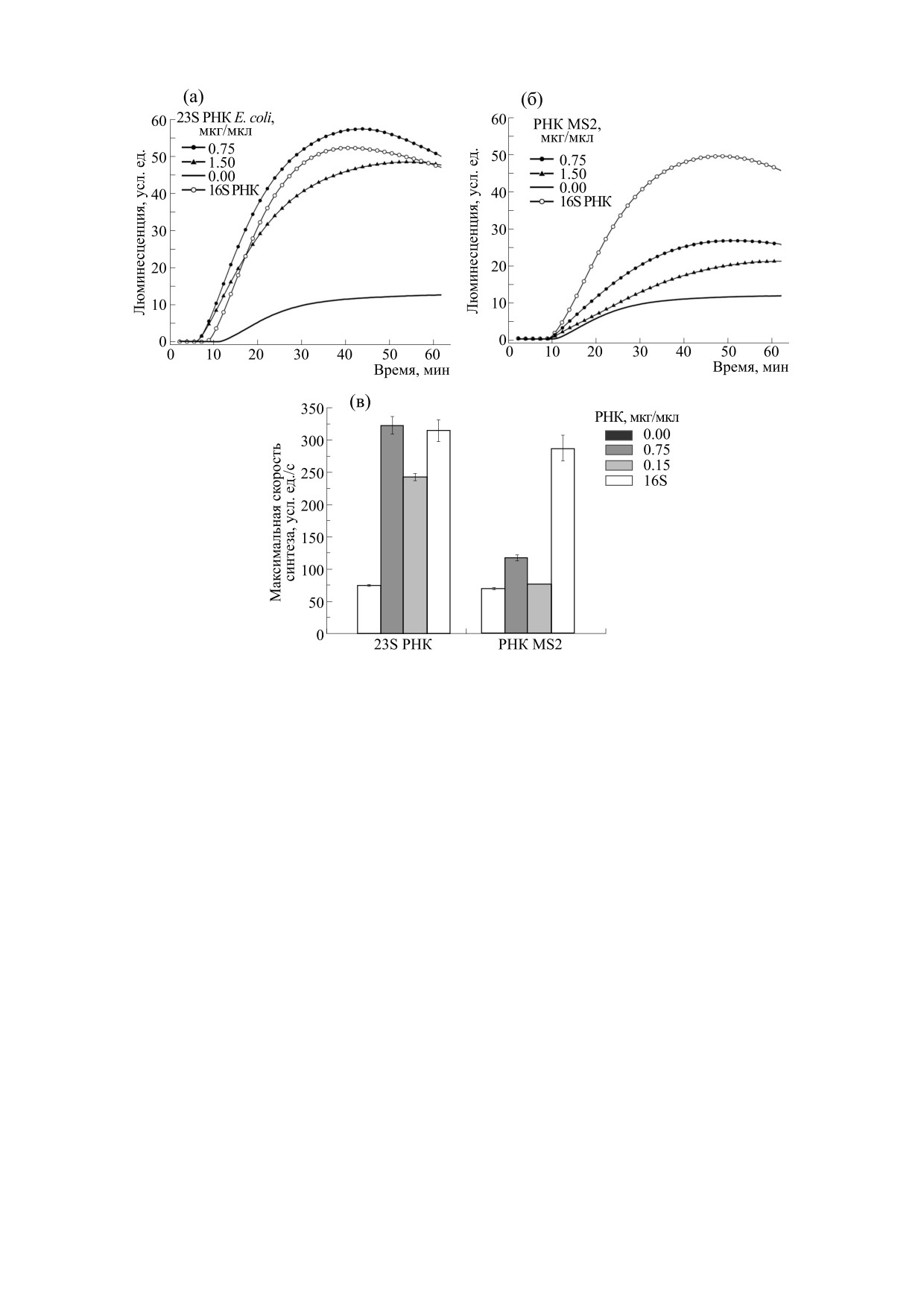
Рис. 1. Присутствие тотальной РНК из WGE и 16S РНК E. coli стимулирует синтез люциферазы в бесклеточной
системе трансляции на основе экстракта зародышей пшеницы: (а) - эффект внесения тотальной РНК изWGE; (б) -
кинетические кривые накопления активной люциферазы при добавлении разных концентраций 16S РНК E. coli; (в) -
максимальная скорость синтеза люциферазы в присутствии разных концентраций 16S РНК. Звездочкой отмечен
максимальный эффект стимуляции, данные представлены в виде Mean ± SD. Трансляция мРНК люциферазы в
концентрации 0.70 мкг/мкл с омега-лидером 5′UTROmega-Luc-3′UTRTMV.
этом максимальная скорость синтеза люцифера-
добавление 23S рРНК оказало стимулирующее
зы увеличивалась в 4.8 раз (рис. 1в). Дальнейшее
влияние на трансляцию репортерной мРНК, со-
увеличение концентрации 16S РНК приводило к
поставимое с 16S РНК (рис. 2а,в). Внесение РНК
снижению стимулирующего эффекта, и внесение
фага MS2 тоже стимулировало трансляцию ре-
16S РНК в концентрации 2.25 мкг/мкл стимули-
портерной мРНК, однако эффект был значитель-
ровало скорость синтеза белка лишь на
20%
но менее выражен (рис. 2б,в). Так, внесение РНК
(рис. 1в).
фага МS2 в максимальной стимулирующей кон-
центрации 0.75 мкг/мкл вызывало увеличение
Для того чтобы определить, обладают ли дру-
гие РНК способностью стимулировать синтез
скорости синтеза люциферазы на 70%. В то же
люциферазы, были проверены 23S рРНК и тРНК
время внесение 23S РНК, так же как и 16S РНК,
E. coli, так как РНК этих классов содержатся в то-
увеличивало максимальную скорость синтеза бо-
тальной РНК WGE. Кроме того, в качестве образ-
лее чем в четыре раза. Добавление тРНК и ДНК в
ца еще одного класса РНК (геномной) была взята
указанных концентрациях в реакционную смесь
РНК бактериофага MS2. Для проверки возмож-
не стимулировало трансляцию, а приводило к
ности ДНК стимулировать трансляцию синтез
увеличению времени лаг-периода и уменьшению
люциферазы провели также в присутствии ДНК
максимальной скорости синтеза люциферазы
тимуса теленка. Эти эксперименты показали, что
(данные не представлены).
БИОФИЗИКА том 67
№ 5
2022
16S рРНК E. coli ЗНАЧИТЕЛЬНО СТИМУЛИРУЕТ ТРАНСЛЯЦИЮ
863
Рис. 2. 23S РНК и РНК фага MS2 также стимулируют трансляцию. Трансляция мРНК люциферазы в концентрации
0.70 мкг/мкл с 5′UTROmega-Luc-3′UTRTMV при добавлении: (а) - 23S рРНК E. coli; (б) - РНК фага MS2; (в) -
максимальная скорость синтеза люциферазы в отсутствие (черные столбики) и в присутствии разных концентраций
23S РНК и РНК фага MS2 (указаны в легенде), концентрация 16S РНК - 0.75 мкг/мкл.
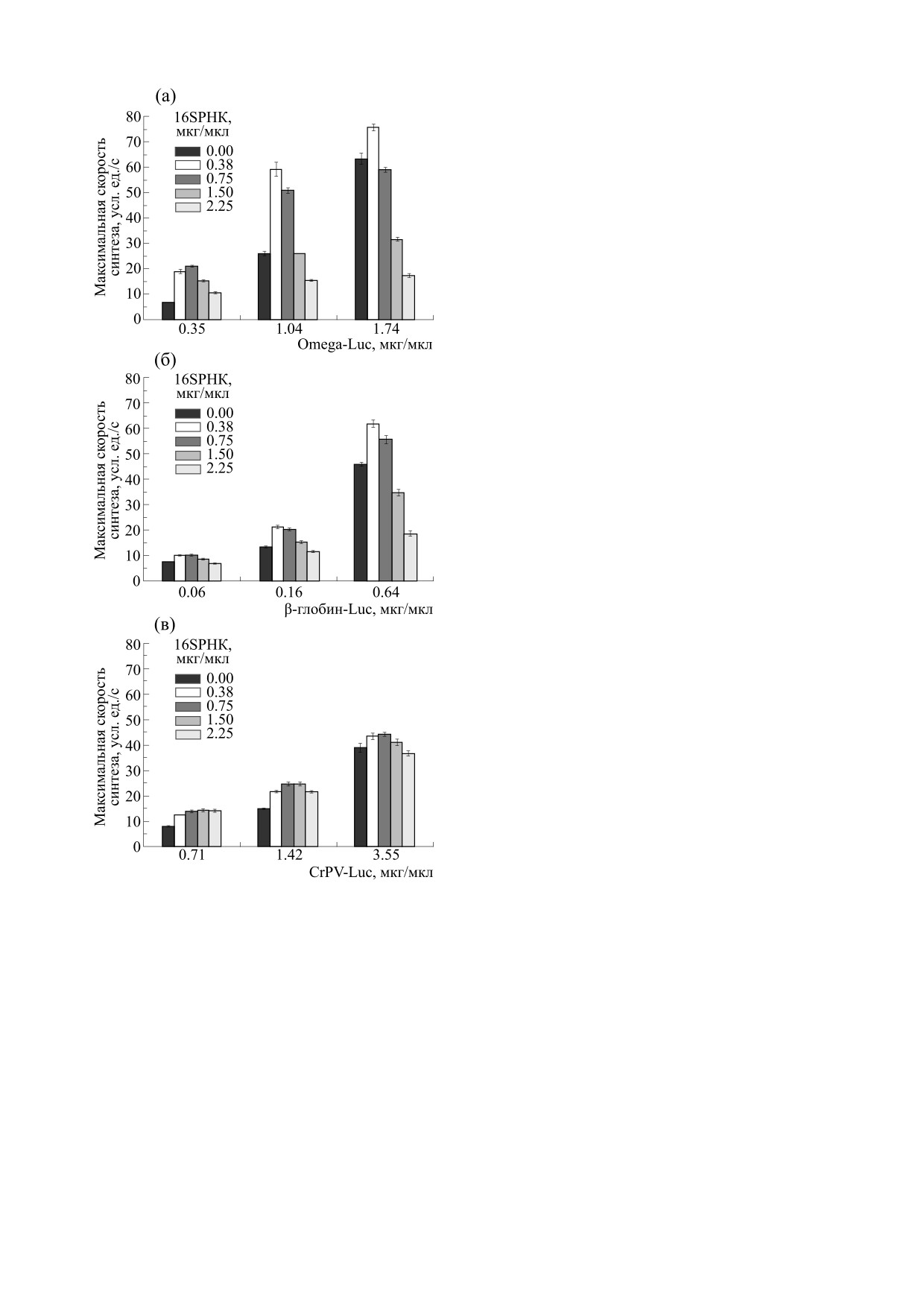
Трансляция мРНК люциферазы с разными спо-
Эксперименты показали, что стимуляция
собами инициации. Напомним, что в эксперимен-
трансляции мРНК люциферазы в экстракте WGE
тах, описанных выше, эффект стимуляции был
происходила вне зависимости от природы ее
обнаружен при трансляции небольших количеств
5′-НТО (или способа инициации) (рис. 3). Одна-
ко величина эффекта зависела от 5′-НТО и кон-
некэпированной мРНК. На следующем этапе ра-
центрации репортерных мРНК. В случае транс-
боты необходимо было установить, как внесение
ляции «низкой» концентрации (0.35 мкг/мкл)
16S РНК будет влиять на трансляцию мРНК с
мРНК люциферазы с омега-лидером добавление
разными типами 5′-НТО и, следовательно, отли-
16S РНК вызывало такой же эффект стимуляции,
чающихся по способу инициации (см. табл. 1).
как описано выше (рис. 3б,в), с увеличением мак-
Для этого, кроме мРНК люциферазы с омега-ли-
симальной скорости синтеза люциферазы в
дером, в системе WGE транслировали мРНК с
8.6 раз. Иной эффект вызывало добавление 16S
классическим кэпированным лидером мРНК
РНК на трансляцию «средней» и «высокой» кон-
глобина, а также с 5′-НТО IRES (табл. 1). Эти
центрации - 1.04 и 1.74 мкг/мкл мРНК соответ-
мРНК транслировали в WGE в трех концентра-
ственно. Во-первых, стимулирующий эффект 16S
циях («низкой», «средней» и «высокой») и добав-
РНК был заметно слабее. Так, максимальная ско-
ляли 16S РНК до конечной концентрации 0.38-
рость синтеза белка при внесении 0.38 мкг/мкл
2.25 мкг/мкл в реакционной смеси.
16S РНК превышала всего лишь в 2.6 и 1.2 раза
БИОФИЗИКА том 67
№ 5
2022
864
ЗЫРИНА, АГАЛАРОВ
максимальную скорость синтеза белка, а даль-
нейшее увеличение концентрации 16S РНК за-
медляло скорость синтеза люциферазы в 2-5 раз
(рис. 3а). Кроме того, в WGE, транслирующей
1.74 мкг/мкл репортерной мРНК, максимальная
скорость синтеза начинала уменьшаться уже при
внесении 0.75 мкг/мкл 16S РНК.
Иным было влияние добавления 16S РНК на
трансляцию мРНК с кэпированным лидером
мРНК глобина (рис. 3б). Проявление ингибиру-
ющего влияния 2.25 мкг/мкл 16S РНК начина-
лось уже с малых концентраций (0.06 мкг/мкл)
мРНК. Стимулирующий эффект на трансляцию
мРНК с глобиновым лидером был менее выра-
женным по сравнению с мРНК с омега-лидером.
Так, максимальная скорость реакции увеличива-
лась в лучшем случае в 1.9 раза (см. 0.06 и
0.16 мкг/мкл мРНК и 0.38 мкг/мкл 16S РНК,
рис. 3б).
В отличие от предыдущих мРНК, трансляция
всех концентраций мРНК с 5′-НТО IRES стиму-
лировалась всеми концентрациями
16S РНК
(рис. 3б). Лишь внесение 2.25 мкг/мкл замедляло
скорость синтеза люциферазы на 10% при макси-
мальном количестве мРНК
3.55 мкг/мкл
(рис. 3в). Максимальное увеличение скорости
синтеза белка (в 3.3 раза) наблюдали также при
трансляции «низкой» концентрации 0.71 мкг/мкл
мРНК при добавлении 1.5 мкг/мкл 16S РНК в си-
стему WGE.
Таким образом, мы выявили, что добавление
16S РНК влияет по-разному на трансляцию ре-
портерной мРНК в зависимости от 5′-НТО и ее
концентрации в системе WGE. Однако эффект
стимуляции синтеза люциферазы не является
специфическим свойством мРНК с омега-лиде-
ром, а проявляется вне зависимости от природы
5′-НТО мРНК. Максимальный стимулирующий
эффект наблюдали при внесении 16S РНК в си-
стему WGE при трансляции небольших коли-
честв репортерных мРНК. Наибольший эффект
стимуляции внесение 16S РНК оказывало на
трансляцию некэпированной мРНК с омега-ли-
Рис. 3. Трансляция мРНК люциферазы c различными
дером.
5′НТО при внесении разных концентраций 16S РНК
E. coli. Максимальная скорость синтеза люциферазы:
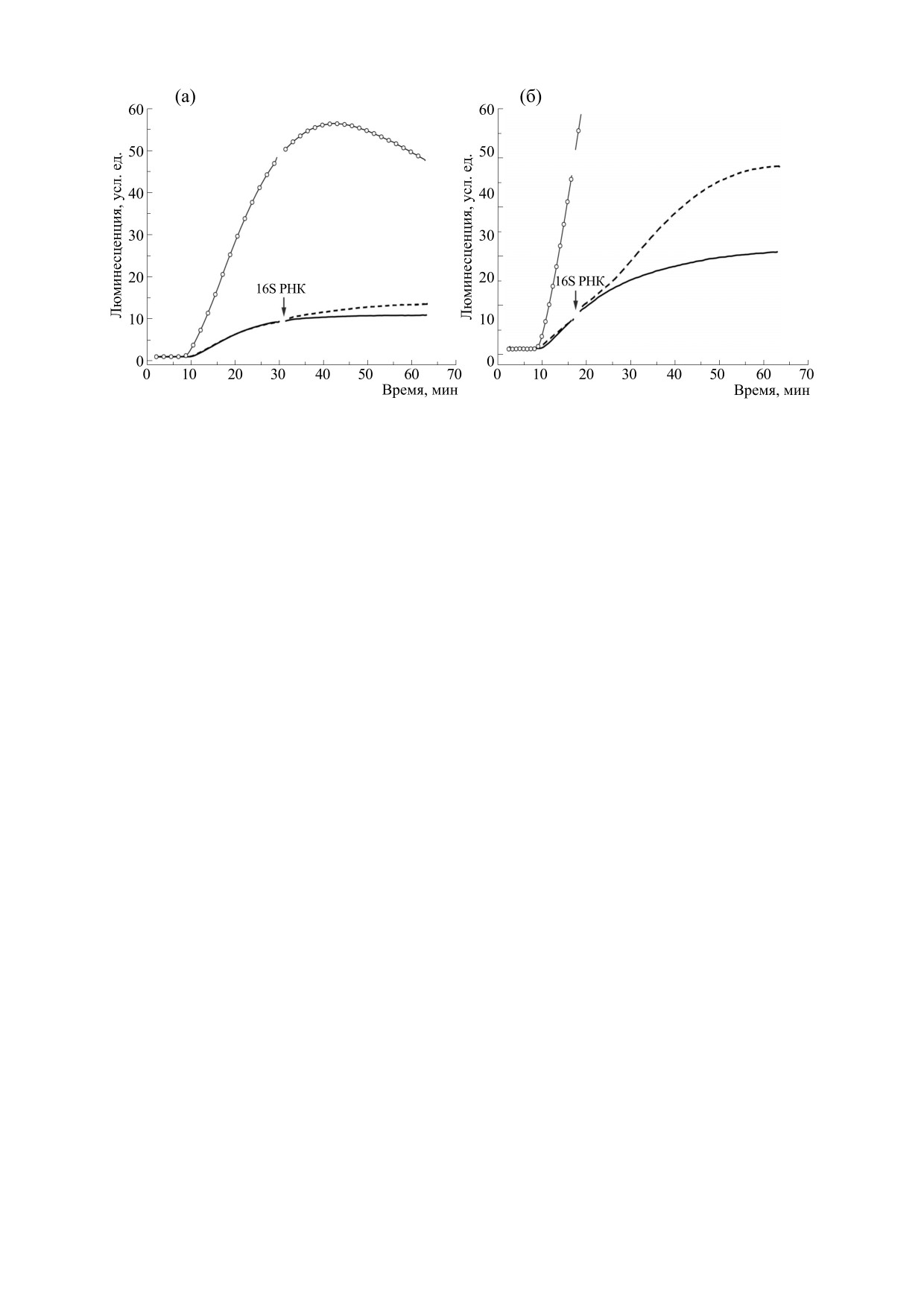
Изменение хода кинетической кривой трансля-
(а)
- мРНК с омега-лидером
5′UTROmega-Luc-
ции при внесении 16S РНК на разных этапах рабо-
3′UTRTMV; (б)
- мРНК с глобиновым лидером
ты системы. Для определения зависимости эф-
5′UTRβGlobin-Luc-3′UTRGAPDH-A50; (в) - мРНК с
CrPV IRES 5′UTRCrPV-Luc-3′UTRA50. Данные пред-
фекта стимуляции трансляции мРНК люцифера-
ставлены в виде Mean ± SD.
зы от момента внесения 16S рРНК в систему
WGE, мы добавляли 0.75 мкг/мкл 16S РНК на
разных этапах работы системы: перед лаг-перио-
«контрольную» (рис. 3а). Во-вторых, увеличение
дом, на линейном участке кинетической кривой,
16S РНК в системе WGE до 1.50 мкг/мкл или
а также на этапе начала выхода кинетической
практически не влияло, или сильно замедляло
кривой на плато (рис. 4). Лаг-период соответству-
БИОФИЗИКА том 67
№ 5
2022
16S рРНК E. coli ЗНАЧИТЕЛЬНО СТИМУЛИРУЕТ ТРАНСЛЯЦИЮ
865
Рис. 4. Изменение хода кинетической кривой трансляции при внесении 16S РНК. Трансляция 0.70 мкг/мкл мРНК
люциферазы 5′UTROmega-Luc-3′UTRTMV и внесение 0.75 мкг/мкл 16S РНК E. coli в момент начала выхода
кинетической кривой на плато (а) и на линейном участке кинетической кривой (стрелка) (б). Кривая с кружками -
16S РНК добавлена в начале реакции, пунктирная кривая - 16S РНК добавлена на определенном этапе реакции,
сплошная кривая - контроль, добавлена деионизированная вода.
ет так называемому времени пробега (transit
ская кривая контрольной реакции после продол-
time), в течение которого происходит инициация
жала свой ход как обычно, со скоростью 46-
трансляции и синтез полноразмерной люцифера-
48 усл. ед./с, после чего происходило замедление
зы, линейный участок кинетической кривой со-
и выход на плато. Временной интервал между до-
бавлением 16S РНК и скачком люминесценции
ответствует максимальной синтетической актив-
приблизительно соответствует времени пробега,
ности трансляционного аппарата, а начало выхо-
что позволило сделать вывод о стимуляции транс-
да кинетической кривой на плато соответствует
ляции на стадии инициации, тем самым исклю-
замедлению процессов синтеза люциферазы при
чив влияние на процесс элонгации.
условии избытка субстратов реакции и отсут-
Влияние 16S РНК на синтез люциферазы в дру-
ствии процессов деградации/агрегации фер-
гих бесклеточных системах трансляции. Для ответа
мента.
на вопрос, универсально ли обнаруженное влия-
Анализ изменения хода кинетических кривых
ние 16S РНК на синтез люциферазы во всех бес-
клеточных системах трансляции или же является
синтеза позволил выявить, что добавление 16S
специфическим свойством системы WGE, была
рРНК на всех этапах работы системы WGE вызы-
вало стимуляцию трансляции (рис. 4, пунктир-
проведена трансляция соответствующих репор-
терных мРНК в системах, полученных из клеток
ные кривые). Однако максимальный эффект на-
бактериий (E. coli) и млекопитающих (ретикуло-
блюдали при добавлении 16S РНК в момент нача-
цитов кролика). Оказалось что внесение 16S РНК
ла реакции (рис.
4а,б, кривые со светлыми
в диапазоне 0.38-2.25 мкг/мкл в обе эти бескле-
кружками). Добавление 16S рРНК в реакцию при
точные системы подавляло трансляцию репор-
начинающемся выходе кинетической кривой на
терных мРНК пропорционально внесенному ко-
плато проявлялось лишь в незначительном уве-
личеству (данные не представлены). Эффект сти-
личении люминесценции (рис. 4а). Внесение 16S
муляции трансляции репортерных мРНК
РНК на линейном участке кинетической кривой
оказался специфичным именно для бесклеточ-
влияло на ход синтеза люциферазы иначе (рис 4б,
ной системы WGE.
пунктирная кривая). Оказалось, что сначала ре-
акция в течение 6-7 мин продолжала идти в ли-
Таким образом, метод мониторинга люминес-
нейном режиме с такой же с максимальной ско-
ценции синтеза люциферазы в режиме реального
ростью (46 усл. ед./с), как до внесения 16S рРНК.
времени позволил обнаружить эффект суще-
После этого происходил скачок люминесценции
ственной стимуляции трансляции репортерной
и реакция снова продолжала идти в линейном ре-
мРНК в бесклеточной эукариотической системе
жиме в течение 13 мин с большей максимальной
WGE при добавлении 16S РНК E. coli. Определен
скоростью (59 усл. ед.). В то же время кинетиче-
класс нетранслируемой РНК (тРНК), не оказы-
БИОФИЗИКА том 67
№ 5
2022
866
ЗЫРИНА, АГАЛАРОВ
вающий стимулирующего эффекта. В данной ра-
БЛАГОДАРНОСТИ
боте удалось определить ряд факторов, влияющих
Авторы благодарят зав. лабораторией механиз-
на эффект стимуляции трансляции репортерных
мов биосинтеза белка Института белка РАН
мРНК в системе WGE: количество добавляемой
В.А. Колба за поддержку, постоянный интерес к
16S РНК, концентрация и тип 5′-НТО репортер-
работе и обсуждение результатов, а также со-
ной мРНК, а также момент внесения 16S рРНК в
трудников лаборатории: К.С. Василенко - за
работающую систему WGE. Максимальный сти-
предоставление плазмиды pTZ10OmegaLuc,
мулирующий эффект оказывало добавление 16S
А.А. Коммера и И.Г. Дашкову - за предоставле-
РНК при трансляции малых концентраций ре-
ние 30S и 50S субчастиц рибосом E. coli, экстракта
портерных мРНК вне зависимости от природы
S-100 E. coli и мРНК люциферазы 5′UTRSD-Luc-
5′-НТО. Резкий подъем люминесценции, наблю-
3′UTRN64.
даемый через промежуток времени, соответству-
ющий времени пробега, позволяет утверждать о
КОНФЛИКТ ИНТЕРЕСОВ
влиянии добавленной 16S РНК на стадию иници-
ации трансляции. Интересно, что среди проте-
Авторы заявляют об отсутствии конфликта
стированных нами бесклеточных систем трансля-
интересов.
ции, эффект стимуляции трансляции репортер-
ных мРНК наблюдался только в системе WGE.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ НОРМ
В системе из зародышей пшеницы эффекты
Данная работа не содержит описания каких-
ускорения синтеза белка были показаны и ранее
либо исследований с участием людей или живот-
[9, 14]. Однако в работе [9] авторами подробно
ных в качестве объектов.
был изучен эффект «разгона белкового синтеза»,
происходящий только при высоких концентра-
СПИСОК ЛИТЕРАТУРЫ
циях некэпированной мРНК, транслирующейся
1.
N. E. Gregorio, M. Z. Levine, and J. P. Oza, Methods
в системе. В работе [14] было описано явление
Protoc., 2 (1), 24 (2019).
взаимной стимуляции трансляции «в одной про-
2.
Y. Endo, Proc. Jpn. Acad. Ser. B. Phys. Biol. Sci., 97
бирке» двух разных транслируемых матриц. В от-
(5), 261 (2021).
личие от этой работы, в рамках нашего исследо-
3.
M. L. Fogeron, L. Lecoq, L. Cole, et al., Front. Mol.
вания показано, что рибосомная РНК, которая
Biosci., 8, 639587 (2021).
считается нетранслируемой, значительно стиму-
4.
V. A. Kolb, E. V. Makeyev, and A. S. Spirin, EMBO J.,
лирует трансляцию мРНК с 5′-НТО различной
13 (15), 3631 (1994).
природы. Иными словами, обнаружено явное
5.
J. W. Hastings, and C. H. Johnson, in Methods in Enzy-
влияние нетранслируемой РНК на трансляцию
mology, Ed. by G. Marriott and I. Parker (Acad. Press,
репортерной мРНК. Ранее небольшой эффект
2003), V. 360, pp. 75-104.
добавления нетранслируемой РНК (некэпиро-
6.
S. M. Marques and J. C. Esteves da Silva, IUBMB Life,
ванная РНК с глобиновым лидером) был показан
61 (1), 6 (2009).
в работе [15].
7.
K. V. Wood, Promega Notes, 28 (1990).
Обнаруженные факты позволяют предпола-
8.
K. V. Wood, Y. A. Lam, and W. D. McElroy, J. Biolu-
гать, что в основе возможного механизма эффек-
min. Chemilumin., 4 (1), 289 (1989).
та стимуляции синтеза люциферазы при добавле-
9.
O. M. Alekhina, K. S. Vassilenko, and A. S. Spirin, Nu-
нии 16S РНК может лежать следующее. Предпо-
cleic Acids Res. 35 (19), 6547 (2007).
ложительно, в экстракте зародышей пшеницы
10.
D. N. Lyabin, I. A. Eliseeva, L. P. Ovchinnikov, PLoS
содержатся неспецифичные РНК-связывающие
One, 7 (12), e52527 (2012).
белки, ингибирующие трансляцию. Находясь в
11.
I. V. Prokhorova, K. A. Akulich, D. S Makeeva, et al.,
системе, 16S РНК как бы «вытитровывает» эти
Sci. Rep., 6, 27720 (2016).
белки и тем самым снимает ингибирование и сти-
12.
V. A. Shirokov, A. Kommer, V. A. Kolb, et al., in Meth-
мулирует трансляцию [14]. Для выяснения моле-
ods Mol. Biol., Ed. by G. Grandi (Humana Press Inc.,
кулярного механизма эффекта стимуляции
Totowa, New Jersey, 2007), V. 375, pp. 19-55.
трансляции репортерных мРНК в бесклеточной
13.
L.M. Gold and M. Schweiger, in Methods in Enzymolo-
системе WGE в присутствии 16S РНК необходи-
gy, Ed. by K. Moldave and L. Grossman (Acad. Press,
мы дальнейшие исследования. Понимание этого
1971) 20, pp. 537-542.
механизма позволит оптимизировать бесклеточ-
14.
Е. А. Согорин и С. Ч. Агаларов, Молекуляр.
ную систему WGE для применения в методах с
биология, 52 (1), 19 (2018).
использованием репортерных мРНК, а также ре-
15.
E. A. Sogorin, S. C. Agalarov, and A. S. Spirin, Sci.
шения различных научно-прикладных задач.
Rep., 6, 24518 (2016).
БИОФИЗИКА том 67
№ 5
2022
16S рРНК E. coli ЗНАЧИТЕЛЬНО СТИМУЛИРУЕТ ТРАНСЛЯЦИЮ
867
16S rRNA Significantly Stimulates Translation of a Reporter mRNA
in a Eucaryotic Cell-Free System
N.V. Zyrina*, ** and S.Ch. Agalarov*
* Institute of Protein Research, Russian Academy of Sciences, Institutskaya ul. 4, Pushchino, Moscow Region, 142290 Russia
**Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Puschino, Moscow Region, 142290 Russia
Real-time monitoring of bioluminescence in a cell-free system originated from wheat germ extracts (WGE)
revealed significant stimulation of reporter mRNA translation after addition of 16S rRNA Escherichia coli.
The effect observed was specific to WGE cell-free system and did not depend on the 5′-UTR of the reporter
mRNA. A class of untranslated RNA (tRNA) that does not have a stimulating effect has been identified. The
magnitude of an effect of translation stimulation of reporter mRNAs in the WGE system depended on the
concentration and the type of 5'-UTR of a reporter mRNA and on a particular moment in time when 16S
RNA was added to the system during translation. Further research of translation stimulation is required to op-
timize the use of the WGE cell-free system for reporter gene technology and find solutions to different ap-
plied research challenges.
Keywords: bioluminescence, translation, WGE cell-free system
БИОФИЗИКА том 67
№ 5
2022