БИОФИЗИКА, 2022, том 67, № 5, с. 877-896
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ДИНАМИКА ПРОЦЕССОВ В ТИЛАКОИДНЫХ МЕМБРАНАХ
ВОДОРОСЛЕЙ in vivo, ИЗУЧАЕМАЯ В МОДЕЛЯХ ФОТОСИСТЕМЫ II
И ТИЛАКОИДА ПО ИЗМЕРЕНИЯМ ИНДУКЦИИ ФЛУОРЕСЦЕНЦИИ
© 2022 г. Н.Е. Беляева*, #, А.А. Булычев*, В.З. Пащенко*, К.Е. Клементьев**,
П.А. Ермаченко***, И.В. Конюхов*, Г.Ю. Ризниченко*, А.Б. Рубин*
*Биологический факультет Московского государственного университета имени М.В. Ломоносова,
Ленинские горы, 1/12, Москва, 119234, Россия
#E-mail: natalmurav@yandex.ru
**Биологический факультет Университета МГУ-ППИ в Шэньчжэне, Шэньчжэнь, 518172, Китай
***ООО «Новые трубные технологии», ул. Щепкина, 51/4, стр. 1, Москва, 129110, Россия
Поступила в редакцию 22.04.2022 г.
После доработки 22.04.2022 г.
Принята к публикации 11.05.2022 г.
На клетках микроводоросли Scenedesmus obliquus (Scenedesmus) детектировали OJIPSMT-паттерн
сигнала индукции флуоресценции хлорофилла a при плотности потока квантов 1200 и 1800 мкмоль
фотонов·м-2·с-1. на временах от микросекунд до 10 мин после темновой адаптации. Количествен-
ное описание быстрых и, частично, медленных OJIPS(M)T-стадий индукции флуоресценции до
100 с обеспечено фитированием модели тилакоидной мембраны при достижении в расчетах адек-
ватной динамики редокс превращений катион-радикала Р700+. Величины параметров процессов
тилакоидной мембраны найдены в решениях совместно с расчетом траекторий переменных модели
тилакоидной мембраны. Динамические стадии восстановления/окисления реакционных центров
фотосистемы II, пула хинонов PQ/PQH2, комплекса Cyt bf и P700 реакционных центров фотосисте-
мы I сопутствуют адаптации системы тилакоидной мембраны к свету. Анализ in silico показал роль
комплекса Cyt bf в регуляции потоков электронов, когда гемы bL/H в интервале 100 мс < t < 3 с более
восстановлены при высокой освещенности, чем при умеренной. Впервые выявлена зависимость
констант скоростей k42-49 рекомбинации разделенных зарядов Phe-P680+ и QA-P680+ от уровня вос-
становленности QB(2)- вместе с зависимостью k42-49 от освещенности хлоропластов. Задание дина-
мических констант скоростей kFNR(t) и kD-qE(t) позволило сопоставить генерацию ΔpHo-i(t) =
= pHS(t) - pHL(t), инициацию qE-тушения при pHL|trigg = 6.7, активацию на свету FNR-редуктазы и
достижение стационарных уровней потоков зарядов до одной-двух минут световой индукции. Фи-
тирование модели изолированной фотосистемы II по сигналам индукции флуоресценции фито-
планктона выявило близость величин параметров переноса электронов в реакционных центрах фото-
системы II у монокультур Scenedesmus, Chlorella и проб фитопланктона за исключением параметров-
маркеров состояния фитоценоза: при деградации водоема в сравнении с экологически полноцен-
ным. Отличия маркеров состоят в уменьшении размеров антенн, усилении в них диссипации энер-
гии, снижении рН люмена.
Ключевые слова: фотосистемы II и I, индукция флуоресценции хлорофилла a, модельные расчеты,
транспорт электронов и протонов, нефотохимическое тушение.
DOI: 10.31857/S0006302922050052, EDN: JIEDQF
рий [3], в том числе и с применением модельных
Детальное изучение процессов оксигенного
фотосинтеза в тилакоидных мембранах прово-
исследований [1-7]. Результаты анализа фото-
дится на клетках водорослей [1, 2] и цианобакте-
синтетического аппарата микроводорослей в ла-
бораторных условиях могут применяться в иссле-
Сокращения: ТМ - тилакоидные мембраны, ФСI - фотосистема I, ФСII - фотосистема II, Cyt bf - цитохромный b6f-
комплекс, ФЛ - флуоресценция, РЦ - реакционный центр, QA и QB - первичный и вторичный хинонные акцепторы
фотосистемы II, PQ - пластохинон, PQH2 - пластохинол, Phe - феофитин, КВК - кислородовыделяющий комплекс, Chl,
Хл а - хлорофиллы антенны и РЦ, ЭТЦ - электронно-транспортная цепь, P680 - хлорофилл реакционного центра
фотосистемы II, ИФ - индукция флуоресценции, F0 и Fm - минимальный и максимальный выход флуоресценции, ЛПЭ -
линейный перенос электронов, ЦПЭ - циклический перенос электронов, PFD - плотность потока квантов света.
877
878
БЕЛЯЕВА и др.
дованиях природных сообществ фитопланктон-
ветствовали измерениям ИФ [7, 14] в диапазоне
ных организмов (фитоценозов) [8]. Вместе с тем
времени до t < 1-2 с.
для изучения природы устойчивости сложных
Известные в литературе данные, по O-J-I-P-
биологических систем [9] важны результаты ана-
стадиям нарастания флуоресценции в условиях
лиза динамики трансформации энергии квантов
высокой интенсивности света, послужили осно-
света в тилакоидных мембранах.
вой для формирования JIP-теста [7, 21-23]. Ам-
плитуды отдельных O-J-I-P-стадий нарастания
Перенос фотосинтезирующего образца из тем-
ИФ связаны с потоками энергии в комплексах
ноты на свет индуцирует в системе тилакоидных
ФСII при трансформации экситонного возбуж-
мембран (ТМ) процессы, переходящие в стацио-
дения антенн в поток электронов с образованием
нарное состояние в течение десятков микросе-
молекул PQH2. С помощью JIP-теста выявляются
кунд-сотен секунд [5, 6, 10]. В исследованиях фо-
тосинтезирующих образцов проводятся измере-
более подробные характеристики образцов по
ния кинетики индукции флуоресценции
сравнению с методом измерения параметров -
хлорофилла в пигмент-белковых комплексах ти-
минимальной (F0), максимальной (Fm) интенсив-
лакоидных мембран. Сведения, полученные в
ностей сигналов быстрой ИФ. Результаты JIP-те-
эксперименте и в компьютерном моделировании
ста можно также связать с размерами светособи-
(in silico), касаются аспектов регуляции процессов
рающих антенн и количеством открытых РЦ
системы ТМ [5-7]. Совокупность процессов пе-
ФСII.
реноса электронов в переходах «темнота - свет»
В то же время кинетические модели, основан-
обладает свойством саморегуляции [9], приводя-
ные на дифференциальных уравнениях [1-4, 15-
щей к согласованному во времени перераспреде-
20, 24-37], дают выражения для скоростей про-
лению зарядов в редокс-кофакторах фотосистем I
цессов транспорта электронов.
и II (ФСI и ФСII) и цитохромного b6f-комплекса
Разработанные нами кинетические модели
(Cyt bf).
ФСII и тилакоидной мембраны (модель тилакои-
Захват квантов света и трансформация энер-
да) основаны на следующих принципах.
гии электронного возбуждения в антенных систе-
1. Адекватность модели и исследуемого объек-
мах хлорофилла сопровождается тепловыми
та, обеспечивается фитированием результатов
(диссипативными) потерями энергии и излуче-
модельных вычислений [1-3, 20, 24, 25, 31-34] до
нием флуоресценции (ФЛ). Известно, что харак-
достижения их оптимального совпадения с дан-
терные сигналы флуоресценции [1-7, 10-14] обу-
ными по ИФ и редокс-превращениям кофактора
словлены состоянием реакционных центров (РЦ)
Р700 ФСI [38-40].
ФСII и ФСI, а также состоянием тилакоидных
2. Количественное описание энергизации
мембран. Использование математических моде-
мембраны основано на моделировании процес-
лей [1-4, 10-20] позволяет провести количе-
сов переноса электронов (e-) и протонов (H+) в
ственный анализ динамики процессов, ответ-
мембранах тилакоидов.
ственных за формирование сигналов флуорес-
ценции при разных режимах светового
В общей модели тилакоида [20, 24-30] выяв-
лялась взаимосвязь компонент трансмембранно-
возбуждения.
го электрохимического потенциала протонов
Так, в работах [11-13] по сигналам затухания
~
(Δμ
): концентраций протонов (pHL(t) - лю-
+
ФЛ после действия импульса света длительно-
H
стью в пико- или микросекунды с помощью «ма-
мена, pHS(t) - стромы) и величины электриче-
лых» моделей, включающих только быстрые ре-
ского потенциала ΔΨ(t). Количественный анализ
акции первичного преобразования энергии света
сигналов флуоресценции проводили в кинетиче-
в РЦ ФСII, были определены численные значе-
ских моделях фотосистемы II и тилакоида на по-
ния параметров процессов возбуждения антенн,
стоянном свету [3, 20, 24-30, 32] и при воздей-
разделения и рекомбинации зарядов в РЦ ФСII,
ствии световых импульсов [1, 2, 31, 33, 34]. Де-
стабилизации электрона на первичном хиноне
тальную модель тилакоидной мембраны
фитировали по сигналам ИФ и Р700 листа гороха
QA- и переноса электрона QA- ↔ QB(-) на вторич-
до t < 10-30 с [24, 25], определив параметры энер-
ный хинон. Объединение в одной модели процес-
сов переноса зарядов на донорной и акцепторной
гетического qE-тушения в антенне РЦ ФСII и ак-
тивации FNR на стромальной стороне ФСI.
сторонах ФСII привело к первым разработкам
кинетических моделей ФСII [16-18, 20], отража-
В разработанной нами модели тилакоидной
ющих восстановление подвижных молекул пула
мембраны цианобактерий [3] учитывалось влия-
хинонов/хинолов (PQ/PQH2) в стромальном QB-
ние qE-тушения и активации FNR, кроме того,
сайте ФСII. Результаты моделирования [17-20]
моделировались переходы состояний 2→1 и 1→2
быстрых O-J-I-P-стадий индукции флуоресцен-
(State Transitions qT2→1 и qT1→2), регулирующие
ции (ИФ) на постоянном свету качественно соот-
распределение энергии возбуждения между ФСII
БИОФИЗИКА том 67
№ 5
2022
ДИНАМИКА ПРОЦЕССОВ В ТИЛАКОИДНЫХ МЕМБРАНАХ
879
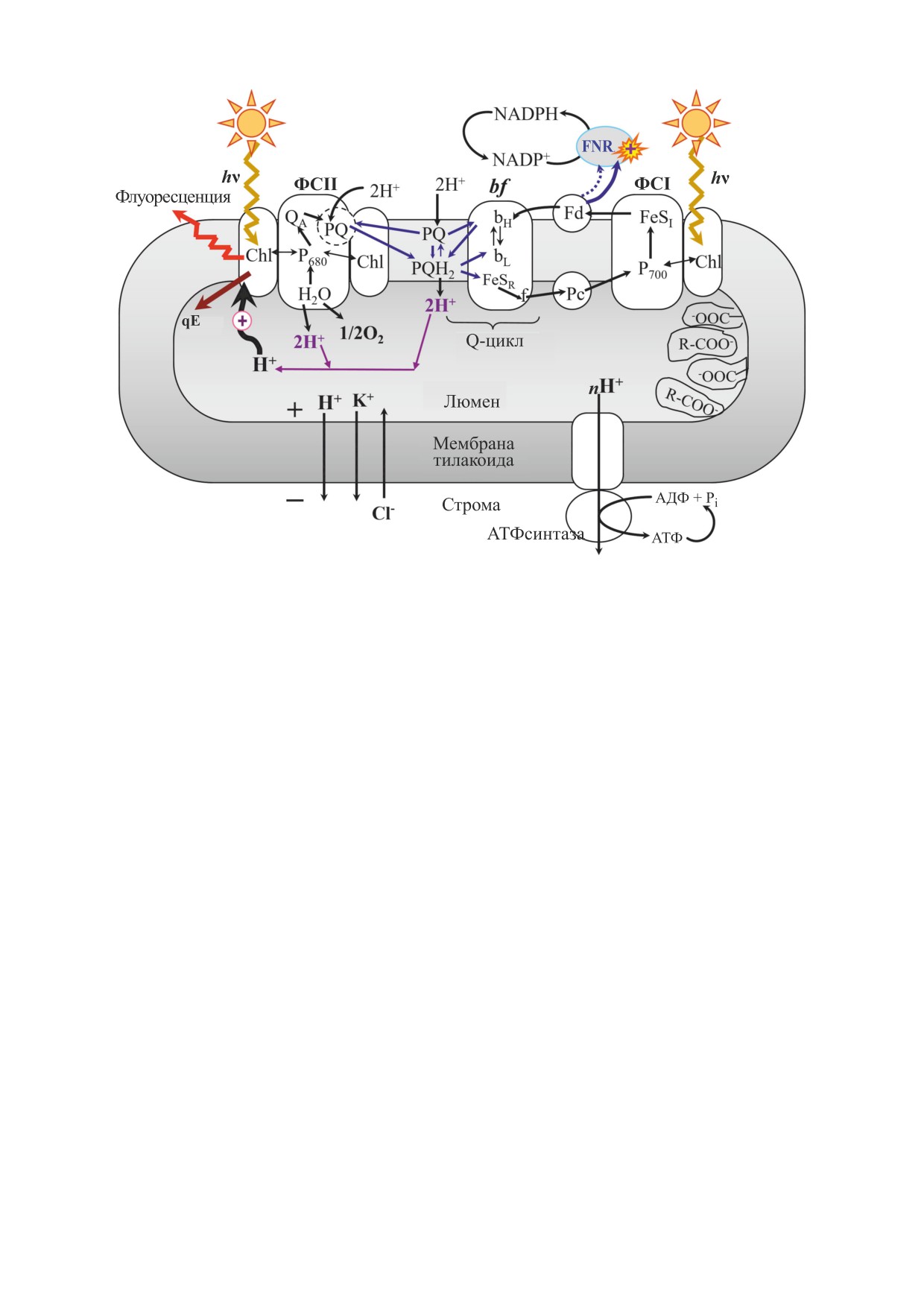
Рис. 1. Общая схема первичных процессов фотосинтеза: ФСI, ФСII - фотосистемы I и II, bf - цитохромный bf ком-
плекс, Chl - хлорофилл антенны, P680 и P700 - пигменты реакционных центров ФСII и ФСI, QA - первичный хинон-
ный акцептор электронов, bL и bH - низко- и высокопотенциальный гемы bf, FeSR -железосерный центр Риске, f -
цитохром f, FeSI - акцепторный комплекс ФCI, PQ - пластохинон; PQH2 - пластохинол; Fd - ферредоксин, Pc -
пластоцианин. FNR - Fd-NADP-редуктаза. R-COO- - буферные группы. Зигзагообразные стрелки обозначают кван-
ты света и флуоресценции. Тонкими стрелками показан перенос электронов по цепи электронного транспорта и
потоки ионов H+, K+ и Cl- через тилакоидную мембрану после включения освещения. Изогнутая стрелка со знаком
«+» - запуск qE-тушения при закислении люмена.
и ФСI [6, 35, 36, 41-45]. В результате модельные
hardtii OJIPSMT-кинетику ИФ детектировали
траектории [3] воспроизводили опытные кривые
[43] в интервале времени до 5 мин, причем фаза
ИФ, детектируемые до 5 мин на клетках Synecho-
SM-возрастания флуоресценции до вторичного
cystis sp. PCC6803.
максимума «M» объяснялась переходом qT2→1 на
временах 2-5 мин [43].
Для изучения состояния фотосинтетического
аппарата с учетом процессов фиксации CO2 необ-
В работе Стирбета и Говинджи (2016) [36] для
ходим переход от измерений ИФ в интервале t <
анализа данных по измерениям ИФ Chlamydomo-
1-2 с к детекции сигналов ИФ до минут [22, 36].
nas [43] была применена модель из работы [35]. В
Известны модельные исследования измерений
этой модели при описании процессов тилакоид-
ИФ на интервале 5-10 мин [36, 37].
ных мембран в стационарном состоянии учиты-
При освещении образца в течение 5-10 мин
вали переходы состояний фотосинтетического
выявляются отличия OJIP-SMT-паттернов ИФ
аппарата и восстановления стромальных пулов
[41] клеток цианобактерий в сравнении с паттер-
Fd и NADPH, причем редуцированное описание
нами хлоропластов водорослей и листьев. Для
процессов ФСII содержало четыре редокс-состо-
хлоропластов характерен OJIPSMT-паттерн ИФ,
яния РЦ ФСII. Оказалось, что полученные в ра-
когда наблюдаются стадии быстрого OJIP- на-
боте
[36] модельные кривые воспроизводили
растания (t < 1 с) и медленного PSMT-спада с пе-
OJIPSMT-паттерн ИФ только качественно. Оче-
реходом через промежуточное SM-нарастание
видно, в анализе OJIPSMT-паттерна ИФ необхо-
(или плечо) перед достижением стационарного
димо применить модель процессов тилакоидной
состояния на временах от десятков секунд до ми-
мембраны с детальным, а не редуцированным
нут. На клетках водоросли Chlamydomonas rein-
описанием процессов ФСII.
БИОФИЗИКА том 67
№ 5
2022
880
БЕЛЯЕВА и др.
В настоящей работе мы поставили задачу ис-
биореактора отбирали через 3, 26 и 48 ч от начала
следования динамики индукционных процессов
культивирования, затем измеряли индукционные
в фотосинтезирующей мембране тилакоида
кривые флуоресценции клеток Chlorella. Интен-
(рис. 1) в интервале времени от десятков микро-
сивность освещения при записи индукционной
секунд до минут на основе модели [25].
кривой составила 400 Вт/м2 или 2000 мкмоль фо-
Нашей целью было моделирование OJIPSMT-
тонов·м-2·с-1 (синий светодиод, 470 нм) [47].
паттернов ИФ клеток Scenedesmus obliquus (далее
Протокол измерений флуоресценции для фито-
Scenedesmus), полученных в данной работе при
ценоза природного водоема. В бассейне р. Темер-
плотности потока квантов 1200 и 1800 мкмоль фо-
ник (Ростов-на-Дону) модельный водоем, сред-
тонов·м-2·с-1 (свет умеренной и высокой интен-
ний в каскаде трех проточных прудов, в течение
сивности) в интервале времени до 10 мин. Фити-
10 лет ежегодно осенью осушался, а весной пере-
рование модели ТМ (рис. 1-4) по измерениям
водился в режим заливного луга в процессе лето-
ИФ Scenedesmus проводили на временах до 100 с,
вания, что способствовало активным процессам
не учитывая роль State transition в кинетике ИФ,
самоочищения и оздоровлению популяции гид-
но с учетом qE-тушения и активации FNR-редук-
робионтов. Исследование фитоценозов каскада
тазы. Задачу нахождения параметров модели ТМ
верхнего, среднего и нижнего прудов (№№ 1, 2, 3)
решали путем фитирования по наборам данных
проведено путем анализа индукции флуоресцен-
ИФ, детектируемой в различных условиях экспе-
ции, измеренной на пробах фитопланктона пру-
римента - две интенсивности освещения Scened-
дов: № 1 - в состоянии биологической деграда-
esmus или две стадии роста культуры Chlorella в
ции, № 2 -после «летования» с высокой биопро-
фотобиореакторе.
дуктивностью (контроль) и № 3 -пруд с цветущей
Модель изолированной фотосистемы II при-
водой.
меняли при обработке измерений ИФ проб фито-
Пробы отбирали 30.05.2017 г. утром в 10.30-
планктона, позволяя получить параметры реак-
11.00 у дамб водохранилищ с глубины 0.3 м от по-
ций РЦ ФСII в качестве характеристик-маркеров
верхности. В течение двух часов пробы транспор-
фитоценозов природных водоемов.
тировали в темной однолитровой таре до лабора-
тории. Для каждой пробы центрифугировали
6 пробирок по 90 г при 4000 об/мин в течение
МЕТОДЫ ЭКСПЕРИМЕНТА
5 мин. Сконцентрированный осадок в объеме 10
И МАТЕМАТИЧЕСКОГО МОДЕЛИРОВАНИЯ
мл отбирали для измерений флуоресценции.
Условия выращивания клеток водорослей для
Пробу ставили на яркий свет, а перед измерения-
измерений флуоресценции. Клетки микроводорос-
ми флуоресценции - на 5 мин в темноту. С помо-
ли Scenedesmus obliquus (далее Scenedesmus) куль-
щью портативного флуорометра на интервале до
тивировали в среде BG11 при значении pH приго-
1 с измеряли ход кривых ИФ, вызываемых светом
товленной среды, равном 7.4 [46]. Культивирова-
4500 мкмоль фотонов·м-2·с-1.
ние происходило на качалке в люминостате при
Структура модели тилакоидной мембраны.
температуре 21°С в режиме освещения при интен-
Структурная схема тилакоидной мембраны хло-
сивности света 70 мкмоль квантов/(м2с) (мкмоль
ропласта иллюстрирует на рис. 1 построение
фотонов·м-2·с-1). Достижение стационарной фа-
обобщенной модели тилакоида [3, 23-25, 30].
зы контролировали спектрофотометрически по
Комплексы антенн, ФСII, ФСI, Cyt bf встроены в
содержанию хлорофилла. Индукционные кривые
мембраны и связаны потоками в люмене, мем-
флуоресценции хлорофилла клеток Scenedesmus
бране, строме, образуя подсистемы общей струк-
регистрировали на импульсном портативном
туры ТМ. Примеры изучения отдельных подси-
флуориметре модели PSI 3000S (Photon System In-
стем известны и получены при описании частич-
struments, Чехия), λmax = 630 нм. Быструю флуо-
но замкнутого набора процессов ФСII [1, 2, 30-
ресценцию детектировали для двух интенсивно-
34], ФСI [48], Cyt bf [49].
стей актиничного света - 1200 и 1800 мкмоль фо-
Модель каталитического цикла фотосистемы II.
тонов·м-2·с-1, равных 40 и 60% от максимальной
Модель ФСII объединяет 30 компонент пигмент-
плотности фотонного потока (3000 мкмоль фото-
белкового мембранного комплекса ФСII (рис. 3,
4). Захват фотона в антенне и перенос экситона в
нов·м-2·с-1). Измерения проводили после адап-
тации клеток Scenedesmus к темноте в течение 10
фотоактивный кластер P680 ведут к восстановле-
мин при длительности освещения 600 с.
нию феофитина (Phe) вместе с генерацией кати-
Культивирование в фотобиореакторе клеток
он-радикала P680+•. Высоко-положительный ре-
микроводоросли Chlorella vulgaris (далее Chlorella)
докс-потенциал P680+• обеспечивает на входе си-
проводили в режиме постоянного освещения.
стемы РЦ ФСII срабатывание S0,1,2,3(4)-циклов
Интенсивность освещения в культиваторе со-
кислородовыделяющего комплекса (КВК) с по-
ставляла 40 Вт/м2 (белые светодиоды). Пробы из
дачей четырех электронов от молекулы воды на
БИОФИЗИКА том 67
№ 5
2022
ДИНАМИКА ПРОЦЕССОВ В ТИЛАКОИДНЫХ МЕМБРАНАХ
881
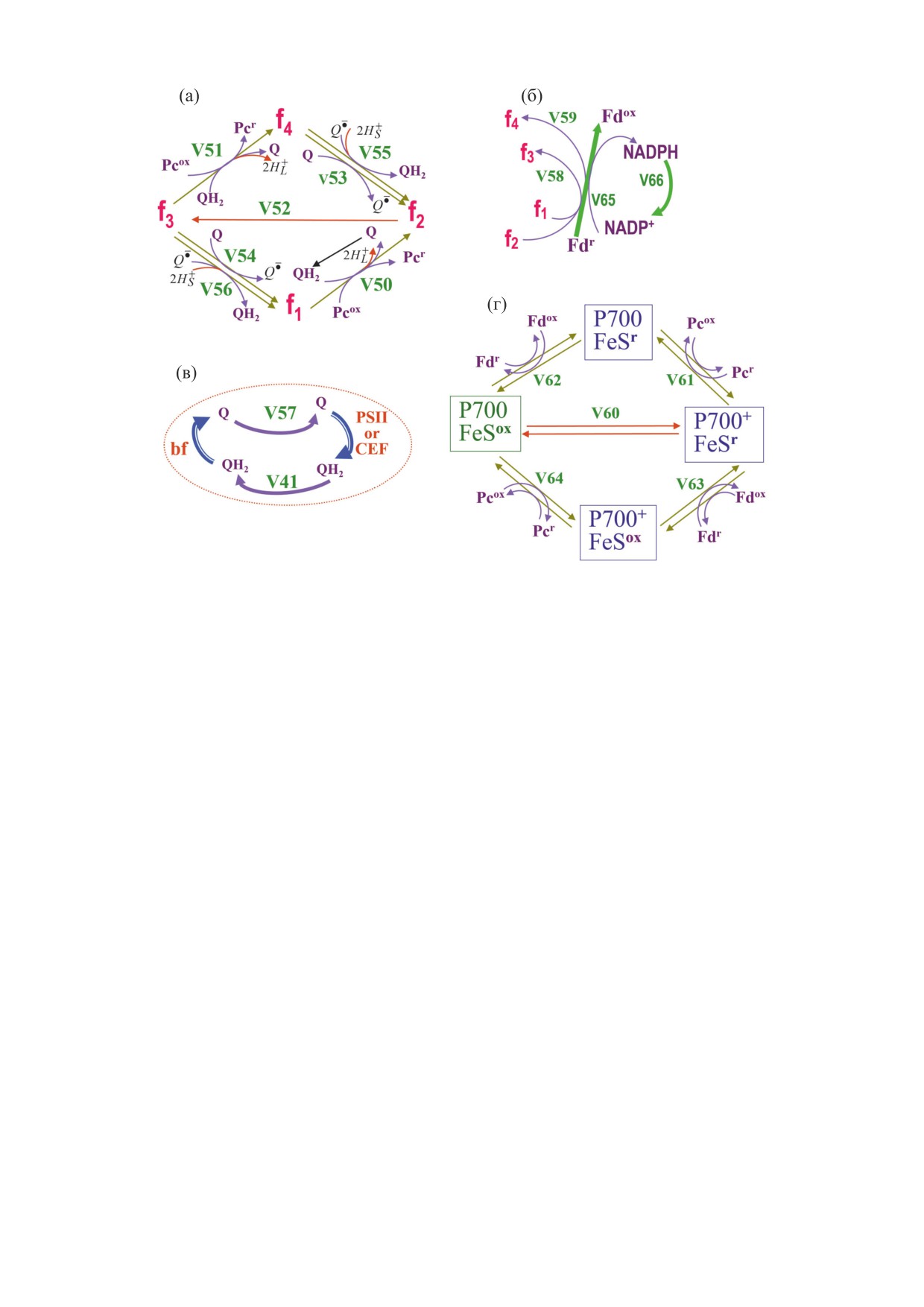
Рис. 2. Обобщенная схема потоков в подсистемах модели тилакоидной мембраны (модель тилакоида). (а) - Реакции
цитохромного комплекса b6f. (б) - Компоненты цепи переноса электронов взаимосвязаны ветвями линейного и
циклического потоков электронов (ЛПЭ и ЦПЭ). Стрелки: «V66» - реакция потребления NADPH в строме, «V65» -
динамическая константа скорости kFNR(t) активации Fd-NADP-редуктазы (FNR), уравнение (9). (в) - Сопряжение
электронного и протонного транспорта (ЭТ/ПТ) в люменальных и стромальных сайтах, включая реакции комплекса
фотосистемы II. (г) - Реакции фотосистемы I.
блока модели ФСII превращение PQH2 →PQ зада-
восстановление P680+• при одновременной гене-
рации молекулярного кислорода. Для упрощения
но [1, 2, 30-34] оттоковой реакцией (41). В соста-
предполагали, что притоку одного электрона на
ве полной модели тилакоида процессы подсисте-
мы ФСII вовлечены в общую структуру потоков
окисленный P680+• через тирозин YZ [34] сопут-
зарядов, где реакции (41) и (57) относятся к диф-
ствует освобождение одного протона в люмен ти-
фузионным потокам PQH2 и PQ.
лакоида. Отток электронов от донорной стороны
РЦ ФСII на акцепторную:
Модель цитохромного комплекса b6f. В системе
ТМ комплекс Cyt bf влияет на редокс-состояние
1(Chl-P680)* ↔ P680+•Phe-QA (КВК → YZ) →
пула PQH2 /PQ, обеспечивая приток электронов
(2)-
→ P680PheQA-QB ↔ QAQB
от ФСII в линейном и от ферредоксина в цикли-
ческом потоках в двух центрах - люменальный
обусловлен разностью редокс-потенциалов ком-
QО-сайт (хинолоксидаза) и ориентированный в
понент ФСII и сопровождается накоплением со-
строму Qi-сайт (хинонредуктаза). Согласно схеме
стояний закрытых РЦ с QA-. Дважды восстанов-
Q-цикла [6] двухэлектронное окисление PQH2|О
ленный и протонированный из стромы пластохи-
в люменальном QО-центре протекает по двум пу-
нол пополняет мембранный пул PQ/PQH2.
тям - высоко- и низкопотенциального переноса
Окисление молекул PQH2 в электронно-транс-
электронов. Отчуждение одного электрона на же-
портной цепи (ЭТЦ) за ФСII ведет к посадке пла-
лезо-серный центр Риске (FeSR) ведет к восста-
стохинона PQ в стромальный QB-сайт, завершая
новлению цитохрома f и пластоцианина (PC).
каталитический цикл H2O-пластохинон оксидо-
Второй электрон от пластосемихинона PQH|О
редуктазы ФСII (рис. 3, 4). В случае отдельного
поступает во внутреннюю цепь восстановления
БИОФИЗИКА том 67
№ 5
2022
882
БЕЛЯЕВА и др.
bL и bH, низко- и высокопотенциальных b6-гемов
и обеспечивает приток электронов на фракцию
и притока затем электронов на PQ|i молекулу в
P+700 катион-радикала РЦ ФСI. Свет индуцирует
Qi -центре: PQH|О → b6L → b6H → PQ|i.
быстрое (10-12-10-9 с) разделение зарядов на ко-
факторах A0 - A1 - FX РЦ ФСI. Поэтому модель
Редукция модели Cyt bf [49] с учетом иерархии
времен реакций Q-цикла включила четыре ре-
ФСI (рис. 2г) объединяет кластеры FX, FA, FB как
акцептор «FeS». Согласно стадии 60, свет генери-
докс-компоненты bLbH, bL•bH, bLbH•, bL•bH•, обо-
значенные f1, f2, f3, f4 на рис. 2а в виде паттерна
рует редокс-состояния P700+FeSr. Вслед за этим
реакций Cyt bf в общей модели ТМ [3, 20, 24, 25,
происходят обратимые реакции донирования
30]. На свету поток электронов в Q-цикл (шаг 41,
электрона на P+700 от PCr или ухода электрона от
рис. 2в) обеспечивает через протолитические ре-
кластера FeSr ФСI на ферредоксин (стадии 61, 64,
акции f1 → f2 и f3 → f4 (шаги 50, 51, рис. 2а) восста-
62, 63, рис. 2г).
новление PC и, одновременно, bL а, затем транс-
мембранно bH гема (f2 → f3, шаг 52). Переходы
Пул молекул Fdr(ox) участвует в потоках линей-
f4 → f2, f3 → f1 ведут к продукции семихинона/пла-
ного (ЛПЭ) и циклического (ЦПЭ) переноса
стохинона (53, 54, 55, 56, рис. 2а) в Qi-центре с по-
электронов (рис.
2б и схема
(1)). Стрелка
треблением двух протонов из стромы. Стрелки 58
Fdr → Fdox указывает на окисление Fdr в несколь-
и 59 на рис. 2б указывают путь донирования элек-
ких сопряженных процессах. Ветви 58 и 59 ЦПЭ
тронов [6, 49] в стромальный хинон-связываю-
связывают паттерны реакций ФСI и Cyt bf. Стрел-
щий Qi-центр за счет вклада ЦПЭ согласно меха-
ка 65 относится к FNR реакции терминального
низму ФСI → Fd → bH → PQ|i (рис. 1).
восстановления NADP+ до редокс-эквивалента
Модель фотосистемы I и взаимосвязь потоков в
NADPH потоком ЛПЭ, в то время, как шаг 66
тилакоидной мембране. Перенос электрона от
(рис. 2б) связан с потреблением NADPH → NADP+
PQH2 через Cyt bf восстанавливает пластоцианин
(см. рис. 1 и формулу (2)).
-
+
e
LEF: H
2
O
→
ФСII
→
PQH
2
→
Q
o
/b
6
f
→
Pc
→
ФСI
→
Fd
⎯⎯⎯→FNR
→
NADP
/NADPH
(1)
-
e
(CEF)
↑ ←⎯⎯⎯
6
b f/Q
i
← ↓
Схема (1) выявляет последовательные собы-
стемы ТМ и стромальных циклов потребления
тия, вызываемые освещением тилакоидных мем-
энергии, запасенной в световых реакциях.
бран в подсистемах ФСII, ФСI, Cyt bf, связанных
Динамические параметры описания скоростей в
процессами переноса электронов и протонов че-
модели тилакоида. Принципы построения модели
рез пулы подвижных переносчиков от входа до
ТМ и системы обыкновенных дифференциаль-
выхода системы ТМ.
ных уравнений подробно представлены в работах
Рис. 1 показывает потоки зарядов (электроны,
[3, 20, 24, 25]. Запись дифференциальных уравне-
ний в балансовой форме:
протоны (H+), противоионы) в компартментах
ТМ. Стадии ЛПЭ и ЦПЭ сопряжены с освобож-
dX
i
= v
production
i
(X t))
-
v
consumption
i
(X t))
дением H+ в люмен (КВК ФСII, QО-центр Cyt bf)
dt
и захватом H+ из стромы (QB-сайт ФСII, Qi-
суммирует скорости производства vproduction(Xi(t))
центр Cyt bf). В результате образование градиента
и потребления vconsumption(Xi(t)) каждой i-й ком-
~
электрохимического потенциала H+ (Δμ
+
): на
поненты (Xi(t)) системы ТМ. Концентрации Xi(t) в
H
мембране тилакоида обеспечивает синтез АТФ.
мМ определяют размерности скоростей в мМ·с-1,
Процессы потребления метаболитов АТФ → АДФ
причем скорости задаются как нелинейные
функции от концентраций компонент в согласии
и NADPH → NADP+ (рис. 1) для упрощения опре-
с механизмами процессов, обсужденных выше.
делены через скорости оттоковых реакций:
При описании процессов использованы кине-
VNADP = kNADP × NADPH/(KNADP + NADPH), (2)
тические параметры прямой kn и обратной k-n
VАТФ = kАТФ × АТФ/(KАТФ + АТФ),
(2a)
констант скоростей и константа равновесия Keq
редокс-реакций:
где kNADP, KNADP и kАТФ, KАТФ задают эффектив-
ные параметры переходов NADPH → NADP и
n
e
⋅
F
⋅ ΔE
m
k
n
= k
-n
⋅
K
n
;
K
eq
=
exp(
-
).
(3)
АТФ → AДФ для моделирования сопряжения си-
eq
RT
БИОФИЗИКА том 67
№ 5
2022
ДИНАМИКА ПРОЦЕССОВ В ТИЛАКОИДНЫХ МЕМБРАНАХ
883
Согласно рис. 3 распад синглетного возбуж-
денного состояния 1Chl* РЦ ФСII происходит
путем испускания флуоресценции (kF), которому
сопутствует тепловая диссипация (kD) в антенне.
Суммарная скорость распада 1Chl* задается кон-
стантой kA:
Рис. 3. Схема распада синглетного возбуждения 1Chl*
kA = kF + kD.
(5)
антенны фотосистемы II. Редокс-формы реакцион-
Потери возбуждения в антенне в процессах
Chl
ного центра фотосистемы II включают:
- пиг-
P680
флуоресценции в модели ФСII определяются со-
менты хлорофилла антенны и P680 в РЦ; Phe - фео-
стояниями с синглетным возбуждением 1Chl*,
и
фитин, первичный акцептор электронов ФС2; QA
т. е. модельными формами в колонках 2 и 6
- первичный и вторичный хинонные акцепторы.
QB
(рис. 4):
Даны две редокс-формы для реакций с номерами n =
= 1, 5, 8, 12, 15, 19, 28, 32 (см. рис. 4). Генерация воз-
F(t) = S·(x2(t) + g2(t) + y2(t) + z2(t) +
бужденного синглетного состояния 1Chl* задается
+ x6(t) + g6(t) +y6(t) + z6(t))·kF.
(6)
= 200 с-1
световой константой kL = kn, предполагая kL
Диссипация энергии в антенне задана кон-
для PFD 300 мкмоль фотонов·м-2·с-1 [25, 30]. Распад
стантой скорости kD(t) [35, 36] в виде зависящего
- кон-
1Chl* определен суммой k-n = kF + kD, где kF
от времени динамического параметра по анало-
(t) -
гии с [24, 25]:
станта скорости испускания флуоресценции, kD
динамическая константа скорости безизлучательной
kD(t) = kDconst + kDvar⋅q(t),
(7)
диссипации энергии в антенне ФСII, уравнение (8).
где компоненты диссипации энергии указывают
на величины: базовую kDconst, минимальную по-
Здесь ΔEm - разность эффективных среднето-
сле темновой адаптации, и kDvar, достигаемую в
чечных редокс-потенциалов носителей электро-
присутствии тушителей в антенне ФСII. Фактор
нов, а n - число электронов, перенесенных в ре-
0 < q(t) < 1 определяет возрастание тепловых по-
докс-реакции. Оценки Keq, взятые из литературы
терь путем распада 1Chl* вследствие запуска qE-
[11-13], уточнялись при анализе экспериментов
тушения при низком люменальном рН согласно
in vivo [1-3, 24, 25].
уравнению Хилла:
1. Электрический трансмембранный потенциал,
+ n
pH люмена и стромы. Регуляторное влияние элек-
[H t)]
L
k t)= k
+k
⋅
,
(8)
трической компоненты ΔΨ электрохимического
D
Dconst
Dvar
+
n
n
L
[H t)]
+K
Q
~
потенциала
Δµ
+
на перенос электронов обсуж-
H
где концентрация [HL(t)] вычисляется при моде-
далось в работах [2, 23-26, 29, 30] и учтено выра-
лировании, параметры n (коэффициент Хилла) и
жением:
KQ (константа Михаэлиса) вместе с kDconst и kDvar
F
находили фитированием модели ТМ по измере-
K
(ΔΨ)=
exp(
-
α
⋅ ΔΨ
⋅ (
))⋅
K
(4)
eq
RT
eq
ниям длительной ИФ без явного рассмотрения
Здесь Keq - константа равновесия в отсутствии
механизма qE-тушения.
мембранного потенциала (т. е. ΔΨ = 0). Фактор α
В модели ТМ реакция ЛПЭ Fdr → FNR∙→ NADP+
задает часть ΔΨ, продуцируемую отдельным ша-
определена константой скорости:
гом переноса электрического заряда по нормали
k65(t) = kFNR(t) =
к мембране [50, 51] и влияющую на перенос заря-
да в течение данного шага.
= kFNRmax⋅(1 - 0.99⋅exp(-t/τFNR)).
(9)
2. Антенные комплексы и световая активация
Здесь после темновой адаптации, в момент
FNR-редуктазы. Поток фотонов определяет «дав-
t = 0 базовый уровень kFNR(t) равен 0.01 от макси-
Chl
мальной величины kFNRmax, достигаемой с харак-
ление» экситонного возбуждения
P680
→
теристическим временем τFNR при усилении ак-
Chl
*
тивности FNR.
→
P680
в антенне, когда избыточное накопле-
ние закрытых РЦ затрудняет фотохимическое
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ
разделение зарядов. Защита системы от «давле-
И МОДЕЛИРОВАНИЯ
ния возбуждения» с дезактивацией возбужден-
ных состояний и тушением флуоресценции обес-
Монокультуры микроводорослей в лаборатор-
печена непосредственно в антенне ФСII.
ных условиях. Лабораторные культуры микрово-
БИОФИЗИКА том 67
№ 5
2022
884
БЕЛЯЕВА и др.
Рис. 4. Схема каталитического цикла фотосистемы II. Каждый прямоугольник - кинетическое состояние ФСII,
определяемое редокс-состоянием входящих в него переносчиков электрона. Штриховкой показаны состояния, способные
к испусканию квантов флуоресценции. Chl и Р680 - хлорофилл антенны ФСII и реакционного центра; Phe - первичный
акцептор электронов феофитин; QA и QB - первичный и вторичный хинонные акцепторы электронов. PQ - пластохинон;
PQH2 - пластохинол; HL+ - протоны, выделяемые в люмен тилакоида, HS+ - протоны, поглощаемые из стромы
тилакоида. Жирные стрелки - световые стадии. Цифры рядом со стрелками и буквы над прямоугольниками (xi, yi, zi, gi, i =
= 1, ... 7) соответствуют номерам реакций и обозначениям переменных модели.
дорослей исследовали, предполагая, что в усло-
ИФ в ответе клеток Scenedesmus на освещение де-
виях постоянной среды обитания характеристики
тектировали на интервале времени до 10 мин при
клеток на равных стадиях роста сохраняются по-
двух интенсивностях актиничного света - 1800 и
стоянными.
, соответствующих
1200 мкмоль фотонов·м-2·с-1
Фитирование модели тилакоидной мембраны
60% (точки ФЛ1) и 40% (точки ФЛ2) от макси-
по измерениям индукции флуоресценции.
мальной плотности потока квантов света (PFD),
1. Культура Scenedesmus obliquus. На рис. 5а
равной 3000 мкмоль фотонов·м-2·с-1. Шкала, на
приведены результаты измерений ИФ Scened-
которой показана интенсивность флуоресцен-
esmus obliquus (далее Scenedesmus) при культиви-
ровании микроводоросли в среде на стадии ста-
ции, выбрана таким образом, что начальный уро-
ционарного роста. Изменения интенсивности
вень ФЛ при значении плотности фотонного по-
БИОФИЗИКА том 67
№ 5
2022
ДИНАМИКА ПРОЦЕССОВ В ТИЛАКОИДНЫХ МЕМБРАНАХ
885
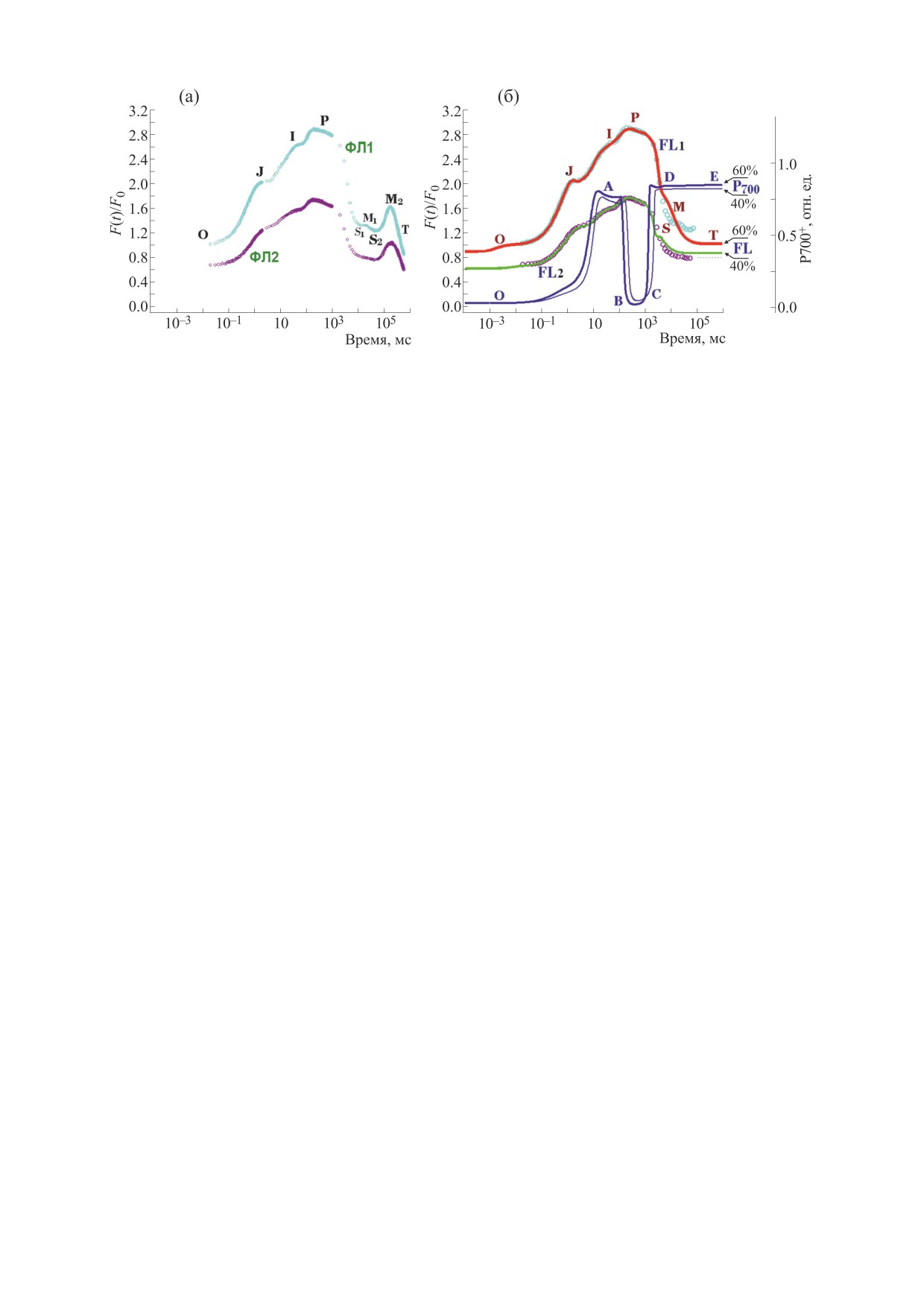
Рис. 5. Фитирование модели тилакоидной мембраны по измерениям на микроводоросли Scenedesmus obliquus (Scened-
esmus). (а) - Детекция сигналов индукции флуоресценции клеток Scenedesmus от 20 мкс до 10 мин (ФЛ1 и ФЛ2) при
интенсивности актиничного света 1800 и 1200 мкмоль фотонов·м-2·с-1, соответствующей 60% и 40% от максимальной
плотности потока квантов PFD 3000 мкмоль фотонов·м-2·с-1. Начальный уровень интенсивности флуоресценции
при PFD 1800 мкмоль фотонов·м-2·с-1 сопоставлен значению «1». (б) - Траектории индукции флуоресценции FL1 и
FL2 фитируют решения модели ТМ (рис. 1-4, табл. 1) по измерениям ИФ клеток Scenedesmus при освещении 60% и
40% (ФЛ1 и ФЛ2) в интервале времени от микросекунд до 100 с. Траектории Р700-60% и Р700-40% (соответственно
толстая и тонкая линии) - динамика окисления-восстановления Р700 редокс-кофактора ФСI.
Количественные результаты фитирования мо-
тока 1800 мкмоль фотонов·м-2·с-1 полагается
дели тилакоида определены в табл. 1. В ней при-
равным «1».
ведены значения параметров, которые соответ-
Данные измерений OJIPSMT кинетики ИФ
ствуют механизмам и факторам регуляции про-
(рис. 5а) показывают стадии нарастания ФЛ до пика
цессов, представленным на рис. 1.
P и последующего спада к стационарному T-уров-
2. Культура Chlorella vulgaris. Изменения флуо-
ню. Вместе с тем промежуточные стадии спада ФЛ
ресценции клеток Chlorella измеряли (рис. 6а) в
содержат локальные минимумы S1(2) и максимумы
интервале 2 с. На рис. 6а результаты измерений
M1(2). Кинетические OJIPS1M1S2M2T-фазы наблю-
ИФ Chlorella при действии света одинаковой ин-
даются для длительных измерений ИФ Scenedesmus
тенсивности (2000 мкмоль фотонов·м-2·с-1) при-
при потоках света 60 и 40% (ФЛ1, ФЛ2, высокий и
ведены точками ФЛ3час, ФЛ26час, ФЛ48час на
умеренный свет). Очевидно, что стадии M1S2M2T
стадиях роста 3, 26 и 48 ч соответственно. Резуль-
на временах 2-5 мин проявляются независимо от
таты фитирования «малой» модели ФСII (траек-
освещенности.
тории FL3, FL26 и FL48 на рис. 6б) по измерени-
ям ИФ на образцах проб культуры из биофоторе-
Расчеты в модели тилакоида проведены
актора отражают кинетику OJIPS-фаз и
(рис. 5б) на шкале времени от пикосекунд до ми-
нарастания и, частично, спада после максимума P
нут. Модельные траектории FL1 и FL2 соответ-
кривой ИФ. Модель [24, 25] процессов в тилако-
ствуют результатам фитирования по кривым ИФ,
иде полностью воспроизводит OJIPS-кинетику
измеренным (ФЛ1, ФЛ2, рис. 5а) при 1800 и
изменений ИФ Chlorella на временах до 2 с (F1 и
1200 мкмоль фотонов·м-2·с-1. Согласно расче-
FL2 на рис. 6в). при достижении максимума P
там, измерения ИФ клеток Scenedesmus на стади-
(Fm) и минимального начального уровня F0 ИФ.
ях OJIPS1(S2)T воспроизведены количественно
Вместе с тем показано моделирование (P700,
для фаз OJIP-нарастания от 10 мкс до 2 с и ча-
рис. 6в) динамики редокс-превращений катион-
стично - для PS1M1S2T-стадий спада в диапазоне
радикала Р700+ [25, 38, 39]. Расчетный ход кри-
времени до 100 с (рис. 5б).
вых флуоресценции на временах t > 10 сек теоре-
Влияние фактора State transition на кинетику
тически соответствует известным данным по ки-
ИФ не учтено в данной работе с целью упроще-
нетике PSMT-фаз ИФ [4, 37].
ния расчетов, а, также для выяснения парамет-
Анализ параметров модели тилакоида для про-
ров, наиболее существенных для воспроизведе-
цессов фотосинтеза микроводорослей. Значения
ния формы кривых ИФ на временах до 100 с без
параметров в табл. 1 получены при достижении в
учета стадий S2M2T на временах до 10 мин.
вычислениях адекватной динамики редокс-пре-
БИОФИЗИКА том 67
№ 5
2022
886
БЕЛЯЕВА и др.
Таблица 1. Параметры процессов тилакоидной мембраны (модель ТМ)
Переходы и номера реакций модели ТМ
kn, мс-1, KEQn
40%
60%
26 ч
48 ч
Фотосистема II
Aeff - Эффективное количество пигментов
Aeff = 140
112
108
антенного комплекса
1(Chl-P680)*Ph ↔ Chl-P680+Ph-(QA)
k2op = 320000000/ Aeff
k-2op = k2op /KEQ2
2.29×106/32 = 7.14×104
2.96×106/16 = 1.85×105
1(Chl-P680)*Ph ↔ Chl-P680+Ph-(QA-)
a = 8; k5cl = 2.86×105
a = 6.4; k5cl = 4.63×105
k5cl = k2op/a; KEQ5 = KEQ2/b
b = 4; KEQ5 = 32/4
b = 5; KEQ5 = 20/5
Первый электрон в QB-сайт, k7
3.2
KEQ7
20-16
12.5-10
Второй электрон в QB-сайт, k14
1.75
KEQ14
8-10
Выход PQH2 в фазу мембраны, k21
0.8
Диссипация 1Chl* в антенне kHD
(3+12)∙104
(3+38)∙104
(2+10) ·104
Закрытые РЦ, безизлучательная рекомбинация
1.3∙105
1.5∙105
2.0∙105
зарядов P680+Phe-, k42-45
5.0∙105
5.8∙105
2.2∙105
6.4∙105
6.8∙105
3.0∙105
Безизлучательная рекомбинация зарядов
1.5
1.8
2.2
P680+QA-, k46-49
1.8
2.0
2.8
3.0
3.2
3.8
Электронтранспортная цепь
Световая константа
0.56, 0.48
0.84, 0.48
0.64
0.62
Комплекс Cyt b6f, bL→ bH, V52
0.30
0.42-0.40
0.48
0.72
Циклический транспорт вокруг ФСI, V58, V59
0.008, 0.01
0.015, 0.001
Электрохимический потенциал
Стационарное состояние рН люмена
6.53
6.44
6.84
6.83
Стационарное состояние рН стромы
8.44
8.46
8.32
8.27
Примечание. Значения параметров получены при достижении в вычислениях адекватной динамики редокс-превращений
катион- радикала Р700+ [39, 40] вместе с фитированием модели ТМ по измерениям ИФ на клетках Scenedesmus и Chlorella
(рис. 5б и 6в); (QA) - открытые, (QA-) - закрытые реакционные центры.
параметра, одинаковая для вариантов расчетов,
вращений катион-радикала Р700+ [25, 38, 39]
помещается в одной ячейке.
вместе с фитированием модели тилакоидной
1. Реакции переноса электронов в фотосистеме II.
мембраны по измерениям ИФ на клетках Scened-
Из табл. 1 видно, что параметры переноса элек-
esmus и Chlorella (рис. 5б и 6в). Параметры пере-
тронов по редокс кофакторам реакционных цен-
носа зарядов, индуцированного светом высокой
тров ФСII близки по величинам или совпадают
и умеренной интенсивности в клетках Scened-
для микроводорослей Scenedesmus и Chlorella.
esmus, даны в столбцах «60%» и «40%». Столбцы
В вычислениях кинетическая константа ско-
«26 ч» и «48 ч» показывают результаты для культу-
рости восстановления Phe была принята равной
ры Chlorella на стадиях роста 26 и 48 ч. Величина
3.2⋅108 мс1 (табл. 1), но зависела [4, 5, 11] также от
БИОФИЗИКА том 67
№ 5
2022
ДИНАМИКА ПРОЦЕССОВ В ТИЛАКОИДНЫХ МЕМБРАНАХ
887
Рис. 6. Фитирование модели изолированной ФСII и модели тилакоидной мембраны по измерениям на клетках Chlo-
rella vulgaris при действии света 2000 мкмоль фотонов·м-2·с-1. (а) - Измерения индукции флуоресценции в интервале
времени от 5 мкс до 2 с на образцах Chlorella стадий роста 3, 26 и 48 ч (ФЛ-3, ФЛ-26 и ФЛ-48 соответственно). (б) -
Результаты фитирования «малой» модели ФСII расчетными кривыми ИФ FL3, FL26, FL48 по измерениям ИФ на
стадиях OJIPS-фаз. (в) - Модель ТМ [25] количественно воспроизводит в расчетах ИФ F1 и F2 (см. табл. 1, «26 ч» и
«48 ч») OJIPS-кинетику ИФ культуры Chlorella стадий роста 26 и 48 ч. Расчетный ход кривых флуоресценции на
временах t > 10 с и моделирование динамики редокс-превращений катион-радикала Р700+ соответствуют известным
данным [39, 40].
параметра эффективного количества пигментов
торых отличиях констант равновесия KEQ7,14,21.
антенны AEff = NAnt, который оказался различ-
Однако величины параметров, выявляемых для
ным для двух таксонов. Кинетика обратной реак-
Chlorella, необходимо в будущем проверить на ос-
нове измерений более длительных, чем 10 с.
ции возбуждения антенн 1(Chl-P680)* зависит от
констант равновесия KEQ2 и KEQ5, показанных в
2. Диссипативные реакции рекомбинации заря-
табл. 1 с учетом факторов a и b снижения эффек-
дов в фотосистеме II. Описание реакций ФСII
(рис. 3 и 4) учитывает тепловые потери при дис-
тивности разделения зарядов в закрытых (с QA-)
сипации возбужденных состояний антенн (kD)
по сравнению с открытыми (QA) РЦ.
либо при рекомбинации зарядов (k42÷49).
Согласно схеме модели ФСII (рис. 4), перенос
Четыре строки модели ФСII отличаются ти-
электронов от донорной на акцепторную сторону
пом редокс-компонент QB-сайта, когда возмож-
ФСII и восстановление пула хинонов определены
ны следующие состояния вторичного хинона:
через константы скоростей реакций k7,14 и k21.
нейтральный (QB), отсутствует (Πempty,), восста-
Количественное описание выявляет одинаковые
для двух таксонов Scenedesmus и Chlorella величи-
новленный (QB-), дважды восстановленный и
ны k7,14 = 3.2, 1.75 мс-1 и k21 = 0.8 мс-1 при неко-
протонированный (QBH-). При анализе ИФ
БИОФИЗИКА том 67
№ 5
2022
888
БЕЛЯЕВА и др.
Таблица 2. Константы скорости безизлучательной рекомбинации зарядов P680+Phe- (k42) и P680+QA- (k46)
Реакции рекомбинации
Phe- → P680+ (k42, мс-1)
QA- и P680+ (k46, мс-1)
Модель фотосистемы II
1200 и 300 мкмоль фотонов·м-2·с-1
Лист гороха
2.75 = 5.5∙108/2∙108 с-1
30%, 5800 и 4500 с-1
Модель тилакоида
3000 и 1000 мкмоль фотонов·м-2·с-1
Synechocystis
3.2 = 4.0∙108/1.25∙108 с-1
55%, 2800 и 1800 с-1
Модель тилакоида
1800 и 1200 мкмоль фотонов·м-2·с-1
Scenedesmus
15.4%, 1.5∙108 и 1.3∙108 с-1
20%, 1800 и 1500 с-1
Примечание. Константы фитированы для двух интенсивностей актиничного света для строки модели ФСII (рис. 4) с
нейтральным QB.
микроводоросли Scenedesmus для каждой из строк
висимость величин k42-45; k46-49 (табл. 1) от ста-
нами выявлены константы скоростей рекомбина-
дии роста Chlorella (26 и 48 ч) не выявлена.
-
ции зарядов: для Phe-P680+
- k42-45 и для QA
В итоге результаты показывают возможности
многопараметрического анализа системы ТМ и
P680+ - k46-49 (табл. 1). Рассмотрим результат на
доказывают необходимость длительных измере-
примере освещенности PFD 1200 мкмоль фото-
ний ИФ с целью наблюдения регуляторных про-
нов·м-2·с-1. Реакции безызлучательной рекомби-
цессов [5-7, 9, 40, 44, 45] и изучения их механиз-
нации зарядов протекают одинаково, если в QB-
мов. Вместе с тем компактная модель ФСII при-
сайте вторичный хинон нейтрален или отсутству-
менима в оперативном анализе с целью изучения
и сравнения особенностей фотосинтетического
ет, а именно, k42 = k43= 1.3∙108 с-1; k46 = k47=
аппарата выбранных объектов.
= 1500 с-1. Увеличение значений k44 до 5.0∙108 с-1,
Фитопланктон каскада водоемов при «летова-
а k48 - до 1800 с-1 (строка QB-), и далее, k45 - до
нии». Фитопланктон (фитоценоз) - это сообще-
ство планктонных организмов [8], которые могут
6.4∙108 с-1, k49 - до 3000 с-1 (QBH-) проявляется
осуществлять процесс фотосинтеза и являются
для тех состояний РЦ, в которых вследствие пере-
первичным звеном трофической цепи водной
носа электронов при освещении накоплен элек-
экосистемы. Если состояние водоема стабильно,
тростатический заряд на вторичном хиноне QB-
то можно полагать, что состояние фитоценоза ха-
сайта. Эффект, возможно, связан с влиянием ло-
рактеризует водоем как объект исследования [8].
кальных электрических полей, возникающих в
При летовании каскада трех проточных прудов
РЦ при освещении на перенос электрона [52, 53].
бассейна реки Темерник наблюдались устойчи-
вые режимы функционирования для каждого из
Диссипативные потери образцов можно срав-
водоемов. А именно, после «летования» в 2017 г.
нить, изменяя в модели уровень поглощения фо-
для среднего в каскаде пруда № 2 характерна чи-
тонов. Полученные при двух интенсивностях по-
стая вода (контроль) и высокая продуктивность
тока света константы безызлучательной рекомби-
популяции малька. В то же время верхний по те-
нации (k42-45; k46-49) удобно сравнить для
чению пруд № 1 существует в состоянии биологи-
минимальных величин в нейтральном QB-сайте
ческой деградации, а в нижнем пруду № 3 проис-
(k42, k46), приведенных в табл. 2. Измерения дли-
ходит цветение воды. Мы взяли пробы фито-
тельной ИФ микроводоросли Scenedesmus прове-
планктона из трех прудов, измерили кривые ИФ
дены здесь при освещении 1200 и 1800 мкмоль
(рис.
7а) и применили модельный анализ
(рис. 7б,в) процессов ФСII для изучения состоя-
фотонов·м-2·с-1. Расчеты в модели тилакоида
ния фитоценозов верхнего, среднего и нижнего
при полуторакратном различии в поглощении
прудов (№№ 1, 2 и 3 соответственно).
фотонов показывают увеличение безызлучатель-
Анализ состояния фитопланктона водоемов в
ной рекомбинации P680+Phe- на
~15% и
модели фотосистемы II. На рис. 7а показан ход
P680+QA- - на ~20%.
кривых ИФ на интервале до 1 с при освещении
постоянным светом неизменной интенсивности
Параметры k42, k46 увеличены в случае осве-
4500 мкмоль фотонов·м-2·с-1 для проб фито-
щения 60% по сравнению с 40% (табл. 1) для РЦ с
планктона, взятых с глубины 0.3 м от поверхно-
редокс состояниями QB, QB- и QBH-. Однако за-
сти прудов №№ 1-3. На рис. 7а кривые ИФ трех
БИОФИЗИКА том 67
№ 5
2022
ДИНАМИКА ПРОЦЕССОВ В ТИЛАКОИДНЫХ МЕМБРАНАХ
889
Рис. 7. Фитирование модели изолированной фотосистемы II по измерениям индукции флуоресценции на пробах
фитопланктона каскада водоемов. (а) - Сигналы ИФ детектировали до 1 с при интенсивности актиничного света
4500 мкмоль фотонов·м-2·с-1 на пробах фитопланктона трех водоемов в различном состоянии: cредний в каскаде пруд
№ 2 (контроль), верхний по течению пруд № 1 (деградация), нижний пруд № 3 с цветением воды. Указаны также
уровни максимума (Fm) и минимума (F0) индукции флуоресценции. Значение FV/Fm = 0.46 максимально для
фитоценоза № 2. (б), (в) - Траектории индукции флуоресценции. ФЛ2, ФЛ1 и ФЛ3 фитируют модель ФСII (схема на
рис. 4, табл. 3) по измерениям ИФ. (б) - Динамика закисления люмена pHлюмен получена в расчетах для фитоценозов
№ 1, № 2, № 3 при стационарных значениях рН в люмене: pH№1 = 5.2, pH№2 = 5.8, pH№3 = 5.5. (в) - Траектории КВК-
1-2-3 рассчитаны через сумму скоростей донирования электрона на Р680+ в четырех реакциях модели ФСII с n = 4, 11,
18, 31 (см. схему на рис. 4; константа скорости k4 в табл. 3). Графики КВК-1-2-3 позволяют сравнить (в отн. ед.) уровни
генерации кислорода фитоценозов № 1, № 2 и № 3.
водоемов не нормированы. Поэтому очевидны
мов. Найденные в модели ФСII величины пара-
отличия начального и максимального уровней
метров собраны в табл. 3. Выше в табл. 1 набор па-
испускания флуоресценции F0, Fm и характера
раметров для Chlorella и Scenedesmus дан для более
кинетических стадий нарастания ИФ. Очевидно,
сложного расчета, когда блок модели ФСII вклю-
что переменная флуоресценция фитопланктона
чен в модель тилакоида.
(выход Fv/F0) для пробы «верхний пруд № 1» зна-
Сравнение данных в табл. 1 и 3 выявляет бли-
чительно снижена по сравнению с данными для
водорослей in vivo (рис. 5а и 6а).
зость или совпадение величин параметров про-
цессов РЦ ФСII, найденных для двух монокуль-
Оперативные вычисления в модели процессов
тур микроводорослей и для проб фитопланктона.
ФСII фитированы по измерениям на пробах
Так, совпадение констант равновесия или кине-
№№ 1-3. Модельные траектории ФЛ1, ФЛ2,
тических очевидно для переноса первого/второго
ФЛ3 (рис. 7б,в) количественно воспроизводят
электрона на пласто/семихинон (QB/QB-) стро-
кинетические стадии нарастания и начальной
стадии спада ИФ, наблюдаемые для трех водое- мального сайта ФСII.
БИОФИЗИКА том 67
№ 5
2022
890
БЕЛЯЕВА и др.
Таблица 3. Определение параметров в результате фитирования модели изолированной фотосистемы II по
сигналам индукции флуоресценции для проб из каскада прудов
Номера реакций n и параметры kn (мс-1) /KEqn
Состояния и процессы
Пруд № 1
Пруд № 2
Пруд № 3
Фитоценозы водоемов
k1
0.24
0.48
0.48
Световая константа
Antn
80
200
200
Aeff - Эффективный размер антенн ФСII
n = 2
320000000 /Aeff ; 16
Первичное разделение зарядов открытых РЦ
kda
2·105
5·104
8·104
Тепловая диссипация возбуждения антенны
n = 7
3.2/20
Перенос 1-го электрона на пластохинон QB-сайта
n = 14
1.6/10
1.6/8
1.6/10
Перенос 2-го электрона на семихинон QB-сайта
n = 21
0.4/1.6
0.4/1.6
0.8/2
Выход PQH2 в фазу мембраны
n = 34
0.2/0.1
0.2/0.1
0.1/0.8
Заполнение QB-сайта молекулой хинона
n = 41
0.05/5000
Отток электронов от ФСII при окислении PQH2
n = 46
2.4
2.4
1.4
Безизлучательная рекомбинация P680+QA-
n = 42
4·105
4·105
105
Рекомбинация зарядов P680+Phe- закрытых РЦ
k4
1.4
4.0
Константы скорости донирования электрона на
катион радикал Р680+
k2/a;
a = 5
a = 5
a = 5
Факторы a и b разделения зарядов в закрытых РЦ
KEq2/b
b = 8
b = 8
b = 10
Примечание. Состояние прудов: непродуктивный (№ 1), «контроль» (№ 2), цветущий (№ 3).
Паттерны флуоресценции фитоценоза как мар-
Состав фотосинтезирующих компонент фито-
керы состояния водоемов. Параметр тепловой
планктона каждого из трех прудов не изучался.
диссипации (kD) в антенне (формула (5)) со-
Однако нами измерено содержание форм хлоро-
гласно табл. 3 отличается для трех фитоценозов:
филла в пробах №№ 1-3. Суммарное возраста-
ние концентрации Хл в прудах № 2 и № 3 по срав-
5·104 мс-1 - № 2 (контроль), 8·104 мс-1 - № 3
нению с верхним прудом № 1 согласуется с ре-
(цветение), 2·105 мс-1 - № 1 (деградация). Таким
зультатом фитирования эффективного размера
образом, потери энергии света за счет тепловой
антенн комплекса ФСII - Aeff. Размер антенн,
диссипации в антенне РЦ ФСII увеличены по
равный 200, получен для прудов № 2 и № 3 и сни-
сравнению с величиной в контроле на 60 и 300%
жен до 80 для пруда № 1, находящегося в состоя-
для водоемов ниже и выше по течению соответ-
нии биологической деградации.
ственно. Интенсивность света, вызывающая сиг-
В модели ФСII, фитированной по ИФ фито-
налы ИФ, одинакова для проб фитоценозов и не
планктона, траектории «КВК1-3» на рис. 7в вы-
может быть причиной различий величин пара-
являют генерацию О2 при условии, что эти траек-
метра kda = kD.
тории рассчитаны как сумма скоростей дониро-
Модель ФСII объясняет усиление тепловой
вания электрона на Р680+ в четырех реакциях
диссипации в антеннах степенью закисления лю-
модели ФСII с n = 4, 11, 18, 31.
мена при освещении. Действительно, фитирова-
Очевидно, что генерация О2 падает (до нуля)
нию кривых ИФ проб №№ 1-3 на рис. 7б соот-
при моделировании фитоценоза неполноценного
ветствуют три варианта расчетов кинетики рН
пруда № 1 (КВК1) по сравнению с фитоценозом
люмена тилакоидных мембран с минимальным
«контроль» (КВК2), в то время как в цветущем
рН для верхнего водоема № 1. Стационарный
пруду № 2 (КВК3) уровень генерации О2 сохра-
уровень рН люмена для проб №№ 1-3 составил
pH№1 = 5.2, pH№2 = 5.8 и pH№3 = 5.5 соответ-
няется. Результаты объяснимы снижением от
ственно.
4000 до 1400 с-1 скорости восстановления Р680+,
БИОФИЗИКА том 67
№ 5
2022
ДИНАМИКА ПРОЦЕССОВ В ТИЛАКОИДНЫХ МЕМБРАНАХ
891
усредненной по Si-состояниям КВК (табл. 3, «k4»,
pHL|Trigg = 6.7 коррелирует с возрастанием qE-ту-
«Пруд 2», «Пруд 1»).
шения в расчетах не только для 60%-го (рис. 8а,
траектории pHL, kD-qE), но и для 40%-го освеще-
Результаты моделирования процессов ФСII на
основе анализа быстрых кривых ИФ фитопланк-
ния (не показано).
тона предоставили параметры, соотносимые с ти-
Динамика линейного и циклического переноса
пом каждого из трех водоемов. Однако, для ана-
электронов при действии света. Как известно, по-
лиза механизмов процессов, стоящих за отличия-
глощение фотона и экситонное возбуждение
ми фитоценозов, необходимо получить расчеты в
1Chl*-антенн в светозахватывающих белковых
полной модели тилакоида по длительным изме-
комплексах приводит к переносу энергии в РЦ и
рениям ИФ.
разделению зарядов в ФСII на временах 10-11-
10-8 с. Стабилизация электрона на QA- 1(Chl-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
P680)*Phe ↔ Phe-P680+QA → PheP680(+)QA- (за
Измерения длительной ИФ на клетках Scened-
esmus получили в интервале от 20 мкс до 10 мин в
~300 пс) и последующий перенос QA-→QB() (за
ответ на свет сильной и умеренной интенсивно-
сотни микросекунд) приводят к накоплению за-
сти (точки ФЛ1-60% и ФЛ2-40%, рис. 5а) и фити-
крытых РЦ (рис. 8б, траектория ΣQA-). Последу-
ровали в модели тилакоидной мембраны (траек-
ющее замедление оттока электронов от ФСII про-
тории FL1 и FL2, рис. 5б, табл. 3). В результате
исходит при обмене молекул PQH2 на PQ при
фитирования определены значения параметров
диффузии PQH2 от стромальной стороны мем-
процессов в системе ТМ (рис. 1), последователь-
браны к люменальной (рис. 8б, PQH2S и PQH2L)
ность и динамика процессов переноса электро-
нов и энергизации мембраны на интервале вре-
и при транспорте электронов PQH2 → Cyt b6f → PC
мени от пикосекунд до 100 с.
→ ФСI. Фотохимическое разделение зарядов и за-
Энергозависимое qE-тушение в антенне фотоси-
крытие РЦ ФСII происходит всегда быстрее по-
стемы II. В результате фитирования модели ТМ
следующего «открытия РЦ» и оттока электронов
по ИФ клеток Scenedesmus, вызываемой светом
от PQH2 в интервале времени 10-3 с.
60%, на рис. 8а можно выявить динамику компо-
Генерация возбуждения 1(Chl-P680)* опреде-
нент энергизации мембраны тилакоида - pH лю-
ляется световой константой kL, значение которой
мена и стромы (pHL(t), pHS(t)), а также электри-
ческого потенциала (ΔΨ(t)). Вместе с траектория-
зависит от сечения поглощения фотонов фотоси-
ми pHL, pHS, ΔΨ дан график kD(t) (kDAnt, рис. 8а),
стемой II и интенсивности света [30]. Фитирова-
ние модельных кривых ИФ при увеличении kL от
определяющий ход во времени динамического
параметра kD(t) = kDconst + kDvar∙q(t) согласно
560 до 840 с-1 показало возрастание амплитуды
уравнениям (7) и (8). Динамика kD(t) указывает
сигнала ИФ (FL2 и FL1, рис. 5а) и ускорение ста-
дий OABCD окисления-восстановления P700
на диссипативные потери в антенне ФСII путем
(Р7002 и Р7001, рис. 5а). «Давление возбуждения»
распада 1Chl* (рис. 3 и формула (5)) и может быть
на систему преобразования энергии света может
объяснена быстрой фазой NPQ тушения (в ин-
привести к разрушению целостности компонент
тервале ~ 1-2 мин) в ответ на освещение образца
ЭТЦ за счет избытка электронов и появления ак-
после темновой адаптации [6, 35-37, 42]. Эту
тивных форм кислорода. На схеме модели ТМ
компоненту NPQ обычно обозначают как энер-
(рис. 1) процесс, обозначенный знаком
, соот-
⊕
гозависимое qE-тушение, вызванное снижением
ветствует предотвращению действия избыточно-
люменального рН.
го возбуждения за счет процесса qE-тушения при
Действительно, график kDAnt (рис. 8а) указы-
энергизации мембраны тилакоида.
вает на низкий уровень диссипации энергии в ан-
Фитирование параметров в формуле (8) (см.
тенне в соответствии с базовой величиной
раздел «qE-тушение») показало, что при увеличе-
kDconst = 3∙107 с-1, неизменной в интервале t < 10
нии световой константы kL в полтора раза (от 560
с после темновой адаптации образца. Для микро-
до 840 с-1) константа kDvar усиленной диссипа-
водоросли Scenedesmus, величина kDconst не зави-
ции энергии в этих условиях возрастает в три ра-
сит от интенсивности света (табл. 3). Параметр
kDvar в формулах (7) и (8) определяет максималь-
за, kDvar = 1.2⋅108 и 3.8⋅108 с-1 (табл. 1). Иными
ный уровень потерь энергии в антенне согласно
словами, усиление распада 1Chl* под влиянием
kDvar = 3.8⋅108 с-1 или 1.2⋅108 с-1 в зависимости от
qE-тушения (kDAnt, рис. 8а) обеспечивает защиту
сильной или средней интенсивности света (табл.
системы ТМ в антенных комплексах ФСII в ответ
1, столбцы 60% или 40%). В интервале t > 10 с ди-
на увеличение kL. Моделирование показывает,
намика закисления люмена до значения
что при действии постоянного света энергозави-
БИОФИЗИКА том 67
№ 5
2022
892
БЕЛЯЕВА и др.
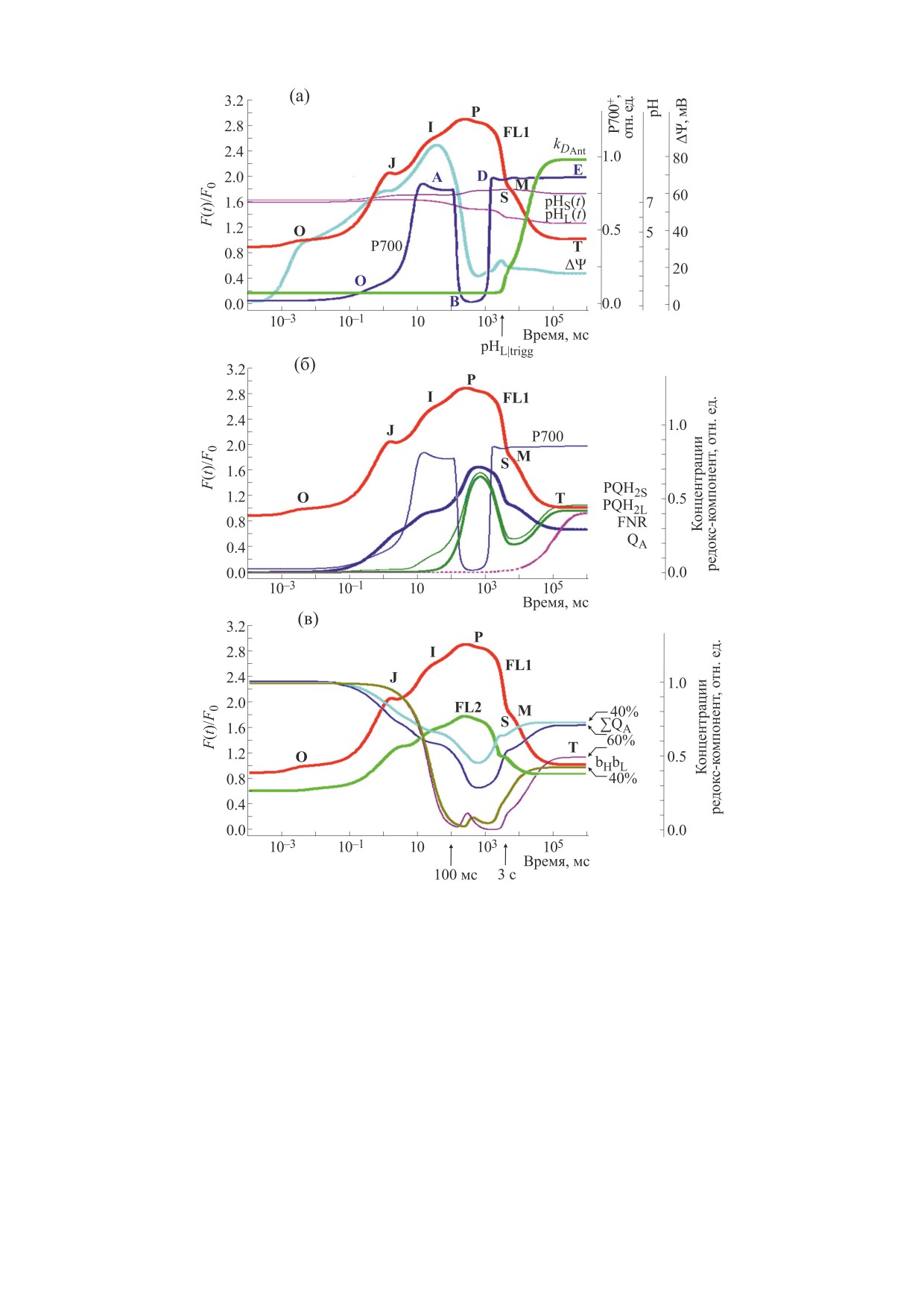
Рис. 8. Динамика компонент системы тилакоидных мембран, моделируемая для микроводоросли Scenedesmus obliquus.
Траектории FL1 и Р700 - расчет индукции флуоресценции, фитированной по ИФ клеток Scenedesmus (рис. 5а, ФЛ1)
и редокс-превращений Р700 ФСI (рис. 5б, FL1, Р700-60%). (а) - Стадии энергизации мембраны связаны с
изменениями pH люмена pHL(t), pH стромы pHS(t) и электрического потенциала ΔΨ(t). Изменения динамической
константы скорости диссипации энергии в антенне ФСII представлены графиком kDAnt (формула (8) для kD(t)),
выявляют запуск qE-тушения при закислении люмена до pHL|Trigg = 6.7. (б) - Рассчитаны: ΣQA- - закрытые формы
РЦ ФСII с QA-, PQH2S и PQH2L - степень восстановленности пула хинолов на стромальной и люменальной сторонах
мембраны, FNR - динамическая константа скорости активации FNR-редуктазы kFNR(t) (формула (9)). (в) -
Концентрации редокс-компонент рассчитаны на основе фитирования модели ТМ для освещенности 60% и 40% (см.
рис. 5б). Динамика открытых РЦ ФСII (ΣQA-60% и ΣQA-40%) определяет фотохимическое qP-тушение. Графики
bL/H-60% и bL/H-40% - расчет состояний Cyt bf без электронов на bL- и bH-гемах. Стрелками выделен интервал
времени 100 мс < t < 3 с, в котором отличия bL/H-60% и bL/H-40% указывают на роль комплекса Cyt bf в световой
адаптации системы ТМ.
БИОФИЗИКА том 67
№ 5
2022
ДИНАМИКА ПРОЦЕССОВ В ТИЛАКОИДНЫХ МЕМБРАНАХ
893
симое qE-тушение включается в интервале 1 с <
(1) Восстановление P700 на стадии «B» паттер-
< t < 10 с и возрастает до максимума в интервале
на OABCDE Р700 (рис. 8б) происходит в процессе
10 с > t < 100 с (kDAnt, рис. 8а), усиливая спад ин-
ЦПЭ из пула Fdr (схема 1, раздел «Структура мо-
тенсивности флуоресценции на медленной
дели ТМ»). (2) Формирование пула PQH2 проис-
PSMT-стадии ИФ на фоне энергизации мембра-
ходит параллельно с накоплением закрытых РЦ
ны (график FL1, рис. 8а).
ФСII (рис. 8б). При этом восстановленные на
Индуцированные светом ЛПЭ и ЦПЭ (схема 1,
стромальной стороне мембраны молекулы PQH2
рис. 1) дают вклад в формирование трансмем-
диффундируют (траектории PQH2S и PQH2L,
бранного градиента протонов. Перенос электро-
рис. 8б) к люменальному сайту Cyt bf.
нов от Fdr в стромальный сайт Cyt bf с последую-
Согласно вычислениям с kL = 560 и 840 с-1
щим окислением PQH2 и восстановлением PC в
(траектории ΣQA-40% и ΣQA-60%, рис. 8в), фото-
люменальном сайте формирует ЦПЭ вокруг ФСI,
обеспечивая генерацию АТФ без продуцирова-
химическое тушение в ФСII определяется коли-
ния NADPH.
чеством открытых РЦ (ΣQA). Очевидно, что при
Известно [6, 40], что при активации стромаль-
световой индукции накопление закрытых РЦ (с
ных метаболических циклов на кривой ИФ появ-
QA-) достигает 65% при освещении 1800 мкмоль
ляется фаза SM. Действительно, в нашей модели
фотонов·м-2·с-1 и 54% степени восстановленно-
ТМ при фитировании ИФ in vivo, до 100 с после
темновой адаптации, выявляется процесс свето-
сти РЦ при 1200 мкмоль фотонов·м-2·с-1. Макси-
вой активации FNR-редуктазы на стадии SM-фа-
мальная восстановленность гемов bL/H поддер-
зы (график FNR, рис. 8б) при соотношении
живается на более длительном интервале времени
АТФ:NADPH = 1.52:1 в стационарном состоя-
до 3 с при kL = 840 с-1 по сравнению с интервалом
нии. Этот результат совпадает с литературными
до 1 с при 560 с-1 (bL/H1-60% и bL/H2-40%,
данными [6, 10] о таком же соотношении метабо-
литов (АТФ/NADPH = 1.5) при оптимальном ре-
рис. 8в). Этому сопутствует снижение фотохими-
жиме работы стромальных циклов.
ческого тушения при усилении освещения
(ΣQA60% в сравнении с ΣQA40%).
Роль цитохромного комплекса b6f в переносе
электронов. Роль цитохромного комплекса Cyt b6f
Согласно расчетам при kL = 840 с-1 превыше-
на стадиях переноса электронов между ФСII и
ние скорости ЛПЭ над ЦПЭ достигается за время
ФСI анализировалась на основе фитирования
около 1 с (здесь не показано) на начальной стадии
траекторий (FL1 и FL2, рис. 5б) на временах от
активации FNR-редуктазы (траектория FNR,
микросекунд до 100 с по измерениям кривых ИФ
рис. 8б). Последующее усиление ЛПЭ ведет к
на клетках Scenedesmus (точки ФЛ1-60% и ФЛ2-
снятию блокировки оттока электронов на стро-
40%, рис. 5а).
мальной стороне ФСI. Вслед за тем вторичное
В условиях темновой адаптации гемы bLbH
окисление Р700 на стадиях CDE паттерна OABC-
комплексов Cyt bf нейтральны и не заполнены
DE редокс-превращений Р700 (Р700, 8б) и терми-
электронами (модель ТМ, рис. 1 и 2а, компонента
нальное восстановление пула PQH2 (РQH2, рис.
f1). В переходах «темнота-свет» динамика про-
8б) достигают стационарного уровня в интервале
цессов с участием подсистем ФСII, пул
1-2 мин, когда переходы ФСII → PQ/PQH2 → Cyt
PQ/PQH2, Cyt bf, ФСI (рис. 8б) связана с динами-
b6f → PC → ФСI взаимно согласованы при свето-
кой редокс-состояния гемов bLbH (bL/H), рассчи-
вой активации FNR-редуктазы (FNR, рис. 8б).
танной при kL = 560 и 840 с-1 на рис. 8в.
В целом на стадии заполнения гемов bL/H
На временах до t < ~10 мс степень восстановле-
электронами обеспечивается согласование про-
ния гемов за счет ЦПЭ не зависит от kL (рис. 8в,
цессов в ФСII и ФСI в течение интервала времени
траектории bL/H1 и bL/H2). В интервале до 100 мс,
100 мс < t < 2 с и одновременное формирование на
этом этапе максимумов восстановленности РЦ
согласно результатам вычислений, быстрые ки-
ФСII, хинолов PQH2, РЦ ФСI.
нетические стадии ИФ (OJI) и изменений Р700
катион-радикала (OAB) связаны с увеличением
доли РЦ ФСII с QA- и окислением P700 (рис. 8б,
ЗАКЛЮЧЕНИЕ
ΣQA- и P700+) в условиях независимой работы
Адаптация системы тилакоидных мембран к
каждой из фотосистем - ФСII и ФСI.
режиму освещения сопровождается индукцион-
В интервале 100 мс < t < 3 с степень восстанов-
ными сигналами ФЛ Chl a и изменениями погло-
ленности Cyt bf максимальна, что отражает по-
щения P700. В данной работе измерения ИФ
очередное заполнение компонент ЭТЦ электро-
микроводоросли Scenedesmus проводили на вре-
нами.
менах до 10 мин при плотности потока квантов
БИОФИЗИКА том 67
№ 5
2022
894
БЕЛЯЕВА и др.
симым от константы скорости kFNR(t) (раздел
света 1800 и 1200 мкмоль фотонов·м-2·с-1 (высо-
кая и умеренная интенсивности). Фитирование
«Структура модели», формула (9)).
модели ТМ по данным ИФ клеток Scenedesmus
В целом теоретический анализ индуцирован-
позволило получить количественное совпадение
ных процессов в тилакоидных мембранах клеток
модельных траекторий ИФ (FL1-60% и FL2-40%,
Scenedesmus показывает, что стационарные ре-
рис. 5б) и детектируемых в опытах сигналов
докс-состояния компонент ЭТЦ определены вза-
OJIPSMT (ФЛ1 и ФЛ2, рис. 5а) на временах до
имным согласованием потоков ЛПЭ и ЦПЭ на
100 с на быстрых (OJIP) и медленных (PSMT) ста-
временах от пикосекунд до 1-2 мин в условиях
диях. Динамика изменения переменных в модели
активации FNR-редуктазы и qE-тушения.
ТМ, рассчитанная до t < 2 мин, соответствует
В данной работе результаты моделирования
(рис. 8а-в) изменениям компонент системы ТМ
сигнала ИФ, детектируемой до 2 с на культуре
в ответ на поглощение света в антенне ФСII и
Chlorella, позволили оценить предел времени, в
ФСI.
котором достигается фитирование данных по ИФ
На свету происходит генерация состояний
с применением модели изолированной ФСII ли-
Phe-P680+ и QA- P680+ с разделенными заряда-
бо модели ТМ. Применение модели ФСII при об-
ми, что сопровождается их рекомбинацией с кон-
работке сигналов ИФ, измеренных до 1 с на про-
стантами скоростей k42-45 и k46-49 (табл. 1) и поте-
бах фитопланктона, позволило получить пара-
рями энергии, запасенной в фотохимическом
метры реакций РЦ ФСII фитоценозов для
процессе. В расчетах обнаружено увеличение
каждого их трех водоемов - экологически полно-
ценного, цветущего, деградирующего. Отличия
констант скоростей рекомбинации зарядов в РЦ с
кривых ИФ, наблюдаемых для фитоценозов, свя-
восстановленным вторичным хиноном QB-сайта
заны с разницей в величинах малого набора пара-
(QB-, QBH-), что может быть связано с влиянием
метров, которые нами предложено использовать
локальных электрических полей [52, 53]. Адапта-
в качестве характеристик (маркеров) состояния
ция системы тилакоидных мембран к освещению
фитоценозов природных водоемов.
отражается в динамике процессов в закрытых и
С целью анализа механизмов процессов, стоя-
открытых РЦ ФСII, восстановления/окисления
щих за отличиями сигналов ИФ необходимо ис-
пула PQ/PQH2 и кофактора P700 РЦ ФСI. Это
следовать монокультуры микроводорослей в кон-
влияет на характер модельных траекторий ΣQA- и
тролируемых лабораторных условиях, используя
данные, полученные при длительной, до минут,
ΣQA, PQH2, P700+ на рис 8б, построенных по
световой индукции образцов оксигенного фото-
данным ИФ клеток Scenedesmus.
синтеза.
Стадии эволюции состояния системы ТМ в
интервале времени t < 2-3 с связаны с генерацией
трансмембранной разности ΔpHo-i(t) = pHS(t) -
БЛАГОДАРНОСТИ
- pHL(t) (рис. 8а) и реализуются в регуляторной
Благодарим сотрудницу кафедры биофизики
перестройке процессов ТМ, как показано in silico
Биологического факультета МГУ имени М.В. Ло-
на рис. 8а-в.
моносова к.б.н. Е.В. Воронову за предоставление
При освещении поступление протонов в лю-
образцов микроводоросли Scenedesmus obliquus.
мен при pHL|Trigg =6.7 инициирует энергозависи-
Мы благодарны также проф. С.И. Погосяну за
полезные обсуждения и к.б.н. С. С. Хрущеву за
мое qE-тушение (kDAnt, рис. 8а), максимально
техническую поддержку работы.
возрастающее в интервале 10 с > t < 100 с. В ре-
зультате рН-зависимой регуляции возбуждения в
антенне (раздел «Структура модели», формула
ФИНАНСИРОВАНИЕ РАБОТЫ
(8)) происходит снижение интенсивности ФЛ на
медленной PSMT-стадии ИФ при согласовании
Исследование выполнено в рамках научного
фотохимического qP-тушения с оттоком элек-
проекта государственного задания МГУ имени
тронов из системы ТМ.
М.В. Ломоносова № 121032500060-0 и при ча-
стичной финансовой поддержке Российского
Такое согласование отражается в характере тер-
фонда фундаментальных исследований (грант №
минального окисления P700 на стадии «E» паттерна
20-04-00465), а также Российского научного фон-
OABCDE P700+, когда происходит снятие блоки-
да (проект № 22-11-00009).
ровки оттока электронов на стромальной стороне
ФСI при активации на свету неактивной в темноте
FNR-редуктазы, (траектории P700+ и FNR, рис. 8б).
КОНФЛИКТ ИНТЕРЕСОВ
Таким образом, усиление оттока электронов от Fdr в
Авторы заявляют об отсутствии конфликта
реакции ЛПЭ NADP+ → NADPH становится зави-
интересов.
БИОФИЗИКА том 67
№ 5
2022
ДИНАМИКА ПРОЦЕССОВ В ТИЛАКОИДНЫХ МЕМБРАНАХ
895
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
22. А. А. Волгушева, О. В. Яковлева, Г. П. Кукаpcкиx и
др., Биофизика, 56 (1) 105 (2011).
Настоящая работа не содержит описания ис-
23. A. Stirbet, D. Lazár, J. Kromdijk, and Govindjee, Pho-
следований с использованием людей и животных
tosynthetica, 56, 86 (2018).
в качестве объектов.
24. N. E. Belyaeva, A. A. Bulychev, G. Yu. Riznichenko,
and A. B. Rubin, Photosynth. Res., 130, 491 (2016).
СПИСОК ЛИТЕРАТУРЫ
25. N. Belyaeva, A. Bulychev, G. Riznichenko, and A. Ru-
1.
N. E. Belyaeva, F.-J. Schmitt, R. Steffen, et al., Photo-
bin, Photosynth. Res., 140, 1 (2019).
synth. Res., 98, 105 (2008).
26. G. Riznichenko, G. Lebedeva, O. Demin, and A. Ru-
2.
N. E. Belyaeva, F.-J. Schmitt, V. Z. Paschenko, et al.,
bin, J. Biol. Phys., 25, 177 (1999).
Photosynth. Res., 125, 123 (2015).
27. G. V. Lebedeva, N. E. Beljaeva, G. Yu. Riznichenko,
3.
N. E. Belyaeva, A. A. Bulychev, K. E. Klementiev,
and O. V. Demin, in BioThermoKinetics in the Post Ge-
et al., Photosynth. Res., 146 (1), 259 (2020).
nomic Era, Ed. by C. Larsson, I. Pahlman and L. Gus-
4.
A. Stirbet and Govindjee, Photosynth. Res., 113, 15
tafsson (Chalmers Reproservice, Goteborg, 1998),
(2012).
pp. 196-199.
5.
A. Stirbet D. Lazár, G. C. Papageorgiou, and Govind-
28. Н. Е. Беляева, Г. В. Лебедева, Г. Ю. Ризниченко
jee, In Cyanobacteria: From Basic Science to Applica-
и др., В сб. «Математика. Компьютер. Образова-
tions, Ed. by A. K. Mishra, D. N. Tiwari, and A. N. Rai
ние» (М., 2000), вып. 7, сс. 606-614.
(Acad. Press, Elsevier, 2019), pp. 79-130.
29. Н. Е. Беляева, Г. В. Лебедева и Г. Ю. Ризниченко,
В сб. «Математика. Компьютер. Образование»
6.
A. N. Tikhonov, Photosynth. Res., 125, 65 (2015).
(М., 2003), вып. 10, сс. 263-276.
DOI: 10.1007/s11120-015-0094-0
30. Н. Е. Беляева, Дисс. … к-та физ.-мат. наук (МГУ
7.
Chlorophyll a fluorescence: a signature of photosynthesis
им. М. В. Ломоносова, М., 2004).
(Advances in Photosynthesis and Respiration, vol. 19),
Ed. by G. C. Papageorgiou and Govindjee (Springer,
31. Н. Е. Беляева, В. З. Пащенко, Г. Ренгер и др.,
Биофизика, 51 (6) 976 (2006).
Dordrecht, 2004).
32. N. E. Belyaeva, A. A. Bulychev, G. Yu. Riznichenko,
8.
А. Н. Шаров, Дисс. … д-ра биол. наук (Санкт-
and A. B. Rubin, Biophysics, 56 (3) 464 (2011а).
Петербургский науч.-исслед. центр экологической
33. N. E. Belyaeva, F.-J. Schmitt, V. Z. Paschenko, et al.,
безопасности РАН, 2020).
BioSystems, 103 (2), 188 (2011b).
9.
Н. Ф. Реймерс, Экология. Теории, законы, правила,
34. N. E. Belyaeva, F.-J. Schmitt, V. Z. Paschenko, et al.,
принципы и гипотезы («Россия молодая», М., 1994).
Plant Physiol. Biochem., 77, 49 (2014).
10.
C. R. Ireland, S. P. Long, and N. R. Baker, Planta, 160,
35. O. Ebenhöh, G. Fucile, G. Finazzi, et al., Philos.
550 (1984)
Trans. R. Soc. B, 369, 20130223 (2014).
11.
G. H. Schatz, H. Brock, and A. R. Holzwarth, Biophys.
36. A. Stirbet and Govindjee, Photosynth. Res., 130, 193
(2016).
J., 54, 397 (1988)
37. A. Laisk, H. Eichelmann, and V. Oja, Photosynth.
12.
T. A. Roelofs, C. H. Lee, and A. R. Holzwarth, Bio-
Res., 90, 45 (2006).
phys. J., 61, 1147 (1992)
38. A. A. Bulychev, A. A. Cherkashin, E. M. Muronets,
13.
J. M. Bowes and A. R. Crofts, Biochim. Biophys. Acta,
and I. V. Elanskaya, Biochim. Biophys. Acta, Bioener-
590, 373 (1980)
getics, 1859, 1086 (2018)/
14.
R. J. Strasser, A. Srivastava, and Govindgee, Photo-
39. V. V. Ptushenko, T. V. Zhigalova, O. V. Avercheva, and
chem. Photobiol., 61, 32 (1995)
A. N. Tikhonov, Photosynth. Res., 139, 509 (2019).
40. I. V. Elanskaya, A. A. Bulychev, E. P. Lukashev, and
15.
G. Renger and A. Schulze, Photobiochem. Photobio-
E. M. Muronets, Biochim. Biophys. Acta - Bioener-
phys., 9. 79 (1985)
getics, 1862, 148318 (2021).
16.
E. Baake and J. P. Schlöder, Bull. Math. Biol., 54, 999
41. G. C. Papageorgiou, M. Tsimilli-Michael, and K. Sta-
(1992)
matakis, Photosynth. Res., 94, 275 (2007).
17.
A. Stirbet, Govindjee, B. J. Strasser, and R. J. Strasser,
42. G. Schansker, S. Z. Tóth, and R. J. Strasser, Biochim.
J. Theor. Biol., 193, 131 (1998)
Biophys. Acta, 1757, 787 (2006).
18.
D. Lazár, J. Theor. Biol., 220, 469 (2003)
43. S. Kodru, T. Malavath, E. Devadasu, et al., Photo-
synth. Res., 125, 219 (2015).
19.
D. Lazár, Photosynthetica, 47 (4), 483 (2009)
44. A. Morales, X. Yin, J. Harbinson, et al., Plant Physiol.,
20. Г. В. Лебедева, Н. Е. Беляева, О. В. Демин и др.,
176, 1247 (2018)
Биофизика, 47, 1044 (2002).
45. A. Stirbet, D. Lazár, Y. Guo, and Govindjee, Ann. Bot-
21. R. J. Strasser, M. Tsimilli-Michael, and A. Srivastava,
any, 126, 511 (2020).
In Chlorophyll a fluorescence: a signature of photosynthe-
46. P. V. Fursova, E. N. Voronova, A. P. Levich, et al.,
sis (Advances in Photosynthesis and Respiration,
Moscow Univ. Biol. Sci. Bull. 72 (4), 184 (2017).
vol. 19), Ed. by G. C. Papageorgiou and Govindjee
47. С. И. Погосян, С. В. Гальчук, Ю. В. Казимирко и
(Springer, Dordrecht, 2004), pp. 321-362.
др., Вода: химия и экология, 6, 34 (2009).
БИОФИЗИКА том 67
№ 5
2022
896
БЕЛЯЕВА и др.
48. G. E. Milanovsky, A. A. Petrova,·D. A. Cherepanov,
51. A. A. Bulychev, M. M. Niyazova, and A. B. Rubin, Bi-
and A. Y. Semenov, Photosynth. Res., 133, 185 (2017).
ologicheskie Membrany, 4, 262 (1987).
49. M. J. Kamali, G. V. Lebedeva, O. V. Demin, et al., Bio-
52. G. Schansker, S. Z. Toth, A. R. Holzwarth, and G. Ga-
physics, 49, 1061 (2004).
rab, Photosyn. Res., 120, 43 (2014).
50. I. A. Reynolds, E. A. Johnson, and C. Tanford, Proc.
Natl. Acad. Sci. USA, 82, 6869 (1985).
53. A. Laisk and V. Oja, Photosynth. Res., 143, 335 (2020).
Dynamics of in vivo Membrane Processes in Algal Thylakoids as Analyzed
from Chlorophyll Fluorescence Induction
Using the Photosystem II and Thylakoid Models
N.E. Belyaeva*, A.A. Bulychev*, V.Z. Paschenko*, K.E. Klementiev**, P.A. Ermachenko***,
I.V. Konyukhov*, G.Yu. Riznichenko*, and A.B. Rubin*
*Faculty of Biology, Lomonosov Moscow State University, Leninskie Gory 1/12, Moscow, 119234 Russia
**Faculty of Biology, Shenzhen MSU-BIT University, Shenzhen 518172, China
***New Pipeline Technology Company, ul. Schepkina, 51/4, bld. 1, Moscow, 129110 Russia
The OJIPSMT pattern of Chl a fluorescence induction (FI) was obtained with microalgae cells Scenedesmus
obliquus (Scenedesmus) exposed after dark adaptation to moderate and high light intensities (1200 and
1800 μmol photon m-2 s-1) in the time range from the microseconds to 10 minutes. The fast and, particu-
larly, slow OJIPS(M)T stages of FI extending up to 100 seconds were quantitatively described by fitting the
thylakoid membrane (TM) model. The calculations adequately reproduced the dynamics of P700 oxidore-
duction transients. The parameters of the TM processes were determined, and the transients of the TM model
variables are shown in calculations. The dynamic stages of redox reactions in the reaction centers (RCs) of
the photosystem II (PSII), the PQ/PQH2 quinone pool, the cytochrome b6f complex (Cyt bf), and P700 of
PSI RCs are influenced by the adaptation of the TM system to light. In silico analysis revealed the role of the
Cyt bf in the regulation of electron fluxes, when bL/H hemes remain in a more reduced state at high light in-
tensity than at moderate illumination in the interval from 100 ms to 3 s. For non-radiative recombination of
the separated charges in the RC Phe-P680+ and QA- P680+, the dependence of the rate constants k42-49 on
the level of QB(2)- reduction was revealed, together with the dependence of k42-49 on the illumination of
chloroplasts. Setting the dynamic rate constants kFNR(t) and kD-qE(t) allows comparing the generation
ΔpHo-i(t) = pHS(t)-pHL(t), initiation of qE-quenching at pHL|Trigg = 6.7, activation in the light FNR -re-
ductase, and reaching the stationary charge flows up to 1-2 minutes of light induction. The fitting model of
isolated PSII according to phytoplankton FI signals revealed the similarity of electron transfer parameters in
PS2 RCs in monocultures such as Scenedesmus, Chlorella, and phytoplankton samples. The markers of the
phytocenosis condition deviated only in the case of the degradation of a water reservoir compared to an eco-
logically clean one. These differences in markers consist in the reduced size of the antennas, an enhanced en-
ergy dissipation, and the pH decrease in the lumen.
Keywords: photosystems I and II; chlorophyll a fluorescence induction; model simulation; electron and proton
transfer; nonphotochemical quenching
БИОФИЗИКА том 67
№ 5
2022