БИОФИЗИКА, 2022, том 67, № 5, с. 906-916
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ЗАЩИТНЫЙ ЭФФЕКТ ПЕРОКСИДА ВОДОРОДА ПРИ ГЕМОЛИЗЕ
ЭРИТРОЦИТОВ НАНОЧАСТИЦАМИ СЕРЕБРА
© 2022 г. В.В. Войнаровский*, Г.Г. Мартинович*, #
*Белорусский государственный университет, просп. Независимости, 4, Минск, 220030, Республика Беларусь
#E-mail: martinovichgg@bsu.by
Поступила в редакцию 01.04.2022 г.
После доработки 03.06.2022 г.
Принята к публикации 22.06.2022 г.
С использованием численного моделирования и спектрофотометрического анализа исследованы
механизмы регуляции адаптации эритроцитов пероксидом водорода при гемолизе наночастицами
серебра. Показано, что наночастицы серебра индуцируют гемолиз эритроцитов, скорость которого
зависит от суммарной концентрации серебра и содержания ионов в растворе. Гемолиз эритроцитов
нитратом серебра протекает в два раза быстрее, чем наночастицами. Обнаружено, что пероксид во-
дорода повышает структурную устойчивость эритроцитов при гемолизе наночастицами серебра и
нитратом серебра. Диапазон концентраций пероксида водорода, при котором наблюдается увели-
чение доли негемолизированных клеток (область гормезиса), зависит от времени разрушения кле-
ток при действии повреждающего фактора. Максимум гормезиса при разрушении наночастицами
серебра наблюдается при концентрации пероксида водорода 1250 мкМ, а при разрушении нитратом
серебра - при 700 мкМ. С помощью численного моделирования установлено, что зависимость мак-
симума гормезиса от концентрации внеклеточного пероксида водорода и времени инкубирования
обусловлена динамическим характером цитоплазматических механизмов, регулирующих соотно-
шение мембранных комплексов метгемоглобина и феррилгемоглобина.
Ключевые слова: гормезис, адаптация, пероксид водорода, эритроциты, метгемоглобин, наночастицы
серебра.
DOI: 10.31857/S0006302922050076, EDN: JIIIGL
Способность адаптироваться к стрессу являет-
Основной молекулой группы АФК, осуществля-
ющей передачу регуляторных сигналов, является
ся важнейшей характеристикой здорового орга-
пероксид водорода [3]. Сигналы, передаваемые
низма [1]. Однако защитно-адаптационные меха-
пероксидом водорода, характеризуются своим
низмы на уровне клеток изучены недостаточно.
концентрационным порогом активации и дли-
Ключевыми участниками регуляции ответа кле-
тельностью. Действие таких сигналов обратимо и
ток на действие стрессовых факторов являются
регулируется многокомпонентной антиокисли-
активные формы кислорода (АФК) - высокоре-
тельной системой в результате сопряженного
акционные продукты метаболизма кислорода,
функционирования специализированных бел-
обладающие широким спектром физиологиче-
ков, таких как каталаза (Cat), глутатионперокси-
ского и патофизиологического действия [2]. К
даза (Gpx), пероксиредоксин (Prx) и др. [2].
АФК относятся различные химические соедине-
В последние годы выяснено, что регуляция
ния, включая синглетный кислород (1О2), су-
экспрессии генов белков антиокислительной си-
стемы клеток млекопитающих осуществляется
пероксидный (О•-) и гидроксильный (НО•)
фактором транскрипции Nrf2 (nuclear E2-related
радикалы, пероксид водорода (Н2О2) и другие. factor 2), активность которого контролируется с
участием редокс-зависимого белка Keap1 (Kelch-
Сокращения: АФК - активные формы кислорода, Cat - ка- like ECH-associating protein 1) [4]. Система Keap1-
талаза, Gpx - глутатионпероксидаза, Prx - пероксиредок-
Nrf2 играет ключевую роль в поддержании кле-
син, NADH - никотинамидадениндинуклеотид (восста-
новленная форма), NAD+ - никотинамидадениндинук-
точного редокс-гомеостаза при стрессовых воз-
леотид (окисленная форма), NADPH - никотинамид- действиях и рассматривается как потенциальная
NADP+- никотинамидадениндинуклеотидфосфат (окис- мишень для терапии широкого спектра заболева-
ленная форма), B3 - белок полосы 3, MetHb - метгемогло-
ний [5, 6]. Однако в эритроцитах, самых много-
бин, FerHb - феррилгемоглобин.
численных клетках крови человека, данная систе-
906
ЗАЩИТНЫЙ ЭФФЕКТ ПЕРОКСИДА ВОДОРОДА
907
ма поддержания редокс-гомеостаза отсутствует, и
ночастиц серебра может изменяться концентра-
защита клеток при стрессовых воздействиях осу-
ция пероксида водорода, в настоящей работе изу-
ществляется цитоплазматическими механизма-
чены условия и механизмы защитного действия
ми, включающими регуляцию функционального
окислителя при повреждении эритроцитов нано-
состояния белков и их взаимодействий с мембра-
частицами серебра.
ной и цитоскелетом клетки.
Разрушение клеток под действием наночастиц
Важнейшим механизмом защиты эритроцитов
серебра обусловлено, в основном, ионами сереб-
является повышение структурной стабильности
ра, высвобождаемыми наночастицами [16, 17], и
мембраны при связывании ее компонентов с ге-
зависит от ряда факторов, включая внеклеточные
моглобином - основным белком эритроцитов
и внутриклеточные редокс-условия [18]. Для ко-
личественного анализа влияния различных фак-
[7]. Константы скорости образования и распада
торов на действие пероксида водорода в эритро-
мембранных комплексов гемоглобина зависят от
цитах построена математическая модель, в кото-
окисленного состояния белка [8, 9]. Взаимодей-
рой передача сигнала с участием пероксида
ствие метгемоглобина с компонентами мембраны
водорода и образование мембранных комплексов
характеризуется более высокой константой свя-
окисленных белков рассматривается как цепь
зывания, чем связывание оксигемоглобина. По-
взаимосвязанных событий.
казано, что обратимое связывание метгемоглоби-
на с белками цитоскелета оказывает стабилизи-
рующее действие на эритроцитарные мембраны
ОПИСАНИЕ МОДЕЛИ
[10, 11]. Восстановление метгемоглобина никоти-
Повышение структурной стабильности мем-
намидадениндинуклеотидом (NADH), катализи-
бран эритроцитов, индуцируемое пероксидом во-
руемое цитохромом b5, приводит к снижению ко-
дорода, усиливает защитные свойства клеток и,
личества мембранных комплексов белка [12].
следовательно, уменьшает количество разрушен-
Накопление более окисленной формы гемогло-
ных при гемолизе клеток. При моделировании
бина - феррилгемоглобина усиливает процессы
индуцированного наночастицами гемолиза эрит-
перекисного окисления липидов и снижает
роцитов считается, что скорость разрушения
структурную стабильность мембран [13]. Меха-
клеток пропорциональна количеству клеток в
низмы изменения баланса окисленных форм ге-
суспензии и количеству высвобождаемых нано-
моглобина и их связывания с мембраной при дей-
частицами ионов серебра, вызывающих разруше-
ствии внешних стрессовых факторов до сих пор
ние. Скорость высвобождения ионов серебра, в
не изучены.
свою очередь, прямо пропорциональна количе-
Ранее нами было показано, что соотношение
ству ионов, заключенных в наночастицы, и зави-
мембранных комплексов различных окисленных
сит от защитных свойств клеток. В этом случае
форм гемоглобина определяет гормезисную зави-
скорость изменения количества клеток в суспен-
симость ответа эритроцитов на действие перок-
зии регулируется двумя конкурирующими про-
сида водорода: регуляторное при низких концен-
цессами (защиты и разрушения) и может быть
описана следующей системой уравнений:
трациях и повреждающее при высоких [14]. Диа-
пазон концентраций пероксида водорода, при
⎧
dn
+
котором наблюдается увеличение структурной
= -
k
·
n
·
⎡Ag
⎤
⎪
p
⎣
⎦
стабильности мембраны (область гормезиса), за-
dt
⎪
+
висит от ряда внутренних и внешних факторов.
⎪
d[Ag
]
1
0
⎨
= · [Ag
] ,
(1)
Значительный рост объемов производства но-
dt
k
⎪
з
вых материалов, содержащих наноразмерные ча-
0
⎪
d[Ag
]
1
0
стицы, и расширение областей их применения
= -
· [Ag
]
⎪
актуализировало исследования механизмов взаи-
⎩
dt
k
з
модействия искусственных наноматериалов и
где n - число клеток в суспензии, kр - коэффици-
биологических систем. Широкое применение на-
ент разрушения, kз - коэффициент защиты,
ходят наночастицы серебра, которые использу-
[Ag+] - концентрация высвобожденных ионов
ются в качестве бактерицидных, противовирус-
ных, противогрибковых и антисептических аген-
серебра в растворе, [Ag0] - концентрация ионов
тов, однако способны проявлять токсические
серебра в форме наночастиц. Суммарная концен-
свойства по отношению к клеткам млекопитаю-
трация серебра считается постоянной.
щих и человека [15]. Поскольку при действии на-
Решением системы (1) является уравнение:
0
t
nt) =
n(0) · exp([Ag
](0) ·
k
· (k
-
k
· exp(–
) -t)),
(2)
p
з
з
k
з
БИОФИЗИКА том 67
№ 5
2022
908
ВОЙНАРОВСКИЙ, МАРТИНОВИЧ
где n(0) - начальное количество клеток в суспен-
зы типа 1 - Glucose transporter 1). Считается, что
при окислении одной молекулы глюкозы восста-
зии, [Ag0](0) - начальная концентрация ионов
серебра, которая была использована при синтезе
навливаются две молекулы NAD+ или две моле-
наночастиц, t - время. Значения коэффициентов
кулы NADP+. Снижение поступления источника
kр и kз определяли на основе экспериментально
энергии (глюкозы) приводит к истощению пула
полученных зависимостей гемолиза эритроцитов
NADPH и NADH и изменяет скорость гликолиза
с использованием метода наименьших квадратов.
или пентозофосфатного пути пропорционально
Защитные свойства клеток при гемолизе опре-
концентрации пиридиннуклеотидов. Таким об-
деляются структурной стабильностью мембраны
разом, в новой модели учитываются не общие
и характеризуются коэффициентом защиты kз.
скорости гликолиза или пентозофосфатного
На основании ранее проведенных исследований
пути, а только их отклонения от начального зна-
[14] в модели полагается, что структурная ста-
чения.
бильность мембраны зависит от количества мем-
Индуцированное пероксидом водорода обра-
бранных комплексов метгемоглобина и феррил-
зование метгемоглобина и феррилгемоглобина
гемоглобина и изменяется со временем.
приводит к их связыванию с компонентами мем-
Для количественного анализа динамики изме-
браны эритроцита. Динамика образования мем-
нения защитных свойств клетки рассматривали
бранных комплексов окисленных форм гемогло-
ключевые этапы образования метгемоглобина и
бина описывается кинетикой лиганд-рецептор-
феррилгемоглобина и их связывания с мембра-
ного взаимодействия, где в качестве лиганда
ной при действии внеклеточного пероксида водо-
выступает окисленный гемоглобин, а рецептором
рода на основе математической модели, описан-
служит мембранный белок полосы 3 (B3). Дости-
ной нами ранее [14]. Для учета влияния наноча-
жение равновесия процессов связывания и рас-
стиц серебра в модели сделаны ряд изменений.
пада комплексов на мембране происходит зна-
В новой модели введено упрощение полной
чительно быстрее процессов восстановления
системы гликолиза и пентозофосфатного пути,
окисленных белков, поэтому в модели рассмат-
основанное на условии стационарного состояния
ривается стационарное состояние формирую-
потоков [19]. При определении скорости восста-
щихся комплексов. Количество мембранных
новления NADPH и NADH учитывается скорость
комплексов метгемоглобина и феррилгемоглоби-
транспорта глюкозы через мембранный транс-
на зависит соответственно от количества метге-
портер GLUT1 (мембранный транспортер глюко-
моглобина и феррилгемоглобина в цитоплазме:
k
1
MetHb + B3←⎯⎯⎯MetHb-B3,
k
-1
FerHb + B3⎯⎯k⎯⎯2
FerHb-B3,
←
k-2
f
[B3
0
] ·
k
d
· [MetHb](t)
(3)
[
MetHb - B3](t)
=
,
m
m
f
f
[
FerHb](t)
·
k
d
+
k
d
·
k
d
+
k
d
·
[
MetHb](t)
m
[B3
] ·
k
· [FerHb](t)
0
d
[
FerHb - B3](t)
=
m
m
f
f
[
FerHb](t)
·
k
d
+ k
d
· k
d
+ k
d
·
[
MetHb t)
где [B3] - концентрация доступных для связыва-
Построенная математическая модель является
ния белков полосы 3, [B30] - суммарная концен-
нелинейной и содержит 17 дифференциальных
уравнений. В табл. 1 и 2 приведены эти уравнения
трация белков полосы 3, [MetHb] - концентра-
и их константы. Все константы и начальные усло-
ция метгемоглобина в клетке, [MetHb-B3] - кон-
вия взяты из литературных источников. Выпол-
центрация мембранных комплексов мет-
нен анализ на устойчивость системы. Численное
гемоглобина, [FerHb] - концентрация феррилге-
решение системы выполнено в программе Wol-
моглобина в клетке, [FerHb-B3] - концентрация
fram Mathematica.
мембранных комплексов феррилгемоглобина,
На основе численного моделирования изучено
f - константа диссоциации комплексов ферри-
влияние пероксида водорода на динамику изме-
k
нения мембраносвязанного состояния окислен-
лгемоглобина, km
- константа диссоциации
ных форм гемоглобина при действии разных по-
комплексов метгемоглобина.
вреждающих факторов.
БИОФИЗИКА том 67
№ 5
2022
ЗАЩИТНЫЙ ЭФФЕКТ ПЕРОКСИДА ВОДОРОДА
909
Таблица 1. Реакции и уравнения скорости в модели
Ссыл
№
Реакция и уравнение скорости
Значение констант
ка
Н2О2 (внешн) → Н2О2
P = 6·10-6 м·с-1
2
S
клет
Sклет = 1.09·10-10 м
1
v
1
= -P
· (
[
H
2
O
2
]
- [H
2
O
2
(внешн)]) ·
·
N
клет
[20]
V
V = 10-6 м3
Nклет= 3·107
Н2О2 (внешн) → Н2О2
P = 6·10-6 м·с-1
2
S
клет
Sклет = 1.09·10-10 м2
[20]
v
= -
P
·
(
[
H
O
]
- [H
O
(внешн)])
·
2
2
2
2
2
V
клет
Vклет = 6.3·10-17 м3
Н2О2 + Cat → Н2О + CompI
3
k3 = 6·106 М-1·с-1
[21]
v3 = k3·[Cat]·[Н2О2]
Н2О2 + CompI → Н2О + О2 + Cat
4
k4 = 1.6·107 М-1·с-1
[21]
v4 = k4·[CompI]·[Н2О2]
Gpx
2
2
HO + 2GSH
→
2
2H O + GSSG
[Gpx] =1.4·10-6 M
5
[Gpx]· [GSH] · [H
O
]
K1 = 2.5·10-5 M·с
[22]
2
2
v
5
=
K
·
[
H
O
]
+
K
·
[
GSH
]
K2 =2.4·10-8 M·с
1
2
2
2
2Hb + Н2О2 → 2MetHb + Н2О
6
k6 = 100 М-1·с-1
[21]
v6 = k6·[Hb]·[Н2О2]
MetHb + Н2О2 → FerHb + Н2О
7
k7 =98 М-1·с-1
[23]
v7 = k7·[MetHb]·[Н2О2]
MetHb + cytb5(восст) → Hb + cytb5(окисл)
8
k8 = 6200 М-1·с-1
[24]
v8 = k8·[MetHb]·[cytb5(восст)]
cytb5R
+
k9 = 418 с-1
NADH + cytb5(окисл)
→
NAD
+ cytb5(восст)
[cytb5R] = 7·10-8 М
9
k
9
· [cytb5R] · [NADH] · [cytb5(окисл)]
[24]
v
9
=
KMNADH = 3.1·10-7 M
NADH
cytb5
(
окис
)
(K
M
+
[
NADH
]
) · (
K
M
+
[
cytb5(окисл)
]
)
K
Mcyt b5(окисл) = 1.5·10-5 M
FerHb + 2Asc → MetHb + DHA + Asc
10
k10 = 400 М-1·с-1
[23]
v10 = k10·[FerHb]·[Asc]
DHAR
k11 = 5.27 с-1
DHA + 2GSH
→
Asc + GSSG
[DHAR] = 10-7 М
11
k
· [DHAR] · [DHA] · [GSH]
[25]
11
v
=
KDHA = 2.1·10-4 М
11
[
DHA
]
·
[
GSH
]
+
K
DHA
·
[
GSH
]
+
K
GSH
·
[
DHA
]
KGSH = 3.5·10-3 М
GR
+
GSSG + NADPH
→
NADP
+ 2GSH
[GR] = 1.4·10-6 М
12
[GR] · [GSSG] · [NADPH]
K1 = 2.4·10-8 M·с
[22]
v12=
K
·
NADPH
+
K
·
GSH
K2 = 2.5·10-5 M·с
1
[
]
2
[
]
GLUT1
+
NAD(P)
→
NAD(P)H
+
+
V
max
· ([NAD
] + [NADP
])
Vmax = 0.0207 М·с-1
v
GLUT
=
+
+
⎛
[glc(внешн)] [
glc(внешн)
] - 2 · ([NAD
] + [NADP
])
Kem = 1.7·10-3 М
13
[19]
2 ·
⎜1 +
+
+
⎜
m
m
Kim = 6.9·10-3 М
⎝
K
ex
K
in
α = 0.54
+
+
[glc(внешн) ·([
glc(внешн)] - 2 · ([NAD
] + [NADP
]))⎞
+ α ·
⎟
m m
⎟
K
ex
·
K
in
⎠
БИОФИЗИКА том 67
№ 5
2022
910
ВОЙНАРОВСКИЙ, МАРТИНОВИЧ
Таблица 2. Полная система уравнений в модели
Система уравнений
Начальные значения, М
[Cat]'(t) = - v3 + v4
[Cat](0) = 5.5·10-6
[CompI]'(t) = v3 - v4
[CompI](0) = 5.5·10-6
[H2O2(внешн)]'(t) = - v1
[H2O2(внешн)](0) = (1…1.25)·10-3
[H2O2]'(t) = v2 - v3 - v4 - v5 - v6 - v7
[H2O2](0) = 0
[cytb5(восст)]'(t) = - v8 + v9
[cytb5(восст)](0) = 8.1·10-6
[cytb5(окисл)]'(t) = v8 - v9
[cytb5(окисл)](0) = 0
[MetHb]'(t) = v6 - v7 - v8 + v10
[MetHb](0) = 0
[FerHb]'(t) = v7 - v10
[FerHb](0) = 0
[Hb]'(t) = - v6 + v8
[Hb](0) = 0.01
[Asc]'(t) = - v10 + v11
[Asc](0) = 7.5·10-5
[DHA]'(t) = v10 - v11
[DHA](0) = 0
[GSH]'(t) = 2(- v5 - v11 + v12)
[GSH](0) = 1.5·10-3
[GSSG](0) = 0
[GSSG]'(t) = v5 + v11 - v12
[NADP]'(t) = - vGLUT + v12
[NADP](0) = 0.2·10-6
[NADPH]'(t) = vGLUT - v12
[NADPH](0) = 5·10-5
[NAD]'(t) = - vGLUT + v9
[NAD](0) = 8.9·10-5
[NADH]'(t) = vGLUT - v9
[NADH](0) = 1.5·10-7
МАТЕРИАЛЫ И МЕТОДЫ
длине волны 680 нм при температуре 37°C. По
окончании гемолиза (через 50 мин для наноча-
В экспериментах использовали нитрат серебра
стиц и 20 мин - для нитрата серебра) измеряли
(«ЛенРеактив», Россия) и пероксид водорода
спектры поглощения гемолизата. Изменение ко-
(РУП «Белмедпрепараты», Беларусь). Кровь здо-
личества клеток оценивали по изменению опти-
ровых доноров получали в ГУ «Республиканский
ческой плотности суспензии эритроцитов на дли-
научно-практический центр трансфузиологии и
не волны 680 нм. Осмотический гемолиз прово-
медицинских биотехнологий» (Минск, Бела-
дили путем инкубирования эритроцитов в
русь). Лейкоцитарный слой и плазму крови отде-
растворах с различной концентрацией NaCl (48-
ляли после двукратного центрифугирования при
85 мМ).
1500 об/мин. Спектрофотометрические исследова-
Для определения защитного эффекта клетки
ния эритроцитов проводили в фосфатно-солевом
инкубировали с пероксидом водорода в течение
буфере, содержащем 10 мМ Na2HPO4/KH2PO4,
10 мин до введения гемолизирующего фактора.
137 мМ NaCl, 2.7 мМ KCl, 5 мМ D-глюкозы
Защитный эффект определяли по увеличению
(рН 7.4).
доли негемолизированных эритроцитов (N/N0,
Получение наночастиц проводили с примене-
где N0 - начальное количество эритроцитов в сус-
нием методов «зеленой химии» [18]. Раствор нит-
пензии, N - количество клеток после гемолиза) в
рата серебра в концентрации 1 мМ смешивали с
присутствии окислителя.
водным экстрактом растений в соотношении 9 : 1
Окисленную форму гемоглобина на мембране
при pH 8.0 и инкубировали в течение 1 ч при ком-
эритроцитов определяли спектрофотометриче-
натной температуре. Окончание синтеза реги-
ски через 10 мин инкубирования с пероксидом
стрировали по появлению пика на длине волны
водорода в концентрации 250 мкМ после осмоти-
400 нм, обусловленного поверхностным плаз-
ческого разрушения клеток. Продукты гемолиза
монным резонансом. Определение размеров на-
выделяли центрифугированием в течение 30 мин
ночастиц проводили спектрофотометрическим
при 7000 об/мин. Далее записывали спектр по-
методом [26]. Количественные изменения нано-
глощения гемолизата на длинах волн 400-450 нм.
частиц в экспериментах выражали через концен-
Измерения проводили с использованием спек-
трацию ионов серебра ([Ag0]), необходимую для
трофлуориметра CM-2203 и спектрофотометра
их синтеза.
UV-VIS РВ 2201 (Solar, Республика Беларусь).
Гемолиз инициировали путем добавления на-
Результаты представлены как средние значе-
ночастиц серебра или нитрата серебра к суспен-
ния ± стандартное отклонение среднего для
зии эритроцитов. Кинетику гемолиза эритроци-
трех-пяти независимых экспериментов. Стати-
тов измеряли путем регистрации оптической
стический анализ проводили с использованием
плотности клеточной суспензии (30 млн/мл) на
программы Microsoft Excel. Достоверность значе-
БИОФИЗИКА том 67
№ 5
2022
ЗАЩИТНЫЙ ЭФФЕКТ ПЕРОКСИДА ВОДОРОДА
911
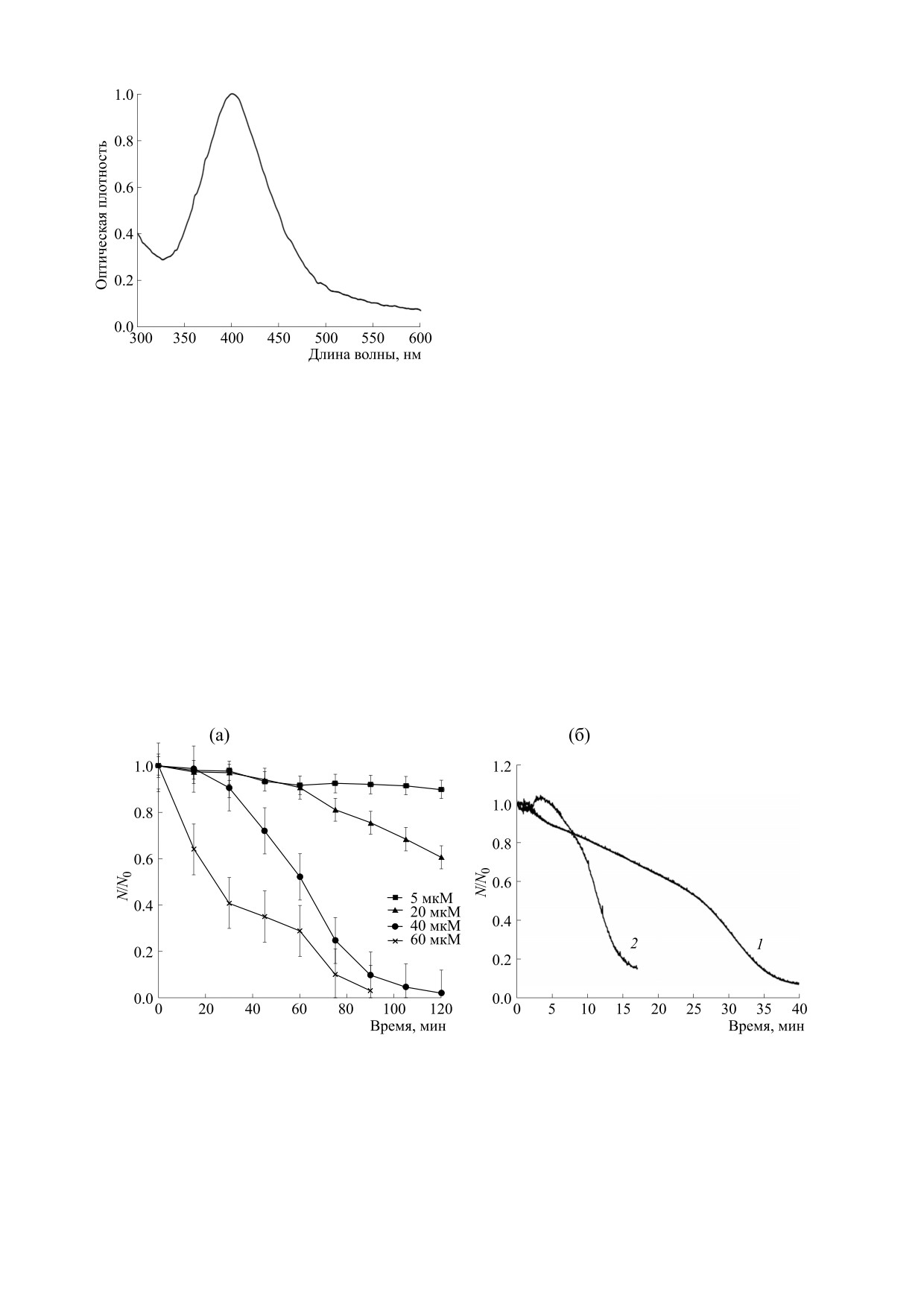
400 нм и шириной менее 100 нм позволяет сделать
вывод о том, что частицы мало различаются по
размеру и имеют диаметр в среднем 20 нм. Отсут-
ствие дополнительных пиков поглощения гово-
рит о доминировании сферических наночастиц.
В результате исследований показано, что по-
лученные наночастицы серебра индуцируют ге-
молиз эритроцитов, скорость которого зависит от
суммарной концентрации серебра и содержания
ионов в растворе. На рис. 2а представлена кине-
тика гемолиза эритроцитов наночастицами при
концентрации серебра от 5 до 60 мкМ. Как видно
из представленных данных, скорость гемолиза
увеличивается с ростом концентрации серебра,
используемого для синтеза наночастиц. При оди-
наковой концентрации серебра гемолиз эритро-
цитов нитратом серебра протекает в два раза
быстрее, чем наночастицами (рис. 2б).
Рис. 1. Спектр поглощения наночастиц серебра. Кон-
центрация серебра 40 мкМ.
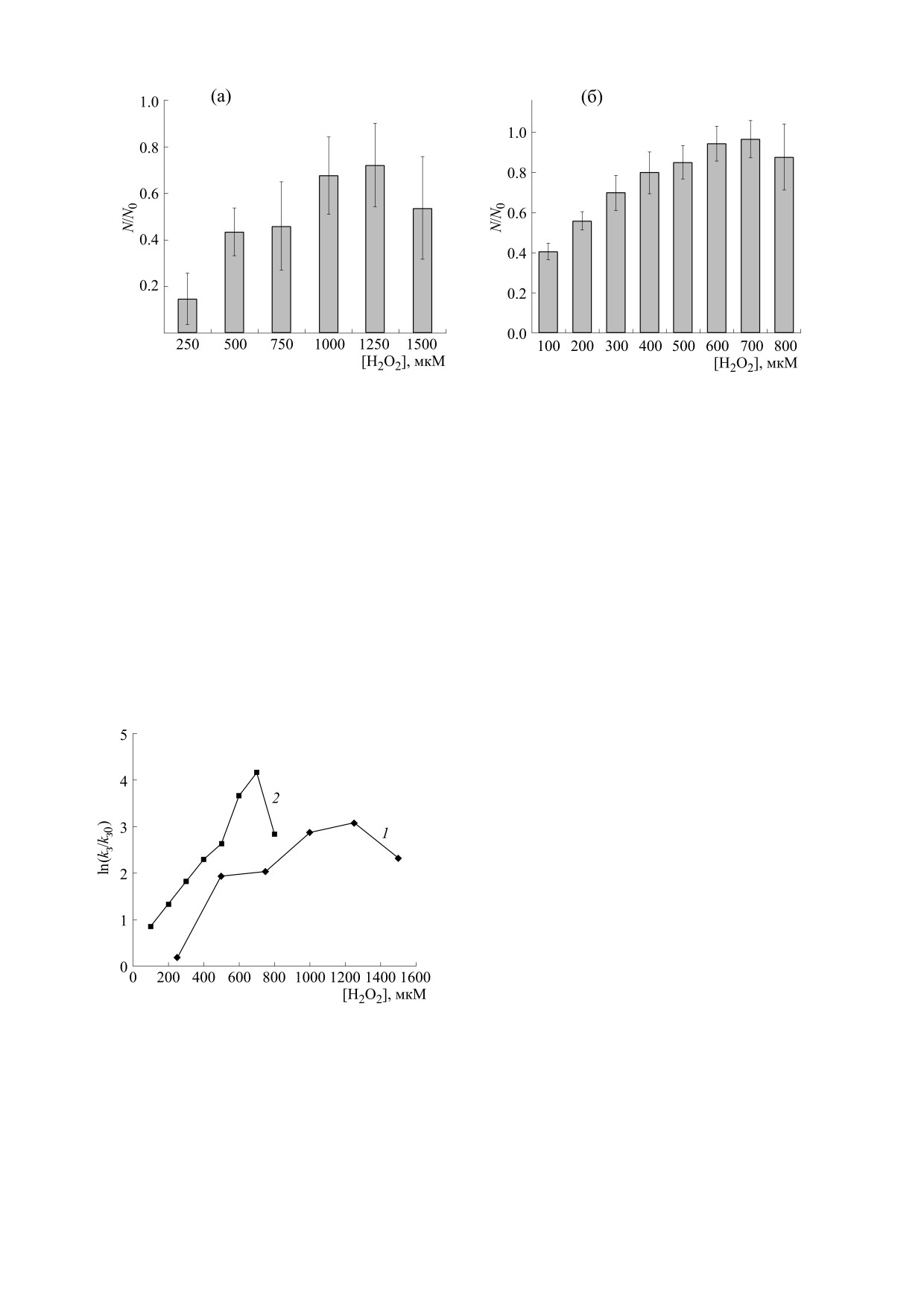
Предварительное инкубирование эритроци-
тов с пероксидом водорода приводит к снижению
доли гемолизированных клеток при разрушении
ний определяли с помощью t-критерия Стьюден-
наночастицами серебра. Защитный эффект про-
та, принимая различия достоверными при уровне
является при концентрации пероксида водорода
значимости р < 0.05.
в диапазоне от 250 до 1500 мкМ. Доля негемоли-
зированых клеток при этом повышается до
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
0.8 (рис. 3а). При разрушении эритроцитов нит-
ратом серебра защитный эффект пероксида водо-
Оптические свойства наночастиц серебра ха-
рода наблюдается при более низких концентра-
рактеризуются наличием в области видимого све-
циях, а доля негемолизированных клеток дости-
та ярко выраженной резонансной полосы, назы-
гает единицы (рис. 3б).
ваемой полосой поверхностного плазмонного ре-
На основе данных по гемолизу эритроцитов
зонанса, положение которой зависит от размера и
определены значения коэффициентов разруше-
формы наночастиц [26]. На рис. 1 показан спектр
ния kр и защиты kз при разных концентрациях пе-
поглощения синтезированных наночастиц сереб-
ра. Положение основного максимума на длине
роксида водорода. Коэффициент kр характеризу-
Рис. 2. (а) - Кинетика гемолиза эритроцитов наночастицами при разных концентрациях серебра; (б) - кинетические
кривые гемолиза эритроцитов наночастицами (кривая 1) и нитратом серебра (кривая 2) при концентрации 100 мкМ.
N/N0 - доля негемолизированных эритроцитов, где N0 - начальное количество эритроцитов в суспензии, N - количество
клеток после гемолиза.
БИОФИЗИКА том 67
№ 5
2022
912
ВОЙНАРОВСКИЙ, МАРТИНОВИЧ
Рис. 3. Зависимость доли негемолизированных эритроцитов от концентрации внеклеточного пероксида водорода при
гемолизе наночастицами серебра (а) и нитратом серебра (б). N/N0 - доля негемолизированных эритроцитов, где N0 -
начальное количество эритроцитов в суспензии, N - количество клеток после гемолиза.
ет токсическое действие ионов серебра и его зна-
представленных на рис. 4 данных, зависимость
чение не зависит от концентрации окислителя,
значений kз от концентрации пероксида водорода
т.е. остается постоянным. Значение коэффици-
является гормезисной: величина коэффициента
ента kз зависит от количества мембранных ком-
защиты повышается при низких концентрациях
плексов метгемоглобина, и, следовательно, зави-
окислителя и снижается при высоких. Различия в
сит от концентрации внеклеточного пероксида
значениях коэффициента защиты клеток при
действии разных гемолизирующих факторов обу-
водорода, при действии которого изменяется ко-
словлены, вероятно, изменением соотношения
личество метгемоглобина и его мембраносвязан-
окисленных форм гемоглобина и их мембрано-
ной формы. Зависимости значений коэффициен-
связанных форм с течением времени.
та защиты от концентрации пероксида водорода
при разрушении наночастицами серебра и нитра-
Зависимость кинетики связывания окислен-
том серебра показаны на рис. 4. Как видно из
ных форм гемоглобина с мембраной эритроцитов
человека от внутриклеточных и внеклеточных
условий изучали на основе предложенной мате-
матической модели. В рамках модели считается,
что внеклеточный пероксид водорода посред-
ством диффузии через мембрану поступает
внутрь клетки, где утилизируется в реакциях с ге-
моглобином и в реакциях с участием каталазы и
глутатионпероксидазы. С ростом начальной кон-
центрации пероксида водорода скорость его диф-
фузии и разложения также увеличивается. При
концентрациях ниже 1.5 мМ и количестве клеток
30 млн время утилизации внеклеточного перок-
сида водорода не превышает 10 мин. Таким обра-
зом, после периода предварительного инкубиро-
вания (10 мин) внеклеточное взаимодействие
между окислителем и наночастицами исключает-
ся, а в клетке остаются только продукты реакций
окисления.
Окисление гемоглобина приводит к образова-
Рис. 4. Зависимость коэффициента защиты от концен-
нию метгемоглобина и феррилгемоглобина, ко-
трации пероксида водорода при гемолизе наночастица-
торые обратимо связываются с компонентами
ми серебра (кривая 1) и нитратом серебра (кривая 2);
эритроцитарной мембраны. Количество мем-
kз - коэффициент защиты при действии пероксида во-
дорода, kз0 - коэффициент защиты без пероксида водо-
бранных комплексов метгемоглобина и феррил-
рода.
гемоглобина при этом зависит от количества
БИОФИЗИКА том 67
№ 5
2022
ЗАЩИТНЫЙ ЭФФЕКТ ПЕРОКСИДА ВОДОРОДА
913
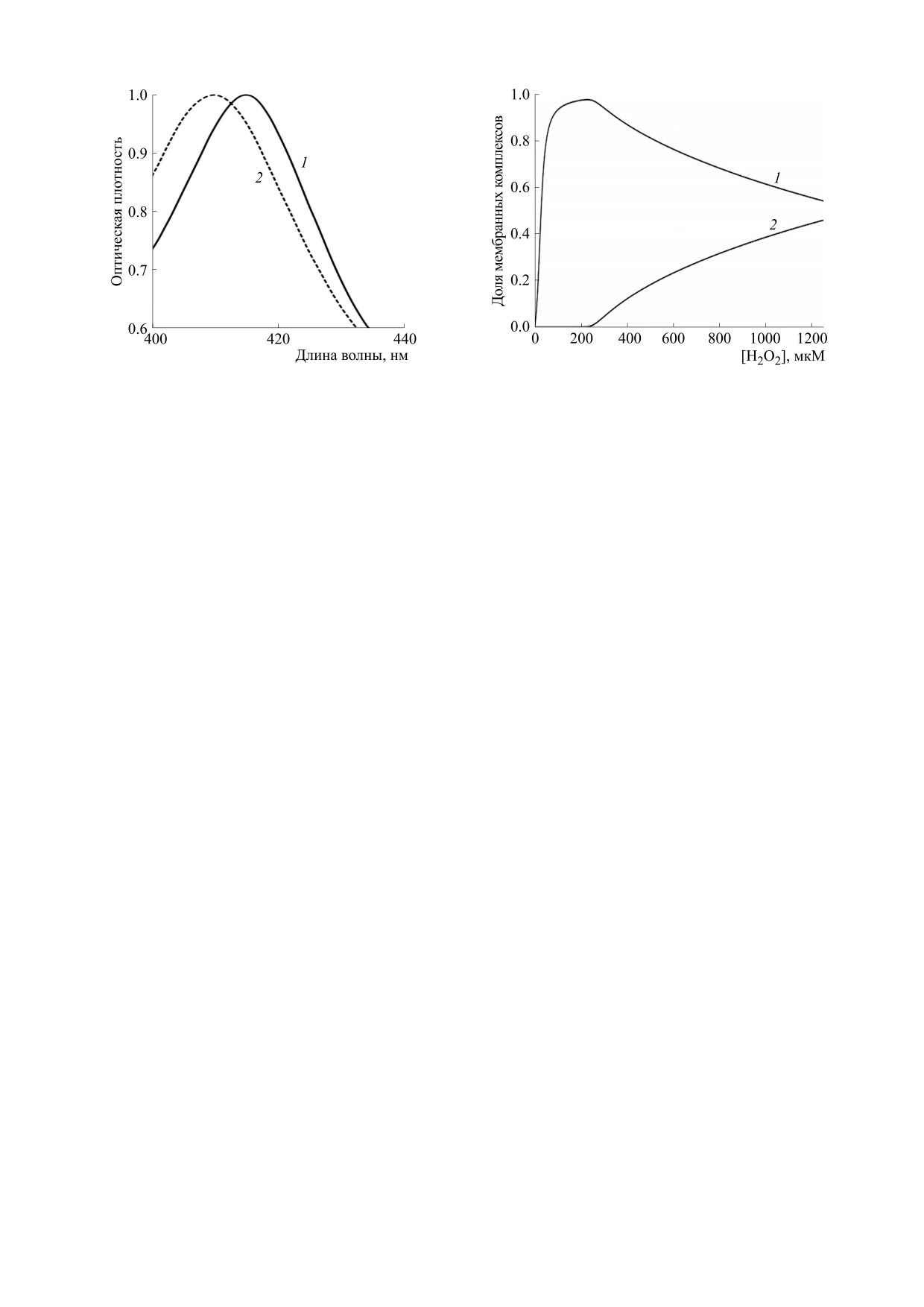
Рис. 5. Спектр поглощения гемолизата эритроцитов в
Рис. 6. Зависимость доли мембранных комплексов мет-
контроле (кривая 1) и гемолизата эритроцитов, проин-
гемоглобина (кривая
1)
и феррилгемоглобина
кубированных с пероксидом водорода в концентрации
(кривая 2) от концентрации внеклеточного пероксида
250 мкМ (кривая 2).
водорода.
соответствующих белков в цитоплазме. Восста-
болических условий. На рис. 6 представлены за-
новление окисленных форм гемоглобина осу-
висимости количества мембранных комплексов
ществляется компонентами антиокислительной
метгемоглобина и феррилгемоглобина от кон-
системы эритроцитов. При уменьшении содер-
центрации внеклеточного пероксида водорода.
жания антиоксидантов восстановление замедля-
При низкой концентрации пероксида водорода в
ется и происходит накопление окисленных форм
клетке, как видно из представленных на рис. 6
белка. Согласно расчетам данный эффект реали-
данных, преимущественно образуются мембран-
зуется при концентрации внеклеточного перок-
ные комплексы метгемоглобина. Снижение пула
сида водорода выше 300 мкМ. На рис. 5 представ-
антиоксидантов в клетке и увеличение концен-
лен спектр поглощения гемоглобиновых ком-
трации пероксида водорода приводит к росту до-
плексов после осмотического разрушения
ли мембранных комплексов феррилгемоглобина.
эритроцитов, проинкубированных с пероксидом
Пероксид водорода в высоких концентрациях
водорода в концентрации 250 мкМ. В спектре
приводит к большему накоплению окисленных
белковых комплексов гемолизата обработанных
форм гемоглобина в клетке. С течением времени
пероксидом водорода клеток наблюдается сме-
общее количество окисленного гемоглобина
щение максимума с 415 нм к 405 нм, что является
уменьшается благодаря ферментативному и не-
признаком накопления метгемоглобина, а не ок-
ферментативному восстановлению. На рис.
7
сигемоглобина на мембране.
представлены результаты численных экспери-
ментов по изменению количества образованного
В рамках предложенной модели адаптацион-
метгемоглобина и феррилгемоглобина в клетке
ного механизма степень увеличения структурной
при концентрации пероксида водорода 400 и
стабильности мембраны определяется количе-
600 мкМ. Из представленных данных видно, что
ством образованных комплексов
«мембрана-
со временем концентрация окисленных форм ге-
метгемоглобин» и
«мембрана-феррилгемогло-
моглобина снижается в связи с восстановлением.
бин». Связывание метгемоглобина с мембраной
Таким образом, повышение защитных свойств
приводит к увеличению структурной стабильно-
клеток, индуцированное пероксидом водорода,
сти мембраны, при образовании комплексов
будет уменьшаться со временем.
«мембрана-феррилгемоглобин», напротив, про-
исходит ускорение процессов перекисного окис-
Для более продолжительного сохранения вы-
ления липидов и нарушение взаимодействия
сокой концентрации мембранных комплексов
цитоскелета с мембраной. Количество образо-
метгемоглобина, необходим пероксид водорода в
ванных комплексов метгемоглобина и феррилге-
более высоких концентрациях. В результате при
моглобина зависит от концентрации внеклеточ-
увеличении времени разрушения эритроцитов
ного пероксида водорода и времени инкубирова-
после воздействия пероксида водорода, положе-
ния, числа клеток в растворе, состояния
ние максимума гормезиса смещается в сторону
антиокислительной системы эритроцитов, мета-
больших концентраций окислителя. При разру-
болической активности клеток и внешних мета-
шении эритроцитов наночастицами серебра, бо-
БИОФИЗИКА том 67
№ 5
2022
914
ВОЙНАРОВСКИЙ, МАРТИНОВИЧ
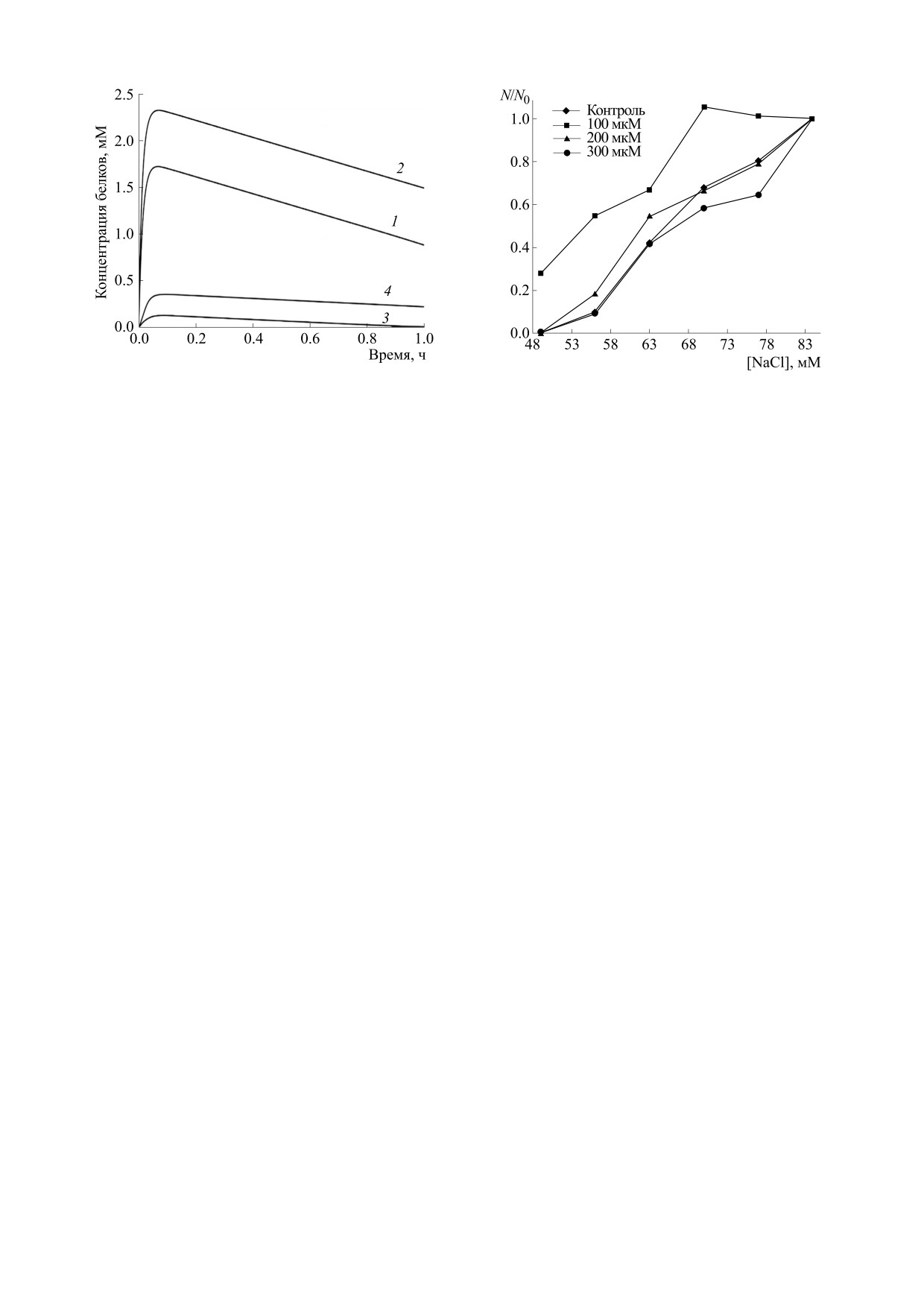
Рис. 7. Зависимость индуцированного перокидом водо-
Рис. 8. Влияние пероксида водорода на зависимость до-
рода изменения концентрации метгемоглобина (кри-
ли негемолизированных эритроцитов от концентрации
вые 1 и 2) и феррилгемоглобина (кривые 3 и 4) от време-
хлорида натрия в растворе. N/N0 - доля негемолизиро-
ни. Концентрация пероксида водорода 400 мкМ (кри-
ванных эритроцитов, где N0 - начальное количество
вые 2 и 4) и 600 мкМ (кривые 1 и 3).
эритроцитов в суспензии, N - количество клеток после
гемолиза.
лее длительном в сравнении с гемолизом нитра-
том серебра, максимум кривой гормезиса наблю-
ЗАКЛЮЧЕНИЕ
дается при концентрации пероксида водорода
1250 мкМ (рис. 3а), тогда как максимум кривой
Ключевым этапом создания эффективных
гормезиса при разрушении нитратом серебра -
здоровьесберегающих технологий служит пони-
при 700 мкМ (рис. 3б). Сокращение времени ге-
мание механизмов адаптации на молекулярно-
молиза, наоборот, приводит к смещению макси-
клеточном уровне. В настоящей работе на основе
мума гормезиса к более низким концентрациям
численного моделирования и спектрофотометри-
окислителя. Нами показано, что при осмотиче-
ческого анализа изучены механизмы регуляции
адаптации эритроцитов пероксидом водорода
ском гемолизе, когда время разрушения состав-
при гемолизе наночастицами серебра.
ляет меньше минуты, защитный эффект достига-
ет максимума при концентрации пероксида водо-
Показано, что наночастицы серебра индуци-
рода 100 мкМ (рис. 8).
руют гемолиз эритроцитов, скорость которого за-
висит от общей концентрации серебра и содержа-
Следует отметить, что скорость повреждения
ния ионов в растворе. Гемолиз эритроцитов нит-
белков при действии наночастиц серебра и нит-
ратам серебра протекает в два раза быстрее, чем
рата серебра также различается. В растворе окси-
наночастицами.
гемоглобина при соотношении концентраций
[Hb] : [AgNO3] = 1 : 10 нитрат серебра вызывает
Установлено, что пероксид водорода позволя-
ет снизить долю гемолизированных клеток при
разрушение белка и накопление агрегатов в тече-
разрушении эритроцитов наночастицами серебра
ние 1 ч, что приводит к увеличению оптической
и нитратом серебра. В рамках предложенной мо-
плотности на длине волны 600 нм в спектре по-
дели защита клеток при действии пероксида во-
глощения белка (рис. 9а). На рис. 9б представлен
дорода обусловлена окислением гемоглобина,
спектр поглощения раствора оксигемоглобина и
что приводит к образованию мембраносвязаного
его изменение при введении наночастиц. Как
состояния окисленных форм белка. Окисление
видно из представленных данных, менее интен-
гемоглобина оказывает разнонаправленное дей-
сивное взаимодействие наночастиц серебра с ок-
ствие на устойчивость клеток: обратимое связы-
сигемоглобином приводит к образованию агрега-
вание метгемоглобина с мембраной приводит к
тов за 3 ч. Таким образом, более медленное по-
увеличению структурной стабильности мембра-
вреждение клеток и белков при действии
ны, увеличение концентрации феррилгемоглоби-
наночастиц серебра приводит к тому, что для со-
на и его связывание с компонентами мембраны
хранения защитных свойств клеток необходимы
приводит к усилению процессов перекисного
более высокие концентрации окислителя, чем
окисления липидов и нарушению взаимодей-
при действии нитрата серебра.
ствия цитоскелета с мембраной.
БИОФИЗИКА том 67
№ 5
2022
ЗАЩИТНЫЙ ЭФФЕКТ ПЕРОКСИДА ВОДОРОДА
915
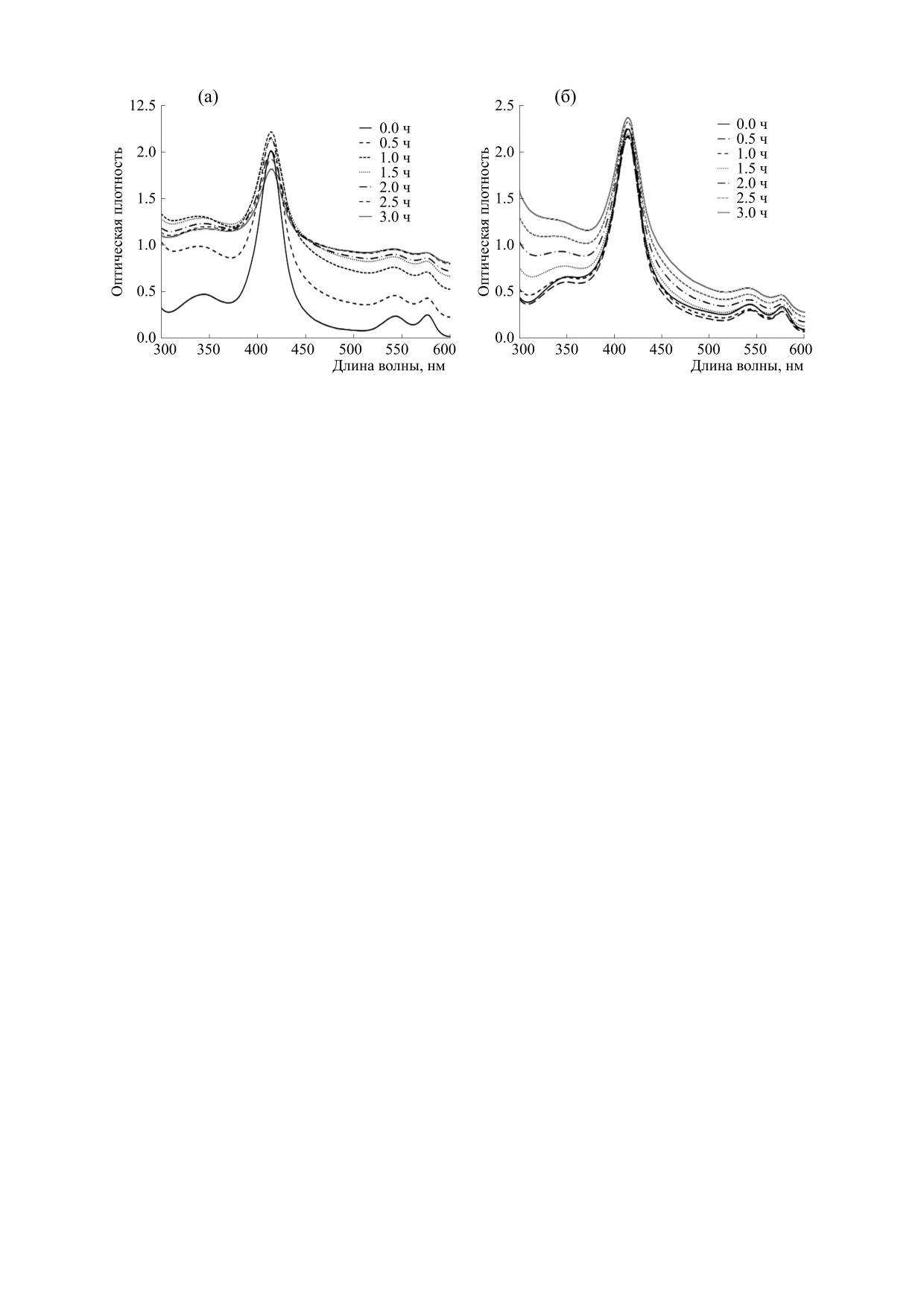
Рис. 9. Изменение спектра поглощения раствора оксигемоглобина во времени при введении нитрата серебра (а) и
наночастиц серебра (б).
Показано, что область гормезиса зависит от
СПИСОК ЛИТЕРАТУРЫ
времени разрушения клеток при действии повре-
1.
C. López-Otín and G. Kroemer, Cell, 184 (1), 33-63
ждающего фактора. Максимум кривой гормезиса
(2021).
при разрушении наночастицами серебра наблю-
2.
Г. Г. Мартинович, Активные формы кислорода в ре-
дается при концентрации пероксида водорода
гуляции функций и свойств клеток: явления и меха-
1250 мкМ, а при разрушении нитратом серебра -
низмы (БГУ, Минск, 2021).
при 700 мкМ. На основе численного моделирова-
3.
H. Sies and D. P. Jones, Nat. Rev. Mol. Cell Biol., 21
ния установлено, что зависимость максимума
(3), 1 (2020).
кривой гормезиса от концентрации внеклеточно-
4.
Н. К. Зенков, А. В. Чечушков, П. М. Кожин и др.,
го пероксида водорода и времени инкубирования
Биохимия, 82 (5), 749 (2017).
обусловлена динамическим характером цито-
5.
Г. Г. Мартинович, И. В. Мартинович, А. В. Вче-
плазматических механизмов, регулирующих со-
рашняя и др., Биофизика, 65 (6), 1081 (2020).
отношение мембранных комплексов метгемогло-
6.
A. V. Ulasov, A. A. Rosenkranz, G. P. Georgiev, et al.,
бинов и феррилгемоглобинов. Таким образом,
Life Sci., 291, 120111 (2021).
динамика процессов связывания метгемоглобина
7.
О. В. Космачевская, Э. И. Насыбуллина, В. Н. Блин-
и феррилгемоглобина с мембраной играет ключе-
дарь и др., Прикладная биохимия и микробиоло-
вую роль в способности эритроцитов к защите от
гия, 55 (2), 107 (2019).
разрушения наночастицами серебра и другими
8.
N. Arashiki, N. Kimata, S. Manno, et al., Biochemis-
повреждающими факторами.
try, 52, 5760 (2013).
9.
E. M. Welbourn, M. T. Wilson, A. Yusof, et al., Free
Radic. Biol. Med., 103, 95 (2017).
ФИНАНСИРОВАНИЕ РАБОТЫ
10.
L. M. Snyder, N. L. Fortier, J. Trainor, et al., J. Clin.
Работа выполнена при частичной финансовой
Invest., 76, 1971 (1985).
поддержке Белорусского республиканского фон-
11.
S. A. Mendanha, J. L. V. Anjos, A. H. M. Silva, et al.,
да фундаментальных исследований (грант
Braz. J. Med. Biol. Res., 45, 473 (2012).
№ Б22-045).
12.
A. Kinoshita, Y. Nakayama, T. Kitayama, et al., FEBS
Journal, 274, 1449 (2007).
13.
P. Jarolim, M. Lahav, S. C. Liu, et al., Blood, 76, 2125
КОНФЛИКТ ИНТЕРЕСОВ
(1990).
Авторы заявляют об отсутствии конфликта
14.
В. В. Войнаровский и Г. Г. Мартинович, Биол.
интересов.
мембраны, 39 (1), 28 (2022).
15.
O. Gherasim, R. A. Puiu, A. C. Birca, et al., Nanoma-
terials, 10 (11), 2318 (2020).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
16.
C. Liao, Y. Li, and S. C. Tjong, Int. J. Mol. Sci., 20,
Настоящая статья не содержит описания ис-
449 (2019).
следований с участием людей и животных в каче-
17.
I. X. Yin, J. Zhang, I. S. Zhao, et al., Int. J. Nanomed-
стве объектов.
icine, 15, 2555 (2020).
БИОФИЗИКА том 67
№ 5
2022
916
ВОЙНАРОВСКИЙ, МАРТИНОВИЧ
18. D. He, A. M. Jones, S. Garg, et al., J. Phys. Chem. C,
23. L. Gebicka and E. Banasiak, Acta Biochim. Pol., 56
115, 5461 (2011).
(3), 509 (2009).
19. H. Holzhütter, Eur. J. Biochem., 271, 2905 (2004).
24. A. Kinoshita, Y. Nakayama, T. Kitayama, et al., FEBS
20. Г. Г. Мартинович и С. Н. Черенкевич, Биомед. хи-
Journal, 274, 1449 (2007).
мия, 51 (6), 626 (2005).
25. X. D. Peng, M. P. Washburn, G. P. Sun et al., Biochem.
21. R. M. Johnson, G. Jr. Goyette, Y. Ravindranath, et al.,
Biophys. Res. Comm., 221 (1), 117 (1996).
Free Radic. Biol. Med., 39, 1407 (2005).
22. F. Orrico, M. N. Möller, A. Cassina, et al., Free Radic.
26. Ю. А. Крутяков, А. А. Кудринский, А. Ю. Оленин
Biol. Med., 121, 231 (2018).
и др., Успехи химии, 77 (3), 242 (2008).
Protective Effect of Hydrogen Peroxide during Erythrocyte Hemolysis
by Silver Nanoparticles
V.V. Voinarovski and G.G. Martinovich
Belarusian State University, prosp. Nezavisimosti 4, Minsk, 220030, Republic of Belarus
Using numerical modeling and spectrophotometric analysis, mechanisms of regulation of erythrocyte adap-
tation by hydrogen peroxide during hemolysis by silver nanoparticles were studied. It was shown that silver
nanoparticles induce hemolysis of erythrocytes, the rate of which depends on the total concentration of silver
and the content of ions in the solution. Hemolysis of erythrocytes by silver nitrate proceeds twice as fast as by
nanoparticles. It was found that hydrogen peroxide increases the structural stability of erythrocytes during
hemolysis by silver nanoparticles and silver nitrate. The concentration range for hydrogen peroxide, within
which the proportion of non-hemolyzed cells (hormesis region) increases, depends on the time of cell de-
struction due to a damaging factor. The maximum hormetic effect after treatment of cells with silver nanopar-
ticles is observed at the hydrogen peroxide concentration of 1250 μM, and after treatment of cells with silver
nitrate, at 700 μM. Based on numerical modeling, it was established that the maximum hormetic effect de-
pends on the concentration of extracellular hydrogen peroxide and the incubation time due to the dynamics
of the cytoplasmic mechanisms that regulate the ratio of membrane complexes of methemoglobin and ferryl-
hemoglobin.
Keywords: hormesis, adaptation, hydrogen peroxide, erythrocytes, methemoglobin, silver nanoparticles
БИОФИЗИКА том 67
№ 5
2022