БИОФИЗИКА, 2022, том 67, № 5, с. 917-925
БИОФИЗИКА КЛЕТКИ
УДК 577.23
ДЕЙСТВИЕ АСТАКСАНТИНА НА ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ
МИТОХОНДРИЙ МОЗГА КРЫС ПРИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
© 2022 г. Р.Р. Крестинин*, Ю.Л. Бабурина*, И.В. Одинокова*,
Л.Д. Сотникова*, О.В. Крестинина*, #
*Институт теоретической и экспериментальной биофизики РАН,
Институтская ул., 3, Пущино Московской области, 142290, Россия
#E-mail: ovkres@mail.ru
Поступила в редакцию 15.06.2022 г.
После доработки 07.07.2022 г.
Принята к публикации 18.07.2022 г.
Изучено влияние астаксантина на функциональное состояние митохондрий мозга у крыс с сердеч-
ной недостаточностью. Сердечная недостаточность была достигнута путем введения изопротерено-
ла крысам подкожно. Хроническое введение астаксантина осуществляли перорально. Обнаружено,
что инъекция изопротеренола ухудшала функциональное состояние митохондрий мозга крыс, в то
время как введение астаксантина снимало эффект изопротеренола и функциональное состояние
митохондрий у крыс с сердечной недостаточностью улучшалось. При этом дыхательный контроль
митохондрий мозга крыс повышался. Содержание основных субъединиц, таких как альфа-субъеди-
ница комплекса V, митохондриально кодируемая цитохром с-оксидаза I комплекса IV, фактор сбор-
ки комплекса убихиноноксидоредуктазы 8 комплекса I, сукцинатдегидрогеназный комплекс II, ци-
тохром b-c1 комплекс субъединицы 2 комплекса III увеличивалось. Изопротеренол ускорял Са2+-
индуцированное набухание митохондрий, тогда как астаксантин этот параметр снижал. Астаксан-
тин оказывал защитное действие на митохондрии.
Ключевые слова: сердечная недостаточность, митохондрии мозга крыс, астаксантин, митохондриаль-
ная дисфункция, окислительный стресс.
DOI: 10.31857/S0006302922050088, EDN: JIJTXD
ся одной из причин возникновения различных
Митохондрии считаются важными клеточны-
заболеваний у человека, таких как метаболиче-
ми органеллами потому что более 90% энергии,
ский синдром и нейродегенеративные, сердечно-
которая идет на многочисленные процессы, про-
сосудистые и воспалительные заболевания [1].
исходящие в клетке, производится именно мито-
хондриями. Кроме того, митохондрии принима-
Снизить окислительный стресс способны анти-
оксиданты [2]. Существуют антиоксиданты, ко-
ют участие в заболеваниях различной этиологии.
торые вырабатываются организмом человека, и
Поддержание структурной и функциональной
целостности митохондрий - важнейшая пред-
те, которые поступление которых возможно толь-
посылка для нормальной функции клетки. Ми-
ко извне, например, с продуктами питания. Под
тохондрии являются основным источником
воздействием различных факторов, таких как за-
грязнение атмосферы, травмы, стресс и других,
активных форм кислорода, дисбаланс которых в
организме приводит к нарушению функциониро-
количество антиоксидантов, вырабатываемых в
вания митохондрий т.е. к митохондриальной дис-
организме уменьшается, это может привести к
функции. В свою очередь, митохондриальная
возникновению различных заболеваний. Одним
дисфункция может вызывать окислительный
из интересных для исследования антиоксидантов
стресс, что приводит к возникновению различ-
является астаксантин, представляющий собой
ных заболеваний. Окислительный стресс являет-
вещество красного цвета. Он принадлежит к се-
мейству каротиноидов, подклассу ксантофилов;
Сокращения: ИЗО - изопротеренол, ММК - митохондрии
обладает сильной антиоксидантной способно-
мозга крысы, ЛДГ - лактатдегидрогеназа, GAPDH - гли- стью и может поглощать синглетный кислород и
дриально кодируемая цитохром с-оксидаза I комплекса IV, свободные радикалы [3]. Большое количество
CIII-UQCRC2 - цитохром b-c1-комплекс субъединицы 2
астаксантина содержится в водоросли Hematococ-
комплекса III, ДК - дыхательный контроль.
cus pluvialis, кроме того он встречается в дрожжах
917
918
КРЕСТИНИН и др.
Рис. 1. Химическая структура астаксантина.
и морских животных, таких как лосось, форель,
МАТЕРИАЛЫ И МЕТОДЫ
креветки и омары. Структурно молекула астак-
Подготовка животных к эксперименту. В экспе-
сантина представляет собой длинный полиено-
рименте были использованы 16 крыс-самцов ли-
вый скелет с полярными иононовыми кольцами
нии Wistar, массой 240-250 г (возраст два месяца).
на концах (рис. 1). Наличие полярных гидрок-
Животных содержали индивидуально в помеще-
сильных и карбонилсодержащих иононовых ко-
нии с регулируемой температурой (22°C) и кор-
лец наделяет его более высокой антиоксидантной
мили стандартной диетой с полным доступом к
способностью по сравнению с другими каротино-
воде и пище. Для экспериментов крыс разделили
идами [4]. Астаксантин имеет уникальную моле-
на четыре группы (по четыре крысы в каждой
кулярную структуру, которая позволяет ему оста-
группе). Первая группа была контрольной, кры-
ваться как внутри, так и вне клеточной мембраны
сам второй группы вводили перорально раство-
[5]. Известно, что астаксантин значительно
ренный в оливковом масле астаксантин (Natural,
ослабляет митохондриальную дисфункцию, свя-
Китай) в дозе 150 мг/кг в течение двух недель.
занную с ишемическим повреждением миокарда,
Крысам третьей группы для индукции сердечной
может снижать окислительный стресс
[6] и
недостаточности делали инъекцию растворен-
предотвращать развитие сердечно-сосудистых за-
ным в воде ИЗО (100 мг/кг) дважды с интервалом
болеваний [7-9].
24 ч. Крысам четвертой группы вводили астак-
сантин (150 мг/кг) в течение двух недель. Живот-
Сердечная недостаточность приводит к умень-
ные первой и третьей групп получали равное ко-
шению кровотока из-за снижения эффективно-
личество оливкового масла. Через две недели
сти сердечной мышцы [10]. У пациентов с сердеч-
крысам четвертой группы делали инъекцию ИЗО
ной недостаточностью были обнаружены как
дважды с интервалом в 24 ч [14, 15], а крысам пер-
анатомические, так и функциональные повре-
вой и второй групп вводили физиологический
ждения головного мозга [11]. Причиной может
раствор. Митохондрии выделяли из мозга крыс
быть недостаточное снабжение кислородом орга-
каждой экспериментальной группы.
низма, в том числе головного мозга. Исследова-
Приготовление тканевых лизатов. От левого
ния, проведенные авторами работы [12], показа-
желудочка сердца отрезали 6-7 мг ткани. К ку-
ли, что астаксантин улучшает обучение и умень-
сочку ткани сердца добавляли RIPA-буфер с кок-
шает ослабление памяти и повреждение
тейлем протеаз (4°С), гомогенизировали и пере-
нейронов. Его применение увеличивало количе-
мешивали на орбитальном шейкере в течении 2 ч
ство пирамидных нейронов гиппокампа и восста-
при температуре 4°С. Полученные образцы цен-
навливало нормальную морфологию нейронов.
трифугировали при 10000 g в течение 20 мин при
Изопротеренол (ИЗО) — неселективный аго-
4°С. Концентрацию белка в тканевых лизатах
нист бета-адренорецепторов. Введение ИЗО
определяли по методу Брэдфорда, она составляла
представляет собой модель, имитирующую
2 мг/мл.
стресс-индуцированные повреждения в различ-
Выделение митохондрий мозга крыс. Мозг крыс
ных сердечных патологиях [13]. Целью настоя-
быстро (в течение 30 с) извлекали и помещали в
щей работы было исследовать влияние астаксан-
раствор, содержащий 320 мМ сахарозы, 0.5 мМ
тина на функциональное состояние митохондрий
ЭДТА, 0.5 мМ ЭГТА, 0.02% бычьего сывороточ-
мозга крыс (ММК) с сердечной недостаточно-
ного альбумина (фракция V, не содержащая жир-
стью. Сердечная недостаточность была вызвана
ных кислот) и 10 мМ трис-HCl, pH 7.4. Ткань моз-
инъекцией ИЗО модели, признанной в междуна-
га гомогенизировали в стеклянном гомогенизато-
родном сообществе и успешно применяемой в
ре; отношение мозговой ткани к среде выделения
нашей лаборатории [14, 15]. Были исследованы
составляло 1 : 10 (масса/объем). Гомогенат цен-
дыхательные активности в ММК, изменение ос-
трифугировали при 2000 g в течение 3 мин. Не-
новных субъединиц комплексов дыхательной це-
очищенный митохондриальный осадок получали
пи и набухание ММК.
путем центрифугирования полученного суперна-
БИОФИЗИКА том 67
№ 5
2022
ДЕЙСТВИЕ АСТАКСАНТИНА НА ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕЕ МИТОХОНДРИЙ
919
танта при 12500 g в течение 10 мин. Затем мито-
(0.2 мкм) методом вестерн-блоттинга. Изменения
хондрии очищали в градиенте Перколла (3-10-
в уровнях субъединиц электронно-транспортной
15-24%). Несинаптические митохондрии мозга
цепи определяли с помощью коктейля антител
суспендировали в растворе, содержащем 320 мМ
Total Oxphos Rodent WB Antibody Cocktail (ab
сахарозы и 10 мМ трис-HCl, pH 7.4, центрифуги-
110413, Abcam, Великобритания). Коктейль анти-
ровали при 11500 g в течение 10 мин и ресуспенди-
тел Oxphos состоит из альфа-субъединицы ком-
ровали в том же буфере. Все процедуры проводи-
плекса V (CV-ATP5A, 55 кДа), цитохром b-c1-
ли при 4°С [16]. Концентрацию белка определяли
комплекса субъединицы 2 комплекса III (CIII-
по методу Бредфорда (Bio-Rad Protein assay; Bio-
UQCRC2, 48 кДа), митохондриально кодируемой
Rad, Германия), она составляла 25-30 мг/мл.
цитохром с-оксидазы I комплекса IV (CIV-MT-
CO1, 40 кДа), сукцинатдегидрогеназного ком-
Измерение дыхательной активности митохон-
плекса II (CII-SDHB, 30 кДа), фактора сборки
дрий. Митохондрии (1 мг белка/мл) инкубирова-
комплекса убихиноноксидоредуктазы 8 комплек-
ли при 25°С в среде, содержащей 125 мМ KCl,
са I (CI-NDUFB8, 20 кДа). COXIV (Abcam, Вели-
10 мМ трис (pH 7.4) и 2 мМ K2HPO4. В экспери-
кобритания) использовали для нормирования
ментах в качестве дыхательных субстратов ис-
белковой нагрузки.
пользовали глутамат (5 мМ) и малат (5 мМ). Экс-
перимент проводили в закрытой камере после до-
Статистический анализ. Для статистического
бавления 150 мкМ АДФ к ММК. Оценивали
анализа использовали среднее значение парамет-
скорости потребления кислорода (Vst.2, Vst.3 и
ров из трех-четырех экспериментов ± SD. Стати-
стическую достоверность считали с использова-
Vst.4; нг-атом О/мин/мг белка).
нием тестов t-критерия Стьюдента и t-критерия
Измерение митохондриального набухания. На-
Стьюдента-Ньюмана-Кайло.
бухание митохондрий определяли путем измене-
ния светорассеяния в митохондриальной суспен-
зии при длине волны 540 нм (А540) на спектрофо-
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
тометре Tecan I-Control Infinite 200 (Tecan Group
Сначала мы проверили изменение содержания
Ltd, Швейцария) при 25°С. Стандартная среда
белков, таких как миоглобин, тропонин I и лак-
инкубации для анализа набухания содержала
татдегидрогеназа, с целью выявления нарушения
125 мМ KCl, 10 мМ трис, 0.4 мМ KH2PO4, 5 мМ
функционирования сердца в присутствии изо-
глутамата и 5 мМ малата. Концентрация мито-
протеренола. Для этого тканевые лизаты сердца
хондриального белка в лунке составляла 0.5 мг
разделяли на белки по массе методом электрофо-
белка/мл. Набухание инициировали добавлени-
реза в системе Лэммли, переносили на нитроцел-
ем 120 нмоль Са2+ на мг белка. Процесс набуха-
люлозную мембрану и окрашивали антителами к
ния характеризовался временем достижения по-
миоглобину, тропонину I и ЛДГ. Как видно из
лумаксимального сигнала светорассеяния (Т1/2).
рис. 2, уровень всех белков в тканевых лизатах
сердца третьей группы (с инъекциями ИЗО) сни-
Электрофорез и вестерн-блоттинг. Аликвоты
жался. На рис. 2а-в в верхней части показан ве-
тканевых лизатов (1 мг/мл), солюбилизирован-
стерн-блоттинг исследуемых белков. В нижней
ные в буфере Лэммли (Bio-Rad, США), наносили
части рисунка представлено количественное со-
по 20 мкг на каждую ячейку и разделяли при по-
отношение белковых полос после нормирования
мощи электрофореза (12.5% SDS-PAGE) на белки
их по GAPDH. Снижение содержания белков в
по массе. Переносили белки с геля на нитроцел-
тканевых лизатах у крыс после инъекции ИЗО
люлозную мембрану (0.2 мкм) и блокировали в
(сравнение колонок 3 и 1) свидетельствует о нару-
растворе Roti-block (Karl Roth, Германия) в тече-
шении функционирования сердца. Астаксантин
ние 1 ч. Полученные мембраны окрашивали ан-
снимал эффект ИЗО, и уровень белков повышал-
тителами к миоглобину, тропонину I и лактатде-
ся (сравнение колонок 4 и 3).
гидрогеназе (ЛДГ) (Abcam, Великобритания).
Моноклональные антитела к глицеральдегид-3-
Следующим этапом исследования было выяс-
фосфатдегидрогеназе (GAPDH) (SantaCruz,
нить влияние астаксантина на функциональное
США) использовали как контроль белковой на-
состояние митохондрий мозга крыс с сердечной
грузки.
недостаточностью. В табл. 1 представлены ре-
зультаты влияния астаксантина на дыхательные
Аликвоты лизатов выделенных интактных ми-
активности в митохондриях мозга крыс, которым
тохондрий (2 мг/мл) из каждой группы переноси-
вводили ИЗО для достижения сердечной недо-
ли в пробирки и солюбилизировали в буфере
статочности. Скорость потребления кислорода в
Лэммли (Bio-Rad, США). Образцы митохондри-
состояниях 2 (Vst.2) отражает субстрат-зависимое
ального белка (20 мкг) наносили на каждую ли-
нию и разделяли при помощи электрофореза
дыхание изолированных митохондрий, а в состо-
(12.5% SDS-PAGE) по массе, затем осуществляли
янии 3 (Vst.3) - скорость потребления кислорода
перенос с геля на нитроцеллюлозную мембрану
митохондриями в фосфорилирующем состоянии.
БИОФИЗИКА том 67
№ 5
2022
920
КРЕСТИНИН и др.
Рис. 2. Влияние астаксантина (АТ) и изопротеренола (ИЗО) на изменение содержания миоглобина, тропонина I и ЛДГ в
тканевых лизатах сердца крыс. Образцы белка экстрагировали и подвергали вестерн-блоттингу. GAPDH использовали как
контроль белковой нагрузки. В верхнем ряду - иммуноокрашивание антителами к миоглобину, ЛДГ, тропонину I и
GAPDH; в нижнем ряду - количественная оценка иммунного окрашивания с помощью компьютерной денситометрии,
представленная как отношение количества отдельных белков к GAPDH; данные представлены как среднее ± SD трех
независимых экспериментов. * - р < 0.05 - достоверная разница в уровне белка по сравнению с контролем (первая группа);
# - p < 0.05 по сравнению с ММК, изолированными из крыс, которым вводили ИЗО (третья группа). Статистическую
значимость оценивали с помощью теста Стьюдента-Ньюмена-Кейлса.
Мы наблюдали, что Vst.2 и Vst.3 снижалась на 50 и
потребления кислорода в состоянии 4 (Vst.4, ско-
30% соответственно в ММК после инъекций ИЗО
рость дыхания в отрегулированном состоянии
по сравнению с контролем. Хроническое введе-
после исчерпания избытка АДФ) в ММК с инъек-
ние астаксантина не повлияло на скорости по-
цией ИЗО замедлялась на 35% по сравнению с
требления кислорода в Vst.2 и Vst.3 по сравнению с
контролем. После введения астаксантина в соче-
контролем. Однако Vst.2 и Vst.3 в ММК из четвер-
тании с ИЗО Vst.4 в ММК не изменилась по срав-
той группы повышались на 70 и 60% соответ-
нению с контролем и увеличивалась на 30% отно-
ственно по сравнению с ММК, изолированными
сительно Vst.4 в ММК, изолированных из крыс,
из группы крыс после инъекции ИЗО. Скорость
которым вводили ИЗО. Показателем работоспо-
Таблица 1. Влияние астаксантина и изопротеренола на дыхательную активность митохондрий, изолированных
из каждой группы крыс
Vst.2
Vst.3
Vst.4
RCI
Первая группа
14.37 ± 1.8
102.06 ± 6.26
12.35 ± 3.69
8.26 ± 1.1
Вторая группа
13.07 ± 1.6
99.5 ±13.78
12.81 ± 2.67
7.76 ± 1.32
Третья группа
7.65 ± 1.12*
77.74 ± 3.74*
14.23 ± 0.51*
5.46 ± 0.98
Четвертаягруппа
12.99 ± 0.54#
116.84 ± 2.19#
12.65 ± 0.61#
9.17 ± 2.73*#
Примечание. Показатели дыхательной активности в состояниях 2, 3 и 4 определяли, как число нг-атомов кислорода,
потребляемых митохондриями в минуту на мг белка. ДК рассчитывается как отношение Vst.3 к Vst.4; данные представлены
как среднее ± SD четырех независимых экспериментов. * - p < 0.05, указывает на достоверную разницу относительно
контроля (ММК из первой группы); # - p < 0.05, указывает на достоверную разницу по сравнению с ММК,
изолированными из группы крыс, которым вводили ИЗО (третья группа).
БИОФИЗИКА том 67
№ 5
2022
ДЕЙСТВИЕ АСТАКСАНТИНА НА ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕЕ МИТОХОНДРИЙ
921
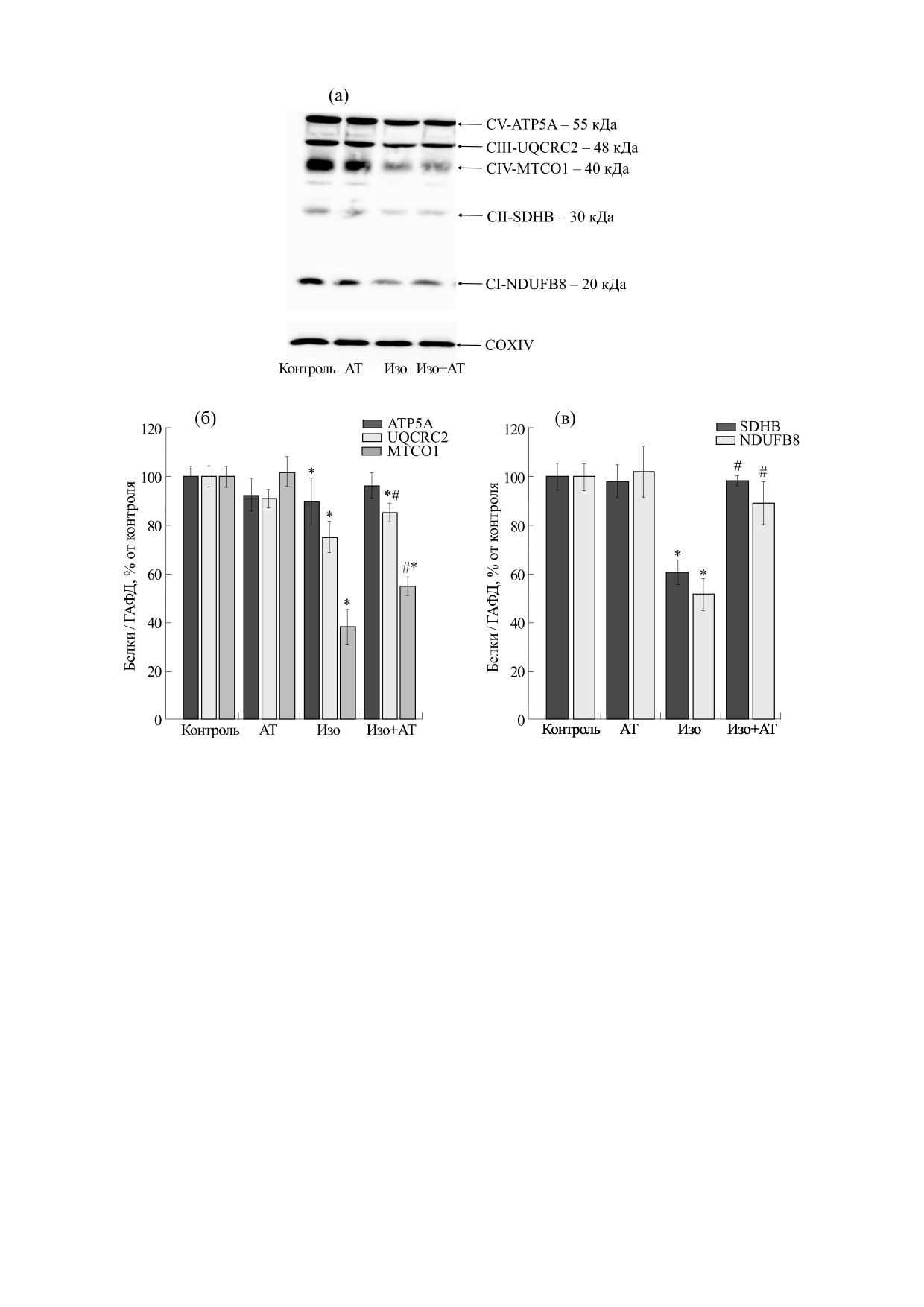
Рис. 3. Влияние астаксантина и ИЗО на изменение уровней основных субъединиц комплексов дыхательной цепи в
ММК. COXIV был использован в качестве контроля белковой нагрузки. (а) - Иммуноокрашивание коктейлем
антител OXPHOS и COXIV; (б) и (в) - количественная оценка иммунного окрашивания с помощью компьютерной
денситометрии, данные представлены как среднее ± SD из трех независимых экспериментов. * - p < 0.05
свидетельствует о достоверном различии уровня белка по сравнению с контролем (первая группа); # - p < 0.05 по
сравнению с ММК, изолированными из крыс, которым вводили ИЗО (третья группа). Статистическую значимость
оценивали с помощью теста ANOVA типа 2 (критерий Стьюдента-Ньюмена-Кейлса).
собности митохондрий является коэффициент
Далее мы проанализировали изменение содер-
дыхательного контроля (ДК), который рассчиты-
жания основных субъединиц комплексов элек-
вается как отношение Vst.3/Vst.4. Следует отме-
трон-транспортной цепи в интактных ММК, вы-
деленных из каждой группы крыс. На рис. 3а по-
тить, что ДК у крыс, которым вводили астаксан-
казан вестерн-блоттинг основных субъединиц
тин, не изменялся по отношению к ДК контроль-
комплексов дыхательной цепи, таких как CV-
ных крыс. ДК в митохондриях крыс после
ATP5A (55 кДа), CIII-UQCRC2 (48 кДа), CIV-
инъекции ИЗО снижался приблизительно на
MTCO1 (40 кДа), CII-SDHB (30 кДа), CI-NDUF8
40%, в то время как ДК в митохондриях крыс, по-
(20 кДа). COX IV использовали как контроль бел-
лучавших астаксантин, с последующей инъекци-
ковой нагрузки. На рис.
3б,в изображены
ей ИЗО увеличился на 40% по сравнению с ДК в
диаграммы, отражающие количественное соот-
митохондриях крыс, которым вводили ИЗО.
ношение белковых полос после нормирования их
БИОФИЗИКА том 67
№ 5
2022
922
КРЕСТИНИН и др.
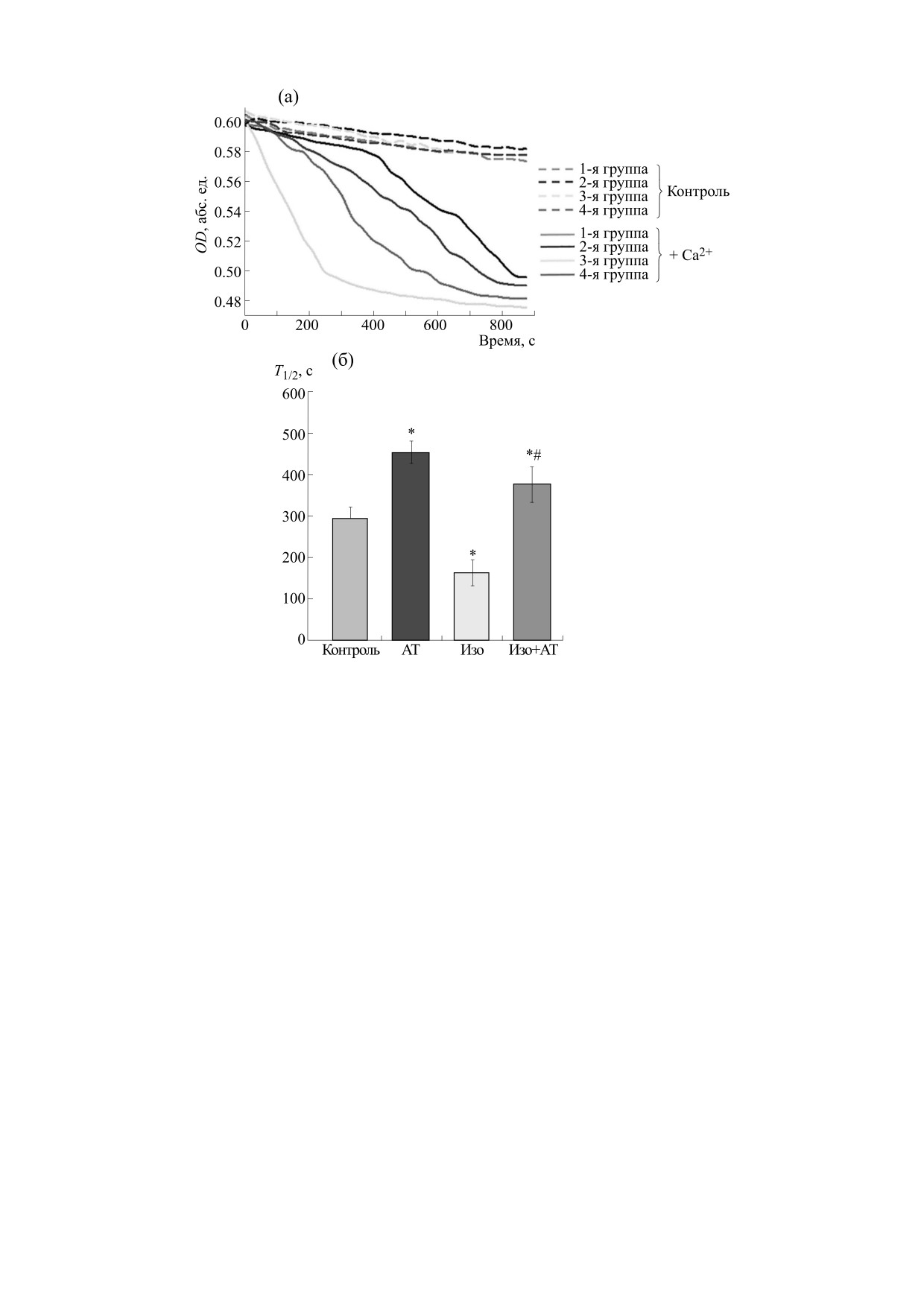
Рис. 4. Влияние астаксантина и ИЗО на набухание митохондрий мозга крыс: (а) - кривые набухания ММК,
изолированных из крыс каждой группы; (б) - диаграмма, отражающая время достижения полумаксимального сигнала
светорассеяния (Т1/2). Набухание инициировалось ионами Са2+ и составляло 120 нмоль на мг белка. Данные
представлены как среднее ± SD из четырех независимых экспериментов. * - p < 0.05 указывает на достоверную
разницу в Т1/2 относительно контроля (первая группа); # - p < 0.05 по сравнению с ММК, изолированными из крыс,
которым вводили ИЗО (третья группа). Статистическую значимость различий оценивали с помощью теста ANOVA
типа 2 (критерий Стьюдента-Ньюмена-Кейлса).
по COX IV. Введение астаксантина не изменяло
38% и CI-NDUF8 - на 35% по сравнению с содер-
уровень всех субъединиц комплексов дыхательной
жанием субъединиц в ММК, изолированных из
цепи по сравнению с контролем (вторая группа
группы крыс с инъекцией ИЗО (четвертая группа
против первой), тогда как инъекция ИЗО снижала
против третьей).
содержание СV-АТР5А на 15%, CIII-UQCRC2 - на
Общепринято, что при разобщении окисли-
25%, CIV-MTCO1 - на 60%, CII-SDHB - на 40%,
тельного фосфорилирования наблюдается из-
а CI-NDUF8 - на 50% относительно контроля
менение проницаемости митохондриальной
(третья группа против первой). При комбиниро-
мембраны. Поэтому на следующем этапе нашего
ванном действии астаксантина и ИЗО мы наблю-
исследования мы измерили набухание митохон-
дали, что по сравнению с контролем не было из-
дрий в наших экспериментальных условиях. На
менений в содержании СV-АТР5А-, CII-SDHB- и
рис. 4а показаны кривые набухания митохон-
CI-NDUF8-субъединиц, однако содержание
дрий, изолированных из всех групп крыс. Набу-
CIII-UQCRC2 и CIV-MTCO1 снижалось на 15 и
45% соответственно (четвертая группа против
хание инициировалось ионами Са2+ (120 нмоль
первой). Следует отметить, что содержание СV-
на мг белка). Рис. 4б количественно отражает
АТР5А увеличивалось на 10%, CIII-UQCRC2 -
процесс набухания, охарактеризованный време-
на 10%, CIV-MTCO1 - на 17%, CII-SDHB - на
нем достижения полумаксимального сигнала све-
БИОФИЗИКА том 67
№ 5
2022
ДЕЙСТВИЕ АСТАКСАНТИНА НА ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕЕ МИТОХОНДРИЙ
923
торассеяния (T1/2). T1/2 митохондрий в присут-
нальное состояние митохондрий мозга, изолиро-
ствии астаксантина увеличивался в полтора раза
ванных из крыс с сердечной недостаточностью.
по сравнению с контролем (вторая группа против
Сердечная недостаточность была достигнута пу-
первой), т.е. скорость набухания снижалась.
тем инъекции изопротеренола, модели широко
Инъекция ИЗО привела к тому, что T1/2 набуха-
используемой в международном научном сооб-
ществе [14, 15]. Снижение уровней белков, таких
ния в ММК снижалась в два раза по сравнению с
как миоглобин, тропонин I и ЛДГ в тканевых ли-
контролем (третья группа против первой), т.е.
затах левого желудочка сердечной мышцы пока-
скорость набухания повышалась. Введение астак-
зало, что сердечная недостаточность была достиг-
сантина крысам с последующей инъекцией ИЗО
нута.
увеличивало T1/2 на 20% по сравнению с контро-
лем (четвертая группа против первой) и более чем
В различных патологиях наблюдается сниже-
в два раза снижало по сравнению с T1/2 в ММК с
ние скорости потребления кислорода митохон-
инъекцией ИЗО (четвертая группа против
дриями, это может быть связано с нарушением
третьей).
работы переносчиков электронов [22]. Известно,
что при окислительном стрессе или гипоксии
скорость потребления кислорода митохондриями
ОБСУЖДЕНИЕ
в Vst.3 снижается. Кроме того, низкая скорость
дыхания неповрежденных митохондрий в состоя-
Митохондриальная дисфункция может быть
нии Vst.4 может быть связана с тем, что высокий
причиной различных заболеваний, таких как
нейродегенеративные и сердечно-сосудистые
мембранный потенциал препятствует переносу
заболевания, сахарный диабет, различные пора-
протонов через внутреннюю мембрану, и тем са-
жения печени и скелетно-мышечной системы,
мым останавливает поток электронов. Утечка
сепсис и психические расстройства [17]. Ми-
ионов через мембрану снимает мембранный по-
тохондриальная дисфункция, вызванная окисли-
тенциал и приводит к увеличению скорости дыха-
тельным повреждением, вызывает морфологи-
ния Vst.4. Повышение Vst.4 может происходить
ческие и функциональные изменения в мито-
также благодаря увеличению проницаемости
хондриях. При патологических состояниях
внутренней мембраны митохондрий. В настоя-
структурные изменения, возникающие при окис-
щей работе мы заметили, что в ММК, изолиро-
лительных повреждениях, такие как набухание,
ванных из крыс третьей группы (инъекция ИЗО),
фрагментация митохондрий и деление митохон-
Vst.3 снижался, а Vst.4 увеличивался по сравнению
дрий, становятся более выраженными [18]. При
с контролем, что приводило к снижению ДК ми-
возникновении различных заболеваний может
тохондрий. Напротив, мы заметили, что Vst.3 уве-
происходить уменьшение потребления кислоро-
личивался, а Vst.4 снижался в митохондриях в
да митохондриями и, как следствие, возникает
группе крыс, которым вводили астаксантин, с по-
митохондриальная дисфункция [19]. Митохон-
следующей инъекцией ИЗО. Астаксантин отме-
дриальная дисфункция характеризуется потерей
нял эффект ИЗО и ДК митохондрий увеличи-
эффективности цепи переноса электронов и сни-
вался.
жением синтеза высокоэнергетических молекул,
таких как аденозин-5'-трифосфат (АТФ), что ха-
Известно, что электрон-транспортная цепь во
рактерно для хронических заболеваний [20]. Ра-
внутренней митохондриальной мембране состо-
нее мы показали, что астаксантин улучшал функ-
ит из трансмембранных белковых комплексов (I-
циональное состояние митохондрий сердца крыс
IV) и свободно движущихся переносчиков элек-
при сердечной недостаточности [7-9].
тронов — убихинона и цитохрома с. Для правиль-
Авторы работы [21] показали, что в результате
ной работы комплексы должны быть собраны в
поражения сердца сердечная недостаточность
специально образованный суперкомплекс. Эти
может индуцировать повреждения головного
собранные компоненты вместе с комплексом V
мозга, поскольку у пациентов с сердечной недо-
становятся основой для производства АТФ при
статочностью были обнаружены как анатомиче-
окислительном фосфорилировании. Следует от-
ские, так и функциональные повреждения голов-
метить, что дефекты дыхательных комплексов и
ного мозга. Было показано, что повреждения го-
АТФ-синтазы влияют на митохондриальные
ловного мозга наблюдаются в широком
функции [23, 24]. В наших экспериментальных
диапазоне клинических состояний и сердечных
условиях уровень основных субъединиц ком-
функций, кроме того, они могут влиять на резуль-
плексов дыхательной цепи в ММК, изолирован-
таты лечения пациентов. Существуют данные,
ных из крыс третьей группы (инъекция ИЗО)
показывающие участие нейрогормональных, пи-
снижался, что свидетельствовало о снижении ми-
щевых и воспалительных механизмов в этом
тохондриальной эффективности. Астаксантин
сложном процессе [21]. В настоящей работе был
отменял эффект ИЗО и содержание субъединиц в
исследован эффект астаксантина на функцио-
интактных ММК повышалось.
БИОФИЗИКА том 67
№ 5
2022
924
КРЕСТИНИН и др.
Снижение скорости потребления кислорода
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
митохондриями может происходить также и в ре-
Опыты проводили в соответствии с Положе-
зультате разрыва мембран и набухания митохон-
нием о проведении исследований на эксперимен-
дрий, вследствие чего проницаемость внутренней
тальных животных (приказ Минздрава России от
мембраны митохондрий может изменяться [25].
12 августа 1997 г. № 755). Протокол одобрен ко-
Ранее мы наблюдали, что скорость набухания ми-
миссией по биологической безопасности и этике
тохондрий сердца, изолированных из крыс с сер-
Института теоретической и экспериментальной
дечной недостаточностью, увеличивалась, тогда
биофизики РАН (протокол №05/2022 от 05 марта
как астаксантин предотвращал эффект ИЗО и
2022).
скорость набухания снижалась [7, 8]. В настоя-
щем исследовании мы заметили тот же эффект в
митохондриях мозга крыс.
СПИСОК ЛИТЕРАТУРЫ
1.
J. S. Bhatti, G. K. Bhatti, and P. H. Reddy, Biochim.
Biophys. Acta Mol. Basis Dis., 1863 (5), 1066 (2017).
ЗАКЛЮЧЕНИЕ
2.
B. Halliwell, Biochem. Soc. Symp., 61, 73 (1995).
В настоящем исследовании мы изучили влия-
3.
J. P. Yuan, J. Peng, K. Yin, and J. H. Wang, Mol. Nutr.
ние астаксантина на функциональное состояние
Food Res., 55 (1), 150 (2011).
митохондрий мозга у крыс с сердечной недоста-
4.
R. R. Ambati, S. M. Phang, S. Ravi, and R. G. As-
точностью, вызванной инъекцией ИЗО. Мы по-
wathanarayana, Mar. Drugs, 12 (1), 128 (2014).
казали, что в условиях сердечной недостаточно-
5.
I.
Higuera-Ciapara, L. Felix-Valenzuela, and
сти скорость потребления кислорода в состоянии
F. M. Goycoolea, Crit. Rev. Food Sci. Nutr., 46 (2),
3 снижалась, а в состоянии 4 увеличивалась,
185 (2006).
вследствие чего снижался и дыхательный кон-
6.
S. H. Kim and H. Kim, Nutrients, 10 (9), 1137 (2018).
троль, в то время как астаксантин снимал воздей-
7.
Y. Baburina, R. Krestinin, I. Odinokova, et al., Antiox-
ствие ИЗО, дыхательный контроль повышался, и
idants (Basel), 8 (12), 576 (2019).
функциональное состояние митохондрий улуч-
8.
R. Krestinin, Y. Baburina, I. Odinokova, et al., Bio-
medicines, 8 (10), 437 (2020).
шалось. Кроме того, астаксантин повышал уро-
вень основных субъединиц комплексов дыха-
9.
O. Krestinina, Y. Baburina, R. Krestinin, et al., Antiox-
idants (Basel), 9 (3), 262 (2020).
тельной цепи и АТФ синтазы в митохондриях
10.
K. Mueller, F. Thiel, F. Beutner, et al., Circ Res., 126
мозга у крыс с сердечной недостаточностью, тем
(6), 750 (2020).
самым снижая проницаемость внутренней мем-
11.
O. Havakuk, K. S. King, L. Grazette, et al., J. Am. Coll.
браны, что также улучшало функциональное со-
Cardiol., 69 (12), 1609 (2017).
стояние мозга крыс. Исходя из вышеизложенного
12.
C. Galasso, I. Orefice, P. Pellone, et al., Mar. Drugs,
можно сделать вывод, что астаксантин выполняет
16 (8), 247 (2018).
защитную функцию в митохондриях, повышая их
13.
P. Balakumar, A. P. Singh, and M. Singh, J. Pharma-
эффективность. Поэтому астаксантин можно
col. Toxicol. Methods, 56 (1), 1 (2007).
рассматривать как важный ингредиент в питании
14.
P. Akila, L. Asaikumar, and L. Vennila, Biomed. Phar-
для профилактики возникновения сердечно-со-
macother., 85, 582 (2017).
судистых заболеваний и повреждений головного
15.
I. Odinokova, Y. Baburina, A. Kruglov, et al., Int. J.
мозга.
Mol. Sci., 19 (6), 1555 (2018).
16.
Y. Baburina, I. Odinokova, T. Azarashvili, et al., Int. J.
Mol. Sci., 19 (11), 3499 (2018).
БЛАГОДАРНОСТИ
17.
G. T. Rezin, G. Amboni, A. I. Zugno, et al., Neuro-
В работе были использовано научное оборудо-
chem. Res., 34 (6), 1021 (2009).
вание Центра коллективного пользования ИТЭБ
18.
S. H. Kim, J. W. Lim, and H. Kim, Nutrients, 10 (9),
РАН.
1320 (2018).
19.
P. M. Herst, M. R. Rowe, G. M. Carson, and
M. V. Berridge, Front. Endocrinol. (Lausanne), 8, 296
ФИНАНСИРОВАНИЕ РАБОТЫ
(2017).
20. P. H. Reddy and T. P. Reddy, Curr. Alzheimer Res., 8
Работа выполнена при финансовой поддержке
(4), 393 (2011).
Российского фонда фундаментальных исследова-
21. J. S. Bock and S. S. Gottlieb, Circulation, 121 (23),
ний (гранты № 20-04-00131 и № 20-015-00072), а
2592 (2010).
также Государственного задания 075-01027-22-00.
22. C. Guo, L. Sun, X. Chen, and D. Zhang, Neural Re-
gen. Res., 8 (21), 2003 (2013).
23. R. Guo, S. Zong, M. Wu, et al., Cell, 170 (6), 1247
(2017).
КОНФЛИКТ ИНТЕРЕСОВ
24. S. Iwata, J. W. Lee, K. Okada, et al., Science, 281
Авторы заявляют об отсутствии конфликта
(5373), 64 (1998).
интересов.
25. K. A. Webster, Future Cardiol., 8 (6), 863 (2012).
БИОФИЗИКА том 67
№ 5
2022
ДЕЙСТВИЕ АСТАКСАНТИНА НА ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕЕ МИТОХОНДРИЙ
925
The Effect of Astaxanthin on the Functional State
of Rat Brain Mitochondria in Heart Failure
R.R. Krestinin*, Yu.L. Baburina*, I.V. Odinokova*, L.D. Sotnikova*, and O.V. Krestinina*
*Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
The effect of astaxanthin on the functional state of brain mitochondria in rats with heart failure was studied.
The induction of heart failure in rats was performed through subcutaneous injection of isoproterenol. Asta-
xanthin was chronically administered through the oral route. It was found that application of isoproterenol
impaired the functional state of rat brain mitochondria, while administration of astaxanthin abolished the ef-
fect of isoproterenol and improved the functional state of mitochondria in rats with heart failure. At the same
time, the respiratory control index of rat brain mitochondria increased. The content of the main subunits,
such as alpha subunits of complex V, mitochondrially encoded cytochrome c oxidase I of complex IV, ubiqui-
none oxidoreductase complex assembly factor 8 of complex I, succinate dehydrogenase (complex II), cyto-
chrome b-c1 complex subunit 2 of complex III increased. Isoproterenol accelerated Ca2+-induced swelling
of mitochondria, while astaxanthin reduced this parameter. Astaxanthin exhibited a protective effect on mi-
tochondria.
Keywords: heart failure, rat brain mitochondria, astaxanthin, mitochondrial dysfunction, oxidative stress
БИОФИЗИКА том 67
№ 5
2022