БИОФИЗИКА, 2022, том 67, № 5, с. 926-937
БИОФИЗИКА КЛЕТКИ
УДК 611.018.8:57.086.16:576.311.332
ОЦЕНКА ОКРАШИВАНИЯ ТКАНИ МОЗГА ЭКСТРАКТОМ ЧАЯ УЛУН
С ОСОБЫМ ВНИМАНИЕМ К ГЛАДКОМУ
ЭНДОПЛАЗМАТИЧЕСКОМУ РЕТИКУЛУМУ
© 2022 г. Е.А. Шишкова*, И.В. Краев**, В.В. Рогачевский*, #
*Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», 142290, Пущино Московской области, Институтская ул., 3
**Faculty of Health and Social Care, the Open University, Walton Hall, Milton Keynes, UK, MK7 6AA
#E-mail: ckpem.icb.ras@gmail.com
Поступила в редакцию 11.07.2022 г.
После доработки 08.08.2022 г.
Принята к публикации 10.08.2022 г.
Электронная микроскопия остается золотым стандартом в исследованиях нервной системы, по-
скольку позволяет получать изображения ультраструктуры нервной ткани с адекватным простран-
ственным разрешением. Несмотря на высокое разрешение электронно-микроскопических изобра-
жений, их корректная интерпретация возможна только при наличии достаточного контраста
элементарных мембран, компонентов цитоплазмы и цитоскелета, которого достигают с использо-
ванием опасных реагентов и тяжелых металлов. Ранее для замены токсичного и радиоактивного
ацетата диоксида урана был предложен раствор сухого экстракта чая улун, но окрашивание с ним
давало более слабый контраст внутриклеточных органелл. Известно, что в зависимости от природы
образца и условий эксперимента различные ткани обладают разной способностью связывать краси-
тель. В данной работе с помощью просвечивающей электронной микроскопии мы впервые оцени-
ли красящие свойства экстракта чая улун на ткани мозга новорожденной и взрослой крысы. Мы об-
наружили, что приготовленный насыщенный водный экстракт чая улун не уступает стандартным
красителям и имеет ряд преимуществ. Показано, что его использование позволяет в незрелом мозге
выявлять тончайшие детали гладкого эндоплазматического ретикулума нейронов, а в сочетании с
осмированием с феррицианидом калия и какодилатным буфером обеспечивает лучшую визуализа-
цию цитоскелета нейронов и гладкого ретикулума терминальных ламелл астроцитов. Окрашивание
насыщенным водным экстрактом чая улун после общепринятого протокола химической фиксации
хорошо подходит для рутинных исследований мозга взрослых животных, в том числе для пакетного
контрастирования большого числа препаратов.
Ключевые слова: сканирующая электронная микроскопия, просвечивающая электронная микроскопия,
экстракт чая улун, контраст мембран; эндоплазматический ретикулум; гиппокамп.
DOI: 10.31857/S000630292205009X, EDN: JILFBC
средством сканирующей электронной микроско-
Современный уровень исследований цен-
пии (SEM) основное внимание уделяют анализу
тральной нервной системы методами электрон-
общей структуры отростков нейронов: дендри-
ной микроскопии включает 3D-реконструкции
тов, дендритных шипиков и аксональных преси-
больших объемов ткани мозга на основе автома-
наптических бутонов, что требует высокого кон-
тической сегментации стека изображений серий-
траста их плазматических мембран.
ных ультратонких срезов на отдельные клеточные
компартменты при помощи машинного обуче-
Для усиления контраста мембран в ходе подго-
ния. В таких исследованиях коннектомики по- товки ткани для электронной микроскопии фик-
сацию ткани альдегидами проводят в присут-
Сокращения: SEM - сканирующая электронная микроско- ствии специальных добавок, таких как ионы
пия, OTO - осмий-тиокарбогидразид-осмий, PSD -
Ca2+, Mg2+, Cu2+. После первичной фиксации
постсинаптическое уплотнение, TEM - просвечивающая
электронная микроскопия, UAc - уранилацетат, ОТЕ - ткань дополнительно фиксируют восстановлен-
плазматический ретикулум, UL - краситель на основе со- ным ферроцианидом тетраоксидом осмия (rO),
лей лантаноидов (UranyLess).
или повторно в OsO4 (rOO или двойное осмиро-
926
ОЦЕНКА ОКРАШИВАНИЯ ТКАНИ МОЗГА ЭКСТРАКТОМ ЧАЯ УЛУН
927
вание), или в вариантах фиксаторов/красителей,
двойное контрастирование, облегчал подготовку
содержащих чрезвычайно токсичный тиокарбо-
препаратов для SEM [10].
гидразид (rOTO), или другими контрастерами. В
Почти все компоненты для подготовки биоло-
качестве последнего этапа кусочек ткани часто
гических образов для электронной микроскопии,
насыщают различными солями тяжелых метал-
применяемые для усиления контраста, являются
лов (см., например, работы [1-5]).
опасными, и чем меньше они будут использо-
ваться, тем лучше. Поэтому если контрастирова-
Такие препараты в целом имеют достаточный
ние свинцом является, по-видимому, незамени-
контраст мембран для последующего анализа ме-
мым для визуализации тонких деталей не только
тодами SEM, такими как сканирование поверх-
в TEM, но и в SEM, то токсичный и радиоактив-
ности блока ткани, последовательно срезаемого
ный UAc можно легко заменить на альтернатив-
алмазным ножом (SBF-SEM) или ионным пуч-
ные менее опасные реагенты.
ком (FIB-SEM), или сканирование ультратонких
Более десяти лет назад в качестве заменителя
срезов (ATUM- или Multi-SEM). Но эти методы
имеют несколько присущих им недостатков,
UAc для контрастирования ультратонких срезов
соединительной ткани легких и гепатоцитов был
ограничивающих комплексный анализ уль-
траструктуры клетки. Известно, что наличие
предложен забуференный фосфатами экстракт
чая улун (OTE-stain) [11, 12]. Позднее OTE-кон-
постсинаптического уплотнения (PSD) и/или
трастирование было протестировано на простей-
пресинаптических везикул наряду с синаптиче-
ших [13], бактериальных клетках [14] и на пери-
ской щелью является критерием идентификации
ферическом миелинезированном нервном во-
ассимметричных и симметричных синапсов [6,
локне [15]. Авторы отмечали, что, несмотря на
7], а площадь активной зоны или мембраны, за-
меньший общий контраст образцов, окрашенных
нятой PSD, является важным маркером уровня
с OTE, некоторые тонкие детали выявлялись луч-
активности синапса. Поэтому высокий контраст
ше [13]. В то время как стандартное двойное кон-
этих структур играет важную роль в анализе цен-
трастирование (UAc и цитрат свинца) давало бо-
тральной нервной системы методами электрон-
лее четкие очертания шероховатого эндоплазма-
ной микроскопии. В то же время, в отличие от
тического ретикулума и митохондрий, после
стандартных протоколов подготовки ткани для
окраски с OTE слабоконтрастные цистерны глад-
просвечивающей электронной микроскопии
кого эндоплазматического ретикулума (гЭР) про-
(TEM), rOTO-препараты имеют значительно
являли лучшую сохранность и были менее фраг-
меньший контраст PSD и плазматических мем-
ментированы [12].
бран синаптической щели [8]. Более того, на не-
которых препаратах, подготовленных для SBF-
С одной стороны, гЭР возбудимых клеток
SEM с применением rOTO-протокола, PSD вооб-
представляет собой сложно разветвленную сеть
ще невозможно идентифицировать (см., напри-
цистерн и играет ключевую роль в динамике
мер, работу [9]). Еще одним недостатком OTO-
ионов кальция во время сокращения мышц и в
метода является очень низкий контраст других
вызванной или гомеостатической синаптической
внутриклеточных структур, таких как рибосомы,
пластичности центральной нервной системы.
ядерный хроматин, тонкие филаменты, в некото-
Поэтому организацию гЭР кардиомиоцитов и
рой степени снижены контраст микротрубочек и
нейронов экстенсивно исследовали с помощью
электронная плотность митохондриального мат-
FIB-SEM или SBF-SEM на основе ручной 3D-ре-
рикса (см. иллюстрации в работе [8] и рис. 5 в ра-
конструкции в больших объемах клеточных ком-
боте [10]).
партментов, хотя и с относительно низким опти-
ческим разрешением (15 нм/пиксель) [16] или с
С учетом этих недостатков некоторым иссле-
вышеупомянутыми ограничениями контрасти-
дователям при подготовке образцов для SEM
рования SEM-препаратов [17]. В этом отношении
пришлось вернуться к методу двойного контра-
анализ гЭР можно было бы облегчить его автома-
стирования срезов уранилацетатом (UAc) и соля-
тизированной 3D-реконструкцией на TEM-изоб-
ми свинца (см., например, работу [10]). Так,
ражениях более высокого разрешения, но этому
срезы ткани, подготовленной по протоколу с
может препятствовать слабый контраст гЭР на
двойным осмированием, последовательно кон-
TEM-препаратах. С другой стороны, наряду с
трастированные уранилацетатом и свинцом
ограниченным числом публикаций по красящим
(рис. 5 в работе [5], рис. 5 в работе [10]) или только
свойствам OTE также известно, что в зависимо-
свинцом (рис. 5 в работе [5]), на SEM-изображе-
сти от природы образца и других эксперимен-
ниях имели достаточный контраст PSD, синапти-
тальных условий, биологические ткани и их внут-
ческой щели и некоторых других внутриклеточ-
риклеточные структуры различаются по своей
ных структур. Кроме этого, классический прото-
способности связывать краситель. Поэтому вы-
кол подготовки для TEM, за которым следовало
бор адекватной техники контрастирования явля-
БИОФИЗИКА том 67
№ 5
2022
928
ШИШКОВА и др.
ется ключевым моментом как для комплексной
одним слотом), покрытые пленкой-подложкой
интерпретации ультраструктуры, так и для полу-
из пиолоформа, укрепленной аморфным угле-
чения корректной эталонной модели для обуче-
родом.
ния нейронной сети.
Получение экстракта чая улун. Ввиду отсут-
В попытке оценить красящие свойства OTE по
ствия местных поставщиков OTE и в отличие от
сравнению с такими широко используемыми
предыдущих публикаций, описывающих исполь-
контрастерами для TEM, как UAc и UranyLess,
зование OTE вместо UAc, мы использовали вод-
мы обнаружили, что ультратонкие срезы, окра-
ный экстракт, полученный из свежеприготовлен-
шенные экстрактом чая улун, полученным из за-
ного молочного чая улун (pOTE), доступного в
варенного чая (pOTE), имеют такой же контраст
любом магазине. В данной работе мы использова-
плазматических мембран, как и окрашенные ура-
ли чай, приобретенный 10 лет назад (Ahmad Tea
нилацетатом. pOTE также имеет ряд преиму-
Ltd., дата упаковки 01.2011). Для получения pOTE
ществ в контрастировании гЭР и других внутри-
5 г сухих листьев чая в 50 мл деионизированной
клеточных структур нейронов и глиальных кле-
воды (milliQ) в стеклянном флаконе нагревали в
ток, по крайней мере в ювенильном мозге, и
микроволновой печи до начала кипения, флакон
хорошо подходит для рутинных исследований
оборачивали алюминиевой фольгой и оставляли
мозга взрослых животных.
настаиваться минимум 40 мин. Полученный рас-
твор вместе с листьями можно хранить плотно за-
крытым и завернутым в фольгу при комнатной
МАТЕРИАЛЫ И МЕТОДЫ
температуре в течение нескольких недель и ис-
Мозг раннего постнатального периода. Гиппо-
пользовать по необходимости. Для удаления
камп криоанестезированных новорожденных
крупных частиц непосредственно перед исполь-
крыс Wistar выделяли между первыми и вторыми
зованием экстракт центрифугировали и пропус-
сутками постнатального развития, разрезали лез-
кали через шприцевой фильтр с порами диамет-
вием перпендикулярно длинной оси на кусочки
ром 0.2 мкм. Сухой вес фильтрованного pOTE со-
менее 1 мм в капле фиксатора и погружали в тот
ставлял около 2.8% и не менялся со временем
же фиксатор, содержащий 3% параформальдеги-
хранения раствора.
да и 2.5% глутарового альдегида в 0.1 М какоди-
Процедуры окрашивания. Все сеточки со среза-
латном буфере, на 1 ч при комнатной температу-
ми ювенильной ткани мозга были разделены по-
ре, а затем на ночь при 4°С. На следующий день
парно (Os и rOs) на несколько групп и окрашены
образцы были дважды отмыты в том же буфере и
на каплях при комнатной температуре следую-
для четкости экспериментальных данных разде-
щими реагентами:
лены на две группы. Одну группу образцов пост-
- Группа 1 (рис. 1а,б) - насыщенным раство-
фиксировали в 1%-м растворе OsO4 в 0.1 М како-
ром UAc в течение 10 мин.
дилатном буфере, содержащем 0.01% K2Cr2O7
- Группа 2 (рис. 1в,г) - насыщенным раство-
(группа Os). Другую группу постфиксировали в
ром UAc в течение 30 мин.
1%-м растворе восстановленного OsO4 добавле-
- Группа 3 (рис. 1д,е) - красителем UranyLess
нием 1.5%-го феррицианида калия (K3[Fe(CN)6]
в течение 1 мин.
(непосредственно перед использованием) в тот
- Группа 4 (рис. 1ж,з) - старым pOTE (хра-
же буфер, содержащий бихромат калия (группа
нился около двух месяцев при комнатной темпе-
rOs). Осмирование обеих групп образцов прово-
ратуре) в течение 40 мин.
дили в течение ночи при 4°С, отмывали дважды
деионизированной водой (milliQ, каждая смена
- Группа 5 (рис. 2а,б) - свежим pOTE в тече-
по 10 мин), обезвоживали в серии возрастающих
ние 40 мин.
концентраций этанола и затем в 100%-м ацетоне,
- Группа 6 (рис. 2в,г) - свежим pOTE, разве-
далее заливали в смесь смол EMBed812 (на ночь в
денным 1:1 по объему 0.2 М какодилатным буфе-
смесь EMBed812 с 100%-м ацетоном в объемном
ром (pH 7.6) в течение 40 мин.
отношении 1 : 1 и затем в чистую смолу), которую
- Группа 7 (рис. 2д,е) - свежим pOTE, разве-
полимеризовали 48 ч при 60°С. Отвержденные
денным 1:1 по объему 0.2 М фосфатным буфером
блоки были заточены специально приготовлен-
(pH 7.3-7.4) в течение 40 мин.
ными стеклянными ножами [18] для получения
пирамидок в СА3-области гиппокампа (содержа-
Затем все сеточки последовательно отмывали
щей большое число конусов роста мшистых воло-
по 1 мин на каждой из трех капель деионизиро-
кон). С каждой пирамидки на ультратоме Leica
ванной воды и дополнительно контрастировали
EM UC6 с помощью алмазного ножа были полу-
модифицированным красителем Сато, содержа-
чены срезы номинальной толщиной 60 нм, кото-
щим три соли свинца [19], разведенным дважды с
рые монтировали на медные бленды (сеточки с
H2O (pH воды был доведен до pH красителя Са-
БИОФИЗИКА том 67
№ 5
2022
ОЦЕНКА ОКРАШИВАНИЯ ТКАНИ МОЗГА ЭКСТРАКТОМ ЧАЯ УЛУН
929
Рис. 1. Ультраструктура нейропиля области СА3 гиппокампа новорожденной крысы после окраски UAc, лантаноида-
ми и старым pОТЕ. Изображения в левой колонке получены c образцов, фиксированных альдегидами и постфикси-
рованных в OsO4; изображения в правой колонке - c образцов, фиксированных альдегидами и постфиксированных в
OsO4, восстановленном феррицианидом калия. (а) и (б) - Срезы обработаны насыщенным раствором UAc в течение
10 мин; (в) и (г) - срезы обработаны насыщенным раствором UAc в течение 30 мин; (д) и (е) - срезы окрашены Ura-
nyLess в течение 1 мин; (ж) и (з) - срезы окрашены старым pОТЕ в течение 40 мин. Все срезы дополнительно контра-
стированы тремя солями свинца по Сато (см. описание в основном тексте). Сокращения: гЭР - трубочки и расширен-
ные цистерны гладкого ЭР, шЭР - цистерны шероховатого ЭР, эс - эндосомальные компартменты ретикулума, М -
митохондрии, МТ - микротрубочки, г - гликогеновые гранулы, Г - глиальные клетки, КР - конусы роста, Д - денд-
риты. Головками стрелок на основных панелях и врезках отмечены тончайшие цистерны гладкого ЭР. Шкала для всех
панелей 1 мкм, для врезок - 200 нм.
БИОФИЗИКА том 67
№ 5
2022
930
ШИШКОВА и др.
Рис. 2. Ультраструктура нейропиля СА3-области гиппокампа новорожденной крысы после окраски свежеприготов-
ленным pОТЕ. Изображения в левой колонке получены c образцов, фиксированных альдегидами и постфиксирован-
ных в OsO4; изображения в правой колонке - c образцов, фиксированных альдегидами и постфиксированных в OsO4,
восстановленном феррицианидом калия. (а) и (б) - Срезы окрашены незабуференным pОТЕ в течение 40 мин; (в) и
(г) - срезы окрашены pОТЕ с какодилатным буфером в течение 40 мин; (д) и (е) - срезы окрашены pОТЕ с фосфат-
ным буфером в течение 40 мин. Все срезы дополнительно контрастированы тремя солями свинца по Сато. (см. опи-
сание в основном тексте). Сокращение: Р - свободные рибосомы и полисомы. Остальные сокращения те же, что и на
рис. 1. Головками стрелок отмечены тончайшие цистерны гладкого ЭР. Шкала для всех панелей 1 мкм; для врезок -
200 нм.
то). Каждую сеточку отмывали 0.02 М раствором
вого альдегида. Мозг был помещен в этот же фик-
NaOH и дважды деионизированной водой в тече-
сатор на ночь. Коронарные срезы дорзального
ние 1 мин.
гиппокампа толщиной 50 мкм получали на виб-
ратоме VT1000S (Leica, Германия) и далее обраба-
Мозг взрослого животного. Крысу Wistar (воз-
тывали как было описано ранее [20, 21]. Срезы
раст 7 месяцев, масса 310 г) анестезировали внут-
были постфиксированы в 1%-м растворе OsO4 в
рибрюшинным введением пентобарбитала на-
трия (200 мг/кг веса). Фиксацию мозга крысы
течение одного-полутора часов при комнатной
проводили путем транскардиальной перфузии
температуре, обезвожены в серии спиртов с воз-
сначала изотоническим солевым раствором (0.9%
растающей концентрацией, затем в 100%-м аце-
NaCl), содержащим гепарин (60 ед./мл), а затем
тоне и выдержаны в смеси ацетон : смола
0.1 М фосфатно-солевым буфером (pH 7.4), со-
(Agar100/Araldite CY212) в течение 30 мин при
держащим 2% параформальдегида и 2% глутаро-
комнатной температуре. Далее для заключения в
БИОФИЗИКА том 67
№ 5
2022
ОЦЕНКА ОКРАШИВАНИЯ ТКАНИ МОЗГА ЭКСТРАКТОМ ЧАЯ УЛУН
931
смолу в расправленном состоянии (flat-embed-
шенного синтеза мембран, необходимых для ро-
ding) срезы помещали в смолу между сжатыми ли-
ста конусов роста [23, 24]. Во-вторых, известно,
стами акларовой пленки и полимеризовали при
что эмбриональная или незрелая ткань окраши-
60°С в течение 48 ч. В области среднего молеку-
вается менее интенсивно и имеет меньший кон-
лярного слоя зубчатой фасции гиппокампа была
траст из-за большого содержания воды [25]. Та-
заточена пирамидка, с которой были получены и
ким образом, было предположено, что если окра-
собраны, как описано выше, ультратонкие срезы
шивание с pОТЕ покажет усиление контраста на
номинальной толщиной ~70-80 нм. Срезы сна-
незрелой ткани, то такой же эффект должен про-
чала выдерживали на каплях свежеприготовлен-
явиться и на зрелой ткани.
ного pOTE в течение 40 мин при комнатной тем-
Окрашивание ткани незрелого мозга. Стан-
пературе, трижды отмывали на каплях деионизи-
дартные красители. Все изображения на рис. 1 и 2
рованной воды и затем контрастировали
иллюстрируют структуру Str. lucidum или radiatum
цитратом свинца по Рейнольдсу в течение 10 мин.
развивающего нейропиля поля СА3 гиппокампа.
Получение изображений. Микрофотографии
Нейропиль сформирован массой растущих ней-
срезов всех образцов ювенильной ткани и калиб-
ритов и их конусов роста, большинство из кото-
ровочной реплики (дифракционной решетки с
рых еще невозможно идентифицировать как ак-
шагом 463 нм) получали с использованием фото-
соны или дендриты, за исключением больших
пленки на электронном микроскопе JEM-1200EX
профилей проксимальных дендритов пирамид-
(JEOL, Япония) при увеличении 12000× с одина-
ных нейронов. В качестве стандарта электронной
ковыми настройками колонны микроскопа:
плотности и контраста мы взяли изображения по-
ускоряющее напряжение - 80 кВ, размер пятна - 3,
сле двойного контрастирования с насыщенным
диафрагма объективной линзы - 20 мкм, плот-
водным раствором UAc (в течение 10 или 30 мин,
рис. 1а и 1в соответственно), за которым следова-
ность потока электронов - 44-47 пА/см2. Нега-
ло контрастирование модифицированным краси-
тивы оцифровывали с разрешением 2400 dpi с по-
телем Сато [19] (в течение 1 мин) с обычно ис-
мощью сканнера Epson Perfection V700 в HDR-ре-
пользуемой нами двукратно сниженной концен-
жиме, а небольшие различия в общей плотности
трацией трех солей свинца.
отсканированных пленок были нормализованы
путем получения одинаковой оптической плот-
Профили нейритов на рис. 1в, некоторые из
ности заливочной среды (внеклеточного про-
которых заполнены пучками микротрубочек,
странства) с помощью уровней серых тонов в
четко очерчены плазматическими мембранами.
программе Photoshop. Изображения срезов мозга
Среди слабоконтрастных микротрубочек можно
взрослого животного были получены на элек-
наблюдать чуть более темные цистерны гЭР, от
тронном микроскопе JEM-1400 (JEOL, Япония) с
расширенных участков которых отходят тонкие
помощью камеры AMT XR60 (AMT Imaging,
следы не совсем различимых анастомозирующих
США) при увеличении 6000× (ускоряющее на-
веточек, направленных поперек оси нейрита (го-
пряжение - 80 кВ, размер пятна - 2, диафрагма
ловки стрелок и указатели на врезках на
объективной линзы - 40 мкм, плотность потока
рис. 1а,в). Четко различимы и некоторые другие
электронов - 35 пА/см2) в режиме захвата монта-
внутриклеточные органеллы, такие как митохон-
дрии с плотным матриксом, эндосомальные ком-
жа из взаимоперекрывающихся кадров. Кадры
объединяли в бесшовные изображения с помо-
партменты, кластеры свободных рибосом и ше-
роховатый ретикулум.
щью эластичных трансформаций плагином
TrakEM2 в программе ImageJ [22]. За исключени-
Поскольку осмий, восстановленный с ферро-
ем исходных настроек AMT XR60, ни яркость, ни
или феррицианидом, широко и регулярно ис-
контраст финального изображения не меняли.
пользуют в ультраструктурных исследованиях для
Отдельные изменения контраста исходных изоб-
усиления контраста мембран [26, 27], мы опробо-
ражений отмечены ниже по тексту.
вали все используемые варианты контрастирова-
ния (левые колонки на рис. 1 и 2) на тех же образ-
цах мозга, но осмированных с феррицианидом
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
калия (правые колонки на рис. 1 и 2). Ювениль-
Для оценки способности pОТЕ окрашивать
ная ткань, фиксированная rOs, обладала несколь-
ткань мозга в качестве кандидата на роль идеаль-
кими отличительными особенностями. Некото-
ной модели мы выбрали мозг крысы на втором
рые из них, такие как значительно усиленный
дне постнатального развития по следующим при-
контраст элементарных мембран и гранул глико-
чинам. Во-первых, данный период развития ха-
гена, были описаны давно, но другие также заслу-
рактеризуется массивным ростом и ветвлением
живают внимания. Плазматические мембраны и
нейритов, а также формированием межклеточ-
тонкие цистерны гЭР в таких образцах имеют не-
ных контактов и, следовательно, требует повы-
равномерные волнистые очертания по типу ряби
БИОФИЗИКА том 67
№ 5
2022
932
ШИШКОВА и др.
на поверхности воды. Поскольку оба протокола
лями, обладающими высокой проникающей
фиксации идентичны за исключением добавлен-
способностью в ткани и высокой химической ак-
ного феррицианида калия, то причиной такого
тивностью, все они также содержат атомы тяже-
волнообразного искривления мембран может яв-
лых металлов и, следовательно, могут оказывать
ляться только постфиксация ткани восстанов-
негативное влияние на окружающую среду и здо-
ленным OsO4. И если во взрослом мозге этот не-
ровье человека. А поскольку они являются редко-
достаток на плазматических мембранах менее вы-
земельными металлами (следовательно, не самы-
ражен за счет плотной упаковки нейрональных
ми дешевыми), то вряд ли будут удобны для па-
отростков в нейропиле (см., например, работы
кетного контрастирования большого числа
[28-30]), то большие межклеточные простран-
сеточек или «конвейерного» контрастирования
ства в незрелом мозге этому способствуют. Сво-
лент со срезами (grid-tape) (см., например, работу
бодное расположение тонких цистерн гЭР в ней-
[5].
роплазме также способствует их волнообразной
Контрастирование с pOTE. Полифенолы, на-
форме после обработки с rOs. Нативную форму
пример дубильную кислоту, благодаря ее крася-
тонких цистерн гЭР можно было бы сохранить
щим свойствам уже давно стали использовать в
или отказавшись от использования rOs (левые ко-
электронно-микроскопических исследованиях в
лонки на рис. 1 и 2) или, по-видимому, только с
качестве промежуточного агента до и после осмия
использованием криофиксации ткани (как, на-
для усиления контраста мембран (см., например,
пример, в работе [31]). Как было ранее отмечено в
работы [40, 41]). С тех пор как авторы работы [11]
работе [26], клетки, фиксированные с rOs, про-
предположили, что ОТЕ с более низкой молеку-
являли более слабое прокрашивание нуклеопро-
лярной массой танинов чая улун предпочтитель-
теинов и слабо различимые рибосомы, но после-
нее дубильной кислоты, использование pОТЕ
дующее контрастирование с UAc позволяло их
стало частью нашей повседневной практики, од-
выявлять. Отчасти в противоположность этим
нако мы готовим pОТЕ заново перед каждым
наблюдениям, после применения протоколов
контрастированием срезов. На рис. 1ж,з пред-
контрастирования, использованных в данной ра-
ставлена ткань, окрашенная водным экстрактом
боте, электронная плотность рибосом повыша-
чая, хранившегося около двух месяцев при ком-
лась, но не в достаточной степени.
натной температуре. Можно видеть, что длитель-
Красители на основе лантаноидов. Недавно в
но хранимый pОТЕ обеспечивает хорошее каче-
качестве замены UAc были предложены некото-
ство окраски всех клеточных структур, включая
рые лантаноиды, такие как Sm, Gd, Nd, Yb [32-
внешние и внутренние мембраны, микротрубоч-
36], полиоксометаллаты [37] или гафний [38], а
ки и промежуточные филаменты, митохондрии,
также ставший уже популярным UranyLess (UL),
нуклеопротеины и рибосомы, не уступая резуль-
содержащий соли La, Dy, Gd [39]. Поэтому для
тату контрастирования с UAc или UL (рис. 1а-е).
определения красящих свойств pОТЕ UL также
Кроме того, стоит обратить внимание на другую,
был взят в качестве второго стандарта электрон-
не отмеченную ранее особенность ювенильной
ной плотности и контраста. В то время как общая
ткани мозга, фиксированной с rOs: глиальные
электронная плотность сечений нейритов и кону-
клетки имеют более плотно окрашенную цито-
сов роста, окрашенных с помощью UL (рис. 1д,е),
плазму, что позволяет в незрелой ткани отличать
занимает промежуточное положение между тако-
их профили от профилей нейронов. Цитоплазма
вой на срезах, контрастированныx с UAc в те-
некоторых глиальных клеток и конусов роста, на-
чение 10 и 30 мин, некоторые детали гЭР выяв-
ряду с гранулами гликогена, окрашивается даже
лялись лучше. Лучшее выявление деталей по
более интенсивно с pOTE (рис. 1з), чем с UAc
сравнению с UAc может быть связано со сравни-
(рис. 1б). Также интересно отметить наличие ци-
тельно меньшей молекулярной массой солей лан-
стерн гЭР в тонких терминальных глиальных от-
таноидов и, как следствие, с увеличением плот-
ростках, тогда как традиционно считается, что
ности промежуточных тонов. Это свойство UL
терминальные отростки астроцитов не имеют та-
позволяет наблюдать, как тонкие трубочки гЭР
ких органелл [42-44]. Характерна ли для pOTE
отходят в разных направлениях от уплощенной
способность контрастировать цистерны гЭР в
цистерны гладкого ретикулума в нейрите (рис. 1д,
терминальных отростках астроцитов или наличие
врезка), или лежат параллельно микротрубочкам
таких цистерн является чертой незрелого мозга -
в дендритах, или произвольно расположены в ко-
вопрос для дальнейших исследований.
нусах роста (рис. 1е).
Авторы работы [11] указывали на необходи-
Все соли выше упомянутых лантаноидов обла-
мость использования забуференного фосфатами
дают хотя и несколько отличающейся, но доста-
OTE для лучшего качества окраски. Для сравне-
точной способностью усиливать контраст. Одна-
ния красящих свойств pОТЕ с результатами вы-
ко будучи достаточно хорошо растворимыми со-
шеупомянутых публикаций, полученных с ис-
БИОФИЗИКА том 67
№ 5
2022
ОЦЕНКА ОКРАШИВАНИЯ ТКАНИ МОЗГА ЭКСТРАКТОМ ЧАЯ УЛУН
933
пользованием коммерчески доступного порошка
обеспечивает лучшее качество изображения. Од-
ОТЕ, мы протестировали красящие свойства све-
нако, поскольку мы не проверяли красящие
жеприготовленного чая как с буферами, так и без
свойства pОТЕ при разных pH, мы не можем с
них. Как показано на рис. 2а, окраска свежепри-
уверенностью утверждать, что высокое качество
готовленным pOTE обеспечивает хорошее окра-
изображений обеспечено использованием имен-
шивание рибосом, микротрубочек, проявляет
но какодилатного буфера, а не pH свежеприго-
резко очерченные контуры плазматических мем-
товленного экстракта чая. Поэтому было бы не-
бран, митохондриальных внешней и внутренней
правильно исключать влияние рН. Тем не менее,
мембран, а также хороший общий вид гЭР с глад-
в более ранних работах Симионеску [45], исполь-
кими мембранами и гомогенно зернистым содер-
зуя галлоилглюкозу en bloc в качестве усилителя
жимым цистерн (рис. 2а, врезка). Как можно ви-
контраста, также наблюдали наилучшие резуль-
деть на врезке, окрашивание с pОТЕ позволяет
таты при использовании мышьяк-содержащих
четко идентифицировать даже самые тонкие ци-
буферов.
стерны гЭР с наименьшими их диаметрами
Окрашивание экстрактом чая ткани зрелого моз-
вплоть до считанных нанометров.
га. Для более широкой оценки красящих свойств
На рис. 2в представлена ткань, окрашенная за-
pОТЕ мы анализировали ткань мозга взрослого
буференным какодилатом pОТЕ. В то время как
животного. На рис. 3 представлен срез среднего
общая электронная плотность не сильно отлича-
молекулярного слоя зубчатой фасции, которая
ется от незабуференного pОТЕ (рис. 2а), изобра-
была фиксирована альдегидами и осмирована не-
жение выглядит более четким благодаря чуть бо-
восстановленным OsO4. Ультратонкие cрезы бы-
лее светлому цитозолю, что способствует более
ли окрашены незабуференным водным pОТЕ, а
легкой идентификации внутриклеточных струк-
затем цитратом свинца по Рейнольдсу. Несмотря
тур. Ткань, окрашенная pОТЕ с фосфатным бу-
на хорошо прокрашенные нуклеопротеины и
фером (рис. 2д; pH 7.3-7.4 согласно работе [11]),
постсинаптические уплотнения дендритных ши-
имеет в целом чуть меньшую электронную плот-
пиков, можно заметить, что зрелая ткань имеет
ность и в общем сравнима с тканью, окрашенной
более низкую общую электронную плотность
с UL или длительно хранившимся pOTE.
нейропиля по сравнению с профилями нейритов
незрелой ткани.
Авторами работы [12] после окрашивания ге-
патоцитов с ОТЕ была показана лучшая визуали-
Такому эффекту могло бы быть несколько
зация альфа-частиц (розеток) гликогена по срав-
причин. Во-первых, существуют некоторые отли-
нению с окрашиванием UAc. Но в отличие от ге-
чия в протоколах подготовки тканей: для ткани
патоцитов, такой эффект мы не наблюдали на
взрослого животного использовали фиксатор на
незрелой ткани мозга. Однозначная идентифика-
фосфатном буфере и смолу Agar100 в качестве за-
ция гликогеновых гранул и глиальных клеток
ливочной среды. Во-вторых, возможно, что у зре-
благодаря их более темной цитоплазме была воз-
лой и незрелой тканей способность связывать
можна только при комбинации фиксации ткани с
pОТЕ отличается. Мы также не можем исключить
rOs и последующей окраски срезов безотноси-
то, что комбинация окраски с pОТЕ с последую-
тельно природы контрастирующих растворов
щим контрастированием цитратом свинца по
(UAc, UL, pOTE и/ или модифицированного
Рейнольдсу неэффективна для усиления контра-
свинцового красителя Сато).
ста мембран, в отличие от последующего контра-
стирования тремя солями свинца по Сато. Дей-
Однако фиксация с rOs имеет другое серьезное
ствительно, по сравнению с окраской UAc авторы
ограничение, как впрочем и ТО- и ОТО-подоб-
работы [14] обнаружили лишь умеренное усиле-
ные протоколы постфиксации: микротрубочки
ние контраста на криофиксированных образцах,
становятся практически не различимы на фоне
залитых в смолу Спура, которые затем были окра-
цитозоля (см. правую колонку на рис.
1 и
шены с ОТЕ на фосфатном буфере и контрасти-
рис. 2б,е). В этом отношении использование
рованы цитратом свинца по Рейнольдсу. Также
pОТЕ, забуференного какодилатом с pH 7.6 (в от-
Феллнер с соавторами [46] показали явно мень-
личие от фосфатного буфера), имеет очевидные
ший контраст образцов, залитых в смолу Agar100,
преимущества для идентификации микротрубо-
окрашенных с ОТЕ и контрастированных цитра-
чек и обеспечивает в общем лучшую ультраструк-
том свинца по Рейнольдсу. Несмотря на то что
турную целостность ткани, которая была фикси-
некоторые из этих причин достойны более глубо-
рована с rOs (рис. 2г).
кого рассмотрения, изображение ткани мозга
Согласно опыту других исследователей и на-
зрелого животного, представленного на рис. 3,
шему собственному известно, что фиксация тка-
имеет хорошее качество, которое является доста-
ней млекопитающих в растворах, забуференных
точным для рутинного подсчета синапсов и/или
какодилатом (в отличие от фосфатного буфера),
для полуавтоматической 3D реконструкции.
БИОФИЗИКА том 67
№ 5
2022
934
ШИШКОВА и др.
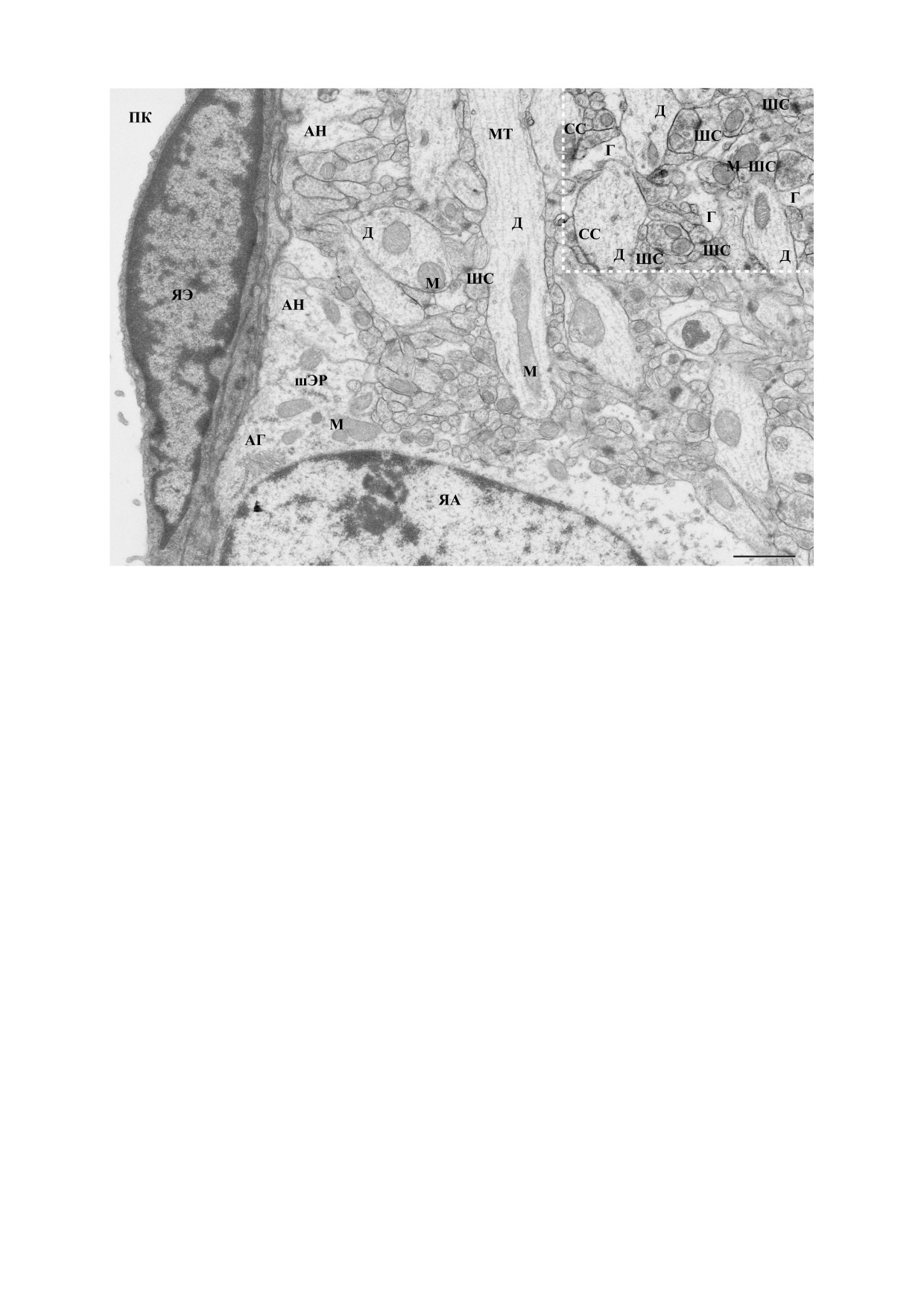
Рис. 3. Ультраструктура зубчатой фасции гиппокампа взрослой крысы. Срез зубчатой фасции окрашен свежеприго-
товленным незабуференным pОТЕ в течение 40 мин и постконтрастирован цитратом свинца. Контраст выделенной
области в верхнем правом углу увеличен для лучшего проявления постсинаптических уплотнений. Сокращения: ПК -
просвет капилляра; ЯЭ - ядро эндотелиальной клетки; ЯА - ядро астроцита; АГ - аппарат Гольджи; АН - астроци-
тарная ножка; ШС - шипиковые синапсы; CC - стволовые синапсы. Остальные сокращения те же, что и на рис. 1.
Шкала 1 мкм.
Предполагаемые механизмы взаимодействия
щих предшественников танинов, таких как кате-
pOTE с тканью. Уже давно было показано, что
хины, кофеин и т.д. Некоторые из них, как и гал-
остаток галловой кислоты в молекуле низкомоле-
лоилглюкоза, также содержат остаток галловой
кулярной галоилглюкозы является эффективным
кислоты, а общая масса катехинов в сухих листьях
усилителем окраски [47]. При том, что относи-
улуна составляет около 8% [49]. В данной работе
тельное содержание галловой кислоты постепен-
мы не пропитывали всю ткань экстрактом чая.
но повышается со временем хранения чая [48],
Тем не менее, в отличие от обработки срезов гал-
для окраски ультратонких срезов мы использова-
лоилглюкозой, окрашивание срезов с pОТЕ обес-
ли чай, собранный 10 лет назад. Поэтому можно
печивает хороший контраст. Учитывая, что неко-
предположить, что наблюдаемое нами усиление
торые полифенолы или катехины связываются с
контраста происходит за счет увеличения в чае
их белковыми мишенями в мембране с образова-
содержания галловой кислоты. Однако авторы
нием устойчивых к растворению детергентами аг-
работы [45] отмечали, что обработка срезов гал-
регатов (см., например, работы [50-52]), нельзя
лоилглюкозой без предварительной пропитки
исключать того, что широкий спектр органиче-
галлоилглюкозой всего образца до заключения в
ских и неорганических веществ, составляющих
смолу не обеспечивала хорошего контраста, а об-
pОТЕ [53], может вносить вклад в усиление кон-
работка галлоилглюкозой как самой ткани, так и
полученных с нее срезов, не увеличивала кон-
траста ткани, в которой каждое вещество находит
траст по сравнению с обработкой лишь только са-
свою нишу для связывания. Несмотря на то что
мой ткани. Но с другой стороны, кроме галловой
точная природа взаимодействия pОТЕ с тканью
кислоты pОТЕ содержит значительное количе-
остается неизвестной, он обеспечивает отличное
ство других низкомолекулярных фенолсодержа-
качество изображений, безопасен в использова-
БИОФИЗИКА том 67
№ 5
2022
ОЦЕНКА ОКРАШИВАНИЯ ТКАНИ МОЗГА ЭКСТРАКТОМ ЧАЯ УЛУН
935
нии/утилизации и обладает некоторыми другими
использовать его для пакетной обработки боль-
преимуществами.
шого числа препаратов.
Иные преимущества окраски с использованием
Другое преимущество использования улуна
pOTE. В отличие от UAc, в результате окраски
может состоять в том, что после трудоемкого при-
срезов с pОТЕ в темноте и при свете мы не обна-
готовления и монтирования ультратонких срезов
ружили каких-либо различий в качестве контра-
есть благоприятная возможность выпить чашку-
стирования, как это было замечено ранее [13]. В
другую ароматного чая, отделив несколько ка-
данной работе для окраски срезов мы использо-
пель для ультратонких срезов. К тому времени,
вали центрифугированный и фильтрованный
когда чаепитие подойдет к концу, срезы будут уже
экстракт, приготовленный из листьев чая. Допол-
окрашены и готовы к последующей обработке со-
нительным преимуществом использования pОТЕ
лями свинца. Таким образом, использование экс-
является отсутствие загрязнений, которых обыч-
тракта чая улун позволяет сочетать исследование
но трудно избежать при окрашивании с UAc. В то
с пользой для здоровья.
же время, некоторые авторы отмечали более ча-
стое загрязнение срезов с ОТЕ, чем с UAc (см.,
БЛАГОДАРНОСТИ
например, работу [46]). Однако, как можно ви-
деть на рис. 1-3, во внеклеточном пространстве
Авторы выражают глубокую благодарность
или просвете капилляра отсутствуют какие-либо
В.Г. Цыгановой (ИТЭБ РАН) за помощь в выде-
крупные или мелкие, сходные с молотым перцем,
лении гиппокампа новорожденных животных.
загрязнения. Также и в других родственных пуб-
ликациях не было информации о большем за-
Исследование было проведено на базе сектора
грязнении после окраски коммерчески доступ-
электронной микроскопии Центра коллективно-
ным ОТЕ. Следовательно, загрязнения, упомяну-
тые в вышеуказанном исследовании, вероятнее
cras.ru/services/tskp/;
всего могут быть следствием неаккуратного обра-
670266/), Пущино, Россия, а также на базе лабо-
щения с сеточками в процессе монтирования и
ратории Электронной микроскопии Открытого
контрастирования срезов, или пропуска стадии
Университета, Милтон-Кинс, Великобритания.
их промывки после контрастирования, которую
рекомендуют некоторые поставщики ОТЕ (напр.,
Science Services GmbH, Германия). Кроме того,
ФИНАНСИРОВАНИЕ РАБОТЫ
коммерчески доступный порошок OTE в отличие
Данное исследование проведено в рамках вы-
от заваренного чая может содержать менее рас-
полнения государственного задания ПНЦБИ
творимые компоненты, которые могут являться
РАН (№ АААА-А20-120101390069-4) при финан-
источником нежелательной контаминации.
совой поддержке Российского фонда фундамен-
тальных исследований (грант № 20-34-90068).
ЗАКЛЮЧЕНИЕ
КОНФЛИКТ ИНТЕРЕСОВ
Проведенное в нашем исследовании усиление
контраста с помощью pOTE ясно показывает, что
Авторы заявляют об отсутствии конфликта
полученный из заваренного листового чая улун
интересов.
насыщенный водный экстракт в комбинации с
какодилатным буфером и/или с повышенным pH
вполне применим в качестве заменителя уранил-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ НОРМ
ацетата в исследованиях центральной нервной
системы. Окрашивание с pOTE даже имеет неко-
Все экспериментальные процедуры проводи-
торые преимущества перед окрашиванием с UAc.
ли в соответствии с: положениями Совета по ис-
pOTE нетоксичен и нерадиоактивен, он лучше
следованиям в области защиты животных и этики
выявляет тончайшие детали гладкого эндоплаз-
Открытого университета и Министерства внут-
матического ретикулума и вполне подходит для
ренних дел Великобритании (PPL 80/2612); Евро-
рутинных исследований мозга взрослых живот-
пейским руководством по содержанию и исполь-
ных. C учетом низкой стоимости чая улун по
зованию лабораторных животных 1986 г. в соот-
сравнению со стоимостью большинства реакти-
ветствии с Этическими принципами Директивы
вов для электронной микроскопии, таких как
Совета ЕС (86/609/EEC); протоколом Комитета
уранилацетат, UranyLess и др., использование
по этике Института теоретической и эксперимен-
экстракта чая в качестве первичного агента в кон-
тальной биофизики (ИТЭБ РАН, Протокол
трастировании ультратонких срезов позволяет
№ 13/2019 от 12.03.2019).
БИОФИЗИКА том 67
№ 5
2022
936
ШИШКОВА и др.
СПИСОК ЛИТЕРАТУРЫ
28. J. Spacek and K. M. Harris, J. Neurosci., 17, 190
(1997).
1.
T. J. Deerinck, E. A. Bushong, V. Lev-Ram, et al., Mi-
croscopy and Microanalysis, 16, 1138 (2010).
29. J. R. Cooney, J. L. Hurlburt, D. K. Selig, et al., J. Neu-
rosci., 22, 2215 (2002).
2.
J. C. Tapia, N. Kasthuri, K. J. Hayworth, et al., Nature
Protocols, 7, 193 (2012).
30. T. Cui-Wang, C. Hanus, T. Cui, et al., Cell, 148, 309
3.
S. Mikula and W. Denk, Nature Methods, 12, 541
(2012).
(2015).
31. N. Jiménez, K. Vocking, E. G. van Donselaar, et al., J.
4.
Y. Hua, P. Laserstein, and M. Helmstaedter, Nature
Struct. Biol., 166, 103 (2009).
Communications, 6, 7923 (2015).
32. M. Nakakoshi, H. Nishioka, and E. Katayama, J. Elec-
5.
Y. Kubota, J. Sohn, S. Hatada, et al., Nature Com-
tron Microsc., 60, 401 (2011).
mun., 9, 437 (2018).
33. N. Hosogi, H. Nishioka, and M. Nakakoshi, Micros-
6.
M. Colonnier, Brain Res., 9, 268 (1968).
copy, 64, 429 (2015).
7.
E. G. Gray, J. Anatomy, 93, 420 (1959).
34. K. Inoue, Y. Muranaka, P. Park, and H. Yasuda, In
8.
A. M. Seligman, H. L. Wasserkrug, and J. S. Hanker, J.
Proc. Eur. Microsc. Congr. (2016), 461.
Cell Biol., 30, 424 (1966).
35. J. Kuipers and B. N. G. Giepmans, Histochem. Cell
9.
L. de Vivo, M. Bellesi, W. Marshall, et al., Science,
Biol., 153, 271 (2020).
355, 507 (2017).
36. A. L. Pinto, R. K. Rai, A. Shoemark, et al., Diagnos-
10.
E. Kim, J. Lee, S. Noh, et al., Appl. Microsc., 50, 14
tics, 11, 1063 (2021).
(2020).
37. A. Moscardini, S. Di Pietro, G. Signore, et al., Sci. Re-
11.
S. Sato, Y. Sasaki, A. Adachi, et al., Med. Electron Mi-
ports, 10, 11540 (2020).
crosc., 36, 179 (2003).
38. K.-I. Ikeda, K. Inoue, S. Kanematsu, et al., Microsco-
12.
S. Sato, A. Adachi, Y. Sasaki, and M. Ghazizadeh, J.
py Research and Technique, 74, 825 (2011).
Microsc., 229, 17 (2008).
39. N. Benmeradi, B. Payre, and S. L. Goodman, Micros-
13.
A. A. Miller and A. V. Simakova, Cell Tissue Biol., 4,
copy and Microanalysis, 21, 721 (2015).
109 (2010).
40. K. Asami, J. Ultrastruct. Mol. Struct. Res. 95, 38
14.
K. Yamaguchi, K.-I. Suzuki, and K. Tanaka, J. Elec-
(1986).
tron Microsc., 59, 113 (2010).
41. R. C. Wagner, J. Ultrastruct. Res., 57, 132 (1976).
15.
X. He and B. I. N. Liu, J. Microsc., 267, 27 (2017).
16.
C. Pinali, H. Bennett, J. B. Davenport, et al., Circ.
42. B. Fernandez, I. Suarez, and G. Gonzalez, Anat. Anz.
Res., 113, 1219 (2013).
156, 31 (1984).
17.
Y. Wu, C. Whiteus, C. S. Xu, et al., Proc. Natl. Acad.
43. A. Reichenbach, A. Derouiche, and F. Kirchhoff,
Sci. USA, 114, E4859 (2017).
Brain Res. Rev., 63, 11 (2010).
18.
V. V. Rogachevskii, Cell Tissue Biol., 7, 487 (2013).
44. B. S. Khakh and M. V. Sofroniew, Nature Neurosci.,
19.
T. Hanaichi, T. Sato, T. Iwamoto, et al., J. Electron
18, 942 (2015).
Microsc., 35, 304 (1986).
45. N. Simionescu and M. Simionescu, J. Cell Biol., 70,
20. V. I. Popov, H. A. Davies, V. V. Rogachevsky, et al.,
608 (1976a).
Neuroscience, 128, 251 (2004).
46. N. Fellner, M. Brandstetter, K. Trimmel, and
21. M. G. Stewart, H. A. Davies, C. Sandi, et al., Neuro-
G. Resch, reSolution, 1, 8 (2012).
science, 131, 43 (2005).
47. N. Simionescu and M. Simionescu, J. Cell Biol., 70,
22. A. Cardona, S. Saalfeld, J. Schindelin, et al., PLoS
622 (1976b).
One, 7, e38011 (2012).
48. M. M.-C. Wang, Y. Yeh, Y.-E. Shih, and J. T.-C. Tzen,
23. E. Kawana, C. Sandri, and K. Akert, Zeitschrift für
J. Food Drug Analysis, 26, 609 (2018).
Zellforschung und Mikroskopische Anatomie, 115, 284
49. M. G. Sajilata, P. R. Bajaj, and R. S. Singhal, Compre-
(1971).
hensive Rev. Food Science Food Safety, 7, 229 (2008).
24. M. Z. Chauhan, J. Arcuri, K. K. Park, et al., iScience,
50. M. Nakayama, K. Shimatani, T. Ozawa, et al., Biosci.,
23, 100836 (2020).
Biotechnol., Biochem., 79, 845 (2015).
25. M. A. Hayat, Principles and Techniques of Electron Mi-
51. M. P. Borisova, A. A. Kataev, and V. S. Sivozhelezov,
croscopy: Biological Applications (Cambridge University
Biochim. Biophys. Acta - Biomembranes, 1861, 1103
Press, 2000).
(2019).
26. M. J. Karnovsky, In Abstr. Book of the 11th Annual Meet.
of the American Society for Cell Biology, Abstracts 284,
52. K. M. Pomier, R. Ahmed, and G. Melacini, Molecules,
146 (1971).
25 (2020).
27. L. A. Langford and R. E. Coggeshall, Anatom. Record,
53. C. Cabrera, R. Giménez, and M. C. López, J. Agricult.
197, 297 (1980).
Food Chem., 51, 4427 (2003).
БИОФИЗИКА том 67
№ 5
2022
ОЦЕНКА ОКРАШИВАНИЯ ТКАНИ МОЗГА ЭКСТРАКТОМ ЧАЯ УЛУН
937
Evaluation of Oolong Tea Extract Staining of Brain Tissue
with Special Reference to Smooth Endoplasmic Reticulum
E.A. Shishkova*, I.V. Kraev**, and V.V. Rogachevsky*
*Institute of Cell Biophysics, Russian Academy of Sciences, ul. Institutskaya 3, Pushchino, Moscow Region, 142290 Russia
**Faculty of Health and Social Care, the Open University, Walton Hall, Milton Keynes, UK, MK7 6AA
Electron microscopy remains the gold standard for studying the nervous system, as it allows adequate spatial
resolution imaging of the finer structures of nervous tissues. Despite the high resolution, correct interpreta-
tion of electron microscopy images is only possible with the sufficient contrast of unit membranes, cytosolic
components and cytoskeleton, which is achieved using hazardous reagents and heavy metals. Earlier, solution
of dry oolong tea extract was introduced as a replacement for toxic and radioactive uranyl acetate. However
staining with oolong extract showed less contrast of intracellular organelles. It is known that depending on
the specimen nature and experimental conditions, different tissues have unequal ability to capture the stain.
Here, oolong tea extract staining of early postnatal and adult rat brain tissue was used for the first time to eval-
uate with transmission electron microscopy. We found that oolong extract obtained from freshly prepared tea
is equal with conventional stains in section staining and has several advantages. We showed that its use on the
immature brain allows to reveal the finest details of the smooth endoplasmic reticulum of neurons. Also, in
combination with osmication with potassium ferricyanide and cacodylate buffer, it provides better visualiza-
tion of the neuronal cytoskeleton and the smooth cisternae in the terminal astrocytic lamellae. A conventional
chemical fixation protocol followed by staining with a saturated oolong tea water extract is also well suited for
routine studies of the brain of adult animals, as well as for multiple grids batch staining.
Keywords: scanning electron microscopy; transmission electron microscopy; oolong tea extract; membrane contrast;
endoplasmic reticulum; hippocampus
БИОФИЗИКА том 67
№ 5
2022