БИОФИЗИКА, 2022, том 67, № 5, с. 938-946
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ЦИТОСТАТИЧЕСКОЕ ДЕЙСТВИЕ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ
ЖЕЛЕЗА С ГЛУТАТИОНОМ НА КЛЕТКИ Escherichia coli
ОПРЕДЕЛЯЕТСЯ КАТИОНАМИ НИТРОЗОНИЯ,
ВЫСВОБОЖДАЮЩИМИСЯ ИЗ ЭТИХ КОМПЛЕКСОВ
© 2022 г. А.Ф. Ванин*, #, В.И. Телегина**, В.Д. Микоян*, Н.А. Ткачев*, С.В. Васильева**
*Федеральный исследовательский центр химической физики им. Н.Н. Семёнова РАН,
ул. Косыгина, 4, Москва, 119334, Россия
Институт биохимической физики им. Н.М. Эмануэля РАН, ул. Косыгина, 4, Москва, 119334, Россия
#E-mail: vanin@polymer.chph.ras.ru
Поступила в редакцию 11.03.2022 г.
После доработки 11.07.2022 г.
Принята к публикации 15.07.2022 г.
Продемонстрировано бактериостатическое действие биядерных динитрозильных комплексов же-
леза с глутатионом на клетки Escherichia coli TN300, определявшееся по колоние-образующей ак-
тивности этих клеток. Бактериостатическое действие, инициированное этими комплексами, резко
усиливалось в присутствии диэтилдитиокарбамата. Предполагается, что этот эффект был обуслов-
лен повышением количества катионов нитрозония (NO+), высвобождавшихся из комплексов в ре-
зультате их распада под действием диэтилдитиокарбамата. Аналогичный результат был получен на
клетках E. coli при их обработке диэтилдитиокарбаматом через 40 мин после контакта клеток с нит-
ритом натрия или S-нитрозоглутатионом. При этом уровень динитрозильных комплексов железа,
появлявшихся в бактериальных клетках под действием нитрита или S-нитрозоглутатиона, был та-
ким же, как и при обработке клеток комплексами с глутатионом. Что касается бактериостатическо-
го эффекта молекул NO, выделявшегося из нитрита или S-нитрозоглутатиона при их кратковремен-
ном контакте с бактериями, в дозовом отношении он был на порядок ниже бактериостатического
действия NO+. Отсюда следует, что именно катионы нитрозония, высвобождающиеся из динитро-
зильных комплексов железа, были ответственны за обнаруженное бактериостатическое действие
этих комплексов на клетки E. coli.
Ключевые слова: динитрозильные комплексы железа, оксид азота, катион нитрозония, S-нитрозоглу-
татион, бактериостатическое действие, клетки Escherichia coli.
DOI: 10.31857/S0006302922050106, EDN: JIRKIZ
В соответствии с современными представле-
тион нитрозония (NO+) - ответственен за подав-
ниями в качестве основного эффектора иммуно-
ление пролиферации бактерий в организме жи-
логической защиты в организме животных и чело-
вотных и человека, обусловленной соответствен-
века при бактериальной инфекции выступает
но превращением молекул NO в пероксинитрит,
система эндогенного оксида азота (NO), продуци-
характеризующийся высокой цитотоксической
руемого ферментативным путем из L-аргинина [1-
активностью [3-6] или способностью NO+ S-нит-
4]. Однако до сих пор остается нерешенным во-
розировать различные жизненно важные белки
прос, какой из компонентов этой системы - NO
[3, 4, 7-9], и тем самым подавлять их активность.
или продукт его одноэлектронного окисления ка-
Цель настоящей работы состояла в попытке
ответить на этот вопрос в экспериментах на клет-
Сокращения: ДНКЖ -динитрозильные комплексы железа, ках Escherichia coli c использованим в качестве до-
М-ДНКЖ - моноядерная форма динитрозильных комплек-
сов железа, Б-ДНКЖ - биядерная форма динитрозильных
норов NO and NO+ динитрозильных комплексов
комплексов железа, МНКЖ - мононитрозильные комплек-
железа (ДНКЖ). Как было показано в работах
сы железа, ДЭТК - диэтилдитиокарбамат, МГД - N-метил-
[10-12], появление этих агентов в ДНКЖ опреде-
D,L-глюкаминдитиокарбамат, GSH - глутатион, Б-ДНКЖ-
ляется механизмом их образования, определяе-
GSH - биядерные динитрозильные комплексы железа с глу-
мым реакцией диспропорционирования молекул
татионом, GS-NO - S-нитрозоглутатион, КОА - колониеоб-
NO, попарно связывающихся с ионом двухва-
разующая активность, СТС - сверхтонкая структура.
938
ЦИТОСТАТИЧЕСКОЕ ДЕЙСТВИЕ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА
939
лентного железа в присутствии тиолсодержащих
[(RS-)2Fe+(NO+)2] или [(RS-)2Fe2+(NO+)(NO)].
(RS-) лигандов, как это показано на схеме 1. В со-
Что касается возможного гидролиза катиона нит-
ответствии с этой схемой появляющийся в ходе
розония, появляющегося в ДНКЖ в результате
диспропорционирования молекул NO анион
диспропорционирования молекул NO, его взаи-
нитроксила (NO-) гидролизуется, т. е. протони-
модействие с анионом гидроксила, которое при-
руется и выходит в форме молекулы нитроксила
водило бы к трансформации NO+ в азотистую
(НNO) из лигандного окружения железа с после-
кислоту или нитрит, блокируется в результате
дующей трансформацией двух молекул HNO в за-
кись азота (N2O) и воду. Освободившееся место у
нейтрализации положительного заряда на этом
нитрозильном лиганде электронной плотностью,
иона железа занимает третья молекула NO, что и
приводит к образование моноядерной формы
поступающей на него от атомов тиоловой серы
ДНКЖ (М-ДНКЖ), характеризующейся в соот-
тиолсодержащих лигандов, характеризующихся
ветствии со схемой 1 резонансной структурой
высокой π-донорной активностью.
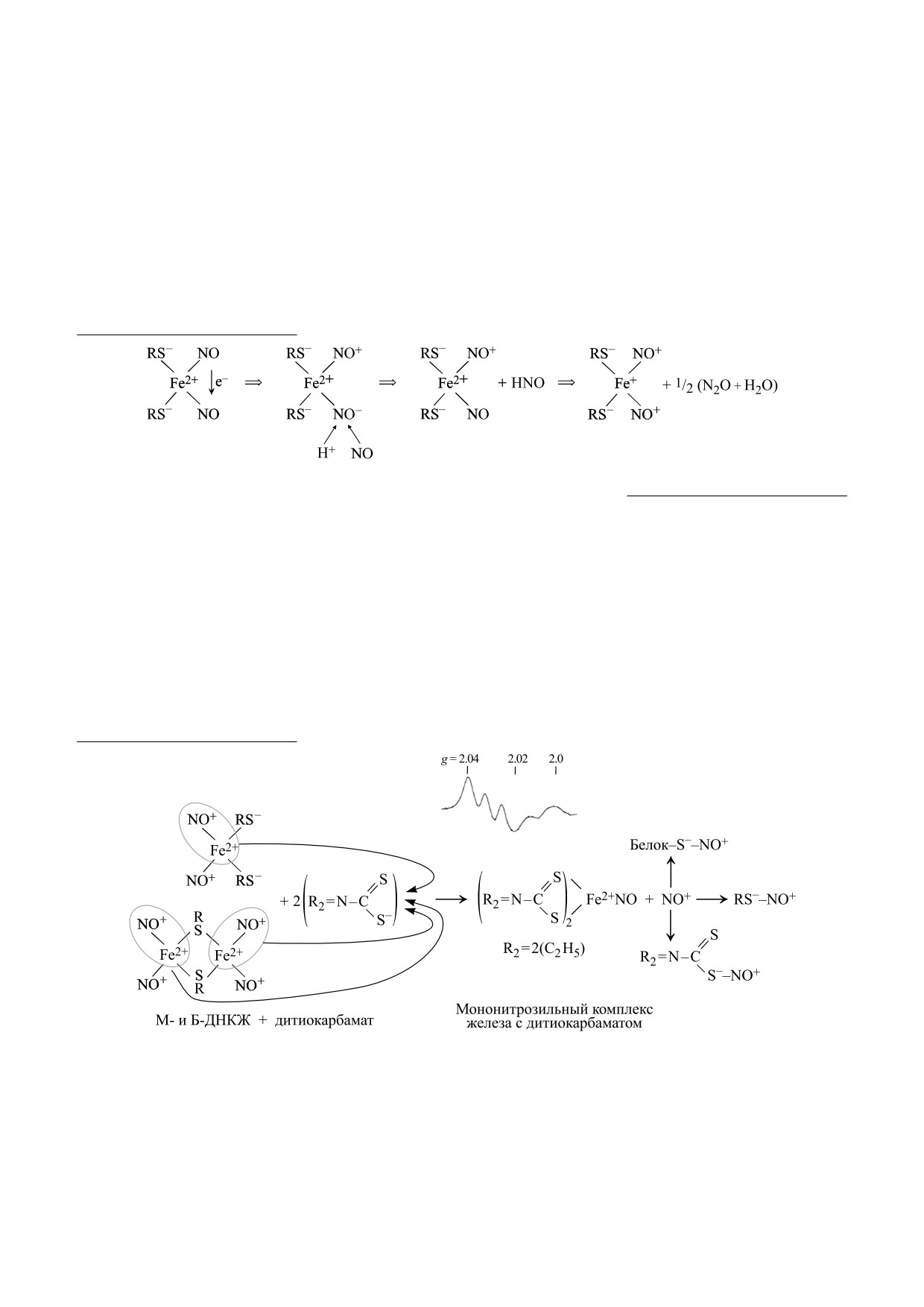
Схема 1. Механизм образования М-ДНКЖ с тиолсодержащими лигандами в реакции Fe2++ NO + RS- [10-12].
Как показано в работах [10-13], приведенные
железа или тиолсодержащих лигандов. Среди
выше резонансные структуры для М-ДНКЖ ха-
агентов, вызывающих распад этих комплексов,
рактерны и для биядерной формы ДНКЖ
особое место занимают производные дитиокар-
(Б-ДНКЖ)
-
[(RS-)2Fe2+2(NO+)2(NO)2] или
бамата (формула R2=N-CS2). Этим соединения
[(RS-)2Fe2+2(NO+)4].
способны перехватывать на себя железомононит-
Согласно данным, приводимым в работах [11,
розильную группу [Fe2+-NO] из железодинитро-
12], катионы нитрозония, также, как и молекулы
зильных фрагментов [Fe2+-(NO)(NO+)] ДНКЖ с
NO, могут высвобождаться из ДНКЖ, причем в
последующим образованием стабильных, ЭПР-
равном количестве, в ходе установлении химиче-
детектируемых мононитрозильных комплексов
ского равновесия между этими комплексами и их
компонентами, а также при необратимом распаде
(МНКЖ) с производными дитиокарбамата, как
последних, обусловленным удалением из ДНКЖ
это показано на схеме 2 [14-16].
Схема 2. Механизм превращения Б-ДНКЖ и М-ДНКЖ с тиолсодержащими лигандами в МНКЖ с ДЭТК или
МГД. Высвобождающиеся при этом катионы нитрозония могут S-нитрозировать низкомолекулярные и
белковые тиолы, а также тиоловую группу в составе ДЭТК или МГД. На врезке сверху приводится
зарегистрированный при 77 К ЭПР-сигнал со значениями g-фактора 2.04 и 2.02 и триплетной сверхтонкой
структурой, характерный для МНКЖ с производными дитиокарбамата.
БИОФИЗИКА том 67
№ 5
2022
940
ВАНИН и др.
Ранее такого рода трансформация ДНКЖ под
GSH в 15 мМ HEPES-буфере при pH 8.0 соответ-
действием производных дитиокарбамата — ди-
ственно в верхней и нижней частях аппарата Тун-
этилдитиокарбамата (ДЭТК) и N-метил-D,L-
берга с последующей откачкой воздуха из аппара-
глюкаминдитиокарбамата (МГД) в живых орга-
та в него вводили NO. Затем после 5 мин встряхи-
низмах была продемонстрирована нашей груп-
вания аппарата, растворы железа и GSH
пой [15, 16].
смешивали в атмосфере NO, снова встряхивали
5-10 мин, что было достаточно для образования
Было показано, что в клетках и тканях образу-
Б-ДНКЖ-GSH, после чего из аппарата откачива-
ющиеся в ходе этой трансформации МНКЖ-
ли NO и определяли по интенсивности полос по-
ДЭТК или МНКЖ-МГД жестко связывают ней-
глощения на 310 и 360 нм с коэффициентами экс-
тральные молекулы NO, предотвращая тем са-
тинкции, соответственно равными ε = 4600 и
мым действие этих молекул, исходно входивших
в ДНКЖ, на их биологические мишени. В резуль-
3700 M-1 см-1 (в пересчете на один атом железа в
тате молекулы NO «выходят из игры». Что касает-
Б-ДНКЖ), концентрацию полученного ком-
ся катионов нитрозония, в соответствии со схе-
плекса [13].
мой 2 они высвобождаются из распадающихся
Синтез S-нитрозоглутатиона (GS-NO), осно-
ДНКЖ в свободной форме с последующим свя-
ванный на способности азотистой кислоты
зыванием с различными тиолами. Как было пока-
(HNO2), возникающей при протонировании на-
зано в работах [17, 18], взаимодействие этих
трита в кислой среде, инициировать S-нитрози-
катионов именно с тиолами, приводящее к обра-
рование тиолов, проводили следующим образом.
зованию S-нитрозотилов, а не с анионами гид-
11 мМ раствор GSH смешивали на воздухе с
роксила, приводящее к гидролизу этих катионов,
10 мМ раствором нитрита натрия с последующим
определяется существенно большим сродством
подкислением исходно нейтрального раствора до
катионов нитрозония к тиолам.
рН 2-3, что сразу же приводило к розовому окра-
Предполагается, что происходящее при этом
шиванию раствора. Через полтора часа рН рас-
S-нитрозирование разнообразных тиолсодержа-
твора повышали до нейтральных значений. Кон-
щих белков могло обеспечивать цитотоксическое
центрацию полученного таким образом GS-NO
действие ДНКЖ [19-24]. Такого рода действие
оценивали по интенсивности его полосы погло-
Б-ДНКЖ с меркаптосукционатом наблюдалось
щения на 334 нм с ε = 980 M-1 см-1.
нами также на культуре опухолевых клеток
Эксперименты на бактериальных клетках. В
MCF7, оно резко усиливалось в присутствии
экспериментах на бактериальных клетках Esche-
МГД, повышавшего уровень катионов, высво-
richia coli TN530 их выживаемость оценивали по
бождавшихся из Б-ДНКЖ [25].
величине колониеобразующей активности (КОА)
Цель настоящей работы состояла в детальном
(в % по отношению к той же величине для необ-
изучении вклада ДЭТК в антибактериальное
работанных, контрольных клеток). Суспензию
(бактериостатическое) действие Б-ДНКЖ с глу-
клеток выращивали на жидкой среде LB при 37°С
татионом (GSH) на бактерии Escherichia coli с тем,
в течение 18 ч. Затем аликвоту разбавляли той же
чтобы определить какой из компонентов этих
средой в соотношении 1 : 50 и выращивали в ней
комплексов - молекулы NO или катионы нитро-
клетки 3 ч до экспоненциальной стадии - до тит-
зония - способны подавлять размножение этих
ра (3-5)·108 кл/мл, соответствовавшего стандарт-
клеток (их колониеобразующую активность).
ному (контрольному) образцу. Изучение влияния
Б-ДНКЖ-GSH, нитрита натрия и GS-NO на бак-
МАТЕРИАЛЫ И МЕТОДЫ
териальные клетки проводили следующим обра-
зом: 1) определялась дозовая зависимость бакте-
Материалы. Были использованы сульфат же-
риостатического действия этих агентов по от-
леза (Fluka, Швейцария), восстановленный глу-
дельности; 2) и 3) определялось влияние ДЭТК на
татион, нитрит натрия и диэтилдитиокарбамат
бактеростатическое действие указанных агентов
натрия ( Sigma, США). Газообразный NO получа-
при одновременном введении в клеточную куль-
ли в реакции сульфата железа с нитритом натрия
туру ДЭТК и каждого из этих агентов или при
в 0.1 M HCl с последующей очисткой методом
введении ДЭТК через 40 мин после контакта кле-
низкотемпературной сублимации в вакууме [13].
ток с Б-ДНКЖ-GSH, нитритом натрия и GS-NO.
Синтез биядерных динитрозильных комплексов
В первом случае 1 мл Б-ДНКЖ-GSH, нитрита на-
железа с глутатионом и S-нитрозоглутатиона. Би-
трия или GS-NO в возрастающей концентрации
ядерные комплексы железа с глутатионом
добавляли в кювету с 1 мл клеток. Смесь инкуби-
(Б-ДНКЖ-GSH) синтезировали обработкой рас-
ровали в течение 30 мин, а затем инокулировали
творов сульфата железа и GSH газообразным NO
на агаре с разбавлением 1 : 10 с последующим ин-
при молярном соотношении Fe2+: GSH, равном
кубированием на нем в течение 24 ч при 37°С и
1 : 2, и давлении NO 100-150 мм рт. ст. После раз-
последующим (для оценки бактериостатической
мещения 0.5 мл раствора сульфата железа в ди-
активности Б-ДНКЖ-GSH, нитрита натрия или
стиллированной воде (pH 5.5) и 4.5 мл раствора
GS-NO) подсчетом колоний - величины КОА
БИОФИЗИКА том 67
№ 5
2022
ЦИТОСТАТИЧЕСКОЕ ДЕЙСТВИЕ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА
941
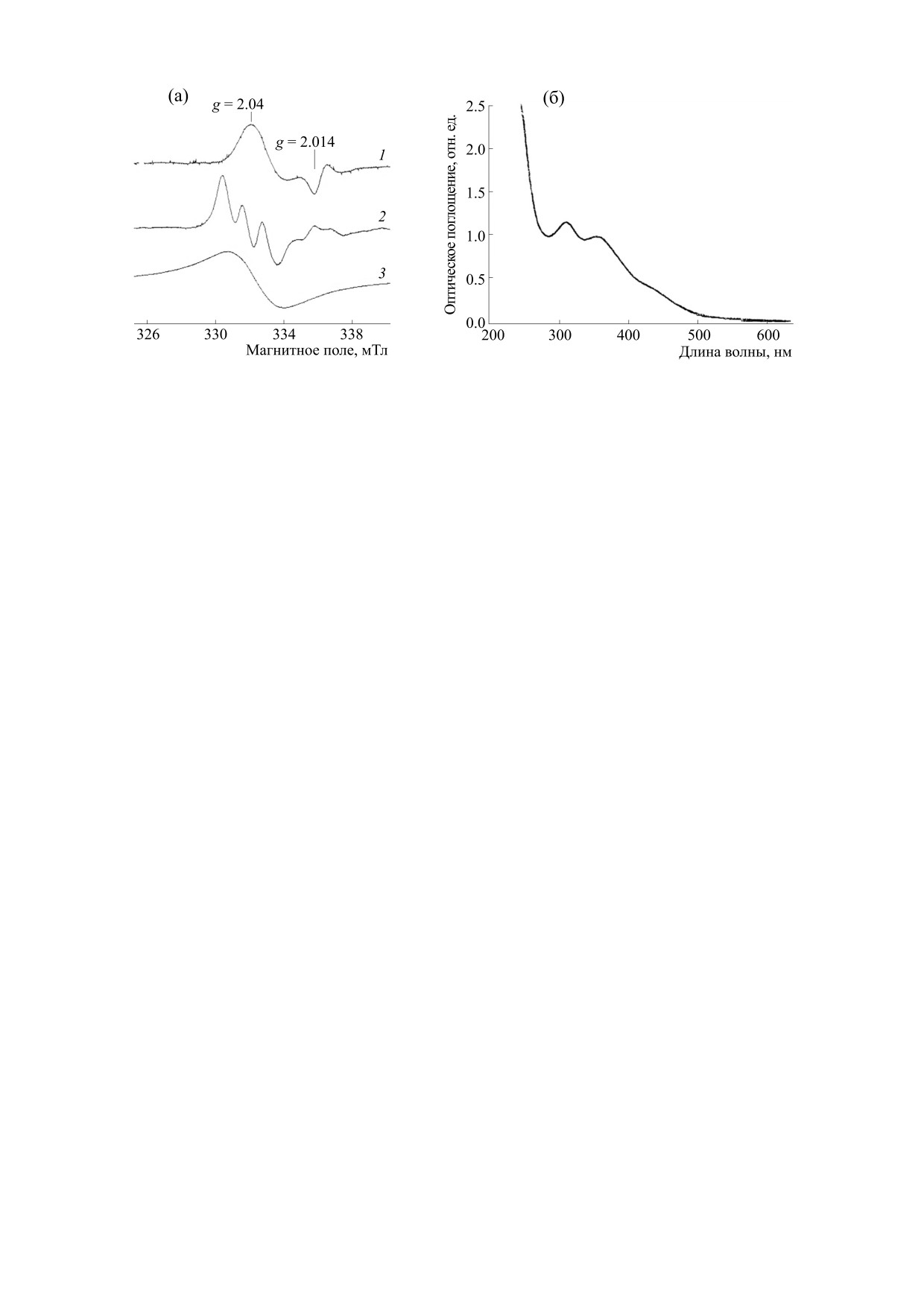
Рис. 1. (а) - Сигналы ЭПР М-ДНКЖ с тиолсодержащими лигандами (спектр 1) и МНКЖ-ДЭТК, зарегистрированные для
последних в гидрофобной (спектр 2) или водной (спектр 3) средах. Запись при 77 К. (б) - Спектр оптического поглощения
Б-ДНКЖ-GSH.
в % (1 клетка = 1 колония). Таким же образом
ризующимися сигналом ЭПР с g⊥ = 2.04 и g⎥⎥ =
изучали влияние ДЭТК (2.5 мМ) на бактериоста-
= 2.014 (gср = 2.03), называемым сигналом 2.03
тическое действие на бактерии Б-ДНКЖ-GSH,
[26] и приведенным на рис. 1а, Б-ДНКЖ-GSH
нитрита натрия или GS-NO (в концентрации
диамагнитны и, следовательно, ЭПР-недетекти-
0.5 мМ) при одновременном введении с ними
руемые. Как указывалось выше, их концентрация
ДЭТК или через 40 мин после них.
могла определяться по интенсивности их полос
Оптические и ЭПР-измерения. Оптические из-
оптического поглощения на 310 и 360 нм в спек-
мерения растворов Б-ДНКЖ-GSH проводили на
тре, приводимом на рис. 1б.
спектрофотометре UV-2501PC (Shimadzu Europa
Что касается сигнала ЭПР МНКЖ-ДЭТК, то,
GmbH, Германия) в плоских кварцевых кюветах с
будучи растворимыми в гидрофобных средах, на-
оптическим путем 10 мм при комнатной темпера-
пример, в клеточных мембранах, эти комплексы,
туре на воздухе. ЭПР-спектры М-ДНКЖ с тиол-
в соответствии с результатами предыдущих пуб-
содержащими лигандами (GSH и клеточными
ликаций [15, 16], характеризовались сигналом
тиолсодержащими белками), а также ЭПР-спек-
ЭПР, приведенным на рис. 1а (со средним значе-
тры МНКЖ-ДЭТК, возникавших в бактериаль-
нием g-фактора 2.04 и разрешенной триплетной
ной культуре, регистрировали при 77 К в кварце-
сверхтонкой структурой (СТС)). Если же эти
вом сосуде Дьюара с жидким азотом на модифи-
комплексы локализовались в водной среде, где
цированном радиоспектрометре RadioPan
они были слабо растворимыми, триплетная СТС
(Польша) при СВЧ мощности 5 мвТ и амплитуте
в их сигнале «смазывалась», в результате чего сиг-
ВЧ модуляции магнитного поля, равной 0.2 мТл.
нал трансформировался в бесструктурный сим-
Концентрацию ЭПР-активных парамагнитных
метричный синглет с центром при g = 2.04, при-
центров оценивали методом двойного интегри-
веденный на рис. 1а.
рования их сигналов ЭПР, используя в качестве
стандарта М-ДНКЖ-GSH с известной концен-
Антибактериальное (бактериостатическое) дей-
трацией. Часть ЭПР-измерений проводилась при
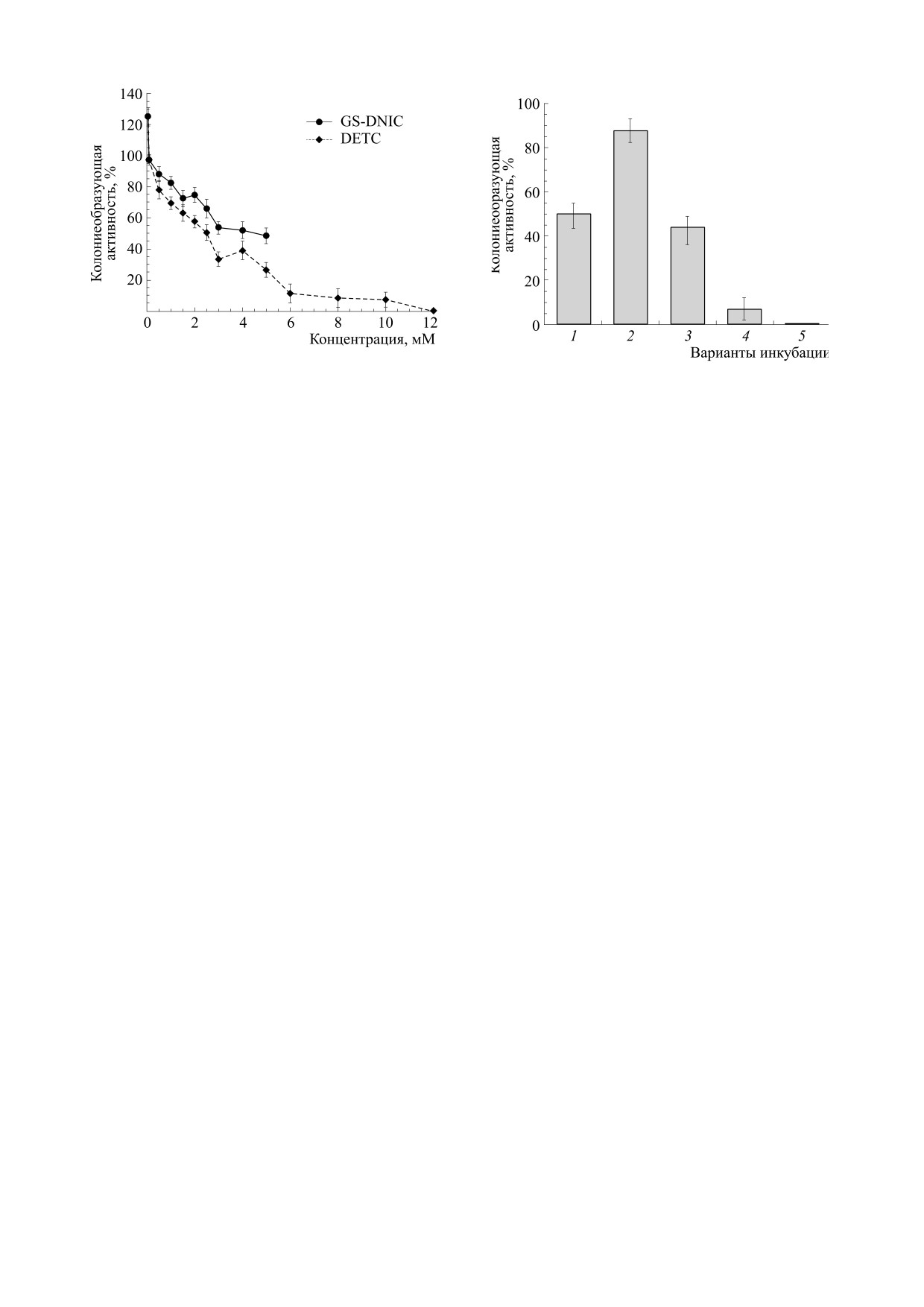
ствие Б-ДНКЖ-GSH на клетки E. coli. Как следует
комнатной температуре с использованием квар-
из рис. 2, клетки E. coli оказались достаточно
цевых капилляров диаметром 1 мм, в которые по-
устойчивыми к бактериостатическому действию
мещали исследуемые растворы.
на них Б-ДНКЖ-GSH. 50%-я величина КОА до-
стигалась лишь при ~5 мМ концентрации этих
Статистическая обработка результатовю Каж-
комплексов. Более того, при их низких концен-
дый результат оценивался как среднее трех неза-
трациях (0.03-0.1 мМ) способность клеток к раз-
висимых измерений ± стандартное отклонение
множению даже повышалась: КОА возрастала по
(M ± SD)
сравнению с контролем до 120%. Аналогичный
эффект обнаруживался и в опытах с обработкой
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
клеток ДЭТК.
Физико-химические характеристики Б-ДНКЖ-
Как указывалось выше, влияние ДЭТК на бак-
GSH и МНКЖ-ДЭТК. В противоположность М-
териостатическое действие Б-ДНКЖ-GSH было
ДНКЖ с тиолсодержащими лигандами, характе-
изучено при их концентрациях соответственно
БИОФИЗИКА том 67
№ 5
2022
942
ВАНИН и др.
Рис. 2. Дозовая зависимость влияния Б-ДНКЖ-GSH и
Рис. 3. Влияние на колониеобразующую активность
ДЭТК на колониеобразующую активность клеток E. coli
бактерий E. coli TN530 добавления к ним ДЭТК
TN530.
(2.5 мМ, колонка 1), Б-ДНКЖ-GSH (0.5 мМ, колон-
ка 2), предполагаемого суммарного действия ДЭТК и
Б-ДНКЖ-GSH при отсутствии взаимодействия меж-
2.5 и 0.5 мМ, для которых, согласно дозовым кри-
ду ними (колонка 3), при одновременном введении в
вым, приведенным на рис. 2, величины КОА ока-
клеточную культуру Б-ДНКЖ-GSH и ДЭТК
зались равными 50 ± 5% и 88 ± 5%. В соответ-
(колонка 4), при введении ДЭТК через 40 мин после
ствии с этими величинами, если бы Б-ДНКЖ-
введения Б-ДНКЖ-GSH (колонка 5).
GSH и ДЭТК действовали на клетки одновремен-
но, не влияя на состояние друг от друга, то, со-
Если же ДЭТК вводили через 40 мин после
гласно теории независимых вероятностных про-
Б-ДНКЖ-GSH, то в клеточной культуре при 77 К
цессов, их суммарное действие определялось бы
регистрировался сигнал ЭПР с триплетной СТС,
44%-й величиной КОА (рис. 3, колонка 3). В ре-
приведенный на рис.
1а, характерный для
альности же при одновременном контакте клеток
МНКЖ-ДЭТК, локализованного в гидрофобной
с ДЭТК и Б-ДНКЖ-GSH эта величина снижа-
среде, очевидно, в клеточных мембранах. Этот
лась до 7 ± 5% (рис. 3, колонка 4). Если же ДЭТК
сигнал регистрировался вместо ЭПР-сигнала
добавляли к клеткам через 40 мин после введения
2.03, приведенного на рис. 1а и наблюдавшегося в
Б-ДНКЖ-GSH, клетки полностью прекращали
клетках к этому времени перед добавлением
размножаться - величина КОА снижалась до ну-
ДЭТК.
левого уровня (рис. 3, колонка 5).
Таким образом есть все основания утверждать,
В соответствии с данными, приводимыми во
что резкое усиление бактериостатического дей-
«Введении», столь резкое усиление бактериоста-
ствия Б-ДНКЖ-GSH при одновременном введе-
тического действия Б-ДНКЖ-GSH под влияни-
нии с ним ДЭТК было обусловлено катионами
нитрозония, высвобождавшимися из Б-ДНКЖ-
ем ДЭТК могло быть обусловлено распадом
GSH. Что касается молекул NO, исходно входив-
Б-ДНКЖ-GSH, сопровождающимся, согласно
ших в состав этих комплексов, они включались в
схеме 2, образованием ЭПР-активных МНКЖ-
устойчивые МНКЖ-ДЭТК, и как сказано выше,
ДЭТК и высвобождением из Б-ДНКЖ-GSH ка-
«выходили из игры», т.е. не могли оказывать на
тионов нитрозония, которые и могли оказывать
клетки никакого действия.
на бактериальные клетки негативное действие.
ЭПР-измерения клеточной массы полностью
Сигнал 2.03, характерный для М-ДНКЖ с
подтвердили это предположение. Вместо сигнала
тиолсодержащими лигандами, не обнаруживался
ЭПР с g⊥ = 2.04 и g⎥⎥ = 2.014 (gср = 2.03), характер-
в клетках, не обработанных Б-ДНКЖ-GSH. Не
обнаруживался в этих клетках после их обработки
ного для МНКЖ с тиолсодержащими лигандами
ДЭТК и сигнал ЭПР, характерный для МНКЖ-
(сигнала 2.03), регистрируемого при 77 К в клет-
ДЭТК.
ках, обработанных только Б-ДНКЖ-GSH и при-
веденного на рис. 1а, при одновременном введе-
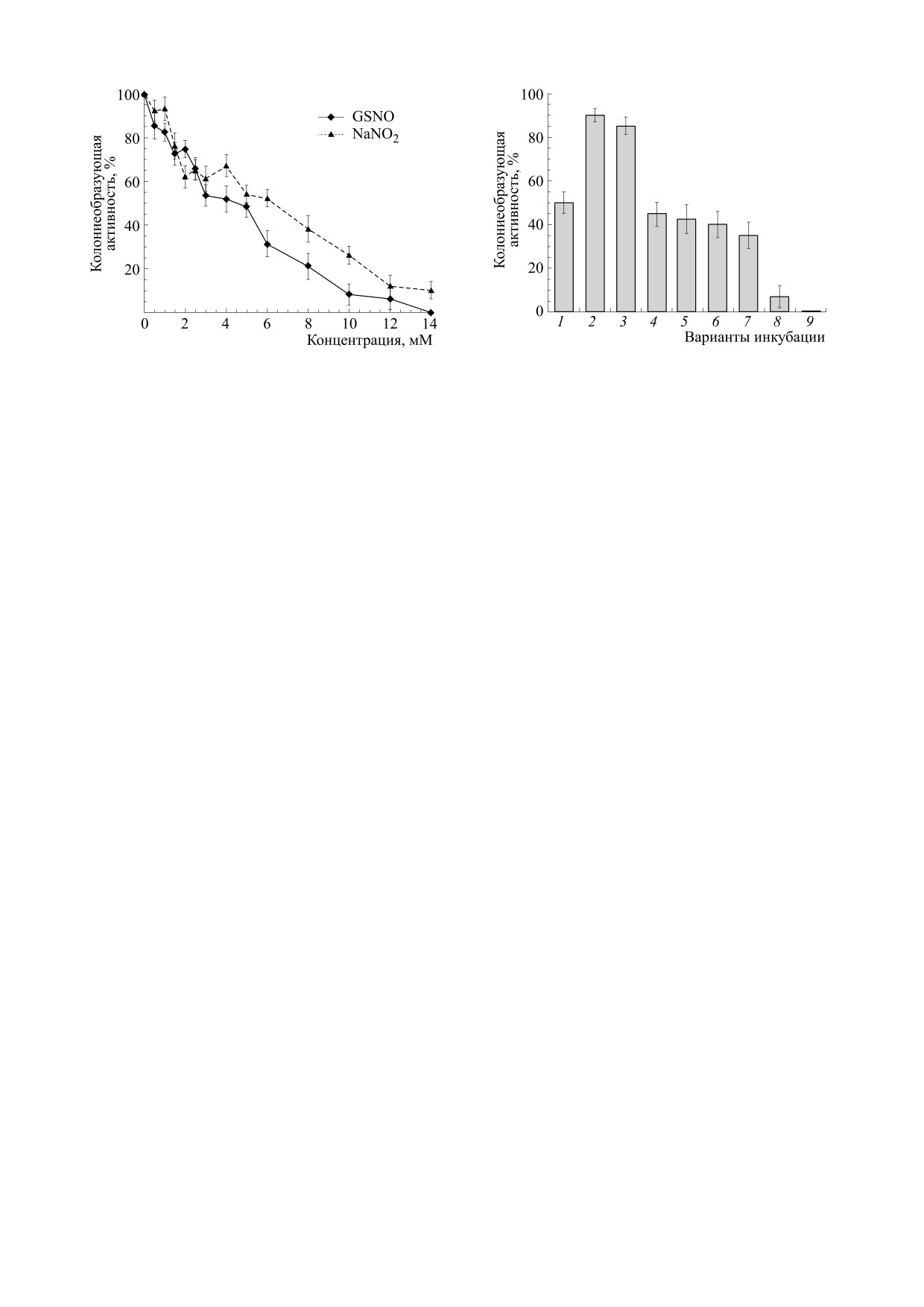
Бактериостатическое действие на клетки E. coli
нии ДЭТК в клетках регистрировался бесструк-
нитрита натрия (NaNO2) и S-нитрозоглутатиона.
турный синглетный сигнал ЭПР, приведенный
Устойчивость клеток E. coli к бактериостатиче-
на рис. 1а и характерный для МНКЖ-ДЭТК, ло-
скому действию NaNO2 и GS-NO в дозовом отно-
кализованного в водной среде, очевидно, в меж-
шении (рис. 4) оказалась примерно такой же, как
клеточной жидкости.
и для Б-ДНКЖ-GSH - для всех них 50%-я вели-
БИОФИЗИКА том 67
№ 5
2022
ЦИТОСТАТИЧЕСКОЕ ДЕЙСТВИЕ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА
943
Рис. 4. Дозовая зависимость бактериостатического
Рис. 5. Влияние на колониеобразующую активность
действия нитрита натрия и GS-NO на клетки E. coli
клеток E. coli TN530 2.5 мМ ДЭТК (колонка 1),
TN530.
0.5 мМ NaNO2 или GS-NO (колонки 2 и 3), предпо-
лагаемого суммарного действия 2.5 мМ ДЭТК и
0.5 мМ NaNO2 или 0.5 мМ GS-NO при отсутствии
взаимодействия между ними (колонки 4 и 5), при од-
чина КОА достигалась при ~5 мМ концентрации
новременном введении в клеточную культуру 2.5 мМ
этих соединений.
ДЭТК и 0.5 мМ NaNO2 или 0.5 мМ GS-NO
Это совпадение могло определяться тем, что
(колонки 6 и 7), при введении 2.5 мМ ДЭТК через
уже через 40 мин инкубации клеток в 0.5 мМ
40 мин после введения 0.5 мМ NaNO2 или 0.5 мМ
GS-NO (колонки 8 и 9).
NaNO2 или GS-NO в них, судя по появлению сиг-
нала 2.03, возникали М-ДНКЖ с тиолсодержа-
щими лигандами, причем в концентрации, при-
ром случае, но не при участии ДНКЖ, а при уча-
мерно равной концентрации этих комплексов в
стии главным образом NO, происходившего из
бактериальных клетках, обработанных 0.5 мМ
NaNO2 или GS-NO и железа, включавшегося в
Б-ДНКЖ-GSH. Этот результат полностью согла-
образование МНКЖ-ДЭТК из инкубационной
суется с предыдущими результатами нашей груп-
среды и из бактерий.
пы [12, 16], а также данными других авторов [27-
29] о появлении в микроорганизмах, клетках и
Образование МНКЖ-ДЭТК не из М-ДНКЖ и
тканях животных как М-, так и Б-ДНКЖ с тиол-
Д-ДНКЖ, а в реакции ДЭТК с NO и примесным
содержащиими лигандами при контакте указан-
железом не могло приводить к появлению в кле-
ных биообъектов с нитритом или S-нитрозотио-
точной культуре катионов нитрозония, что, оче-
лами, очевидно, в результате поступления в них
видно, и вело к тому, что при одновременном до-
газообразного NO, высвобождавшегося из этих
бавлении к клеткам ДЭТК, NaNO2 или GS-NO не
соединений. При снижении времени контакта
наблюдалось заметное влияние ДЭТК на бакте-
бактериальных клеток с 0.5 мМ NaNO2 или GS-
риостатическое действие нитрита и GS-NO.
NO до 3-5 мин образование заметного количе-
ства ДНКЖ с тиолсодержащими лигандами не
Результаты ЭПР-измерений, которые позво-
обнаруживалось.
лили нам сделать этот вывод, состояли в следую-
щем. При обработке бактериальных клеток
Что касается стимулирующего влияния ДЭТК
ДЭТК через 40 мин после их контакта c NaNO2
на бактериостатическое действие 0.5 мМ NaNO2
или GS-NO в клетках при 77 К регистрировался
или GS-NO, в отличие от аналогичных опытов с
сигнал ЭПР МНКЖ-ДЭТК с триплетной СТС,
Б-ДНКЖ-GSH, оно обнаруживалось при добав-
приведенный на рис. 1а. Это означает, что ком-
лении ДЭТК только через 40 мин после введения
плексы возникали при взаимодействии с ДНКЖ,
NaNO2 и GS-NO и не имело места при одновре-
возникшими в клетках, в гидрофобных компарт-
менном введении ДЭТК и этих агентов (рис. 5,
ментах которых локализовались растворяющиеся
соответственно колонки 8, 9 и 6, 7).
в них МНКЖ-ДЭТК. Этот процесс и приводил к
При этом, судя по приводимым ниже резуль-
появлению в клетках катионов нитрозония, по-
татам ЭПР-анализа, в первом случае МНКЖ-
давлявших размножение этих клеток. Прн одно-
ДЭТК возникали в результате взаимодействия
временной обработке клеток ДЭТК, NaNO2 или
ДЭТК с М-ДНКЖ и Б-ДНКЖ, возникавшими до
GS-NO в клеточной культуре при 77 К регистри-
этого в присутствии NaNO2 или GS-NO. МНКЖ-
ровался бесструктурный симметричный сигнал
ДЭТК возникали в клеточной культуре и во вто-
МНКЖ-ДЭТК, приведенный на рис. 1в, что сви-
БИОФИЗИКА том 67
№ 5
2022
944
ВАНИН и др.
детельствовало о локализации этих комплексов
ного NO, ни избыток железа (соответственно в
не в клетках, а в водной межклеточной среде, ха-
экспериментах с обработкой клеток газообраз-
рактеризуюшейся слабой растворимостью в ней
ным NO или Б-ДНКЖ-GSH) не влияли на кон-
МНКЖ-ДЭТК. Отсюда следует, что эти ком-
центрацию образующихся ДНКЖ, есть основа-
плексы возникали не в реакции ДЭТК с ДНКЖ,
ние утверждать, что лиимитирующим фактором в
которые могли бы возникать в клетках, а в меж-
образовании этих комплексов могли выступать
клеточной среде в реакции ДЭТК с NO, образую-
клеточные тиолсодержащие соединения (пре-
щимся из NaNO2 или GS-NO, и ионами Fe2+, ко-
имущественно тиолсодержащие белки).
торые могли поступать из среды инкубации или
Что касается уровня МНКЖ-ДЭТК, возни-
из самих клеток. Очевидно, что этот процесс не
кавших в клетках после их одновременной обра-
мог приводить к появлению в межклеточной сре-
ботки ДЭТК (2.5 мМ) и 0.5 мM NaNO2 или GS-
де катионов нитрозония.
NO, он оказался равным 50 мкM. Это означает,
что количество NO, быстро возникавшего из нит-
Последнее полностью согласуется с результа-
рита или GS-NO и включавшегося в МНКЖ-
тами измерений КОА клеток при одновременном
ДЭТК было не ниже этой концентрации. Она
их контакте с ДЭТК, NaNO2 или GS-NO (рис. 5,
оказалась существенно большей уровня
колонки 6 и 7). Величины КОА составляли соот-
М-ДНКЖ и Б-ДНКЖ с эндогенными тиолсодер-
ветственно 40 ± 5 и 35 ± 5%, что было сопостави-
жащими лигандами, возникавших в клетках
мо с рассчитанными величинами КОА, при одно-
(~1.5 и 5 мкM) через 40 мин их инкубации с нит-
временном (суммарном), независимом друг от
ритом или GS-NO. Соответственно и уровень вы-
друга действии ДЭТК, нитрита натрия или GS-
свобождавшихся из них катионов нитрозония
NO на бактериальныен клетки (рис. 5, колонки 4
был на том же низком уровне. Тем не менее, бак-
и 5).
териостатический эффект, вызываемый NO
Концентрации ДНКЖ с тиолсодержащими ли-
(50 мкM), возникавшего из нитрита и GS-NO
гандами и МНКЖ-ДЭТК в клеточной суспензии.
(колонки 2 и 3 на рис. 5), был существенно ниже
Сигнал ЭПР М-ДНКЖ с тиолсодержащими ли-
про сравнению с действием на клетки катионов
гандам (сигнал 2.03), превращающийся в более
NO+ (1,5 - 5 мкM), высвобождавшихся под дей-
интенсивный сигнал ЭПР с триплетной СТС
ствием ДЭТК из М- и Б-ДНКЖ, возникших в
МНКЖ-ДЭТК, мы зарегистрировали в клетках
клетках через 40 мин их инкубации с нитритом
E. coli после их обработки сначала газообразным
или GS-NO (колонки 8 и 9 на рис. 5). Этот факт
NO при давлении 100 торр в течение 15 мин в со-
однозначно свидетельствует о более высокой бак-
ответствии с работой [13], а затем ДЭТК. Судя по
териостатической активности этих катионов по
интенсивности сигнала ЭПР М-ДНКЖ, появляв-
сравнению с аналогичной активностью молеку-
шихся в клетках при их обработке NO, их концен-
лярного NO.
трация в клеточной суспензии составляла
2.0 ± 0.5 мкМ и была практически такой же, как и
концентрация тех же комплексов, возникавших в
ЗАКЛЮЧЕНИЕ
той же суспензии при введении в нее на 40 мин
0.5 мМ Б-ДНКЖ-GSH, NaNO2 или GS-NO - со-
Главный результат проведенных нами исследо-
ответственно 1.5 ± 0.5, 1.5 ± 0.5 и 2.5 ± 0.5 мкМ.
ваний состоит в обнаружении резкого усиления
При последующем введении в эти суспензии
бактериостатического (негативного) действия на
ДЭТК (2.5 мМ), концентрация образующихся
бактерии Escherichia coli TN530 биядерных ДНКЖ-
МНКЖ-ДЭТК достигала соответственно 4.0 ±
GSH под влиянием ДЭТК. Аналогичный резуль-
± 0.5, 5.0 ± 0.5 и 5.0 ± 0.5 мкМ, тогда как в клет-
тат был получен ранее в работе [30] и в нашей рабо-
ках, предварительно обработанных газообразным
те [25] в экспериментах на культурах опухолевых
NO, концентрация этих комплексов составляла
клеток соответственно Jurkat и MCF-7. В этих ра-
6.5 ± 0.5 мкМ. Согласно результатам наших работ
ботах вместо ДЭТК использовали МГД, хорошо
[15, 16], более высокий уровень МНКЖ-ДЭТК по
растворимое в воде производное дитиокарбамата,
сравнению М-ДНКЖ объясняется включением в
а вместо Б-ДНКЖ-GSH М-ДНКЖ - тиосульфат
реакцию с ДЭТК биядерных ДНКЖ с тиолсодер-
[30] или Б-ДНКЖ-меркаптосукцинат [25], вво-
жащими лигандами, образующихся в клетках в
дившиеся в клеточные культуры одновременно с
более высоком количестве по сравнению с их мо-
МГД. Результатом было резкое усиление гибели
ноядерными аналогами.
клеток по сравнению с аналогичным действием на
клетки МГД, тиосульфата или меркаптосукцината
Образование в бактериальных клетках
при их добавлении в клеточные культуры по от-
М-ДНКЖ и Б-ДНКЖ при их обработке как газо-
дельности.
образным NO, так и его донорами примерно в
одинаковой концентрации могло быть обуслов-
В вышеупомянутых работах [25, 30], как и в на-
лено лимитирующим влиянием на синтез этих
шей настоящей работе, были использованы экзо-
комплексов одного из компонентов ДНКЖ. По-
генные, синтезированные химическим путем
скольку при таком синтезе ни уровень газообраз-
ДНКЖ. Между тем уже в первых наших публика-
БИОФИЗИКА том 67
№ 5
2022
ЦИТОСТАТИЧЕСКОЕ ДЕЙСТВИЕ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА
945
циях в 1960-е годы, рассмотренных позже в моно-
2. F.C. Fang, J. Clin. Invest., 99, 2818 (1997).
графиях А.Ф. Ванина [31, 32], и до настоящего
3. J. L. Jones, J. G. Ganopolsky, A. Labbe, et al., Appl.
времени было продемонстрировано образование
Microbiol. Biotechnol., 88, 401 (2010).
в живых организмах и клеточных культурах эндо-
4. L. A. Bowman, S. McLean, R. K. Pool, et al., Adv. Mi-
генных М-ДНКЖ и Б-ДНКЖ с тиолсодержащи-
crobiol. Physiol., 59, 135 (2011).
ми лигандами, возникавших в этих биообъектах
5. H. Ischiropoulos and F. B. Al-Mehdi, FEBS Lett., 364,
при появлении NO из его эндогенных и экзоген-
279 (1995).
ных источников. Есть основание полагать, что
6. M. J. Juedes, and G. N. Wogan, Mutat. Res., 349, 51
эти эндогенные комплексы могут функциониро-
(1996).
вать в качестве основных эффекторов Т-клеточ-
ного иммунитета. В пользу этого может говорить
7. D. D. Schraier, J. S. Chouake, J. D. Nosanchuk, et al.,
факт обнаружения в 1990-е годы М-ДНКЖ с
Virulence, 3, 271 (2012).
тиолсодержащими лигандами в активированных
8. S. Spiro, FEMS Lett., 31, 193 (2007).
макрофагах, эффективно продуцирующих NO
9. D. Seth, D. T. Hess, A. Hausladen, et al., Mol. Cell, 69,
при участии индуцибельной формы NO синтазы
451 (2018).
(iNOS) [33-36]. Эти комплексы могли перехо-
10. A. F. Vanin, Austin J. Anal. Pharmaceut. Chem., 5,
дить из макрофагов в сокультивируемые с ними
1109 (2018).
опухолевые клетки с последующей гибелью этих
клеток [34].
11. A. F. Vanin, Cell Biochem. Biophys., 77, 279 (2019).
Поскольку ДНКЖ с тиолсодержащими лиган-
12. A. F. Vanin, Appl. Magn. Resonance, 50, 851 (2020).
дами, действительно, могут выступать в качестве
13. A. F. Vanin, A. P. Poltorakov, V. D. Mikoyan, et al., Ni-
доноров катионов нитрозония [10-12], и эти ка-
tric Oxide Biol. Chem., 23, 136 (2011).
тионы могут, как мы показали в настоящей рабо-
14. R. R. Borodulin, L. N. Kubrina, V. D. Mikoyan, et al.,
те, подавлять размножение клеток E. coli, а также
(2013) Nitric Oxide Biol. Chem., 29, 4 (2013).
вызывать гибель опухолевых клеток [25, 30], не
15. V. D. Mikoyan, E. N. Burgova, R. R. Borodulin, et al.,
исключено, что способность иммунокомпетент-
Nitric Oxide Biol. Chem., 62, 1 (2017).
ных клеток подавлять размножение различных
16. В. Д. Микоян, Е. Н. Бургова и А. Ф. Ванин, Биофи-
патогенных бактерий определяется образованием
зика, 65, 1142 (2020).
в них ДНКЖ с тиолсодержащими лигандами как
донорами катионов нитрозония. Цитотоксиче-
17. D. A. Wink, R. W. Nims, J. F. Darbyshir, et al., Chem.
ское действие последних, как основных эффекто-
Res. Toxicol., 7, 519 1994).
ров системы Т клеточного иммунитета может
18. V. G. Kharitonov, A. R. Sandquist, and V. S. Sharma,
определяться их способностью S-нитрозировать
J. Biol. Chem., 270, 28158 (1995).
различные жизненно важные тиолсодержащие
19. X. Cui, C. L. Joannou, M. N. Hughes, et al., FEBS
белки и ферменты [30].
Lett., 98, 67 (1992).
Среди этих ферментов могут оказаться проте-
20. K. Yoshida, T. Akaaki, K. Doi, et al., Infection and Im-
азы различных вирусов, включая коронавирусы
munity, 61, 3552 (1993).
SARS-CoV-2, так что не исключено, что ДНКЖ с
21. J. Green, M. D. Rolfe, and L. J. Smith, Virulence, 5, 1
тиолсодержащими лигандами могут оказаться
(2013).
полезными при лечении ковида. Предположение
22. J. R. Laver, S. McLean, A. H. Bowman, et al., Antiox-
об этом было сделано в работе [37] и подтвержде-
id. Redox Signal., 18, 309 (2013).
но при испытании смеси Б-ДНКЖ-GSH + ДЭТК
в экспериментах на сирийских хомячках, инфи-
23. R. Grosser, A. Weiss, L. N. Shaw, et al., J. Bacteriol.,
цированных коронавирусом SARS-CoV-2 [38].
198, 2043 (2016).
24. S. B. Wiegand, L. Traeger, H. R. Nguyen, et al., Redox
Biol., 39, 101826 (2021).
КОНФЛИКТ ИНТЕРЕСОВ
25. A. F. Vanin, V. A. Tronov, and R. R. Borodulin, Cell
Авторы заявляют об отсутствии конфликта
Biochem. Biophys., 79, 93 (2021).
интересов
26. A. F. Vanin, V. A. Serezhenkov, V. D. Mikoyan, et al.,
Nitric Oxide Biol. Chem., 2, 224 (1998).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ НОРМ
27. J. C. Woolum, E. Tiezzi, and B. Commoner, Biochim.
Biophys. Acta, 160, 311 (1968).
Данная работа не содержит описания каких-
либо исследований с участием людей или живот-
28. A. Samouilov, H. Li, and J. L. Zweier, in Radicals for
ных в качестве объектов.
Life. The Various Forms of Nitric Oxide, Ed. by E. van
Faassen and A. F. Vanin (Elsevier, Amsterdam, 2007),
p. 313.
СПИСОК ЛИТЕРАТУРЫ
29. T. Yoshimura, in Radicals for Life. The Various Forms of
1. M. A. de Groote and F. C. Fang, Clin. Infection Dis.,
Nitric Oxide, Ed. by E. van Faassen and A. F. Vanin (El-
21 (Suppl. 2), S162 (1995).
sevier, Amsterdam, 2007), p. 337.
БИОФИЗИКА том 67
№ 5
2022
946
ВАНИН и др.
30. A. L. Kleschyov, S. Strand, S. Schmitt, et al., Free Rad-
34. C. Pellat, Y. Henry, and J.-C. Drapier, Biochem. Bio-
ic. Biol. Med., 40, 1340 (2006).
phys. Res. Commun., 166, 119 (1990).
31. А. Ф. Ванин, Динитрозильныеи комплексы железа с
35. J.-C. Drapier, C. Pellat, and Y. Henry, J. Biol. Chem.,
тиол-содержащими лигандами: Физико-химия, био-
266, 10162 (1991).
логия, медицина (Институт компьютерных иссле-
дований, М.-Ижевск, 2015).
36. A. F. Vanin, P. I. Mordvintcev, S. Hauschildt, et al.,
32. A. F. Vanin, Dinitrosyl iron complexes as a ‘working
Biochim. Biophys. Acta, 1177, 37 (1993).
form” of nitric oxide in living organisms (Cambridge
37. А. Ф. Ванин, Биофизика, 65, 818 (2020).
Scholars Publ., Cambridge, UK, 2019).
33. J. R. Lancaster and J. B. Hibbs, Proc. Natl. Acad. Sci.
38. А. В. Шиповалов, А. Ф. Ванин, О. В. Пьянков и др.
USA, 87, 1223 (1990).
Биофизика, 67, 981 (2022).
Cytostatic Effect of Dinitrosyl Iron Complexes with Glutathione on Escherichia coli
Cells Is Related to Nitrosonium Cations Released from These Complexes
A.F. Vanin*, #, V.I. Telegina**, V.D. Mikoyan*, N.A. Tkachev*, and S.V. Vasilieva**
*Semenov Federal Research Center for Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
Our study has shown that a bacteriostatic effect of binuclear dinitrosyl iron complexes with glutathione is ob-
served for Escherichia coli TN300 cells, it has been measured using the colony-forming efficiency assay. The
bacteriostatic effect evoked by these complexes increased considerably in the presence of diethyldithiocarba-
mate. Our results suggested that this effect was caused by the increase in the number of nitrosonium cations
(NO+) released from DNICs that decomposed under the action of diethyldithiocarbamate. Similar results
were obtained when E.coli cells were treated with diethyldithiocarbamate 40 min after addition of sodium ni-
trite or S-nitrosoglutathione. Notably, the total DNICs level observed in the bacterial cells due to the effects
of sodium nitrite or S-nitrosoglutathione was almost the same as obtained after treatment with complexes
with glutathione. As to bacteriostatic effects of the molecules of NO released from nitrite or S-nitrosogluta-
thione during the short-time reaction with bacteria, it was significantly smaller than bacteriostatic effects of
NO+. Therefore, it was assumed that nitrosonium cations released from DNICs were responsible for the ob-
served bacteriostatic effect of these complexes on E. coli cells.
Keywords: dinitrosyl iron complexes, nitric oxide, nitrosonium cations, S-nitrosoglutathione, bacteriostatic effect,
Escherichia coli cells
БИОФИЗИКА том 67
№ 5
2022