БИОФИЗИКА, 2022, том 67, № 5, с. 969-981
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 577.3
ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ КАТИОНОВ НИТРОЗОНИЯ
В ОТНОШЕНИИ SARS-CoV-2 НА МОДЕЛИ СИРИЙСКОГО ХОМЯЧКА
© 2022 г. А.В. Шиповалов*, А.Ф. Ванин**, #, О.В. Пьянков*, Е.Г. Багрянская***,
В.Д.Микоян**, Н.А. Ткачев**, Н.А. Асанбаева***, В.Я. Попкова**
*Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора РФ,
Кольцово, Новосибирская область, 630559, Россия
**Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН,
ул. Косыгина, 4, Москва, 119991, Россия
***Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН,
просп. Академика Лаврентьева, 9, Новосибирск, 630090, Россия
#E-mail: vanin@polymer.chph.ras.ru
Поступила в редакцию 04.07.2022 г.
После доработки 04.07.2022 г.
Принята к публикации 08.07.2022 г.
В экспериментах на модели сирийского хомячка продемонстрированo противовирусное действие в
отношении вируса SARS-CoV-2 биядерных динитрозильных комплексов железа с глутатионом и
диэтилдитиокарбамата натрия при последовательной аэрозольной обработке зараженных живот-
ных растворами этих соединений. Методом электронного парамагнитного резонанса в аналогич-
ных экспериментах на здоровых хомячках установлена преимущественная локализация комплек-
сов железа и диэтилдитиокарбамата натрия в ткани легких. У мышей при таких же измерениях эти
агенты равно эффективно локализовались как в легких, так и в печени. Предполагается, что при
контакте биядерных динитрозильных комплексов железа с глутатионом и диэтилдитиокарбамата
натрия в организме животных происходит высвобождение из комплексов железа катионов нитро-
зония, вызывающих S-нитрозирование протеаз клетки-хозяина и вируса, что приводит к подавле-
нию инфекции, вызванной вирусом SARS-CoV-2.
Ключевые слова: SARS-CoV-2, биядерные динитрозильные комплексы железа с глутатионом, диэтилди-
тиокарбамат натрия, катионы нитрозония.
DOI: 10.31857/S0006302922050167, EDN: JJZIZA
транскрипции, а также протеаз клетки-хозяина
Для вирусных инфекций характерно резкое
[2-16], есть основание предполагать, что именно
повышение в клетках организма-хозяина уровня
этот процесс обеспечивает снижение вирусной
одного из универсальных регуляторов метаболи-
продукции, являясь эффективным средством за-
ческих процессов - оксида азота (NO) [1-15].
щиты организма животных и человека от вирус-
Поскольку внутриклеточное увеличение концен-
ной инфекции.
трации NO сопровождается S-нитрозированием
разнообразных вирусных белков - протеаз, бел-
Учитывая тот факт, что S-нитрозирование раз-
ков оболочки, обратных транскриптаз, факторов личных внутриклеточных компонентов не осу-
ществляется непосредственно молекулами NO, а
Сокращения: ДНКЖ - динитрозильные комплексы желе- обеспечивается
одноэлектронно-окисленной
за, ЭПР
- электронный парамагнитный резонанс,
М-ДНКЖ - моноядерная форма динитрозильных ком-
формой этих молекул - катионами нитрозония
плексов железа, Б-ДНКЖ - биядерная форма динитро- (NO+), связывающимися вместо протонов с тио-
зильных комплексов железа, МНКЖ - мононитрозильные
комплексы железа, ДЭТК - диэтилдитиокарбамат, GSH -
ловыми группами тиолсодержащих белков и низ-
восстановленный глутатион, ОТ-ПЦР - полимеразная
комолекулярных соединений, необходимо пони-
цепная реакция с обратной транскрипцией, Б-ДНКЖ-
GSH - биядерные динитрозильные комплексы железа с
мание механизма превращения NO в NO+ в клет-
глутатионом, в/б - внутрибрюшинно.
ках животных и человека.
969
970
ШИПОВАЛОВ и др.
В настоящее время большинство исследовате-
ДНКЖ с тиолсодержащими лигандами были
лей полагает, что это превращение обеспечивает-
открыты и идентифицированы сначала в дрожже-
ся окислением NO до диоксида азота с последую-
вых клетках, а затем в тканях животных методом
щим связыванием NO2 c NO c образованием до-
электронного парамагнитного резонанса (ЭПР) в
нора NO+ - триоксида азота (N2O3), способного
60-е годы прошлого столетия одним из авторов
S-нитрозировать тиолы [17-19]. Однако показа-
настоящей работы А.Ф. Ваниным по характерно-
но, что процесс S-нитрозирования может проис-
му для моноядерной формы ДНКЖ (М-ДНКЖ)
ходить в клеточных культурах и в отсутствие кис-
сигналу ЭПР со средним значением g-фактора
лорода, т. е. без окисления NO до NO2 [20-22].
(gср), равным 2.03 (сигнал c g⊥ = 2.04, g|| = 2.014,
Ряд авторов предполагает, что появление в клет-
gср = 2.03) [27, 28]. В последние годы им же был
ках животных и человека катиона NO+ обеспечи-
предложен механизм образования этих комплек-
вается образованием в них при участии молекул
сов, в основе которого лежит реакция диспропор-
NO динитрозильных комплексов железа (ДНКЖ)
ционирования двух молекул NO, связывающихся
с тиолсодержащими лигандами, способных вы-
ступать в качестве доноров как молекул NO, так и
с ионом Fe2+ в присутствии тиолсодержащих ли-
катионов нитрозония [20-26].
гандов (схема 1):
Схема 1. Механизм образования М-ДНКЖ с тиолсодержащими лигандами в реакции Fe2+, NO и тиолов,
предполагающий взаимное одноэлектронное окисление-восстановление молекул NO, превращающихся в
соответствии с этой реакцией (реакцией диспропорционирования) в катион нитрозония (NO+) и анион
нитроксила (NO-) [25, 26].
Образующийся в ходе этой реакции анион
появление в клетках организма-хозяина доноров
нитроксила в результате гидролиза (связывания с
катионов нитрозония - ДНКЖ с тиолсодержащи-
протоном) превращается в молекулу нитроксила
ми лигангдами, способных инициировать S-нитро-
и выходит из комплекса. Его место занимает ней-
зирование различных тиолсодержащих соединений
тральная молекула NO. Гидролиз сохраняющего-
в клетках животных и человека и тем самым сни-
ся в комплексе катиона нитрозония (его связыва-
жать и/или исключать вирусную продукцию в чув-
ние с анионом гидроксила) предотвращается пе-
ствительной клетке.
ремещением на этот катион части электронной
плотности с тиоловой серы, характеризующейся
В работах группы А.Ф. Ванина был предложен
высокой π-донорной активностью. В результате
подход, позволяющий селективно высвобождать
положительный заряд на этом нитрозильном ли-
из М-ДНКЖ и Б-ДНКЖ катионы нитрозония с
ганде нейтрализуется, и он перестает связываться
одновременным включением ионов железа и мо-
с OH--анионами.
лекул NO в устойчивые комплексы — мононит-
Таким образом, согласно приведенному на
розильные комплексы железа (МНКЖ) с произ-
схеме 1 механизму образования М-ДНКЖ, одна из
водными дитиокарбамата, устраняя тем самым
его резонансных структур может быть представлена
какое-либо влияние ионов железа и молекул NO
как [(RS-)2Fe2+(NO)(NO+)]+. Подобная структура
на внутриклеточные процессы. Такое влияние
может быть характерной и для биядерной формы
могли оказывать только высвобождающиеся под
ДНКЖ (Б-ДНКЖ) - [(RS-)2Fe2+2(NO)2(NO+)2]2+
действием дитиокарбамата в соответствии со схе-
[25, 26]. Реализация этой структуры обеспечивает
мой 2 катионы нитрозония:
БИОФИЗИКА том 67
№ 5
2022
ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ КАТИОНОВ НИТРОЗОНИЯ
971
Схема 2. Механизм превращения М-ДНКЖ и Б-ДНКЖ с тиолсодержащими лигандами в МНКЖ с
производными дитиокарбамата. Высвобождающиеся при этом катионы нитрозония могут S-нитрозилировать
низкомолекулярные и белковые тиолы, а также тиоловую группу в составе дитиокарбамата. Наверху приводится
зарегистрированный при 77 К сигнал ЭПР со значениями g-фактора 2.04 и 2.02 и триплетной сверхтонкой
структурой, характерный для МНКЖ с дитиокарбаматом [29, 30].
В настоящей работе мы изучили противови-
Культуры клеток. В работе использовали ли-
русную активность катионов нитрозония в отно-
нию клеток Vero E6, полученную из коллекции
шении вируса SARS-CoV-2 на сирийском хомяч-
культур клеток ГНЦ вирусологии и биотехноло-
ке (животная модель COVID-19), используя
гии «Вектор» Роспотребнадзора. Выращивание
Б-ДНКЖ с глутатионом + производное дитио-
монослоя клеток Vero E6 осуществляли в среде
карбамата (диэтилдитиокарбамат - ДЭТК) как
DMEM (Gibco, США) с добавлением 10% эмбри-
систему, способную путем аэрозольного введе-
ональной сыворотки крупного рогатого скота
ния этих соединений поставлять катионы нитро-
(HyClone, США) и комплексного антибиотика
зония в организм этих животных.
(Gibco, США). В качестве поддерживающей сре-
ды при культивировании вируса использовали ту
же среду, но с 2% эмбриональной сыворотки.
МАТЕРИАЛЫ И МЕТОДЫ
Соединения. В экспериментах использовали
Животные. В эксперименте использовали сам-
сульфат железа (FeSO4 · 7H2O, Fluka, Швейца-
цов и самок аутбредных сирийских хомячков
массой тела 80-100 г. Животные были получены
рия), восстановленный глутатион (GSH), N-аце-
из Питомника лабораторных животных ГНЦ ви-
тил-L-цистеин, диэтилдитиокарбамат натрия и
русологии и биотехнологии «Вектор» Роспотреб-
нитрит натрия (Sigma, США).
надзора. Хомячкам подкожно имплантировали
Вирусы. В работе использовали штамм SARS-
транспондеры (чипы) IPTT-300 (BMDS, США)
CoV-2 hCoV-19/Russia/Vologda-171613-1208/2020,
для бесконтактного измерения температуры и
полученный из Государственной коллекции мик-
идентификации и помещали по два в индивиду-
роорганизмов ГНЦ вирусологии и биотехноло-
ально вентилируемые клетки. Животные имели
гии «Вектор» Роспотребнадзора (Кольцово, Но-
неограниченный доступ к пище и воде. Акклима-
восибирская область). Инфекционный вирус вы-
тизация к условиям эксперимента была проведе-
деляли в культуре клеток Vero Е6, аликвоты
на в течение 7 суток до заражения. Во время экс-
вируса были заморожены и хранились при темпе-
периментов в клетках поддерживали температуру
ратуре -80°С. Титр стока составлял не менее
22-24°C и относительная влажность 40-55%. Хо-
106 ЦПД50/мл. Для исследований использовали
мячков взвешивали, измеряли температуру и оце-
вирус пассажа 4. Титр вирусной суспензии опре-
нивали на клинические признаки болезни еже-
деляли методом конечных разведения на клетках
дневно.
Vero E6 по методу Рида и Менча [31]. Работы, свя-
занные с живым вирусом, проводили в условиях
Для определения оптимальных концентраций
максимально изолированной лаборатории, соот-
вводимых аэрозольно соединений использовали
ветствующей международным требованиям
самцов аутбредной линии мышей CD1 массой тела
BSL3+, в ГНЦ вирусологии и биотехнологии
18-20 г. Животные были получены из вивария Ин-
«Вектор» Роспотребнадзора, имеющего разреше-
ститута биохимической физики им. Н.М. Эмануэ-
ние на проведение таких исследований.
ля РАН.
БИОФИЗИКА том 67
№ 5
2022
972
ШИПОВАЛОВ и др.
Модель инфекции SARS-CoV-2 в сирийских хо-
нальной сыворотки крупного рогатого скота (Hy-
мячках. Модель заражения хомячков вирусом
Clone, США) и комплексного антибиотика (Gib-
SARS-CoV-2 была описана ранее [32].
co, США), в общей сложности от шести до восьми
В работе использовали шесть групп животных
лунок были заражены каждым разведением виру-
(две опытных и одна контрольная), по восемь хо-
са. После 72-часовой инкубации клетки фикси-
мячков (четыре самца и четыре самки) в каждой.
ровали 4%-м раствором забуференного формали-
Перед заражением хомячков анестезировали
на с последующим окрашиванием 0.1% кристал-
внутримышечным наркозом Zoletil 100 (Virbac,
лическим
фиолетовым.
Специфическое
Франция). Заражение анестезированных живот-
поражение монослоя культуры клеток в лунке
ных производили интраназально инокуляцией ви-
учитывали как ЦПД. Расчет титра вируса прово-
руса пипеткой в объеме 50 мкл, в дозе 50 ИД50. Че-
дили по формуле Рида-Менча [31] и выражали в
рез 120 ч после заражения всех животные подвер-
lg ЦПД50/мл (lg TCID50/мл).
гали эвтаназии методом трансцервикальной
Введение соединений. Аэрозольное введение
дислокации. Проводили вскрытие, забор тканей
соединений проводили в вертикальной динами-
носовых ходов и легких. Полученные с помощью
ческой камере в течение 30 мин. Рабочий расход
механического гомогенизатора (FastPrep-24, MP
воздуха через камеру составлял 10 л/мин. Во внут-
Biomedical», США)
10%-е гомогенаты тканей
ренний объем камеры одновременно помещали
осветляли центрифугированием при 10000 об/мин
восемь хомячков. Диспергирование проводили
(ротор SW28, Beckman Coulter, США). Аликвоты
распылителем
«Омрон» с расходом воздуха
осветленных образцов использовали для опреде-
6 л/мин. В распылитель заливали 10 мл 10 мМ
ления количества РНК вируса в образцах методом
водного раствора препаратов. Отбираемый аэро-
полимеразной цепной реакции с обратной тран-
золь улавливали с помощью пробоотборника
скрипцией (ОТ-ПЦР) в режиме реального време-
МЦ-2, соединяемого с выходным штуцером ка-
ни через суррогатный показатель Ct (число цик-
меры. Объемная скорость отбора проб аэрозоля в
лов) и для определения концентрации в ЦПД50/мл
пробоотборнике составляла 10.0 ± 0.5 л/мин, объ-
инфекционного вируса методом титрования на
ем сорбирующей жидкости (дистиллированная
культуре клеток Vero E6.
вода) - 10 мл.
Определение РНК вируса SARS-CoV-2 в биоло-
Аналогичным образом вводили ингаляцион-
гических образцах методом ОТ-ПЦР в режиме ре-
ным путем те же соединения аутбредным мышам
ального времени. Для выделения РНК использо-
CD 1, не зараженным коронавирусом.
вали набор «РИБО-преп» («АмплиСенс», Рос-
Введение препарата зараженным коронавиру-
сия). Синтез кДНК из выделенной РНК
сом сирийским хомячкам проводилось в течение
проводили реагентами для реакции обратной
четырех суток дважды в сутки, первое введение
транскрипции «Реверта-L» (ЦНИИЭ Роспотреб-
через 1 ч после заражения. Через 120 ч после зара-
надзора, Москва). Набор реагентов
«Вектор-
жения животных подвергали эвтаназии (методом
ПЦРРВ-COVID19-RG» (ГНЦ вирусологии и
трансцервикальной дислокации) с последующим
биотехнологии
«Вектор» Роспотребнадзора,
вскрытием и забором тканей носовой полости и
Кольцово, Новосибирская область) использова-
легких ( в асептических условиях) для определе-
ли для амплификации фрагментов кДНК вируса
ния в них количества РНК вируса в гомогенатах
SARS-CoV-2. Результаты исследования интер-
тканей методом ОТ-ПЦР в режиме реального
претировали в соответствии с инструкцией про-
времени через показатель Ct (число циклов) и ме-
изводителя.
6
тодом титрования на культуре клеток Vero
Определение инфекционного титра вируса
(lg TCID50/мл).
SARS-CoV-2 в биологических образцах на переви-
ваемой культуре клеток Vero E6. Клетки Vero E6
Синтез биядерных динитрозильных комплексов
высевали за 24 ч до заражения в 96-луночные
железа с глутатионом. При синтезе Б-ДНКЖ с
глутатионом (Б-ДНКЖ-GSH) использовали спо-
планшеты с посевной дозой 1.5·104 клетки/лунка.
собность S-нитрозотиолов, как это показано на
В день эксперимента были сделаны последова-
тельные десятикратные разведения вируса в среде
схеме 3, образовывать в реакции с ионами Fe2+ и
DMEM (Gibco, США) с добавлением 2% эмбрио-
тиолами соответствующие М-ДНКЖ.
Схема 3. Механизм образования М-ДНКЖ в реакции S-нитрозотиолов, Fe2+ и тиолов [33].
БИОФИЗИКА том 67
№ 5
2022
ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ КАТИОНОВ НИТРОЗОНИЯ
973
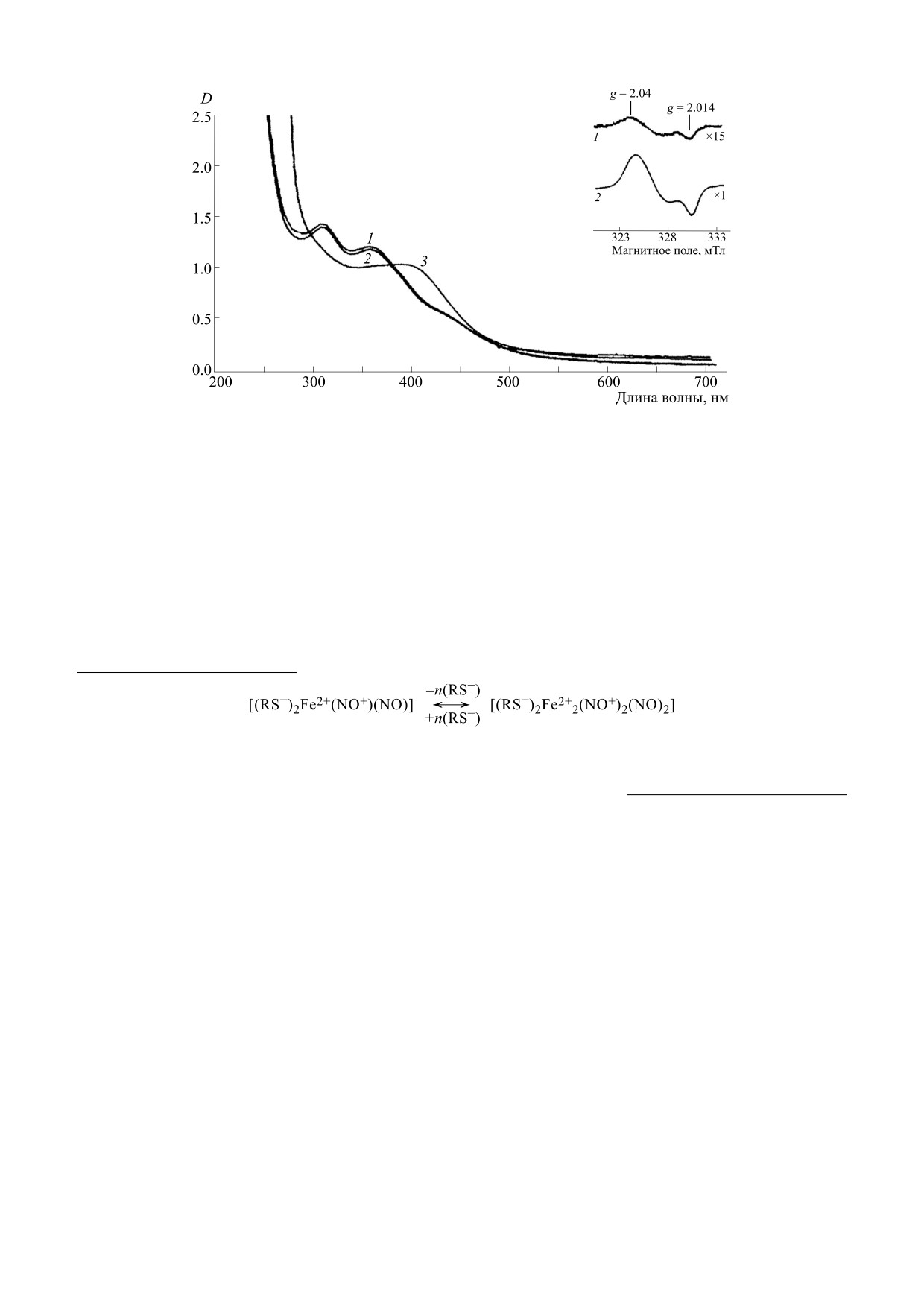
Рис. 1. Спектры оптического поглощения Б-ДНКЖ-GSH и М-ДНКЖ-GSH при концентрации 0.46 мМ (соответ-
ственно спектры 1 и 3); на вставке - ЭПР-сигнал М-ДНКЖ-GSH (сигнал 2.03 со значениями тензора g-фактора, рав-
ными g⊥ = 2.04, g|| = 2.014) [25].
соответствии со схемой 4 в Б-ДНКЖ-диамаг-
В соответствии со схемой 3 ионы Fe2+ связы-
нитные комплексы, не дающие сигнала 2.03. Их
вают по две молекулы S-нитрозотиолов на ион
с последующим диcпропорционированием
концентрацию можно было оценить по интен-
сивности двух полос оптического поглощения
этих молекул, что сразу же приводит к образо-
ванию М-ДНКЖ, характеризующихся, как уже
на 310 и 360 нм (приведены на рис. 1) с коэффи-
указывалось выше, сигналом ЭПР с gср = 2.03
циентами экстинкции в пересчете на один атом
железа в Б-ДНКЖ, равными соответственно
(сигналом 2.03). При низкой концентрации
тиолов в растворе М-ДНКЖ конденсируются в
4600 и 3700 М-1см-1.
Cхема 4. Равновесное взаимопревращение М-ДНКЖ и Б-ДНКЖ с тиолсодержащими лигандами. Равновесие
сдвигается влево при повышении в растворе уровня тиолов (RS-), ионизованных по тиоловой группе [34].
Синтез 10 мМ раствора Б-ДНКЖ-GSH прово-
сти полосы поглощения на 334 нм, характерной
дили в соответствии с методом, описанным в ра-
для S-нитрозоглутатиона с ε = 0.94 М-1см-1 [36].
боте [35]. Для этого в 15 мМ раствор HEPES-бу-
Обычно образование S-нитрозоглутатиона в кон-
фера при рН 7.2-7.4 последовательно вводили
центрации 20 мМ завершалось при комнатной
глутатион, ферросульфат и нитрит натрия в кон-
температуре в течение полутора часов. После это-
центрации соответственно 40, 20 и 20 мМ, тща-
го рН раствора, окрашенного из-за наличия в нем
тельно перемешивая раствор после каждого вве-
S-нитрозоглутатиона в розовый цвет, повышали
дения. Введение глутатиона приводило к подкис-
до рН 7.3-7.5 капельным добавлением крепкого
лению раствора этого буфера до рН 3.6-3.8; для
(100 мМ) раствора NaOH - при этом раствор при-
надежного предотвращения образования гидро-
обретал оранжевую окраску, обусловленную на-
окисных комплексов железа при последующем
чавшимся в соответствии со схемой 3 образова-
добавлении в раствор глутатиона ферросульфата
нием М-ДНКЖ-GSH. Раствор оставляли на ночь
до введения последнего рН раствора понижали
добавлением серной кислоты до рН 1-2. Послед-
на воздухе при комнатной температуре. За это
нее гарантировало также более эффективное об-
время в соответствии со схемами 3 и 4 половина
разование в растворе S-нитрозоглутатиона после
железа (10 мМ) включалась в М-ДНКЖ-GSH, а
добавления в реакционный раствор нитрита на-
затем в Б-ДНКЖ-GSH, тогда как другая полови-
трия. За этим процессом следили по интенсивно-
на железа включалась в водонерастворимые гид-
БИОФИЗИКА том 67
№ 5
2022
974
ШИПОВАЛОВ и др.
Таблица 1. Вирусная нагрузка в тканях носовой полости и тканях легких хомяxков, интраназально инфициро-
ванных вирусом SARS-CoV-2 с последующим аэрозольным лечением препаратами Б-ДНКЖ-GSH и Б-ДНКЖ-
GSH + ДЭТК
Вирусная нагрузка SARS-CoV-2
Соединение
в тканях носовой полости
в тканях легких
lg TCID50/vk
Ct*
lg TCID50/ml
Ct*
Б-ДНКЖ-GSH
4.1 ± 0.5
23.83 ± 1.27
4.4 ± 0.8
20.67 ± 2.13
Б-ДНКЖ-GSH +
2.7 ± 0.4
27.28 ± 3.44
2.4 ± 0.4
30.33 ± 1.18
ДЭТК
Плацебо
5.0 ± 0.5
19.80 ± 2.19
3.7 ± 0.4
25.96 ± 1.60
Примечание. * - Более низкие пороговые значения числа циклов (Ct) указывают на более высокие вирусные нагрузки.
роокисные комплексы, выпадавшие в осадок. На
ней в жидкий азот, образцы цилиндрической
следующий день этот осадок удаляли фильтрова-
формы помещали в жидком азоте в палец Дьюара
нием раствора на бумажном фильтре.
соответствующей формы, после чего регистриро-
вали в этих образцах спектры ЭПР при соответ-
В результате получали прозрачный раствор
ствующих параметрах ЭПР-радиоспектрометра
Б-ДНКЖ-GSH в концентрации 10 мМ, который
(Bruker, Германия) или модифицированного
замораживали в жидком азоте и хранили в замо-
ЭПР-радиоспектрометра («РадиоПан», Польша).
роженном состоянии при температуре не выше -
В качестве эталонного образца (стандарта) при
18°C до использования в экспериментах на жи-
определении концентрации М-ДНКЖ, возни-
вотных.
кавших в тканях животных, использовали рас-
На рис. 1 приводятся спектры поглощения по-
твор М-ДНКЖ-GSH, сигнал ЭПР которого
лученного описанным выше методом препарата
(ЭПР-сигнал 2) приводится на рис. 1. Поскольку
Б-ДНКЖ-GSH (спектр 1) с полосами поглоще-
плотность ткани легкого примерно в два раза
ния на 310 и 360 нм (раствор разбавлен до концен-
меньше плотности воды, после оценки содержа-
трации 0.5 мМ). Спектр не изменялся в течение
ния М-ДНКЖ в этом органе в соответствии со
часа при подкислении раствора до рН
1.0
стандартом, полученную величину удваивали.
(спектр 2). На вставке приводится сигнал ЭПР
10 мМ раствора Б-ДНКЖ-GSH (cигнал
2.03,
РЕЗУЛЬТАТЫ
спектр
1), обусловленный
5%-й примесью
М-ДНКЖ. При добавлении к этому раствору
Оценка эффективности соединений Б-ДНКЖ-
10 мМ GSH и повышении рН с 7.5 до 10.5
GSH и ДЭТК при аэрозольном введении. Анализ
Б-ДНКЖ полностью переходил в М-ДНКЖ.
результатов, приведенных в табл. 1, по данным
Спектр поглощения последнего с полосой на
метода ОТ-ПЦР (Сt) показывает, что при прове-
400 нм и сигнал 2.03 представлены на рис. 1 соот-
дении лечения животных только раствором
ветственно кривой
3 и ЭПР-сигналами на
Б-ДНКЖ-GSH достоверно снижается вирусная
вставке.
нагрузка в тканях носовой полости в 16 раз
(р = 0.0006, по критерию Манна-Уитни) по срав-
Измерение спектров ЭПР изолированных тка-
нению с контрольными животными (плацебо).
ней нативных (незараженных) животных. После
При этом по инфекционному титру
проведения эксперимента у нативных (незара-
(lg TCID50/мл) достоверное снижение вирусной
женных) животных (сирийские хомячки, мыши)
проводили эвтаназию методом трансцервикаль-
нагрузки ни в тканях носовой полости, ни в тка-
нях легких зафиксировано не было (р > 0.005, по
ной дислокации для последующего определения
локализации ДНКЖ и МНКЖ-ДЭТК в изолиро-
критерию Манна-Уитни).
ванных образцах крови и тканях легких и печени
Для системы соединений Б-ДНКЖ-GSH +
животных методом ЭПР. Забор крови и тканей
+ ДЭТК при их последовательном введении
органов осуществляли в асептических условиях.
определена достоверная противовирусная актив-
Образцы (легкие, печень и кровь) помешали в
ность. По данным метода ОТ-ПЦР (Сt) отмечено
пластмассовые трубки диаметром 4 мм и замора-
снижение уровня накопления РНК в тканях лег-
живали в жидком азоте. Для последующего изме-
ких в 21 раз (p = 0.0007, по критерию Манна-Уит-
рения спектров ЭПР в препаратах замороженных
ни), в тканях носовой полости
- в 16 раз
тканей трубки с замороженными в них тканями
(p = 0.0025, Манн-Уитни). Методом титрования в
извлекали из жидкого азота и постепенно, нагре-
тканях носовой полости определено еще большее
вая в руках, поршнем выдавливали образцы тка-
снижение вирусной нагрузки
- в
200 раз
БИОФИЗИКА том 67
№ 5
2022
ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ КАТИОНОВ НИТРОЗОНИЯ
975
Таблица 2. Вирусная нагрузка в тканях носовой полости и тканях легких хомяков, интраназально инфицирован-
ных вирусом SARS-CoV-2 с последующим аэрозольным лечением препаратами ДЭТК и ДЭТК + Б-ДНКЖ-GSH
Вирусная нагрузка SARS-CoV-2
Соединение
в тканях носовой полости
в тканях легких
lg TCID50/ml
Ct*
lg TCID50/ml
Ct*
ДЭТК
5.3 ± 0
11.59 ± 2.04
5.5 ± 0
13.31 ± 1.28
ДЭТК + Б-ДНКЖ-
5.3 ± 0
10.78 ± 0.44
5.2 ± 0.3
14.60 ± 0.86
GSH
Плацебо
5.5 ± 0
9.60 ± 2.02
4.3 ± 0.1
15.54 ± 1.84
Примечание. * - Более низкие пороговые значения числа циклов (Ct) указывают на более высокие вирусные нагрузки.
(p = 0.0002, по критерию Манна-Уитни). При
Результаты, полученные после аэрозольного
исследовании тканей легких наблюдалось сниже-
введения зараженным хомячкам соединений
ние вирусной нагрузки в 20 раз (p = 0.0002, по
ДЭТК или ДЭТК с последующим аэрозольным
критерию Манна-Уитни).
введением Б-ДНКЖ-GSH, показали (табл. 2),
что при такой комбинации введения соединений
В соответствии со схемой 2 такая последова-
достоверное снижение вирусной нагрузки в чув-
тельность введения в дыхательные пути хомячков
ствительных тканях органов-мишеней по двум
Б-ДНКЖ-GSH и ДЭТК должна приводить к на-
исследуемым параметрам по сравнению с кон-
коплению в тканях дыхательных путей высво-
трольными животными (плацебо) зафиксирова-
бождающихся из Б-ДНКЖ катионов нитрозо-
но не было.
ния, что, по-видимому, и обеспечило подавление
ЭПР-измерение тканей сирийских хомячков. На
инфекции SARS-CoV-2.
рис. 2 приведены одни из типичных спектров
Рис. 2. Спектры ЭПР легких (1), печени (2) и крови (3) хомячков, подвергнутых ингаляции распыленным 10 мМ раствором
ДНКЖ (а) и 10 мМ растворами сначала ДНКЖ, а затем ДЭТК (ДНКЖ + ДЭТК) (б). Cигнал при g = 2.0 обусловлен
эндогенными свободными радикалами. Спектры зарегистрированы на радиоспектрометре Bruker при 77 K, СВЧ-
мощности
5 мвт, амплитуде высокочастотной модуляции магнитного поля
0.5 мТ и одинаковом усилении
радиоспектрометра.
БИОФИЗИКА том 67
№ 5
2022
976
ШИПОВАЛОВ и др.
ЭПР, зарегистрированных при 77 К в крови, лег-
ких и печени здоровых (незараженных) хомячков
после аэрозольного введения в течение 30 мин
10 мл 10 мМ раствора Б-ДНКЖ-GSH (рис. 2а) и
спектры ЭПР тех же тканей хомячков при том же
способе введения
10 мл
10 мМ раствора
Б-ДНКЖ-GSH с последующим 30-минутным
введением 10 мМ раствора ДЭТК (ДНКЖ +
+ ДЭТК, рис. 2б). В обоих случаях наибольший
сигнал 2.03 (сигнал ЭПР появляющихся в тканях
М-ДНКЖ) наблюдался в легких. При ингаляции
животных только раствором Б-ДНКЖ-GSH кон-
центрация М-ДНКЖ в этом органе варьировала в
пределах 30-40 мкмолей/кг влажной ткани. В
крови эта величина варьировала в пределах 3-
5 мкмолей/л, а в печени сигнал 203 практически
не обнаруживался. При ингаляции животных
сначала растворами Б-ДНКЖ-GSH, а затем
ДЭТК (ДНКЖ + ДЭТК), судя по интенсивности
сигнала 2.03, уровень М-ДНКЖ в легких достигал
Рис. 3. Спектры ЭПР легких (1), печени (2) и крови хо-
140-160 мкмолей/кг, т. е. в среднем повышался в
мячков, подвергнутых 30-минутной ингаляции распы-
четыре-пять раз по сравнению с величиной, на-
ленным 10 мМ раствором ДЭТК с последующей 30-ми-
блюдавшейся при ингаляции животным только
нутной ингаляцией распыленным 10 мМ раствором
Б-ДНКЖ-GSH (рис. 2а). В печени содержание
Б-ДНКЖ-GSH (ДЭТК + + ДНКЖ). Cигнал при g = 2.0
М-ДНКЖ достигало 3 мкмолей/кг, в крови сиг-
обусловлен эндогенными свободными радикалами.
нал 2.03 не обнаруживался (рис. 2б).
Спектры зарегистрированы на радиоспектрометре
Bruker при 77 K, СВЧ мощности 5 мвт, амплитуде ВЧ
На рис. 3 приведены спектры ЭПР, зареги-
модуляции магнитного поля 0.5 мТ и одинаковом уси-
стрированные в крови, легких и печени хомячков
лении радиоспектрометра.
после обработки в течение 30 мин распыленным
10 мМ раствором ДЭТК с последующим аэро-
При обратной последовательности аэрозоль-
зольным введением 10 мМ раствора Б-ДНКЖ-
ного введения мышам - сначала 50 мМ раствора
GSH. Судя по интенсивности сигнала 2.03 в этих
ДЭТК, а затем 10 мМ раствора Б-ДНКЖ-GSH -
тканях, наибольшее количество М-ДНКЖ обна-
соотношение содержания возникавших в тканях
руживалось в легких (30-40 мкмолей/кг), макси-
мышей М-ДНКЖ не менялось: (рис. 5а) оно оста-
мальная концентрация в печени достигала
валось наибольшим в легких (в пределах 6-
10 мкмолей/кг, а в крови - 0.5 мкмолей/кг.
10 мкмолей/кг), в крови достигало уровня
ЭПР-измерение тканей мышей. Аэрозольное
0.8 мкмолей/кг, в печени - 1.5-3.0 мкмолей/кг
введение мышам 10 мМ раствора Б-ДНКЖ-GSH
(рис. 5). При этом наряду с сигналом 2.03 в пече-
объемом 10 мл в течение 40 мин приводило, судя
ни животных обнаруживался сигнал ЭПР
МНКЖ-ДЭТК - комплексов, возникавших в ре-
по интенсивности сигнала 2.03, к появлению
зультате взаимодействия ДЭТК с ДНКЖ (в соот-
М-ДНКЖ в легких и печени в концентрации со-
ветствии со схемой 2). Сигнал ЭПР этих ком-
ответственно
0.5-1.2 и
1.5-2.0 мкмолей/кг
плексов характеризовался (в полном соответ-
(рис. 4а), т.е., в отличие от сирийских хомячков,
ствии с работой [37]) значениями g-фактора,
аэрозольно вводимые Б-ДНКЖ-GSH достаточно
равными g⊥ = 2.04, gÊÊ = 2.02, gср = 2.033, и разре-
эффективно переходили из легких в кровь, а отту-
да в печень. Тем не менее в крови регистрировал-
шенной триплетной сверхтонкой структурой при
g⊥ (рис. 5б).
ся лишь очень слабый сигнал 2.03. При последую-
щем введении этим животным 10 мл распыленно-
Сигнал ЭПР МНКЖ-ДЭТК в «чистом виде»
го 10 мМ раствора ДЭТК уровень появлявшихся в
обнаруживался в легких после ингаляции живот-
тканях мышей М-ДНКЖ практически не повы-
ных только 50 мМ раствором ДЭТК (рис. 6а).
шался. При увеличении концентрации ДЭТК до
Концентрация МНКЖ при этом не превышала
50 мМ существенно, в три-четыре раза, увеличи-
0.4 мкмоля/кг. При последующем внутрибрю-
валась концентрация М-ДНКЖ во всех исследо-
шинном (в/б) введении этим животным
вавшихся тканях животных (рис. 4б). При этом в
Б-ДНКЖ-GSH в дозе 100 мкмолей/кг массы жи-
легких уровень М-ДНКЖ варьировал в пределах
вотных сигнал МНКЖ-ДЭТК в легких маскиро-
1.5-3.0 мкмолей/кг, в печени - 0.8-1.4 мкмо-
вался сигналом 2.03, обусловленным примесью
лей/кг, а в крови - 0.3-0.5 мкмолей/л.
крови (рис. 6а). В крови этих животных концен-
БИОФИЗИКА том 67
№ 5
2022
ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ КАТИОНОВ НИТРОЗОНИЯ
977
Рис. 4. Сигнал 2.03 в крови (к), легких (л) и печени (п) мышей, подвергнутых 40-минутной ингаляции 10 мМ раствором
Б-ДНКЖ-GSH (а) с последующей их 40-минутной ингаляцией 50 мМ раствором ДЭТК (б). Cигнал при g = 2.0 обусловлен
эндогенными свободными радикалами. Спектры зарегистрированы на радиоспектрометре «РадиоПан» при 77 К, СВЧ
мощности 5 мвт, амплитуде ВЧ модуляции магнитного поля 0.5 мТ и одинаковом усилении радиоспектрометра.
трация М-ДНКЖ достигала
30 мкмолей/л
в легких, сигнал МНКЖ-ДЭТК в печени маски-
(рис. 6а). Как и в легких, в печени сигнал ЭПР
ровался сигналом 2.03 после в/б введения мышам
МНКЖ-ДЭТК в «чистом виде» обнаруживался
Б-ДНКЖ-GSH в дозе 100 мкмолей/кг (рис. 6а).
после ингаляции животных только 50 мМ раство-
Заметный сигнал ЭПР МНКЖ-ДЭТК в легких
ром ДЭТК, при этом концентрация этих ком-
и печени регистрировался в них после аэрозоль-
плексов достигала 3.0 мкмоля/кг (рис. 6а). Как и
ного введения мышам 10 мМ раствора Б-ДНКЖ-
Рис. 5. (а) - Спектры ЭПР, зарегистрированные в крови (к), легких (л) и печени (п) мышей, подвергнутых 40-минутной
ингаляции распыленным 50 мМ раствором ДЭТК с последующей ингаляцией этих животных 10 мМ раствором Б-ДНКЖ-
GSH. (б) - Демонстрация спектра ЭПР, зарегистрированного в печени мышей (п), как суммы сигнала 2.03 (1) и сигнала
МНКЖ-ДЭТК (п-1). Cигнал при g = 2.0 обусловлен эндогенными свободными радикалами. Спектры зарегистрированы на
радиоспектрометре «РадиоПан» при 77 К, СВЧ мощности 5 мвт, амплитуде ВЧ модуляции магнитного поля 0.5 мТ и
одинаковом усилении радиоспектрометра.
БИОФИЗИКА том 67
№ 5
2022
978
ШИПОВАЛОВ и др.
Рис. 6. Спектры ЭПР, зарегистрированные в крови (к), легких (л) и печени (п) мышей. (а) - Животные были подвергнуты
в течение 40 мин ингаляции 50 мМ распыленным раствором ДЭТК (спектры 40 и 10) с последующим в/б введением этим
животным Б-ДНКЖ-GSH в дозе 100 мкмолей/кг массы животных (спектры 4, 2.5 и 1). (б) - Животные были подвергнуты
в течение 40 мин ингаляции 10 мМ распыленным раствором Б-ДНКЖ-GSH (спектры 30, 20 и 20) с последующим
введением им ДЭТК в дозе 0.5 мМ/кг массы животных (спектры 10 и 5). Cигнал при g = 2.0 обусловлен эндогенными
свободными радикалами. Спектры зарегистрированы на радиоспектрометре РадиоПан при 77 К, СВЧ мощности 5 мвт и
амплитуде ВЧ модуляции магнитного поля 0.5 мТ. Относительное усиление радиоспектрометра указано цифрами на
правой стороне спектров.
GSH с последующим в/б введением им ДЭТК в
печени животных интенсивность сигнала 2.03 по-
дозе 500 мкмолей/кг массы животных (рис. 6б). В
сле такой обработки достоверно (в соответствии
легких на этот сигнал накладывался сигнал 2.03,
со схемой 2) повышалась в два раза: включение в
так что суммарная концентрация МНКЖ-ДЭТК
эти ткани N-ацетил-L-цистеина обеспечивало
и М-ДНКЖ в этой ткани составляла 5.0 мкмо-
превращение части Б-ДНКЖ в М-ДНКЖ. Более
лей/кг при концентрации М-ДНКЖ, возникав-
слабый в этом отношении эффект N-ацетил-L-
ших после начального введения мышам
цистеина по сравнению с действием ДЭТК на
Б-ДНКЖ-GSH, в 1 мкмоль/кг (рис. 6б). В печени
Б-ДНКЖ определялся, по нашему мнению, вы-
концентрация образующихся у животных
соким сродством ДЭТК к железо-мононитро-
МНКЖ-ДЭТК достигала 10 мкмолей/кг ткани
зильной группе, обеспечивающим практически
при концентрации М-ДНКЖ, возникавших по-
полное превращение Б-ДНКЖ в МНКЖ-ДЭТК.
сле начального аэрозольного введения мышам
Б-ДНКЖ-GSH, в 0.6 мкмоль/кг (риc. 6б). В кро-
ви образование МНКЖ-ДЭТК в аналогичных
ОБСУЖДЕНИЕ
опытах не обнаружено: после в/б введения ДЭТК
сохранялись М-ДНКЖ в концентрации
В результате проведенных исследований пока-
0.5 мкмолей/л, появившиеся в крови после инга-
зано, что комбинация соединений Б-ДНКЖ-
ляции мышам Б-ДНКЖ-GSH (рис. 6б).
GSH + ДЭТК обладает выраженной противови-
русной активностью в отношении вируса SARS-
Значительное различие концентрации образу-
CoV-2. В соответствии со схемой 2 такая последо-
ющихся МНКЖ-ДЭТК и М-ДНКЖ в печени
(как и в легких), очевидно, было обусловлено
вательность введения в дыхательные пути живот-
включением ДНКЖ в эти ткани преимуществен-
ных Б-ДНКЖ-GSH и ДЭТК должна приводить к
но биядерной ЭПР-неактивной формы этих ком-
накоплению в тканях дыхательных путей и легких
плексов. Такое же заключение следует из опытов,
хомячков высвобождающихся из Б-ДНКЖ кати-
в которых после аэрозольного введения мышам
онов нитрозония, что и могло, в соответствии с
раствора Б-ДНКЖ-GSH им вводили в/б раствор
высказанной в работе [16] одним из соавторов на-
N-ацетил-L-цистеина при нейтральных значени-
стоящей статьи гипотезой, обеспечивать подав-
ях рН в дозе 100 мкмолей/кг. Как в легких, так и в
ление инфекции COVID-19.
БИОФИЗИКА том 67
№ 5
2022
ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ КАТИОНОВ НИТРОЗОНИЯ
979
Результаты вышеприведенных ЭПР-исследо-
водить к распаду этих комплексов. Такого рода
ваний здоровых хомячков и мышей, подвергав-
распад МНКЖ-ДЭТК мог приводить к распаду
шихся ингаляции распыленными растворами
всех этих комплексов, что и могло быть причиной
Б-ДНКЖ-GSH и ДЭТК в различной их последо-
того, что в наших опытах нам не удалось зафикси-
вательности, позволяют утверждать, что, дей-
ровать превращение Б-ДНКЖ-GSH при аэро-
ствительно, при ингаляционном введении снача-
зольном введении сирийским хомячкам раствора
ла Б-ДНКЖ-GSH, а затем ДЭТК в тканях орга-
Б-ДНКЖ, а затем раствора ДЭТК. При этом ка-
нов-мишеней вируса SARS-CoV-2 - дыхательных
тионы нитрозония должны были (в соответствии
путей и легких может накапливаться заметное ко-
со схемой 2) высвобождаться из Б-ДНКЖ и пока-
личество катионов нитрозония.
зывать противовирусное действие, регистрируе-
мое по вирусной нагрузке в тканях органов-ми-
Неожиданный результат этих исследований
шеней сирийских хомячков.
состоит в том, что в легких при такой последова-
В результате действия аэрозольно вводимого
тельности введения указанных соединений здо-
раствора ДЭТК в легких и печени мышей обнару-
ровым хомячкам не удалось (рис. 2) наблюдать
живалось образование МНКЖ-ДЭТК (рис. 6а),
образование ЭПР-активных МНКЖ-ДЭТК, как
причем в печени их концентрация была на поря-
это ожидалось в соответствии со схемой 2. Един-
ственный эффект, который обнаруживался при
док выше, чем в легких. Появление этих
комплексов скорее всего было обусловлено гене-
дополнительной ингаляции хомячкам раствора
рацией в легких и печени эндогенного NO, об-
ДЭТК после ингаляции им раствора Б-ДНКЖ-
разующего вместе со слабосвязанным внутрикле-
GSH, состоял в значительном (трех-четырехкрат-
точным («свободным») железом и ДЭТК соответ-
ном) повышении интенсивности сигнала 2.03,
регистрируемого в легких (рис. 2а,б). Если учесть,
ствующие МНКЖ. Поскольку в легких,
контактирующих с атмосферным кислородом,
что вводившиеся животным Б-ДНКЖ-GSH-
очевидно должно было продуцироваться значи-
комплексы ЭПР-неактивны, а сигнал 2.03 обу-
тельное количество анионов супероксида, их дей-
словлен моноядерной формой ДНКЖ, указанное
ствие, как указывалось выше, должно было при-
выше его усиление могло быть обусловлено (в со-
ответствии со схемой 4) появлением в ткани лег-
водить, во-первых, к распаду значительной части
(существенно большей, чем в печени) МНКЖ-
ких дополнительного количества тиолов, обеспе-
ДЭТК и, во-вторых, могло приводить к исчезно-
чивающих превращение ДНКЖ в М-ДНКЖ. Это
вению в легких поступающего в них ДЭТК. В ре-
означает, что при включении в эти ткани ДЭТК
зультате при последующей, после ДЭТК, аэро-
последний, как тиолсодержащий агент, мог по-
вышать внутриклеточный восстановительный
зольной обработке животных раствором
Б-ДНКЖ реакция этих комплексов с ДЭТК ста-
потенциал, обеспечивая тем самым восстановле-
новилась невозможной, комплексы МНКЖ-
ние дисульфидов до тиолов. Другой, по-видимо-
ДЭТК не возникали и не могли обеспечить сни-
му, более реальный механизм повышения уровня
жение уровня анионов супероксида и тем самым
восстановительных агентов (или снижения внут-
риклеточного окислительного потенциала) мог
повышение внутриклеточного восстановитель-
ного потенциала. Это и могло приводить к тому,
состоять в следующем. ДЭТК, реагируя с ДНКЖ,
что не обнаруживалось, судя по сигналу 2.03, по-
действительно мог обеспечивать в соответствии
вышение количества ЭПР-активных М-ДНКЖ,
со схемой 2 образование МНКЖ-ДЭТК - ком-
как это имело место в опытах при обработке хо-
плекса, который, в соответствии с результатами
работы [38], мог активно связывать анионы су-
мячков сначала распыленным раствором Б-ДН-
КЖ-GSH, а затем ДЭТК (рис. 2 и 3). Концентра-
пероксида, нейтрализуя их прооксидантное дей-
ция М-ДНКЖ, возникающих в легких в опытах с
ствие. Если учесть, что легкие находятся непо-
ингаляцией хомячков растворами сначала ДЭТК,
средственно в контакте с кислородом воздуха,
а затем Б-ДНКЖ-GSH (рис. 3), была такой же,
следует ожидать наличие в тканях легких значи-
тельного количества супероксид-анионов, кото-
как в опытах с ингаляцией этих животных только
раствором Б-ДНКЖ-GSH (рис. 2а).
рого могло оказаться достаточным для распада
МНКЖ-ДЭТК при связывании этих комплексов
В отличие от сирийских хомячков, у которых
с анионами супероксида. Такой распад мог быть
М-ДНКЖ, определяемые в организме животных
обусловлен, например, изомеризацией в нитрат
после аэрозольного введения Б-ДНКЖ-GSH, ло-
пероксинитрита, образующегося при связывании
кализовались преимущественно в легких, у мы-
супероксида с молекулой NO в лигандной сфере
шей при тех же условиях эксперимента М-ДНКЖ
железа в МНКЖ-ДЭТК [38], что должно было
накапливались и в легких, и практически в той же
приводить к распаду этих комплексов. Кроме то-
концентрации в печени. Этот феномен, очевид-
го, связанный с МНКЖ-ДЭТК пероксинитрит
но, был обусловлен ослаблением у мышей гема-
мог при каталитическом действии железа окис-
то-тканевого барьера, т.е. более легким проник-
лять ДЭТК до его димерной дисульфидной фор-
новением различных веществ (как Б-ДНКЖ, так
мы (дисульфорама) что также должно было при-
и ДЭТК) из клеток в кровь и обратно. Это и при-
БИОФИЗИКА том 67
№ 5
2022
980
ШИПОВАЛОВ и др.
водило к тому, что при ингаляции мышей сначала
8. J. Martel, Y.-F. Ko, J. D. Young, et al., Microbes and
раствором ДЭТК, а затем Б-ДНКЖ-GSH оба
Infection, 22, 168 (2020).
этих вещества, поступая в печень, могли образо-
9. J. Wu, Nitric Oxide Biol. Chem., 102, 39 (2020).
вывать ЭПР-регистрируемые в этой ткани
10. F. Sodano, E. Gazzano, R. Fruttero, at al., Molecules,
МНКЖ-ДЭТК (рис. 5). В более значительном ко-
27, 2337 (2022).
личестве эти комплексы появлялись в печени, ес-
11. E.Keaerts, L. Vijgen, L. Chen, et al., Int. J. Infect. Dis.,
ли Б-ДНКЖ-GSH после аэрозольного введения
8, 223 (2004).
ДЭТК вводили мышам внутрибрюшинно
12. W. Xu, S. Zheng, R. A. Dweik, et al., Free Radic. Biol.
(рис. 6б). Характерно, что и при таком способе
Med., 41, 19 (2006).
введения соединений уровень образующихся в
13. G. Regev-Shoshani, S. Vimalnathan, B. McMullin,
печени МНКЖ-ДЭТК был выше, чем в легких.
et al., Nitric Oxide Biol. Chem., 31, 48 (2015).
В заключение следует отметить, что в прове-
14. E.U. Uehara, B. de Stefano Shida, and C. A. de Brito,
денной нами ранее работе [39] при оценке мето-
Inflamm. Res., 64, 845 (2015).
дом ЭПР локализации М-ДНКЖ в органах крыс
15. M. Colosanti, T. Persichini, G. Venturinio, et al.,
при аэрозольном введении Б-ДНКЖ-GSH на-
IUBMB Life, 48, 25 (1999).
блюдалась, как и у сирийских хомячков, преиму-
16. А. Ф. Ванин, Биофизика, 65, 818 (2020).
щественная локализация М-ДНКЖ в тканях лег-
17. J. S. Stamler, Cell, 78, 931 (1994).
ких. Можно предполагать, что у человека (при
18. K. M. Miranda, M. G. Espey, and D. A. Wink, J. Inorg.
возможном использовании схемы Б-ДНКЖ-
Biochem., 79, 237 (2000).
GSH + ДЭТК для лечения COVID-19) появляю-
19. T. A. Heinrich, R. S. da Silva, K. M. Miranda, et al., Br.
щиеся при распаде ДНКЖ катионы нитрозония
J. Pharmacol., 169, 1417 (2013).
будут преимущественно локализоваться в тканях
20. M. Boese, P. I. Mordvintcev, A. F. Vanin, et.al., J. Biol.
легких и дыхательных путей, оказывая местное
Chem., 270, 2924 (1995).
противовирусное действие.
21. C. A. Bosworth, J. C. Toledo, J. W. Zmiewski, et al.,
Proc. Natl. Acad. Sci. USA, 106, 4671 (2009).
22. M. F. Foster, L. Liu, M. Zhang, et.al., Biochemistry,
ФИНАНСИРОВАНИЕ РАБОТЫ
48, 792 (2009).
Исследование выполнено в рамках выполне-
23. A. F. Vanin, Austin J. Analyt. Pharmaceut. Chem., 5,
ния государственного задания ГНЦ вирусологии
1109 (2018).
и биотехнологии «Вектор» Роспотребнадзора.
24. A. F. Vanin, Cell Biochem. Biophys., 77, 279 (2019).
25. А. Ф. Ванин, Биофизика, 65, 421 (2020).
26. A. F. Vanin, Appl. Magn. Res., 51, 851 (2020).
КОНФЛИКТ ИНТЕРЕСОВ
27. A. F. Vanin, Dinitrosyl Iron Copmplexes as a “Working
Авторы заявляют об отсутствии конфликта
Form” of Nitric Oxide in Living Organisms (Cambridge
интересов.
Scholars Publishing Cambridge, UK, 2019).
28. N. Lehnert, E. Kim, H. N. Dong, et al., Chem Rev.,
121, 14682 (2021).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
29. R. R. Borodulin, L. N. Kubrina, V. D. Mikoyan, et al.,
Все эксперименты на животных проводили в
Nitric Oxide Biol. Chem., 29, 4 (2013).
соответствии с соответствующими национальны-
30. A. F. Vanin, V. A. Tronov, and R. R. Borodulin, Cell
ми и международными руководящими принци-
Biochem. Biophys., 79, 93 (2021).
пами по уходу и гуманному использованию жи-
31. L. J. Reed and H. A. Muench, Am. J. Hyg., 27, 493
вотных.
(1938).
32. J. F. W. Chan, A. J. Zhang, S. Yuan, et al., Clin. Infect.
Dis., 71, 2428 (2020).
СПИСОК ЛИТЕРАТУРЫ
33. A.F . Vanin, I. V. Malenkova, and V. A. Serezhenkov,
1. Н. О. Быкова, Н. В. Горбунов, А. П.Волгарёв и др.,
Nitric Oxide Biol. Chem., 1, 191 (1997).
Бюл. эксперим. биологии и медицины, 112, 617
34. A.F . Vanin, A. P. Poltorakov, V. D. Mikoyan, et al., Ni-
(1991).
tric Oxide Biol. Chem., 23, 136 (2011).
2. G. Karupian and N. Harris, J. Exp. Med., 181, 2171
35. R. R. Borodulin, L. N. Kubrina, V. O. Shvydkiy, et al.,
(1995).
Nitric Oxide Biol. Chem., 35, 110 (2013).
3. C. J. Lowenstein, S. L. Hill, A. Lafond-Walker, et al.,
36. D. L. H. Williams, Nitrosation Reactions and the Chem-
Clin. Invest., 92, 1837 (1996).
istry of Nitric Oxide (Elsevier, Amsterdam, 2004).
4. E. Peterhans, Biol Trace Element Res., 56, 107 (1997).
37. A. F. Vanin, Methods Enzymol., 301, 269 (1999).
5. C. S. Reiss and T. Kamatsu, J. Virol., 72, 4547 (1998).
38. A. F. Vanin, X. Liu, A. Samouilov, et al., Biochim. Bio-
6. T. Akaike and H. Maeda, Immunology, 101, 300
(2000).
phys. Acta, 1474, 365 (2000).
7. S. Äkerstrom, M. Mousavi-Jazi, J. Klingstrom, et al., J.
39. А. Ф. Ванин, А. В. Пекшев, А. Б. Вагапов и др.,
Virol., 78, 1966 (2005).
Биофизика, 66, 1 (2021).
БИОФИЗИКА том 67
№ 5
2022
ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ КАТИОНОВ НИТРОЗОНИЯ
981
Antiviral Activity of Nitrosonium Cations against SARS-CoV-2
on a Syrian Hamster Model
A.V. Shipovalov*, A.F. Vanin**, O.V. Pyankov*, E.G. Bagryanskaya***, V.D. Mikoyan**,
N.A. Tkachev**, N.A. Asanbaeva***, and V.Ya. Popkova**
*State Scientific Center for Virology and Biotechnology “Vector”, Rospotrebnadzor of the Russian Federation,
Koltsovo, Novosibirsk Region, 630559 Russia
**N.N. Semenov Federal Research Center for Chemical Physics, Russian Academy of Sciences,
ul. Kosygina 4, Moscow, 119991 Russia
***N.N. Vorozhtsov Institute for Organic Chemistry, Siberian Branch of the Russian Academy of Sciences,
prosp. Akademika Lavrentieva 9, Novosibirsk, 630090 Russia
The antiviral action of binuclear dinitrosyl iron complexes with glutathione and diethyldithiocarbamate
against SARS-CoV-2 virus was demonstrated in a Syrian hamster model after subsequent aerosol exposure of
SARS-CoV-2-infected animals to the solutions of said compounds. EPR assays on intact hamsters exposed
by the aerosol route to the same dose of these solutions showed that iron complexes and diethyldithiocarba-
mate are predominantly found in lung tissues. These results have been compared with similar measurements
made on intact mice: the levels of the said reagents which were present in the lungs and liver were really in the
same range. It is suggested that the release of nitrosonium cations from binuclear dinitrosyl iron complexes
with glutathione occurs during the interaction of iron complexes towards diethyldithiocarbamate in the ani-
mal body. These cations caused S-nitrosation of host and viral cell proteases leading to suppression of SARS-
CoV-2 infection.
Keywords: SARS-CoV-2, binuclear iron dinitrosyl complexes with glutathione, sodium diethyldithiocarbamate, ni-
trosonium cations
БИОФИЗИКА том 67
№ 5
2022