БИОФИЗИКА, 2022, том 67, № 5, с. 982-990
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 577.3
РОЛЬ КАТИОНА НИТРОЗОНИЯ В МЕХАНИЗМЕ
ПРОТИВООПУХОЛЕВОГО ЭФФЕКТА ПРЕПАРАТОВ
ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА
© 2022 г. А.Ф. Ванин*, Л.А. Островская**, Д.Б. Корман**, Н.В. Блюхтерова**,
В.А. Рыкова**, М.М. Фомина**
*Федеральный исследовательский центр химической физики им. Н.Н. Семёнова РАН,
ул. Косыгина, 4, Москва, 119334, Россия
**Институт биохимической физики им. Н.М. Эмануэля РАН, ул. Косыгина, 4, Москва, 119334, Россия
Е-mail: larros@list.ru
Поступила в редакцию 26.07.2022 г.
После доработки 26.07.2022 г.
Принята к публикации 05.08.2022 г.
С целью изучения механизма противоопухолевого действия динитрозильных комплексов железа,
генерирующих как монооксид азота (NO), так и катионы нитрозония (NO+), проведено исследова-
ние влияния диэтилдитиокарбамата, «ловушки» молекул NO, на противоопухолевую активность
биядерных динитрозильных комплексов железа с глутатионом или N-ацетилцистеином. Установ-
лено, что эффективность этих комплексов in vivo в отношении солидных опухолей мышей сохраня-
ется на свойственном им уровне или даже повышается при совместном применении с диэтилдитио-
карбаматом. Предполагается, что эффект ингибирования роста опухоли под влиянием биядерных
динитрозильных комплексов железа обусловлен высвобождением из этих комплексов катионов
нитрозония, а не молекул оксида азота.
Ключевые слова: монооксид азота, катионы нитрозония, динитрозильные комплексы железа, биядерные
динитрозильные комплексы железа с глутатионом, биядерные динитрозильные комплексы железа с
N-ацетилцистеином, диэтилдитиокарбамат натрия, противоопухолевая активность in vivo, солидные
опухоли мышей.
DOI: 10.31857/S0006302922050179, EDN: JKBAWP
роста и гибели клеток. Высокие концентрации
Исследованиями последних лет установлено,
NO способны также модулировать противоопу-
что нарушение физиологических процессов, ре-
холевую иммунную защиту [1].
гулируемых монооксидом азота NO, может рас-
сматриваться в качестве фактора, вызывающего
Ранее нами было обнаружено, что генерирую-
развитие ряда патологических состояний, в том
щие оксид азота моно- и биядеpные фоpмы ди-
числе опухолевых заболеваний [1-3].
нитpозильныx комплекcов железа с различными
тиолсодержащими лигандами обладают способ-
Показано, что монооксид азота в зависимости
ностью ингибировать развитие ряда солидных
от относительного уровня NO может либо стиму-
опуxолей мышей (каpцинома легкиx Льюиc, аде-
лировать опухолевый рост, либо вызвать гибель
нокарцинома Акатол и аденокарцинома Са-755).
клеток, в связи с чем этот радикал часто характе-
Показан также определенный цитотоксический
ризуют как «обоюдоострый меч». Уровни NO ни-
эффект некоторых динитpозильныx комплексов
же или выше оптимальных для развития опухоли
железа в отношении клеток опухоли человека
значений могут активировать трансдукцию сиг-
(культура МСF7) [4-11].
налов, ведущих к ингибированию опухолевого
На основании анализа собственных экспери-
ментальных и многочисленных литературных
Сокращения: ДНКЖ - динитрозильные комплексы желе-
данных А.Ф. Ваниным был предложен механизм
за, ДЭТК - диэтилдитиокарбамат натрия, Б-ДНКЖ-Г -
биядерные динитрозильные комплексы железа с глутатио-
биологической активности динитрозильных ком-
ном, МНКЖ-ДЭТК - мононитрозильные комплексы же-
плексов железа (ДНКЖ), согласно которому эти
леза с диэтилдитиокарбаматом, Б-ДНКЖ-АЦЦ - биядер- комплексы способны выступать в качестве доно-
ные динитрозильные комплекс железа с N-ацетилцистеи- ров как нейтральных молекул NO, так и катионов
ном, в/в - внутривенно, в/б - внутрибрюшинно, п/к -
подкожно.
нитрозония NO+. При этом предполагается, что,
982
РОЛЬ КАТИОНА НИТРОЗОНИЯ
983
противоопухолевое и цитотоксическое действие
МАТЕРИАЛЫ И МЕТОДЫ
ДНКЖ с тиолсодержащими лигандами может
Препараты. В экспериментах использовали
определяться их способностью высвобождать при
сульфат железа (FeSO4 · 7H2O, Fluka, Швейца-
распаде как нейтральные молекулы NO, так и ка-
рия), восстановленный глутатион, N-ацетилци-
тионы нитрозония (NO+) [2].
стеин и нитрит натрия (Sigma, США).
С целью выяснения вопроса о том, какой из
Газообразный NO получали в реакции сульфа-
указанных компонентов ДНКЖ - молекулы ок-
та железа с нитритом натрия в 0.1 М растворе HCl
сида азота NO или катионы нитрозония NO+ -
с последующим разделением NO и примесного
может оказывать решающее противоопухолевое
диоксида азота (NO2) методом низкотемператур-
действие были проведены целенаправленные
ной сублимации жидкой смеси этих газов в ваку-
эксперименты с использованием диэтилдитио-
умированной системе [15].
карбамата натрия (ДЭТК), являющегося «ловуш-
Диэтилтиокарбамат натрия ДЭТК. Применя-
кой» для молекул NO, в качестве инструмента ис-
ли конвенциальный препарат диэтилдитиокарба-
следования [12-14].
мата натрия ([C2H5)2=N-CS2, Sigma, США).
Было установлено, что ДЭТК при контакте с
Биядерная форма ДНКЖ с глутатионом. Син-
биядерным динитрозильным комплексом желе-
тез Б-ДНКЖ-Г проводили согласно описанному
за, содержащим глютатион (Б-ДНКЖ-Г), пере-
ранее «простейшему» методу синтеза ДНКЖ с
хватывает на себя из железо-динитрозильной
тиолсодержащими лигандами [16]. В соответ-
группы комплекса железо-мононитрозильный
ствии с этим методом синтез 5 мМ раствора
фрагмент с образованием устойчивых ЭПР-реги-
ДНКЖ с глутатионом осуществляли следующим
стрируемых мононитрозильных комплексов же-
образом. К 10 мл дистиллированной воды на воз-
леза с ДЭТК (МНКЖ-ДЭТК), которые практиче-
духе добавляли 62 мг глутатиона (20 мМ), вызы-
ски не высвобождают нейтральные молекулы NO
вавшего подкисление раствора до рН 4.0, с после-
[13, 14].
дующим введением в него 28 мг (10 мМ) сульфата
железа, приводившего к дальнейшему снижению
При этом второй нитрозильный лиганд в же-
рН до 3.8. После этого в раствор добавляли 6.9 мг
лезо-динитрозильной группе высвобождается в
(10 мМ) нитрита натрия, что приводило к розово-
форме катиона нитрозония NO+, связывающего-
му окрашиванию раствора, обусловленному об-
ся с тиолами различного происхождения с обра-
разованием S-нитрозоглутатиона. Судя по интен-
зованием соответствующих S-нитрозотиолов, что
сивности оптического поглощения на 334 нм, ха-
и может определять сохранение противоопухоле-
рактерного для S-нитрозоглутатиона, реакция
вого и цитотоксического действия Б-ДНКЖ в
заканчивалась через полтора часа с образованием
присутствии ДЭТК [2, 12].
10 мМ этого соединения. После этого рН раство-
Именно таким путем было показано, что цито-
ра повышали до 7.2, что приводило к оранжевому
токсическое действие Б-ДНКЖ-Г или Б-ДНКЖ с
окрашиванию раствора, обусловленному начав-
меркаптсукцинатом на опухолевые клетки
шимся процессом образования Б-ДНКЖ-Г в рас-
MCF7 [13], а также цитотоксическое действие
творе при участии S-нитрозоглутатиона, Fe2+ и
Б-ДНКЖ-Г на бактерии Escherichia coli [14] опре-
глутатиона [16]. Для полного превращения S-нит-
деляется способностью этих комплексов высту-
розоглутатиона в Б-ДНКЖ-Г требовалось не-
пать в качестве доноров катиона нитрозония
сколько часов. Полученный раствор после уда-
NO+.
ления образовавшегося за это время осадка
гидроокиси трехвалентного железа путем филь-
Использование вышеописанного подхода поз-
трования через фильтровальную бумагу замора-
волило также предположить, что и в условиях
живали в жидком азоте и использовали (после
in vivo катионы нитрозония NO+ играют опреде-
размораживания) в экспериментах на животных.
ляющую роль в реализации противоопухолевого
Оценку полученного количества Б-ДНКЖ-Г (мо-
эффекта Б-ДНКЖ-Г [12].
лекулярная масса 846 Да) проводили оптическим
методом по интенсивности характерных для этого
В продолжение исследования механизма про-
комплекса полос поглощения на 310 и 360 нм, ха-
тивоопухолевого действия динитрозильных ком-
рактеризующихся коэффициентами экстинкции,
плексов железа в данной работе проведено изуче-
равными, соответственно, 4600 и 3700 М-1 см-1 в
ние влияния различных режимов применения
пересчете на один атом железа в Б-ДНКЖ [15].
ДЭТК на противоопухолевую активность биядер-
Согласно этой оценке концентрация Б-ДНКЖ-Г
ного динитрозильного комплекса железа, содер-
в растворе составляла 5 мМ.
жащего разные лиганды - глютатион (Б-ДНКЖ-
Г) и N-ацетил -цистеин (Б-ДНКЖ-АЦЦ), а также
Биядерная форма ДНКЖ с N-ацетилцистеином.
дана оценка противоопухолевого эффекта самого
Синтез Б-ДНКЖ-АЦЦ проводили путем обработ-
ДТЭК на моделях солидных опухолей мышей
ки газообразным NO (при давлении 150 мм рт. ст.) 1
in vivo.
мл раствора сульфата железа в дистиллированной
БИОФИЗИКА том 67
№ 5
2022
984
ВАНИН и др.
воде и ацетилцистеина в 15 мМ HEPES-буфера (рН
жиме на протяжении пяти-десяти суток после пе-
7.4), помещенных соответственно в верхнюю и
ревивки опухоли.
нижнюю части аппарата Тунберга, с последующим
Оценка противоопухолевой активности пре-
смешиванием этих растворов в присутствии NO,
паратов проведена при сопоставлении кинетики
как было описано ранее [15]. Концентрация суль-
роста опухолей в группах контрольных и леченых
фата железа в этой смеси составляла 5 мМ. После
животных. Показателем ростингибирующего эф-
пятиминутного встряхивания смеси, приводившей
фекта препарата служил коэффициент торможе-
к включению всего двухвалентного железа в ДН-
ния роста опухоли ТРО (%), который определяли
КЖ-АЦЦ, NO удаляли из аппарата откачкой, рас-
из соотношения: ТРО = (РС - РТ)/РС (%), где РС
твор полученного Б-ДНКЖ-АЦЦ замораживали и
и РТ - объем (или масса) опухоли в группах кон-
использовали (после размораживания) в экспери-
трольных (С) и леченных (Т) животных соответ-
ментах на животных. Концентрацию препарата Б-
ственно. Для изучения кинетики роста опухолей
ДНКЖ-АЦЦ оценивали по интенсивности полосы
проводили измерение двух взаимно перпендику-
его оптического поглощения на 360 нм.
лярных размеров опухолевого узла на протяже-
Противоопухолевая активность in vivo. Экспе-
нии всего периода развития опухолей. Объем
рименты проведены на 80 инбредных мышах ли-
опухоли вычисляли в соответствии с формулой
нии BDF1
- гибридах первого поколения
для эллипсоида как V = ab2/2, где a - длина, b -
f1(C57Bl/6 x DBA2) - и линии Balb/c, самках с мас-
ширина и высота опухолевого узла. При оценке
сой тела 18-20 г, разведения питомника «Филиал
массы опухоли использовали величину плотно-
«Столбовая» НЦБМТ ФМБА России».
сти опухолевой ткани, равную 1 г/см3 [17].
В качестве опухолевых тест-систем служили
Каждая группа животных, получавших тера-
солидные опухоли мышей - карцинома легких
певтическое воздействие, состояла из шести-
Льюис, аденокарцинома Акатол и аденокарцино-
восьми мышей пpи восьми-десяти животных в
ма Са-755, перевиваемые подкожно в соответ-
контроле. Наблюдение за животными продолжа-
ствии со стандартной методикой [17].
ли в течение всего периода развития опухоли,
Препарат Б-ДНКЖ-Г вводили животным в
вплоть до гибели животных.
водном растворе в суточной дозе 2 мкМ/кг внут-
Статистическая обработка данных проведена
ривенно (в/в), внутрибрюшинно (в/б) или под-
путем оценки размеров опухолей (массы опухо-
кожно (п/к) на протяжении пяти-восьми суток
лей) у контрольных и леченых животных с ис-
после перевивки опухоли.
пользованием пакета компьютерных программ
Препарат Б-ДНКЖ-АЦЦ вводили животным
Statistica 6.0.
в виде водного раствора в суточной дозе 2 и
10 мкМ/кг п/к на протяжении девяти суток после
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
перевивки опухоли.
В работе представлены результаты, характери-
В зависимости от условий эксперимента вод-
зующие противоопухолевую активность ДЭТК
ные растворы ДЭТК вводили в суточных дозах
при индивидуальном применении, а также дан-
10 или 50 мг/кг в/б при комбинированном при-
ные, полученные при совместном применении
менении через 1 ч или 15 мин после введения
ДЭТК и динитрозильных производных железа,
Б-ДНКЖ-Г или Б-ДНКЖ-АЦЦ, либо в моно-ре-
содержащих различные лиганды - Б-ДНКЖ-Г и
Таблица 1. Противоопухолевая активность ДЭТК при различных режимах введения на моделях солидных
опухолей мышей
Время оценки
Средняя масса опухоли
Доза (мг/кг/сутки) и режим
Штамм опухоли
эффекта,
мышей, г
ТРО, %
введения
сутки
леченые
контрольные
Карцинома
50 мг/кг, в/б, пятикратно,
26
0.72 ± 0.2
3.00 ± 0.3
76
легких Льюис
1, 4, 7, 10, 13 сутки
Карцинома
50 мг/кг, в/б, пятикратно,
21
0.78 ± 0.1
2.07 ± 0.2
62
легких Льюис
1-5 сутки
Карцинома
50 мг/кг, в/б, восьмикратно,
28
3.1 ± 0.2
8.00 ± 0.3
61
легких Льюис
1-4 и 7-10 сутки
Аденокарцинома
50 мг/кг, в/б, пятикратно,
23
3.4 ± 0.3
4.5 ± 0.3
24
Акатол
1-5 сутки
Аденокарцинома
10 мг/кг, в/б, девятикратно,
21
7.51 ± 0.6
9.43 ± 0.6
20
Са-755
1-9 сутки
БИОФИЗИКА том 67
№ 5
2022
РОЛЬ КАТИОНА НИТРОЗОНИЯ
985
Б-ДНКЖ-АЦЦ, на моделях солидных опухолей
мышей.
Противоопухолевая активность диэтилдитиокар-
бамата. Изучение противоопухолевого действия
ДЭТК, примененного в моно-режиме, проведено
в отношении трех солидных опухолей мышей -
карциномы легких Льюис, аденокарциномы Ака-
тол и аденокарциномы Са-755 при различных схе-
мах применения препарата.
Как видно их данных, представленных в
табл. 1, ДЭТК проявляет противоопухолевую ак-
тивность в отношении карциномы легких Льюис,
вызывая ингибирование роста опухоли на 61-
76% по сравнению с контролем. Очевидно, что
эффективность ДЭТК при в/б введении в суточ-
ной дозе 50 мг/кг зависит от режима его примене-
ния. Наибольшее торможение роста опухоли
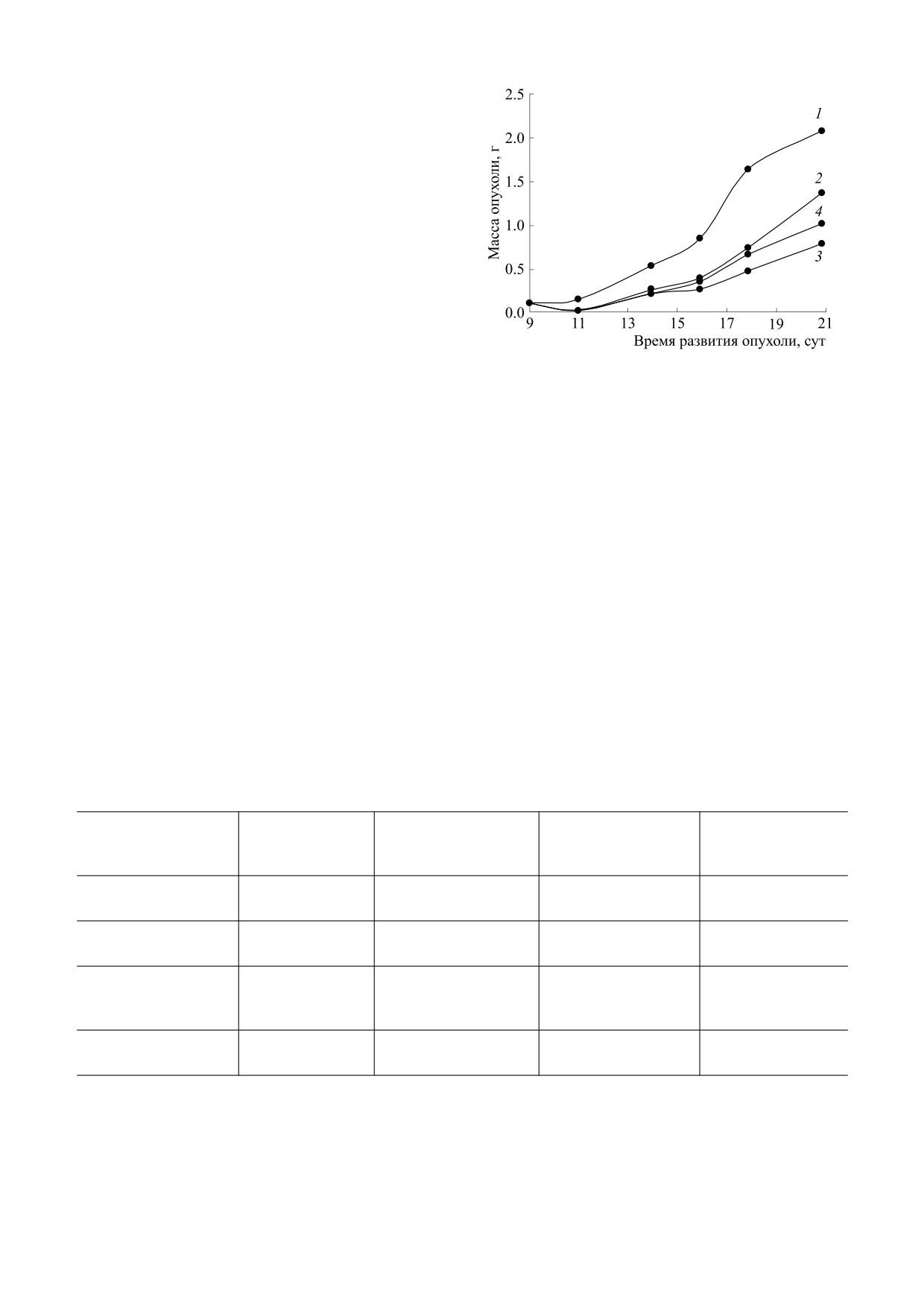
Рис. 1. Влияние сочетанного пятикратного применения
(76%) отмечено при введении препарата интер-
Б-ДНКЖ-Г и ДЭТК с часовым интервалом на кинетику
миттирующим курсом пятикратно на первые,
развития карциномы легких Льюис: 1 - контроль; 2 -
четвертые, седьмые, десятые и тринадцатые сут-
Б-ДНКЖ-Г, 2 мкМ/ кг, в/в; 3 - ДЭТК, 50 мг/кг
(250 мкМ/кг), в/б; 4 - Б-ДНКЖ-Г, 2 мкМ/кг, в/в +
ки. Применение ДЭТК пятикратно ежедневно с
+ ДЭТК, 50 мг/кг, в/б. Введение препаратов на первые,
первых по пятые сутки, либо восьмикратно на
четвертые, седьмые, десятые и тринадцатые сутки после
первые-четвертые и седьмые-десятые сутки ока-
перевивки опухоли
залось менее эффективным и приводило к тормо-
жению роста опухоли соответственно на 62 и 61%
по сравнению с контролем (табл. 1).
применения при сохранении постоянных суточ-
Аденокарциномы Акатол и Са-755 малочув-
ных доз препаратов - 50 и 2 мкМ/кг соответствен-
ствительны к действию ДЭТК. Торможение роста
но. Исследовано влияние интервала между приме-
этих опухолей под влиянием ДЭТК составляет 24
нением препаратов (1 ч либо 15 мин), а также пути
и 20% при в/б применении соответственно в до-
введения Б-ДНКЖ-Г (в/в, в/б, п/к) на эффект
зах 50 мг/кг пятикратно и 10 мг/кг девятикратно
воздействия ДЭТК, всегда вводимого в/б после
(табл. 1).
инъекции животным динитрозильного комплекса
Таким образом, в результате проведенных экс-
железа.
периментов выявлена способность ДЭТК к инги-
Введение Б-ДНКЖ-Г (в/в) и ДЭТК (в/б) с часо-
бированию опухолевого роста (карцинома легких
вым интервалом, пятикратно. Эффективность
Льюис) в условиях in vivo.
сочетанного и индивидуального применения
Противоопухолевая активность совместного при-
препаратов при в/в пятикратном (на первые, чет-
менения Б-ДНКЖ-Г и диэтилдитиокарбамата на
вертые, седьмые, десятые и тринадцатые сутки
модели карциномы легких Льюис. Влияние ДЭТК
после перевивки опухоли) введении Б-ДНКЖ-Г
на противоопухолевую активность Б-ДНКЖ-Г
характеризуют данные, представленные на рис. 1
изучено для различных режимов их сочетанного
и в табл. 2.
Таблица 2. Влияние сочетанного пятикратного применения Б-ДНКЖ-Г (в/в) и ДЭТК (в/б) с интервалом в 1 ч на
развитие карциномы легких Льюис
Препарат
Суточная доза и
Время оценки
Средняя масса
ТРО,%
путь введения
эффекта, сутки
опухоли, г
Б-ДНКЖ-Г
2 мкМ/ кг в/в
26
1.55 ± 0.1
48
ДЭТК
50 мг/кг в/б
26
0.72 ± 0.2
76
Б-ДНКЖ-Г + ДЭТК
2 мкМ/ кг в/в +
26
1.28 ± 0.3
57
50 мг/кг в/б
Контроль
-
26
3.00 ± 0.3
-
Примечание. Препараты вводили на 1, 4, 7, 10, 13 сутки.
БИОФИЗИКА том 67
№ 5
2022
986
ВАНИН и др.
противоопухолевого эффекта Б-ДНКЖ-Г (с 50 до
60%). При этом введение одного ДЭТК оказалось
наиболее эффективным (76%) по сравнению с
влиянием других воздействий. Во всех этих слу-
чаях подавление роста опухоли наблюдалось в те-
чение недели после окончания введения живот-
ным указанных агентов (тринадцатые сутки по-
сле перевивки опухоли), после чего начинался
постепенный рост опухоли.
Введение Б-ДНКЖ-Г (в/б) и ДЭТК (в/б) с часо-
вым интервалом, восьмикратно. Эффективность
сочетанного и индивидуального применения
Б-ДНКЖ-Г и ДЭТК при в/б восьмикратном (с
первых по четвертые и с седьмых по десятые сут-
ки после перевивки опухоли) введении препара-
тов характеризуют данные, представленные на
рис. 2 и в табл. 3.
Рис. 2. Влияние совместного восьмикратного примене-
ния препаратов Б-ДНКЖ-и ДЭТК с часовым интерва-
Как видно из представленных данных,
лом на кинетику развития карциномы легких Льюис:
Б-ДНКЖ-Г как при индивидуальном в/б восьми-
1 - контроль; 2 - Б-ДНКЖ-Г, 2 мкМ/кг, в/б; 3 - ДЭТК,
кратном применении, так и при введении по той
50 мг/кг, в/б; 4 - Б-ДНКЖ-Г, 2 мкМ/кг, в/б + ДЭТК,
50 мг/кг, в/б. Введение препаратов с первых по четвер-
же схеме в комбинации с ДЭТК вызывает тормо-
тые и с седьмых по десятые сутки после перевивки опу-
жение развития опухоли на 52%. ДЭТК при при-
холи.
менении в моно-режиме ингибирует рост опухо-
ли на 62% по сравнению с контролем (рис. 2,
табл. 3).
Как видно, Б-ДНКЖ-Г при в/в введении в су-
Таким образом, и в данной серии эксперимен-
точной дозе 2 мкМ/кг вызывал 48%-е торможе-
тов при в/б введении Б-ДНКЖ-Г, также как и
ние роста опухоли, а ДЭТК, введенный в/б пяти-
при в/в применении препарата, показано, что до-
кратно в суточной дозе 50 мг/кг ингибировал рост
полнительное введение ДЭТК не оказывает влия-
опухоли на 76% по сравнению с контролем. Эф-
ния на исходную противоопухолевую активность
фект совместного применения Б-ДНКЖ-Г и
динитрозильного комплекса железа с глутатио-
ДЭТК (через час после введения Б-ДНКЖ-Г) со-
ном (табл. 2 и 3).
ответствовал почти 57%-му ингибированию опу-
Введение Б-ДНКЖ-Г (п/к) и ДЭТК (в/б) с ин-
холевого роста по сравнению с контролем (рис. 1,
тервалом в 15 мин, пятикратно. Результаты изу-
табл. 2).
чения противоопухолевой эффективности соче-
Таким образом, сочетанное применение
танного и индивидуального пятикратного приме-
ДЭТК и Б-ДНКЖ-Г (в/в) с часовым интервалом
нения препаратов при п/к введении Б-ДНКЖ-Г
приводило лишь к незначительному повышению
и в/б введении ДЭТК с интервалом в 15 мин ха-
Таблица 3. Влияние сочетанного в/б восьмикратного применения Б-ДНКЖ-Г и ДЭТК с интервалом в 1 час на
развитие карциномы легких Льюис
Препарат
Суточная доза и
Время оценки
Средняя масса
ТРО, %
путь введения
эффекта, сутки
опухоли, г
Б-ДНКЖ-Г
2 мкМ/ кг, в/б
28
3.8 ± 0.2
52
ДЭТК
50 мг/кг, в/б
28
3.1 ± 0.2
61
Б-ДНКЖ-Г + ДЭТК
2 мкМ/ кг, в/б + 50
28
3.8 ± 0.3
52
мг/кг, в/б
Контроль
-
28
8.00 ± 0.3
-
Примечание. Препараты вводили с первых по четвертые и с седьмых по десятые сутки после перевивки опухоли.
БИОФИЗИКА том 67
№ 5
2022
РОЛЬ КАТИОНА НИТРОЗОНИЯ
987
рактеризуют данные, представленные на рис. 3 и
в табл. 4.
Б-ДНКЖ-Г при введении п/к оказывает, как и
следовало ожидать, менее выраженное противо-
опухолевое действие, чем при введении в/в и
в/б - торможение роста опухоли составляет соот-
ветственно 34, 48 и 52% по сравнению с контро-
лем (табл. 2-4, рис. 1-3).
Применение ДЭТК через 15 мин после Б-ДН-
КЖ-Г приводит к повышению ингибирующей
рост опухоли способности динитрозильного ком-
плекса при п/к введении с 34 до 51% (рис. 3,
табл. 4).
Очевидно, что в экспериментах как с введени-
ем в/в и в/б, так и с п/к введением Б-ДНКЖ-Г
совместно с ДЭТК, являющимся «ловушкой» для
молекул NO, обнаруживается сохранение и даже
некоторое повышение (при в/в и п/к применении
Рис. 3. Влияние совместного пятикратного применения
Б-ДНКЖ-Г) исходной противоопухолевой ак-
препаратов Б-ДНКЖ-Г (п/к) и ДЭТК (в/б) с
интервалом в 15 мин на кинетику развития карциномы
тивности Б-ДНКЖ-Г. При этом наиболее замет-
легких Льюис: 1 - контроль; 2 - Б-ДНКЖ-Г, 2 мкМ/кг,
ное влияние ДЭТК на активность Б-ДНКЖ-Г по-
п/к; 3 - ДЭТК, 50 мг/кг, в/б; 4 - Б-ДНКЖ-Г, 2 мкМ/кг,
казано при введении препаратов с интервалом в
п/к + ДЭТК, 50 мг/кг, в/б. Введение препаратов с
15 мин (по сравнению с часовым перерывом меж-
первых по пятые сутки после перевивки опухоли.
ду введениями).
Этот факт можно рассматривать как свиде-
тельство того, что эффект ингибирования роста
(аурумакрил), механизм действия которого не
опухоли под влиянием Б-ДНКЖ-Г обусловлен,
связан с генерацией монооксида азота и нитрозо-
вероятно, главным образом образованием в фи-
ния. Было показано, что сочетанное применение
зиологических условиях катионов нитрозония
этих препаратов в половинных дозах приводило к
существенному снижению эффективности ауру-
(NO+), а не присутствием молекул оксида азота
макрила, примененного в полноценной терапев-
(NO).
тической дозе в моно-режиме (неопубликован-
Косвенным подтверждением высказанного
ные данные).
предположения могут служить данные, получен-
ные в экспериментах на аденокарциноме Акатол
Противоопухолевая активность совместного
по изучению влияния ДЭТК на противоопухоле-
применения Б-ДНКЖ-АЦЦ и диэтилдитиокарба-
вую активность препарата полиакрилата золота
мата на модели аденокарциномы Са-755. С целью
Таблица 4. Влияние сочетанного применения Б-ДНКЖ-Г (п/к) и ДЭТК (в/б) с интервалом в 15 мин на развитие
карциномы легких Льюис
Препарат
Суточная доза и
Время оценки
Средняя масса
ТРО, %
путь введения
эффекта, сутки
опухоли, г
Б-ДНКЖ-Г
2 мкМ/кг, п/к
21
1.36 ± 0.2
34
ДЭТК
50 мг/кг, в/б
21
0.78 ± 0.1
62
Б-ДНКЖ-Г + ДЭТК
2 мкМ/ кг, п/к +
21
1.01 ± 0.1
51
50 мг/кг в/б
Контроль
-
21
2.07 ± 0.2
-
Примечание. Препараты вводили с первых по пятые сутки после перевивки опухоли.
БИОФИЗИКА том 67
№ 5
2022
988
ВАНИН и др.
нокарциномы Акатол на 60% по сравнению с
контролем [11].
Отметим, что в серии опытов, представленных
в настоящей статье, использован другой режим
введения Б-ДНКЖ-АЦЦ, отличающийся от при-
менявшегося в цитируемой работе [11]. Так, пре-
парат вводился в дозе 2 мкМ/кг, п/к, а не в ис-
пользовавшейся ранее дозе 10 мкМ/кг, вводив-
шейся в/в или в/б.
ДЭТК вводился в дозе 10 мг/кг, в/б, также
уменьшенной в пять раз по сравнению с приме-
нявшейся ранее дозой 50 мг/кг.
Полученные результаты представлены на
рис. 4 и в табл. 5.
Представленные данные свидетельствуют о
Рис. 4. Влияние сочетанного применения Б-ДНКЖ-
АЦЦ (п/к) и ДЭТК (в/б) с часовым интервалом на
том, что, как и следовало ожидать, снижение в
кинетику развития аденокарциномы Са-755:
1
-
пять раз доз применяемых препаратов приводит к
контроль; 2 - Б-ДНКЖ-АЦЦ, 2 мкМ/кг, п/к; 3 -
практически полному исчезновению их наблю-
ДЭТК, 10 мг/кг (50 мкМ/кг), в/б; 4 - Б-ДНКЖ-АЦЦ,
давшегося ранее противоопухолевого эффекта.
2 мкМ/кг, п/к
+ ДЭТК, 10 мг/кг, в/б. Введение
Так, Б-ДНКЖ-АЦЦ, как уже отмечалось ранее,
препаратов с первых по девятые сутки после перевивки
опухоли
при применении в дозе 10 мкМ/кг, в/в либо в/б
десятикратно, вызывал торможение роста опухо-
ли на 60% по сравнению с контролем, а при вве-
изучения влияния природы лиганда на чувстви-
дении п/к в дозе 2 мкМ/кг не оказывал противо-
тельность динитрозильного комплекса железа к
опухолевого действия. Эффект ДЭТК, вызывав-
действию ДЭТК проведено изучение противо-
шего при применении в/б в дозе
50 мг/кг
опухолевой эффективности сочетанного приме-
торможение роста опухоли (карцинома Льюис)
нения этого препарата и биядерного динитро-
на 61-76% по сравнению с контролем, снижается
зильного комплекса железа, содержащего N-аце-
до
20% при в/б введении препарата в дозе
тилцистеин, на модели аденокарциномы Са-755.
10 мг/кг.
Ранее нами было установлено, что Б-ДНКЖ-
Вместе с тем следует отметить, что при сов-
АЦЦ, примененный в/в либо в/б десятикратно в
местном применении этих препаратов в заведомо
дозе 10 мкМ/кг, вызывает торможение роста аде-
неэффективных малых дозах наблюдается досто-
Таблица 5. Влияние сочетанного применения Б-ДНКЖ-АЦЦ (п/к) и ДЭТК (в/б) с интервалом в 1 ч на развитие
аденокарциномы Са-755
Препарат
Доза и путь
Время оценки
Средняя масса
ТРО, %
введения
эффекта, сутки
опухоли, г
Б-ДНКЖ-АЦЦ
2 мкМ/кг, п/к
21
9.43 ± 0.8
0
ДЭТК
10 мг/кг, в/б
21
7.51 ± 0.6
20
Б-ДНКЖ-АЦЦ +
2 мкМ/ кг, п/к + 10
21
5.34 ± 0.4
43
ДЭТК
мг/кг, в/б
Контроль
-
21
9.43 ± 0.6
-
Примечание. Препараты вводили с первых по девятые сутки после перевивки опухоли.
БИОФИЗИКА том 67
№ 5
2022
РОЛЬ КАТИОНА НИТРОЗОНИЯ
989
верное торможение аденокарциномы Са-755 на
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
43% по сравнению с контролем (рис. 4, табл. 5).
Все применимые международные, националь-
Исходя из полученных данных можно предпо-
ные и институциональные принципы ухода и ис-
ложить, что наблюдающийся эффект ингибиро-
пользования животных при выполнении работы
вания роста опухоли при совместном примене-
были соблюдены.
нии даже весьма низких доз препаратов Б-ДН-
КЖ-АЦЦ и ДЭТК обусловлен присутствием
СПИСОК ЛИТЕРАТУРЫ
катионов нитрозония (NO+) на фоне «дезактива-
ции» под влиянием ДЭТК молекул NO, генериру-
1.
Д. Б. Корман, Л. А. Островская и А. Ф. Ванин,
емых Б-ДНКЖ-АЦЦ.
Биофизика,
66,
259
(2021). DOI:
10.31857/
S000630292102006X
В заключение следует отметить, что проведен-
2.
А. Ф. Ванин, Биохимия (2022), в печати.
ное исследование влияния ДЭТК на противоопу-
холевую активность биядерных динитрозильных
3.
A. F. Vanin, Dinitrosyl Iron Complexes as a “Working
комплексов железа, содержащих различные ли-
Form” of Nitric Oxide in Living Оrganisms (Cambridge
ганды - Б-ДНКЖ-Г и Б-ДНКЖ-АЦЦ, показало,
Scholars Publishing, Cambridge, UK, 2019).
что эффективность этих препаратов сохраняется
4.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
на свойственном им уровне или даже повышается
Биофизика, 59, 508 (2014).
при совместном применении с ДЭТК. При этом
5.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
очевидно, что эффект взаимодействия ДЭТК с
Биофизика, 60, 152 (2015).
ДНКЖ существенным образом зависит от приро-
ды лиганда, содержащегося в динитрозильном
6.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
комплексе, режима применения препарата и вида
Биофизика, 60, 1157 (2015).
опухоли.
7.
A. F. Vanin, L. A. Ostrovskaya, and D. B. Korman,
Austin J. Reprod. Medicine & Infertility, 2,
1109
Можно полагать, что полученные в представ-
(2015).
ленной работе данные подтверждают высказан-
ное ранее предположение о том, что наблюдаю-
8.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
щийся эффект весьма вероятно обусловлен спо-
Биофизика, 62, 591 (2017).
собностью ДЭТК разрушать в опухолях ДНКЖ с
9.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
высвобождением из них катионов нитрозония
Биофизика, 64, №6, 1216 (2019).
(NO+), что и приводит к сохранению или даже
10.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
некоторому усилению противоопухолевого
Биофизика,
65
(5),
1009
(2020).
DOI:
действия препаратов при их совместном приме-
10.31857/S0006302920050191
нении.
11.
А. Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
Есть основание предполагать, что изменение
Биофизика,
66
(6),
1223
(2021).
DOI:
порядка введения животным Б-ДНКЖ и ДЭТК
10.31857/S0006302921060193
на обратный, т. е. вместо Б-ДНКЖ + ДЭТК вво-
12.
А.Ф. Ванин, Л. А. Островская, Д. Б. Корман и др.,
дить ДЭТК + Б-ДНКЖ, может существенно по-
Биофизика,
66
(6),
1217
(2021).
DOI:
высить противоопухолевую активность этих пре-
10.31857/S0006302921060181
паратов. Это предположение следует из результа-
тов опытов, изложенных в цитированной ранее
13.
A. F. Vanin, V. A. Tronov, and R. R. Borodulin, Cell
работе [2], касающихся образования МНКЖ-
Biochem. Biophys., 79 (1), 93 (2021).
ДЭТК из ДНКЖ в тканях животных in vivo в зави-
14.
А. Ф. Ванин, Д. И. Телегина, В. Д. Микоян и др.,
симости от порядка введения животных ДНКЖ и
Биофизика, 67, 942 (2022).
ДЭТК. Из этих результатов следует, что эффек-
тивность высвобождения NO+ из ДНКЖ в орга-
15.
A. F. Vanin, A. P. Poltorakov, V. D. Mikoyan, et al., Ni-
низме животных должна повышаться при введе-
tric Oxide Biol. Chem., 23, 136 (2010).
нии ДНКЖ после ДЭТК. Это предположение
16.
R. R. Borodulin, L. N. Kubrina, V. O. Shvydkiy, et al.,
планируется проверить в ближайшее время.
Nitric Oxide Biol. Chem., 35, 110 (2013).
17.
Е. М. Трещалина, О. С. Жукова, Г. К. Герасимова
КОНФЛИКТ ИНТЕРЕСОВ
и др., в сб. Руководство по проведению доклиниче-
ских исследований лекарственных средств, под ред.
Авторы заявляют об отсутствии конфликта
А. Н. Миронова и др. («Гриф и К», М., 2012), ч. 1,
интересов.
сс. 642-657.
БИОФИЗИКА том 67
№ 5
2022
990
ВАНИН и др.
Role of the Nitrosonium Cation in Mechanism Underlying Antitumor Effects
of Drugs in Combination with Dinitrosyl Iron Complexes
A.F Vanin*, L.A. Ostrovskaya**, D.B. Korman**, N.V. Bluhterova**,
V.A. Rykova**, and M.M. Fomina**
*Semenov Federal Research Center of Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
**Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
The aim of this study was to explore the mechanism of antitumor action of dinitrosyl iron complexes, which
generate both nitrogen monoxide (NO) and nitrosonium cations (NO+). For this reason, the effect of dieth-
yldithiocarbamate, used in spin trapping of NO radicals, on the antitumor activity of binuclear dinitrosyl iron
complexes with glutathione or N-acetyl cysteine, was studied. It was found that the effectiveness of these
drugs in vivo against solid tumors of mice was kept as expected or even increased when these drugs were used
in combination with diethyldithiocarbamate. It is assumed that the tumor growth inhibitory effect of dini-
trosyl iron complexes is probably due mainly to the presence of nitrosonium cations, but not nitric oxide mol-
ecules released from these complexes.
Keywords: nitrogen monoxide, nitrosonium cations, dinitrosyl iron complexes, binuclear dinitrosyl iron complexes
with glutathione, binuclear dinitrosyl iron complexes with N-acetyl cysteine, diethyldythiocarbamate, antitumor
activity in vivo, solid tumors of mice
БИОФИЗИКА том 67
№ 5
2022