БИОФИЗИКА, 2022, том 67, № 6, с. 1045-1055
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ВЫСВОБОЖДЕНИЕ КАТИОНОВ НИТРОЗОНИЯ ИЗ ДИНИТРОЗИЛЬНЫХ
КОМПЛЕКСОВ ЖЕЛЕЗА ПРИ ИХ РАСПАДЕ ПОД ДЕЙСТВИЕМ
АНИОНОВ СУПЕРОКСИДА ИЛИ ЭТИЛЕНДИАМИНТЕТРААЦЕТАТА
© 2022 г. А.Ф. Ванин*, #, В.Д. Микоян*, Н.А. Ткачев*
*Федеральный исследовательский центр химической физики им. Н.Н. Семёнова РАН,
ул. Косыгина, 4, Москва, 119334, Россия
#E-mail: vanin@polymer.chph.ras.ru
Поступила в редакцию 14.09.2022 г.
После доработки 14.09.2022 г.
Принята к публикации 20.09.2022 г.
Оптическим методом продемонстрирован полный распад биядерных динитрозильных комплексов
железа с глутатионом под действием стократного избытка анионов супероксида калия (KO2) или
ЭДТА. В соответствии с резонансной структурой [(RS-)2Fe2+2(NO+)2(NO)2], характерной для этих
комплексов, их распад, вызванный взаимодействием супероксида с тиоловыми и NO-
компонентами комплексов, приводил к высвобождению в раствор катионов нитрозония (NO+),
превращавшихся в результате гидролиза в анионы нитрита, в количестве, равном половине
нитрозильных (NO+, NO) лигандов в комплексах. При распаде этих комплексов, вызванном ЭДТА
как хелатором железа, высвобождавшиеся катионы NO+ не гидролизовались, а связывались с
третичными аминами в ЭДТА. При этом биядерные динитрозильные комплексы железа с
глутатионом трансформировались в высокоспиновые (S = 3/2) мононитрозильные комплексы,
регистрируемые методом ЭПР. Полученные результаты полностью согласуются с представлениями
о динитрозильных комплексах железа с тиолсодержащими лигандами, как соединениях, способных
в живых организмах выступать в качестве доноров как нейтральных молекул NO, так и катионов
нитрозония.
Ключевые слова: динитрозильные комплексы железа, оксид азота, катионы нитрозония, анионы
супероксида, нитрит.
DOI: 10.31857/S0006302922060011, EDN: LITIHT
нитрозильных фрагментов (ЖДНФ) этих комплек-
В наших предыдущих исследованиях мы показа-
сов в одной из их резонансных структур, описывае-
ли, что динитрозильные комплексы железа (ДНКЖ)
при их разрушении способны высвобождать катио-
мой как Fe2+(NO+)(NO). Такая структура возникает
ны нитрозония (NO+), образующие с присутствую-
в результате реакции диспропорционирования двух
щими тиолами S-нитрозотиолы, а в их отсутствие -
молекул NO, связывающихся с катионом двухва-
гидролизующиеся (в реакции с анионами гидрокси-
лентного железа, с последующим протонированием
ла) до анионов нитрита [1-8]. Эта способность
образующегося аниона нитроксила и его выходом из
ДНКЖ определяется существованием железо-ди-
лигандного окружения железа (см. схему [2, 9]):
Включение вместо аниона нитроксила третьей
ядерных форм ДНКЖ (М- и Б-ДНКЖ), включаю-
молекулы NO и приводит к образованию указанной
щие в себя различные анионные (L-) лиганды, мо-
выше резонансной структуры ЖДНФ. В соответ-
гут быть представлены соответственно как [(L-)2-
ствии с ней резонансные структуры моно- и би-
Fe2+-(NO+)(NO)] и [(L-)2Fe2+2(NO+)2(NO)2].
Сокращения: ДНКЖ - динитрозильные комплексы железа, ЖДНФ - железо-динитрозильные фрагменты, М-ДНКЖ и
Б-ДНКЖ - моно- и биядерные формы динитрозильных комплексов железа, МНКЖ - мононитрозильные комплексы же-
леза, Б-ДНКЖ-GSH - биядерные динитрозильные комплексы железа с глутатионом, ДЭТК - диэтилдитиокарбамат, GS-
NO - S-нитрозоглутатион.
1045
1046
ВАНИН и др.
При включении в ДНКЖ в качестве анионных
агирующих в составе ДНКЖ с молекулами NO
лигандов соединений, не содержащих тиоловых
[10], или под действием одного из достаточно
групп, комплексы становятся неустойчивыми из-за
сильных хелаторов переходных металлов - анио-
гидролиза катионов нитрозония, входящих в состав
нов
этилендиаминтетрауксусной
кислоты
этих комплексов. Потеряв эти катионы, М- и
(ЭДТА), способных, как мы предполагали, заме-
Б-ДНКЖ превращаются в мононитрозильные ком-
щать при избыточной концентрации молекулы
глутатиона в биядерных динитрозильных ком-
плексы железа (МНКЖ) (формула
[(L-)2Fe2+-
плексах железа с глутатионом (Б-ДНКЖ-GSH) с
(NO)]. Что касается высвобождающихся катионов
последующей (в соответствии с вышесказанным)
нитрозония, они переходят в раствор, где гидроли-
трансформацией последних в МНКЖ с диэтил-
зуются до анионов нитрита (при сохранении ней-
дитиокарбаматом (ДЭТК). Предполагалось, что
тральных значений рН).
при обоих воздействиях из распадающихся
Иная ситуация реализуется для ДНКЖ при
Б-ДНКЖ-GSH могли бы высвобождаться катио-
включении в них тиолсодержащих анионных
ны нитрозония, связывающиеся с тиоловой груп-
(RS-) лигандов, характеризующихся в отличие от
пой глутатиона с образованием S-нитрозоглута-
других лигандов высокой электрон-донорной ак-
тиона (GS-NO).
тивностью. Перенос электронной плотности с
атомов серы на катионы нитрозония приводит к
нейтрализации положительного заряда на этих
MАТЕРИАЛЫ И МЕТОДЫ
лигандах и тем самым к подавлению их гидролиза
Материалы. В работе использовали ферро-
(взаимодействия катионов нитрозония с аниона-
сульфат (FeSO4·7H2O) (Fluka, Швейцария), глу-
ми гидроксила) [3, 5-9]. В результате резко повы-
татион, надпероксид (диоксид) калия (KO2), нит-
шается стабильность ДНКЖ, что и обеспечивает
функциональную активность этих комплексов в
рит натрия и этилендиаминтетраацетат калия
живых организмах как доноров нейтральных мо-
(ЭДТА) (Sigma, США). Газообразный NО полу-
чали в реакции ферросульфата с нитритом натрия
лекул NO и катионов нитрозония (NO+). Соот-
в 0.1 М HCl с последующей очисткой NO методом
ветственно, при удалении тиолсодержащих ли-
низкотемпературной сублимации [11].
гандов из ДНКЖ в результате окисления их тио-
ловых групп или их блокаде тиоловыми
Синтез биядерных ДНКЖ с глутатионом. Ком-
реагентами ДНКЖ начинают распадаться с вы-
плексы синтезировали обработкой газообразным
свобождением катионов нитрозония, гидролизу-
NO (при давлении 100 мм рт. ст.) 1 мл раствора
ющихся до нитрита [5-8].
ферросульфата в дистиллированной воде и 4 мл
10 мМ раствора глутатиона в 15 мМ HEPES-буфе-
Что касается образования S-нитрозотиолов в
ре (рН 7.4), помещенных соответственно в верх-
ходе распада ДНКЖ, такого рода процесс наблю-
нюю и нижнюю части аппарата Тунберга, с
дался нами только при кислотной обработке этих
последующим пятиминутным встряхиванием ап-
комплексов. В этих условиях ДНКЖ распадались
парата и смешиванием этих растворов в присут-
из-за протонирования тиолов, с последующим их
ствии NO, как это описано в работе [11]. Концен-
выходом из лигандного окружения железа и свя-
трация ферросульфата в этой смеси составляла
зыванием с катионами нитрозония, высвобожда-
5 мМ. После последующего пятиминутного
ющимися из ДНКЖ [5-8].
встряхивания смеси, приводившей к включению
Во всех этих опытах количество катионов нит-
всего железа в Б-ДНКЖ-GSH, NO удаляли от-
розония, высвобождавшихся из ДНКЖ, было в
качкой, раствор полученного комплекса замора-
точности равно количеству железа в составе этих
живали и использовали после разморозки в экс-
комплексов. Таким образом, поскольку каждый
периментах.
атом железа в ЖДНФ связан с двумя нитрозиль-
Концентрацию Б-ДНКЖ-GSH оценивали по
ными лигандами, можно было утверждать, что
интенсивности одной из полос его оптического
при распаде фрагментов половина этих лигандов
поглощения (на 360 нм) с коэффициентом погло-
должна высвобождаться в форме катионов нит-
щения (в пересчете на один атом железа в
розония, а другая половина - в форме нейтраль-
ных молекул NO, что находится в полном соот-
Б-ДНКЖ, равным 3700 М-1см-1 [11].
ветствии с вышеприведенной резонансной струк-
Оптические и ЭПР-измерения. Оптические из-
турой ЖДНФ в моно- и биядерной формах
мерения растворов проводили при комнатной
ДНКЖ.
температуре на спектрофотометре UV-2501PC
В настоящей работе мы проверили, сохраняет-
(Shimadzu, Europa Gmbh, Германия), используя
ся ли эта закономерность для Б-ДНКЖ с одним
плоскую кварцевую кювету с длиной оптического
из типичных представителей тиолсодержащих
пути 10 мм. ЭПР измерения проводили при 77 К
лигандов - глутатионом при распаде этих ком-
на модифицированном ЭПР-спектрометре Ra-
плексов под действием анионов супероксида, ре-
dioPan (Польша) при мощности СВЧ 5 мВт и ам-
БИОФИЗИКА том 67
№ 6
2022
ВЫСВОБОЖДЕНИЕ КАТИОНОВ НИТРОЗОНИЯ
1047
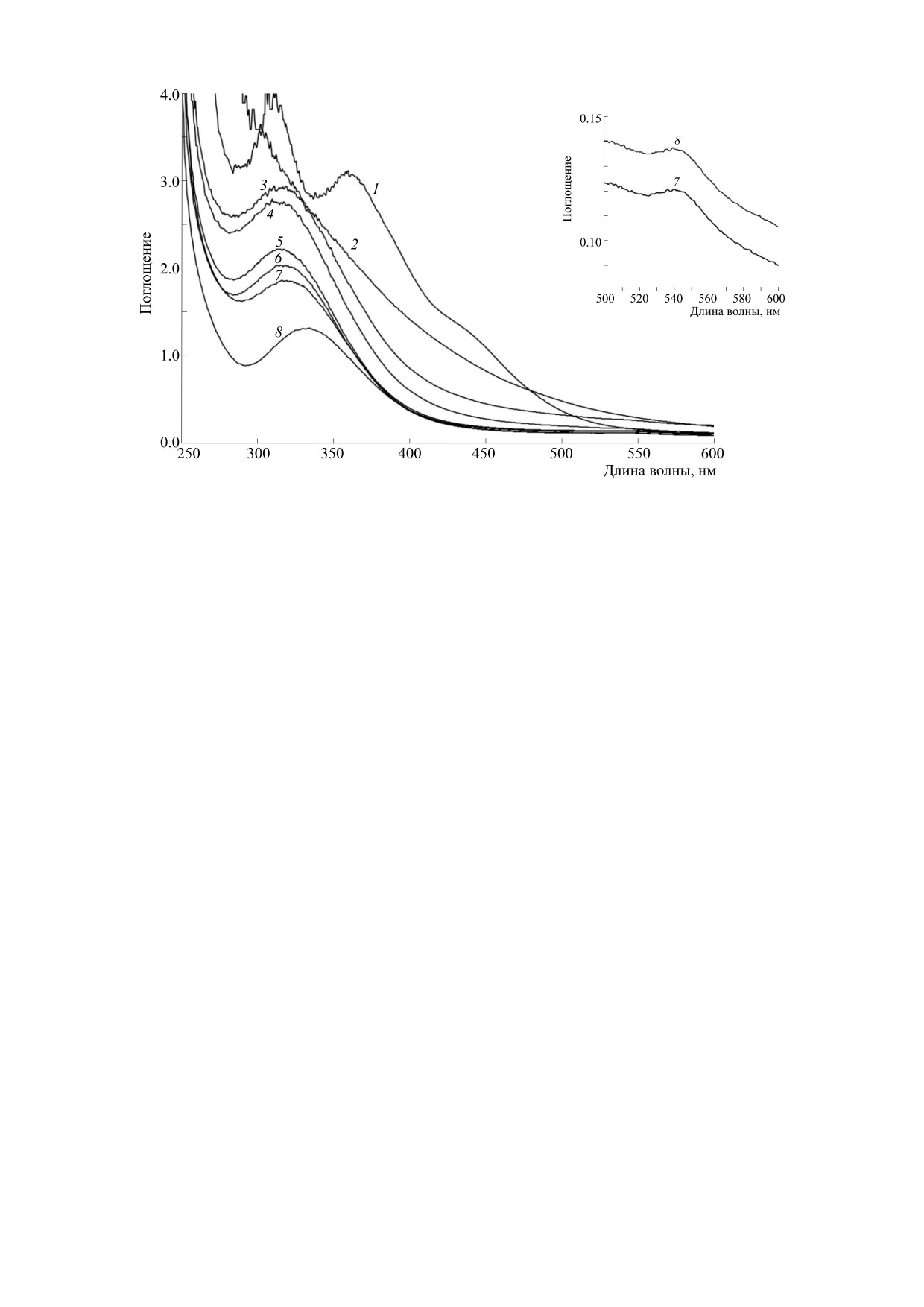
Рис. 1. Эволюция спектра поглощения 0.9 мМ раствора Б-ДНКЖ-GSH (кривая 1) после добавления к нему в качестве
донора O2- 100 мМ KO2 (кривая 2) с последующим добавлением в раствор 100 мМ GSH и серной кислоты - кривые
3-8, запись соответственно через 1, 5, 30, 45, 60 и 90 мин после добавления GSH в диапазоне значений оптического
поглощения D = 0-4.0. Врезка - кривые 7 и 8, записанные в диапазоне 500-600 нм и D = 0-0.14.
плитуде высокочастотной модуляции магнитного
Этот сдвиг заканчивался формированием полосы
поля 0.2 мТл.
поглощения на этой длине волны (кривая 8 на
рис. 1) и слабой полосы на 543 нм (рис. 1, врезка) -
полос, характерных для оптического поглощения
РЕЗУЛЬТАТЫ
S-нитрозотиолов [4]. Таким образом, обработка
продукта распада Б-ДНКЖ-GSH избытком глу-
Действие супероксида на Б-ДНКЖ-GSH. Вве-
татиона в сильно кислой среде вела к образова-
дение в 0.9 mM раствор Б-ДНКЖ-GSH в 15 мМ
нию GS-NO. Такое превращение мог испытывать
HEPES-буфере порошка KO2 в конечной кон-
только нитрит, который, очевидно, появлялся
центрации 100 мМ приводило к резкому повыше-
(наряду с гидроокисными комплексами железа) в
нию рН раствора - с 7.5 до 11 и, судя по быстрому
растворе Б-ДНКЖ-GSH, распадавшихся под
исчезновению спектра поглощения этого ком-
действием супероксида. В соответствии с инфор-
плекса (рис. 1, кривая 1), к его практически мгно-
мацией, приведенной во «Введении», нитрит мог
венному распаду. Вместо исходного спектра ре-
возникать из катионов нитрозония, высвобож-
гистрировалось монотонно возрастающее при
давшихся из Б-ДНКЖ-GSН, с их последуюшим
переходе к коротковолновой области оптическое
гидролизом.
поглощение (рис. 1, кривая 2), обусловленное,
Это предположение согласуется с количеством
очевидно, в основном комплексами трехвалент-
образовавшегося GS-NO, которое можно было
ного железа, высвободившегося из распавшихся
определить исходя из величины оптического по-
ДНКЖ и включившегося при щелочных рН в по-
глощения на 334 нм (кривая 8 на рис. 1). Она со-
лимерные гидроокисные комплексы. При после-
ставила 0.5, что соответствовало концентрации
дующем добавлении в раствор глутатиона в кон-
GS-NO, равной 0.5 мМ. Эта величина оказалась
центрации 100 мМ и серной кислоты, снижавших
равна концентрации катионов нитрозония - од-
рН раствора до 1.0-1.5, в растворе сразу же реги-
ного из двух нитрозильных лигандов в составе
стрировалась полоса поглощения на 315 нм, при-
ЖДНФ, которые могли бы (в соответствии с вы-
веденная на рис. 1 (кривая 3). При выдерживании
шесказанным во «Введении») выделиться из каж-
этого раствора на воздухе при комнатной темпе-
дого из этих фрагментов ДНКЖ при их распаде.
ратуре максимум этой полосы по мере снижения
поглощения гидроокисных комплексов железа
При повторении опытов, аналогичных проил-
сдвигался за 1.5 ч к 334 нм (рис. 1, кривые 4-8). люстрированным на рис. 1, но с другими исход-
БИОФИЗИКА том 67
№ 6
2022
1048
ВАНИН и др.
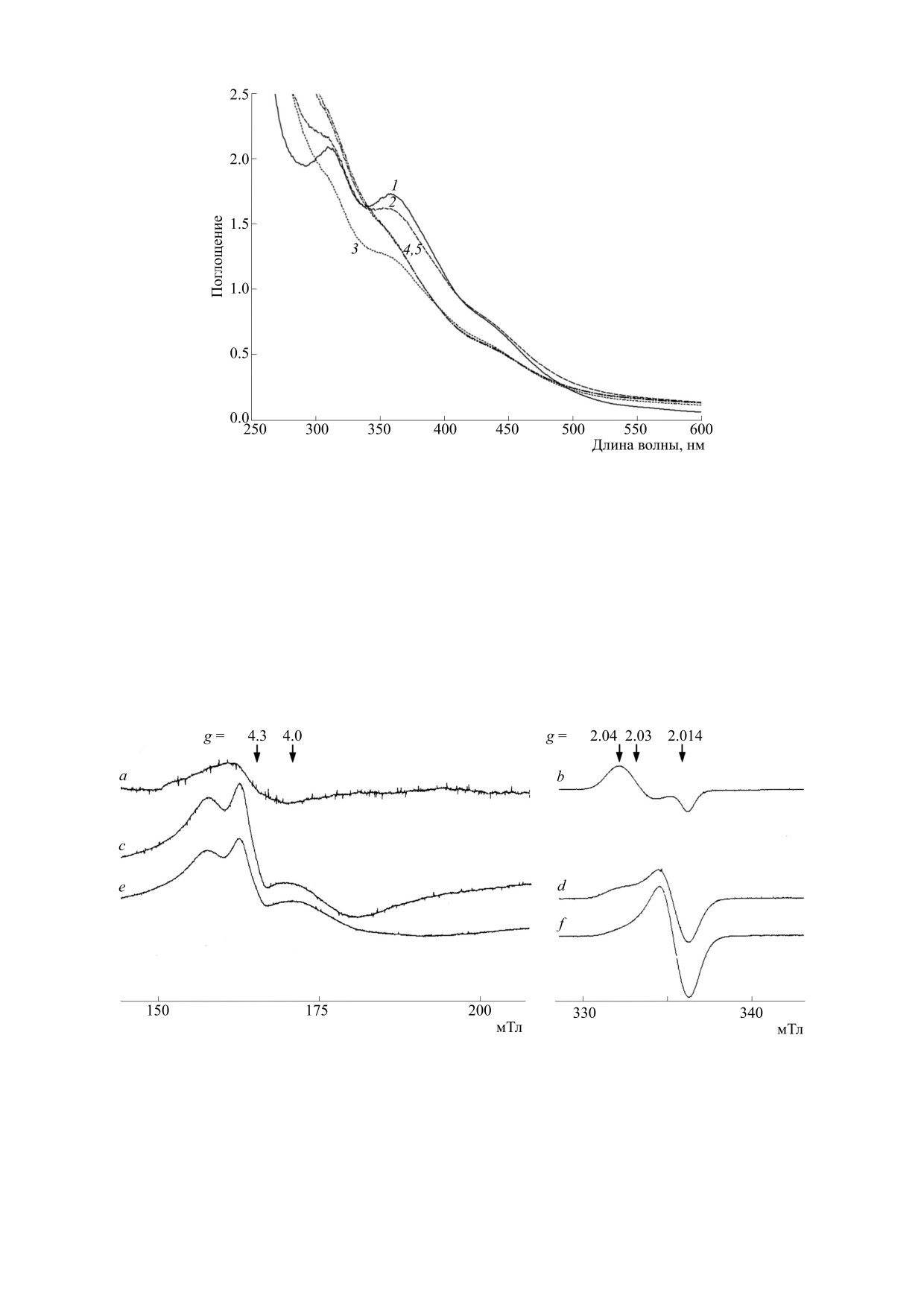
Рис. 2. Результаты вычитания кривых 2 и 3 из кривой 1, а также кривой 3 из кривой 2 (кривые 1-2, 1-3 и 2-3
соответственно). Кривые 1, 2 и 3 соответствуют кривым 3, 7 и 8, приводимым на рис. 1. Кривая 4 - спектр поглощения
0.5 мМ водного раствора FeCl3 при рН 2.0.
ными концентрациями Б-ДНКЖ-GSH (0.7 и
результате ослабления полосы на 300 нм, обу-
0.5 мМ), также было получено точное соответ-
словленной оптическим поглощением ионов
ствие этих концентраций и концентрации обра-
Fe3+, спектр поглощения 0.5 мМ раствора кото-
зующихся GS-NO (0.7 и 0.5 мМ). Проверка раз-
рых приводится на рис. 2 (кривая 4). Это ослабле-
броса экспериментальных результатов по трем
ние, очевидно, было обусловлено восстановлени-
повторам показала, что среднее отклонение от
ем этих ионов до двухвалентного состояния, в ко-
средней величины концентрации образующихся
тором эти ионы характеризуются слабым
GS-NO не превышало 10%. Столь четко выра-
оптическим поглощением.
женное равенство между концентрацией
Б-ДНКЖ-GSH (в пересчете на атом железа в этих
Аналогичный результат был получен в опытах,
комплексах) и GS-NO, образующихся в выше-
в которых рН 0.5 мМ раствора Б-ДНКЖ-GSH
описанных опытах, делает весьма правдоподоб-
был сначала поднят до щелочных значений - до
ным наше предположение о высвобождении из
11.0, а затем были добавлены 50 мМ КО2. Как и в
распадающихся под действием анионов суперок-
предыдущих опытах, это добавление приводило,
сида одного из двух нитрозильных лигандов в со-
судя по исчезновению спектра оптического по-
ставе ЖДНФ в форме катиона нитрозония с по-
глощения Б-ДНКЖ-GSH, к его распаду и появ-
следующим его превращением в анион нитрита.
лению интенсивного бесструктурного поглоще-
Следует отметить, что при десятикратном сни-
ния во всем диапазоне спектра (рис. 3, кривая 3),
обусловленного, очевидно (как следует из даль-
жении уровня KO2, т. е. при соотношении
нейшего), в основном гидроокисными комплек-
Б-ДНКЖ-GSH и KO2, равном 1 : 10, распад
сами уже не трех-, а двухвалентного железа. При
Б-ДНКЖ-GSH не обнаруживался.
последующем добавлении в раствор глутатиона в
Встает вопрос, какой процесс при выдержива-
концентрации 100 мМ и подкислении серной
нии продуктов распада Б- ДНКЖ-GSH в кислой
кислотой до рН 1.0-1.5 в растворе сразу же реги-
среде в присутствии 100 мМ глутатиона мог при-
стрировали полосу поглощения на 325 нм (рис. 3,
водить к выявлению в этой системе GS-NO? От-
кривая 4). При последующей инкубации этого
вет был получен в результате приведенного на
раствора на воздухе при комнатной температуре,
рис. 2 вычитания кривых 2 и 3 из кривой 1 (соот-
приводившей к снижению бесструктурного по-
ветствующих кривым 7, 8 и 3 на рис. 1). Это вычи-
глощения гидроокисных комплексов железа из-
тание показало, что постепенное формирование
за их осаждения, максимум исходной кривой 4 за
полосы, характерной для GS-NO, происходило в
1 ч сдвигался к 330 нм. Этот сдвиг сопровождался
БИОФИЗИКА том 67
№ 6
2022
ВЫСВОБОЖДЕНИЕ КАТИОНОВ НИТРОЗОНИЯ
1049
Рис. 3. Эволюция спектра поглощения 0.5 мМ раствора Б-ДНКЖ-GSH (кривая 1, рН 7.5) с последующими
соответственно повышением рН раствора до 11.0 (кривая 2), добавлением к нему 50 мМ KO2 ((кривая 3) и далее
введением в раствор 100 мМ GSH и серной кислоты — кривые 3-8, запись соответственно через 1, 5, 30, 45, 60 и
90 мин. Кривая 4-5 - разность кривых 4 и 5.
появлением слабой полосы на 543 нм. Эти изме-
лочных рН, как это имело место в опытах, иллю-
нения однозначно свидетельствовали о появле-
стрируемых соответственно на рис. 1 и 3.
нии в растворе GS-NO, возникавшего в результа-
Повышение рН 0.9 или 0,5 мМ растворов Б-
те S-нитрозирования глутатиона азотистой кис-
ДНКЖ-GSH до щелочных значений при добав-
лоты, появлявшейся, в свою очередь, из нитрита
лении к ним избытка супероксида (соответствен-
в кислой среде. Что касается последнего, он появ-
но 100 или 50 мМ) можно было предотвратить и
лялся в результате гидролиза катионов нитрозо-
тем самым заблокировать распад Б-ДНКЖ-GSH,
ния, высвобождавшихся в присутствии суперок-
используя для этого растворы HEPES с высокой
сида из Б-ДНКЖ-GSH.
концентрацией буфера. Результаты такого рода
Что касается менее значительного с течением
опытов на 0.5 мМ растворе Б-ДНКЖ-GSH в
времени сдвига максимума полосы поглощения
500 мМ HEPES-буфере при рН 7.5, обработанном
GS-NO в этих опытах (с 325 до 330 нм) по сравне-
от 200 до 1000 мМ КО2. приведены на рис. 4а. Как
нию с аналогичным сдвигом, приведенным на
следует из него, добавление 200 мМ КО2 практи-
рис. 1 (с 315 до 334 нм), оно могло быть обуслов-
чески не влияло на устойчивость Б-ДНКЖ-GSH
лено меньшей крутизной в этой области оптиче-
и только при повышении концентрации КО2 до
ского поглощения, наложенного на полосу по-
1 М начинался распад этого комплекса. Величина
глощения GS-NO на рис. 3, по сравнению с при-
рН при этом практически не изменялась. Это
веденным поглощением на рис.
1 (можно
означало, что емкости буфера было достаточно
соответственно сравнить разностные кривые 4-5
для нейтрализации анионов гидроксила, уровень
и 1-2). Большая крутизна этого поглощения на
которых должен был бы (в отсутствие этого буфе-
рис. 1, по-видимому, была обусловлена значи-
ра) повышаться в результате связывания прото-
тельным вкладом в него оптического поглощения
нов с анионами супероксида. Эта нейтрализация
трехвалентного железа, Последнее, очевидно,
достигалась высвобождением из HEPES-буфера
определялось тем, что высвобождающееся в этих
соответствующего количества протонов, так что
опытах из Б-ДНКЖ-GSH двухвалентное железо
анионов супероксида начинало «не хватать» для
могло окисляться до Fe3+ перекисью водорода (в
их реакции с молекулами NO в составе Б-ДНКЖ,
реакции Фентона), образующейся в большем ко-
которая приводила бы к распаду этих комплексов
личестве при добавлении супероксида к
и высвобождению из них катионов нитрозония. В
Б-ДНКЖ-GSH при нейтральных, чем при ще-
результате, как это следует из рис. 4 (кривые 2-4),
БИОФИЗИКА том 67
№ 6
2022
1050
ВАНИН и др.
Рис. 4. Эволюция спектра поглощения 0.5 мМ растворов Б-ДНКЖ-GSH: (а) - в 500 мМ HEPES-буфере, рН 7.5
(кривая 1), через 5 мин после добавления к нему 200 мМ КО2 (кривая 2), через 5 мин после добавления к предыдущему
еще 500 мМ КО2 (кривая 3) и еще 500 мМ КО2 (кривая 4); добавление КО2 не привело к заметному повышению рН
раствора; (б) - в 15 мМ HEPES-буфере, рН 7.5 (кривая 1), после введения в раствор 100 мМ GSH и повышения рН до
11.0 (кривая 2) и далее сразу или через 10 мин после добавления 50 мМ КО2 (кривые 3 и 4).
комплексы не распадались, и, как следствие, ка-
рН 11-12. В результате вместо спектра поглоще-
тионы нитрозония в форме нитрита или GS-NO в
ния с полосами на 310 и 360 нм, характерного для
этих опытах не обнаруживались.
исходного Б-ДНКЖ-GSH, регистрировался
Таким образом, распад Б-ДНКЖ-GSH под
спектр с полосой поглощения на 400 нм, харак-
действием анионов супероксида, необходимый
терный для монядерной формы ДНКЖ-
для высвобождения в раствор катионов нитрозо-
М-ДНКЖ-GSH (рис. 4в, кривые 1 и 2) Такое пре-
вращение закономерно следовало из-за повыше-
ния, в водных растворах мог достигаться только
ния уровня молекул GSH с ионизованной по сере
при щелочных значениях рН (при рН 10-11), т. е.
в условиях подавления реакции протонов с анио-
тиоловой группой в соответствии с химическим
нами супероксида, способными разрушать
равновесием между Б- и М-ДНКЖ, определяе-
Б-ДНКЖ с тиолсодержащими лигандами [10].
мым уровнем ионизованных тиолов. Что касается
действия на М-ДНКЖ анионов супероксида (до-
Встает вопрос, можно ли было в этих условиях
бавлены 50 мМ КО2), то, судя по незначительно-
предотвратить превращение высвобождающихся
из Б-ДНКЖ-GSH катионов нитрозония в нитрит
му снижению полосы поглощения на 400 нм, оно
не приводило к заметному распаду этих комплек-
в результате их гидролиза - связывания с аниона-
сов и появлению в растворе GS-NO (рис. 4в, кри-
ми гидроксила, а именно, обеспечить связывание
вые 3 и 4). При последующем подкислении рас-
катионов нитрозония с тиоловой группой моле-
твора вновь регистрировался спектр поглощения
кул глутатиона, как одного из представителей
тиолсодержащих соединений, с образованием со-
Б-ДНКЖ (данные не приведены).
ответствующего S-нитрозотиола - GS-NO. Оче-
Таким образом и в этих опытах нам не удалось
видно, что для этого необходимо было поднять
обнаружить распад Б-ДНКЖ-GSH, что обеспе-
концентрацию свободного глутатиона (не вклю-
чило бы появление в растворе катионов нитрозо-
ченного в Б-ДНКЖ) до высокого уровня с тем,
ния, связывание которых с тиоловой группой
чтобы обеспечить его конкуренцию с анионами
глутатиона могло бы привести к образованию
гидроксила в реакции с катионами нитрозония.
GS-NO. Не исключено, что в этих опытах разру-
Такого рода опыты были поставлены на
шительное действие анионов супероксида на
0.5 мМ растворе Б-ДНКЖ-GSH в 15 мМ HEPES-
Б-ДНКЖ-GSH было предотвращено восстано-
буфере, рН 7.5, в который добавляли 100 мМ GSH
вительным действием на эти анионы тиоловых
с последующим подщелачиванием раствора до
групп молекул глутатиона
БИОФИЗИКА том 67
№ 6
2022
ВЫСВОБОЖДЕНИЕ КАТИОНОВ НИТРОЗОНИЯ
1051
Рис. 5. Изменение спектра поглощения 0.5 мМ раствора Б-ДНКЖ-GSH, рН 7.4 (кривая 1) через 2 и 15 мин после
добавления 50 мМ ЭДТА (кривые 2 и 3 соответственно) с последующим добавлением 50 мМ глутатиона при рН 1.0
(кривые 4 и 5, зарегистрированные через 2 и 20 мин после добавления GSH и последующего подкисления раствора).
Действие ЭДТА на Б-ДНКЖ-GSH. ЭДТА как
Этот результат коррелировал с изменением
хелатор металлов, в том числе железа, способен
спектра ЭПР Б-ДНКЖ-GSH: последний (рис. 6,
разрушать Б-ДНКЖ-GSH при введении в рас-
сигналы a и b) становился идентичным спектру
твор в 100-кратной избыточной концентрации -
ЭПР комплексов, возникавших при обработке
50 мМ против 0.5 мМ Б-ДНКЖ-GSH, о чем сви-
газообразным NO раствора Fe2+ (0.5 мМ) + ЭДТА
детельствовало полное исчезновение спектра по-
(50 мМ) (рис. 6, сигналы c,d и e,f соответственно).
глощения этого комплекса уже через 15 мин по-
Отсюда следует, что распад Б-ДНКЖ-GSH под
сле добавления к нему ЭДТА (рис. 5, кривые 1-3).
действием избыточной дозы ЭДТА был обуслов-
Рис. 6. Спектры ЭПР исходного 0.5 мМ раствора Б-ДНКЖ-GSH (сигналы а и b), того же комплекса после его
обработки стократным избытком ЭДТА (сигналы c и d) и комплексов, образующихся после обработки газообразным
NO раствора 0.5 мМ FeSO4 + 50 мМ ЭДТА (сигналы e и f). Спектры зарегистрированы при 77 К при относительном
усилении спектрометра при регистрации сигналов а-f, соответственно равном 100, 10, 20, 1, 10 и 1.
БИОФИЗИКА том 67
№ 6
2022
1052
ВАНИН и др.
лен замещением тиолсодержащих лигандов в
дить в раствор с последующим их гидролизом до
этих комплексах молекулами ЭДТА при сохране-
анионов нитрита. Содержание этих анионов, как
нии в них нитрозильных лигандов. При этом, су-
и в вышеприведенных опытах с воздействием на
дя по сигналам, представленным в спектре ЭПР,
Б-ДНКЖ-GSH анионов супероксида, можно бы-
появлялись два типа парамагнитных центров, от-
ло оценить, действуя на анионы нитрита глутати-
ветственных за эти сигналы - ДНКЖ с ЭДТА с
оном при кислых значениях рН, что приводило
S = 1/2, дающие сигнал ЭПР в диапазоне значе-
бы к образованию GS-NO.
ний g-фактора 2.04-2.014 (рис. 6, сигналы d и f)
Как следует из данных, приводимых на рис. 5
[12], и высокоспиновые комплексы с S = 3/2, да-
(кривые 4 и 5), образование GS -NO в такого рода
ющие сигналы ЭПР в районе значений g-фактора
опытах не обнаруживалось. Спрашивается, куда
4.0-4.3 (рис. 6, сигналы с и e). Cравнительно уз-
могли исчезать катионы нитрозония? Ответ сле-
кий сигнал с g = 4,3 был обусловлен примесными
дующий - они могли связываться с ЭДТА, а
комплексами Fe3+, тогда как более широкий сиг-
именно, с входящими в него третичными амино-
нал при g = 4.0 представлял собой низкополевую
группами с образованием ионов нитрозоаммония
компоненту широкого сигнала ЭПР с g = 4.0 и 2.0,
(R3N+NO), распадающихся при комнатной тем-
обусловленного МНКЖ-ЭДТА [12, 13]).
пературе в результате разрыва N-C-связи [15].
Исходя из результатов расчета методом двой-
Реализация реакции катионов нитрозония с тре-
ного интегрирования соотношения интегральной
тичными аминами в ЭДТА, а не реакции катио-
интенсивности сигналов ЭПР высокоспинового
нов нитрозония с тиоловой группой молекул глу-
МНКЖ с цитратом (S = 3/2) и низкоспинового
татиона, могла быть обусловлена добавлением в
ДНКЖ с тем же лигандом (S = 1/2) . проведенно-
раствор ЭДТА в концентрации, в 100 раз превы-
го нами в работе [14] при соответствующем соот-
шающей концентрацию глутатиона, определяе-
ношении амплитуды этих сигналов (первой про-
мой количеством Б-ДНКЖ-GSH.
изводной их ЭПР поглощения), было показано,
Как низкоспиновые ДНКЖ-ЭДТА, так и вы-
что даже при десятикратном превышении ампли-
сокоспиновые МНКЖ-ЭДТА оказались неустой-
туды сигнала ЭПР низкоспиновых ДНКЖ по
чивыми. Первые исчезали в присутствии газооб-
сравнению с амплитудой сигнала высокоспино-
разного NO в течение 10-15 мин, очевидно, в ре-
вых МНКЖ при g = 4.0 вклад низкоспиновых
зультате гидролиза входящих в их состав
ДНКЖ в интегральное ЭПР-поглощение обоих
катионов нитрозония, тогда как высокоспиновые
типов парамагнитнвх центров не превышал не-
МНКЖ распадались в течение 20-30 мин после
скольких процентов по сравнению с вкладом в
откачки газообразного NO из аппарата Тунберга,
это поглощение высокоспиновых МНКЖ. По-
в котором они были синтезированы, в результате
скольку, как это следует из рис. 6, именно такое
их денитрозирования.
соотношение было характерно для амплитуды
Взаимодействие ЭДТА с катионами нитрозония,
сигналов ЭПР ДНКЖ-ЭДТА и МНКЖ-ЭДТА,
продуцируемыми азотистой кислотой. Связывание
можно говорить о доминирующем вкладе высо-
катионов нитрозония с аминогруппами ЭДТА
коспиновых МНКЖ-ЭДТА в интегральное ЭПР-
можно было показать в опытах с использованием
поглощение раствора этого комплекса + ДНКЖ-
азотистой кислоты как донора этих катионов.
ЭДТА, соответствующем концентрации железа,
Эти опыты сводились к следующему: 1 мМ рас-
использованного при синтезе этих комплексов -
творы NaNO2 в 15 мМ HEPES-буфере, не содер-
0.5 мМ. Такая же концентрация характерна и для
МНКЖ-ДЭТК, образующегося при распаде
жавших и содержавших 100 мМ ЭДТА (кривые 2
Б-ДНКЖ-GSH при действии на него ЭДТА (сиг-
и 3), подкисляли на 15 мин до рН 1-2 с последую-
нал с на рис. 6). Последнее следует из равенства
щим добавлением к этим растворам 100 мМ глу-
амплитуды сигналов е и с, зарегистрированных
татиона с тем, чтобы оптическим способом оце-
при относительном усилении 20 и 10.
нить концентрацию GS-NO, образующегося в ре-
акции глутатиона и азотистой кислоты,
Следует отметить, что при десятикратном сни-
возникавшей в кислой среде из нитрита. Предпо-
жении уровня ДЭТК, т. е. при соотношении
лагалось, что часть катионов нитрозония, входя-
Б-ДНКЖ-GSH и ДЭТК, равном 1 : 10, распад
щих в состав азотистой кислоты, успеет за 15 мин
Б-ДНКЖ-GSH не обнаруживался.
необратимо связаться с аминогруппами ЭДТА,
Таким образом, при действии ЭДТА на
что должно было привести к снижению концен-
Б-ДНКЖ-GSH железо-мононитрозильные груп-
трации образующегося GS-NO по сравнению с
пы из железо-динитрозильных фрагментов Б-
концентрацией этого вещества, возникавшего в
ДНКЖ-GSН практически полностью переходи-
тех же опытах в растворе нитрита в отсутствие
ли на ЭДТА с образованием соответственно
ЭДТА. Проведенные оптические измерения пол-
МНКЖ-ДЭТК. Другая часть (другая половина)
ностью подтвердили это предположение. Интен-
нитрозильных лигандов из Б-ДНКЖ-GSH долж-
сивность полосы поглощения на 334 нм, обуслов-
на была в форме катионов нитрозония перехо-
ленной GS-NO, возникавшим в растворе в отсут-
БИОФИЗИКА том 67
№ 6
2022
ВЫСВОБОЖДЕНИЕ КАТИОНОВ НИТРОЗОНИЯ
1053
Рис. 7. Спектры поглощения 100 мМ раствора глутатиона (кривая 1), 1 мМ раствора нитрита натрия (кривая 2), 1 мМ
раствора нитрита натрия + 100 мМ ЭДТА (кривая 3), 1 мМ раствора нитрита натрия, подкисленного на 15 мин до
рН 1-2 с последующим добавлением 100 мМ глутатиона (кривая 4). Кривая 4-3 получена вычитанием кривой 3 из
кривой 4, кривая 5 - спектр поглощения 1 мМ раствора нитрита натрия, подкисленного на 15 мин с последующим
добавлением 100 мМ глутатиона. На врезке приведены спектры поглощения растворов, характеризующихся кривой 5
и кривой 4-3 в области 400-600 нм.
ствие ЭДТА (рис. 7, кривая 5), существенно
условиях [7, 8] оба этих компонента ДНКЖ могут
превосходила аналогичное поглощение GS-NO,
высвобождаться при распаде комплексов в оди-
возникавшего в растворе нитрита в присутствие
наковом количестве. Хотя в наших опытах нам не
ЭДТА (кривая 4-3. полученная вычитанием кри-
удалось наблюдать предполагавшегося образова-
вой 3 из кривой 4). Кривая 4 представляла собой
ния GS-NO при связывании с глутатионом вы-
оптическое поглощение раствора нитрита + ЭД-
свобождающихся из Б-ДНКЖ-GSH катионов
ТА, подкисленного на 15 мин с последующим до-
нитрозония, об их появлении в растворе можно
бавлением глутатиона, тогда как кривая 3 - опти-
было судить по косвенным данным. Так, напри-
ческое поглощение раствора нитрита + ЭДТА без
мер, о высвобождении катионов нитрозония из
подкисления и последующего добавления глута-
железо-динитрозильных фрагментов при дей-
тиона. Глутатион сам по себе не давал заметного
ствии на них анионов супероксида при стократ-
оптического поглощения в регистрируемой обла-
ном избытке можно было судить по накоплению
сти оптического спектра (рис. 7, кривая 1).
в растворе анионов нитрита. Их количество, ко-
торое оценивалось по уровню образовавшихся из
Полученное различие в концентрации GS-NO
них в кислой среде в присутствии глутатиона мо-
в растворах, соответствующих кривым 5 и 4-3 дает
лекул GS-NO, в молярном отношении было рав-
основание предполагать, что катионы нитрозо-
но половине нитрозильных лигандов в исходных
ния, высвобождавшиеся из Б-ДНКЖ-GSH, рас-
Б-ДНКЖ-GSH.
падавшихся в присутствии ЭДТА, могли частич-
но связываться с аминогруппами ЭДТА.
В принципе, высвобождающиеся из этих ком-
плексов катионы нитрозония могли быть обнару-
жены по количеству GS-NO, которые могли бы
ОБСУЖДЕНИЕ
возникать при связывании катионов нитрозония
Основной результат проведенных нами иссле-
с тиоловой группой молекул глутатиона, тем бо-
дований полностью согласуется с развиваемыми
лее что константа этой реакции по данным рабо-
нашей группой представлениями о том, что
ты [16] на три-четыре порядка превышала реак-
ДНКЖ с тиолсодержащими лигандами могут вы-
цию связывания катионов нитрозония с аниона-
ступать в качестве доноров как молекул NO, так и
ми гидроксила
- реакцию гидролиза этих
катионов нитрозония, причем при определенных
катионов до анионов нитрита. В этих опытах мы
БИОФИЗИКА том 67
№ 6
2022
1054
ВАНИН и др.
не обнаружили сколько-нибудь заметного обра-
сосредотачиваться только на характерных для
зования GS-NO, по-видимому, из-за окисления
этих катионов реакций гидролиза и их взаимо-
глутатиона до его дисульфидной формы избыт-
действия с тиолами, приводящих соответственно
ком добавлявшегося в раствор диоксида (надпе-
к превращению этих катионов в анионы нитрита
роксида) калия (KO2).
или S-нитрозотиолы. Соответствующие сведения
о разнообразных реакциях - реакциях нитрози-
Что касается высвобождения из Б-ДНКЖ-
рования с различными электрофильными соеди-
GSH молекул NO в опытах с обработкой этих
нениями, в которые, в частности, в живых орга-
комплексов анионами супероксида, говорить об
низмах, могут включаться катионы нитрозония,
этом не приходится из-за полного исчезновения
можно найти, например, в монографии [15] или в
этих молекул в составе ЖДНФ в результате их ре-
обзоре [17].
акции со стократным избытком анионов су-
пероксида, добавлявшихся к раствору Б-ДНКЖ-
Таким образом, проведенные нами исследова-
ния дают основание полагать, что реализация
GSH. Именно взаимодействие молекул NO с
изученных нами процессов в живых организмах,
анионами супероксида, приводившее к транс-
а именно реакция появляющихся в них ДНКЖ с
формации NO в составе ДНКЖ в пероксинитрит
[10], обеспечивало распад этих комплексов и тем
тиолсодержащими лигандами с анионами
самым высвобождение из них катионов нитрозо-
супероксида или хелаторами железа может при-
водить к появлению в живых организмах высво-
ния. Что касается молекул пероксинитрита, обра-
бождающихся из ДНКЖ молекул NО и катионов
зовавшихся в составе ДНКЖ, после их предпола-
нитрозония, оказывающих на процессы жизнеде-
гаемой изомеризации в анионы нитрата они вы-
ятельности как позитивное, регуляторное, так и
ходили в этой форме из ДНКЖ, что и приводило
к распаду этих комплексов.
негативное, цитотоксическое действие [18].
Аналогичный результат, а именно высвобож-
дение из Б-ДНКЖ-GSH в равном соотношении
КОНФЛИКТ ИНТЕРЕСОВ
молекул NO и катионов нитрозония, наблюда-
Авторы заявляют об отсутствии конфликта
лось нами при обработке этих комплексов сто-
интересов.
кратным избытком ЭДТА. Такая обработка при-
водила к трансформации 0.5 мМ Б-ДНКЖ-GSH
в парамагнитные ЭПР-регистрируемые высокос-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
пиновые МНКЖ-ЭДТА с S = 3/2, возникавшие
Настоящая статья не содержит каких-либо ис-
практически в той же концентрации - 0.5 мМ
следований с участием людей или животных в ка-
(рис. 6). Эта трансформация, очевидно, была обу-
честве объектов исследований.
словлена высвобождением из исходных Б-
ДНКЖ-GSH 0.5 мМ катионов нитрозония, что и
приводило к превращению этих комплексов в
СПИСОК ЛИТЕРАТУРЫ
МНКЖ-ДЭТК при сохранении в них соответ-
ственно 0.5 мМ молекул NО, имевшихся в исход-
1. А. Ф. Ванин, И. В. Маленкова, П. И. Мордвинцев
и др., Биохимия, 58, 1094 (1993).
ных Б-ДНКЖ-GSH. Что касается появлявшихся
при этом низкоспиновых ДНКЖ-ДЭТК с S = 1/2,
2. A. F. Vanin, I. V. Malenkova, and V. A. Serezhenkov,
Nitric Oxide Biol. Chem., 1, 191 (1997).
их содержание в растворе было пренебрежимо
мало по сравнению с количеством МНКЖ-
3. A. F. Vanin and D. Sh. Burbaev, Biophys. J. 14, Article
ID 878236 (2011).
ДЭТК.
4. R. R. Borodulin, L. N. Kubrina, V. D. Mikoyan, et al.,
Высвобождение катионов нитрозония из Б-
Nitric Oxide Biol. Chem., 29, 4 (2013).
ДНКЖ-GSH в результате их связывания с тре-
5. A. F. Vanin, Austin J. Anal. Pharm. Chem., 5, 1103
тичными аминами в составе ЭДТА, по видимому,
(2018).
было обусловлено следующим. При замещении
6. A. F. Vanin, Cell. Biochem. Biophys., 77, 279 (2019).
глутатионовых лигандов в Б-ДНКЖ молекулами
ЭДТА, не содержащими тиоловой группы, элек-
7. A. F. Vanin, Appl. Magn. Res., 51, 851 (2020).
тронная плотность на нитрозильных лигандах
8. А. Ф. Ванин, Биофизика, 65, 421 (2020).
снижалась, они вновь приобретали положитель-
9. А. Ф. Ванин, Биофизика, 67, 434 (2022).
ный заряд и могли, как электрофилы, легко свя-
10. K. B. Shumaev, A. A. Gubkin, V. A. Serezhenkov, et al.,
зываться с нуклеофилами, в данном случае с тре-
Nitric Oxide Biol. Chem., 18, 37 (2008).
тичными аминами в ЭДТА.
11. A. F. Vanin, A. P. Poltorakov, V. D. Mikoyan, et al., Ni-
Обнаруженное в нашей работе связывание ка-
tric Oxide Biol. Chem., 23, 136 (2011).
тионов нитрозония с имеющимися в ЭДТА тре-
12. A. F. Vanin and D. I. Aliev, Studia Biophysica, 93, 63
тичными аминами показывает, что при рассмот-
(1983).
рении химических превращений катионов нит-
13. A. Wanat, T. Schneppensiper, G, Stochel, et al., Inorg.
розония в живых организмах не следует
Chem., 41, 4 (2002).
БИОФИЗИКА том 67
№ 6
2022
ВЫСВОБОЖДЕНИЕ КАТИОНОВ НИТРОЗОНИЯ
1055
14. A. F. Vanin, N. A. Sanina, V. A. Serezhenkov, et al., Ni-
16. V. G. Kharitonov, A. R. Sandquist, and V. S. Sharma,
tric Oxide Biol. Chem., 16, 82 (2007).
J. Biol. Chem., 270, 28158 (1995).
15. D. L. H. Williams, Nitrosation Reactions and the Chem-
17. Г. И. Бородкин и В. Г. Шубин, Успехи химии, 86,
istry of Nitric Oxide, (Elsevier, Amsterdam, The Neth-
18 (2017).
erlands, 2007).
18. А. Ф. Ванин, Биохимия, № 11 (2022) (в печати).
Nitrosonium Cation Release from Dinitrosyl Iron Complexes during Superoxide Anion-
or Ethylendiaminetetraacetate-Induced Decomposition of These Complexes
A.F. Vanin*, V.D. Mikoyan*, and N.A. Tkachev*
*Semenov Federal Research Center for Chemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
An optical method has been applied to demonstrate a complete decomposition of binuclear dinitrosyl iron
complexes with glutathione after the addition of a 100-fold excess of potassium superoxide anions (KO2) or
EDTA. According to the resonance structure [(RS-)2Fe2+2(NO+)2(NO)2] of these complexes, their decom-
position, induced by the interaction of thiol- and NO-components of the complexes with the superoxide ion,
led to nitrosonium (NO+) cation release into the solution. Due to the hydrolysis reaction, nitrosonium cat-
ions are converted into nitrite anions in the amount equal to half of nitrosyl ligands presented in these com-
plexes. When the complexes were decomposed by EDTA as an iron chelator, NO+ cations released from the
complexes were not hydrolyzed but bound to tertiary amino groups in EDTA. At the same time, through the
use of EPR method it was found out that dinitrosyl iron complexes with glutathione were transformed into
high spin (S = 3/2) mononitrosyl iron complexes. These findings support the concept that dinitrosyl iron
complexes with thiol-containing ligands are compounds that can serve as donors to both neutral NO mole-
cules and nitrosonium cations in living organisms.
Keywords: dinitrosyl iron complexes, nitric oxide, nitrosonium cations, superoxide anions, nitrite
БИОФИЗИКА том 67
№ 6
2022