БИОФИЗИКА, 2022, том 67, № 6, с. 1079-1088
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ВОЗМОЖНЫЕ ФАЗОВЫЕ ЭФФЕКТЫ В ДИСПЕРСИИ ГЛОБУЛЯРНОГО
БЕЛКА В ДИАПАЗОНЕ ТЕМПЕРАТУР НАТИВНОГО СОСТОЯНИЯ
© 2022 г. С.П. Рожков*, А.С. Горюнов*
*Институт биологии КарНЦ РАН, Пушкинская ул., 11, Петрозаводск, 185910, Россия
E-mail: rozhkov@krc.karelia.ru
Поступила в редакцию 27.05.2022 г.
После доработки 26.07.2022 г.
Принята к публикации 08.08.2022 г.
Предложен качественный подход к механизму возникновения фазовых переходов и равновесий
разного типа в дисперсиях глобулярного белка в диапазоне температур, где структурное состояние
белка считается нативным. Предполагается, что возможны два типа нативных конформеров N и N*,
имеющих максимумы стабильности в разных температурных диапазонах, но между которыми
существует обратимый структурный переход. Также предполагается наличие двух типов
интермедиатов белка I и I*, сосуществующих с конформерами N и N* в соответствующих
диапазонах температур. Обсуждается вопрос о поиске возможных путей перехода от
термодинамики (пред)денатурационных переходов белка к термодинамике конденсационных
фазовых переходов всей дисперсии в целом, с формированием фазовых границ. Предполагается,
что интермедиаты I и I* могут участвовать в фазовых переходах типа «жидкость-жидкость» (L-L), с
образованием из них микрофаз (кластеров) в метастабильном равновесии с фазой раствора,
состоящей из нативных конформеров. Наступление фазовых переходов зависит как от
микроокружения макромолекул белка в дисперсии, так и от свойств интермедиатов белка. На
фазовых диаграммах, построенных в координатах «температура-энтропия» {T,S}, «химический
потенциал конформеров - температура» {μi,T}, определены зоны метастабильных состояний N↔I и
N*↔I* , верхняя и нижняя критические температуры растворения, зона сверхкритических фазовых
переходов. Обсуждаются условия, при которых метастабильные равновесия N↔I и N*↔I* являются
результатом фазовых переходов типа (L-L). Установлено, что максимальная стабильность белка
достигается именно в области критических фазовых переходов. Эта область является гомогенной,
но характеризуется как зона пониженной термодинамической устойчивости дисперсии белка в
целом.
Ключевые слова: химический потенциал, конформация, интермедиаты, кластеры, фазовые переходы,
фазовая диаграмма.
DOI: 10.31857/S0006302922060047, EDN: LJFWJL
лизации [3]. Вместе с тем известно, что основны-
Проблемы конформации и саморегуляции в
ми участниками физиологически значимых ФП
белковых системах, равно как и связанных с ними
фазовых переходов (ФП) 1 рода между нативны-
L-L в цитоплазме являются конформационно ла-
ми (N) и денатурированными (D) состояниями,
бильные внутренне неупорядоченные белки [4-
являются предметом интенсивных исследований
7]. В связи с этим возникает вопрос, в какой мере
[1]. В то же время пока еще недостаточно рас-
конформационная лабильность белка способ-
сматривается роль конформации белка в таких,
ствует наступлению и определяет параметры ФП
например, ФП в дисперсиях глобулярных белков,
в белковом растворе. Один из способов ответить
как ФП типа «жидкость-жидкость» (ФП L-L) [2],
на него состоит, на наш взгляд, в том, чтобы про-
что обычно наблюдаются в температурном интер-
следить взаимосвязь между термодинамикой
вале стабилизации нативной формы белка и по-
(пред)денатурационных переходов белка и тер-
дробно изучаются в связи с проблемами кристал-
модинамикой конденсационных фазовых пере-
ходов всей дисперсии (раствора) в целом. Это
Сокращения: ФП - фазовые переходы, N - нативный, D - позволило бы тем самым установить взаимосвязь
«жидкость-жидкость», НКТР - нижняя критическая тем- различных уровней организации - от внутримо-
лекулярного до уровня водно-белковой системы
пература растворения, ВКТР - верхняя критическая тем-
пература растворения.
(раствора, дисперсии), поскольку все эти процес-
1079
1080
РОЖКОВ, ГОРЮНОВ
сы регулируются однотипными физическими и
растворения (НКТР). Существует и другая группа
химическими молекулярными взаимодействия-
белков, которые лучше растворяются при повы-
ми [8].
шении температуры и имеют верхнюю критиче-
скую температуру растворения (ВКТР). Считает-
ФП типа L-L обычно связаны с образованием
ся, что последовательность аминокислот опреде-
плотных белковых микрофаз - кластеров, нахо-
ляет характер растворимости и конденсации.
дящихся в метастабильном равновесии с разбав-
Однако большое число полимеров, частным слу-
ленным белковым раствором. Плотные микрофа-
чаем которых являются белки, могут иметь и ту и
зы содержат около тысячи белков и возникают в
другую температуры [14]. В последнее время на-
области температур L-L-переходов. Их образова-
блюдается прогресс в дизайне внутренне неупо-
ние объясняется механизмами коллоидных взаи-
рядоченных белков, растворы которых обладают
модействий, обусловленных короткодействую-
как НКТР, так и ВКТР, т.е. способных к конден-
щим потенциалом притяжения и дальним потен-
сации как при нагревании, так и при охлаждении
циалом отталкивания между молекулами белка
[15]. С другой стороны, в зависимости от микро-
[3]. Существуют экспериментальные данные о за-
окружения, которое определяется составом и
висимости критических температур ФП L-L от
значениями pH дисперсии (зарядом белка), кон-
концентрации белков, различных солей [9] и дру-
центрациями и типами электролита, осмолитов и
гих осмолитов в дисперсии [10]. Теоретический
т. д., дисперсия как с ВКТР, так и с НКТР может
опыт изучения ФП L-L с критической точкой
быть образована одним и тем же белком. Приме-
(при критическом составе и температуре) был
ром такого белка может служить сывороточный
сконцентрирован на относительно простых бел-
альбумин, имеющий ВКТР в присутствии поли-
ковых модельных системах типа «вода-глобуляр-
этиленгликолей или ряда неорганических солей в
ный белок» [3] и «вода-белок-соль» [11]. В по-
диапазоне пониженных, но положительных тем-
следнем случае для такой тройной системы было
ператур [16], и имеющий НКТР в области более
получено теоретическое выражение критическо-
высоких температур в присутствии поливалент-
го состава, соответствующего критической тем-
ных солей [17].
пературе. Критический состав определялся отно-
шением молярных концентраций белка и соли
В данной работе мы рассматриваем низкотем-
m2/m3 и зависел от заряда белка, числа адсорби-
пературный (D)↔(N) и высокотемпературный
рованных белком ионов электролита, коэффици-
(D)*↔(N)* конформационные переходы белка
ента активности соли [11]. При определенном
как ФП первого рода, хотя первый из них обычно
значении m2/m3 на фазовой диаграмме предска-
имеет место в диапазоне отрицательных темпера-
тур. При этом исходим из представления, что
зывалось возникновение критического ФП меж-
низкотемпературное D и высокотемпературное
ду плотной и разбавленной фазами. В результате
D* состояния белка хотя и похожи, но не иден-
этого перехода должна появляться устойчивая
тичны, поскольку вторичные структуры отлича-
макроскопически однородная дисперсия. Крити-
ются динамикой и гидратацией [18].
ческое значение m2/m3 может означать, что опре-
деленное количество ионов соли должно взаимо-
С другой стороны, есть факты о существова-
действовать с молекулой белка и занимать соот-
нии двух стабильных конформеров белка в обла-
ветствующие места в структуре белка.
сти физиологических температур, которые мы
Регулировка может осуществляться как путем
назовем N- и N*-конформерами. Первый из них
подгонки температуры к составу, так и состава к
имеет максимум стабильности в области более
температуре. При отсутствии необходимого соот-
низких, а второй - в области более высоких тем-
ношения могут возникать белковые фракции с
ператур. Так, бычья карбоангидраза имеет два
разным количеством адсорбированных ионов,
свернутых конформера с температурой перехода
отличающиеся по конформации, гидратации,
между ними около 30°C. При этом второй кон-
удельному объему и значениям химического по-
формер переходит в состояние расплавленной
тенциала. Существование различных белковых
глобулы при нагревании [19]. Предполагается
фракций способствует дестабилизации гомоген-
[20], что две свернутые N- и N*-формы белка ха-
ного состояния дисперсии [12] и тем самым до-
рактерны для многих ферментов. При этом суще-
пускает возможность разделения фаз за счет вы-
ствуют данные о конкретных структурных разли-
деления молекул с более высоким химическим
чиях стабильных конформеров [21].
потенциалом в отдельные микрофазы. В этом
В работе [22] было показано, что бычий сыво-
случае последние могут служить причиной воз-
роточный альбумин находится в одном конфор-
никновения кристаллического полиморфизма
мационном состоянии А в интервале температур
[13].
12-20°С, а в интервале температур 22-50°С - в
Если растворимость глобулярного белка сни-
двух различных конформационных состояниях А
жается с повышением температуры, то их раство-
и В. Процент содержания конформации A умень-
ры имеют нижнюю критическую температуру
шался, в то время как процент содержания кон-
БИОФИЗИКА том 67
№ 6
2022
ВОЗМОЖНЫЕ ФАЗОВЫЕ ЭФФЕКТЫ В ДИСПЕРСИИ ГЛОБУЛЯРНОГО БЕЛКА
1081
формации B увеличивался примерно до 25% при
к образованию относительно стабильной макро-
приближении температуры к 50°C. Бычий сыво-
гомогенной системы из смеси N-, N*-, I- и I*-мо-
роточный альбумин спонтанно переходил из кон-
лекул без фазовых границ.
формационного состояния А в конформацион-
В данной работе ставится задача качественно-
ное состояние В при температуре около 58°С.
го описания термодинамической системы в пред-
Ранее нами по результатам исследования ме-
ставлении фазовых диаграмм, в которой фазовые
тодом ЭПР спиновой метки структурно-динами-
переходы первого рода молекул (D)*↔(N)* и
ческих свойств сывороточного альбумина чело-
(D)↔(N) приняты за реперные точки, в темпера-
века в водно-солевых дисперсиях также были вы-
турном интервале между которыми существуют
явлены
два
температурных
диапазона
белковые фракции из (N + I)- и (N* + I*)-моле-
максимальной стабильности нативного состоя-
кул. В диапазоне некоторых температур может
ния белка [23, 24].
оказаться энергетически выгодно их фазовое раз-
деление с установлением метастабильного равно-
Таким образом, в некоторой области темпера-
весия. Вместе с тем в других, также определенных
тур существуют два типа взаимопревращающихся
условиях, происходят критические ФП между
стабильных конформеров, которые, наиболее ве-
этими фазами с формированием макроскопиче-
роятно, отличаются по растворимости в зависи-
ски однородной системы, в которой на микро-
мости от температуры. Их температурный пере-
скопическом уровне возможны последователь-
ход А↔В, видимо, можно отнести к явлению, ко-
ные изменения конформации всех компонентов
торое классифицирутся в термодинамике как
системы. Это состояние характеризуется силь-
непрерывный фазовый переход, связанный с из-
ным развитием флуктуаций концентрации кон-
менением симметрии системы без скачков термо-
формеров при макроскопической гомогенности
динамических функций, а лишь с их плавным из-
дисперсии.
менением [25].
Для характеристики этих переходов и метаста-
Кроме того, для многих белков наряду с натив-
бильных равновесий предлагается рассмотреть
ным состоянием обнаруживаются различные
фазовые диаграммы в координатах температур-
долгоживущие интермедиаты [26], причем их
ных изменений энтропии S, концентрации и хи-
концентрация иногда может быть значительной.
Естественно предположить, что они являются бо-
мических потенциалов μi различных состояний
лее лабильными, чем нативная форма, но менее
белка, где i = D, D*, N, N*, I, I* - соответствую-
лабильными, чем развернутая форма. Мы допус-
щие конформеры.
каем, что некоторые из интермедиатов (I*) имеют
более высокую растворимость и концентрацию в
ТЕОРИЯ
высокотемпературном диапазоне, образуя соот-
ветствующую фракцию белка, а некоторые ин-
Кривая стабильности белка. Как следует из ко-
термедиаты (I) имеют более высокую раствори-
локолообразной формы кривой стабильности
мость и концентрацию в низкотемпературном
белка, стабилизация нативного состояния N про-
диапазоне и образуют там свою фракцию. Не ис-
исходит при положительных значениях разности
ключено, что они способны менять структурное
свободной энергии ΔGDN = GD - GN между дена-
состояние при смене температурных диапазонов.
турированным состоянием белка D и нативным
Помимо растворимости, различие N- и I-кон-
состоянием N [28]. Температуры, при которых
формеров белка, равно как N*- и I*-конформе-
ΔGDN = 0, соответствуют ФП первого рода. Ниже
ров, может быть сопряжено с различием их объе-
и выше этих температур наблюдаются холодовое
ма и химических потенциалов. Так, известно, что
и термическое денатурированные состояния.
объем нативного состояния больше, чем денату-
Форма кривой стабилизации и температуры пе-
рированного из-за образования некоторого коли-
реходов изменяются в присутствии осмолитов
чества заполненных растворителем пустот в
или адсорбентов [29].
структуре нативного белка [27] При некоторой
величине этого различия термодинамическая
Обращает на себя внимание, что по краям ку-
устойчивость дисперсии нарушается и запускает-
пола стабильность белка меньше, чем в середине.
ся процесс фазового разделения. При этом мета-
Это может быть связано с тем, что наряду со ста-
стабильное равновесие может устанавливаться за
бильным N-конформером в этом диапазоне тем-
счет высвобождения молекул с повышенным хи-
ператур присутствуют интермедиаты белка, кото-
мическим потенциалом в отдельные микрофазы в
рые по конформационной «гибкости» занимают
результате ФП типа «жидкость-жидкость». Если
промежуточное между N и D положение и тем са-
же структурно-динамические различия между N-
мым метастабильны. Если концентрация интер-
и I-молекулами или N*- и I*-молекулами умень-
медиатов достаточна и их объем отличен от объе-
шатся при изменении температуры или состава
ма N-конформера, это уменьшает термодинами-
системы, то возможен критический ФП, ведущий
ческую устойчивость однофазной системы в
БИОФИЗИКА том 67
№ 6
2022
1082
РОЖКОВ, ГОРЮНОВ
целом, поскольку может оказаться энергетически
которое может быть обусловлено их разными
выгодным их выделение в отдельную фазу. По-
объемами и давлениями, исчезает.
добный случай нами теоретически рассматривал-
На рис. 2 также показаны фазовые переходы
ся ранее [30]. Гомогенная однофазная система яв-
первого порядка при Т1 и Т6 и область постепен-
ляется термодинамически более устойчивой, чем
ного превращения конформера N в конформер
система при наличии метастабильных состояний.
N* (и наоборот) в интервале температур Т3-Т4
как возможный фазовый переход более высокого
В случае существования одного стабильного
порядка, чем первый.
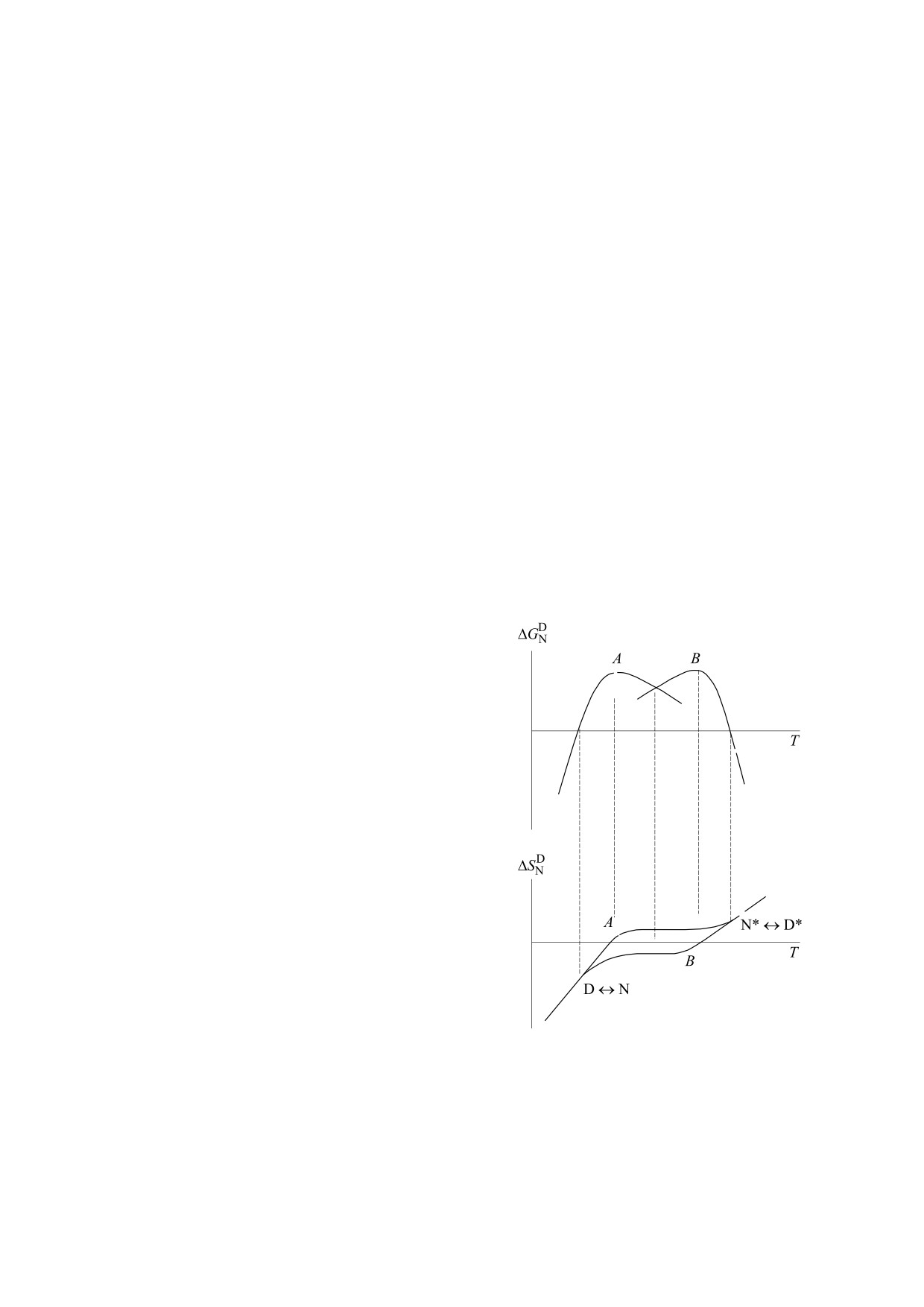
конформера ΔGDN имеет форму одиночного ку-
Химические потенциалы конформеров белка.
пола, а ΔSDN монотонно растет в этом интервале
Поскольку на рис. 2 каждое метастабильное рав-
температур и меняет знак при температуре мак-
новесие представлено своей изобарой, а давление
симальной стабилизации конформера. При нали-
и химический потенциал компонента взаимосвя-
чии двух стабильных N- и N*-конформеров мож-
заны (Δμ = PV), возможные изменения различ-
но ожидать наличия двух выраженных экстрему-
ных конформеров белка от температуры в интер-
мов ΔGDN , обозначенных на рис. 1 как А и В
вале температур от термической до холодовой де-
натурации могут быть представлены в терминах
соответственно, и двух кривых ΔSDN , пересекаю-
химических потенциалов (рис. 3), а не давлений.
щих ΔSDN = 0 в точках экстремума при соответ-
Химический потенциал μ вещества уменьшается
ствующих температурах. Они сходятся вблизи
с ростом температуры при постоянном давлении,
температур ФП 1 рода N↔D и N*↔D*, как это
так как (∂μ/∂T)р = -S, а энтропия S положитель-
представлено на рис. 1. Здесь мы предполагаем,
на [31]. Качественно зависимости μi от T, где
что состояния D и D*, N и N* различаются.
i = D, D*, N, N*, I, I* - соответствующие состоя-
Энтропийные изменения белка. Из анализа
ния белка, показаны на рис. 3. Их форма опреде-
рис. 1 можно выделить ряд энтропийных измене-
лена из общих теоретических представлений о
ний, сопровождающих ФП белковых молекул в
температурном поведении химического потенци-
растворе в интервале температур от холодовой до
ала компонент в конденсированной системе [31].
тепловой денатурации. Во-первых, это скачки
Помимо этого, подобные зависимости следуют из
энтропии для фазового перехода первого рода
D↔N и N*↔D*. Во-вторых, это изменения энтро-
пии при переходах D*N и DN* через точки ΔSDN
= 0, а также при переходах NN*. Эти изменения
можно наглядно рассмотреть на примере гипоте-
тической фазовой диаграммы в координатах
«температура-энтропия», как показано на рис. 2.
Здесь энтропийные изменения будут иметь соот-
ветствующие знаки:
ΔSDN = SD - SN < 0,
ΔSD*N* = SD* - SN* > 0,
ΔSD*N = SD* - SN > 0,
(1)
ΔSDN* = SD - SN* < 0.
При построении фазовой диаграммы на рис. 2
исходили из того, что ФП первого рода обычно не
заканчивается при одной температуре, но воз-
можны метастабильные состояния. В нашем
представлении подобные состояния могут возни-
кать из-за интермедиатов белка I* и I. Относящи-
еся к ним изобары в форме кривых Ван-дер-Ва-
альса изображены на рис. 2. Метастабильные рав-
новесия конформеров белка в интервале между
Т1-Т3 и Т6-Т4 возможны, если эти конформеры
Рис. 1. Зависимость энергии Гиббса ΔGDN (а) и
будут находиться под разными давлениями. В
энтропии ΔSDN (б) разности D- и N-состояний
белка, представленного двумя стабильными
критических точках [25] Т3 и Т4 различие между
конформерами A и B в интервале температур от
интермедиатами и нативными конформерами,
холодовой до тепловой денатурации.
БИОФИЗИКА том 67
№ 6
2022
ВОЗМОЖНЫЕ ФАЗОВЫЕ ЭФФЕКТЫ В ДИСПЕРСИИ ГЛОБУЛЯРНОГО БЕЛКА
1083
Рис. 2. Схематическое изображение фазовой диа-
Рис. 3. Температурные зависимости химических по-
граммы модельного белка со свойствами, представ-
тенциалов μi различных конформеров модельного
ленными на рис. 1, в координатной плоскости «тем-
белка (i = D, D*, N, N*, I, I*), построенные на основе
пература (Т) - энтропия (S)». Горизонтальные линии
общих термодинамических представлений о темпе-
между N и D, а также N* и D*, соответствуют фазо-
ратурном поведении компонент в конденсированной
вым переходам первого рода. Кривые (изобары), об-
системе [31]. T1 и T6 - фазовые переходы N↔D и
разованные петлями Ван-дер-Ваальса при низких и
N*↔D*; Т2 и Т5 - средние температуры зоны метаста-
высоких температурах, указывают на метастабильное
бильных равновесий; T3 и T4 являются критическими
равновесие между интермедиатом I и молекулами N,
точками с ВКТР и НКТР соответственно. Между Т3 и
а также I*- и N*-молекулами.
Т4 находится сверхкритическая макроскопически од-
нофазная область с пониженной стабильностью.
известной фазовой диаграммы эллиптического
типа, связывающей давление, при котором про-
ша новой фазы в старой фазе. Есть формула (см.
исходят ФП N↔D, с температурой (диаграмма
работу [25]), связывающая радиус метастабиль-
Хаулея (C. A. Hawley)), где вместо давления ис-
ного зародыша R с разницей давлений в нем Р2 с
пользуется химический потенциал. Углы наклона
давлением в основной фазе Р1 или с разницей в
касательных к кривым, характеризующим SD, SN,
химических потенциалах:
SD*, SN*, выбраны так, чтобы выполнялись усло-
R = 2σ/(P2 - P1) или R = 2σv2/(μ1 - μ2),
(2)
вия (1). Поэтому углы наклона касательной к SD
меньше, чем к SN, а углы наклона касательной к
где σ - поверхностное натяжение, μ - химиче-
ский потенциал частиц в фазах, v2 - объем ядра.
SD* больше, чем SN*. В данном диапазоне темпе-
ратур от T1 до Т6 наиболее стабильны состояния
Согласно этим выражениям разность (P2 - P1)
белка N и N*, поэтому значения μN и μN* мини-
может быть такой, что зародыш новой фазы соиз-
мальны. При этом состояния D и D* наименее
мерим с размером молекулы белка, однако чем
стабильны, поэтому значения μD и μD* макси-
разность меньше, тем радиус новой фазы будет
мальны. Соответственно концентрация белков
больше. Различие между давлениями на N- и D-
изменяется в сторону N и N* как более стабиль-
конформеры может быть значительным. Об этом
ных состояний, а содержание D*- и D-форм ста-
говорят экспериментальные факты использова-
новится незначительным. Можно предположить,
ния гидростатического давления для проверки
что эти закономерности сохраняются, если вме-
адекватности эллиптической формы фазового
равновесия N↔D на фазовой диаграмме Хаулея
сто SD и SD* рассматривать SI и SI*, как показано
[32] в координатах {P, T}. Поскольку объем натив-
на рис. 3.
ного состояния больше, чем развернутого, то, со-
Наличие метастабильного равновесия между
гласно этой диаграмме, равновесие N↔D при лю-
макромолекулами N, I (или N, D), имеющих раз-
бой температуре из диапазона Т1 - Т6 можно до-
ный объем (или обладающими разными химиче-
стичь либо ростом гидростатического давления,
скими потенциалами), будет обеспечиваться раз-
которое ведет к уменьшению объема N-конфор-
ными давлениями на них. Это возможно, если на
мера до объема D-конформера, либо ростом от-
уровне макромолекул действует закон Лапласа о
рицательного давления, которое увеличивает
капиллярном давлении. Сосуществование N, I
объем D-конформера до объема N-конформера.
(или N, D) макромолекул термодинамически эк-
И в том и другом случае это большие значения
вивалентно появлению метастабильного зароды-
давлений - в сотни МПа [33] (или десятки кбар).
БИОФИЗИКА том 67
№ 6
2022
1084
РОЖКОВ, ГОРЮНОВ
Чем больше разница давлений, тем меньше зна-
ОБСУЖДЕНИЕ
чение R, которое будет приближаться к молеку-
Если ΔGDN = 0 определяет границу перехода
лярному. Можно предположить, что такого же
порядка давления необходимы, чтобы интерме-
N↔D, то граница термодинамической устойчиво-
диаты находились в метастабильном равновесии
сти дисперсии белка по отношению к диффузи-
онным процессам (концентрационные флуктуа-
N↔I. Может ли капиллярное давление обеспечить
ции перестают «растворяться», и это способству-
такую разность, неизвестно.
ет фазообразованию) определяется детер-
С другой стороны, можно достичь метаста-
минантом устойчивости δ2G = 0, где δ2G =
бильного равновесия при гораздо меньших зна-
= det(∂2G/∂mi/∂mj) [11]. Здесь mi и mj - молярные
чениях давления, если интермедиаты группиру-
концентрации компонентов раствора: белка и
ются в кластеры или микрофазы. В этом случае на
осмолита соответственно. Равенство нулю этого
них будет действовать давление Лапласа
детерминанта позволяет рассчитать границу
ΔP = ±2σ/R, где ΔP - разность давлений в сосед-
устойчивости системы к разделению фаз (спино-
них фазах, разделенных искривленной поверхно-
даль) [11]. К спинодали примыкает бинодаль как
стью R. Недавно были получены интересные ре-
линия метастабильного равновесия фаз. LLPTs
зультаты в диапазоне гидростатических давлений
есть общая критическая точка спинодали и бино-
до 1 кбар, когда на примере γ-кристаллина было
дали и обычно наблюдается в непосредственной
показано, что фазовый переход L-L очень чув-
близости от кривой растворимости нативной
ствителен к относительно низкому давлению
формы белка [2, 3]. Такой подход позволяет пе-
[34]. Так, при низких температурах капли γ-кри-
рейти от рассмотрения проблемы конформации и
сталлина переходят в гомогенный раствор при
ее стабильности для индивидуальной формы бел-
давлении около 0.1 кбар, что находится в пределах
ка к проблеме устойчивости всей дисперсии по
капиллярного давления микронных капель. По-
отношению к разделению на фазы и образованию
этому гораздо более вероятно существование ме-
метастабильных состояний из разных по стабиль-
тастабильного равновесия в форме ФП L-L, чем в
ности и растворимости форм белка. Это можно
форме отдельных молекул. Такой подход позво-
сделать посредством фазовых диаграмм «темпе-
ляет перейти от термодинамики отдельных кон-
ратура-состав» (рис. 4), где состав определяется
формеров белка к термодинамике жидких фаз,
отношением m2/m3 [11]. Эта диаграмма представ-
состоящих из этих конформеров, и рассматри-
ляет систему, в которой существуют два стабиль-
вать их метастабильное равновесие как ФП типа
ных конформера N и N* и два интермедиата I и I*
«жидкость-жидкость».
(рис. 4). В основе диаграммы лежит типичная
диаграмма смешения системы полимер-раство-
При температурах Т1 и Т6 (ФП первого рода)
ритель [14], но концентрация соли выступает как
на рис. 3 наблюдается излом потенциальных кри-
параметр, играющий роль давления, поскольку
вых, но в точке их пересечения обеспечивается
кривые 1-6 - изобары.
равновесие всех состояний белка как по объему,
На рис. 4 показаны две бинодали - одна с
так и по давлению. Между температурами Т3 и Т4,
НКТР и одна с ВКТР (соответствующие им спи-
где ΔSDN = 0, предполагается существование зо-
нодали (внутренние параболы) и связанные с
этим неравновесные процессы здесь рассматри-
ны, в которой возможен непрерывный переход
ваться не будут). Бинодали соответствуют мета-
как переход более высокого порядка, чем ФП-1,
стабильным равновесиям типа N↔I или N*↔I*,
от N-конформера к N*- и I*-конформерам, и от
представленными на рис. 2, но в данном контек-
N*-конформера к N- и I-конформерам. Этот пе-
сте не на молекулярном, а на фазовом уровне.
реход должен сопровождаться ростом флуктуа-
Кривые растворимости белка представлены тон-
ций концентраций конформеров. Зона между Т3
кими линиями. Цифры слева от 1 до 6 соответ-
и Т4 интересна тем, что дисперсия белка здесь яв-
ствуют возрастающим концентрациям электро-
ляется термодинамически устойчивой, посколь-
лита m3 в дисперсии белка, в то время как по оси
ку в ней нет фазовых границ и метастабильных
абсцисс меняется концентрация белка m2. Кри-
состояний, как по краям всего температурного
вые растворимости, соединяющие противопо-
диапазона, но из-за развития флуктуаций такое
ложные стороны бинодали, отражают метаста-
состояние характеризуется пониженной термо-
бильное равновесие конформеров N↔I (кривые 1
динамической устойчивостью [25]. Вместе с тем
и 2) и N*↔I* (кривые 3 и 4). В этих случаях макро-
эта зона оказывается зоной максимальной ста-
фазы дисперсии содержат молекулы N и N*, а
бильности нативного состояния и она, согласно
микрофазы-кластеры содержат интермедиаты I и
теории Семенченко [35], может обладать опреде-
I*, соответственно. Кривые 5 и 6 соответствуют
ленными термодинамическими преимуществами
равновесию фазы из I*-конформеров и их аморф-
при функционировании белковых систем.
ных агрегатов.
БИОФИЗИКА том 67
№ 6
2022
ВОЗМОЖНЫЕ ФАЗОВЫЕ ЭФФЕКТЫ В ДИСПЕРСИИ ГЛОБУЛЯРНОГО БЕЛКА
1085
Рис. 4. Гипотетическая фазовая диаграмма дисперсии модельного белка в плоскости «температура (Т) - состав
(m2/m3)», где m2 - концентрация белка, m3
- концентрация соли. Бинодали и спинодали представлены
низкотемпературными и высокотемпературными параболами с НКТР и ВКТР. N↔I и N*↔I*- метастабильные
равновесии соответствующих конформеров белка и состоящих из них фаз. 1-6 - Кривые растворимости белка при
возрастании концентрации соли, отражающие общий эффект «всаливания» и «высаливания»; 7 - растворимость
олигомеров белка; 8 - растворимость микрофибрилл.
Согласно рис. 4 I-кластеры должны быть более
атов. Эта область макроскопически однофазна,
плотные, чем N-фаза (эквивалент «капель» в га-
хотя имеет пониженную термодинамическую
зовой фазе), а I*-кластеры - менее плотные, чем
устойчивость из-за флуктуаций. Здесь сильно
N*-фаза (эквивалент «пузырей» в жидкой фазе).
развиты флуктуации концентрации различных
Это теоретически возможно, если I*-конформе-
конформеров, вероятно, в виде динамических
ры формируют вытянутые криволинейные или
мезоскопических кластеров [3]. Вместе с тем в
линейные фибриллы. Статистическая трактовка
этой области нативное состояние белка является
подобного явления, предложенная Онзагером
наиболее стабильным, потому что в этом состоя-
для вытянутых макромолекул полимеров, допус-
нии ему соответствует максимальное число мак-
кает в таком случае фазовое разделение (цитиру-
ромолекул.
ется по [36]). Вследствие деплеционного меха-
Нами было показано ранее [30, 37], что образо-
низма микрофибриллы из I*-конформеров будут
вание зародышей - кластеров латентной фазы в
создавать отдельные микрофазы, внутри которых
белковой дисперсии может быть энергетически
будет действовать потенциал отталкивания из-за
выгодным, если полярные и заряженные группы
перекрывания вытянутых «сфер влияния» с фор-
одной белковой молекулы располагаются вблизи
мированием «пустого» пространства, куда другие
неполярных групп другой молекулы белка при
фибриллы стерически попадать не могут.
формировании ядер. Это связано с компенсацией
вклада неполярных групп в уменьшение энтро-
Поскольку как в низкотемпературных, так и в
пии при упорядочении воды. Таким образом, не-
высокотемпературных кластерах могут идти про-
полярная область одной молекулы белка как бы
цессы полимеризации, то могут возникать олиго-
экранируется другой молекулой белка от взаимо-
меры белка в первом случае (пунктирная линия
действия с объемной водой, при этом удаление
7), либо фибриллы белка во втором (пунктирная
молекул воды из зоны контакта не происходит.
линия 8). Их растворимости также будут зависеть
Поэтому образование таких белковых кластеров
от температуры и концентрации соли, и эти пред-
не меняет отношения поверхности к объему. Так
полагаемые изменения показаны пунктирными
в кластерах регулируется гидрофобность интер-
линиями 7 и 8 на рис. 4.
фейса за счет модификации структуры воды меж-
ду поверхностями макромолекул. Чем меньше
В критических точках (НКТР и ВКТР) разли-
экранируемая за счет взаимодействия поверх-
чие между конформерами N и I или N* и I* исче-
ность (т.е. разность (μ1 - μ2) в уравнении (2)), тем
зает. Точка пересечения штриховых линий при-
больше молекул должно объединиться в кластер-
ходится на область закритических фазовых пере-
микрофазу и тем больше должен быть ее размер,
ходов, в которой существует флуктуационная
чтобы получить энергетический выигрыш. Оче-
смесь всех конформеров и их возможных ассоци-
видно, более выгодно группироваться в кластер
БИОФИЗИКА том 67
№ 6
2022
1086
РОЖКОВ, ГОРЮНОВ
таким молекулам, у которых экспонировано
зывается энтропийно выгодно выделение таких
больше гидрофобных групп (в соответствии с
ассоциатов в отдельные фазы вследствие суще-
уравнением (2) значение R должно быть меньше).
ствования сегрегационного механизма неустой-
Расчеты с учетом этих предположений показыва-
чивости. Если это так, то линейные ассоциаты I*-
ют, что в недонасыщенных белковых растворах в
конформеров могут создавать микрофазы, но ме-
объеме макрофазы могут возникать белковые
нее плотные, чем фазы, составленные из домини-
кластеры переменного размера. Увеличение на-
рующих при этих температурах N*-конформеров.
сыщенности приводит к уменьшению радиуса
Это подобно тому, как пузырьки возникают в
одних из них и увеличению радиуса других. Они
жидкой фазе и существуют за счет избыточного
становятся одинаковыми только при насыщении,
когда достигается размер зародыша кристалличе-
давления Лапласа в системе с вогнутой поверхно-
ской фазы.
стью с отрицательной кривизной. Такие микро-
сферы из I*-ассоциатов могут появляться в более
Поскольку в метастабильном равновесии мик-
рофаз и основной фазы должны участвовать по-
плотной N*-фазе за счет сил отталкивания. При
верхностные силы, возникает необходимость
этом силы отталкивания между надмолекулярны-
учета капиллярного давления в белковых микро-
ми структурами в «сферах» вызывают дополни-
фазах, которое может быть как положительным,
тельное давление на основную фазу N*-белка и
так и отрицательным. Практически отсутствует
обеспечивают стабильность фазового разделения
теоретическое описание этих явлений для белко-
типа L-L. Это может быть сопряжено с ростом
вых дисперсий [38]. Однако приближенные оцен-
положительных значений второго вириального
ки по уравнению Лапласа для микрофаз размером
коэффициента осмотического давления.
до сотен нанометров показывают, что дополни-
тельное давление в таких каплях может достигать
Предлагаемый подход не означает, что для лю-
десятков бар с учетом того, что удельная поверх-
бого белка реализуются все теоретически воз-
ностная энергия гидратной оболочки белка нахо-
можные состояния на фазовой диаграмме, так
дится в пределах 15-30 мДж/м2 [39].
как каждый из белков имеет свою структуру,
предысторию и особую среду функционирова-
Химические потенциалы молекул в диспер-
ния. Тем не менее некоторые из них эксперимен-
сии, находящихся в метастабильном равновесии,
равны
тально зарегистрированы для ряда глобулярных
белков.
μN,N*(P) = μI,I* (P ± ΔP),
Поскольку свернутые, развернутые и интерме-
где μI,I* - химический потенциал молекул внутри
диатные конформации белков различаются по
кластера, а μN,N* - в основной фазе. Экспери-
своей гидратации и объему, поверхностное натя-
ментальные данные показывают, что в низкотем-
жение может играть важную роль в белок-белко-
пературном диапазоне I-фаза является более
вых взаимодействиях, осмотическом давлении,
плотной, чем N-фаза. Это эквивалентно жидким
образовании надмолекулярных структур и плот-
«каплям», находящимся в равновесии с «газовой»
ности их упаковки. Мы полагаем, что предложен-
фазой. Они стабилизированы избыточным давле-
ные фазовые диаграммы белковой дисперсии,
нием Лапласа на выпуклой поверхности «ка-
которые включают НКТР, ВКТР и сверхкритиче-
пель». В таких плотных «каплях» могут идти про-
скую область между ними в отношении конкрет-
цессы, ведущие к олигомеризации белков (двух-
ных фазовых состояний дисперсии, также могут
стадийное зародышеобразование здесь не
прояснить роль поверхностных эффектов в отно-
рассматривается). Затем при повышении темпе-
шении плотности и полиморфизма кристалличе-
ратуры выше зоны бинодали «растворение» плот-
ной I-фазы может привести к появлению в дис-
ских зародышей. Однако эффект поверхностного
персии сферических олигомеров, растворимость
натяжения в малых микрофазах или белковых
и конформация которых в дальнейшем изменя-
кластерах при достаточно высоких концентраци-
ются в направлении I → I*, как показано на рис. 4,
ях требует гораздо более глубокого понимания,
и накоплению агрегатов фибриллярного типа.
как и вероятные структуры жидкокристалличе-
Экспериментально установлено [40], что в вы-
ского типа внутри кластеров. Наиболее интерес-
сокотемпературном диапазоне в солевых диспер-
ным аспектом является сверхкритическая зона
сиях белка в определенных условиях образуются
фазовой диаграммы между ВКТР и НКТР, в ко-
агрегаты фибриллярного типа. Может оказаться,
торой существуют и трансформируются белковые
что I*-конформеры участвуют в этом процессе.
мономеры, олигомеры и мезоскопические белко-
Появление таких асимметричных вытянутых ас-
вые кластеры. Несмотря на то, что эта макроско-
социатов значительно увеличивает их эффектив-
пически однородная фаза обладает пониженной
ный объем по сравнению с реальным объемом
термодинамической устойчивостью, нативная
молекул, из которых они составлены. Часто ока-
конформация белка в этой фазе оказывается наи-
БИОФИЗИКА том 67
№ 6
2022
ВОЗМОЖНЫЕ ФАЗОВЫЕ ЭФФЕКТЫ В ДИСПЕРСИИ ГЛОБУЛЯРНОГО БЕЛКА
1087
более стабильна. Процессы в этой зоне могут
14. А. А. Тагер, Физико-химия полимеров (Научный
представлять собой модель физико-химического
мир, М., 2007).
состояния белков в клеточной протоплазме, ко-
15. G. L. Dignon, W. Zheng, Y. C. Kim, and J. Mittal, ACS
торую следует рассматривать в связи с аналогич-
Cent. Sci., 5, 821 (2019).
ным состоянием межклеточной жидкости, так
16. Y. Wang and O. Annunziata, J. Phys. Chem. B, 111,
как вместе они могут контролировать осмотиче-
1222 (2006).
ский гомеостаз как немедленный адаптивный от-
17. O. Matsarskaia, M. K. Braun, F. Roosen-Runge, et al.,
вет на колебания температуры или состава систе-
J. Phys. Chem. B, 120, 7731 (2016).
мы в условиях физиологического стресса [41].
18. M. Adrover, G. Martorell, S. R. Martin, et al., J. Mol.
Biol., 417, 413 (2012).
ФИНАНСИРОВАНИЕ РАБОТЫ
19. H. N. Hollowell, S. S. Younvanich, S. L. McNevin,
Исследование выполнено по Государственно-
et al., J. Biochem. Mol. Biol., 40, 205 (2007).
му заказу (проект № FMEN-2022-0006).
20. B. M. Britt, J. Biochem. Mol. Biol., 37, 394 (2004).
21. R. L. Tuinstra, F. C. Peterson, S. Kutlesa, et al., Proc.
КОНФЛИКТ ИНТЕРЕСОВ
Natl. Acad. Sci. USA, 105, 5057 (2008).
Авторы заявляют об отсутствии конфликта
22. L. Bian, D. Wu, and W. Hu, Biomed. Chromatogr., 28,
интересов.
295 (2014).
23. С. П. Рожков и А. И. Кяйвяряйнен, Биофизика,
30, 772 (1986).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
24. С. П. Рожков, А. С. Горюнов и М. Ю. Крупнова,
Настоящая статья не содержит каких-либо ис-
Труды КарНЦ РАН. Сер. Экспериментальная био-
следований с участием людей или животных в ка-
логия, № 11, 38 (2020).
честве объектов исследований.
25. И. П. Базаров, Термодинамика (Высшая школа, М.,
1983).
СПИСОК ЛИТЕРАТУРЫ
26. M. Tsytlonok and L. S. Itzhaki, Arch. Biochem. Bio-
1. А. В. Финкельштейн и А. Б. Птицын, Физика белка:
phys., 531, 14 (2013).
курс лекций (Книжный дом «Университет», M.,
27. C. Royer and R. Winter, Curr. Opin. Colloid & Inter-
2002).
face Sci., 16, 568 (2011).
2. V. N. Uversky and A. V. Finkelstein, Biomolecules, 9,
28. П. Л. Привалов, Биофизика, 32, 742 (1987)
842 (2019).
3. P. G. Vekilov, J. Physics: Condensed Matter, 24,
29. C. Alfano, D. Sanfelice, S. R. Martin, et al., Nature
193101 (2012).
Commun. 8, 15428 (2017).
4. A. V. Fonin, A. L. Darling, I. M. Kuznetsova, et al.,
30. С. П. Рожков, Биофизика, 46, 53 (2001).
Cell Molec. Life Sci., 75, 3907 (2018).
31. П. Эткинс, Физическая химия (Мир, М., 1980).
5. E. L. Baba, T. J. Kim, D. B. Rogers, et al., J. Phys.
32. S. A. Hawley, Biochemistry, 10, 2436 (1971).
Chem. B, 120, 12040 (2016).
33. L. Smeller, F. Meersman, and K. Heremans, Biochim.
6. A. A. M. André and E. Spruijt, Int. J. Mol. Sci., 21,
Biophys. Acta, 1764, 497 (2006).
5908 (2020).
7. A. A. Hyman, C. A. Weber, and F. Julicher, Annu. Rev.
34. S. Cinar, H. Cinar, H. S. Chan, and R. Winter, J. Am.
Cell Dev. Biol., 30, 39 (2014).
Chem. Soc., 141, 7347 (2019).
8. П. Хиппель и Т. Шлейх, в кн. Структура и ста-
35. В. К. Семенченко, Журн. физ. химии, 36 (1), 15
бильность биологических макромолекул (М.:
(1962).
Мир,1973), Гл. 4.
36. Д. А. Фридрихсберг, Курс коллоидной химии (Хи-
9. J. J. Grigsby, H. W. Blanch, and J. M. Prausnitz, Bio-
мия, Л., 1984).
phys.Chem., 91, 231 (2001).
37. S. P. Rozhkov, J. Cryst. Growth, 273, 266 (2004).
10. O. Galkin and P. G. Vekilov, Proc. Natl. Acad. Sci.
38. A. Cacciuto and D. Frenkel, J. Phys. Chem. B, 109,
USA, 97, 6277 (2000).
6587 (2005).
11. S. P. Rozhkov and A. S. Goryunov, Biophys. Chem.,
39. С. П. Рожков и А. С. Горюнов, Биофизика, 51, 236
151, 22 (2010).
(2006).
12. D. Bulone, V. Martorana, and P. L. San Biagio, Bio-
phys. Chem., 91, 61 (2001).
40. J. Juarez, S. G. Lope, and A. Cambon, J. Phys. Chem.
B, 113, 10521 (2009).
13. С. П. Рожков, Актуальные вопросы биологиче-
ской физики и химии, 6 (2), 330 (2021).
41. С. П. Рожков, Биофизика, 50, 115 (2005).
БИОФИЗИКА том 67
№ 6
2022
1088
РОЖКОВ, ГОРЮНОВ
Possible Phase Effects in Dispersion of a Globular Protein in the Temperature Range
of the Protein’s Native State
S.P. Rozhkov* and A.S. Goryunov*
*Institute of Biology, Karelian Research Centre of the Russian Academy of Sciences,
Pushkinskaya ul. 11, Petrozavodsk, 185910 Russia
This work proposes a qualitative approach to study the mechanism of occurrence of phase transitions (PT)
and equilibria of various types in globular protein dispersions in the temperature range within which the
structure of a protein can be considered as the native state of a protein. Presumably, the presence of two types
of N and N* native conformers with a maximum stability in different temperature ranges is possible, but for
these protein conformations, structural phase transition is reversible. It is also expected that there are two
types of protein intermediates, I and I*, coexisting with N and N* conformers in the corresponding tempera-
ture ranges. Possible ways of transfer from the thermodynamics of (pre)denaturation protein transitions to the
thermodynamics of condensation phase transitions of the overall dispersion, with the formation of phase
boundaries, are discussed. I and I* intermediates are assumed to be involved in liquid-liquid (L-L) phase
transitions, forming microphases (clusters) out of them in metastable equilibrium with the solution phase
composed of native conformers. The onset of phase transitions depends both on the microenvironment of
protein macromolecules in the dispersion and on the properties of protein intermediates. Phase diagrams
plotted in temperature and entropy (T-S) coordinates, in the μi - T plane, illustrate zones of metastable states
N↔I and N*↔ I*, the upper and lower critical solution temperatures have been determined and the zone of
supercritical phase transitions are shown. The conditions under which N↔I and N*↔I* metastable equilibria
are phase transitions of the (L-L) type are discussed. It is concluded that maximal protein stability is achieved
just in the region of critical phase transitions. This region is homogeneous, but on the whole, it is character-
ized as a zone of reduced thermodynamic stability of protein dispersion.
Keywords: chemical potential, conformation, intermediates, clusters, phase transitions, phase diagram
БИОФИЗИКА том 67
№ 6
2022