БИОФИЗИКА, 2022, том 67, № 6, с. 1093-1100
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ВЗАИМОДЕЙСТВИЕ МОЛЕКУЛ СЫВОРОТОЧНОГО АЛЬБУМИНА,
ЖИРНЫХ КИСЛОТ И ГРАФЕНОВ НАНОЧАСТИЦ ШУНГИТОВОГО
УГЛЕРОДА В ВОДНОЙ ДИСПЕРСИИ ПО ДАННЫМ СПЕКТРОСКОПИИ
КОМБИНАЦИОННОГО РАССЕЯНИЯ ВОДЫ В ДИАПАЗОНЕ БОЛЬШИХ
ВОЛНОВЫХ ЧИСЕЛ
© 2022 г. С.П. Рожков*, А.С. Горюнов*, В.А. Колодей**, Л.А. Пронькина**, Н.Н. Рожкова**
*Институт биологии КарНЦ РАН, Пушкинская ул., 11, Петрозаводск, 185910, Россия
**Институт геологии КарНЦ РАН, Пушкинская ул., 11, Петрозаводск, 185910, Россия
E-mail: rozhkov@krc.karelia.ru
Поступила в редакцию 05.05.2022 г.
После доработки 09.06.2022 г.
Принята к публикации 11.07.2022 г.
Методом комбинационного светорассеяния проведено исследование положения экстремумов, ам-
плитуд и ширин основных спектральных линий диапазона волновых чисел 3200-3600 см-1, обу-
словленных валентными OH-колебаниями в сетке водородных связей воды при изменении концен-
трации бычьего сывороточного альбумина в диапазоне 0.01-10 мг/мл. Сравнивали вариации этих
параметров для белка при наличии и в отсутствие жирных кислот, а также влияние наночастиц шун-
гитового углерода на эти вариации. Обнаружено, что стабильность системы водородных связей
воды существенно нелинейно зависит от концентрации белка, причем в диапазоне концентраций
0.1-0.3 мг/мл белка стабилизация максимальна и убывает как с ростом, так и уменьшением концен-
трации. Дестабилизация системы водородных связей с ростом концентрации белка может быть свя-
зана с его конформацией и/или агрегацией. Изменения зависят как от лигандного состояния бы-
чьего сывороточного альбумина (наличие жирных кислот), так и влияния наночастиц шунгитового
углерода. В присутствии наночастиц шунгитового углерода сетка водородных связей поддерживает-
ся в более однородном, но разрыхленном состоянии во всем диапазоне концентраций белка как с
жирными кислотами, так и без них. Полученные данные указывают на важную роль воды в меха-
низмах взаимодействия между молекулами белка, а также между графенами наночастиц шунгито-
вого углерода и поверхностью белка в области их центров связывания с жирными кислотами.
Ключевые слова: альбумин, жирная кислота, графены шунгитового углерода, комбинационное рассеяние
света, водородные связи.
DOI: 10.31857/S000630292205060060, EDN: LJWEII
сте с тем общие закономерности взаимодействия
Графены и оксиды графена являются перспек-
между водой, наночастицами и биомакромолеку-
тивным наноматериалом для биомедицинских
целей благодаря их уникальным свойствам - дву-
лами еще не вполне поняты. Так до конца не вы-
мерной структуре, большой поверхности, хими-
яснена роль конформации и лигандного состоя-
ческой и механической стабильности, специфи-
ния биополимера при формировании различных
ческим электронным свойствам и биосовмести-
биоконьюгатов. Но главное, пока не установлена
мости [1]. Это обеспечивает им потенциальную
возможная роль воды, физико-химическое состо-
возможность осуществлять транспортную функ-
яние которой может определять и регулировать
цию по доставке биопрепаратов, а также высту-
баланс сил в таких системах. Поэтому основной
пать в качестве биосенсоров, искусственных фер-
целью работы является установление возможной
ментов-пероксидаз [2, 3], центров гетерогенной
роли сетки водородных связей воды в механизме
нуклеации при кристаллизации белков [4]. Вме-
взаимодействия в системе «вода-наночастица-
биополимер» на примере дисперсии сывороточ-
Сокращения: ShC - графены шунгитового углерода, GO - ного альбумина быка в различном лигандном со-
оксид графена, БСА - бычий сывороточный альбумин,
ЖК - жирные кислоты, КРС - комбинационное рассея-
стоянии, а также в присутствии наночастиц шун-
ние света.
гитового углерода.
1093
1094
РОЖКОВ и др.
Базовые элементы шунгитового углерода
конечном итоге преобладало и стабилизировало
(ShC) относятся к числу графенов [5, 6]. Они
дисперсию GO.
представляют собой молекулы, близкие по свой-
Исследование биоконъюгатов наночастиц
ствам к восстановленному оксиду графена. Пред-
ShC с альбумином и его агрегатами проводилось
полагается, что такие элементы в докембрийский
нами ранее методами гель-фильтрационной хро-
период истории Земли агрегировали в наночасти-
матографии, дифференциальной сканирующей
цы и в составе гидротермальных флюидов образо-
калориметрии, электронного парамагнитного ре-
вывали залежи шунгитовых пород [7, 8]. В насто-
зонанса спиновых меток и спиновых зондов, ди-
ящее время разработаны технологии разделения
намического рассеяния света [15]. Основным эф-
этих пород на составляющие и получены устой-
фектом взаимодействия сывороточного альбуми-
чивые водные дисперсии углеродных наночастиц
на и наночастиц ShC в дисперсии является
[9]. Исследование эффектов и понимание меха-
увеличение разницы температур индивидуальных
низмов взаимодействий таких природных графе-
переходов термодинамических структурных до-
новых наночастиц с биологическими молекулами
менов белка. При этом наблюдаются различия в
представляют собой приоритетную цель в биоме-
характере взаимодействий структурных доменов
дицинском направлении при решении задач ре-
сывороточного альбумина с поверхностью нано-
гуляции связывания и транспорта лигандов бел-
частиц ShC. Получены убедительные экспери-
ками, окислительно-восстановительного баланса
ментальные доказательства, что взаимодействие
в системах с участием белков, структурно-дина-
наночастиц ShC с макромолекулами альбумина
мического состояния как самих макромолекул
наблюдается в основном в области их центров
белка, так и фазовых свойств их дисперсий [10,
связывания жирных кислот (ЖК) [16]. Данные,
11]. При этом наночастицы ShC в гораздо боль-
полученные методом электронного парамагнит-
шей степени удовлетворяют требованию стандар-
ного резонанса спинового зонда для модифици-
тизации физико-химических свойств углеродных
рованных спин-мечеными ЖК макромолекул сы-
наноматериалов при создании водно-дисперсных
вороточного альбумина и методом дифференци-
систем, чем получаемые разными способами ис-
альной сканирующей калориметрии по теплотам
кусственные углеродные наноматериалы, даже
плавления макромолекул в дисперсиях при раз-
после специальной очистки и функционализации
ном содержании наночастиц ShC, указывают на
последних [12].
различия в конформационном состоянии белка,
зависящие как от концентрации белка, так и на-
Сывороточный альбумин является одним из
ночастиц. При этом анализ распределения моле-
наиболее распространенных модельных объектов
при изучении молекулярных биологических эф-
кул белка и их агрегатов по размерам методом ди-
намического рассеяния света показал существен-
фектов углеродных наночастиц, что определяется
ное повышение однородности распределения под
его коммерческой доступностью и важнейшей
влиянием наночастиц ShC, которое мы объясня-
физиологической ролью в функционировании
ли ролью ShC в перераспределении ЖК между
различных тканей и сред организма животных и
человека. Ранее уже исследовалось [13] влияние
фракциями белка. Было высказано предположе-
ние, что формирование био-нано-границы между
химического состава раствора на адсорбцию сы-
БСА и наночастицами ShC способствует большей
вороточного альбумина человека на оксиде гра-
однородности границы связывания ЖК, умень-
фена (GO). Была установлена ключевая роль
шению фракций белка и активных центров на по-
электростатики в контроле взаимодействий «сы-
вороточный альбумин человека - оксид графе-
верхности белка, ответственных за супрамолеку-
лярную гетерогенность белка в растворе. В случае
на». При этом физическое состояние адсорбци-
наночастиц ShC это объясняется переходом ли-
онных белковых слоев было сопряжено с кон-
гандов (ЖК) с молекул сывороточного альбумина
формационным состоянием белка. В работе [14]
на наночастицы графеноподбного углерода с со-
получена информация о влиянии концентрации
бычьего сывороточного альбумина (БСА) на кол-
ответствующим изменением соотношения фрак-
ций сывороточного альбумина с различным со-
лоидную стабильность дисперсии GO в экологи-
держанием лигандов.
чески значимых условиях. Стабильность была
максимальной в диапазоне промежуточных кон-
При интерпретации всех полученных резуль-
центраций белка и обусловливалась разной сте-
татов явно или неявно подразумевалась важная
пенью его адсорбции. Низкая концентрация БСА
роль воды в реализации обнаруживаемых эффек-
снижала стабильность GO в основном за счет
тов. В то же время данные об изменении состоя-
электростатического связывания положительно
ния системы водородных связей в дисперсии, со-
заряженных лизиновых групп БСА и отрицатель-
провождающих изменения взаимодействия меж-
но заряженных групп GO, а также эффекта сжа-
ду компонентами дисперсии, отсутствовали.
тия двойного слоя. С увеличением концентрации
Поэтому конкретной задачей настоящей работы
БСА рост адсорбции БСА на GO приводил к
было исследование изменений конфигурации
сильному стерическому отталкиванию, которое в
сетки водородных связей в дисперсии БСА в
БИОФИЗИКА том 67
№ 6
2022
ВЗАИМОДЕЙСТВИЕ МОЛЕКУЛ СЫВОРОТОЧНОГО АЛЬБУМИНА
1095
сравнении с гибридной дисперсией БСА-ShC в
ные комбинационного рассеяния, такие как по-
условиях различия лигандного состояния белка
ложение пика, площадь полосы и ширина полосы
при взаимодействии с жирными кислотами. Для
(т.е. полная ширина на полувысоте), были опре-
этого предполагалось использовать метод комби-
делены с использованием программного обеспе-
национного рассеяния света (КРС) в частотной
чения OMNIC. Полосы в спектрах аппроксими-
области спектра 3000-3650 см-1, который харак-
рованы гауссовыми функциями. Асимметрию
линий учитывали в результате аппроксимации
теризует состояние системы водородных связей
спектров тремя гауссовыми функциями. Анали-
воды [17]. Изменения концентрации белка в ши-
зировали пики, полученные по вертикальным ли-
роком диапазоне от 0.01 до 10 мг/мл позволяют
ниям положения максимумов гауссианов.
охватить относительно большой диапазон моляр-
ного соотношения графен/белок (около 2000-
0.1).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследования свойств дисперсий наночастиц
МЕТОДЫ И МАТЕРИАЛЫ
ShC и их конденсатов показали, что они обладают
многоуровневой структурной организацией в во-
Cтабильные водные дисперсии наночастиц
де, возникающей в результате последовательных
ShC были получены по оригинальной методике
взаимодействий исходных структурных элемен-
[9]. Об их графеновой природе существуют экспе-
тов [18]. Графеновые фрагменты размерами до
риментальные и теоретические свидетельства
1 нм (около 0.4-0.7 нм), обладающие свойствами
[18]. Раствор БСА в дистиллированной воде с
восстановленного оксида графена, являются ми-
концентрацией от 0.02 до 20 мг/мл добавляли в
нимальным базовым элементом ShC. В полярных
дисперсию наночастиц ShC в дистиллированной
растворителях они образуют стопки в пять-шесть
воде (исходная концентрация наночастиц 0.07 и
слоев с суммарным дипольным моментом 6.5 Д и
0.14 мг/мл) в соотношении 1:1, тщательно пере-
представляют собой первый уровень структурной
мешивали и выдерживали не менее трех часов до
организации. Последующие уровни организации
съемки. Полученные смеси были однородны по
представлены глобулярными кластерами этих
цвету и сохраняли устойчивость во времени. Ис-
стопок и агрегатами. Водные дисперсии наноча-
пользовали коммерческие препараты альбумина
стиц ShC обладают широким спектром свойств,
фирмы Sigma (США) - как обезжиренный (БСА-
которые, с одной стороны, указывают на их пря-
обезжир), так и нативный, фракция V (БСА5фр),
мую связь со свойствами углерода шунгитовых
содержащая ЖК. Эта фракция содержит не более
пород, а с другой стороны, подобны свойствам,
1.5 моль ЖК на моль белка [19]. В ряде случаев
характерным для водных дисперсий таких кван-
применяли пальмитиновую кислоту для насыще-
товых точек, как наночастицы золота и серебра,
ния образцов сывороточного альбумина жирны-
CdS и CdSe, а также синтетических графеновых
ми кислотами.
квантовых точек [21]. Дипольный момент и по-
Взаимодействие наночастиц ShC с белковыми
лярные группы по дефектным краям могут при-
молекулами регистрировали по спектрам КРС с
давать поверхности наночастиц ShC гидрофиль-
использованием рамановского спектрометра
ные свойства, способствовать устойчивости кла-
Nicolet Almega XR (Thermo Scientific, США),
стеров из наночастиц в водной дисперсии и их
оснащенного лазером с длиной волны излучения
способности к интеркаляции воды внутри струк-
532 нм, со спектральным разрешением выше
тур [22].
1 см-1; мощность возбуждающего лазера на дан-
Спектроскопия КРС ранее использовалась как
ной длине волны составляла 15 мВт. Спектры ре-
один из методов, позволяющих охарактеризовать
гистрировали с 30-минутным накоплением. Дис-
структурную однородность и структурные уровни
персии помещали в кварцевую кювету, которую
наночастиц ShC в водной дисперсии и при кон-
устанавливали в отделении для макрообразцов
денсации дисперсии наночастиц ShC в диапазоне
перпендикулярно оси лазерного пучка. Темпера-
200-4000 см-1 [12]. Взаимодействие наночастиц
тура образца равнялась 22°С и под действием ла-
углерода с белковыми молекулами можно было
зера не менялась. Спектр КРС получали путем
бы регистрировать в спектрах КРС по изменению
возбуждения образца (дисперсии наночастиц)
интенсивности обычных для углерода полос ID,
при 532 нм с последующими измерениями часто-
IG в области 1300-1600 см-1 и сдвигу частот G-по-
ты и интенсивности рассеянного света. Наряду с
лосы [23]. Но в спектре КРС белка в растворе на-
регистрацией изменения интенсивности полос
ID, IG и сдвига частот G-полосы оценивали из-
блюдается широкий пик при 1573 см-1 с плечом
менения положения, интенсивности и ширины
1635 см-1, характерный для α-спирали белка, ко-
пиков КРС в области спектра 3000-3650 см-1, ко-
торый сам по себе располагается в области частот
торые характеризуют состояние системы водо-
D- и G-пиков углерода (рис. 1, спектр 1; рис. 2а,
родных связей воды [17, 20]. Спектральные дан-
спектр 1). При этом суммарный спектр БСА-ShC
БИОФИЗИКА том 67
№ 6
2022
1096
РОЖКОВ и др.
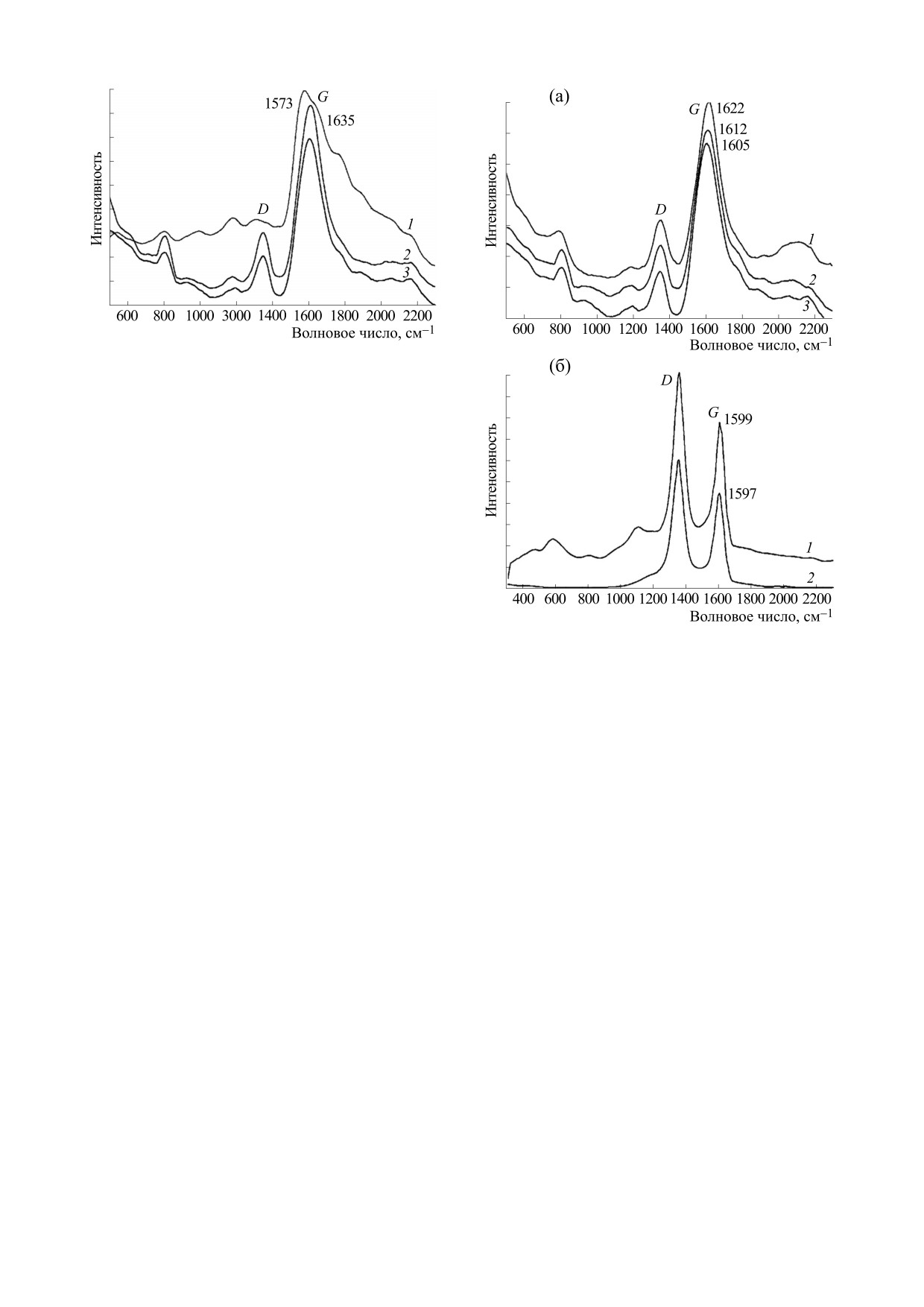
Рис. 1. Сравнение спектров КРС в дисперсиях БСА (1),
БСАобезжир + дисперсия наночастиц ShC (2) и БСА5фр
+ дисперсия наночастиц ShC (3).
в области G полосы характеризуется одним мак-
симумом, который смещается в сторону меньших
частот (1612, 1605 см-1) по сравнению с G-пиком
в дисперсии наночастиц графеноподобного ShC
(рис. 2а, спектр 1), но в сторону больших частот
по сравнению с положением максимума пика в
растворе белка. Положение максимума пика чув-
ствительно к лигандному состоянию БСА, опре-
деляемому взаимодействием с жирными кислота-
ми (рис. 2), однако закономерности этого взаи-
модействия остаются неясными. Значительный
сдвиг полосы свидетельствует о различном взаи-
Рис. 2. (а) - Сравнение спектров КРС дисперсий
модействии наночастицы ShC с БСА5фр и ShC с
наночастиц ShC
(1), БСАобезжир
+ дисперсия
БСАобезжир. Так, изменения частот 1622, 1605,
наночастиц ShC (2) и БСА5фр + дисперсия наночастиц
ShC (3). (б) - Сравнение спектров КРС конденсатов:
1612,
1635 см-1в ряду ShC, БСАобезжир-ShC,
БСАобезжир + дисперсия наночастиц ShC (1), дисперсия
БСА5фр-ShC могут быть сопряжены с интеркаля-
наночастиц ShC (2).
цией воды в графеновые слои наночастиц [8].
Более информативным относительно опосре-
позволяет оценить изменение ориентационной упо-
дованного растворителем взаимодействия между
рядоченности молекул воды, поскольку увеличение
молекулами белка и ShC, которое зависит от ли-
этого отношения коррелирует с уменьшением меж-
гандного состояния БСА-ЖК, оказывается ана-
молекулярного сопряжения OH-осцилляторов и
лиз спектров КРС в высокочастотной области
уменьшением ограничения подвижности молекул
спектра 3000-3650 см-1. Совокупность пиков в
воды.
этой области характеризуют состояние водород-
Вместе с тем под влиянием растворенных ве-
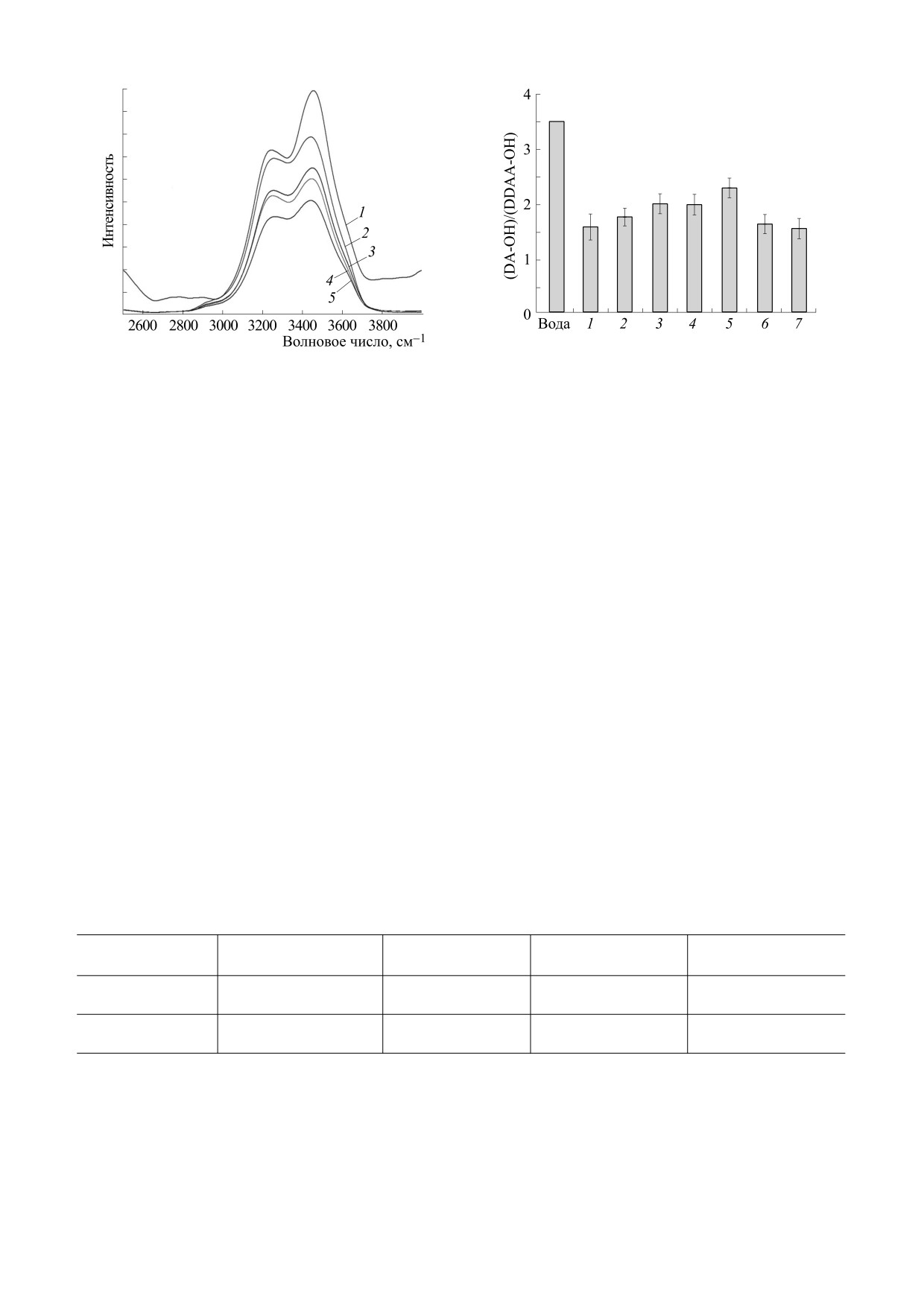
ных связей молекул воды (рис. 3).
ществ или изменения температуры значения ча-
Несмотря на то что деконволюция спектра воды
стот могут изменяться [20]. Так, в присутствии
в этой области позволяет выделить пять характери-
гидратированных тканей биологического проис-
стических частот, наиболее интенсивными являют-
хождения и биомакромолекул положения пиков
ся две частоты 3230 и 3440 см-1 которым соответ-
смещаются в область 3450 и 3250 см-1 [24, 25]. В
ствуют 90% состояния воды [17, 20] (рис. 3). Первая
наших образцах также наблюдались сдвиги мак-
характеризует симметричную моду валентных
симумов интенсивности (DA-OH) и (DDAA-OH)
ОН-колебаний в сетке связей молекул воды в состо-
(табл. 1).
янии «два донора-два акцептора» (DDAA-OH), а
На диаграмме (рис. 4) приведены усредненные
вторая - ассиметричную моду воды в состоянии
значения отношения d с учетом ширины пиков l
«донор-акцептор» (DA-OH). Отношение интен-
на половине высоты: d = I1 l 1/I2 l 2, полученные в
сивностей (I) пиков d = I(3440 см-1)/I(3230 см-1)
разных сериях экспериментов: для воды, для дис-
БИОФИЗИКА том 67
№ 6
2022
ВЗАИМОДЕЙСТВИЕ МОЛЕКУЛ СЫВОРОТОЧНОГО АЛЬБУМИНА
1097
Рис. 4. Диаграмма, характеризующая диапазоны изме-
Рис. 3. Сравнение спектров КРС дисперсий БСА+ShC
нений усредненной по ряду измерений величины отно-
при разных отношениях концентраций компонентов и
шения интенсивности пиков d = (DA-OH)/(DDAA-
различном лигандном состоянии белка: 1 - БСА5фр,
OH) спектров КРС в диапазоне 3200-3600 см-1 по раз-
1мг/мл;
2 - БСАобезжир, 0.025 мг/мл + 0.07 мг/мл
ным образцам дисперсий ShC в концентрациях 0.07-
ShC; 3 - БСА5фр, 0.025 мг/мл + 0.07 мг/мл ShC; 4
-
0.14 мг/мл) (1); ShC (0.14 мг/мл) в присутствии ЖК
БСАобезжир, 0.05 мг/мл + 0.07 мг/мл ShC; 5 - БСА5фр,
пальмитиновой кислоты в отношении 1-10 моль ЖК на
0.05 мг/мл + 0.07 мг/мл ShC.
моль ShC (2); БСА5фр (5 мг/мл) (3) и БСА в присутствии
пальмитиновой кислоты в отношении (1-10) ЖК на
молекулу БСА (4); дисперсий БСА в присутствии нано-
частиц ShC в концентрации
0.07 мг/мл
(5-7):
персий ShC в концентрации 0.07-0.14 мг/мл, для
(БСА5фр 0.1 мг/мл+ShC) (5); БСА5фр 0.05 мг/мл + S h C
дисперсий ShC (0.14 мг/мл) в присутствии разных
( 6); БСАобезжир 0.025 мг/мл + ShC (7).
концентраций ЖК, для БСА5фр (5 мг/мл) и
БСА5фр (5 мг/мл) в присутствии от 1 до 10 моле-
кул пальмитиновой ЖК на молекулу белка, для
движности воды, возможно, вследствие ее высво-
гибридных наночастиц ShC с нативным БСА5фр и
бождения из областей связывания с ЖК. При
обезжиренным БСАобезжир при разных концен-
этом нет заметной зависимости от концентрации
пальмитиновой кислоты. При умеренных кон-
трациях белка, ЖК и ShC. Если в качестве отно-
шения брать только амплитуды спектров или
центрациях молекул белка (5 мг/мл) их взаимо-
только полную площадь спектров, получаемую в
действие с ЖК не влияет на состояние молекул
процессе деконволюции сигналов, то абсолютная
воды, поскольку взаимодействие в основном
величина отношения при этом изменяется, но
происходит в неполярных полостях белка и при
полученные тенденции к изменению сохраняют-
этом высвобождается мало воды. При добавле-
ся во всех случаях.
нии в эту систему 0.14 мг/мл ShC подвижность
молекул воды увеличивается (величина d растет),
В терминах ограничения подвижности моле-
возможно, вследствие взаимодействия ShC с по-
кул воды на основе данных рис. 4 можно сделать
вывод, что в дисперсиях ShC (значение d мало)
верхностью белка с высвобождением связанной
подвижность молекул воды заметно уменьшается
воды. При большом молярном отношении
(водородные связи укрепляются). Взаимодей-
ShC/белок ~ 1000 (два последних столбца на
ствие ShC с ЖК стимулирует слабый рост по-
рис. 4) подвижность молекул воды уменьшается
Таблица 1. Положение пиков спектров КРС дисперсий БСА в диапазоне 3200-3600 см-1
БСА5фр
БСАобезжир
БСА5фр-ShC
БСАобезжир-ShC
DDAA-OH
3235 ± 3
3226 ± 2
3231 ± 1
3230 ± 3
DA-OH
3445 ± 4
3434 ± 3
3445 ± 2
3440 ± 4
Примечание. Лигандное состояние дисперсий БСА: с ЖК (БСА5фр) и без ЖК (БСАобезжир), а также в присутствии
наночастиц шунгитового углерода (ShC). Положение пиков спектров усреднено для концентраций белка от 0.01 до 10 мг/
мл; концентрация наночастиц шунгитового углерода (ShC) - 0.07 мг/мл.
БИОФИЗИКА том 67
№ 6
2022
1098
РОЖКОВ и др.
(величина d мала) и в основном, видимо, опреде-
ляется ее взаимодействием с ShC (табл. 1).
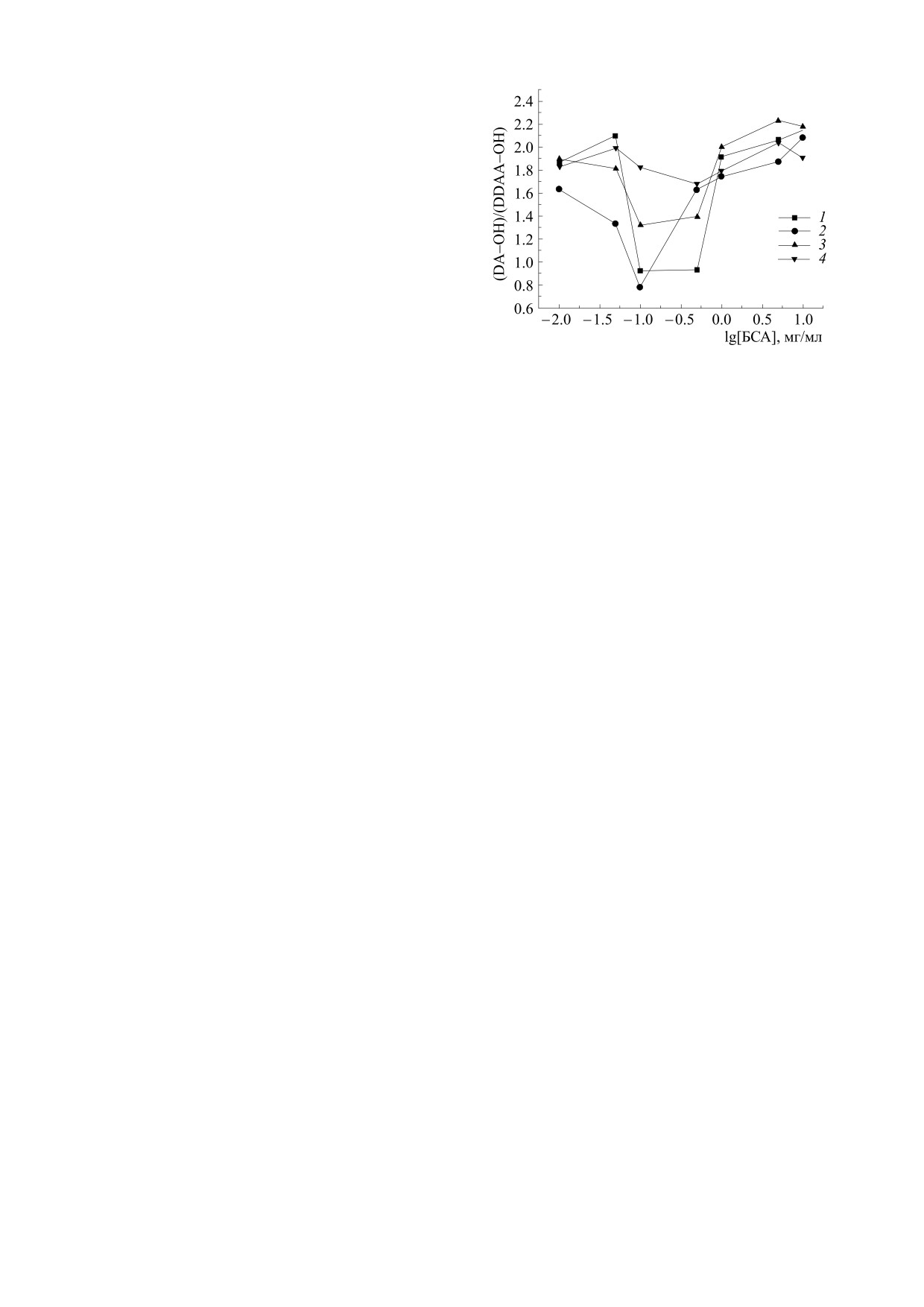
На рис. 5 показаны величины отношения ин-
тенсивностей пиков спектров КРС d = (DA-OH)/
(DDAA-OH) в зависимости от концентрации бел-
ка в диапазоне 0.01-10 мг/мл. Обращают на себя
внимание их относительно резкие и систематиче-
ские изменения в диапазоне концентраций 0.1-
0.3 мг/мл белка и возвращение к исходному со-
стоянию с дальнейшим увеличением концентра-
ции белка. Изменения зависят как от лигандного
состояния БСА (наличие ЖК), так и влияния
ShC. Так, в присутствии ShC скачок меньше, а в
системе БСА+ЖК+ShC отклонения во всем диа-
пазоне концентраций белка практически отсут-
ствуют. При этом уменьшение отношения
Рис. 5. Изменение отношения интенсивностей пиков
(DA-OH)/(DDAA-OH) указывает на упрочнение
спектров КРС в диапазоне 3200-3600 см-1 (DA-
водородных связей, а увеличение - на их ослаб-
OH)/(DDAA-OH) дисперсий БСА при концентрации
ление. Подобные скачки отношения интенсив-
белка от 0.01 до 10 мг/мл в различном лигандном состо-
ности пиков в системе «вода-этанол» в зависи-
янии: БСА5фр (1) и БСАобезжир (2), а также это измене-
ние в присутствии наночастиц шунгитового углерода в
мости от концентрации последнего связывались с
концентрации
0.07 мг/мл.: БСАобезжир-ShC
(3),
упрочнением связей в системе в связи с образова-
БСА5фр-ShC (4). Относительная ошибка определения
нием водных клатратов вокруг неполярных групп
отношения не превышала 10%.
спирта [26]. В нашем случае первоначальное
упрочнение связей с ростом концентрации белка
может быть связано с влиянием неполярных
неполярных областей белка для воды и формиро-
групп белка на систему связей воды, которое за-
вания там гидратации полуклатратного типа.
тем уменьшается вследствие стабилизации на-
тивной конформации, агрегации и/или олигоме-
Таким образом, резкое изменение отношения
ризации молекул белка через взаимодействие и
интенсивностей (DA-OH)/(DDAA-OH) на рис. 5
экранирование неполярных групп. Как известно,
в определенном диапазоне концентраций белка
может быть интерпретировано как немонотон-
сывороточные альбумины склонны к олигомери-
ный характер изменения состояния всей системы
зации, в которой может участвовать до 20% белка
[27]. Если белки не содержат лиганды, взаимо-
водородных связей воды в дисперсии, сопряжен-
ного с состоянием конформации или ассоциации
действующие с ними по неполярным полостям,
белковых макромолекул. Это явление напомина-
то стабилизация наблюдается при меньших кон-
ет микрорасслаивание неэлектролита на про-
центрациях белка как на рис. 5 (образец 2). В при-
странственной сетке водородных связей воды,
сутствии ShC, графены которого также взаимо-
при котором упругость сетки выталкивает моле-
действуют с белком по неполярным полостям,
кулы неэлектролита к ее дефектам [28]. В местах
стабилизация сетки водородных связей воды не
дефектов молекулы неэлектролита объединяются
наблюдается, что особенно заметно в системе
так, чтобы их гидрофобные части имели наи-
БСА5фр+ ShC.
меньший контакт с водой. С дальнейшим ростом
В табл. 1 приведены усредненные положения
концентрации неэлектролита существующая сет-
ка Н-связей разрушается и вместе с этим прекра-
пиков спектров КРС в диапазоне 3200-3600 см-1,
щается процесс расслаивания.
соответствующих валентным ОН-колебаниям в
сетке водородных связей воды (DDAA-OH) и
Немонотонный характер температурных изме-
(DA-OH). Их изменения в зависимости от ли-
нений конформации белков в предденатурацион-
гандного состояния белка и взаимодействия с
ной области температур также наблюдали в их
ShC могут свидетельствовать об индуцированном
растворах методом ИК спектроскопии на полосе
изменении сетки водородных связей воды во всей
поглощения Амид I [29]. Было установлено, что
системе. При этом сдвиг в низкочастотную об-
по мере роста температуры в растворе БСА снача-
ласть указывает на «замораживание» колебаний,
ла система водородных связей воды разрыхляет-
как это наблюдается при понижении температу-
ся, достигает некоторого предела, а затем начина-
ры [20]. Более низкие значения волновых чисел в
ет перестраиваться и связи восстанавливаются.
образцах обезжиренного БСА могут указывать на
Таких скачков наблюдается два, при 25 и 43°С.
более прочную сетку водородных связей в такой
Это может быть сопряжено с изменением кон-
системе, возможно, из-за большей доступности
формации белка и сопровождаться изменением
БИОФИЗИКА том 67
№ 6
2022
ВЗАИМОДЕЙСТВИЕ МОЛЕКУЛ СЫВОРОТОЧНОГО АЛЬБУМИНА
1099
взаимодействия между молекулами белков и их
ФИНАНСИРОВАНИЕ РАБОТЫ
разделением на фракции. Не исключено, что
Исследование выполнено в рамках Государ-
фракции белка могут возникать из-за неравно-
ственного заказа (проекты № FMEN-2022-0006 и
мерного распределения ЖК по центрам сорбции.
№ АААА-А18-118020690131-4).
В этом случае в присутствии ShC происходит мо-
дификация центров, способствующая более од-
КОНФЛИКТ ИНТЕРЕСОВ
нородному распределению ЖК по центрам свя-
зывания. Это ведет к уменьшению числа различ-
Авторы заявляют об отсутствии конфликта
интересов.
ных фракций белка, ответственных за
гетерогенность белка в растворе.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Настоящая статья не содержит каких-либо ис-
ЗАКЛЮЧЕНИЕ
следований с участием людей или животных в ка-
честве объектов исследований.
Исследование изменений конфигурации сет-
ки водородных связей воды в гибридной диспер-
сии БСА-ShC в сравнении с дисперсией БСА в
СПИСОК ЛИТЕРАТУРЫ
условиях изменения лигандного состояния белка
1.
J. Liu, L. Cui, and D. Losic, Acta Biomater., 9, 9243
при взаимодействии с жирными кислотами пока-
(2013).
зало, что конформационное состояние альбуми-
2.
Y. Ni, F. Zhanga, and S. Kokot, Anal. Chim. Acta, 769,
40 (2013).
на определяет состояние водородных связей во-
3.
H. Sun, A. Zhao, N. Gao, et al., Angew Chem. Int.
ды. Конформация альбумина зависит от его кон-
Ed., 54 (24), 7176 (2015).
центрации, способности к адсорбции жирных
4.
B. S. Gully, J. Zou, G. Cadby, et al., Nanoscale, 4, 5321
кислот и взаимодействию с наночастицами ShC,
(2012).
которое происходит в первую очередь по центрам
5.
N. N. Rozhkova, A. V. Gribanov, and M. A. Khodor-
связывания ЖК. Обезжиренный белок в большей
kovskii, Diamond and related materials. 16,
2104
степени стабилизирует сетку водородных связей
(2007).
6.
E. F. Sheka and N. A. Popova, Phys. Chem. Chem.
воды вследствие большей доступности неполяр-
Phys., 15, 13304 (2013).
ных участков для воды, но, вероятно, из-за этого
7.
E. F. Sheka, N. N. Rozhkova, K. Holderna-Natkaniec,
имеет большую склонность к агрегации из-за
and I. Natkaniec, Nanosystems: Physics, chemistry,
уменьшения растворимости. С ростом концен-
mathematics, 5 (5), 659 (2014).
трации белка вследствие агрегации или стабили-
8.
E. F. Sheka and N. N. Rozhkova, Int. J. Smart Nano
зации нативного состояния экспонирование гид-
Mat., № 5, 1 (2014).
рофобных областей уменьшается, и сетка связей
9.
Н. Н. Рожкова и С. С. Рожков, Патент РФ
№ 2448899 (2012).
воды разрыхляется. Под влиянием наночастиц
10.
S. P. Rozhkov and A. S. Goryunov, Russ. J. Gen.
ShC происходит перераспределение ЖК по цен-
Chem. 83 (13), 2585 (2013).
трам сорбции и ведет к повышению однородно-
11.
С. П. Рожков и А. С. Горюнов, Труды КарНЦ РАН.
сти распределения активных центров на поверх-
Сер. Эксперим. биология, №12, 38 (2018).
ности белка. При этом сетка водородных связей
12.
N. N. Rozhkova, Russ. J. Gen. Chem. 83 (13), 2676
изначально поддерживается в более рыхлом и од-
(2013).
нородном состоянии при вариациях концентра-
13.
X. Liu, C. Yan, and K. L. Chen, Environ. Sci. Technol.,
ции компонент. Это сопряжено с минимизацией
53 (15), 8631 (2019).
фракционности белка и гетерогенности его су-
14.
B. Sun, Y. Zhang, W. Chen, et al., Environ. Sci. Tech-
прамолекулярной организации в дисперсии.
nol., 52 (13), 7212 (2018).
Проведенные исследования подтверждают обна-
15.
С. П. Рожков, А. С. Горюнов, Труды КарНЦ РАН.
руженную ранее многофункциональность нано-
Сер. Эксперим. биология, № 5, 33 (2017).
частиц ShC в дисперсии, выполняющих функции
16.
A. Goryunov, S. Rozhkov, and N. Rozhkova, Eur. Bio-
гомогенизаторов и модификаторов белков, а так-
phys. J., 49, 85 (2020).
же возможных регуляторов транспорта и взаимо-
17.
L. E. Masson, C. M. O’Brien, I. J. Pence, et al., Ana-
действия жирных кислот с белками.
lyst, 143, 6049 (2018).
18.
N. N. Rozhkova, S. P. Rozhkov, and A. S. Goryunov,
In Carbon nanomaterials sourcebook. Graphene, Ed. by
БЛАГОДАРНОСТИ
K. D. Slatter (CRC Press, Boca Raton, London, New
York, 2016), Vol. 1, pp. 151-174.
Экспериментальные данные получены на обо-
19.
A. Michnik, K. Michalik, and Z. Drzazga, J. Thermal
рудовании ЦКП ФИЦ КарНЦ РАН
Anal. Calorim., 80, 399 (2005).
БИОФИЗИКА том 67
№ 6
2022
1100
РОЖКОВ и др.
20. S. M. Baschenko and L. S. Marchenko, Semiconductor
24. Y. Maeda and H. Kitano, Spectrochim. Acta. Part A,
Physics, Quantum Electronics & Optoelectronics, 14
51, 2433 (1995).
(1), 77 (2011).
25. M. Unal and O. Akkus, J. Biomed. Opt., 23 (1), 015008
(2018).
21. Б. С. Разбирин, Н. Н. Рожкова, Е. Ф. Шека и др.,
26. S. Burikov, S. Dolenko, T. Dolenko, et al., Mol. Phys-
Журн. эксперим. и теорет. физики, 145 (5), 838
ics, 108 (6), 739 (2010).
(2014).
27. G. D. Fullerton, K. M. Kanal, and I. L. Cameron, Cell
Biol. Intern., 30, 86 (2006).
22. Y. Xu, T. Watermann, H.-H. Limbach, et al., Phys.
28. И. А. Чабан, М. Н. Родникова и В. В. Жакова, Био-
Chem. Chem. Phys., 16, 9327 (2014).
физика, 41 (2), 293 (1996).
23. A. C. Ferrari and J. Robertson, Phil. Trans. R. Soc.,
29. А. П. Жуковский, Н. В. Ровнов и А. И. Халоимов,
362, 2477 (2004).
Биофизика, 29, 586 (1984).
Interaction between Serum Albumin Molecules, Fatty Acids and Graphenes of Shungite
Carbon Nanoparticles in Aqueous Dispersion Based on Raman Spectroscopic Analysis
of Water in the High Wavenumber Region
S.P. Rozhkov *, A.S. Goryunov*, V.A. Kolodey**, L.A. Pron’kina**, and N.N. Rozhkova**
*Institute of Biology, Karelian Research Centre of the Russian Academy of Sciences,
Pushkinskaya ul. 11, Petrozavodsk, 185910 Russia
**Institute of Geology, Karelian Research Centre of the Russian Academy of Sciences,
Pushkinskaya ul. 11, Petrozavodsk, 185910 Russia
The Raman spectroscopy method was used to analyze the positions of extrema, amplitudes, and widths of the
main Raman spectral lines in the wavenumber range 3200-3600 cm-1 attributed to the hydrogen bonded
complex upon addition of bovine serum albumin with a concentration of 0.01-0.10 mg/ml. The values ob-
tained for these parameters in the presence and absence of fatty acids within the said protein concentration
range were compared and the effects of shungite carbon nanoparticles on these variations were studied. The
stability of the hydrogen bonded complex in water is found to depend significantly nonlinearly on the protein
concentration: the stability was maximum in the protein concentration range of 0.1-0.3 mg/mL and became
less both with an increase and decrease of the protein concentration. The destabilization of water hydrogen
bonds with increasing protein concentration may be associated with its conformation and/or aggregation.
Changes depend both on a ligand state of bovine serum albumin (presence of fatty acids) and on the effects
of shungite carbon. In the presence of nanoparticles of shungite carbon, the hydrogen bonded complex is
maintained in a more uniform but loosened state over the entire range of protein concentrations, with and
without fatty acids. The data obtained indicate that water plays an important role in the mechanisms of inter-
action between protein molecules, as well as between shungite carbon graphenes and the protein surface in
the fatty acid binding sites.
Keywords: albumin, fatty acid, schungite carbon graphenes, Raman scattering, hydrogen bonds
БИОФИЗИКА том 67
№ 6
2022