БИОФИЗИКА, 2022, том 67, № 6, с. 1122-1130
БИОФИЗИКА КЛЕТКИ
УДК 577.355.2
ДИМЕРИЗАЦИЯ СВОБОДНОГО И АССОЦИИРОВАННОГО
С МЕМБРАНАМИ ФОТОСИСТЕМЫ II БЕЛКА PsbO
ПРИ ОБЛУЧЕНИИ УФ-СВЕТОМ
© 2022 г. М.С. Христин*, Т.Н. Смолова*, А.А Хоробрых*, #
*Институт фундаментальных проблем биологии РАН - обособленное подразделение ФИЦ «Пущинский научный
центр биологических исследований РАН», Институтская ул., 2, Пущино Московской области,142290, Россия
#E-mail: andrewkhor@rambler.ru
Поступила в редакцию 24.08.2022 г.
После доработки 16.09.2022 г.
Принята к публикации 20.09.2022 г.
Основной функцией белка PsbO в ФСII является стабилизация Mn4CaO5-кластера водоокисляю-
щего комплекса. В работе впервые показано, что кратковременное воздействие УФ-света как на
изолированный, так и на мембранносвязанный белок PsbO приводит к его димеризации. Некова-
лентный димер белка PsbO обнаруживался с помощью гель-фильтрации. Разделение с помощью
электрофореза в полиакриламидном геле белков мембран ФСII, освещенных УФ-светом, свиде-
тельствовало об образовании ковалентного димера PsbO, как и в случае изолированного белка PsbO.
Образование ковалентного димера PsbO под действием УФ-излучения подтверждает предположе-
ние о существовании in vivo нековалентного димера PsbO, который может играть стабилизирующую
роль в ФСII.
Ключевые слова: УФ-свет, мембраны ФСII, белок PsbO, димеризация, дисульфидная связь, дитирозино-
вая связь, электростатическая связь.
DOI: 10.31857/S0006302922060096, EDN: LKETDZ
Фотосистема II (ФСII) представляет собой
электронов для P680+•. В результате последова-
пигментно-белковый комплекс, локализованный
тельного разделения зарядов в РЦ ФСII форми-
в тилакоидной мембране. Основная функция
руются промежуточные S-состояния Mn4CaO5-
ФСII — фотоокисление воды и передача электро-
кластера (S0, S1, S2, S3 and S4). Переход от S4 к S0
нов от воды в фотосинтетическую электрон-
сопровождается окислением двух молекул воды и
транспортную цепь. ФСII можно условно разде-
выделением О2.
лить на реакционный центр (РЦ), состоящий из
белков D1 и D2, на которых располагаются ко-
Mn4CaO5-кластер окружен внешними белка-
факторы переноса электронов; водоокисляющий
ми, которые защищают его от экзогенных восста-
комплекс (ВОК), имеющий каталитический
новителей и служат для оптимизации выделения
центр - Mn4CaO5-кластер, и внутренние (СР43 и
кислорода. Эти белки включают марганец-стаби-
СР47) и внешние светособирающие комплексы,
лизирующий белок (PsbO), который обнаружива-
окружающие РЦ. Реакционный центр преобразу-
ется во всех оксигенных организмах, белки PsbP и
ет энергию возбужденного хлорофилла в энергию
PsbQ, характерные для высших растений и зеле-
ных водорослей, в то время как цианобактерии
разделенных зарядов ([P680+• Фео-•]) с образо-
содержат PsbU и PsbV [3, 4]. В последнее время
ванием сильного окислителя P680+• с окисли-
установлена роль Asp158 белка PsbO в его связы-
тельно-восстановительным потенциалом
1.10-
вании с ФСII и ее активностью [5], а также необ-
1.27 В [1, 2]. P680+• окисляет Mn4CaO5 кластер
ходимость в белке PsbJ для активности ФСII у му-
через редокс-активный тирозиновый остаток
тантов Thermosynechococcus vulcanus, обедненных
белка Д1 (TyrZ), который действует как донор
люменальными белками PsbO и PsbV [6].
Марганец-стабилизирующий белок PsbO
Сокращения: ФСII - фотосистема II, РЦ - реакционный прочно связывается с белками мембран ФСII с
центр, ВОК - водоокисляющий комплекс, PsbO - марга-
люменальной стороны [3] на расстоянии 17 Å от
нец-стабилизирующий белок, ПААГ - полиакриламид-
ный гель, ДТТ - дитиотреитол.
Mn4CaO5-кластера ВОК [7]. Мутанты Synechocys-
1122
ДИМЕРИЗАЦИЯ СВОБОДНОГО И АССОЦИИРОВАННОГО С МЕМБРАНАМИ
1123
tis sp. PCC 6803, лишенные белка PsbO, показыва-
[19], а также белком-рецептором УФ-света UVR 8
ют низкую скорость фотосинтетического выделе-
[20]. УФ-свет вызывает образование синглетного
ния кислорода в сравнении с диким типом. При
кислорода, гидроксильных радикалов в мембра-
высокой интенсивности света эти мутанты быст-
нах тилакоидов [21]. Нами показано, что в препа-
ро утрачивают способность выделять кислород
ратах РЦ ФСII УФ-свет индуцирует выцветание
[8], что свидетельствует о защитной роли белка
хлорофилла а, феофитина, каротиноида, а также
PsbO при функционировании ФСII в условиях
изменяет структуру белков, ковалентно сшивает
фотоокислительного стресса. Отмытые от внеш-
гетеродимер D1-D2 [22]. В результате этих и, воз-
них белков фрагменты мембран ФСII утрачивают
можно, других, еще неизученных механизмов, за-
фотосинтетическую активность, а при инкубации
пускаемых УФ-светом, ингибируется ФСII.
с белками, прежде всего с препаратами PsbO, вос-
Нельзя исключить поглощение света диапазона
станавливают ее [9]. Блокирование генов двух
УФ-В белком PsbO и, как следствие, образование
изоформ белка PsbO1 и PsbO2 в Arabidopsis thali-
фотомодифицированных форм белка. Это может
ana приводит к снижению фотосинтетической
влиять на структурно-функциональные свойства
активности и обнаружению мономера ФСII при
белка и регулировать фотосинтетическую актив-
электрофорезе в полиакриламидном геле [10].
ность растений.
Рассматривается также участие белка PsbO в по-
Настоящая работа посвящена исследованию
ступлении воды к Mn4CaO5-кластеру и отводе
индуцированной УФ-светом димеризации как
протонов, образующихся при разложении воды,
свободного, так и связанного с мембранами ФСII
из активного центра ВОК в люмен [3, 11-13]. Бы-
белка PsbO.
ло установлено, что в отводе протонов принима-
ют участие карбоксилатные группы глутамата и
аспартата, расположенные на поверхности β-ци-
МАТЕРИАЛЫ И МЕТОДЫ
линдра белка PsbO [14]. Механизм передачи про-
Кислород-выделяющие мембраны ФСII полу-
тонов включает релеподобную регуляцию, син-
чали из хлоропластов гороха и шпината по мето-
хронно связанную с конформационными изме-
ду, описанному в работе [23]. Белок PsbO был вы-
нениями белка [15].
делен по методу, описанному в работе [24].
Установлено, что на одну ФСII приходится две
Выделенный белок PsbO и мембраны ФСII
молекулы белка PsbO [16]. Связывание двух моле-
освещали ртутно-кварцевой лампой ОКН-11,
кул белка с одним реакционным центром ФСII
950 Вт, (максимумы основных полос излучения
увеличивает скорость выделения кислорода [11].
паров ртути 253.65 и 435.8 нм), расположенной на
Доказательство участия нековалентного димера
расстоянии 150 мм от чашки Петри, в которую на-
белка PsbO в стабилизации ФСII in vivo основано
ливали раствор образца слоем толщиной в 2-
на анализе энергетических и электростатических
3 мм. Чашку помещали на лед и дополнительно
взаимодействий между двумя молекулами белка
охлаждали поверхность растворов с помощью
[14], а также электронно-микроскопических
вентилятора. Такие условия исключали нагрев
изображений ФСII в мембранах тилакоидов [17].
образца во время УФ-облучения. В отдельных
опытах использовали интерференционные филь-
Экспериментально обнаружить димер белка
тры на 260 и 296 нм с полушириной полос в
PsbO в мембранных фрагментах, обогащенных
спектре пропускания 10 нм.
комплексами ФСII (мембраны ФСII) возможно с
помощью химических сшивок, например, карбо-
Флуоресценцию белка до и после облучения
диимидом, который ранее был успешно исполь-
регистрировали с помощью спектрофлуориметра
зован для сшивки PsbO с CP47 [18]. Однако хими-
Hitachi-850 (Япония).
ческий метод сшивок не подтверждает наличие
Электрофорез в полиакриламидном геле
димера белка PsbO в ФСII. Вероятно, условия для
(ПААГ) проводили в денатурирующих условиях в
обратимой димеризации белка PsbO в растворе и
градиенте акриламида (12-18%) при комнатной
в мембранах ФСII значительно отличаются. Та-
температуре. Образцы белковых фракций после
ким образом, вопрос о наличии димера белка Ps-
гель-хроматографии осаждали трихлоруксусной
bO в мембранах ФСII нельзя считать окончатель-
кислотой (10%), отмывали ацетоном, центрифуги-
но решенным. Представляется, что использова-
ровали и высушивали. Осадок белка растворяли в
ние УФ-света для сшивки димера белка PsbO
трис-HCl-буфере (pH 6.8), содержащем 10% саха-
позволит получить новые данные о его возмож-
розы, 8 М мочевины, 3% додецилсульфата натрия,
ном участии в стабилизации ФСII.
0.005% бромфенолового синего, 1% 2-меркапто-
этанола или 5 мМ дитиотреитола (ДТТ).
УФ-свет, являясь составным компонентом
спектра солнечного света, оказывает на растения
Гель-фильтрацию белка PsbO проводили на
как положительное, так и повреждающее дей-
колонке Superdex-75 10/300 (GE Healthcare, Шве-
ствие. Известно, что свет диапазона УФ-В погло-
ция) с использованием жидкостного хроматогра-
щается белком psb33, ассоциированным с ВОК
фа АКТА FPLC (Amersham Biociences, Швеция).
БИОФИЗИКА том 67
№ 6
2022
1124
ХРИСТИН и др.
Рис. 1. Профиль гель-фильтрации белка PsbO из шпината на колонке Superdex-75. На врезке - электрофореграммы
фракции I без (дорожка 1) и с 5 мМ ДТТ (дорожка 2), фракции II (дорожка 3), фракции III без (дорожка 4) и с 5 мМ
ДТТ (дорожка 5). Штрихами слева обозначены белковые маркеры с молекулярными массами 116.0, 66.2, 45.0, 35.0,
25.0, 18.4, 14.4 кДа; звездочками отмечены димер и мономер фракции I + 5 мМ ДТТ.
Белок PsbO, растворенный в среде А (50 мМ
сивности полосы (т.е. концентрации белка) в зо-
HEPES-NaOH, pH 7.0, 35 мМ NaCl) наносили на
не 33 кДа, соответствующей относительной моле-
колонку Superdex-75
10/300, уравновешенную
кулярной массе белка PsbO, и уменьшению ин-
средой А и элюировали средой А при скорости
тенсивности в зоне, соответствующей его димеру
потока 0.5 мл/мин.
(рис. 1, дорожка 2). Этот факт может свидетель-
ствовать о том, что в геле часть димера белка PsbO
содержит дисульфидную связь, а часть димера, не
РЕЗУЛЬТАТЫ
прореагировавшая с ДТТ, вероятно, имеет другой
На рис. 1 представлены результаты разделения
тип ковалентной связи, предположительно дити-
белка PsbO из шпината на колонке Superdex
розиновый мостик между двумя молекулами мо-
10/300 и электрофореза в ПААГ трех (I-III) его
номера. Он может образоваться при окислитель-
фракций. В первой фракции содержится белок с
ных реакциях, катализируемых ионами металлов
молекулярной массой около 70 кДa, согласно ка-
и УФ-светом [26].
либровке колонки по стандартам молекулярных
Как показано на рис. 2, освещение раствора
масс, приложенным фирмой-производителем.
белка PsbO УФ-светом в течении 5 мин приводит
Результаты разделения фракций I-III с помощью
к снижению интенсивности флуоресценции при
электрофореза в ПААГ (рис.1, врезка) показали,
310 нм при возбуждении светом 280 нм, а также
что фракция I содержит две близкие белковые зо-
смещению спектра флуоресценции в длинновол-
ны, незначительно отличающиеся по подвижно-
новую область, что характерно для денатуриро-
сти. Относительная молекулярная масса этих
ванного белка PsbO, когда единственный остаток
зон соответствует димеру белка PsbO (рис. 1, до-
триптофана (Трп) становится доступным для све-
рожки 1 и 2). Во фракциях II и III содержатся мо-
та. Для белка PsbO известна особенность флуо-
номер и димер белка PsbO (рис. 1, дорожки 3-5).
ресценции единственного остатка Трп [27]. Мак-
Также следует отметить, что мономер белка PsbO
симальная эмиссия флуоресценции приходится
разделяется на две фракции, одна из которых со-
примерно на 317 нм, что указывает на сильно гид-
держит дисульфидную связь и представляет окис-
рофобное окружение этого остатка в молекуле
ленный мономер PsbO, другая - мономер с вос-
белка PsbO. Освещение светом 295 нм возбуждает
становленной дисульфидной внутрибелковой
только остаток Трп, а светом 280 нм - и этот оста-
связью, т.е. вместо дисульфида содержит две
ток, и остатки восьми остатков тирозина (Тир).
сульфгидрильные группы [25].
Инкубация белка фракции I с 5 мМ ДТТ перед
Освещение УФ-светом и разделение электро-
электрофорезом приводила к увеличению интен- форезом в ПААГ показывают также образование
БИОФИЗИКА том 67
№ 6
2022
ДИМЕРИЗАЦИЯ СВОБОДНОГО И АССОЦИИРОВАННОГО С МЕМБРАНАМИ
1125
Рис. 2. Спектры флуоресценции (Еx = 280 нм) белка PsbO из гороха до (спектр 1) и после (спектр 2) пятиминутного
облучения УФ-светом. На врезке - электрофореграммы исходного белка (дорожка 2), после облучения УФ-светом в
течение 1 мин (дорожка 3), 2 мин (дорожка 4) и 5 мин (дорожка 5); дорожка 1 - белковые маркеры с молекулярными
массами 116.0, 66.2, 45.0, 35.0, 25.0, 18.4, 14.4 кДа. Освещение образца проводили светом интенсивностью 54.3 мкмоль
фотонов·м-2с-1 с помощью ртутно-кварцевой лампы (ОКН-11).
димера PsbO (рис. 2, дорожки 3-5). Связь между
фильтров, а также расстояние от УФ-лампы до по-
двумя молекулами белка формируется в результа-
верхности освещаемых препаратов были одинако-
те фотохимического образования радикала Тир,
выми, выявленное различие (заметное увеличение
локализованного на поверхности молекулы бел-
интенсивности полосы димера) обусловлено дли-
ка. Столкновение двух молекул, каждая из кото-
ной волны и интенсивности УФ-света (для фильтра
рых содержит на поверхности радикалы Тир, со-
здает условия для формирования связи Tир-Tир.
на 260 нм - 39.5 мкмоль фотонов·м-2с-1 и на
На рис. 3 представлен спектр флуоресценции
белка PsbO, освещенного УФ-светом в течение
5 мин. Видно, что возбуждение белка светом с
длиной волны 325 нм выявляет максимум флуо-
ресценции при 410 нм, что соответствует дитиро-
зину (согласно флуоресцентному методу опреде-
ления дитирозина [28]).
Исследование влияния УФ-света на белки
предусматривает, как правило, использование
УФ фильтров, пропускающих свет определенно-
го диапазона, что позволяет учитывать природу
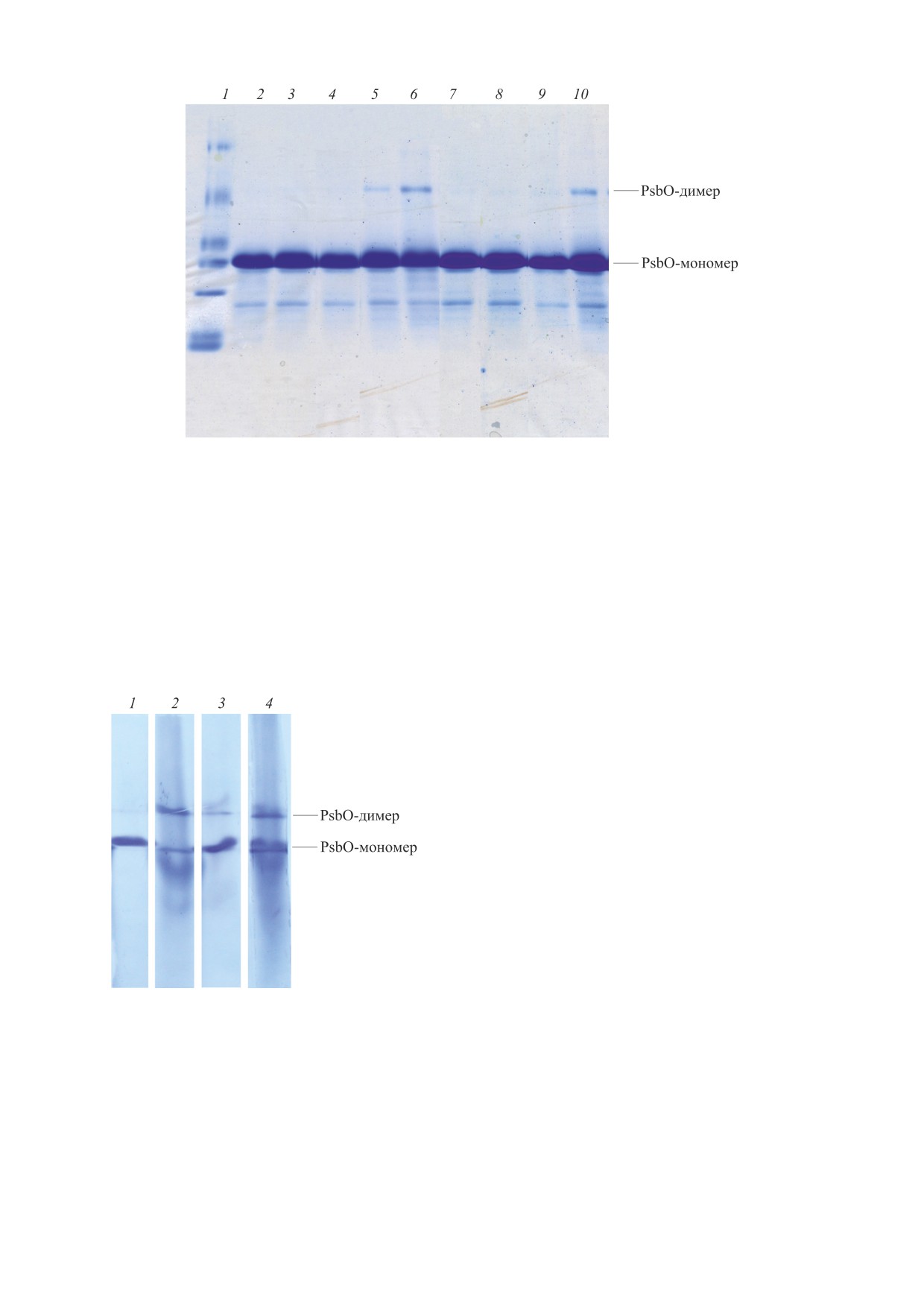
аминокислот в структуре белка. На рис. 4 пред-
ставлены результаты электрофореза белка PsbO
после освещения с использованием фильтров,
пропускающих свет 276 нм (рис. 4, дорожки 3-6)
и 290 нм (рис. 4, дорожки 7-10) по отношению к
контрольному варианту (рис. 4, дорожка 2). За-
метное увеличение содержания белка PsbO в по-
лосе димера наблюдается после 5 и 10 мин осве-
Рис. 3. Спектр флуоресценции (Ех = 325 нм) осве-
щения белка с использованием фильтра 276 нм
щенного УФ-светом белка PsbO из гороха. Освеще-
(рис. 4, дорожки 5 и 6) и после 10 мин освещения с
ние образца проводили светом интенсивностью 54.3
использованием фильтра
290 нм (рис.
4,
мкмоль фотонов·м-2с-1 с помощью ртутно-кварце-
дорожка 10). Так как диаметр и толщина обоих
вой лампы (ОКН-11) в течение 3 мин.
БИОФИЗИКА том 67
№ 6
2022
1126
ХРИСТИН и др.
Рис. 4. Электрофореграммы белка PsbO из гороха до (дорожка 2) и после облучения УФ-светом через фильтры 260 нм
в течение 1 мин (дорожки 3 и 7 соответственно), 5 мин (дорожки 5 и 9 соответственно) и 10 мин (дорожки 6 и 10
соответственно).
для удаления белков PsbP и PsbQ ВОК. Предпола-
290 нм - 27.2 мкмоль фотонов·м-2с-1). Частично
галось, что удаление внешних белков PsbP и
разница может быть за счет разного коэффициен-
PsbQ, находящихся на достаточно близком рас-
та поглощения при 260 и 290 нм.
стоянии от PsbO, может способствовать большей
Индуцированная УФ-светом димеризация
доступности УФ-света к белку PsbO. Кроме того,
белка PsbO была также исследована в мембран-
отмывка внешних белков PsbP и PsbQ от мембран
ных препаратах ФСII, обработанных 1 М NaCl
с помощью 1 M NaCl частично удаляет белок
PsbO, вероятно, ту его часть, которая находится в
люмене в не связанном с мембранами состоянии.
Такой белок можно добавить к отмытым 1 М
NaCl препаратам ФСII перед освещением УФ-
светом с тем, чтобы наблюдать эффект димериза-
ции белка в условиях, когда часть белка связана с
мембранами ФСII, а другая часть находится в
растворимой форме. Кроме того, нельзя исклю-
чить редокс-взаимодействие между связанными с
мембранами и растворимыми мономерами PsbO.
На рис. 5 представлены результаты электрофо-
реза растворимого (рис. 5, дорожки 1 и 3) и свя-
занного с мембранами ФСII (рис. 5, дорожки 2
и 4) белка PsbO до (рис. 5, дорожка 1) и после
(рис. 5, дорожки 2 и 4) облучения УФ-светом. К
мембранам ФСII, содержащим связанный белок
PsbO, после освещения добавляли растворимый
белок PsbO. Как видно из рис. 5, полосы мономе-
ра и димера белка PsbO во всех вариантах опыта
(свободный необлученный УФ-светом белок Ps-
Рис. 5. Электрофореграммы белка PsbO (дорожка 1);
bO; облученные УФ-светом мембраны ФСII, со-
белка PsbO, экстрагированного из мембранных пре-
держащие связанный белок; облученный УФ-
паратов ФСII, предварительно освещенных УФ-све-
светом белок PsbO; свободный необлученный бе-
том (дорожка 2); белка PsbO, освещенного УФ-све-
лок PsbO, добавленный к облученным мембра-
том в течение 5 мин (дорожка 3); белка PsbO, экстра-
гированного из освещенных УФ-светом мембранных
нам ФСII, содержащим связанный белок PsbO)
препаратов ФСII + белок PsbO (дорожка 4).
совпадают по подвижности, что исключает ошиб-
БИОФИЗИКА том 67
№ 6
2022
ДИМЕРИЗАЦИЯ СВОБОДНОГО И АССОЦИИРОВАННОГО С МЕМБРАНАМИ
1127
ку в идентификации образовавшегося димера
результате взаимодействия цистеинов белка с
белка после освещения препаратов ФСII (рис. 5,
окислителями, например, персульфатом аммо-
дорожка 2).
ния, который используется в качестве окислителя
при полимеризации гелей для электрофореза. В
ФСII такими окислителями являются радикаль-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ные формы кислорода [33], образующиеся во вре-
Новые знания о влиянии УФ-света на струк-
мя освещения препаратов ФСII видимым светом.
турно-функциональную организацию ФСII важ-
Межбелковые сшивки в изолированных тила-
ны для более глубокого понимания механизмов
коидах хлоропластов при освещении видимым
повреждения и адаптации растений к возрастаю-
светом наблюдаются только при температуре
щей на Земле интенсивности УФ-света связанно-
40°С [34]. В цитируемой работе иммуноблотинг
го с истощением озонового слоя [29] и потепле-
белков в ПААГ специфическими антителами
нием климата. УФ-свет поглощается ароматиче-
против белка PsbO показал образование несколь-
скими кислотными остатками белков (прежде
ких дополнительных полос после освещения при
всего, Tир и Tрп), липидами, нуклеиновыми кис-
температуре 40°С, одна из которых соответствует
лотами, что усиливает окислительный стресс в
мономеру белка. Снижение компактности и фор-
ФСII и, таким образом, ингибирует фотосинтез
мы зоны мономера белка в полосах после обра-
[21, 30]. В настоящей работе получены данные,
ботки мембран белым светом интерпретируются
свидетельствующие о способности полихромати-
авторами работы [35] как повреждение структуры
ческого (рис. 2) и монохроматического (рис. 4)
белка PsbO гидроксильными радикалами (ОН•),
УФ-света активировать димеризацию изолиро-
образующимися в реакции перекиси водорода с
ванного белка PsbO. Неожиданным явилось об-
ионами переходных металлов. Мы наблюдали
разование димеров без воздействия на белок УФ-
расширение и раздвоение зоны мономера белка
света. Так, при хроматографии неосвещенного
PsbO в присутствии окислителей (Н2О2, ферри-
УФ-светом изолированного белка PsbO на гель-
цианида), восстановителей (ДТТ, 2-меркаптоэта-
фильтрационной колонке (рис. 1) были обнару-
нола), а также при электрофорезе. Так как эти из-
жены мономеры и димеры белка. Было предполо-
жено, что в процессе разделения происходит об-
менения обратимы, можно говорить о структур-
ратимая димеризация и мономеризация белка.
ных изменениях белка, связанных с редокс-
состоянием Цис, Трп и Тир. Возможно, димеры,
Образование димеров также наблюдается при
способные к мономеризации, образуются в гелях
электрофорезе в ПААГ фракций белка, получен-
при электрофорезе в результате окислительно-
ных при его хроматографии на колонке Superdex-
75 (рис. 1). Димеризация при электрофорезе, ве-
восстановительных изменений дисульфидной
роятно, связана с тем, что на границе концентри-
связи. Димер белка PsbO, в котором молекулы
связаны между собой в результате индуцирован-
рующего и разделяющего гелей мономерный бе-
ного УФ-светом образования дитирозина, не
лок концентрируется в узкую зону при рН 6.8 и
подвергается мономеризации. Такие димеры, ве-
димеризуется, а затем движется в разделяющем
геле с рН 8.5. Электрофорез белков в гелях, при-
роятно, подвергаются протеолитической деграда-
готовленных с использованием персульфата ам-
ции in vivo. Важным подтверждением образова-
ния дитирозинового мостика является обнаруже-
мония, происходит в условиях, благоприятных
ние специфической флуоресценции (рис. 3). В
для окисления цистеина [31], что способствует
литературе описаны результаты восстановления
димеризации белка с участием цистеинов и в свя-
зи с этим приводит к возникновению артефактов.
дисульфидной связи инсулина и вазопрессина с
Учитывая это, мы проводили предэлектрофорез
помощью УФ-света [36]. В их восстановлении,
вероятно, принимает участие возбужденный Tрп
без белков для удаления персульфата, заменяли
[37]. По аналогии с этими работами мы также не
электродные буферы на свежие и затем наносили
исключаем возможность восстановления дисуль-
белковые растворы в ячейки гелевого блока. По-
сле окрашивания белков в гелях красителем Ку-
фидной связи при облучении УФ-светом и после-
масси и при наличии димерной полосы белка на-
дующего их окисления с образованием межбел-
ковой дисульфидной связи.
блюдается шлейф, направленный от димера к мо-
номеру (рис. 2, врезка, дорожка 5), что можно
Индуцированное УФ-светом образование ди-
объяснить мономеризацией димера в процессе
тирозина эффективно используется для межмо-
электрофореза. Такой эффект наблюдается при
лекулярных сшивок белков в научных исследова-
электрофорезе рекомбинантного хемокина, со-
ниях и решении практических задач. По предпо-
держащего четыре цистеина [32].
ложению исследователей
[38] определение
Таким образом, сравнивая собственные ре-
ковалентных сшивок белков в растениях методом
зультаты электрофореза PsbO с литературными
электрофореза в ПААГ является информативным
данными, можно заключить, что димер с межмо-
и ценным тестом для определения чувствитель-
лекулярной дисульфидной связью формируется в
ности растений к УФ-свету. Сшитые белки могут
БИОФИЗИКА том 67
№ 6
2022
1128
ХРИСТИН и др.
Рис. 6. Схема предполагаемого образования дитирозиновой и дисульфидной связи в димере белка PsbO при облуче-
нии УФ-светом в растворе (а), ассоциированного с ВОК (б) и с димерами ФСII в мегакомплексах тилакоидов (в). Мо-
дель белка PsbO взята из Data Bank entry 3ARC30, модель димера PsbO в мегакомплексе - согласно работе [14].
функционировать в растениях и обладать повы-
бодного белка PsbO (рис. 6а) и в составе димера
шенной устойчивостью к стрессам. Эта идея под-
ВОК ФСII (рис. 6б), а также его участия в образо-
тверждается многочисленными примерами сши-
вании мегакомплексов ФСII (рис. 6в). Такая ди-
вания белков с помощью химических и физиче-
меризация белка PsbO, вероятно, происходит не
ских методов при моделировании и создании
только в препаратах изолированного белка, но и в
искусственного фотосинтеза, био-фототранзи-
фотосинтезирующих организмах растений, бак-
сторов на основе фотосинтетических белков.
терий, водорослей. Пока в литературе недоста-
На рис. 6 представлена гипотетическая схема
точно экспериментальных данных, позволяющих
индуцированной УФ-светом димеризации сво- глубже понять физиологическую роль этой, без-
БИОФИЗИКА том 67
№ 6
2022
ДИМЕРИЗАЦИЯ СВОБОДНОГО И АССОЦИИРОВАННОГО С МЕМБРАНАМИ
1129
условно важной, структурно-функциональной
СПИСОК ЛИТЕРАТУРЫ
перестройки белков. Накопленные литературные
1.
В. В. Климов, С. И Аллахвердиев, Ш. Деметер
данные и результаты, представленные нами в
и др., Докл. АН СССР, 49, 227 (1979).
этой работе, позволяют предположить, что УФ-
2.
H. Ishikita, B. Loll, J. Biesiadka, et al., Biochemistry,
свет активирует перестройку белка PsbO, изменяя
44, 4118 (2005).
его структурную организацию. Предполагается,
3.
T. M. Bricker, J. L. Roose, R. D. Fagerlund, et al., Bio-
что нековалентные связи между мономерами бел-
chim. Biophys. Acta, 1817, 121 (2012).
ка PsbO участвуют в организации димеров ФСII.
4.
K. Ifuku and T. Noguchi, Front. Plant Sci., 7, 84
В этом случае образование дитирозиновых диме-
(2016). DOI: 10.3389/fpls.2016.00084
ров белка PsbO, индуцированное УФ-светом, мо-
5.
Q. Zhu, Y. Yang, Y. Xiao, et al., Photosynth. Res., 146
жет быть вовлечено в этот процесс. Пока неясно,
(1-3), 29 (2020).
связано ли образование дитирозиновых связей со
6.
P. Chao, J. A. Forsman, L. Hui, et al., Photosynth.
стабилизацией ВОК при действии УФ-света или
Res., 151 (1), 103 (2022).
их образование свидетельствует о повреждении, и
7.
A. R. Offenbacher, B. C. Polander, and B. A. Barry, J.
таким образом является маркером стресса ФСII.
Biol. Chem., 288, 29056 (2013).
В настоящее время отсутствуют сведения о воз-
8.
S. R. Mayes, K. M. Cook, S. J. Self, et al., Biochim.
можности деполимеризации индуцированных
Biophys. Acta, 1060 (1), 1 (1991).
УФ-светом димеров белка. Изучение механизмов
9.
Н. И. Шутилова, И. Г. Кадошникова, Т. Н. Смоло-
деполимеризации белков, кроме научного, может
ва и др., Биохимия, 52 (12), 1958 (1987).
также иметь практическое значение при констру-
10.
B. Lundin, M. Nurmi, M. Rojas-Stuetz, et al., Photo-
ировании искусственного фотосинтеза и в меди-
synth. Res., 98, 405 (2008).
цине. Например, проблема лечения болезни Пар-
11.
H. Popelkova and C. F. Yocum, J. Photochem. Photo-
кинсона, молекулярным механизмом которой яв-
biol., 104, 179 (2011).
ляется активируемая окислительным стрессом
12.
А. В. Пиголев и В. В. Климов, Биохимия, 80 (6),
ковалентная полимеризация си-нуклеина с обра-
785 (2015).
зованием его дитирозиновых димеров, до послед-
13.
R. Hussein, M. Ibrahim, A. Bhowmick, et al., Nature
него времени не решена, так как невозможно по-
Commun., 12 (1), 6531 (2021)
добрать лекарственное средство, которое могло
14.
L. M. Gerland, D. Friedrich, L. Hopf, et al., ChemBi-
бы активировать деполимеризацию димеров и аг-
oChem., 21, 1597 (2020).
регатов (телец Леви) в клетках нейронов.
15.
C. del Val and A.-N. Bondar, Biochim. Biophys. Acta,
Таким образом, исследуя димеризацию УФ-
1858 (6), 432 (2017).
светом, мы предполагаем возможность образова-
16.
J. L. Roose, C. F. Yocum, and H. Popelkova, Biochem-
ния трех типов димера белка PsbO in vitro, разли-
istry, 50, 5988 (2011).
чающихся по типу связи между двумя мономе-
17.
M. Li, J. Ma, X. Li, et al., eLife, 10, e69635 (2021).
рами: электростатической, дитирозиновой и
DOI: 10.7554/eLife.69635
дисульфидной. Возможность образования кова-
18.
A. Seidler, Eur. J. Biochem., 242, 485 (1996).
лентного димера белка в виде двух популяций, в
19.
R. Fristedt, A. Herdean, C. E. Blaby-Haas, et al., Plant
одной из которых связь мономеров дитирозино-
Physiol., 167 (2), 481 (2015).
вая, а в другой дисульфидная подтверждается
20. D. J. Kliebenstein, J. E. Lim, L. G. Landry, et al., Plant
масс-хроматографическим анализом пептидов
Physiol., 130, 234 (2002).
препарата α-лактальбумина, облученного УФ-
21. É. Hideg and I. Vass, Plant Sci., 115 (2), 251 (1996).
светом [39].
22. О. В. Никитишена, М. С. Христин, Т. Н. Смолова
и др., Биохимия, 62, 1280 (1997).
23. D. A. Berthold, G. T. Babcock, and C. F. Yocum,
ФИНАНСИРОВАНИЕ РАБОТЫ
FEBS Lett., 134, 231 (1981).
Работа выполнена в рамках государственного
24. O. V. Pobeguts, T. N. Smolova, D. S. Timoshevsky,
et al., J. Photochem. Photobiol., 100 (1), 30 (2010).
задания ФИЦ ПНЦБИ РАН (122041100274-6).
25. M. Karamoko, S. Cline, K. Redding, et al., Plant Cell,
23, 4462 (2011).
КОНФЛИКТ ИНТЕРЕСОВ
26. M. B. Maina, G. Burra, Y. K. Al-Hilaly, et al.,
iScience, 23 (10), 101537 (2020)
Авторы заявляют об отсутствии конфликта
27. K. Ruan, J. Li, R. Liang, et al., Biochim. Biophys. Res.
интересов.
Commun., 293, 593 (2002)
28. D. A. Malencik and S. R. Anderson, Amino Acids, 25,
233 (2003).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ НОРМ
29. J. B. Kerr and C. T. McElroy, Science, 262 (5136), 1032
Настоящая статья не содержит каких-либо ис-
(1993).
следований с участием людей или животных в ка-
30. G. Renger, M. Volker, H. J. Eckert, et al., J. Photo-
честве объектов исследований.
chem. Photobiol. 49 (1), 97 (1989).
БИОФИЗИКА том 67
№ 6
2022
1130
ХРИСТИН и др.
31. C. Achilli, A. Ciana, and G. Minetti, J. Biol. Methods,
36. S. K. Gammelgaard, S. B. Petersen, K. F. Haselmann,
5 (4), e104 (2018)
et al., ACS Omega, 5, 7962 (2020).
32. M. K. Crow, N. Karasavvas, and A. H. Sarris, Biotech-
37. E. A. Permyakov, S. E. Permyakov, G. Y. Deikus, et al.,
niques, 30 (2), 311 (2001).
Proteins: Structure, Function, and Genetics, 51, 498
33. P. Pospísil, Biochim. Biophys. Acta, 1787 (10), 1151
(2003).
(2009).
38. N. Shanthi, K. Lingakumar, and G. Kulandaivelu, J.
34. A. K. Singh, G.S. Singhal, Photosynthetica, 36, 213
Global Biosci., 4 (4), 1996 (2015).
(1999).
35. T. Henmi, M. Miyao and Y. Yamamoto, Plant Cell
39. Z. Zhao, K. Engholm-Keller, M. M. Poojary, et al., J.
Physiol., 45(2), 243 (2004).
Agric. Food Chem., 68 (24), 6701 (2020).
Dimerization of the Free and Photosystem II-Associated PsbO Protein
upon Irradiation of UV Light
M.S. Khristin*, T.N. Smolova*, and A.A. Khorobrykh*
Institute of Fundamental Problems of Biology, Russian Academy of Sciences,
ul. Institutskaya 3, Pushchino, Moscow Region, 142290 Russia
The main function of the PsbO protein in photosystem II is to stabilize the water-oxidizing Mn4CaO5 cluster.
The present study shows for the first time that short-term exposure of both isolated and membrane-bound
protein PsbO to UV light led to protein dimerization. A non-covalent dimer of the PsbO protein was detected
by gel filtration. The electrophoretic separation of proteins of PSII membrane fragments illuminated with UV
light using a polyacrylamide gel was indicative of the formation of the covalent dimer of the PsbO protein, as
with the isolated PsbO protein. The formation of the covalent dimer of the PsbO protein exposed to UV light
confirms the assumption about the existence in vivo of a non-covalent dimer of the PsbO protein that may
play a regulatory role in PSII.
Keywords: UV light, PSII membranes, PsbO protein, dimerization, disulfide bond, tyrosine bond, electrostatic
bond
БИОФИЗИКА том 67
№ 6
2022