БИОФИЗИКА, 2022, том 67, № 6, с. 1163-1175
БИОФИЗИКА КЛЕТКИ
УДК 577.3
АКТИВНОСТЬ И КАТАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
СУКЦИНАТДЕГИДРОГЕНАЗЫ МИТОХОНДРИЙ ПЕЧЕНИ КРЫС
ПРИ УМЕРЕННОЙ ГИПОТЕРМИИ
© 2022 г. Р. А. Халилов*, А. М. Джафарова*, #, В. Р. Абдуллаев*
*Дагестанский государственный университет, ул. М. Гаджиева,
43а, Махачкала, Республика Дагестан, 367000, Россия
#E-mail: albina19764@mail.ru
Поступила в редакцию 17.05.2022 г.
После доработки 11.07.2022 г.
Принята к публикации 16.08.2022 г.
Ранее нами было показано, что кратковременная умеренная (30°С) гипотермия способствует суще-
ственному повышению интенсивности свободно-радикальных процессов и изменению ряда
биоэнергетических параметров митохондрий, а ее пролонгирование в течение трех часов - их нор-
мализации, что может быть связано с модуляцией активности и каталитических свойств сукцинат-
дегидрогеназы. Данное исследование показывает, что умеренная гипотермия, особенно пролонги-
рованная в течение трех часов, существенно повышает скорость катализа сукцинатдегидрогеназы и
влияет на характер ее концентрационной и температурной зависимости. Модуляция активности
сукцинатдегидрогеназы в динамике гипотермии происходит за счет изменений ее кинетических и
термодинамических характеристик, из которых наиболее значимый вклад в эффективность катали-
за фермента вносит параметр Vmax - максимальная скорость. Эти изменения могут играть важную
роль в сохранении энергосинтезирующей функции митохондрий и снижения в них интенсивности
свободно-радикальных процессов.
Ключевые слова: гипотермия, крысы, митохондрии, сукцинатдегидрогеназа, кинетические характери-
стики.
DOI: 10.31857/S0006302922060138, EDN: LKLTTR
щита, обусловленная понижением температуры
Гипотермия - это состояние, развивающееся у
тела, является результатом снижения скорости
гомойотермных животных при снижении темпе-
метаболических процессов и уменьшения по-
ратуры их тела. В зависимости от этиологии раз-
требности тканей в кислороде и глюкозе [6]. Наи-
вития гипотермического состояния различают
более часто для этих целей используют умерен-
несколько видов гипотермии - случайная, интра-
ную пролонгированную гипотермию [7].
операционная, искусственная. Случайная гипо-
термия может иметь место у животных, обитаю-
Наряду с положительными терапевтическими
щих в регионах со значительными колебаниями
эффектами умеренная гипотермия вызывает ряд
температурного режима [1]. При проведении об-
нежелательных изменений в организме [6], что
ширных операций с использованием наркоза че-
ограничивает потенциальные возможности ее
ловек может подвергаться так называемой «ин-
применения. Понимание основных механизмов
траоперационной» гипотермии [2]. Искусствен-
деструктивных или компенсаторно-приспособи-
ные гипотермических состояния широко
тельных изменений, лежащих в основе терапев-
применяются при операциях на сердце и мозге, а
тической гипотермии, жизненно важно для раз-
также в терапевтических целях для предупрежде-
работки надлежащего и эффективного лечения.
ния рисков развития ишемических и реперфузи-
На начальных этапах гипотермия сопровожда-
онных повреждений жизненно важных органов и
ется возбуждением симпатической нервной си-
защиты от последствий гипоксии, ишемии-ре-
стемы провоцируя дрожь, гипертонию, тахикар-
перфузии, инсульта и инфаркта, травм [3-5]. За-
дию, тахипноэ и сужение сосудов. Изменения
микроциркуляции могут снизить скорость крово-
Сокращения: ЭТЦ - электрон-транспортная цепь, СДГ -
сукцинатдегидрогеназа, ФАД - флавинадениндинуклео-
тока, способствовать седиментации эритроцитов,
тид, АФК - активные формы кислорода.
увеличению вязкости крови. Все это в совокупно-
1163
1164
ХАЛИЛОВ и др.
сти приводит к состоянию гипоксии и развитию
МАТЕРИАЛЫ И МЕТОДЫ
окислительного стресса [6, 8, 9]. Существенные
Животные и моделирование гипотермии. Опыты
физиологические изменения при низких темпе-
выполнены на крысах-самцах Вистар возраста
ратурах тела животного могут сопровождаться
три с половиной месяца с массой тела 200-220 г.,
адаптивными или патологическими изменения-
полученных из питомника «Филиал «Столбовая»
ми в энергетическом метаболизме клетки, ключе-
НЦБМТ ФМБА России» (Чеховский район Мос-
вую роль в которых играют электрон-транспорт-
ковской области) и содержащихся в стандартных
ные цепи (ЭТЦ), локализованные в мембранах
условиях вивария Дагестанского государственно-
митохондрий.
го университета. В контрольных и эксперимен-
Одним из структурных элементов ЭТЦ мито-
тальных группах было использовано по 8-10 жи-
хондрий является комплекc II - сукцинат: убихи-
вотных.
нон-оксидоредуктаза, представленный олиго-
Моделирование гипотермических состояний.
мерным, встроенным в липидную матрицу внут-
Гипотермию вызывали наружным охлаждением
ренней мембраны митохондрий ферментом -
животных в плексигласовых камерах с «рубаш-
сукцинатдегидрогеназой (СДГ), окисляющим
кой», через которую циркулировала холодная
сукцинат до фумаровой кислоты сопряженно с
(5°С) вода. Температуру тела крыс снижали рав-
восстановлением флавинадениндинуклеотида
номерно со средней скоростью 0.28°С/мин. При та-
(ФАД). Кроме того, СДГ является функциональ-
ком способе моделирования в течение 30 ± 1.0 мин
ным участником цикла трикарбоновых кислот,
температура тела животных снижалась до 30°С
играющим ключевую роль в промежуточном ме-
(кратковременная умеренная гипотермия). По
таболизме [10]. Полученные относительно недав-
достижении этой температуры крыс сразу же де-
но экспериментальные данные свидетельствуют
капитировали. Для моделирования состояний
о существенном вкладе комплекса II, наряду с
пролонгированной гипотермии после того, как
комплексами I и III, в продукцию активных форм
температура тела животных достигла 30°С, под-
кислорода (АФК) при различных патологических
держивали этот уровень гипотермии в течение 1 и
состояниях организма, сопровождающихся гипо-
3 ч (пролонгированая часовая и трехчасовая уме-
ксией [11]. Важной особенностью этого фермента
ренная гипотермия) путем контроля температуры
является независимость его активности от соот-
воды в «рубашке» камеры. Мониторинг темпера-
ношения восстановленного и окисленного нико-
туры тела проводили с помощью ректального
тинамидадениндинуклеотида (НАДН/НАД+),
цифрового термометра MS6501. В качестве кон-
что позволяет сохранять энергосинтезирующую
троля служили интактные крысы с нормальной
функцию митохондрий в условиях гипоксии при
(37°С) температурой тела.
нарушении НАД-зависимого дыхания клеток
Выделение митохондрий. Крыс декапитирова-
[12].
ли, после чего быстро выделяли печень и промы-
Ранее нами было показано, что кратковремен-
вали ее ледяной средой выделения (1°С) в течение
ная умеренная (30°С) гипотермия крыс повышает
5 мин. Печень предварительно измельчали, про-
скорости глутамат- и сукцинат-зависимого дыха-
пускали через пресс и готовили 10%-й гомогенат
ния изолированных митохондрий печени. При
в среде выделения, после чего центрифугировали
этом коэффициент окислительного фосфорили-
10 мин при 1800 g. Супернатант отделяли и цен-
рования и дыхательный контроль снижаются, а
трифугировали при 15000 g в течение 15 мин на
уровни маркеров окислительного стресса, напро-
центрифуге MR 23i (Thermo Fisher Scientific,
тив, увеличиваются. Пролонгирование гипотер-
США). Полученный дважды отмытый осадок до-
мии до одного часа сопровождается дальнейшей
водили до 2 мл и суспендировали в 0.32 М сахаро-
интенсификацией сукцинат-зависимого дыхания
зе. Суспензию митохондрий наслаивали на зара-
и свободно-радикальных процессов в митохон-
нее приготовленный градиент плотности сахаро-
дриях, снижением коэффициента окислительно-
зы (содержащий 3.5 мл - 1.1 М; 7.5 мл - 0.8 М;
го фосфорилирования и дыхательного контроля,
7.5 мл - 0.5 М и 5 мл - 0.3 М сахарозы) и центри-
в то время как пролонгирование до трех часов
фугировали в бакет-роторе SW32 Ti при 7000 g на
приводит к нормализации данных параметров
ультрацентрифуге Optima L-90K (Beckman
[13, 14]. Обнаруженные изменения респиратор-
Coulter, США).
ных характеристик митохондрий могут быть свя-
Митохондрии, находящиеся в слоях
0.5-
заны с модуляцией активности и каталитических
0.8 М, отсасывали специальным приспособлени-
свойств СДГ при низких температурах тела.
ем для отбора фракций и осаждали при 15000 g на
Целью данной работы явилось исследование
центрифуге MR 23i. Полученные митохондрии
эффектов гипотермии различной длительности
промывали в среде выделения и повторно цен-
на активность, кинетические и термодинамиче-
трифугировали при 15000 g в течение 15 мин. По-
ские характеристики СДГ митохондрий печени
лученный осадок ресуспендировали в среде инку-
крыс.
бации и замораживали при температуре -70°С.
БИОФИЗИКА том 67
№ 6
2022
АКТИВНОСТЬ И КАТАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
1165
Все растворы сахарозы, использованные для
где m - количество восстановленного феррициа-
создания градиента ее плотности в пробирке, бы-
нида (в мкг); М - молекулярная масса феррициа-
ли приготовлены на 10 мМ НЕРЕS-буфере, со-
нида калия; b - содержание белка в пробе в мг; t -
держащем 1 мМ ЭДТА (рН 7.2) и 0.1% альбумина.
время инкубации в мин.
Состав среды выделения: 0.25 М сахарозы (Ap-
Определение кинетических и термодинамиче-
pliСhem, Германия), 5 мМ HEPES (AppliСhem,
ских характеристик сукцинатдегидрогеназы.
Германия), 0.5 мМ ЭДТА (AppliСhem, Германия),
Концентрационную зависимость активности
0.1% бычьего сывороточного альбумина (Sigma,
СДГ определяли, измеряя активность СДГ в диа-
США) (pH 7.4). Среда инкубации содержала
пазоне концентраций сукцинита 0.065-35 мМ. В
0.32 М сахарозы, 3 мМ HEPES, 0.25 мМ ЭДТА,
соответствии с литературными данными кинети-
1 мМ MgCl2, 13 мМ KCl (рН 7.4). Содержание
ка СДГ хорошо описывается классической моде-
белка в суспензии митохондрий определяли по
лью ферментативной кинетики Михаэлиса-
методу Лоури [15].
Ментен:
Определение активности сукцинатдегидрогена-
Vmax ·
[S]
зы. Для оценки активности СДГ применяли ме-
V
=
,
(2)
K S]
+
тод, в котором в качестве конечного акцептора
M
электронов выступает ферроцианид калия
где V - скорость реакции, Vmax - максимальная
(К3[Fe(CN)6]). Принцип метода заключается в
скорость, KM - константа Михаэлиса.
восстановлении ферроцианида калия, раствор
которого имеет желтую окраску, до бесцветного
Данное уравнение было использовано для рас-
чета кинетических характеристик фермента с по-
ферроцианида калия сукцинатом под действием
мощью многомерного нелинейного регрессион-
СДГ [16]. Для определения активности СДГ в сус-
ного анализа.
пензии митохондрий готовили растворы опыт-
ной и контрольной проб, содержащие 1.48 мл
Температурную зависимость активности СДГ
0.1 М фосфатного буфера (рН 7.8), 0.1 мл янтар-
определяли, измеряя активность СДГ в диапазо-
ной кислоты (Sigma, США) (рН 7.8), 0,1 мл 25 мМ
не температур 5-37°С и концентрации субстрата
ЭДТА (рН 7.8), 0.1 мл 150 мМ азида натрия (Sig-
в среде инкубации 4.37 мМ. По полученным ре-
ma, США), 0.1 мл дистилированной воды. В кон-
зультатам вычисляли активность фермента, стро-
трольную пробу вносили 2 мл 20% трихлоруксус-
или линейные анаморфозы в координатах Арре-
ной кислоты (Acros Оrganics, Бельгия), которая
ниуса, по которым определяли энергии актива-
приводит к денатурации СДГ с начала инкуба-
ции (Еа) и энтальпии активации (ΔHa).
ции, что препятствует специфическому восста-
Статистическая обработка. Обработка данных
новлению ферроцианида калия сукцинатом. За-
проведена с помощью однофакторного диспер-
тем в обе пробирки вносили по 0.1 мл суспензии
сионного анализа (ANOVA) с использованием па-
митохондрий, содержащей 100 мкг белка и инку-
кета прикладных программ Statistica 8.0 (StatSoft
бировали в течение 5 мин для ингибирования ци-
Inc., США). Нормальность распределения оце-
тохромоксидазы азидом натрия. Реакцию начи-
нивали критерием Шапиро-Уилка. Достовер-
нали добавлением 0.1 мл 25 мМ ферроцианида ка-
ность различий между нормально распределен-
лия (Sigma, США), затем пробы инкубировали
ными данными определяли с помощью критерия
15 мин при температуре 30°С, после чего в опыт-
Фишера на уровне значимости p ≤ 0.05. Для оцен-
ную пробирку добавляли 2 мл охлажденной 20%-
ки взаимосвязи между нормально распределен-
й трихлоруксусной кислоты. Растворы центрифу-
ными переменными был использован корреля-
гировали при 1800 g и в надосадочной жидкости
ционный анализ Пирсона. Данные в диаграммах
определяли оптическую плотность при λ = 420 нм.
приведены в виде среднего ± ошибка среднего.
По разнице оптической плотности контрольной
Каждая кривая на графиках концентрационной и
и опытной проб определяли количество ферро-
температурной зависимости скорости катализа
цианида калия, восстановленного за время инку-
СДГ - среднее из восьми-десяти независимых
бации, используя калибровочную кривую.
экспериментов.
Поскольку реакция протекает стехиометриче-
ски и 1 моль сукцината восстанавливает 2 моля
РЕЗУЛЬТАТЫ
ферроцианида, можно выражать активность СДГ
через количество окисленного сукцината.
Концентрационная зависимость активности и
Активность фермента (в мкМ сукцината/мг
кинетические характеристики сукцинатдегидроге-
белка за 1 мин) вычисляется по следующей фор-
назы. Исследована активность и концентрацион-
ная зависимость СДГ митохондрий печени кон-
муле:
трольных крыс в диапазоне концентраций сукци-
m1000,
ната
0.065-35 мМ. Из рис.
1, на котором
A
=
(1)
2M·b·t
представлены графики концентрационной зави-
БИОФИЗИКА том 67
№ 6
2022
1166
ХАЛИЛОВ и др.
симости активности СДГ, видно, что с повыше-
нием концентрации сукцината in vitro активность
СДГ в митохондриях печени контрольных крыс
увеличивается, достигая максимального значе-
ния при концентрации 4.37 мМ. Дальнейшее по-
вышение концентрации субстрата не оказывает
эффекта на скорость катализа СДГ. Таким обра-
зом, кинетика катализа СДГ носит классический
характер и может быть адекватно описана класси-
ческой моделью Михаэлиса-Ментен. При этом
необходимо отметить следующую особенность
кинетики СДГ: в области низких концентраций
сукцината имеет место сигмоидный характер за-
висимости скорости катализа фермента от содер-
жания субстрата в среде инкубации. Это указыва-
ет на то, что в данном диапазоне концентраций
янтарной кислоты незначительные изменения ее
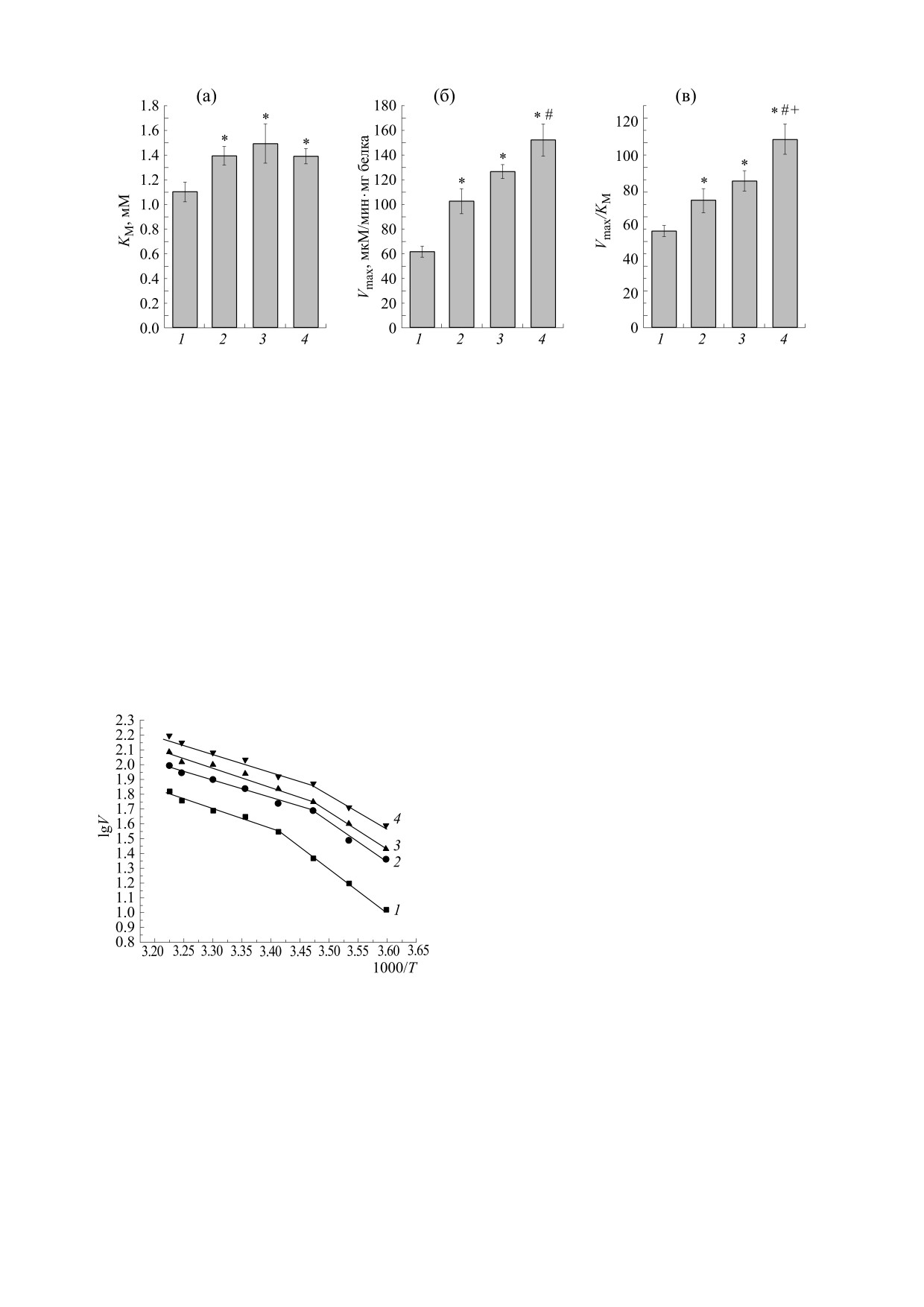
Рис. 1. Концентрационные зависимости активности
притока в компартмент локализации фермента
СДГ митохондрий печени крыс при умеренной
приводят к резкому повышению активности фер-
гипотермии различной длительности: 1 - контроль, 2 -
мента.
кратковременная гипотермия, 3 - пролонгированная
часовая гипотермия, 4 - пролонгированная трехчасовая
Снижение температуры тела крыс до 30°С в те-
гипотермия. По оси абсцисс - логарифм концентрации
чение 30 мин (умеренная кратковременная гипо-
сукцината, по оси ординат - скорость ферментативной
термия) сопровождается существенным повыше-
реакции.
нием активности фермента и изменениями харак-
тера его концентрационной зависимости (рис. 1).
При этом повышение при различных концентра-
молекул СДГ достигается при более высоких кон-
циях субстрата носит неоднозначный характер:
центрациях субстрата, а кооперативная кинетика
связывания становится менее выраженной.
при низких концентрациях оно более выражено,
нежели при высоких. Например, у гипотермиче-
Исследование кинетических характеристик
ских крыс активность СДГ при концентрации сук-
показало, что кратковременная гипотермия спо-
цината 0.065 мМ увеличивается в 3.21 раза (в кон-
собствует повышению Vmax - на 66.2% (рис. 2а).
троле - 1.07 ± 0.12 мкмоль/мин·мг, при кратковре-
При этом значение KM тоже увеличивается - на
менной гипотермии - 3.44 ± 0.22 мкмоль/мин·мг,
26.4% (рис. 2б). Более выраженное повышение
р < 0.05), при 4.37 мМ - на 58.9% (в контроле -
Vmax по сравнению с KM способствует тому, что
54.6 ± 7.9 мкмоль/мин·мг, при кратковременной
отношение Vmax/KM, приближенно отражающее
гипотермии - 86.71 ± 9.4 мкмоль/мин·мг, р < 0.05),
а при 35 мМ - на 68.7% (в контроле - 54.9 ±
эффективность катализа фермента при физиоло-
гических концентрациях субстрата в клетке, тоже
± 5.6 мкмоль/мин·мг, при кратковременной гипо-
становится выше контрольных значений (на
термии - 92.7 ± 4.9 мкмоль/мин·мг, р < 0.05)
31.5%, рис. 2в).
Пролонгированная гипотермия в течение 1 ч
Пролонгирование гипотермии до 1 ч способ-
сопровождается дальнейшими повышениями ак-
ствует значительному повышению Vmax СДГ
тивности СДГ и изменениями ее концентрацион-
(примерно в два раза). При этом, несмотря на бо-
ной зависимости (рис. 1). Так, при концентрации
лее существенное по сравнению с кратковремен-
0.065 мМ скорость катализа фермента увеличива-
ной гипотермией повышение KM (на 35.4% отно-
ется по сравнению с кратковременной гипотер-
мией на 20% (4.13 ± 0.27 мкмоль/мин·мг), при
сительно контроля), эффективность катализа
концентрации 4.37 мМ - на 15.4% (100.5 ±
продолжает увеличиваться, достигая уровня, ко-
± 7.9 мкмоль/мин·мг), а при 35 мМ - на 26.1%
торый выше уровня контроля на 51.4% (рис. 2).
(116.9 ± 8.6 мкмоль/мин·мг, р < 0.05). Трехчасовая
Дальнейшее пролонгирование гипотермии (до
гипотермия продолжает повышать активность
3 ч) продолжает увеличивать значение Vmax. Оно
СДГ: при концентрации сукцината 0.065 мМ она
становится в 2.46 раз выше контрольных значе-
становится в 4.7 раза выше уровня контроля
ний и на 20.1% выше уровня у животных с гипо-
(5.08 ± 0.32 мкмоль/мин·мг, р < 0.05), при 4.37 мМ -
термией 1 ч. При этом наблюдается незначи-
в 2.2 раза (120.3 ± 8.4 мкмоль/мин·мг, р < 0.05), а
тельное по сравнению с часовой гипотермией
при 35 мМ - в 2.6 раза (142.9 ± 9.4 мкмоль/
снижение KM. Оно способствует еще более выра-
мин·мг, р < 0.05).
женному повышению эффективности катализа,
Из рис. 1 видно, что в динамике пролонгиро-
достигающему 95.1% от уровня контрольных жи-
вания гипотермии насыщение активных центров
вотных (рис. 2).
БИОФИЗИКА том 67
№ 6
2022
АКТИВНОСТЬ И КАТАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
1167
Рис. 2. Кинетические характеристики ((а) - Vmax, (б) - КM, (в) - Vmax/КM) СДГ митохондрий печени крыс
при гипотермии различной длительности: 1 - контроль, 2 - кратковременная гипотермия, 3 - пролонгированная
часовая гипотермия, 4 - пролонгированная трехчасовая гипотермия. По оси абсцисс - состояния животных, по оси
ординат - значения кинетических характеристик.
Температурная зависимость активности и тер-
пературе инкубации 20.0 ± 1.6°С - точке излома
модинамические параметры сукцинатдегидрогена-
всей температурной кривой.
зы. Исследована зависимость активности СДГ
Умеренная кратковременная гипотермия уве-
митохондрий печени крыс от температуры инку-
личивает активность фермента при всех темпера-
бации фермента in vitro (в диапазоне 5-37°С). Ре-
турах его инкубации in vitro. Примечателен тот
зультаты исследования, представленные на рис. 3
факт, что с повышением температуры инкубации
в виде графиков в координатах Аррениуса
разница в активности СДГ между контрольными
(1000/T - lgV), демонстрируют тот факт, что тем-
и гипотермическими животными становится ме-
пературная зависимость скорости катализа СДГ
нее выраженной. Кроме того, кратковременная
носит нелинейный характер (рис. 3). Она пред-
гипотермия способствует изменению характера
ставлена двумя линейными анаморфозами, пере-
температурной зависимости. Позиция излома на
секающимися у контрольных животных при тем-
графике температурной зависимости смещается в
сторону более низких температур - 15.0 ± 1.3°С
(р < 0.05). Пролонгирование умеренной гипотер-
мии способствует дальнейшему повышению ак-
тивности фермента при всех температурах его ин-
кубации и незначительным изменениям в накло-
нах температурных анаморфозов, при этом
паттерны температурной зависимости фермента
остаются в совокупности схожими с таковыми
для крыс, подверженных кратковременной гипо-
термии.
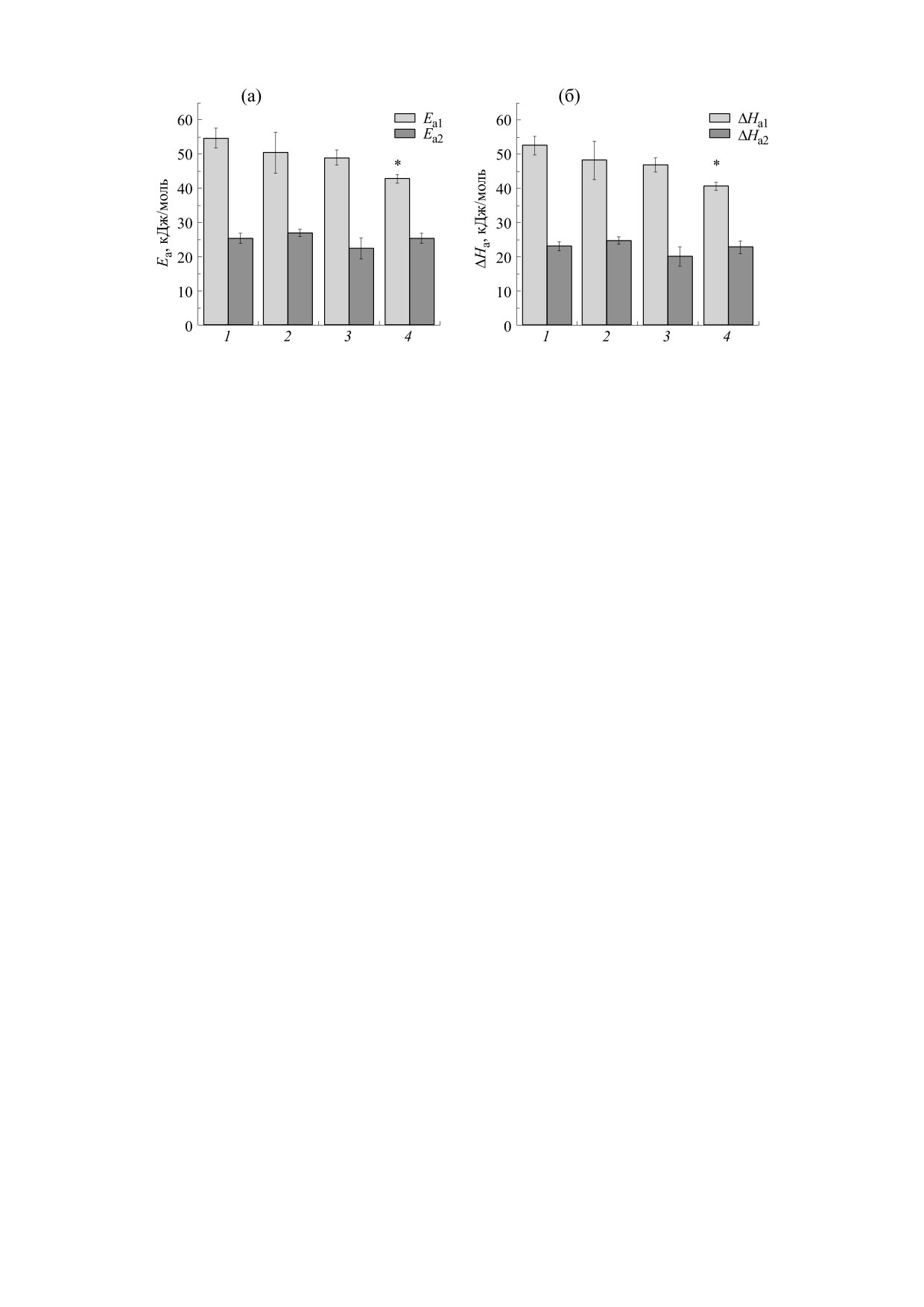
Из наклонов линейных анаморфозов были
рассчитаны эффективные энергии активации вы-
ше (Еа2) и ниже (Еа1) точки излома. Результаты
исследования представлены на рис. 4а. Оказа-
лось, что у всех исследованных групп крыс Еа1
существенно выше Еа2 (например, у контроль-
ной группы животных - в 2.15 раза). Кратковре-
менная гипотермия способствует незначительно-
Рис. 3. Температурные зависимости активности СДГ
му снижению Еа1. Это снижение в динамике про-
митохондрий печени крыс при умеренной гипотермии
лонгирования гипотермии становится более
различной длительности: 1 - контроль, 2 - кратковре-
выраженным, достигая в течение 3 ч гипотермии
менная гипотермия, 3 - пролонгированная часовая ги-
уровня, который на 21.7% ниже такового нормо-
потермия, 4 - пролонгированная трехчасовая гипотер-
термических крыс. При этом значения Еа2 у ги-
мия. По оси абсцисс - температура в обратных едини-
цах, по оси ординат
- логарифм скорости
потермированных животных претерпевают лишь
ферментативной реакции.
незначительные флуктуации.
БИОФИЗИКА том 67
№ 6
2022
1168
ХАЛИЛОВ и др.
Рис. 4. Термодинамические параметры ((а) - энергия активации ниже точки излома (Еа1) и выше точки излома (Еа2),
(б) - энтальпия активации ниже точки излома (ΔНа1) и выше точки излома (ΔНа2)) СДГ митохондрий печени крыс
при гипотермии различной длительности: 1 - контроль, 2 - кратковременная гипотермия, 3 - пролонгированная
часовая гипотермия, 4 - пролонгированная трехчасовая гипотермия. По оси абсцисс - состояния животных, по оси
ординат - величины термодинамических параметров.
Из значений эффективных энергии активации
ратуре менее 30°С, увеличивает скорость метабо-
были вычислены значения изменений энтальпии
лизма и потребление кислорода [19]. Это может
активации СДГ ниже (ΔHa1) и (выше ΔHa2) точ-
увеличить производство метаболического тепла в
ки излома в соответствии со следующей фор-
пять-шесть раз по сравнению с уровнем метабо-
мулой:
лизма в покое, а также потребление кислорода на
50-400% [20, 21]. Раннее нами было показано,
ΔH = Еа - RT.
(3)
что кратковременная гипотермия способствует
Из рис. 4б видно, что данный термодинамиче-
значительной интенсификации глутамат- и сук-
ский параметр СДГ митохондрий печени крыс в
цинатзависимого дыхания митохондрий печени
период низкотемпературного воздействия пре-
крыс [13].
терпевает изменения, характерные для Еа. Крат-
ковременная гипотермия способствует незначи-
Реакции, направленные на снижение тепло-
тельному снижению ΔHa1, однако в динамике
потерь, основаны на вазоконстрикции и центра-
пролонгирования значения ΔHa1 становятся су-
лизации кровотока. Возникновение спазма пери-
щественно ниже контрольных. При этом гипо-
ферических сосудов повышает вязкость крови и
нарушает микроциркуляцию [22]. Все это, в сово-
термия не оказывает значительного эффекта на
купности со сдвигом при низких температурах
ΔHa2.
кривой диссоциации оксигемоглобина влево,
приводит к ситуации тканевой гипоксии [9].
ОБСУЖДЕНИЕ
Снижение концентрации кислорода в клетках
Известно, что на начальных этапах развития
может привести к изменениям редокс-состояния
гипотермия сопровождается стрессорной реак-
компонентов дыхательной цепи и мембранного
цией, при которой происходит активация гипота-
потенциала (ΔΨm) митохондрий. Результатом та-
ламо-гипофизарно-надпочечниковой системы
ких изменений может стать дисфункция мито-
[17].
хондрий и их деэнергизация, сопровождающаяся
Эта активация может индуцировать терморе-
нарушениями функционально-метаболических
гуляторные реакции, направленные как на увели-
показателей, контролирующих жизнедеятель-
чение производства тепла, так и на снижение
ность клетки. Кроме того, накопление восстано-
теплопотерь. Для увеличения теплопродукции
вительных эквивалентов в митохондриальных це-
включаются механизмы дрожательного и недро-
пях переноса электронов при гипотермии может
жательного термогенеза. Усиливается обмен ве-
увеличить производство активных форм кисло-
ществ, увеличивается распад гликогена и липи-
рода в митохондриях и способствовать развитию
дов, повышается содержание глюкозы и жирных
окислительного стресса [23]. Изменения функци-
кислот в крови [18].
ональной активности комплексов ЭТЦ могут иг-
Дрожь, возникающая при снижении темпера-
рать немаловажную роль в развитии у гомойо-
туры ниже 35.5°С и прекращающаяся при темпе-
термных животных как компенсаторно-приспо-
БИОФИЗИКА том 67
№ 6
2022
АКТИВНОСТЬ И КАТАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
1169
собительных, так и патологических реакций при
Повышение KM для СДГ является свидетель-
низких температурах тела.
ством того, что насыщение фермента субстратом
происходит при более высоких концентрациях,
Результаты нашего исследования свидетель-
что увеличивает возможности регуляции актив-
ствуют о том, что снижение температуры тела
ности фермента в широком диапазоне концен-
крыс сопровождается значительными изменени-
ями как в активности, так и в кинетических ха-
траций сукцината. С другой стороны, повышение
рактеристиках одного из ключевых компонентов
KM могло быть обусловлено хорошо описанным в
дыхательной цепи - сукцинат:убихинон-оксидо-
литературе конкурентным ингибированием ак-
редуктазы. Умеренная гипотермия уже в первые
тивности СДГ оксалоацетатом. Однако, учитывая
30 мин снижения температуры тела способствует
тот факт, что изменения значения KM при гипо-
повышению скорости катализа СДГ при всех ис-
термии не носит драматический характер, а также
следованных концентрациях субстрата, причем
то, что наряду с повышением KM активность СДГ
это повышение по мере пролонгирования гипо-
и значения Vmax тоже увеличивается, вероятность
термического состояния становится более суще-
конкурентного ингибирования СДГ оксалоацета-
ственным. Особый интерес представляют серьез-
том можно исключить. Возможно на начальных
ные изменения характера концентрационной за-
этапах снижения температуры тела, интенсифи-
висимости СДГ. Если у контрольных крыс
кация дыхания митохондрий in vivo, приводит к
наблюдается сигмоидальный характер зависимо-
накоплению оксалоацетата, ингибирующего СДГ
сти от концентрации субстрата, то в динамике
до тех пор, пока концентрации сукцината не до-
пролонгирования гипотермии кооперативная ки-
стигнут достаточно высоких уровней. С этой точ-
нетика связывания субстрата становится менее
ки зрения повышение KM для СДГ при гипотер-
выраженной.
мии может иметь биологический смысл: оно поз-
Известно, что комплекс СДГ имеет сложную
волит увеличить концентрации субстрата, при
структуру и состоит из четырех субъединиц,
которых фермент работает с максимальной эф-
включая две гидрофильные субъединицы
-
фективностью, и тем самым снять ингибирую-
СДГ-A и СДГ-B, которые вместе образуют ката-
щий эффект оксалоацетата. Известно, что значе-
литический центр энзима, и две гидрофобные
ния KM приблизительно соответствуют физиоло-
субъединицы - СДГ-C и СДГ-D [10]. Основная
гическим концентрациям субстрата в клетке или
функция СДГ-A заключается в превращении сук-
ее компартментах [24].
цината в фумарат и преобразовании ФАД в
Исходя из полученных нами эксперименталь-
ФАДН2. Электроны ФАДН2 передаются субъ-
ных данных можно предположить, что при гипо-
единице СДГ-B. СДГ-B содержит три железо-
термии содержание сукцината в митохондриях
серных кофактора, через которые опосредуется
существенно увеличивается. Действительно, бы-
транспорт электронов от СДГ-A к СДГ-C и
ло обнаружено, что у гомойотермных животных в
СДГ-D и, в конечном счете, к убихинону [10]. Та-
период воздействия низких температур окружаю-
ким образом, механизм катализа СДГ и передачи
щей среды уровень циркулирующего сукцината
электронов на убихинон достаточно сложный и
значительно возрастает [25]. Скорее всего, такое
определяется функциональным состоянием и
повышение является отражением усиленного ка-
взаимодействием нескольких его субъединиц.
таболизма липидов и углеводов на начальных эта-
Изменения активности СДГ происходят за
пах гипотермии.
счет изменения его каталитических параметров -
Кроме этого, накопление сукцината в мито-
Vmax и KM. Мы обнаружили достаточно выражен-
хондриях может происходить вследствие дефици-
ные однонаправленные изменения как со сторо-
та кислорода в клетке. Так, было показано, что
ны KM, так и со стороны Vmax. Обе величины в
при ишемии и гипоксии в митохондриях увели-
разной степени увеличиваются. При этом повы-
чивается концентрация фумарата, что способ-
шение Vmax положительно коррелирует с повы-
ствует обращению реакции, катализируемой
шением активности СДГ (r = 0.90, p < 0.05), в от-
комплексом II, в сторону образования сукцината.
личие от значений KM, корреляционные связи
Такая реверсия становится возможной благодаря
которой со скоростью катализа СДГ незначитель-
тому, что комплекс I регенерирует восстановлен-
ны и статистически недостоверны (r = 0.30,
ный убихинон, необходимый для поддержания
p > 0.05). Таким образом, основной вклад в повы-
обратной реакции (превращения фумарата в сук-
шение эффективности катализа СДГ при гипо-
цинат) [26].
термии вносят именно изменения Vmax, а не KM.
Vmax - это величина, которая зависит от кон-
Можно предположить, что повышение KM СДГ
центрации фермента и от числа его оборотов
при гипотермии посредством снижения аффин-
(kcat). Повышение концентрации фермента воз-
ности субстрата к активному центру фермента на-
можно либо вследствие интенсификации процес-
правлено на компенсацию резких скачков Vmax.
сов его биосинтеза, либо из-за снижения скоро-
БИОФИЗИКА том 67
№ 6
2022
1170
ХАЛИЛОВ и др.
сти его деградации. Одним из первичных тран-
вания СДГА, является SIRT3 - представитель
скрипционных регуляторов митохондриального
сиртуинового семейства НАДФ-зависимых деа-
биогенеза является респираторный фактор-1
цетилаз митохондрий [35].
(NRF-1), который индуцирует экспрессию СДГ
Было обнаружено, что в фосфорилировании
посредством связывания с промоторами генов
СДГ принимает участие тирозинкиназа FGR, ко-
SDH-A и SDH-D [27].
торая является одной из киназ, нацеленных на
Однако в условиях низких температур тела
аминокислотные остатки тирозина Y535 и Y596
скорости всех энергоемких процессов, к которым
СДГ-A у крыс [36]. Впоследствии было установ-
относится и биосинтез белка, сильно снижаются
лено, что АФК опосредуют активацию тирозин-
[28]. Кроме того временные рамки гипотермии
киназы FGR, которая фосфорилирует СДГA по
ограничены и учитывая то, что биосинтез белка
Y604, и что эта функция FGR требуется для кор-
является слишком инерционным механизмом, за
ректировки метаболизма в различных условиях,
столь короткий период достижения гипотермиче-
таких как гипоксия/реоксигенация и активация
ского состояния (30 мин) быстрое увеличение
Т-клеток [37]. В митохондриях была обнаружена
концентрации СДГ за счет высоких скоростей
растворимая аденилатциклаза, которая может ак-
процессов транскрипции и трансляции представ-
тивироваться путем изменения содержания АТФ,
ляется сомнительным. Было показано, что при
ионов кальция и бикарбоната. Такая активация
трехчасовой гипотермии, вызванной анестезией,
может стимулировать внутримитохондриальную
в печени происходит снижение экспрессии цело-
протеинкиназу A, которая способна фосфорили-
го ряда белков, связанных с синтезом АТФ, элек-
ровать многие белки ЭТЦ, изменяя их активность
трон-транспортной цепью и биосинтезом моче-
[38].
вины, а также экспрессии шаперонов Hspa 5,
Hsp90b1, Pdia3, Dnajb11
[29]. Следует также
Митохондрии также содержат фосфатазы, ко-
учесть, что в отличие от других комплексов дыха-
торые действуют в обратном направлении по от-
тельной цепи ни одна из субъединиц комплекса II
ношению к киназам. то есть осуществляют де-
не кодируется митохондриальной ДНК [30]. По-
фосфорилирование СДГ-А. Примером этого яв-
этому ко времени и энергоемкости биосинтеза
ляется PTEN-подобная митохондриальная
отдельных субъединиц СДГ и их последующей
фосфатаза-1 - фермент, дефосфорилирующий
сборки добавляется время и энергоемкость их
фосфатидилглицеролфосфат (в пути биогенеза
транспорта в митохондрии и последующей
кардиолипина) [39], а также СДГ-A. Его нгибиро-
сборки.
вание приводит к усилению фосфорилирования и
активации СДГ и, как следствие, к снижению
Вместе с тем имеется ряд работ, в которых по-
концентрации глюкозы [40].
казано, что низкие температуры индуцируют
синтез небольшого подмножества белков холодо-
Сукцинилирование является недавно откры-
вого шока, таких как индуцируемый холодом
той посттрансляционной модификацией, кото-
РНК-связывающий белок (CIRP) и мотив 3 холо-
рая превращает катионную боковую цепь лизина
доиндуцируемого РНК-связывающего белка
в анион с различными последствиями для струк-
(RBM3)
[31-33], и увеличивают экспрессию
туры и функции белка. Десукцинилирование Lys
мРНК белка теплового шока hsp72 [34]. Таким
в клетках млекопитающих и бактерий осуществ-
образом, гипотермия способствует повышенной
ляется с помощью SIRT5 (глобальный регулятор
экспрессии лишь ограниченного числа «стрес-
сукцинилирования Lys в митохондриях) [27].
сорных» белков, при этом биосинтез большин-
Изменения кинетических параметров СДГ
ства других белков остается подавленным. Отсю-
при гипотермии могут быть связаны и окисли-
да следует, что обнаруженные изменения Vmax
тельной модификацией аминокислотных остат-
связаны с реализацией других механизмов регу-
ков фермента посредством АФК. Многочислен-
ляции, направленными на повышение числа обо-
ные литературные данные свидетельствуют о том,
ротов СДГ (kcat).
что начальные этапы гипотермии сопровождают-
Срочная регуляция, следы которой остаются in
ся интенсификацией свободно-радикальных
vitro, скорее всего, осуществляется посредством
процессов в различных тканях животных [6, 8,
посттрансляционной модификации фермента.
14]. Обнаружено, что кратковременная гипотер-
Посттрансляционные модификации регулируют
мия увеличивает уровни карбонильных групп в
активность СДГ четырьмя способами: деацетили-
белках мембран митохондрий печени, при этом
рование фосфорилирование, сукцинилирование
содержание тиоловых групп значительно снижа-
и пропионилирование [27]. Обратимое ацетили-
ются. Кроме того, снижается интенсивность соб-
рование множественных остатках лизина СДГ-А
ственной флуоресценции мембранных белков
в митохондриях млекопитающих ослабляет ее ка-
митохондрий, что указывает на окисление в них
талитическую активность. При этом основной
остатков ароматических аминокислот. Обнару-
деацетилазой, регулирующей уровень ацетилиро-
жены изменения и в спектрах флуоресценции
БИОФИЗИКА том 67
№ 6
2022
АКТИВНОСТЬ И КАТАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
1171
белков, которые могут свидетельствовать об их
субстратов для ремоделирования мембраны могут
конформационных перестройках [14].
использоваться ненасыщенных жирные кислоты,
содержание которых в крови гипотермированных
Известно, что сукцинат-связывающий уча-
животных увеличивается [46]. Быстрые измене-
сток СДГ-A и убихинон-связывающий участок,
ния индекса ненасышенности мембранных дипи-
сформированный Гис207 субъединицы В, Сер27
дов могут быть связаны и с активностью фермен-
и Арг31 субъединицы C и Тир83 субъединицы D,
тов десатураз, играющих важную роль в темпера-
взаимодействуют между собой с помощью Fe/S
турных адаптациях не только пойкилотермных,
участков СДГ-B [41]. Все эти аминокислотные
но и, как показала работа [46], гомойотермных
остатки могут оказаться чувствительны к АФК,
животных.
особенно Сер27, и их модификация может суще-
ственно изменить эффективность катализа СДГ.
Перестройки в липидной матрице также могут
При этом следует отметить, что уровень маркеров
быть связаны с окислительной модификацией
окислительной модификации белков при проло-
мембранных фосфолипидов. Ранее нами было
нировании гипотермии в течение 1 ч продолжает
установлено, что кратковременная умеренная ги-
увеличивается, однако через 3 ч происходит его
потермия стимулирует перекисное окисление ли-
нормализация [14]. В то же время результаты на-
пидов в митохондриях [14]. Известно, что про-
стоящего исследования показали, что активность
цессы обновления фосфолипидов могут уско-
СДГ в динамике пролонгирования гипотермии
ряться после их окислительной модификации, в
продолжает расти.
результате чего окисленные ацильные цепи быст-
ро удаляются из фосфолипидов мембран под дей-
Поскольку субъединицы СДГ-C и СДГ-D
ствием фосфолипазы А2 [47].
фермента погружены в липидный бислой внут-
ренней мембраны митохондрий, то изменения
Таким образом, повышение эффективности
структурно-динамического состояния липидной
катализа СДГ при гипотермии вполне могло бы
матрицы также могут оказать существенный эф-
объясняться снижением вязкости общих и анну-
фект на активность СДГ. Ранее, при исследова-
лярных липидов внутренней мембраны митохон-
нии мембран митохондрий с помощью флуорес-
дрий. Однако в соответствии с эксперименталь-
центного зонда пирена, нами было обнаружено,
ными данными, представленными в предыдущем
что кратковременная умеренная гипотермия и ее
исследовании [42], в динамике пролонгирования
пролонгирование увеличивают коэффициент эк-
гипотермии дальнейших изменений показателей
симеризации пирена в анулярных и общих липи-
микровязкости не происходит, а интенсивность
дах митохондриальных мембран, что указывает
перекисного окисления липидов и вовсе норма-
на снижении их микровязкости [42]. Обнаружен-
лизуется [14], в то время как в настоящей работе
ные изменения физического состояния мембран-
активность СДГ продолжает увеличиваться.
ных липидов, скорее всего, обусловлены ремоде-
Особый интерес представляет исследование
лированием их жирнокислотного состава. По
температурной зависимости СДГ. Обнаружено,
данным работы [43], при снижении температуры
что она носит нелинейный характер, то есть в ко-
тела до 28-27°С происходят изменения фосфоли-
ординатах Аррениуса представлена двумя пересе-
пидного спектра и содержания полиненасыщен-
кающимися в точке излома прямыми, имеющи-
ных жирных кислот в липидах митохондрий мио-
ми различные энергии активации. Это может
карда белых крыс и собак. Повышение степени
быть обусловлено несколькими причинами: фа-
ненасыщенности мембранных липидов при уме-
зовыми переходами в отдельных субъединицах
ренной гипотермии приводит к снижению их
СДГ или ее липидном микроокружении, сменой
микровязкости и сдвигу фазового перехода в об-
лимитирующей катализ стадии, ассоциацией-
ласть низких температур [43].
диссоциацией субъединиц СДГ в определенном
К сожалению, в доступной нам более совре-
температурном диапазоне или изменением ха-
менной литературе мы не обнаружили какую-ли-
рактера взаимодействий комплекса II с другими
бо новую информацию о влиянии гипотермии на
компонентами ЭТЦ.
липидный состав митохондриальных мембран го-
Известно, что внутренняя мембрана митохон-
мойотермных животных. При этом имеются ра-
дрий характеризуется необычно высоким содер-
боты, в которых показано, что умеренная гипо-
жанием белков (до 75%). Основная часть этих
термия и ее пролонгирование изменяют ЖК со-
белков - белки, входящие в комплексы ЭТЦ. Бы-
став липидов синаптических и эритроцитарных
ло обнаружено, что комплексы при определен-
мембран в направлении повышении степени их
ных условиях могут интегрироваться в так назы-
ненасыщенности [44, 45].
ваемые суперкомплексы, образование которых
Вероятнее всего, в митохондриях при гипотер-
сопряжено с наиболее эффективным окислитель-
мии происходит включение механизмов ремоде-
ным фосфорилированием. В частности, было по-
лирования мембранных фосфолипидов путем их
казано, что суперкомплексы в митохондриях пе-
деацилирования и реацилирования. В качестве
чени крыс образуются в области температуры
БИОФИЗИКА том 67
№ 6
2022
1172
ХАЛИЛОВ и др.
19°С, при этом электронная микроскопия демон-
ние скорости катализа СДГ, скорее всего, незна-
стрирует изменение морфологии крист с образо-
чителен.
ванием, так называемых, «сухих крист» [48]. Эта
Объяснение данному факту можно дать исходя
температура примерно соответствует температуре
из элементарных представлений химической ки-
точки излома на графике температурной зависи-
нетики, если обратиться к уравнению Эйринга.
мости СДГ печени крыс, представленном в на-
Согласно данному уравнению скорость химиче-
шем исследовании. Следовательно, нелинейный
ского процесса определяется изменением его
характер температурной зависимости СДГ может
свободной энергии:
быть обусловлен температурной зависимостью
работы ЭТЦ митохондрий в режиме суперком-
k
B
T
k
=
exp(-ΔG
*/RT),
(5)
плекса.
h
Известно, что СДГ может быть очень чувстви-
где k - константа скорости реакции, kB - кон-
тельна к фазовым переходам в липидах внутрен-
станта Больцмана, h - постоянная Планка, ΔG* -
ней мембраны митохондрий [49], поэтому точка
свободная энергия активации.
излома на графиках Аррениуса может соответ-
Изменение свободной энергии активации
ствовать температуре фазового перехода липид-
(ΔG) химической реакции можно вычислить по
ной матрицы митохондриальной мембраны
следующей формуле:
Кратковременная гипотермия и ее пролонги-
ΔG = ΔH - TΔS.
(6)
рование смещают точку излома температурной
кривой в более низкотемпературную область -
Из формулы видно, что вклад в изменение ΔG
15°С. Такое смещение очень хорошо коррелирует
вносит как ΔH, так и энтропия активации - ΔS.
с нашими ранними данными о том, что гипотер-
Исходя из вышеприведенных предположений,
мия снижает вязкость общих и аннулярных липи-
повышение скорости катализа СДГ может быть
дов митохондриальных мембран [42], что, вероят-
обусловлено более значимым вкладом энтропий-
нее всего, обусловлено изменением их жирно-
ного фактора в снижение свободной энергии ак-
кислотного состава в сторону повышения
тивации ферментативной реакции. Возможно,
индекса ненасыщенности. Повышение текучести
что при гипотермии структурно-динамические
мембраны способствует тому, что фазовые пере-
изменения в молекуле СДГ или ее окружении
ходы аннулярных липидов, в которые погружены
способствуют существенному повышению эн-
гидрофобные субъединицы СДГ, происходят при
тропии активации СДГ, что позволяет снизить
более низких температурах. Однако нельзя ис-
ΔG СДГ и тем самым, существенно повысить ско-
ключать возможности того, что при гипотермии
рость ее катализа. Повышение ΔS, скорее всего,
происходят изменения в условиях работы мито-
тесно связано с изменениями в липидной под-
хондрий в режиме суперкомплекса.
ложке фермента и повышением его конформаци-
Особое внимание заслуживает тот факт, что
онной подвижности. Оно направлено на компен-
при кратковременной гипотермии и в динамике
сацию воздействия на фермент низкотемператур-
ее пролонгирования эффективные энергии акти-
ного фактора.
вации и энтальпии активации ниже точки излома
Имеет ли повышение активности СДГ при ги-
снижаются, достигая минимальных значений
потермии биологическую значимость или явля-
при трехчасовой гипотермии.
ется отражением патологических процессов, про-
Известно, что константа скорости химической
исходящих в митохондриях на уровне ЭТЦ?
реакции зависит от ее энергии активации в соот-
Известно, что в условиях нормоксии в интакт-
ветствии с уравнением Аррениуса:
ных митохондриях основной вклад в работу дыха-
-ΔEa
тельной цепи вносит комплекс I ЭТЦ, окисляю-
RT
щий НАД-зависимые субстраты. Только 25-30%
k
=
k
⋅ e
(4)
0
митохондриального дыхания в этих условиях свя-
Таким образом, чем ниже энергия активации,
зано с комплексом II и окислением сукцината,
тем больше скорость катализа.
содержание которого в матриксе митохондрий
невелико [50]. В условиях гипоксии происходят
Корреляционный анализ показал, что между
изменения работы дыхательной цепи: обратимое
Еа1, ΔНа1 и эффективностью катализа СДГ име-
подавление функции комплекса I и компенсатор-
ется отрицательная корреляция (r
= -0.99,
ная активация комплекса II. При этом резко воз-
P < 0.05). При этом следует отметить, что измене-
растают содержание сукцината в крови и тканях
ния скорость катализа СДГ при гипотермии име-
[51] и вклад сукцинатоксидазного окисления в
ют более резкий и существенный характер по
общее дыхание. Дыхание на сукцинате может до-
сравнению с энергией и энтальпией активации.
стигать 70-80% [50].
Более того, изменения термодинамических пара-
метров Еа2, ΔНа2 и вовсе незначительны. Следо-
Переход на преимущественное окисление сук-
вательно, вклад энтальпии активации в повыше-
цината представляет собой один из механизмов
БИОФИЗИКА том 67
№ 6
2022
АКТИВНОСТЬ И КАТАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
1173
повышения устойчивости клетки к гипоксии. Ли-
первого комплекса происходит деполяризация
митирующими факторами при этом являются на-
внутренней мембраны митохондрий, сопровож-
личие достаточного количества сукцината и ак-
дающаяся тяжелыми нарушениями трансмем-
тивность сукцинатдегидрогеназы. Было показа-
бранного транспорта, что, в конечном счете, мо-
но, что содержание сукцината в первые 30 мин
жет явиться причиной гибели клетки [57].
гипоксии возрастает на порядок, достигая 4-
Поскольку, многие исследования указывают
7 ммоль/л [52]. Одновременно при гипоксии на-
на высокую вероятность развития гипоксии на
блюдается активация сукцинатдегидрогеназы и
ранних этапах индукции гипотермического со-
сукцинатоксидазного окисления, а также увели-
стояния, то повышение эффективности катализа
чение вклада последнего в дыхание и синтез
СДГ за счет Vmах, скорее всего, является одним из
энергии [53].
компенсаторно-приспособительных механизмов
По мнению некоторых авторов, переход на
развития адаптации к условиям дефицита кисло-
преимущественное окисление сукцината в усло-
рода в митохондриях. Повышение KM для СДГ,
виях гипоксии, возможно связан с тем, что наи-
обнаруженное нами на начальных этапах разви-
более удаленные от кислорода пиридиннуклеоти-
тия гипотермического состояния, может указы-
ды - НАД и НАДФ, как правило, восстановлены
вать на то, что фермент при гипотермии функци-
на 100%, тогда как часть флавопротеидов и цито-
онирует в условиях высокого содержания сукци-
хромный участок дыхательной цепи остаются в
ната.
значительной мере окисленными. Такие разли-
В последние годы внимание многих исследо-
чия в степени восстановленности пиридиннук-
вателей привлекает участие СДГ в генерации
леотидов и флавопротеидов в условиях гипоксии
АФК в митохондриях. Первоначально основны-
создают возможность для преимущественного
ми источниками митохондриальных АФК счита-
окисления янтарной кислоты, поскольку, сукци-
лись дыхательные комплексы I и III, а вклад ком-
натдегидрогеназа в отличие от большинства дру-
плекса II игнорировался. Выявление мутаций в
гих дегидрогеназ является флавинзависимым
комплексе II, приводящих к увеличению продук-
ферментом [54].
ции АФК при различных заболеваниях, и доказа-
Предположено, что переключение путей окис-
тельства того факта, что он играет решающую
ления субстратов дыхательной цепи от НАД-за-
роль в продукции АФК посредством обратного
висимого на сукцинатоксидазный является эво-
переноса электронов через комплекс I, демон-
люционно сформированным срочным механиз-
стрируют значительный вклад комплекс II в гене-
мом адаптации к гипоксии, который снижает
рацию АФК, который имеет важные физиологи-
характерные для гипоксии нарушения синтеза
ческие или патологические последствия [11].
АТФ и способствует устранению гипоксического
Было показано, что во время ишемии и гипо-
ацидоза. Репрограммирование работы субстрат-
ксии в митохондриях происходит накопление
ного участка дыхательной цепи при гипоксии
сукцината до тех пор, пока не будет исчерпан ис-
происходит очень быстро. Было показано, что из-
точник фумарата или не начнется реперфузия, во
менения кинетических показателей основных
время которой комплекс II метаболизирует до-
ферментов Комплексов I и II наблюдаются уже
ступный сукцинат с образованием убихинона,
через 30 мин после самых различных гипоксиче-
что приводит к гиперполяризации внутренней
ских воздействий [55].
митохондриальной мембраны
[58]. Сочетание
высоких уровней убихинона и гиперполяризо-
Феномен активного окисления янтарной кис-
ванного мембранного потенциала «заставляет»
лоты сукцинатдегидрогеназой получил название
комплекс I входить в так называемое состояние
«монополизации дыхательной цепи», биологиче-
обратного переноса электронов и продуцировать
ское значение которого заключается в быстром
АФК с чрезвычайно высокой скоростью [26]. Та-
ресинтезе АТФ клетками и повышении их анти-
ким образом, накопление сукцината в митохон-
оксидантной активности [56]. Это важно в усло-
дриях, может стать ключевым фактором ишеми-
виях гипоксии, когда развивается дефицит НАД-
чески-реперфузионного повреждения [26]. Мож-
зависимых субстратов, приводящий к наруше-
но предположить, что высокая активность СДГ
нию функционирования первого комплекса ми-
при гипотермии предотвращает накопление сук-
тохондриальной дыхательной цепи. В этой пато-
цината в митохондриях и снижает продукцию
логической ситуации янтарная кислота «постав-
АФК посредством обратного переноса электро-
ляет» электроны непосредственно на комплекс II
нов, оказывая тем самым протекторный эффект.
дыхательной цепи, восстанавливая электрохими-
ческий градиент на митохондриальной мембране
Таким образом, результаты нашего исследова-
и обеспечивая тем самым «бесперебойную» рабо-
ния свидетельствует в пользу предположения о
ту митохондрий, что поддерживает уровень и
возможном переключении окисления субстратов
адекватность энергетического обеспечения клет-
дыхательной цепи от НАД-зависимого на сукци-
ки. В противном случае при ингибировании
натоксидазный путь, которое происходит уже на
БИОФИЗИКА том 67
№ 6
2022
1174
ХАЛИЛОВ и др.
начальных этапах гипотермии и становится более
6.
N. Alva, J. Palomeque, and T. Carbonell, Oxidative
выраженным в динамике ее пролонгирования.
Medicine and Cellular Longevity, 2013, 10 (2013).
Это переключение обусловлено изменениями в
7.
Л. В. Усенко и А. В. Царев, Общая реаниматоло-
каталитических свойствах СДГ, увеличивающи-
гия, 5 (1), 21 (2009).
ми ее активность, и является срочным регулятор-
8.
Э. З. Эмирбеков и Н. К. Кличханов, Свободноради-
ным и компенсаторным механизмом адаптации,
кальные процессы и состояние мембран при гипотер-
который реализуется в условиях дефицита кисло-
мии (ЮФУ, Ростов-на-Дону, 2011).
рода в печени, а возможно и в других органах. Та-
9.
V. V. Zinchuk and S. V. Hlutkin, Asian J. Pharmacy,
кая модуляция активности СДГ, обеспечивает со-
Nursing and Med. Sci., 3 (2), 55 (2015).
хранение энергосинтезирующей функции дыха-
тельной цепи при нарушении кислородного
10.
V. Yankovskaya, R. Horsefield, S. Törnroth, et al., Sci-
гомеостаза и снижает скорости генерации в них
ence, 299, 700 (2003).
АФК. Действительно, ранее нами было обнару-
11.
K. H. Vanova, M. Kraus, J. Neuzil, and J. Rohlena,
жено, что в динамике пролонгирования гипотер-
Redox Rep., 25 (1), 26 (2020).
мии происходит нормализация ряда биоэнерге-
12.
В. В. Афанасьев, Е. Р. Баранцевич и Т. П. Вишне-
тических параметров митохондрий (скорости
вецкая, Азбука нейроцитопротекции (Изд. дом
фосфорилирования, значений коэффициента
«СТЕЛЛА», С-Пб., 2016).
окислительного фосфорилирования и дыхатель-
13.
Р. А. Халилов, С. И. Хизриева, А. М. Джафарова и
ного контроля) [13], а также интенсивности в них
В. Р. Абдуллаев, Бюл. эксперим. биологии и меди-
свободно-радикальных процессов [14]. Все эти
цины, 169 (1), 33 (2020).
данные в совокупности указывают на активацию
14.
Р. А. Халилов, А. М. Джафарова, С. И. Хизриева и
у гомойотермных животных при длительном воз-
В. Р. Абдуллаев, Цитология, 91 (7), 536 (2019).
действии низких температур эволюционно сфор-
мированных компенсаторных механизмов, спо-
15.
D. H. Lowry, J. Biol. Chem., 193, 265 (1951).
собствующих повышению неспецифической ре-
16.
М. И. Прохорова, Методы биохимических исследо-
зистентности организма к экстремальным
ваний (липидный и энергетический обмен) (Изд-во
факторам окружающей среды.
ЛГУ, Л., 1982).
17.
М. Т. Д. Маяхи и Н. К. Кличханов, Изв. Самарско-
го науч. центра РАН, 14, 273 (2012).
ФИНАНСИРОВАНИЕ РАБОТЫ
18.
Н. Г. Волжина, Дис
д-ра биол. наук (Ростовский
Работа выполнена в рамках Госзадания
гос. ун-т, Ростов-на-Дону, 1992).
(FZNZ-2020-0002).
19.
M. E. Nunnally, R. Jaeschke, G. J. Bellingan, et al.,
Crit. Care Med., 39, 1113 (2011).
КОНФЛИКТ ИНТЕРЕСОВ
20.
D. Danzl, in Auerbach PS, ed. Wilderness medicine. 6th
Авторы заявляют об отсутствии конфликта
edn. (Elsevier, Philadelphia, 2012), pp. 116-142.
интересов.
21.
O. Karcioglu and N. Koyuncu, Vasc. Med. Surg. 6 (1),
1 (2018).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
22.
N. Alva, T. Carbonell, and J. Palomeque, J. Thermal
Biol., 29, 259 (2004).
В ходе исследования были соблюдены все нор-
23.
В. П. Скулачев, А. В. Богачев и Ф. О. Каспарин-
мы и правила выполнения экспериментальных
ский, Мембранная биоэнергетика (МГУ, М., 2012).
работ с использованием лабораторных животных
(Директива
2010/63/EU Совета Европейского
24.
P. Hochachka and G. Somero, Biochemical adaptation
Сообщества по защите животных, используемых
(Oxford University Press, Oxford, 2002).
в экспериментальных и других научных целях).
25.
E. L. Mills, K. A. Pierce, M. P. Jedrychowski, et al.,
Nature, 560, 102 (2018).
26.
E. T. Chouchani, V. R. Pell, E. Gaude, et al., Nature,
СПИСОК ЛИТЕРАТУРЫ
515 (7527), 431 (2014).
1. D. Brown, H. Brugger, and J. Boyd, N. Engl. J. Med.,
27.
B. Moosavi, X. Zhu, W.-C. Yang, and G.-F. Yang, Biol.
367, 1930 (2012).
Chem., 401 (3), 319 (2020).
2. Z. Sun, J. E. Dalton, D. Yang, et al., Anesthesiology,
28.
M. Erecinska, M. Thoresen, and I. A. Silver, J. Cereb.
122 (2), 276 (2015).
Blood Flow Metab., 23, 513 (2003).
3. X. N. Tang and M. A. Yenari, Ageing Res. Rev., 9 (1),
61 (2010).
29.
T. Oda, K. Shimizu, A. Yamaguchi, et al., Cryobiology,
65, 104 (2012).
4. K. Søreide, Injury, 45 (4), 647 (2014).
30.
G. Cecchini, Annu. Rev. Biochem., 72, 77 (2003).
5. M. Andresen, J. T. Gazmuri, A. Marín., et al., Scand.
J. of Trauma, Resuscitation and Emergency Medicine
31.
G. Tong, S. Endersfelder, L. M. Rosenthal, et al., Brain
23 (1), 2 (2015).
Res., 1504, 74 (2013).
БИОФИЗИКА том 67
№ 6
2022
АКТИВНОСТЬ И КАТАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
1175
32. H. K. Hsu, P. L. Shao, K. L.Tsai, et al., J. Mol. Endo-
46. S. Gonzalez, A. M. Nervi, R. O. Peluffo, and
crinol., 34 (2), 433 (2005).
R. R. Brenner, Lipids, 18, 7 (1983).
33. D. Wang and J. Zhang, Mol. Med. Rep., 11, 1759
47. J. J. Van den Berg, J. A. Op den Kamp, and B. H. Lu-
(2015).
bin, Biochemistry, 32, 4962 (1993).
34. K. E. Cullen and K. D. Sarge, J. Biol. Chem., 272 (3),
48. Л. С. Ягужинский, Ю. А. Скоробогатова и
1742 (1997).
С. В. Нестеров, Биофизика, 62 (3), 518 (2017).
35. N. I. Fedotcheva, M. N. Kondrashova, E. G. Litvino-
49. J. Rutter, D. R. Winge, and J. D. Schiffman, Mito-
va, et al., Biophysics, 63, 743 (2018).
chondrion, 10 (4), 393 (2010).
36. M. Salvi, N. A. Morrice, and A. M. Brunati, FEBS
50. L. D. Lukyanova, E. L. Germanova, Y. I. Kirova, in
Lett., 581, 5579 (2007).
The Adaptation Biology and Medicine. Cell Adaptations
and Challenges, Ed. by P. Wang, C. H. Kuo, N. Takeda,
37. R. Acin-Perez, I. Carrascoso, F. Baixauli, et al., Cell
and P. K. Singal (New York, 2011), pp. 251-277.
Metab. 19, 1020 (2014).
51. D. M. Stroka, T. Burkhardt, and I. Desballerts, FASEB
38. F. Valsecchi, et al., Physiology (Bethesda), 28, 199
J., 15, 2445 (2001).
(2013).
52. A. King, M. A. Selak, and E. Gottlieb, Oncogene, 25
39. A. Bezawork-Geleta, J. Rohlena, L. Dong, et al.,
(34), 4675 (2006).
Trends Biochem. Sci., 42, 312 (2017).
53. S. L. Vargas, I. Toma, J. J. Kang, et al., J. Amer. Soc.
40. A. K. Nath, J. H. Ryu, Y. N. Jin, et al., Cell Rep., 10,
Nephrol., 20, 1002 (2009).
694 (2015).
41. J. Rutter, D. R. Winge, and J. D. Schiffman, Mito-
54. Э. Ш. Абиева, Изв. НАН Азербайджана (сер. Био-
chondrion, 10 (4), 393 (2010).
логические и медицинские науки), 70, 55 (2015).
42. Р. А. Халилов, С. И. Хизриева, А. М. Джафарова и
55. Л. Д. Лукьянова, Фізіол. журн., 59 (6), 141 (2013).
В. Р. Абдулаев, Биол. мембраны, 5, 351 (2021).
56. А. В. Смирнов, О. Б. Нестерова, Р. В. Голубев и др.,
43. A. P. Shepelev, Biofizika, 23, 465 (1977).
Сукцинатсодержащие диализирующие растворы в
практике гемодиализа (Левша, С.-П., 2014).
44. А. М. Каландаров, З. И. Раджабова, С. А. Забелин-
ский и др., Журн. эволюц. биохимии и физиоло-
57. Е. В. Екушева, Эксперим. клинич. фармакология,
гии, 54 (2), 81 (2018).
81 (8), 37 (2018).
45. З. Г. Раджабова, С. А. Забелинскийa, М. А. Чебота-
58. J. N. Bazil, D. A. Beard, and K. C. Vinnakota, Biophys.
рева и др., Биол. мембраны, 37 (2), 134 (2020).
J., 110 (4), 962 (2016).
Activity and Catalytic Characteristics of Rat Liver Mitochondrial Succinate
Dehydrogenase at Moderate Hypothermia
R.A. Khalilov*, A.M. Dzhafarova*, and V.R. Abdulaev*
*Dagestan State University, ul. Gadjieva 43a, Makhachkala, Republic of Dagestan, 367000 Russia
Previously, it was shown in our study that short-term moderate hypothermia (30°C) contributes to a signifi-
cant increase in the intensity of free-radical processes and a change in a number of bioenergetics parameters
of mitochondria, and its prolongation for 3 hours leads to their normalization. The detected changes may be
associated with modulation of the activity and catalytic properties of succinate dehydrogenase. This study
show that moderate hypothermia, and especially prolonged exposure to a colder environment for 3 hours, sig-
nificantly increases the rate of succinate dehydrogenase catalysis and affects the nature of its concentration
and temperature dependences. Modulation of succinate dehydrogenase activity in the dynamics of hypother-
mia occurs due to changes in its kinetic and thermodynamic parameters, of which the maximum rate (Vmax)
makes the most significant contribution to the efficiency of enzyme catalysis. These changes may play an im-
portant role in maintaining the energy-synthesizing function of mitochondria and reducing the intensity of
free-radical processes in them.
Keywords: hypothermia, rats, mitochondria, succinate dehydrogenase, kinetic characteristics
БИОФИЗИКА том 67
№ 6
2022