БИОФИЗИКА, 2022, том 67, № 6, с. 1176-1184
БИОФИЗИКА КЛЕТКИ
УДК 577.3
АЛЬТЕРНАТИВНЫЕ ФОТОСЕНСИБИЛИЗАТОРЫ
ДЛЯ ФОТОХИМИОТЕРАПИИ НА ОСНОВЕ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ - ПРОИЗВОДНЫХ НИТРОФУРАНА
© 2022 г. Г.Ж. Парра*, Л.П. Феррейра**, Г.П. Борисевич***, Ю.Е. Борисевич***, #
*Instituto Butantan, Av. Vital Brasil, 1500 - Butantã, São Paulo 05503-900, Brazil
**Centro Universitário da Fundação Educacional de Barretos - UNIFEB, Av. Prof. Roberto Frade Monte,
389 - Aeroporto, Barretos - SP, 14783-226, Brazil
***Universidade de São Paulo, Campus Ribeirão Preto, Av. Bandeirantes, 3900, Ribeirão Preto, SP, 14040-901, Brazil
#E-mail: iourib@ffclrp.usp.br
Поступила в редакцию 26.08.2022 г.
После доработки 26.08.2022 г.
Принята к публикации 29.08.2022 г.
Фотохимиотерапия - в настоящее время метод лечения различных заболеваний, включая онколо-
гические, в форме фотодинамической терапии. В организм вводится фотосенсибилизатор, который
накапливается в больной ткани. Облучение видимым светом переводит накопленный фотосенси-
билизатор в электронно-возбужденные состояния, которые, взаимодействуя с кислородом, перево-
дят его в активные формы, разрушающие больные клетки. Однако энергия электронного возбужде-
ния может расходоваться путем флуоресценции и внутренней и интеркомбинационной конверсий.
Это ограничивает эффективность фотодинамической терапии, стимулируя поиск альтернативных
путей фотохимиотерапии, с использованием невозбужденных активных частиц, например, свобод-
ных радикалов. Среди свободных радикалов интересен радикал NO•, в малых концентрациях участ-
вующий во многих жизненно важных процессах, а в высоких концентрациях вызывающий гибель
клеток. Среди различных классов фотосенсибилизаторов, способных к фотовысвобождению NO•,
внимание привлекают производные нитрофурана. Представитель этого класса нитрофурантоин,
применяемый как лекарство в урологии, продемонстрировал высокую фотоактивность против ряда
раковых клеток и бактерий.
Ключевые слова: фотохимиотерапия, альтернативные механизмы, производные нитрофурана, фото-
высвобождение NO•, нитрофурантоин.
DOI: 10.31857/S000630292206014X, EDN: LKQTPP
Мне странно, когда кто-то называет себя ученым...
Кто такие эти «ученые»?
Я знаю только одного - «кота ученого»!
Л.А. Блюменфельд
Фундаментальная наука - штука, конечно, увлекательная.
Вон Милликен, к примеру, уйму времени потратил,
определяя заряд электрона. Но надо же помнить
и о больных и умирающих людях,которые ждут нашей помощи.
С.Э. Шноль
(из беседы со студентами-биофизиками)
Фотохимиотерапия - неинвазивная медицин-
ний, в настоящее время - в форме фотодинами-
ская технология, применяемая при лечении рака,
ческой терапии [1, 2]. Эта технология основана на
грибковых, бактериальных и вирусных заболева-
введении в организм пациента фотоактивного ве-
Сокращения: ФС - фотосенсибилизатор, НФТ - нитрофурантоин, MTT - 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетра-
золиум бромид, CTE - цитотоксический эффект (cytotoxic effect).
1176
АЛЬТЕРНАТИВНЫЕ ФОТОСЕНСИБИЛИЗАТОРЫ
1177
щества (фотосенсибилизатора, ФС), который на-
уже широко используются в медицине, главным
капливается в больной ткани, и последующем об-
образом как бактерицидные, противогрибковые
лучении этой ткани видимым светом. Поглоще-
и противовоспалительные препараты, механизм
ние квантов видимого света переводит
которых основан на высвобождении NO• в про-
накопленный ФС в электронно-возбужденные
цессе их метаболизма [11]. Кроме того, в отличие
синглетное и триплетное состояния, которые,
от применяемых в настоящее время ФС, они де-
взаимодействуя с молекулярным кислородом,
шевы и широкодоступны, что важно для их при-
формируют его активные состояния, такие как
менения особенно в ветеринарии.
синглетно-возбужденное состояние «синглетный
Интенсивная, главным образом желто-зеле-
кислород», анион супероксид и т. д., разрушаю-
ная окраска производных нитрофурана указывает
щие больные клетки в результате прямых или
на наличие оптического поглощения в видимой
вторичных реакций, в частности, цепных [1-3].
части спектра, что говорит о возможности их фо-
Преимуществами фотохимиотерапии по сравне-
тореакций при облучении видимым светом.
нию с классическими методами радио- и химио-
Ранее мы обнаружили высокую фотоактив-
терапии является отсутстувие негативных побоч-
ность бактерицидного препарата хинифурила
ных эффектов, поскольку, в отличие от химиоте-
против лейкемии мышей Р388 [12, 13] и установи-
рапевтических препаратов, ФС не являются
ли, что она обусловлена формированием при фо-
токсичными в невозбужденном состоянии, а ви-
товозбуждении трех активных частиц: радикала
димый свет также не представляет опасности для
NO•, синглетного кислорода и анион суперокси-
организма пациента. Привлекательной является
да [13].
также техническая простота метода. Надо отме-
тить, что в последнее время проводятся исследо-
Другим представителем этого класса является
вания по применению фотохимиотерапии в сель-
нитрофутантоин, который привлекает внимание
скохозяйственной ветеринарии с использовани-
из-за широкого променения в качестве лекар-
ем Солнца в качестве естественного источника
ственного препарата в урологии [14], а также в
видимого облучения.
сельском хозяйстве, как обеззараживающая до-
бавка к кормам селскохозяйственных животных
Однако эффективность фотохимиотерапии в
[15]. В наших исследованиях мы установили его
форме фотодинамической терапии ограничива-
высокую фотоактивность против ряда раковых
ется рядом факторов. Дело в том, что энергия
клеток и бактерий.
электронно-возбужденных состояний как ФС,
В данной статье мы представляем результаты
так и кислорода, кроме желательных реакций,
исследования фотоактивности нитрофурантоина
может расходоваться путем излучательной (флуо-
против клеток murine melanoma B16F10, а также
ресценция) и безызлучательной (внутренняя и
обсуждаем возможные механизмы его фотоак-
интеркомбинационная конверсия) релаксации
тивности.
[4]. Кроме того, для раковых тканей характерно
низкое содержание молекулярного кислорода,
что понижает вероятность его реакции с возбуж-
МАТЕРИАЛЫ И МЕТОДЫ
денными состояниями ФС. Эти факторы ограни-
В экспериментах был использован нитрофу-
чивают эффективность фотодинамической тера-
рантоин (НФТ, рис. 1) производства Sigma Chem-
пии, стимулируя поиск альтернативных путей
фотохимиотерапии, не требующих участия моле-
ical Co (США). НФТ плохо растворим в воде, по-
этому его исходный раствор приготовляли в ди-
кулярного кислорода и возбужденных состояний
метилсулфоксиде.
ФС. Одним из возможных путей может быть ис-
пользование в качестве активных частиц свобод-
Спектральные и фотофизические характери-
ных радикалов, высвобождаемых под действием
стики НФТ были исследованы в фосфатном бу-
видимого света.
фере при pH 7.2 и в этиловом спирте.
Среди свободных радикалов особый интерес
представляет нитроксильный радикал NO•, в
низких концентрациях участвующий во многих
жизненно важных процессах, а в высоких кон-
центрациях вызывающий гибель клеток [5-7].
Задача сводится к поиску ФС, высвобождающих
NO· под действием света [8-10]. Среди различных
ФС, возможных фотодоноров NO•, особое вни-
мание привлекают производные нитрофурана,
такие как фурацилин, нитрофурантоин, фуразо-
лидон, фуразидин, нифуроксазид, хинифурил.
Привлекательность этих веществ в том, что они
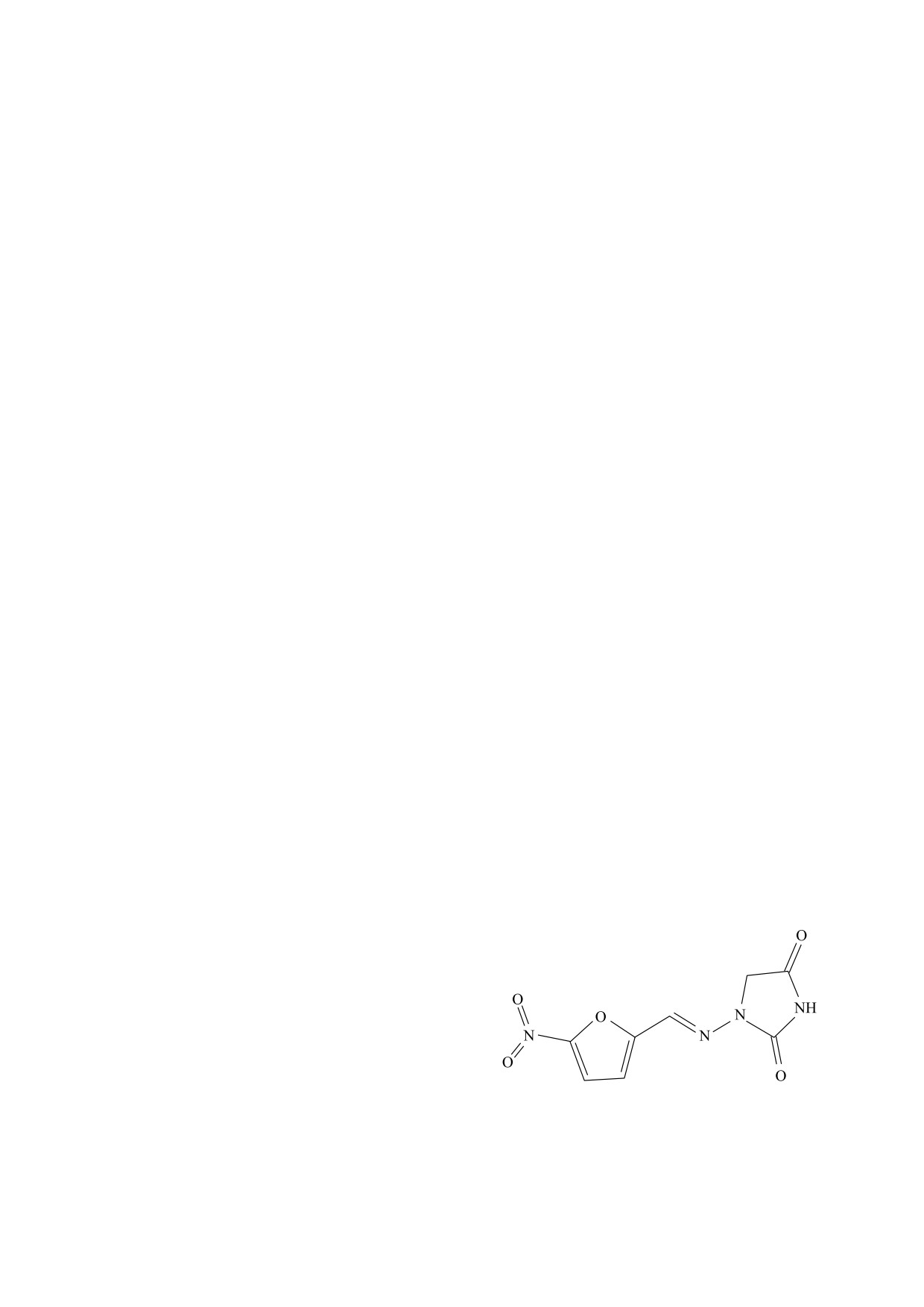
Рис. 1. Структурная формула нитрофурантоина.
БИОФИЗИКА том 67
№ 6
2022
1178
ПАРРА и др.
Кинетику формирования и диссипации нит-
а затем растворы сенсибилизатора удаляли и до-
роксильного радикала NO• и его квантовый вы-
бавляли свежую среду. Для экспериментов со све-
ход (ϕNO) определяли методом хемилюминесцен-
том была использована среда RPMI, свободная от
красного фенола, поскольку часть его спектра по-
ции [16].
глощения совпадает со спектром НФТ.
Детектирование синглетного кислорода осу-
ществляли путем регистрации во времени его
Определение фототоксичности. Для светового
фосфоресценции при λ = 1270 нм [17].
облучения культуры на подложках с 96 ячейками
Эксперименты с культурой клеток murine mela-
использовали источник из 96 светодиодов с дли-
noma B16F10. Методика экспериментов с культу-
ной волны излучения 385 нм, распределенных
рой клеток murine melanoma B16F10 детально опи-
равномерно по поверхности. Интенсивность све-
сана в работе [18]. Была использована культура
та измеряли радиометром USB4000 (Ocean Optics,
клеток из «American Type Culture Collection»
США), а время облучения выбирали так, чтобы
(Rockville, MD, США). Перед использованием в
получить дозы 2, 6 и 12 Дж/см2. Были проделаны
экспериментах с культурой клеток основной рас-
контрольные эксперименты, а именно: ячейки,
твор НФТ (21 мM в диметилсулфоксиде) был со-
содержащие клетки без сенсибилизатора и без об-
любилизирован в среде RPMI 1640 (Roswell Park
лучения (контроль 0); ячейки с клетками, обрабо-
Memorial Institute, США).
танные сенсибилизатором, но без облучения
Клетки выращивали в среде RPMI 1640 с фе-
(контроль 1); ячейки с облученными клетками
ноловым красным с добавкой 10% Fetal Calf Se-
без сенсибилизатора (контроль 2).
rum, глютамина и антибиотиков при 35°С во
Тест на выживание клеток был проделан с
влажной среде, содержащей 5% СО2 и 95% возду-
применением
3-(4,5-диметилтиазол-2-ил)-2,5-
ха. Все реагенты получены от Gibco-Invitrogen
дифенил-тетразолиум бромида (MTT) в соответ-
(Carlsbad, CA, США).
ствии с методикой, описанной Моссманом [19].
Осевшие клетки отмывали дважды в фосфат-
MTT добавляли к образцу после 24-часовой ин-
ном буфере, а затем диспергировали в трипсин-
кубации с НФТ в темноте или после облучения
ЭДТА (2.5 г/л, Sigma-Aldrich, США), центрифу-
светом. В каждую ячейку добавляли 200 мкл рас-
гировали при 1100 об/мин в течение 8 мин при
твора RPMI-MTT (0.5 мг/мл) и через 3 ч заменяли
10°С в полной среде и высевали. Клетки распре-
на 200 мкл диметилсулфоксида.
деляли на подложки с 96 ячейками по 0.2 мл сре-
Величину оптической плотности в ячейках
ды при плотности 2·104 клеток на каждую ячейку.
определяли при длине волны 492 нм с помощью
После 24 ч роста из ячеек удаляли среду и добав-
ляли свежую среду RPMI с различным содержа-
Thermoplate Reader. Цитотоксический эффект
нием НФТ (0.1-100 мкM). Клетки инкубировали,
(cytotoxic effect, CTE) рассчитывали по формуле:
Оптическое поглощение обработанных клеток
CTE(%)=1-
×100.
Оптическое поглощение необработанных клеток
Летальные концентрации НФТ в темноте
Во всех флуоресцентных экспериментах клетки
(IC50) и при световом облучении (LD50) опреде-
выращивали в чашках Петри и тщательно промы-
ляли из зависимости СТЕ от концентрации НФТ.
вали после инкубации и перед экспериментами.
Все результаты представлены как средние по
3 экспериментам величины СТЕ с ошибкой, по-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
лученные для 18 индивидуальных ячеек.
Спектральные и фотофизические характеристи-
Проникновение НФТ в клетки, его внутрикле-
ки НФТ. Спектральные и фотофизические харак-
точная локализация и определение внутриклеточ-
теристики НФТ были впервые детально изучены
ного NO· с помощью флуоресцентной микроскопии.
в работе [21].
Эксперименты были проведены с помощью мик-
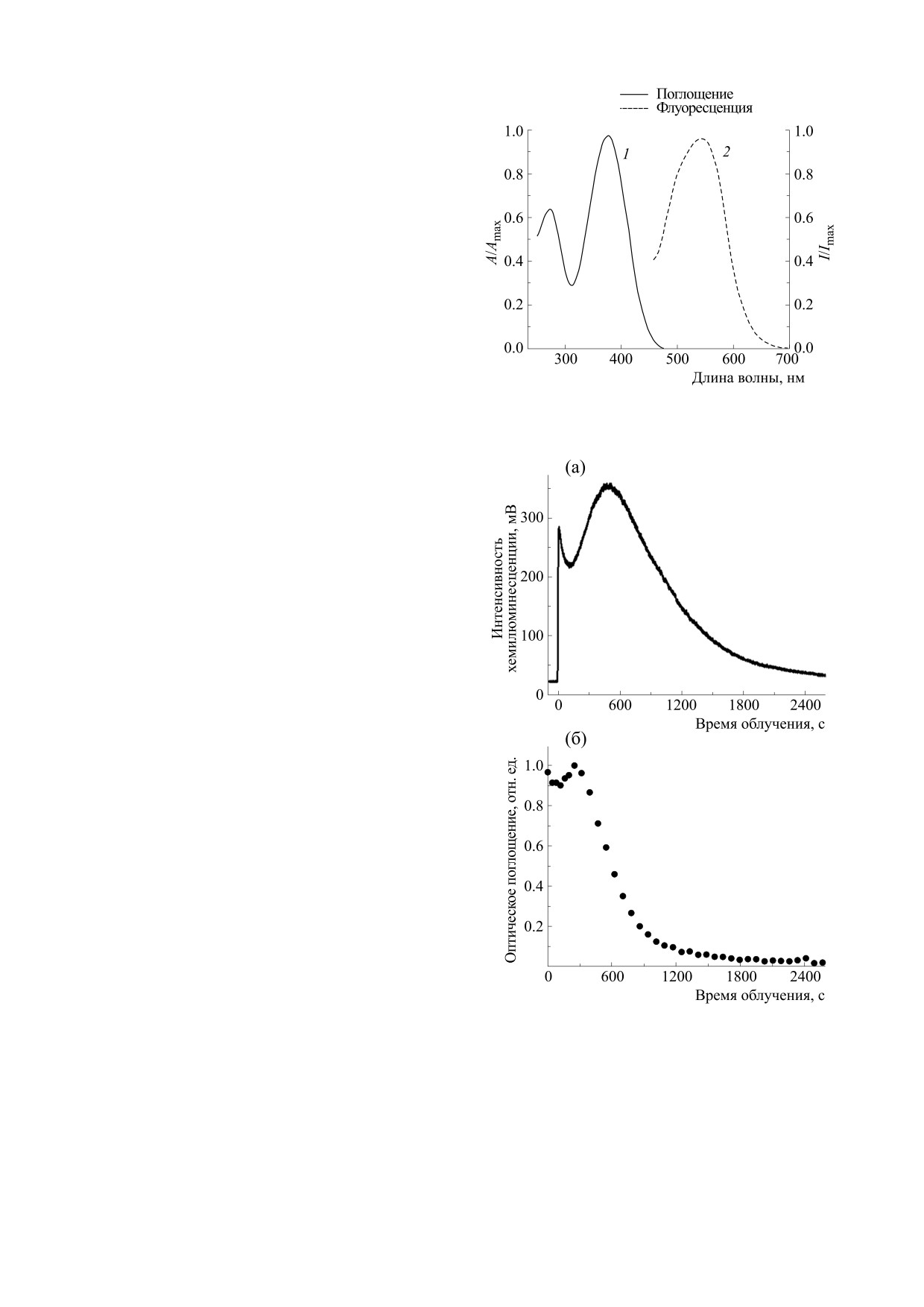
Спектры оптического поглощения и флуорес-
роскопа Nikon Eclipse Ti, оборудованного инку-
ценции НФТ в фосфатном буфере при pH 7.2
бационной системой «stage top». Были использо-
представлены на рис. 2. НФТ имеет два интенсив-
ваны специфические красители для клеточных
ных пика оптического поглощения в фиолетовой и
органелл. Митохондрии окрашивали с помощью
близкой ультрафиолетовой спектральных обла-
родамина 123, а для ядер был использован препа-
стях с коэффициентам молярного поглощения
рат Hoechst (оба - Sigma, США). В качестве ин-
ε378nm = 1.6·104 M-1см-1 и ε273nm = 1.0·104 M-1см-1.
дикатора образования NO· в клетках был исполь-
зован диаминофлуоресцеин в форме диацетата,
При облучении светом в области оптического
гарантирующей его проникновение в клетку [20].
поглощения раствор НФТ излучает очень слабую
БИОФИЗИКА том 67
№ 6
2022
АЛЬТЕРНАТИВНЫЕ ФОТОСЕНСИБИЛИЗАТОРЫ
1179
флуоресценцию с максимумом при λ = 544 нм
(рис. 2) и квантовым выходом ϕфл = (3.0 ± 0.5)·10-4
[21]. Кинетическая кривая затухания флуорес-
ценции имеет биэкспоненциальный характер с
временами жизни τ1 = 1.3 ± 0.3 нс и τ2 = 0.030 ±
± 0.003 нс [21]. Тем не менее, наличие собствен-
ной, хотя и слабой, флуоресценции позволило
установить места локализации НФТ внутри
клетки.
Методом импульсного фотолиза [22, 23] было
зарегистрировано формирование триплетного
состояния НФТ с крайне низким квантовым выхо-
дом (ϕТ ≈ (1-5)·10-6) и со временем жизни в отсут-
ствие молекулярного кислорода τТ = 0.2 ± 0.1 мкс
[21]. Триплетное состояние тушится молекуляр-
ным кислородом с бимолекулярной константой
тушения kq = (1.2 ± 0.1)·1010 M-1c-1 [21], харак-
терной для процессов, контролируемых диффу-
Рис. 2. Нормированные спектры оптического поглоще-
зией [4, 24]. Тушение сопривождается формиро-
ния и флуоресценции нитрофурантоина при pH 7.2 [21].
ванием синглетного кислорода. Однако интен-
сивность излучения при λ = 1270 нм находилась
на уровне шумов, что не позволило достоверно
определить величину квантового выхода синглет-
ного кислорода даже при насыщении раствора
кислородом.
Обычно времена жизни триплетных состоя-
ний органических молекул, включая производ-
ные нитрофурана [4, 13], в растворах находятся в
интервале от десятков микросекунд до милисе-
кунд. Столь короткие времена жизни НФТ, а так-
же низкие квантовые выходы его флуоресценции
и триплетного состояния, указывают на наличие
альтернативных мономолекулярных процессов
диссипации энергии электронного возбуждения
НФТ. Одним из таковых может являтся фотоизо-
меризация молекулы НФТ, что характерно для
молекул, в структуре которых присутствует цепь
π-сопряжения [25].
Другая возможность диссипации энергии
электронного возбуждения НФТ - фотовысво-
бождение радикала NO•, аналогично наблюдаю-
щемуся в случае хинифурила [13].
Чтобы проверить эту гипотезу, были продела-
ны эксперименты по регистрации NO• при облу-
чении буферных растворов НФТ.
Фотовысвобождение NO•. Детектирование
NO• при облучении растворов НФТ видимым
светом в диапазоне 400-450 нм проводили хеми-
люминесцентным методом в соответствии со сле-
дующей реакцией:
NO• + O3 → NO2* + O2 → NO2 + hν + O2.
На рис. 3а представлена кривая формирования
Рис. 3. (а) - Зависимость от времени облучения интен-
и расходования NO• в зависимости от времени
сивности хемилюминесценции буферного раствора
нитрофурантоина, вызванной фотовысвобождением
облучения.
радикала NO•; (б) - Зависимость от времени облучения
Параллельно с формированием радикала
нормализованного оптического поглощения раствора
NO•мы наблюдали изменение оптического по-
нитрофурантоина при λ = 355 нм.
БИОФИЗИКА том 67
№ 6
2022
1180
ПАРРА и др.
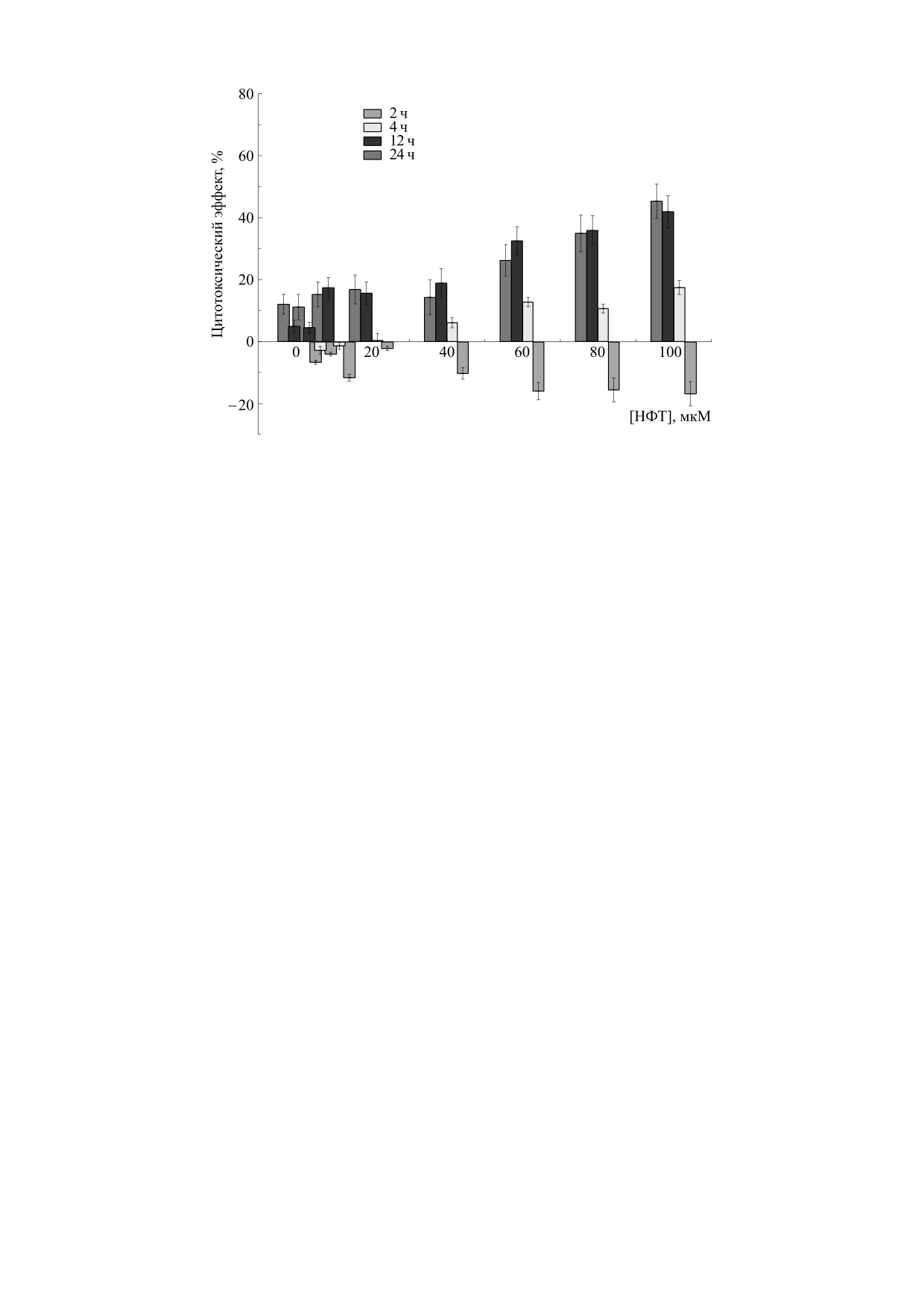
Рис. 4. Цитотоксический эффект нитрофурантоина против клеток B16F10 через 2, 4, 12 и 24 ч инкубации в темноте [18].
глощения НФТ, временная зависимость которой
ние локализации НФТ с локализацией маркeров
(рис. 3б) подобна временной зависимости кон-
ядер и митохондрий показалo, что распределение
центрации NO•.
в клетках НФТ и родамина 123 одинаково, а
именно, что оба они связываются с митохондри-
Сложный характер этих кривых говорит о том,
ями, но избегают клеточных ядер, с которыми
что фототрансформация НФТ и, соответственно,
связывается краситель Hoechst.
фотовысвобождение NO• происходят в несколь-
ко этапов. Полная схема этих процессов нуждает-
Высвобождение NO• при облучении NFT внутри
клетки. При облучении культуры клеток с НФТ
ся в дополнительном исследовании, однако факт
светом с длиной волны 385 нм наблюдается
фотовысвобождения NO• сомнений не вызывает.
уменьшение флуоресценции НФТ, что свиде-
Основываясь на этом факте можно было ожидать,
тельствует о его фототрансформации. Параллель-
что НФТ будет проявлять фотоцитотоксичность.
но с уменьшением флуоресценции НФТ, в клетке
Это предположение было подтверждено экспери-
наблюдается формирование NO•, которое фик-
ментами с клетками murine melanoma B16F10 [18].
сировалось с помощью диацетата диаминофлуо-
Интернализация НФТ и его локализация внутри
ресцеина, специфического флуоресцентного
клеток murine melanoma B16F10. Прежде всего бы-
маркера внутриклеточного NO• [20]. Клетки ин-
ло проведено исследование кинетики проникно-
кубировали с НФТ в течение 6 часов и коинкуби-
вения НФТ внутрь клеток (интернализация) и его
ровали с диаминофлуоресцеином в течение
локализации по отношению к внутриклеточным
10 мин. Интенсивность флуоресценции диами-
структурам [18]. Эти исследования были проведе-
нофлуоресцеина возрастает с ростом дозы облу-
ны с помощью флуоресцентной микроскопии.
чения, доказывая таким образом, что источником
Клетки инкубировали с НФТ в концентрации
NO• в клетках действительно является НФТ, пре-
20 мкM в течение 1, 2, 4 и 24 ч; флуоресценция
образующийся под действием света.
НФТ в клеточной среде для разных времен инку-
Цитотоксичность НФТ по отношению к клеткам
бации (tинк) была визуализирована с использова-
murine melanoma B16F10 в темноте и на свету. На
нием соответствующих фильтров.
рис. 4 представлены данные по цитотоксическо-
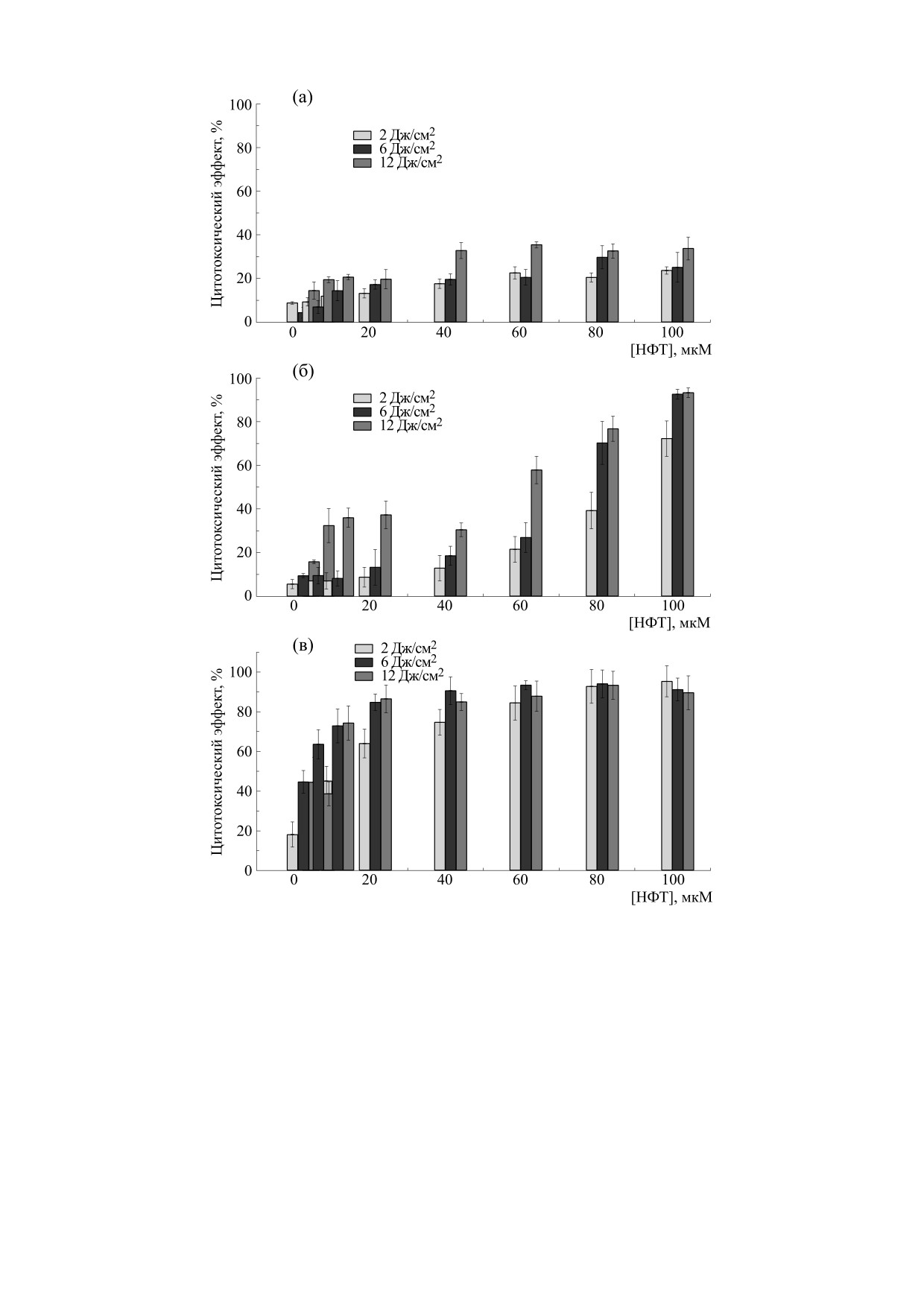
При временах инкубации tинк, меньших 4 ч,
му эффекту НФТ в темноте в зависимости от вре-
интенсивность флуоресценции НФТ в клетках
мени инкубации. Для tинк = 2 ч НФТ не проявляет
была очень слабой и диффузной. При повыше-
цитотоксичности во всем диапазоне использо-
нии tинк наблюдался рост интенсивности флуо-
ванных концентраций (0.1-100 мкM). Более того,
ресценции и ее локализация в определенных ор-
наблюдается пролиферация клеток, увеличиваю-
ганеллах внутри клетки, что указывает на увели-
щаяся с ростом концентрации НФТ. Для tинк = 4 ч
чение концентрации НФТ внутри клетки и его
пролиферация клеток уменьшается с ростом кон-
связывание с клеточными структурами. Сравне-
центрации НФТ вплоть до ее критического зна-
БИОФИЗИКА том 67
№ 6
2022
АЛЬТЕРНАТИВНЫЕ ФОТОСЕНСИБИЛИЗАТОРЫ
1181
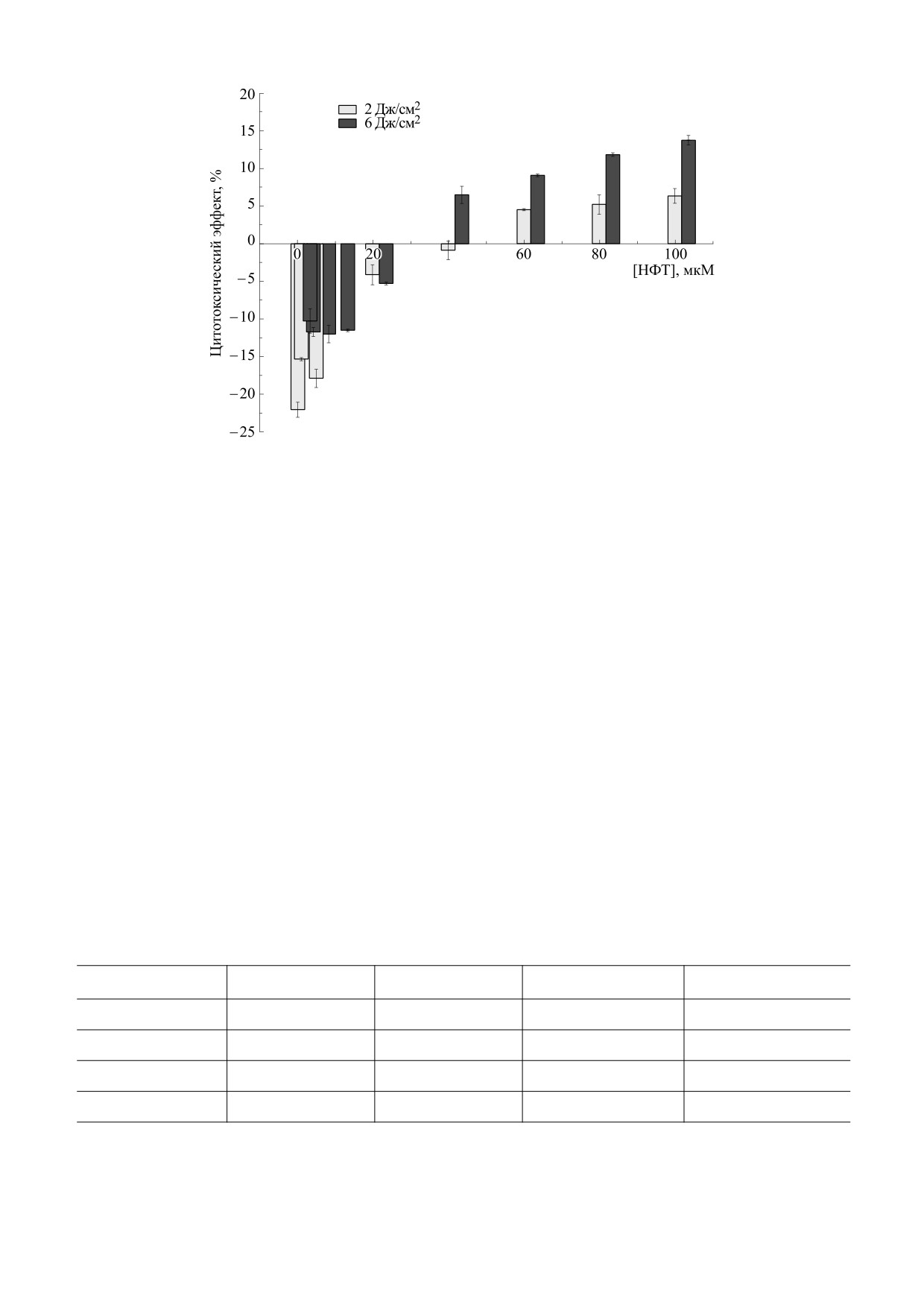
Рис. 5. Цитотоксический эффект нитрофурантоина против клеток B16F10 после двухчасовой инкубации и последующего
облучения светом 385 нм с дозами 2 и 6 Дж/см2 [18].
чения [НФТ]кр ≈ 40 мкМ, при которой не наблю-
Интересно отметить, что при низких концен-
даются ни пролиферация, ни токсичность. Для
трациях NFT пролиферация при облучении све-
том гораздо эффективнее наблюдаемой в темноте
[НФТ] > [НФТ]кр наблюдается только токсич-
(рис. 4 и 5). Однако для времен инкубации 4, 12 и
ность, а CTE увеличивается с ростом концентра-
24 ч при облучении вообще нет пролиферации,
ции НФТ. Для tинк 12 и 24 ч наблюдается только
наблюдается только гибель клеток. СТЕ растет с
цитотоксичность и СТЕ растет с ростом концен-
увеличением tинк, дозы облучения и концентра-
трации НФТ.
ции НФТ (рис. 6). Для tинк = 24 ч и дозы
При облучении образцов, содержащих НФТ,
12 Дж/см2 СТЕ достигает сатурации ≈100% уже
светом с длиной волны 385 нм для tинк = 2 ч при
при [NFT] = 20 мкM, в то время как при этих
облучении (рис. 5) НФТ в концентрациях ниже
условиях в темноте величина CTE всего около
40 мкM вызывает пролиферацию вплоть до дозы
≈15%.
облучения 2 Дж/см2. Для более высоких концен-
Летальные концентрации в темноте (IC50) и
траций наблюдается гибель клеток, причем CTE
при облучении светом (LD50) были получены из
растет с увеличением содержания НФТ. Для дозы
данных, представленных на рис. 4-6, а их соот-
6 Дж/см2 наблюдается аналогичное поведение,
ветствующие величины представлены в табл. 1.
однако пролиферация менее эффективна, токси-
Основываясь на приведенных данных, мы мо-
ческий эффект появляется при меньших концен-
жем утверждать, что НФТ проявляет против ра-
трациях НФТ, а СТЕ превышает наблюдаемый
ковых клеток B16F10 фотоцитотоксичность, мно-
при 2 Дж/см2.
гократно превосходящую его цитотоксичность в
Таблица 1. IC50 и LD50 нитрофурантоина для клеток B16F10 в зависимости от времени инкубации и дозы
облучения [18]
Доза света, Дж/см2
IC50 (12 ч), мкМ
LD50 (12 ч), мкМ
IC50 (24 ч), мкМ
LD50 (24 ч), мкМ
0
> 100
-
> 100
-
2
-
90
-
13
6
-
70
-
6
12
-
50
-
2
БИОФИЗИКА том 67
№ 6
2022
1182
ПАРРА и др.
Рис. 6. Цитотоксический эффект нитрофурантоина против клеток B16F10 после инкубации в течение 4 ч (а), 12 ч (б) и 24 ч
(в) и последующего облучения светом 385 нм с дозами 2, 6 и 12 Дж/см2 [18].
темноте. Фотоцитотоксичность НФТ обусловле-
низких концентрациях стимулирует различные
на его фототрансформацией, сопровождающейся
биопроцессы в клетках и организме, тогда как
высвобождением радикала NO•. Интересен тот
при высоких концентрациях он их подавляет,
факт, что при низких внутриклеточных концен-
приводя к гибели клеток [5-7].
трациях НФТ и низких дозах облучения наблюда-
Важно отметить также, что фототоксичность
ется эффект стимуляции роста клеток (пролифе-
НФТ не связана с наличием или отсутствием в
рация). Этот эффект обусловлен тем, что NO• в
системе молекулярного кислорода.
БИОФИЗИКА том 67
№ 6
2022
АЛЬТЕРНАТИВНЫЕ ФОТОСЕНСИБИЛИЗАТОРЫ
1183
В наших экспериментах мы не наблюдали раз-
вым медицинским препаратам, разрешенным к
рушение клеточной мембраны. Это указывает на
использованию в медицине.
то, что механизм фотоцитотоксичности НФТ
имеет, скорее всего, характер не некроза, а апо-
ФИНАНСИРОВАНИЕ РАБОТЫ
птоза. Это соответствует тому факту, что НФТ
связан с клеточными митохондриями, а не с
Работа выполнена при финансовой поддержке
внешней мембраной. Однамо детальный меха-
следующих Агентств финансирования (Брази-
низм фотоцитотоксичности НФТ требует даль-
лия):
нейшего изучения.
- Conselho Nacional de Desenvolvimento
Científico e Tecnológico (CNPq)
- гранты
Недостатком НФТ как фотоактивного веще-
No. 304863/2017-3, No. 305303/2013-9;
ства для фотохимиотерапии является то, что
спектр его оптического поглощения расположен
- Coordenação de Aperfeiçoamento de Pessoal de
в области 350-450 нм, т. е. вне фототерапевтиче-
Nível Superior - Brasil (CAPES) - Finance Code
ского окна (600-800 нм), где биологические тка-
001.
ни относительно прозрачны. Поэтому его приме-
нение должно ограничиваться лечением поверх-
КОНФЛИКТ ИНТЕРЕСОВ
ностных (кожных) заболеваний, и он не может
быть использован для лечения массивных опухо-
Авторы заявляют об отсутствии конфликта
лей. Однако незначительные изменения в его
интересов.
структуре, такие как удлинение цепи π-сопряже-
ния, могут привести к смещению его оптического
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
спектра в нужную область [26]. Кроме того, нами
было установлено, что как НФТ, так и хинифурил
Настоящая статья не содержит каких-либо ис-
демонстрируют интенсивное двухфотонное по-
следований с участием людей или животных в ка-
глощение [27], что позволяет инициировать их
честве объектов исследований.
фотореакции при облучении квантами света с
длиной волны 700-900 нм.
СПИСОК ЛИТЕРАТУРЫ
Представляет интерес также возможность
1. V. V. Kuznetsov, Res. Practic. Med. J., 2 (4), 98 (2015).
применения НФТ в одонтологии при лечении
2. J. F. Algorri, Mario Ochoa, P. Roldán-Varona, et al.,
зубных каналов, характеризующихся низким со-
Cancers 13 (17), 4447 (2021).
держанием кислорода.
3. S. Kwiatkowski, B. Knap, D. Przystupski, et. al.,
Biomed. Pharmacother., 106, 1098 (2018).
ВЫВОДЫ
4. Н. Турро, Молекулярная фотохимия (Мир,
М.,1967).
Основываясь на исследовании фототоксично-
5. S. Moncada, R. M. Palmer, and E. A. Higgs, Pharma-
сти производных нитрофурана, нитрофурантои-
col. Rev., 43 (2), 109 (1991).
на и хинифурила, мы можем утверждать, что его
6. D. D. Thomas, L. A. Ridnour, et al., Free Radic. Biol.
производные представляют собой новый класс
Med., 45 (1), 18 (2008).
фотоактивных веществ для применения в фото-
химиотерапии. Преимуществом этого класса
7. A. F. Vanin, V. A. Tronov, and R. R. Borodulin, Cell
фотоактивных веществ по сравнению классиче-
Biochem. Biophys., 79, 93 (2021).
скими фофотсенсибилизаторами для фотодина-
8. S. A. Cicillini, A. C. L. Prazias, A. C. Tedesco, et al.,
мической терапии является то, что их фототок-
Polyhedron, 28, 2766 (2009).
сичность основана не на формировании под
9. S. Gupta, N. Ahmad, and H. Mukhtar, Cancer Res., 58
действием света электронно-возбужденных со-
(9), 1785 (1998).
стояний с последующей реакцией с молекуляр-
10. M. Korbelik, C. S. Parkins, H. Shibuya, et al., Br. J.
ным кислородом и формировании его активных
Cancer, 82 (11), 1835 (2000).
форм, а на фотовысвобождении нитроксильного
11. N.A. Daghastanli, M. M. Rossa, H. S. Selistre-De-
радикала NO·. Это должно увеличивать эффек-
Araujo, et al., J. Photochem. Photobiol. B, 75, 27
тивность процесса, так как энергия электронно-
(2004).
возбужденных состояний фотосенсибилизатора и
12. N. A. Daghastanli, I. A. Degterev, A. C. Tedesco, et al.,
кислорода, помимо ожидаемых процессов, может
Braz. J. Med. Biol. Res., 37, 1873 (2004).
быть рассеяна по альтернативным путям, как из-
лучательным (флуоресценция), так и безызлуча-
13. N. A. Daghastanli, I. A. Degterev, G. B. Olivera, et al.,
тельным (внутренняя конверсия). Преимуще-
J. Photochem. Photobiol. A, 184, 98 (2006).
ством производных нитрофурана также является
14. A. Porreca, D. D'Agostino, D. Romagnoli, et al., Con-
то, что они относятся к легкодоступным и деше-
trol Trials. Urol. Int., 105 (7-8), 531 (2021).
БИОФИЗИКА том 67
№ 6
2022
1184
ПАРРА и др.
15. M. Vass, K. Hruska, and M. Franek, Veterinarni Me-
22. G. Porter, Science, 160, 1299 (1968).
dicina, 53, 469 (2008).
23. Y. E. Borissevitch, A. S. Tatikolov, and V. A. Kuzmin,
16. Nitric Oxide Analyser (NOA 280). Operation and Service
High Energy Chem., 5, 474 (1978).
Manual, Ed. by P. M. Sievers, (Software Version 2.05,
24. Дж. Лакович, Основы флуоресцентной спектроско-
Sievers, USA, 1997).
пии (Мир, M., 1986).
17. А. А. Красновский, А. С. Бендиткис и А. С. Коз-
лов, Биохимия, 84 (2), 240 (2019).
25. P. Russegger, Chem. Phys. Lett., 69 (2), 362 (1980).
18. L. P. Ferreira, G. G. Parra, D. C. K. Codognato, et al.,
26. Новый справочник химика и технолога, под ред.
Photochem. Photobiol. Sci., 16, 1071 (2017).
Ю. В. Поконова (Мир и семья, M.,
2005),
19. T. Mosmann, J. Immunol. Meth. 65 (1-2), 55 (1983).
гл. 4.3.5.2. Полиметиновые красители.
chemanalytica.com/book/novyy_spravochnik_khimi-
20. T. Nagano and T. Yoshimura, Chem. Rev. 102, 1235
ka_i_tekhnologa/12_obshchie_svedeniya/6152.
(2002).
21. G. G. Parra, L. P. Ferreira, D. C. K. Codognato, et al.,
27.
27. L. De Boni, D. S. Correa, D. L. Silva, et al., J.
Lumin., 185, 10 (2017).
Chem. Phys., 134, 014509 (2011).
Alternative Photosensitizers for Photochemotherapy Based on Medicinal Drugs
That are Derivatives of Nitrofuran
G.G. Parra*, L.P. Ferreira**, G.P. Borissevitch***, and I.E. Borissevitch***
*Instituto Butantan, Av. Vital Brasil, 1500 - Butantã, São Paulo 05503-900, Brazil
**Centro Universitário da Fundação Educacional de Barretos - UNIFEB,
Av. Prof. Roberto Frade Monte, 389 - Aeroporto, Barretos - SP, 14783-226, Brazil
***Universidade de São Paulo, Campus Ribeirão Preto, Av. Bandeirantes, 3900, Ribeirão Preto, SP, 14040-901, Brazil
Photochemotherapy is now a method for treating different diseases, which include cancer, and employing a
photosensitizers used for photodynamic therapy. A photosensitizer, upon its introduction into the organism,
is accumulated in the diseased tissue. Irradiation of the photosensitizer by visible light results in the formation
of the electronically excited state of the accumulated photosensitizer; this state undergoes reactions in the
presence of oxygen to form reactive active species which destroys diseased cells. However, the excited state
energy can also dissipate through fluorescence and internal and intercombination conversions. This limits the
efficiency of photodynamic therapy, stimulating a search for alternative pathways in photochemotherapy, us-
ing unexcited active particles, for example, free radicals. Among free radicals, NO• radical is of a special in-
terest as in low concentrations it takes part in many vital processes, and elevated levels of this radical is a cause
of cell death. Nitrofuran derivatives receive attention out of the different classes of photosensitizers, that lead
to release of NO• under light. One of them, nitrofurantoin, used as a drug in treatment of urinary infections,
demonstrates high photoactivity against a number of cancer cells and bacteria.
Keywords: photochemotherapy, alternative mechanisms, nitrofuran derivatives, NO• photorelease, nitrofurantoin
БИОФИЗИКА том 67
№ 6
2022