БИОФИЗИКА, 2022, том 67, № 6, с. 1185-1191
БИОФИЗИКА КЛЕТКИ
УДК 577.3
МЕХАНИЗМ ЦИТОТОКСИЧЕСКОГО ДЕЙСТВИЯ ПОЛИАКРИЛАТА
ЗОЛОТА НА ОПУХОЛЕВЫЕ КЛЕТКИ
© 2022 г. А.К. Чигасова*, Л.А. Островская*, #, Д.Б. Корман*
*Институт биохимической физики им. Н.М. Эмануэля РАН, ул. Косыгина, 4, Москва, 119334, Россия
#Е-mail: larros@list.ru
Поступила в редакцию 12.08.2022 г.
После доработки 12.08.2022 г.
Принята к публикации 22.08.2022 г.
Проведено исследование роли апоптоза в индуцируемом полиакрилатом золота (аурумакрилом)
процессе гибели опухолевых клеток, а также изучение влияния препарата на структуру ДНК клеток
карциномы молочной железы человека MCF-7. Установлено, что аурумакрил, будучи активным
цитотоксическим агентом, вызывает гибель клеток, изменение их морфологической структуры,
индуцирует сшивки в молекуле ДНК. Показано, что апоптоз не является доминирующим
механизмом в индуцированной аурумакрилом гибели клеток.
Ключевые слова: полиакрилат золота (аурумакрил), культура клеток MCF-7 цитотоксичность,
апоптоз, сшивки ДНК.
DOI: 10.31857/S0006302922060151, EDN: LKVLQG
Металлоцены, содержащие благородные ме-
Согласно существующим представлениям зо-
таллы - золото и серебро, - весьма широко ис-
лотосодержащие соединения относят к потенци-
следуются в последние годы в качестве веществ,
альным противоопухолевым агентам с мульти-
проявляющих разностороннюю биологическую,
таргетным механизмом действия, способным вы-
в том числе противоопухолевую активность [1, 2].
зывать как некротическую, так и апоптотическую
Особое место среди такого рода веществ зани-
гибель клеток, влиять на пролиферативные и
мает полиакрилат золота (аурумакрил), представ-
окислительно-восстановительные процессы в
ляющий собой единственное из изученных пре-
опухоли, воздействуя на ДНК и антиоксидантные
паратов соединение на полимерной основе, со-
ферменты (тиоредоксин редуктаза) в опухолевых
держащее наноструктурированное золото [3, 4].
клетках [1, 2].
Показано, что аурумакрил проявляет значи-
Ранее нами было установлено, что аурумак-
тельную противоопухолевую активность на моде-
рил, обладая выраженным цитотоксическим эф-
лях солидных опухолей животных (карцинома
фектом, вызывает также значительные измене-
легких Льюис, аденокарцинома Акатол, адено-
ния в кинетике клеточной пролиферации выжив-
карцинома Са-755) in vivo, а также обладает цито-
шей фракции опухолевых клеток. Воздействие
токсической эффективностью в отношении кле-
аурумакрила приводило к накоплению клеток в
точных линий опухолей человека (рак молочной
фазе пролиферативного покоя G0, снижению до-
железы MCF-7, рак легкого А-549, рак толстой
ли делящихся клеток и к утрате выжившими клет-
кишки HCT116, меланома Mel Me) in vitro [5-9].
ками репродуктивной способности [7].
Принципиальные отличия в физико-химиче-
Задача представленной работы состояла в
ской структуре аурумакрила от других широко ис-
оценке роли апоптоза в индуцируемом аурумак-
следуемых металлокомплексов дают основания
рилом процессе гибели опухолевых клеток и в
полагать, что, возможно, мишени и механизмы
изучении влияния препарата на структуру ДНК
реализации противоопухолевого эффекта ауру-
клеток карциномы молочной железы человека
макрила иные, чем у ряда известных лекарствен-
MCF-7.
ных средств, в частности, таких как цисплатина.
Экспериментальным подтверждением такого ро-
МАТЕРИАЛЫ И МЕТОДЫ
да соображений могут служить полученные нами
данные об отсутствии перекрестной резистентно-
Препарат. Исследовавшийся препарат ауру-
сти между аурумакрилом и цисплатиной [10].
макрил представляет собой неполную золотую
1185
1186
ЧИГАСОВА и др.
соль полиакриловой кислоты, содержащую
зию. Затем в равных пропорциях смешивали рас-
8 масс. % ионов металла, отвечает общей формуле
твор 0.4%-го трипанового синего и клеточной
(-CH2-CHCOOH-)n(-CH2CHCOOAuCl3H-)m,
суспензии, смесь ресуспендировали и непосред-
где n = 12000-35000, m = 1650-6650. Молекуляр-
ственно после этого оценивали клеточную гибель
ная масса полимера составляет 100-300 кДа. ИК-
путем подсчета окрашенных (погибших) клеток в
спектры препарата содержат полосы поглощения
камере Горяева при анализе 500 клеток для каж-
карбоксильной и карбоксилатной групп при 1720
дой точки [7].
и 1570 см-1. Субстанция препарата представляют
Полученные данные представлены в виде кри-
собой стекловидные пластинки золотистого цве-
вых, характеризующих изменение доли погибших
та, хорошо растворимые в воде [3]. Оценка эф-
после воздействия аурумакрила клеток по отно-
шению к контролю в зависимости от концентра-
фектов препарата in vitro проведена при его при-
менении в концентрациях, изменяющихся в диа-
ции препарата.
пазоне от 1 до 1000 мкг/мл.
Морфологический анализ клеток. Морфологи-
ческие изменения клеток MCF-7 под влиянием
Культура клеток. Эксперименты проведены с
аурумакрила фиксировали на микрофотоизобра-
использованием культуры клеток рецептор-по-
жениях клеток, полученных с помощью инверти-
ложительной карциномы молочной железы чело-
рованного микроскопа СКХ 41 SF (Olympus, Япо-
века MCF-7, полученной из банка опухолей
ния), оснащенного CCD камерой Infinity 3-1 и
НМИЦ онкологии им. Н.Н. Блохина (Москва).
объективом 20× (Lumenera Corp., Канада).
Культивирование клеток проводили в стан-
Анализ апоптотической гибели клеток. Для
дартной культуральной среде DMEM/F12 (Life
определения пути гибели клеток линии MCF-7
Technologies Thermo Fisher Scientific, США) с до-
под влиянием аурумакрила использовали метод
бавлением 2 мM L-глутамина («ПанЭко», Рос-
оценки доли апоптотических клеток среди всех
сия), 100 ед/мл пенициллина, 100 мг/мл стрепто-
погибших клеток с помощью ДНК-связывающе-
мицина («ПанЭко», Россия) и 10% фосфатно-со-
го флуоресцентного красителя YO-PRO-1, кото-
левого буфера (Life Technologies Thermo Fisher
рый избирательно проникает через мембрану
Scientific, США) путем термостатирования при
только апоптотических клеток.
37°C в 5% CO2 (CO2-инкубатор MCO-18AC, San-
Данный метод основан на представлениях о
yo, Япония). В дальнейшем клетки снимали с по-
том, что в период апоптоза активируется рецеп-
верхности флаконов 0.25%-м раствором трипси-
тор P2X7 неселективного катионного канала
на-ЭДТА («ПанЭко», Россия) и пассировали с
P2X7R, управляемого аденозинтрифосфатом, что
плотностью 200 клеток/см2 в той же культураль-
приводит к превращению этого канала в цитоли-
ной среде. Пассирование клеток проводили при
тическую пору [11]. Некоторые красители, такие
достижении культурой 80-90% монослоя. Замену
как флуоресцентный краситель YO-PRO-1, могут
среды осуществляли каждые четверо суток.
проникать внутрь этих пор, после чего клетки на-
Экспериментальное изучение аурумакрила
чинают флуоресцировать в зеленой области спек-
проведено на клетках, находящихся в фазе экспо-
тра, тогда как другие красители, такие как йоди-
ненциального роста (плотность клеточной попу-
стый пропидий, не обладают этим свойством в
ляции ~ 80%). Клетки снимали с пластика раство-
данных условиях. Таким образом, YO-PRO-1 мо-
ром трипсина-ЭДТА с последующей инактива-
жет служить ранним маркером апоптотической
цией трипсина и отмывкой клеток в полной
гибели клеток [12]. Добавление йодистого пропи-
среде. Клетки пассировали в чашки Петри диа-
дия позволяет дифференцировано окрасить по-
метром 35 мм, содержащие покровные стекла
гибшие клетки, флуоресцирующие после окраски
(SPL Lifesciences, Южная Корея). Действие ауру-
в красной области спектра. Через мембрану жи-
макрила в различных концентрациях (1, 10, 100 и
вых клеток эти красители не проникают.
1000 мкг/мл) изучено при инкубации клеток с
Оценку доли клеток на ранней стадии апопто-
препаратом при 37°С в течение 1, 6 и 24 ч, при па-
за проводили с использованием коммерческого
раллельном инкубировании интактных клеток в
набора Vybrant Apoptosis Assay Kit № 4 с флуорес-
качестве контроля [7].
центными красителями YO-PRO-1 и йодистым
Оценка цитотоксического эффекта. Исследова-
пропидием (Invitrogen, США). Клетки окрашива-
ние цитотоксичности аурумакрила в отношении
ли в соответствии с протоколом производителя.
клеток MCF-7 проведено в тесте с использовани-
В исследуемые временные точки (через 1, 6 и
ем 0.4%-го раствора трипанового синего, воспри-
24 ч после воздействия аурумакрила) клетки два-
имчивость к которому характеризует жизнеспо-
жды промывали раствором Хенкса и снимали их с
собность клеток.
поверхности чашек 0.25%-м раствором трипси-
Клетки дважды отмывали от среды фосфатно-
на-ЭДТА. Затем к 1 мл клеточной суспензии в
солевым буфером (рН 7.4), снимали с чашек рас-
растворе Хенкса добавляли по 1 мкл раствора YO-
твором трипсина-ЭДТА и переводили в суспен-
PRO-1 и йодистого пропидия из упомянутого
БИОФИЗИКА том 67
№ 6
2022
МЕХАНИЗМ ЦИТОТОКСИЧЕСКОГО ДЕЙСТВИЯ ПОЛИАКРИЛАТА ЗОЛОТА
1187
фореза (раствор для щелочной денатурации и
электрофореза: NaOH
-
100
ммоль/л,
Na2ЭДТА - 1 ммоль/л, рН 12.5; стабилизация по
напряжению - 2 В/см; 20 мин при 4°С) и с даль-
нейшей нейтрализацией в течение 3-5 мин в
0.4 моль/л трис-HCl-буфере при 4°С. Для окрас-
ки ДНК использовали акридиновый оранжевый
(2 мкг/мл в фосфатно-солевом буфере, рН 7.4).
Визуализацию и документирование ДНК-комет
проводили на люминесцентном микроскопе
Eclipse Ni-U (Nikon, Япония), оснащенным ви-
деокамерой ProgRes CFcool (Jenoptik AG, Герма-
ния). Для анализа и обработки микрофотоизоб-
ражений ДНК-комет использовали программу
CASP 1.2.2 (СASPlab, Польша).
Статистическую обработку полученных ре-
Рис. 1. Изменение доли погибших опухолевых клеток
зультатов проводили с помощью программы Sta-
культуры MCF-7 в зависимости от концентрации и
tistica 7.0. Результаты представлены как среднее
времени воздействия аурумакрила: 1 - инкубация 1 ч,
2 - инкубация 6 ч, 3 - инкубация 24 ч.
из пяти независимых результатов ± стандартная
ошибка.
коммерческого набора. Клетки инкубировали
20 мин при 4°С, ресуспендировали и помещали в
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
камеру Горяева для подсчета апоптотических
В продолжение исследования механизма дей-
клеток. Подсчет клеток в апоптозе проводили с
ствия аурумакрила в данной работе представлены
помощью люминеcцентного микpоcкопа Eclipse
результаты изучения влияния препарата на жиз-
Ni-U (Nikon, Япония) со следующими cвето-
неспособность и морфологию клеток карциномы
фильтpами: B-2E/C с излучением зеленой флуо-
молочной железы человека MCF-7, их апоптоти-
ресценции для YO-PRO-1 (возбуждение на 465-
ческую гибель и структуру ДНК.
495 нм и эмиccия на 515-555 нм) и Y-2E/C с ис-
пусканием красной флуоресценции для йодисто-
Цитотоксичность аурумакрила. Установлено,
го пропидия (возбуждение на 540-580 нм и эмиc-
что аурумакрил обладает цитотоксическим дей-
cия на 600-660 нм). Анализировали по 300 клеток
ствием на опухолевые клетки, вызывая их гибель,
для каждой точки.
выраженность которой зависит от времени воз-
действия препарата и его концентрации. Макси-
Анализ сшивок ДНК. Изучение влияния ауру-
мальный эффект - гибель 61% клеток - наблюда-
макрила на ДНК опухолевых клеток MCF-7 про-
ется через 24 ч после воздействия аурумакрила в
водили путем детектирования сшивок ДНК с ис-
концентрации 1000 мкг/мл (рис. 1)
пользованием метода ДНК-комет в щелочных
Расчетная доза, летальная для 50% опухолевых
условиях.
), определенная в тесте с использова-
клеток (IC50
Клетки инкубировали с аурумакилом в диапа-
нием красителя трипановый синий, составляет
зоне концентраций от 1 до 500 мкг/мл в течение
для аурумакрила 720 мкг/мл (58 мкг/мл в пересче-
1 ч при 37°С. Затем клетки дважды отмывали от
те на содержание золота).
среды фосфатно-солевым буфером (рН 7.4), сни-
мали с чашек раствором трипсина-ЭДТА и пере-
Следует отметить, что ранее при оценке цито-
токсичности аурумакрила с помощью МТТ-теста
водили в суспензию, содержащую 1×106 клеток в
было установлено, что коэффициент IC50 препа-
1 мл. Суспензию контрольных или обработанных
рата составляет 125 мкг/мл (10 мкг/мл в пересчете
полиакрилатом золота клеток смешивали с 1%-м
на содержание золота) [12].
раствором легкоплавкой агарозы при 37.5°С (1:1)
и наносили по 75 мкл на предметные стекла,
Можно полагать, что столь существенные от-
предварительно покрытые 1%-м раствором нор-
личия в показателях цитотоксического эффекта
моплавкой агарозы, после чего накрывали по-
препарата отражают разницу в чувствительности
кровным стеклом и выдерживали 10 мин при 4°С.
примененных методов оценки гибели клеток, в
Затем в течение 1 ч клетки подвергали лизису при
основе которых лежит использование различных
4°С (лизирующий буфер: NaCl - 2.5 моль/л, трис-
реагентов - трипанового синего и МТТ, и не ока-
HCl - 20 ммоль/л, Na2ЭДТА - 100 ммоль/л,
зывают принципиального влияния на оценку ау-
ДМСО - 10%, Triton-X100 - 1%) и щелочной де-
румакрила как высокоактивного цитотоксиче-
натурации с последующим проведением электро-
ского агента.
БИОФИЗИКА том 67
№ 6
2022
1188
ЧИГАСОВА и др.
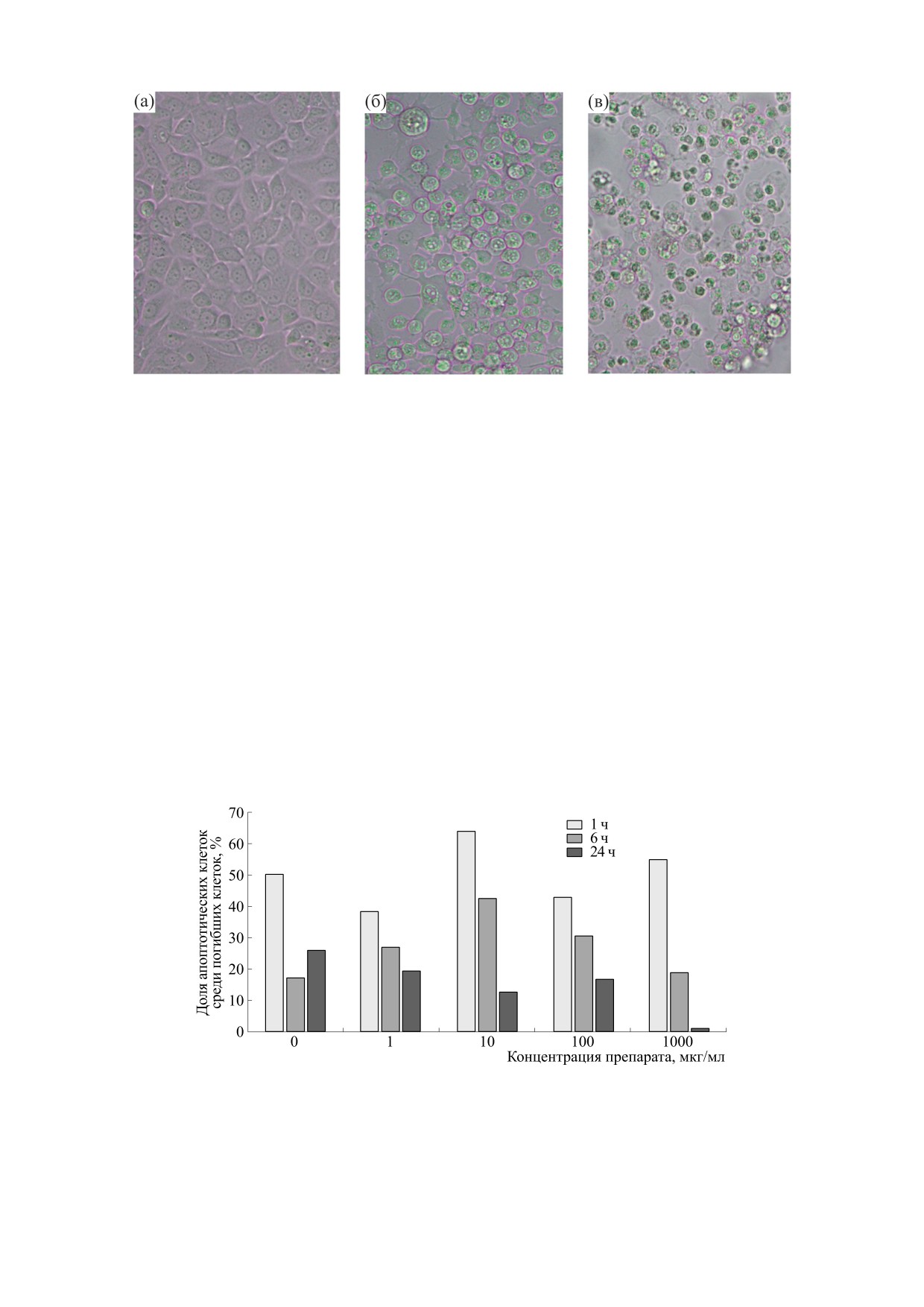
Рис. 2. Микрофотографии клеток MCF-7 после инкубации с аурумакрилом (1000 мкг/мл) в течение 1 ч (а), 6 ч (б) и 24 ч (в).
Влияние аурумакрила на морфологическую
клеток среди общего числа погибших клеток для
структуру клеток. Воздействие аурумакила в кон-
всех изученных концентраций препарата. Наибо-
центрации 1000 мкг/мл вызывает изменения в
лее значительное снижение доли апоптотических
морфологической структуре клеток MCF-7.
клеток отмечено при 24-хчасовой инкубации,
при которой регистрировалась наибольшая ги-
Как видно из представленных на рис. 2 микро-
бель клеток.
фотографий, уже через 6 ч инкубации с препара-
том клетки приобретают несвойственную им
Полученные данные позволяют предполо-
округлую форму (рис. 2б), а через 24 ч - сжима-
жить, что гибель клеток, индуцированная ауру-
ются и уменьшаются в размерах (рис. 2в).
макрилом, происходит не благодаря развитию
апоптоза, а является следствием других процес-
Механизм гибели клеток под влиянием аурумак-
сов, возможно, связанных с нарушением митоти-
рила. Изменения доли апоптотических клеток
ческого цикла клеток, о чем упоминалось ранее
среди погибших клеток в зависимости от концен-
трации и времени воздействия аурумакрила ха-
[7].
рактеризуют данные, представленные на рис. 3.
Известно, что одним из механизмов цитоток-
Как видно, при увеличении времени инкуба-
сичности наночастиц золота может быть блок
ции клеток с аурумакрилом с 1 до 24 ч наблюдает-
клеточного цикла. В ряде исследований показано
ся закономерное снижение доли апоптотических
блокирование клеток в G1-фазе, накопление кле-
Рис. 3. Изменение доли апоптотических клеток среди общего числа погибших клеток MCF-7 в зависимости от
концентрации и времени воздействия аурумакрила.
БИОФИЗИКА том 67
№ 6
2022
МЕХАНИЗМ ЦИТОТОКСИЧЕСКОГО ДЕЙСТВИЯ ПОЛИАКРИЛАТА ЗОЛОТА
1189
ле агарозы к аноду и создающей так называемый
«хвост» ДНК-комет, регистрируется путем оцен-
ки показателя электрофоретической подвижно-
сти ДНК.
Как видно из данных, представленных на
рис. 4, воздействие аурумакрила в концентрации
500 мкг/мл приводит к снижению доли неповре-
жденной и фрагментированной ДНК в хвосте ко-
меты. Доля ДНК в хвосте ДНК-комет под влия-
нием препарата снижается примерно в четыре ра-
за - с 31.2%, регистрируемых в контрольном
образце, до 7.4%, определяемых в клетках, под-
вергавшихся воздействию аурумакрила в концен-
трации 500 мкг/мл (рис. 4). Соответственно воз-
растает доля «сшитой» ДНК, остающейся в голо-
Рис. 4. Изменение доли ДНК в хвосте ДНК-комет
ве ДНК-кометы и не мигрирующей к аноду.
клеток MCF-7 в зависимости от концентрации
аурумакрила.
Полученные данные свидетельствуют о выра-
женном влиянии аурумакрила на структуру ДНК
опухолевых клеток, выражающемся в индуциро-
ток в фазе G0/G1 и уменьшение содержания кле-
вании препаратом сшивок ДНК.
ток в S- и G2/M-фазах под влиянием золотосо-
Морфологические изменения, происходящие
держащих препаратов [1, 2].
с клетками MFC-7 под влиянием аурумакрила,
наглядно иллюстрируют микрофотографии
Нами, в частности, было показано, что ауру-
ДНК-комет (рис. 5).
макрил вызывает значительные изменения в кле-
точной кинетике опухоли. Так, доля «покоящих-
В контроле отчетливо виден «хвост» ДНК-ко-
ся» клеток через 24 ч инкубации с аурумакрилом
меты, содержащий неповрежденную ДНК, выход
возрастает с 40%, наблюдающихся в контроле, до
которой составляет более 30% (рис. 5а), в то время
93%, регистрируемых на этот срок при воздей-
как после воздействия аурумакрила наблюдается
ствии препарата в дозе 1000 мкг/мл. Наряду с
практически полное исчезновение
«хвостов»
этим среди выживших клеток наблюдается
ДНК-комет и сжимание, уменьшение в размерах
уменьшение под влиянием аурумакрила доли де-
ядер у основного количества клеток (рис. 5б).
лящихся клеток с 60%, регистрируемых в это вре-
Распределение клеток карциномы молочной
мя в контроле, до 7%, что было расценено как ре-
железы MFC-7 в соответствии с долей ДНК, со-
продуктивная гибель клеток [7].
держащейся в хвосте ДНК-комет через 1 ч после
инкубации с аурумакрилом (500 мкг/мл), показа-
Индукция сшивок ДНК аурумакрилом. Извест-
но на рис. 6.
но, что при анализе структурных изменений ДНК
методом ДНК-комет доля фрагментированной
Как видно, около 70% клеток карциномы мо-
ДНК, мигрирующей во время электрофореза в ге-
лочной железы MFC-7 в контроле после проведе-
Рис. 5. Микрофотографии ДНК-комет клеток карциномы молочной железы MFC-7: (а) - контроль, (б) - аурумакрил
(500 мкг/мл, инкубация 1 ч). Напряженность электрического поля 2.0 В/см.
БИОФИЗИКА том 67
№ 6
2022
1190
ЧИГАСОВА и др.
Рис. 6. Распределение клеток аденокарциномы молочной железы MFC-7 в соответствии с содержанием ДНК в хвосте
ДНК-комет после воздействия аурумакрила в различных концентрациях (инкубация 1 ч).
ния электрофореза содержали более 25% ДНК в
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
хвосте ДНК-комет.
Настоящая статья не содержит каких-либо ис-
следований с участием людей или животных в ка-
Аналогичное распределение клеток в соответ-
честве объектов исследований.
ствии с содержанием ДНК в хвосте ДНК-комет
наблюдается для клеток, подвергавшихся в тече-
ние часа воздействию аурумакрила в концентра-
СПИСОК ЛИТЕРАТУРЫ
циях 10, 50 и 100 мкг/мл.
1. Д. Б. Корман, Л. А. Островская, Н. В. Блюхтерова
и др., Биофизика,
66
(6),
1229
(2021). DOI:
Иное распределение клеток наблюдается при
10.31857/S000630292106020X
воздействии аурумакрила в концентрации
2. Д. Б. Корман, Л.А. Островская и В. А. Кузьмин,
500 мкг/мл. Показано, что среди 60% проанали-
Вопр. онкологии, 64 (6), 697 (2018).
зированных клеток менее 5% клеток содержали
ДНК в хвосте ДНК-комет, что свидетельствует о
3. Л. А. Островская, Д. Б. Корман, Н. В. Блюхтерова
и др., Хим. физика, 38 (12), 64 (2019).
выраженной способности аурумакрила вызывать
сшивки в молекуле ДНК опухолевых клеток
4. Л. А. Островская, Д. Б. Корман, Н. В. Блюхтерова
(рис. 6).
и др., Рос. биотерапевтич. журн., 19 (4), 74 (2020).
5. L. A. Ostrovskaya, M. G. Voronkov, D. B. Korman,
Таким образом, в результате исследования
et al., J. Cancer Therapy, 1 (2), 59 (2010). DOI:
влияния аурумакрила на клетки карциномы мо-
10.4236/jct.2010.12010
лочной железы MFC-7 человека установлено:
6. Л. А. Островская, Д. Б. Корман, А. К. Грехова и др.,
Изв. РАН. Сер. хим., 66 (12), 2333 (2017).
- аурумакрил, будучи активным цитотоксиче-
ским агентом, вызывает гибель клеток и измене-
7. Л. А. Островская, Д. Б. Корман, А. К. Грехова и др.,
Биофизика,
62
(3),
598
(2017).
DOI:
ние их морфологической структуры;
10.1134/S0006350917030150
- апоптоз не является доминирующим меха-
8. Л. А. Островская, Д. Б. Корман, Е. И. Некрасова
низмом в индуцированной аурумакрилом гибели
и др., Биофизика,
66
(5),
978
(2021). DOI:
клеток;
10.31857/S0006302921050161
9. Л. А. Островская, Д. Б. Корман, Е. И. Некрасова
- молекулярный механизм действия аурумак-
и др., Биофизика,
67
(1),
82
(2022). DOI:
рила на опухолевые клетки связан с индукцией
10.31857/S0006302922010070
сшивок в молекуле ДНК.
10. Л.А. Островская, Д.Б. Корман, Е.И. Некрасова
и др., Биофизика, 67 (5), 951 (2022).
11. R. Kopp, A. Krautloher, A. Ramírez-Fernández, et al.,
КОНФЛИКТ ИНТЕРЕСОВ
Front. Mol. Neurosci., 12, 183 (2019).
Авторы заявляют об отсутствии конфликта
12. S. Fujisawa, Y. Romin, A. Barlas, et al., Cytotechnolo-
интересов.
gy, 66, 259 (2013).
БИОФИЗИКА том 67
№ 6
2022
МЕХАНИЗМ ЦИТОТОКСИЧЕСКОГО ДЕЙСТВИЯ ПОЛИАКРИЛАТА ЗОЛОТА
1191
Aurum Polyacrylate: Mechanism of Cytotoxic Action on Tumor Cells
A.K. Chigasova*, L.A. Ostrovskaya*, and D.B. Korman*
*Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
The role of aurum polyacrylate (aurumacryl)-induced apoptosis in tumor cells as well as the effect of this an-
titumor drug on the DNA structure of human breast carcinoma cells MCF-7 were studied. It was established
that aurumacryl as an active cytotoxic agent can induce cell death, produce cellular morphological changes,
and cause crosslinking in a DNA molecule. It was shown that apoptosis is not a dominant mechanism in au-
rumacryl-induced cell death.
Keywords: aurum polyacrylate (aurumacryl), MCF-7 cell culture, cytotoxicity, apoptosis, DNA cross-linking
БИОФИЗИКА том 67
№ 6
2022