БИОФИЗИКА, 2022, том 67, № 6, с. 1224-1231
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 51-76+57.087
ИССЛЕДОВАНИЕ КИНЕТИКИ ТРАНСПОРТА
РАДИОФАРМАЦЕВТИЧЕСКИХ СОЕДИНЕНИЙ НА ОСНОВЕ
ФОЛИЕВОЙ КИСЛОТЫ, МЕЧЕННЫХ ГАЛЛИЕМ-68
© 2022 г. А.С. Лунёв*, #, К.А. Лунёва*, **, Ф.И. Василевич**, М.Г. Рахимов*, А.А. Ларенков*
*ГНЦ РФ - Федеральный медицинский биофизический центр имени А.И. Бурназяна ФМБА России,
ул. Живописная, 46, Москва, 123098, Россия
**Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина,
ул. Академика Скрябина, 23, Москва, 109472, Россия
#E-mail: mr.alekslunev@gmail.com
Поступила в редакцию 07.06.2022 г.
После доработки 02.08.2022 г.
Принята к публикации 20.09.2022 г.
При внутривенном введении радиофармацевтического препарата происходит его встраивание в ме-
таболические пути организма путем связывания с транспортными молекулами, от кинетики кото-
рых будет зависеть достижение конечного результата - терапевтического или диагностического эф-
фекта. Создание математической модели кинетики транспорта радиофармацевтического препарата
in silico позволяет количественно оценить его переход между органами - камерами или компарт-
ментами. Одними из перспективных агентов для диагностической визуализации злокачественных
новообразований и ревматоидных патологий являются конъюгаты фолиевой кислоты, меченные
галлием-68. Исследование кинетики радиофармацевтических препаратов на основе фолиевой кис-
лоты, опирающееся на результаты экспериментальных данных, полученных на крысах линии Wistar
с моделями воспалительных процессов различной этиологии, подтвердило, что дополнительное
введение в молекулу аминокислотного фрагмента His-Glu-His-Glu (в составе конъюгата [68Ga]Ga-
FA-II) позволяет значительно снизить накопление радиоактивности в почках по сравнению с немо-
дифицированым аналогом [68Ga]Ga-FA-I. Изменение фармакокинетических параметров при вве-
дении аминокислотного фрагмента подразумевает значительное снижение лучевых нагрузок на
критические органы и ткани и благоприятно скажется на возможности применения исследуемых
соединений в визуализации патологических процессов методом позитронно-эмиссионной томо-
графии.
Ключевые слова: фармакокинетика, камерная модель, фолаты, радиофармпрепарат, биораспределение,
галлий-68.
DOI: 10.31857/S0006302922060199, EDN: LLXPGC
глощенных доз, создаваемых в органах и тканях,
При внутривенном введении радиофармацев-
для анализа которых необходимо построить ка-
тического лекарственного препарата (РФЛП)
мерную модель для исследования кинетики
происходит его встраивание в метаболические
РФЛП.
пути организма путем связывания с транспорт-
ными молекулами, от кинетики которых будет за-
Создание математической модели кинетики
висеть достижение конечного результата - тера-
транспорта РФЛП in silico, опираясь на экспери-
певтического или диагностического эффекта [1].
ментальные данные, позволяет количественно
Однако применение РФЛП в диагностических
оценить переход РФЛП между органами - каме-
или терапевтических целях сопряжены с риском
рами или компартментами [4]. Метод камерных
развития ряда осложнений, напрямую связанных
моделей и построения экспоненциальных функ-
с ионизирующим излучением радионуклида [2,
ций камерного накопления-выведения дает воз-
3]. Поэтому на этапе разработки РФЛП необхо-
можность строить индивидуальные модели для
димо рассчитать прогностические значения по-
конкретных РФЛП и анализировать их поведение
в критических органах и патологических очагах.
Сокращения: РФЛП
- радиофармацевтический лекар-
ственный препарат, ЮИА - ювенильный идиопатический
Одними из перспективных агентов для диа-
артрит.
гностической визуализации методом позитрон-
1224
ИССЛЕДОВАНИЕ КИНЕТИКИ ТРАНСПОРТА РАДИОФАРМАЦЕВТИЧЕСКИХ СОЕДИНЕНИЙ
1225
но-эмиссионной томографии злокачественных
идиопатического артрита (ЮИА) изложена в па-
новообразований и ревматоидных патологий яв-
тенте РФ «Способ создания биологической моде-
ляются производные фолиевой кислоты, мечен-
ли системного ювенильного идиопатического
ные галлием-68 [5, 6].
артрита в эксперименте» [11].
Ранее нами были проведены эксперименты
Крысам в ступню правой задней конечности
in vitro и ex vivo, доказывающие возможность диа-
вводили внутрикожно 0.1 мл полного адъюванта
гностического применения синтезированных со-
Фрейнда (ThermoFisher Scientific, США). Затем
единений на основе фолиевой кислоты, мечен-
внутрибрюшинно вводился препарат «Пироге-
ных галлием-68, для визуализации злокачествен-
нал» (Филиал «Медгамал» НИИЭМ им. Н.Ф. Га-
ных новообразований методом позитронно-
малеи РАМН, Россия) в концентрации
эмиссионной томографии. Причина, по которой
50 мкг/мл, из расчета 1 мкг на крысу, доведенный
радиоконъюгаты фолиевой кислоты до сих пор
до 1 мл водой для инъекций. Контрольным жи-
практически не используются в клинической
вотным внутрибрюшинно вводили 1 мл физиоло-
практике, может быть связана с их нежелатель-
гического раствора. Внешнее состояние крыс по-
ным высоким накоплением в ткани почки, кото-
сле проведения инъекционных процедур сохра-
рое является наиболее сложным препятствием
нялось в норме. Наблюдение за состоянием
для их внедрения в клиническую практику радио-
животных проводили ежедневно.
фармпрепаратов на их основе [7]. Исследование
На восемнадцатые сутки проводили повтор-
кинетики транспорта 68Ga-меченных производ-
ную иммунизацию путем внутрибрюшинного
ных фолиевой кислоты поможет количественно
введения препарата «Пирогенал» 50 мкг/мл, из
описать течение процесса in vivo, а также пра-
расчета 2 мкг на крысу, доведенного до 1 мл во-
вильно и корректно интерпретировать выбор
дой для инъекций. Контрольным животным вну-
определенного конъюгата.
трибрюшинно вводился 1 мл физиологического
раствора.
На 39 сутки была проведена очередная имму-
МАТЕРИАЛЫ И МЕТОДЫ
низация путем внутрибрюшинного введения пре-
Все процедуры проведенного исследования
парата Пирогенал (50 мкг/мл, из расчета 10 мкг
соответствовали принципам надлежащей лабора-
на крысу), доведенного до 1 мл водой для инъек-
торной практики [8].
ций. Контрольным животным внутрибрюшинно
Основное различие между [68Ga]Ga-FA-I и
вводили 1 мл физиологического раствора.
[68Ga]Ga-FA-II заключается в наличии амино-
Методика моделирования острого септического
кислотного фрагмента His-Glu-His-Glu в
воспалительного процесса на крысах. Для модели-
рования септического воспаления мягких тканей
[68Ga]Ga-FA-II, добавленного с целью уменьше-
использовали культуру клеток E. coli. Клетки
ния накопления в почках in vivo. Проведенные ра-
культивировали в течение трех суток в термостате
нее эксперименты показали обнадеживающие
в среде LB (10 г бактотриптона, 5 г дрожжевого
результаты - при изучении биораспределения
экстракта и 10 г хлорида натрия на 1 л среды).
накопление (%/г от введенной активности) в поч-
Микробные тела в количестве 4·106 в объеме
ках [68Ga]Ga-FA-II было в два-три раза ниже, чем
0.2 мл вводили крысам внутримышечно в двугла-
[68Ga]Ga-FA-I [7].
вую мышцу бедра, после чего на пятые сутки раз-
В качестве тест-систем были взяты крысы сам-
вивалась острая форма воспаления [12, 13].
ки линии Wistar массой 234 ± 27 г, полученные из
Методика моделирования острого асептическо-
сертифицированного питомника лабораторных
го воспалительного процесса на крысах. Традици-
животных «Филиал «Андреевка» НЦБМТ ФМБА
онно для экспериментального воспроизведения
России». Экспериментальных животных содер-
гнойного асептического воспаления используют
жали в требуемых условиях, на стандартной пол-
различные химические раздражающие агенты.
норационной диете, свободном доступе к питье-
Скипидарное воспаление было выбрано для на-
вой воде и пище. Животные были включены в
стоящего исследования как легко воспроизводи-
эксперимент после десятидневного карантина.
мая, точно дозируемая и безопасная для персона-
Все манипуляции с животными, в том числе, свя-
ла классическая модель острого локального асеп-
занные с их эвтаназией, выполняли согласно Ев-
тического воспаления с выраженной клеточной
ропейской Конвенции по их защите, изложенной
реакцией [14]. Асептическое воспаление вызыва-
в директиве Европейского сообщества [9] и Ди-
ли путем внутримышечного введения 0.2 мл ски-
рективе по охране животных, используемых в на-
пидара в двуглавую мышцу бедра. Рекомендуе-
учных целях [10].
мый объем вводимого раствора скипидара был
Методика моделирования системного ювениль-
получен опытным путем при анализе зависимо-
ного идиопатического артрита на крысах. Методи-
сти введения различного объема ирританта от
ка моделирования системного ювенильного
процента гибели животных, сроков формирова-
БИОФИЗИКА том 67
№ 6
2022
1226
ЛУНЁВ и др.
описывающая время, за которое радиоактивность
в камере снижается в два раза, равна (формула 1):
λэфф = λфиз + λбиол.
(1)
На рис. 1 показана камерная модель, описыва-
ющая кинетику исследуемых препаратов. Отра-
жены камеры с наиболее активным накоплением
РФЛП. Модель разбита на шесть камер с эффек-
тивными константами скоростей накопления и
выведения.
При внутривенном введении исследуемых
РФЛП происходит их дальнейшая миграция по
камерам, кинетика которой может быть описана
системой дифференциальных уравнений (форму-
ла 2):
Рис. 1. Камерная модель кинетики транспорта исследу-
емых РФЛП.
dI
=
λ
IB
B
-
λ
BI
I,
dt
dL
ния и степени развития воспаления. Раствор ски-
=
λ
B
-
(λ
+
λ
)L,
LB
BL
CL
пидара стерилизовали фильтрованием через сте-
dt
рилизующий фильтр.
dK
=
λ
KB
B
−
(λ
BK
+
λ
UK
)K,
dt
Исследование биораспределения ex vivo. Изуче-
(2)
dU
ние биораспределения исследуемых радиофарма-
=
λ
K
,
UK
цевтических соединений проводили на 42-е сутки
dt
от начала моделирования ЮИА и на 5-е сутки мо-
dC
=
λ
CL
L
,
делирования воспалительных процессов различ-
dt
ной этиологии. Животные были разбиты на
dB
шесть групп, сформированных по критериям мо-
=
λ
BI
I
+
λ
BL
L
+
λ
BK
K
-
(λ
IB
+
λ
LB
+
λ
KB
)B,
dt
дели патологии и введения исследуемого радио-
фармацевтического соединения по пять крыс в
где эффективные константы скоростей накопле-
ния и выведения имеют вид λкуда/откуда (I - очаг
каждой группе. [68Ga]Ga-FA-I и [68Ga]Ga-FA-II
воспаления, B - кровь, L - печень, K - почки,
((0.5 нмоль,
100 мкл;
500 нM),
10-12 MБк/
U - мочевой пузырь, C - кишечник).
100 мкл для каждого меченого конъюгата) вводи-
ли внутривенно в объеме 0.1 мл. Радиохимиче-
Решением представленной системы диффе-
ренциальных уравнений является нахождение
ская чистота всех препаратов [68Ga]Ga-FА-I и
уравнений показательных функций с эффектив-
[68Ga]Ga-FА-II, используемых для биологиче-
ными скоростями накопления-выведения.
ских исследований, составляла ≥ 98%. Изучение
Из решения уравнений (2) следует, что лишь
биораспределения ex vivo проводили через 30, 60,
экскрецию мочевым пузырем и кишечником
120 и 240 мин после внутривенного введения.
можно описать моноэкспонентой, тогда как био-
Животных подвергали эвтаназии, отбирали орга-
логическое поведение других камер описывается
ны и ткани (кровь, почки, печень, кишечник, мо-
полиэкспоненциальными функциями (с не-
чевой пузырь с содержимым, патологический
сколькими скоростями выведения). Следует от-
очаг), взвешивали пробы. Радиоактивность в ото-
метить, что зачастую быструю аккумуляцию
бранных пробах органов и тканей измеряли мето-
удобно описывать линейной функцией, что зна-
дом прямой радиометрии на автоматическом гам-
чительно упрощает процесс ее последующего ин-
ма-счетчике Wizard 2480 (PerkinElmer, США) с
тегрирования.
последующим определением содержания в них
радиоактивности и выражали в %/орг или %/г ор-
Расчет фармакокинетических параметров. Сум-
гана.
мирование значений интегрированных частей
(накопления и выведения) функции позволит
Моделирование камерного перехода. Если ор-
определить общую площадь под кривой (AUC -
ган (для математической модели и далее по
area under curve), физическим смыслом которой
тексту - камера) является открытой системой, то,
является число ядерных распадов (формула 3) в
кроме физического распада со скоростью λфиз, ч-1,
каждой исследуемой камере:
меченый препарат будет подвергаться биологиче-
t
max
∞
скому выведению со скоростью λбиол, ч-1. Поэто-
C
max
AUC
=
1
F t)
dt
+
2
F t)dt
=
S
+
,
(3)
му общая эффективная скорость выведения λэфф,
λBI
0
tmax
БИОФИЗИКА том 67
№ 6
2022
ИССЛЕДОВАНИЕ КИНЕТИКИ ТРАНСПОРТА РАДИОФАРМАЦЕВТИЧЕСКИХ СОЕДИНЕНИЙ
1227
Таблица 1. Значения исследуемых биологических констант скоростей для камерной модели кинетики
транспорта 68Ga-меченных конъюгатов фолиевой кислоты
Константы скоростей для
Перенос между камерами
[68Ga]Ga-FA-I, ч-1
[68Ga]Ga-FA-II, ч-1
камерной модели
(куда → откуда)
IB
Воспаление → кровь
5.595*
5.853*
BI (ЮИА)
Кровь → воспаление
0.633
0.540
BI (СВ)
Кровь → воспаление
0.671
0.211
BI (АВ)
Кровь → воспаление
0.871
0.267
LB
Печень → кровь
0.078
0.012
BL
Кровь → печень
0.285
0.070
CL
Кишечник → печень
0.652
0.301
KB
Почки → кровь
6.252*
7.841*
BK
Кровь → почки
→0
→0
UK
М. пузырь → почки
0.620
0.088
B
Общая скорость для крови
0.692
0.835
Примечание. ЮИА - ювенильный идиопатический артрит; СВ - септическое воспаление; АВ - асептическое воспаление.
Физическая константа скорости 68Ga - 0.613 ч-1. * - Резкое накопление в течение 30 мин после введения.
где F1(t) - функция быстрой аккумуляции препа-
CL
V
d
=
,
(5)
рата в камере, ограниченной во времени [0,tmax];
λ
eff
F2(t) - функция выведения препарата из камеры с
IA
константой скорости λBI; Cmax - угловой коэф-
C
=
,
(6)
фициент, отражающий максимально возможное
V
d
накопление препарата (или радиоактивности) в
где λэфф - эффективная константа скорости кро-
камере; S - площадь, отражающая резидентное
ви, рассчитанная с помощью камерной модели и
время в отрезке быстрого накоплении и ограни-
метода аппроксимации Рунге-Кутты.
ченная функцией F1(t).
Статистическая обработка полученных резуль-
Клиренс CL (формула 4) отражает элимина-
татов. Все полученные данные обработаны мето-
цию РФЛП путем его выведения из камеры или
дами математической статистики с применением
биотрансформации:
компьютерной программы Statistica™ (TIBCO
Data Science). При статистической обработке ре-
IA
CL
=
,
(4)
зультатов исследования определяли показатели
AUC
средних арифметических значений (M), стан-
дартных ошибок с учетом отклонения значений
где IA - значение введенной активности (injected
выборки от средних арифметических (± m). До-
activity), МБк или кБк.
стоверность различий оценивали с использова-
Чем больше значение клиренса, тем меньше
нием U-критерия Манна-Уитни. Частоты при-
описанная площадь под кривой AUC и, как след-
знаков сравнивали с использованием критерия
ствие, препарат быстрее покидает ту или иную ка-
χ2. Различия считали достоверными при p ≤ 0/05.
меру. Очевидно, что уменьшение числа ядерных
распадов на единицу массы камеры снижает аб-
сорбцию эмиссионной энергии и приводит к
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
уменьшению лучевых нагрузок на пациента в бу-
При начальных условиях B(0) = 1; I(0) = 0;
дущем.
L(0) = 0; K(0) = 0; C(0) = 0; U(0) = 0 и далее экспе-
Зная клиренс, можно найти объем биораспре-
риментальных данных накопления препарата во
деления Vd (формула 5), который показывает, ка-
времени с помощью решения дифференциаль-
кой объем займет введенный радиофармпрепарат
ных уравнений идентифицировали значения
с текущей концентрацией C в исследуемой каме-
констант скоростей накопления и выведения для
ре (формула 6) - чем ниже концентрация, тем
всех исследуемых камер (табл. 1). Следует отме-
больше объем биораспределения
тить, что почти любая константа скорости явля-
БИОФИЗИКА том 67
№ 6
2022
1228
ЛУНЁВ и др.
Таблица 2. Значения фармакокинетических параметров для 68Ga-меченных конъюгатов фолиевой кислоты
Объем
Средняя
Введение
Площадь под
Камера
Клиренс, мл/ч
биораспределения,
концентрация,
[68Ga]Ga-X
кривой, кБк/мл∙ч
мл
кБк/мл
X = FA-I
11.0 ± 1.1
163.7 ± 17.2
125.5 ± 13.8
14.3 ± 1.3
Кровь
X = FA-II
7.2 ± 0.7
249.5 ± 26.2
172.3 ± 19.0
10.4 ± 0.9
X = FA-I
27.3 ± 2.8
65.9 ± 6.9
52.9 ± 5.8
34.0 ± 3.1
ЮИА
X = FA-II
25.5 ± 2.6
70.6 ± 7.4
61.3 ± 6.7
29.4 ± 2.6
X = FA-I
18.4 ± 1.9
97.6 ± 10.2
76.0 ± 8.4
23.7 ± 2.1
СВ
X = FA-II
19.0 ± 2.0
95.0 ± 10.0
115.2 ± 12.7
15.6 ± 1.4
X = FA-I
10.9 ± 1.1
165.7 ± 17.4
111.7 ± 12.3
16.1 ± 1.4
АВ
X = FA-II
18.5 ± 1.9
97.3 ± 10.2
110.6 ± 12.2
16.3 ± 1.5
X = FA-I
13.4 ± 1.4
134.3 ± 14.1
106.2 ± 11.7
17.0 ± 1.5
Печень
X = FA-II
9.8 ± 1.0
183.6 ± 19.3
200.9 ± 22.1
9.0 ± 0.8
X = FA-I
16.1 ± 1.7
111.7 ± 11.7
87.4 ± 9.6
20.6 ± 1.9
Почки
X = FA-II
13.5 ± 1.4
133.7 ± 14.0
134.3 ± 14.8
13.4 ± 1.2
X = FA-I
25.6 ± 2.6
70.2 ± 7.4
78.2 ± 8.6
23.0 ± 2.1
Легкие
X = FA-II
22.2 ± 2.3
81.0 ± 8.5
118.6 ± 13.0
15.2 ± 1.4
X = FA-I
11.0 ± 1.1
163.7 ± 17.2
125.5 ± 13.8
14.3 ± 1.3
Кишечник
X = FA-II
7.2 ± 0.7
249.5 ± 26.2
172.3 ± 19.0
10.4 ± 0.9
Примечание. ЮИА - ювенильный идиопатический артрит; СВ - септическое воспаление; АВ - асептическое воспаление.
ется одновременно для одной камеры константой
Фармакокинетические параметры для иссле-
накопления, а для другой выведения.
дуемых препаратов представлены в табл. 2.
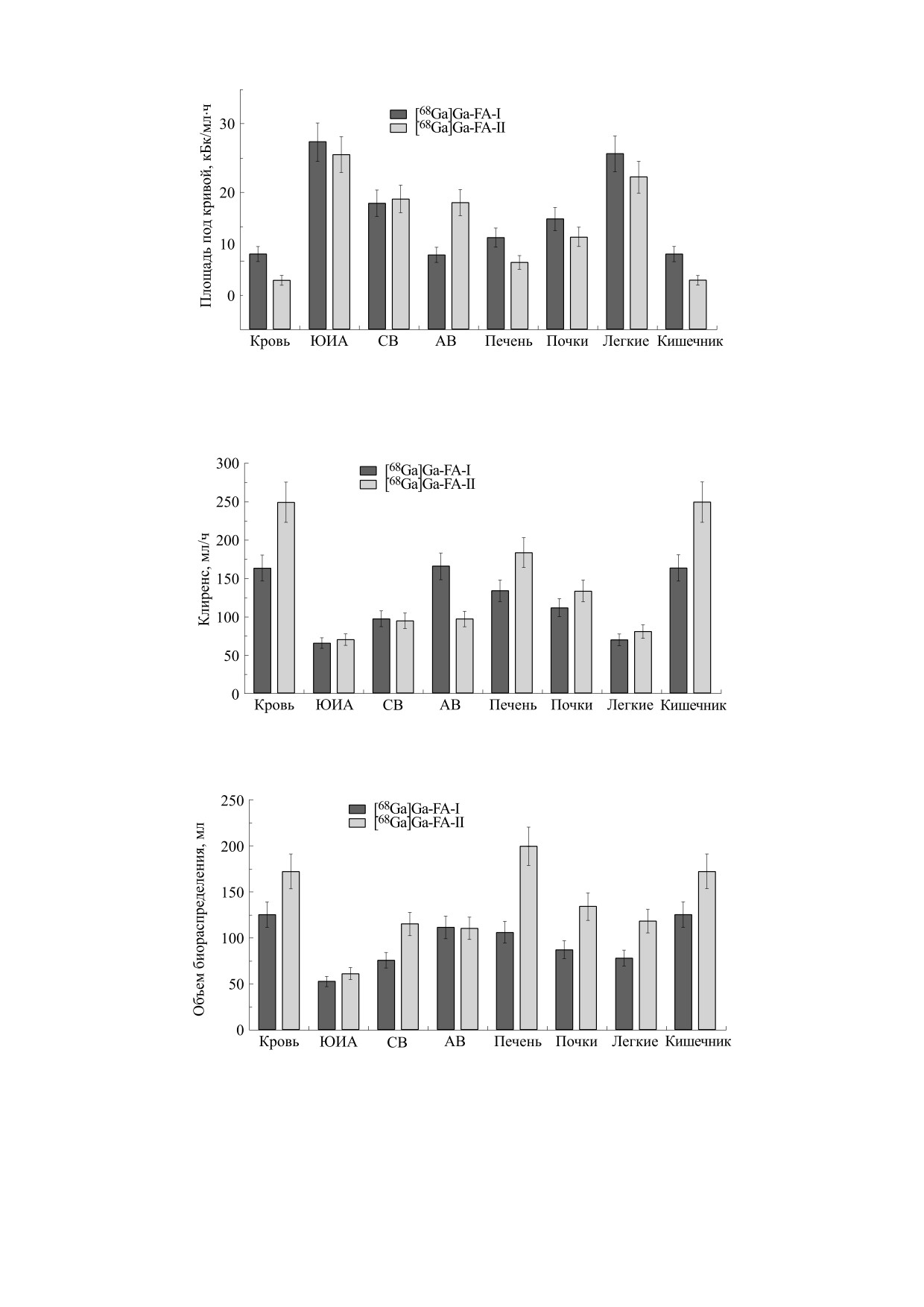
При снижении площади под кривой (рис. 2)
Анализ камерной модели кинетики транспор-
прямо пропорционально увеличивался клиренс
та на основе результатов, представленных в
введенного РФЛП из камеры (рис. 3). Для боль-
табл. 1, показал, что после внутривенного введе-
шинства органов и тканей нет статистически до-
ния происходит максимально быстрая миграция
стоверной разницы между площадями под кри-
препарата из крови в очаги воспаления и почки
вой для двух препаратов, за исключением крови,
для обоих препаратов в течение первого часа.
асептического воспаления и кишечника, что го-
ворит о более контрастной визуализации очагов
Однако [68Ga]Ga-FA-II заметно медленнее (в
три-четыре раза) выводился из очагов септиче-
воспаления при применении [68Ga]Ga-FA-II.
ского и асептического воспаления по сравнению
Увеличение клиренса определенных камер
с [68Ga]Ga-FA-I. Скорость миграции [68Ga]Ga-
приводит к разбавлению радиоактивности и сни-
FA-II в печень также была в шесть раз ниже, по-
жению лучевых нагрузок. Так, клиренс крови, пече-
сле чего лишь 20% попадало в общий кровоток, а
ни и кишечника от галлия-68 для [68Ga]Ga-FA-II
80% мигрировало в кишечник, напротив, для
статистически достоверно был выше по сравне-
[68Ga]Ga-FA-I эти значения составляли около 30
нию с [68Ga]Ga-FA-I при сохранении более низ-
и 70% соответственно, с точки зрения скоростей
ких значений для очагов воспаления, что пози-
переноса между камерами. Определить точную
тивно подтверждает эффективность использова-
скорость транспорта РФЛП из почек обратно в
ния таких РФЛП для контрастной визуализации
кровь достоверно не представилось возможным в
методом позитронно-эмиссионной томографии.
силу постоянной фильтрации крови через них,
Клиренс почек от радиоактивности не различал-
однако скорость выведения [68Ga]Ga-FA-II из
ся для обоих препаратов.
почек в сторону мочевого пузыря была в семь раз
Объем биораспределения (рис. 4) находится в
выше, чем для [68Ga]Ga-FA-I.
обратно пропорциональной зависимости со сред-
БИОФИЗИКА том 67
№ 6
2022
ИССЛЕДОВАНИЕ КИНЕТИКИ ТРАНСПОРТА РАДИОФАРМАЦЕВТИЧЕСКИХ СОЕДИНЕНИЙ
1229
Рис. 2. Сравнение значений площади под кривой AUC для различных органов и тканей при введении 68Ga-меченных конъ-
югатов фолиевой кислоты: ЮИА - ювенильный идиопатический артрит, СВ - септическое воспаление, АВ - асептиче-
ское воспаление.
Рис. 3. Сравнение значений клиренса для различных органов и тканей от 68Ga-меченных конъюгатов фолиевой кислоты:
ЮИА - ювенильный идиопатический артрит, СВ - септическое воспаление, АВ - асептическое воспаление.
Рис. 4. Сравнение значений объема биораспределения для различных органов и тканей при введении 68Ga-меченных
конъюгатов фолиевой кислоты: ЮИА - ювенильный идиопатический артрит, СВ - септическое воспаление, АВ -
асептическое воспаление.
БИОФИЗИКА том 67
№ 6
2022
1230
ЛУНЁВ и др.
Рис. 5. Сравнение значений средней концентрации 68Ga-меченных конъюгатов фолиевой кислоты для различных органов
и тканей: ЮИА - ювенильный идиопатический артрит, СВ - септическое воспаление, АВ - асептическое воспаление.
ней концентрацией препаратов для органов и
кулу фрагмента His-Glu-His-Glu благоприятно
тканей (рис. 5).
скажется на возможности применения в визуали-
зации воспалительных процессов методом пози-
Статистически достоверное различие в объеме
биораспределения для многих органов и тканей
тронно-эмиссионной томографии.
подчеркивает разницу в фармакокинетическом
поведении исследуемых препаратов: [68Ga]Ga-
КОНФЛИКТ ИНТЕРЕСОВ
FA-II из большинства органов и тканей выводит-
Авторы заявляют об отсутствии конфликта
ся быстрее, чем [68Ga]Ga-FA-I, при этом суммар-
интересов.
но сохраняются одинаковые характеристики для
очагов воспаления.
Таким образом, исследование кинетики
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
транспорта радиофармацевтических препаратов
Все применимые международные, националь-
на основе фолиевой кислоты подтвердило, что
ные и институциональные принципы ухода и ис-
дополнительное введение в молекулу аминокис-
пользования животных при выполнении работы
лотного фрагмента His-Glu-His-Glu позволяет
были соблюдены.
значительно снизить среднюю концентрацию
(кБк/мл) [68Ga]Ga-FA-II в почках (в 1.5 раза ниже
СПИСОК ЛИТЕРАТУРЫ
по сравнению с [68Ga]Ga-FA-I) наряду со сниже-
1. В. И. Скворцова, Ядерная медицина: справочник для
нием накопления в три раза [7].
персонала отделений, лабораторий и центров ядер-
ной медицины,
2-е изд., доп. (ГНЦ ФМБЦ
ВЫВОДЫ
им. А.И. Бурназяна ФМБА России, М., 2020).
2. M. G. Stabin and J. A. Siegel, Health Physics, 85 (3),
Дополнительное введение в молекулу амино-
294 (2003).
кислотного фрагмента His-Glu-His-Glu измени-
ло динамику распределения соединения
3. А. Н. Клёпов, Ю. А. Кураченко, В. А. Левченко
и др., Применение методов математического моде-
[68Ga]Ga-FA-II по сравнению с [68Ga]Ga-FA-I.
лирования в ядерной медицине (Обнинск, 2006).
Наблюдалось снижение накопления [68Ga]Ga-
4. A. Ferreira, H. Martins, J. C. Oliveira, et al., Current
FA-II в почках, что позволило положительно
Drug Metabolism, 22 (2), 150 (2021).
скорректировать кинетику транспорта, согласно
созданной камерной математической модели.
5. C. Müller, Molecules, 18, 5005 (2013).
Изменение при введении аминокислотного
6. M. Fernandez, F. Javaid, V. Chudasama, Chem. Sci., 9
фрагмента фармакокинетических параметров
(4), 790 (2018).
также подразумевает значительное снижение лу-
7. A. Larenkov, M. Rakhimov, K. Lunyova, et al., Mole-
чевых нагрузок на критические органы и ткани
cules, 25, 2712 (2020).
(кровь, печень, кишечник).
8. Государственный стандарт РФ ГОСТ 33044-2014.
Математические расчеты количественно под-
Принципы надлежащей лабораторной практики
твердили, что дополнительное введение в моле-
(Стандартинформ, М., 2019).
БИОФИЗИКА том 67
№ 6
2022
ИССЛЕДОВАНИЕ КИНЕТИКИ ТРАНСПОРТА РАДИОФАРМАЦЕВТИЧЕСКИХ СОЕДИНЕНИЙ
1231
9. Европейская конвенция по защите позвоночных жи-
12. A. H. Groll, C. E. Gonzalez, N. Giri, et al., J. Antimi-
вотных, используемых для экспериментальных и дру-
crob. Chemother., 43 (1), 95 (1999)..
гих научных целей (ЕЭС, Страсбург, 1986).
13. А. С. Лунёв, Дис
канд. биол. наук (Моск. вет.
10. Директива 2010/63/EU Европейского парламента и
академия им. К.И. Скрябина, М., 2016).
Совета ЕС по охране животных, используемых в на-
учных целях (Rus-LASA, СПб, 2012).
14. Е. И. Шишацкая, Бюл. эксперим. биологии и ме-
11. Патент RU 2 612 843 C1, 8, 2017.
дицины, 144 (12), 635 (2007).
Kinetic Study of Folate-Based Radiopharmaceuticals Labeled by 68Ga
A.S. Lunev*, K.A. Lunyova*, **, F.I. Vasilevich**, M.G. Rakhimov*, and A.A. Larenkov*
*A.I. Burnasyan Federal Medical Biophysical Center, Zhivopisnaya ul. 46, Moscow, 123098 Russia
**K.I. Skryabin Moscow State Academy of Veterinary Medicine and Biotechnology,
ul. Akademika Skryabina 23, Moscow, 109472 Russia
Radiopharmaceuticals that are given intravenously are moved into metabolic pathways in the organism by
binding to carrier molecules, the kinetic schemes of which will be crucial in achieving the result (therapeutic
or diagnostic effect). The development of in silico model of the transport kinetics of a radiopharmaceutical is
important in that it can allow for extraction of quantitative information about transfer of a radiopharmaceu-
tical between organs (cameras or compartments). Among promising agents for imaging purposes of malignant
neoplasms and rheumatic pathologies is a 68Ga labeled folic acid. The study of the kinetics of folic acid-based
radiopharmaceuticals using experimental data obtained on a Wistar rat model of inflammation that has dif-
ferent causes confirmed that additional introduction of the amino acid fragment His-Glu-His-Glu to the
molecule (as part of [68Ga]Ga-FA-II conjugate) is useful to significantly reduce radioactivity uptake in the
kidneys as opposed to unmodified analog [68Ga]Ga-FA-I. Alterations in pharmacokinetic parameters after
administration of the amino acid fragment imply a significant reduction in radiation doses on critical organs
and tissues and will be associated with the possibility of using the studied compounds for imaging purposes
of pathological processes during positron emission tomography.
Keywords: pharmacokinetics, camera model, folates, radiopharmaceuticals, biodistribution, gallium-68
БИОФИЗИКА том 67
№ 6
2022