БИОФИЗИКА, 2022, том 67, № 6, с. 1236-1242
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 577.359: 616.77
ОЦЕНКА ТРОМБООБРАЗОВАНИЯ ПРИ ИМПЛАНТАЦИИ В АРТЕРИЮ
КРОЛИКА ПОЛИУРЕТАНОВОГО СОСУДИСТОГО ПРОТЕЗА,
ОБРАБОТАННОГО АЗОТНОЙ ПЛАЗМОЙ
© 2022 г. В.С. Чудинов*, #, И.Н. Шардаков*, В.В. Литвинов**, Г.Г. Фрейнд**,
С.Ю. Солодников***, В.В. Маслова****
**Пермский государственный медицинский университет, Петропавловская ул., 26, Пермь, 614990, Россия
***Пермский национальный исследовательский политехнический университет,
Комсомольский просп., 29, Пермь, 614990, Россия
****Санкт-Петербургский научно-исследовательский институт вакцин и сывороток ФМБА России, ул. Свободы,
52, Санкт-Петербург, Красное село, 198320, Россия
#E-mail: chudinovsl@mail.ru
Поступила в редакцию 18.06.2022 г.
После доработки 12.07.2022 г.
Принята к публикации 13.07.2022 г.
Образцы сосудистых протезов синтезировали из полиуретана на основе полипропиленгликоля,
терминированного 2,4-толуилендиизоцианатом. Внешняя и внутренняя поверхности имплантатов
обрабатывались ионами азота высокой энергии 20 и 10 кэВ соответственно. В результате ионно-
плазменной обработки на поверхностях имплантатов был сформирован активный гидрофильный
углеродный нанослой. На внутреннюю и внешнюю поверхности образцов, обработанных ионно-
плазменным методом, нанесен белок тропоэластин. Обработанные и необработанные плазмой
образцы протезов были имплантированы в сонную артерию кроликов. После недели экспозиции
проведена морфологическая оценка тканей, окружающих стенки внутрисосудистых протезов.
Показано, что внутри всех протезов сформировались тромбы. Однако морфологическая картина
тканей вокруг стенок имплантатов, обработанных плазмой, характеризуется ускоренной
канализацией тромба и пролиферацией эндотелия со стороны интимы сосуда по сравнению с
необработанными имплантатами.
Ключевые слова: биосовместимость, тромб, полиуретан, ионно-плазменная обработка, углеродный
слой.
DOI: 10.31857/S0006302922060217, EDN: LMDZHX
В ангиохирургии актуальным вопросом оста-
менном применении имплантатов из данных
ется применение протезов вен и артерий малого
видов материалов статистика ухудшается, нару-
диаметра, т.к. это может быть обусловлено дефи-
шается проходимость протезов по причине их
цитом собственных сосудов для замещения пора-
тромбоза. Через три года применения этих им-
женных участков [1, 2]. Следует отметить, что
плантатов замена требуется в 31% случаев, а через
синтетические материалы для имплантации все-
пять лет - в 61% случаев [7, 8]. Еще в 1979 г. авто-
гда вызывают реакцию на инородное тело, кото-
ры работы [9] в наблюдениях за 362 имплантата-
рая проявляется хроническим воспалением с
ми из растянутого политетрафторэтилена марки
формированием вокруг имплантата фиброзной
Gore-Tex, вживленными больным при операции
ткани или тромботических масс при соприкосно-
бедренно-подколенного шунтирования, отмети-
вении материала с кровью [3, 4].
ли проходимость протезов через три года лишь у
58% больных. Клинически применение синтети-
В сосудистой хирургии широко распростране-
ческих эндопротезов сердечно-сосудистой систе-
но использование имплантатов из политет-
мы вызывает опасность возникновения тромбо-
рафторэтилена. Важно отметить, что в 89-99%
зов и тромбоэмболического синдрома, которые
случаев применения протезов из политетрафтор-
могут привести к смерти пациента. Наибольшая
этилена в краткосрочном периоде использова-
частота таких осложнений эндопротезирования
ния, до одного месяца, проблемы с их проходи-
сосудов наблюдается при таких достаточно рас-
мостью отсутствуют [5, 6]. Однако при долговре-
пространенных сопутствующих заболеваниях как
1236
ОЦЕНКА ТРОМБООБРАЗОВАНИЯ ПРИ ИМПЛАНТАЦИИ
1237
сахарный диабет, злокачественные опухоли, а
стой хирургии. В данной работе мы используем
также при протезировании сосудов малого диа-
рецептуру полиуретанов с механическими свой-
метра, менее 6 мм.
ствами максимально сходными с характеристи-
ками мягких тканей [18].
Ранее нами были проведены исследования
взаимодействия белков и клеточных культур с уг-
леродным нанослоем, сформированного обра-
МАТЕРИАЛЫ И МЕТОДЫ
боткой ионами высокой энергии полиуретанов
различных рецептур. Было продемонстрировано,
Для синтеза полиуретана на основе полипро-
что белки образуют ковалентную связь с гидро-
пиленгликоля-диизоцианата использовали ком-
фильной углеродной поверхностью полиурета-
поненты фирмы Sigma-Aldrich (США). Полиуре-
нов, образованной в результате плазменной обра-
тан синтезировали из форполимера на основе
ботки, что способствует улучшенной пролифера-
полипропиленгликоля с концевыми гидроксиль-
ции эндотелиальных клеток на них [10, 11].
ными группами, терминированными 2,4-толуи-
Образование ковалентной связи между адсорби-
лендиизоцианатом. Для отверждения форполи-
рованным белком и обработанной азотной плаз-
мер смешивали с политетрагидрофураном в реак-
мой поверхностью полимера обеспечивается на-
ционном боксе при влажности
2-3% и
личием неспаренных электронов на краю угле-
температуре 23°С в течение 5 мин и наносили на
родных кластеров в модифицированном ионным
стеклянные формы. Соотношение изоцианатных
пучком поверхностном слое [12]. Неспаренные
и гидроксильных групп составляло 100 : 35. Реак-
электроны в таких структурах могут продолжи-
цию отверждения проводили в течение трех суток
тельное время (до года) находиться в активном
в заданных условиях, после чего полученный по-
состоянии по причине их стабилизации π-элек-
лиуретан отжигали в вакуумном термошкафу при
тронным облаком конденсированных полиаро-
температуре 120°С и давлении 7·10-2 миллибар.
матических структур. Гидрофильность обрабо-
Затем форму с полиуретаном погружали в толуол
танной азотной плазмой поверхности позволяет
до равновесного набухания полиуретана. Данный
сохранять каталитическую активность адсорби-
растворитель разрешен к применению в техноло-
рованных белков [13].
гии медицинских имплантатов согласно доку-
Процесс адсорбции белка аналогично проис-
ментации FDA. После этого полиуретан отслаи-
ходит на модифицированной плазмой поверхно-
вали от стеклянной формы и сушили на воздухе
до полного удаления растворителя, что детекти-
сти имплантата после его внедрения в живой ор-
ровалось методом ИК-спектроскопии много-
ганизм. Важно отметить, что адсорбция белков на
поверхности инородного тела является первым
кратно нарушенного полного внутреннего отра-
этапом взаимодействия организма и искусствен-
жения. После синтеза низкомолекулярные про-
ного имплантата и влияет на дальнейшее разви-
дукты удаляли из полиуретана с помощью
набухания в гептане. Для отмывки полиуретанов
тие реакции организма на внедренный имплантат
после синтеза использовали деионизированную
[14, 15]. На основании имеющихся результатов
воду с удельным сопротивлением 18 МОм·см при
исследований предполагается, что реакция орга-
низма на внедрение имплантата, модифициро-
25°С, получаемую из системы Direct Q5 (Milli-
ванного азотной плазмой, будет отличаться от ре-
pore, США). Полученный имплантат после от-
мывки в деионизированной воде сушили на воз-
акции после вживления имплантата без обработ-
духе. При сушке полиуретан защищали от попа-
ки. Это предположение было подтверждено нами
в экспериментах с лабораторными животными.
дания пыли.
При подкожном внедрении образцов импланта-
Для эксперимента по установке в кровенос-
тов в лабораторных крыс наблюдалась менее вы-
ный сосуд полимерного протеза по описанной
раженная клеточная и тканевая реакция организ-
методике синтеза были подготовлены 4 полые
ма на полиуретаны после ионно-плазменной об-
трубки из полиуретана. Внешний диаметр трубок
работки при сравнении с необработанными [11,
составлял 2 мм, толщина стенки 100 мкм и длина
16, 17].
10 мм. Два протеза не подвергали предваритель-
ной обработке, еще два протеза были обработаны
В данной работе мы продолжаем комплекс ис-
в Университете Сиднея (Австралия) ионно-плаз-
следований полиуретанов, обработанных азотной
менным методом, адаптированным к использо-
плазмой, в экспериментах на животных на при-
ванию для изделий сложной формы, описанным
мере имплантации внутрисосудистого протеза в
в патенте [19]. Для ионно-плазменной обработки
сонную артерию кроликов с морфологической
внешней стороны протеза использовали метод
оценкой тромбообразования. Описанный далее
плазменно-иммерсионной ионной имплантации
эксперимент является предварительным и пока-
при энергии ионов 20 кэВ и времени обработки
зывает целесообразность дальнейших исследова-
ний полимерных материалов, обработанных ион-
800 с, что соответствовало флюенсу 1016 ион/см2.
но-плазменным методом, для сердечно-сосуди-
Плазменную обработку внутренней стенки про-
БИОФИЗИКА том 67
№ 6
2022
1238
ЧУДИНОВ и др.
Рис. 1. Внедрение внутрисосудистого имплантата в лабораторное животное: выделение тупым способом левой сонной
артерии (а) и внедрение имплантатов в сосуд (б).
теза выполняли в течение 10 мин при амплитуде
восстановление кровотока в сосуде. Операцион-
напряжения 10 кэВ и давлении в подводящей
ную рану ушивали шовным материалом «Ви-
трубке 2 торр. После обработки протезы погружа-
крил» 4/0. Швы обрабатывали 3%-й перекисью
ли в буферный раствор с белком тропоэластином
водорода. После операции животным вводили
в концентрации 100 мкг/мл при pH 7.0. Далее об-
изотонический раствор хлорида натрия (20 мл)
разцы высушивали, упаковывали и транспорти-
подкожно, внутримышечно вводили фуросемид в
ровали в Пермь (Россия). Все четыре протеза пе-
дозировке 0.5 мл, дексаметазон - 0.5 мл, сульфо-
ред операцией имплантации подвергали стерили-
камфокаин - 0.5 мл, цефтриаксон - 100 мг. Про-
зации в течение
10 мин ультрафиолетым
должительность операции составляла 42-45 мин.
облучением с длиной волны 254 нм в ламинарном
Наблюдение за животными проводили непре-
боксе Lamsystems и погружали в фосфатно-бу-
рывно в течение шести часов, далее выполняли
ферный раствор с pH 7.4 до момента операции.
ежедневный ветеринарный осмотр в течение се-
ми суток.
Эксперимент проводили на четырех кроликах
породы Советская шиншилла. Кроликам № 1 и 2
Эвтаназию животных проводили под нарко-
из опытной группы был имплантирован сосуди-
зом «Золетил» в дозе 10 мг/кг. Извлеченные части
стый протез, внутренняя поверхность которого
сонной артерии с имплантатом разрезали попе-
была обработана ионно-плазменным методом с
рек на две части и фиксировали в 10%-м растворе
последующим нанесением слоя белка тропоэла-
нейтрального формалина.
стин. Кроликам № 3 и 4 из контрольной группы
вживлены полиуретановые образцы имплантатов
Обработку препаратов внутрисосудистых им-
без ионно-плазменной обработки.
плантатов проводили по общепринятой методи-
ке. Срезы на микротоме делали с обеих сторон
Перед операцией всем животным вводили 0.05
анастомоза и по середине исследуемого крове-
мл гепарина и 0.1 мл 1%-го атропина. Операцию
носного сосуда, окрашивали гематоксилином и
по вживлению сосудистых протезов выполняли
эозином. Для оценки зрелости фибрина приме-
под общим наркозом препаратом «Золетил» в до-
няли методики окраски по Зербино (оранжевый,
зе 8 мг/кг внутримышечно. После введения жи-
вотного в наркоз место операции выбривали ма-
кислотный красный, водный голубой). Зрелость
фибрина оценивали в зависимости от сроков его
шинкой для стрижки животных. Скальпелем раз-
резали кожный покров, тупым способом
образования. «Молодым» характеризовали фиб-
выделяли левую сонную артерию (рис. 1а), на ко-
рин, волокна которого окрашиваются в желто-
торую для остановки кровотока накладывали две
оранжевый цвет, сроки его образования состав-
сосудистые клипсы. В дистальном конце выде-
ляют 0-6 ч; «зрелым» называли фибрин, окраши-
ленного сосуда заточенной инъекционной иглой
ваемый в красный цвет, сроки его образования 6-
вскрывали оболочки сосуда и в просвет сосуда
24 ч; «старым» -фибрин, окрашиваемый в синий
пинцетом вводили имплантаты (рис. 1б). На со-
цвет, сроки его образования более 24 ч. На гото-
судистый дефект наносили два шва нитями PRO-
вых гистологических срезах оценивали общую
LEN 007, для дополнительной герметизации ар-
морфологическую картину, сохранную площадь
терии использовали сульфакрилатный клей.
просвета артерии, состав и зрелость структурных
Снимали клипсы и визуально контролировали
компонентов сформированного тромба.
БИОФИЗИКА том 67
№ 6
2022
ОЦЕНКА ТРОМБООБРАЗОВАНИЯ ПРИ ИМПЛАНТАЦИИ
1239
Рис. 2. Кролик № 1, гистологический срез тканей в сосудистом протезе с модифицированной поверхностью (окраска
гематоксилином и эозином) и контуры полости кровотока.
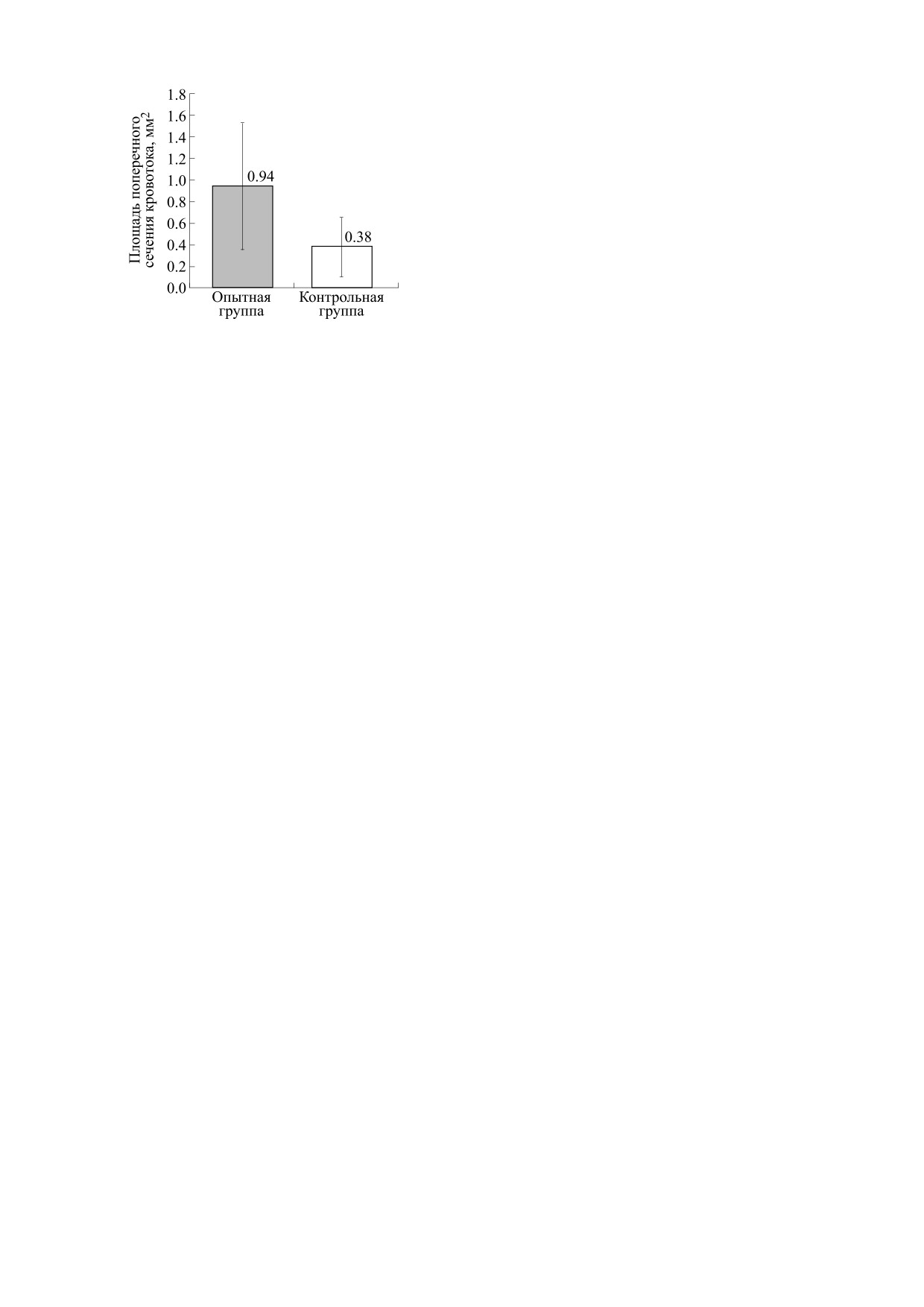
Для подсчета площади поперечного сечения
преобладает «старый» фибрин, что указывает на
восстановленного кровотока делали микрофото-
сроки образования тромба от 18 до 24 ч.
графии с помощью цифровой оптической систе-
Необработанные контрольные имплантаты.
мы микроскопии (Hirox, Япония). Снимки обра-
Окружающие имплантат ткани кролика № 3 ха-
батывали с помощью программного пакета «Im-
рактеризуются формированием нескольких мел-
age J». Всего исследовали по четыре поперечных
ких полостей, выстланных эндотелием вблизи
среза сонной артерии кролика, содержащей им-
интимы сосуда. В просвете сосуда наблюдается
плантат.
крупный смешанный тромб с каналом средних
размеров (рис. 4). В тромботических массах пре-
обладают волокна «молодого» и единичные во-
РЕЗУЛЬТАТЫ
локна «зрелого» фибрина, что указывает на сроки
образования тромба от 12 до 18 ч. В отдельных
В ходе ежедневного мониторинга состояния
участках отмечается пролиферация интимы со-
животных после оперативного вмешательства у
суда.
всех четырех кроликов не выявлено нарушений в
У кролика № 4 в просвете сосуда наблюдается
поведении, кожных покровах и питании.
крупный тромб, в одном из участков которого
Модифицированные плазмой имплантаты. При
видна полость - канализация (рис. 5). В тромбо-
анализе опытного образца тканей кролика № 1
тических массах преобладают волокна «зрелого»
обнаружено, что тромботические массы рыхлые,
фибрина, что указывает на сроки образования
характеризуются нитями фибрина и эритроцита-
тромба от 18 до 24 ч. Отмечается слабая пролифе-
ми. Наблюдается тромб небольших размеров, на
рация интимы и формирование щелевидной по-
фоне которого встречаются пучки фибробластов.
лости. Вблизи интимы сосудов локализуются не-
В тромботических массах преобладают волокна
большие фокусы соединительной ткани, свиде-
«зрелого» и «старого» фибрина, что указывает на
тельствующие об организации тромба.
сроки образования тромба от 18 до 24 ч. Со сторо-
На рис. 6 представлен график средних значе-
ны интимы отмечается пролиферация эндотелия,
ний площади поперечного сечения восстанов-
замещение тромботических масс соединительной
ленного кровотока в полости сосудов животных с
тканью. Также наблюдается наличие крупных по-
имплантатами без обработки плазмой и обрабо-
лостей - канализация тромба, в части полостей
танных ионно-плазменным методом.
отмечается
эндотелизация-реваскуляризация
(рис. 2).
ОБСУЖДЕНИЕ
В тканях, окружающих имплантат кролика
По результатам гистологического исследова-
№ 2, отмечается выраженная полиморфнокле-
ния в группе животных с необработанными поли-
точная инфильтрация сосудистой стенки (лим-
мерными имплантатами наблюдалась типичная
фоциты, макрофаги, нейтрофилы). Просвет со-
картина тромбообразования на поверхности кон-
суда выполнен тромбом с выраженными призна-
тактирующего с кровью инородного тела. Про-
ками организации и средними полостями
свет сосуда был выполнен тромботическими мас-
канализации (рис. 3). В тромботических массах
сами со слабой пролиферацией эндотелия инти-
БИОФИЗИКА том 67
№ 6
2022
1240
ЧУДИНОВ и др.
Рис. 3. Кролик № 2, гистологический срез тканей в сосудистом протезе с модифицированной поверхностью (окраска
гематоксилином и эозином) и контуры полости кровотока.
Рис. 4. Кролик № 3, гистологический срез тканей в сосудистом протезе с немодифицированной плазмой поверхностью
(окраска гематоксилином и эозином) и контуры полости кровотока.
Рис. 5. Кролик № 4, гистологический срез тканей в сосудистом протезе с необработанной плазмой поверхностью (окраска
гематоксилином и эозином) и контуры полости кровотока.
БИОФИЗИКА том 67
№ 6
2022
ОЦЕНКА ТРОМБООБРАЗОВАНИЯ ПРИ ИМПЛАНТАЦИИ
1241
При этом в опытной группе (с обработанными
азотной плазмой имплантатами) канализирован-
ные участки кровотока по площади сечения в два
с половиной раза превышают размеры у кон-
трольной группы (необработанные имплантаты).
Также со стороны интимы опытная группа харак-
теризуется более выраженной пролиферацией
эндотелия по сравнению с контрольной. На ос-
новании предварительного эксперимента по им-
плантации лабораторным животным сосудистых
полиуретановых протезов, обработанных азотной
плазмой, можно сделать вывод о возможности
применения искусственных полиуретановых
протезов с ионно-плазменными методами обра-
ботки. Для дальнейших исследований требуется
Рис. 6. Результаты гистологического исследования ре-
отработать оптимальные режимы ионно-плаз-
канализации тромба в образцах протезов сосудов опыт-
менной обработки, условия хранения и вживле-
ной (обработанной плазмой) и контрольной (не обра-
ния имплантата, разработать протокол послеопе-
ботанной плазмой) групп животных.
рационной антикоагулянтной терапии, провести
новые эксперименты с целью статистического
мы и небольшим количеством щелевидных
подтверждения результата.
полостей. Наблюдалась медленно протекающая
канализация тромба без его выраженной органи-
БЛАГОДАРНОСТИ
зации, что говорит о затяжном процессе тромбо-
образования.
Выражаем благодарности исследователям
В опытной группе животных с протезами сосу-
А.В. Кондюрину и И.В. Кондюриной из «Эвин-
дов, обработанными ионно-плазменным мето-
гар Сайнтифик», проф. М. Билек, проф. Д. Мак-
дом и с нанесенным белковым слоем тропоэла-
кензи и проф. А. Вайсу Университета Сиднея за
стина, сформированные тромботические массы в
разрешение работать в их лабораториях и предо-
просвете были меньших размеров по сравнению с
ставленный белок тропоэластин.
группой контроля. Со стороны интимы наблюда-
лась пролиферация эндотелия и замещение тром-
ФИНАНСИРОВАНИЕ РАБОТЫ
ботических масс соединительной тканью с выра-
женной канализацией тромба.
Работа выполнена при поддержке Российско-
Образование тромбов и в опытной, и в кон-
го фонда фундаментальных исследований и
трольной группах обусловлено малыми диамет-
Пермского края (проект № 20-48-596014), а также
рами имплантатов и отсутствием антикоагулянт-
Государственного задания ИМСС УрО РАН.
ной терапии в послеоперационный период. Од-
нако данная модель эксперимента создает
наиболее подходящие условия для развития
КОНФЛИКТ ИНТЕРЕСОВ
тромбообразования с возможностью оценки ре-
Авторы заявляют об отсутствии конфликта
акции организма на имплантацию искусственно-
интересов.
го сосудистого протеза.
Из оценки полученных результатов следует,
что опытная группа характеризуется ускоренной
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
канализацией и васкуляризацией тромба. Пло-
Хирургические вмешательства, содержание,
щадь участков для кровотока у опытной группы в
питание и эвтаназия животных соответствовали
два с половиной раза превышает размер таких
требованиям Европейской конвенции по защите
участков у контрольной группы.
позвоночных животных, используемых для экс-
периментов или иных научных целях.
ВЫВОДЫ
По результатам морфологических исследова-
СПИСОК ЛИТЕРАТУРЫ
ний тканей, окружающих стенки сосудистых
1. F. J. Veith, C. M. Moss, S. Sprayregen, et al., Surgery,
протезов, имплантированных в сонную артерию
85 (3), 253 (1979).
кроликов, выявлено, что внутри всех протезов,
как обработанных ионно-плазменным методом,
2. Г. И. Попов, П. В. Попрядухин, Г. Ю. Юкина и др.,
так и необработанных, сформировались тромбы.
Цитология, 62 (1), 38 2020).
БИОФИЗИКА том 67
№ 6
2022
1242
ЧУДИНОВ и др.
3.
И. В. Попова, А. О. Степанова, Д. С. Сергеевичев
tion B: Beam Interactions with Materials and Atoms,
и др., Патология кровообращения и кардиохирур-
440, 163 (2019).
гия, 19 (4), 63 (2015).
12. Б. Рэнби и Я. Рабек, Фотодеструкция, фотоокис-
4.
M. S. Lord, W. Yu, B. Cheng, et al., Biomaterials, 30
ление, фотостабилизация полимеров, под ред.
(28), 4898 (2009).
Н. М. Эмануэля (Мир, М., 1978).
13. C. T. H. Tran, N. J. Nosworthy, A. Kondyurin, et al.,
5.
Л. А. Бокерия, М. Б. Темрезов и В. И. Коваленко,
RSC Adv., 3, 23604 (2013).
Анналы хирургии, № 2, 5 (2010).
14. W. J. Hu, J. W. Eaton, T. P. Ugarova, et al., Blood, 98
6.
C. Devine and C. McCollum, J. Vasc. Surg., 40 (5), 924
(4), 1231 (2001).
(2004).
15. Биоcовмеcтимоcть, под pед. В. И. Cеваcтьянова и
7.
P. Klinkert, P. N. Post, P. J. Breslau, et al., Eur. J. Vasc.
М. П. Киpпичникова (Медицинcкое инфоpмаци-
Endovasc. Surg., 27 (4), 357 (2004).
онное агентcтво, М., 1999).
8.
I. J. Rychlik, P. Davey, J. Murphy, et al., J. Vasc. Surg.,
16. В. С. Чудинов, И. В. Кондюрина, В. Н. Терпугов
60 (2), 506 (2014).
и др., Мед. техника, № 4, 19 (2020).
9.
H. Haimow, F. Giron, H. J. Haimow, et al., Arch.
17. V. S. Chudinov, I. N. Shardakov, V. V. Maslova, et al.,
Surg., 114 (6), 673 (1979).
In AIP Conf. Proc., 2167, 020055 (2019).
10.
В. С. Чудинов, И. В. Кондюpина, И. Н. Шаpдаков
18. I. Kondyurina, S. G. Wise, A. K. Y. Ngo, et al.,
и др., Биофизика, 63 (3), 444 (2018).
Biomed. Mater., 12 (4), 045002 (2017).
11.
V. Chudinov, I. Kondyurina, V. Terpugov, et al., Nucle-
19. И. Н. Шардаков и В. С. Чудинов, Патент РФ
ar Instruments and Methods in Physics Research, Sec-
№ 2721280 (2020).
Assessment of Thrombus Formation during Implantation
of a Polyurethane Vascular Prosthesis Treated with Nitrogen Plasma
in the Rabbit Artery
V.S. Chudinov*, I.N. Shardakov*, V.V. Litvinov**, G.G. Friend**,
S.Yu. Solodnikov***, and V.V. Maslova****
*Institute of Continuous Media Mechanics, Ural Branch of Russian Academy of Sciences,
ul. Akademika Koroleva 1, Perm, 614013 Russia
**Perm State Medical University, Petropavlovskaya ul. 26, Perm, 614990 Russia
***Perm National Research Polytechnic University, Komsomolsky prosp. 29, Perm, 614990 Russia
****St. Petersburg Research Institute of Vaccines and Serums, FMBA of Russia,
ul. Svobody 52, Krasnoe Selo, St. Petersburg, 198320 Russia
Samples of vascular prostheses were made of polyurethane synthesized with polypropylene glycol terminated
by 2,4-toluene diisocyanate. The outer and inner surfaces of the implants were treated by nitrogen ions with
high energy of 20 keV and 10 keV, respectively. As a result of ion-plasma treatment, a hydrophilic active car-
bon nanolayer was generated on implant surface. Tropoelastin protein was attached to the inner and outer sur-
faces of the samples subjected to ion-plasma treatment. Prostheses that were and were not exposed to plasma
were implanted in the rabbit carotid arteries. One week after carotid implantation, morphology of tissues sur-
rounding the walls of the implanted vascular prostheses was assessed. It was shown that thrombus formation
occurred on all the prostheses which had been implanted. However, the morphological pattern of tissues
around the walls of plasma-treated implants is characterized by accelerated thrombus canalization and endo-
thelial cell proliferation of intima as opposed to that around the walls of untreated implants.
Keywords: biocompatibility, thrombus, polyurethane, ion-plasma treatment, carbon layer
БИОФИЗИКА том 67
№ 6
2022