БИОФИЗИКА, 2023, том 68, № 1, с. 57-65
БИОФИЗИКА КЛЕТКИ
УДК 57.033, 57.013
ЛОКАЛЬНАЯ ОПТИЧЕСКАЯ ТОМОГРАФИЯ НЕРВНОЙ КЛЕТКИ
© 2023 г. Г.Г. Левин*, А.А. Самойленко*, Т.А. Казакова**,
Т.А. Маракуца***, Г.В. Максимов**, ***, #
*Всероссийский научно-исследовательский институт оптико-физических измерений,
Озерная ул., 46, Москва, 119361, Россия
**Московский государственный университет имени М.В. Ломоносова, Ленинские горы, 1/24, Москва, 119892, Россия
***Национальный исследовательский технологический университет «МИСиС»,
Ленинский просп., 4, Москва, 119049, Россия
#E-mail: gmaksimov@mail.ru
Поступила в редакцию 12.10.2022 г.
После доработки 12.10.2022 г.
Принята к публикации 25.10.2022 г.
Представленная модификация метода локальной оптической томографии позволяет исследовать
динамические процессы субклеточных структур нативных нервных клеток. Преимущество данного
подхода заключается в том, что возможен анализ динамики распределения структур нейрона в
интересующей точке или области внутри клетки без проведения полной реконструкции
изображения клетки. Доказано, что появляется возможность определения размеров, интересующей
области клетки и координат субклеточных структур для дальнейшего исследования их динамики. В
данной модификации метод локальной томографии позволяет исследовать как клетки, так и
клеточные структуры, так как не требует зондирования всего поля зрения. Локальное зондирование
интересующей области при функционировании нервной клетки позволит, во-первых, сократить
время регистрации данных для получения локальных томограмм и, во-вторых, исследовать
одновременно динамику нескольких областей внутри клетки.
Ключевые слова: локальная оптическая томография, нейрон.
DOI: 10.31857/S0006302923010064, EDN: NZPZCQ
клетки, имеющие многочисленные отростки и
В настоящее время метод оптической фазовой
внутриклеточные структуры (ядро, митохондрии
микроскопии широко используется для исследо-
и т.п.).
вания динамики различных процессов в клетке
[1, 2]. C помощью оптической фазовой микроско-
На наш взгляд, существует несколько ограни-
пии были выявлены изменения показателя пре-
чений, которые снижают эффективность томо-
ломления в ходе функционирования клетки. Од-
графических исследований подобных биологиче-
нако применение данного метода сопровождает-
ских объектов. Во-первых, особенности оптиче-
ся рядом трудностей, связанных, в частности, с
ской схемы многоракурсного зондирования
проблемой разрешения внутриклеточных струк-
нативной клетки позволяют исследовать объект
тур клетки, чувствительностью и временным раз-
только при ограниченном угле обзора [4]. Во-вто-
решением отдельного измерения. В связи с этим
рых, при некоторых ракурсах объекта (например,
нервной клетки) размер превышает область зон-
особое внимание уделяется разработке методик
дирования и приводит к проблеме регистрации
оптической томографии в фазовой и абсорбцион-
ной микроскопии. Однако эти исследования воз-
неполных проекций. Эти ограничения усложня-
ют задачу реконструкции томограмм с использо-
можны для морфологического анализа отдельной
ванием обратного преобразования Радона, дово-
клетки, которая полностью попадает в поле зре-
дя ее до некорректной, так как приводят к много-
ния прибора со всех направлений зондирования
численным артефактам в восстановленном
[3]. В настоящее время методы и алгоритмы тра-
изображении, компенсация которых существен-
диционной оптической компьютерной томогра-
но ухудшает пространственное разрешение мето-
фии не распространяются на клетки более слож-
да. В-третьих, используемые алгоритмы рекон-
ной формы, такие, например, как нервные
струкции изображений, полученных с помощью
Сокращения: ОКТ - оптическая компьютерная томогра-
оптической компьютерной томографии (ОКТ),
фия, ОРХ - оптическая разница хода.
учитывают только слабые дифракционные эф-
57
58
ЛЕВИН и др.
фекты для случая однократного рассеяния в при-
сливаются с плазматической мембраной (в тече-
ближении Борна или Рытова для уравнения эйко-
ние нескольких минут) и молекулы медиатора
нала [5]. Очевидно, что в этих случаях градиенты
диффундируют в экстраклеточную среду. Извест-
показателя преломления внутри и на границе
но, что в крупной (60-80 мкм в диаметре) соме
клетки должны быть малы, и в случае примене-
нейрона пиявки серотонин хранится в скоплени-
ния метода ОКТ для исследования нативной
ях везикул (диаметром 100 нм), а электрическая
клетки эти условия не выполняются. Известно,
стимуляция (серия из десяти импульсов частотой
что величина плотности клеточной мембраны су-
20 Гц) вызывает экзоцитоз (направленное пере-
щественно превышает плотность структур цито-
распределение везикул от центра клетки к ее пе-
плазмы и приводит к сильным дифракционным
риферии) в течение 2-5 мин. С помощью элек-
эффектам на краях клетки. Дифракцию света на
тронных микроскопии установлено, что в состоя-
мембране легко можно наблюдать на любом фа-
нии покоя в нейроне скопления везикул
зовом изображении клетки. При этом дифракци-
локализованы далеко от плазматической мембра-
онные искажения проекционных данных локали-
ны, тогда как после стимуляции нейрона большая
зуются на границах клетки и внутренних ее
часть их перемещается и плотно прилегает к плаз-
органелл. Таким образом, использование нело-
матической мембране клетки. В связи с этим, в
кальных алгоритмов реконструкции ОКТ приво-
настоящее время существует насущная задача
дит к искажениям проекций и восстановлении
микроскопического контроля за перераспределе-
изображения клетки.
нием скоплений везикул при функционировании
нейрона [6].
Современные методы решения обратных не-
корректных задач, использующие итерационные
Ранее, нами было доказано, что распределение
процедуры позволяют реконструировать изобра-
оптической разницы хода (ОРХ) луча света в
жение внутриклеточных структур в некотором
функционирующем нейроне меняется как во вре-
приближении даже при неполных и неточных
мени, так и в субклеточных структурах нейрона.
проекциях. Однако достоверность полученных
Установлено, что ОРХ в каждой точке клетки
изображений вызывает сомнения, а выводы о
определяется коэффициентом преломления ком-
корреляции полученного изображения и реаль-
понентов цитоплазмы, их размерами и количе-
ных структур клетки необходимо делать с боль-
ством, а, главное, зависит от их перераспределе-
шой осторожностью. При этом теряется основ-
ния субклеточных структур (везикул и митохон-
ное достоинство томографических методов ис-
дрия, ядро и т.д). Доказано, что в состоянии
следования
- высокая чувствительность к
покоя у нейрона величина стандартного отклоне-
локальным изменениям плотности внутри объек-
ние ОРХ клетки (динамика распределения ОРХ)
та. В связи с этим можно выделить целый ряд за-
незначительно варьирует в околоядерной области
дач, при которых не нужно строить трехмерное
и в области плазматической мембраны. Однако
изображение всей клетки, а достаточно анализи-
при активации ацетилхолиновых рецепторов
ровать динамику локальных изменений ее струк-
нейрона и деполяризации мембраны выявлены
турных элементов.
существенные изменения величины стандартно-
В данной работе будут впервые представлены
го отклонение ОРХ Retzius-нейрона (распределе-
результаты исследования ОКТ нативной нервной
ния ОРХ) [7].
клетки (нейрона). Известно, что морфология
В связи с этим мы считаем, что основным ас-
нейрона включает тело (сому) и ряда отростков
пектом исследований морфологии и цитологии
(дендриты и аксон), по которым нервный им-
нейрона является анализ динамики внутрикле-
пульс поступает на нейрон или передается на дру-
точных процессов нервной клетки. Мы предпо-
гую клетку. Известно, что в этих структурах ней-
лагаем, что без использования специфических
рона происходят динамические процессы, кото-
флуоресцентных маркеров структур нейрона ло-
рые связаны не только с периодическими
кальная ОКТ позволит исследовать динамику
изменениями мембранного электрического по-
трехмерной субклеточной структуры функцио-
тенциала как в теле клетки, так и ее отростках, но
нирующей нервной клетки.
и изменениями в цитоплазме клетки, связанны-
ми с перераспределениями субклеточных струк-
Цель работы заключалась в том, чтобы с помо-
тур цитоскелета (локализация митохондрий или
щью метода локальной оптической томографии
внутриклеточных везикул, содержащих нейроме-
разработать методологию анализа динамических
диаторы). Процесс возбуждения нейрона связан с
процессов в нейроне (в интересующей точке или
деполяризацией плазматической мембраны (уве-
области без проведения полной реконструкции
личение мембранного потенциала), что иниции-
всего сечения клетки). Для реализации предлага-
рует перераспределение цитоплазматический пу-
емой методологии были получены 3D-изображе-
лов везикул, вектор которого направлен из цен-
ния нейрона, реконструированные методом ло-
тра нервной клетки к плазматической мембране.
кальной дифференциальной томографии, опре-
После завершения деполяризации, везикулы
делены координаты и дана характеристика
БИОФИЗИКА том 68
№ 1
2023
ЛОКАЛЬНАЯ ОПТИЧЕСКАЯ ТОМОГРАФИЯ
59
счет нейронов проводили в камере Горяева (кон-
центрация нейронов обычно составляла (1.0-
3.5)·106 клеток/мл), затем переносили
100-
150 мкл клеточной суспензии в чашки Петри,
преинкубированные с полиорнитином (Sigma,
США) для улучшения адгезии клеток на поверх-
ности чашек Петри. Культивирование осуществ-
ляли в среде NBM в течение пяти-семи суток в
СО2-инкубаторе при 37°С, 5% СО2 и относитель-
ной влажности 98%.
Оптическая локальная дифференциальная томо-
графия. Подробное описание экспериментальной
установки было представлено в работе [8]. Мож-
но выделить следующие основные характеристи-
ки используемого микротомографа. Источником
света служил низкокогерентный светодиод, что
позволило снизить шумы получаемых изображе-
ний; проекции (с разных углов) получали за счет
освещения через широкоапертурный объектив.
Фазовые изображения получали с помощью
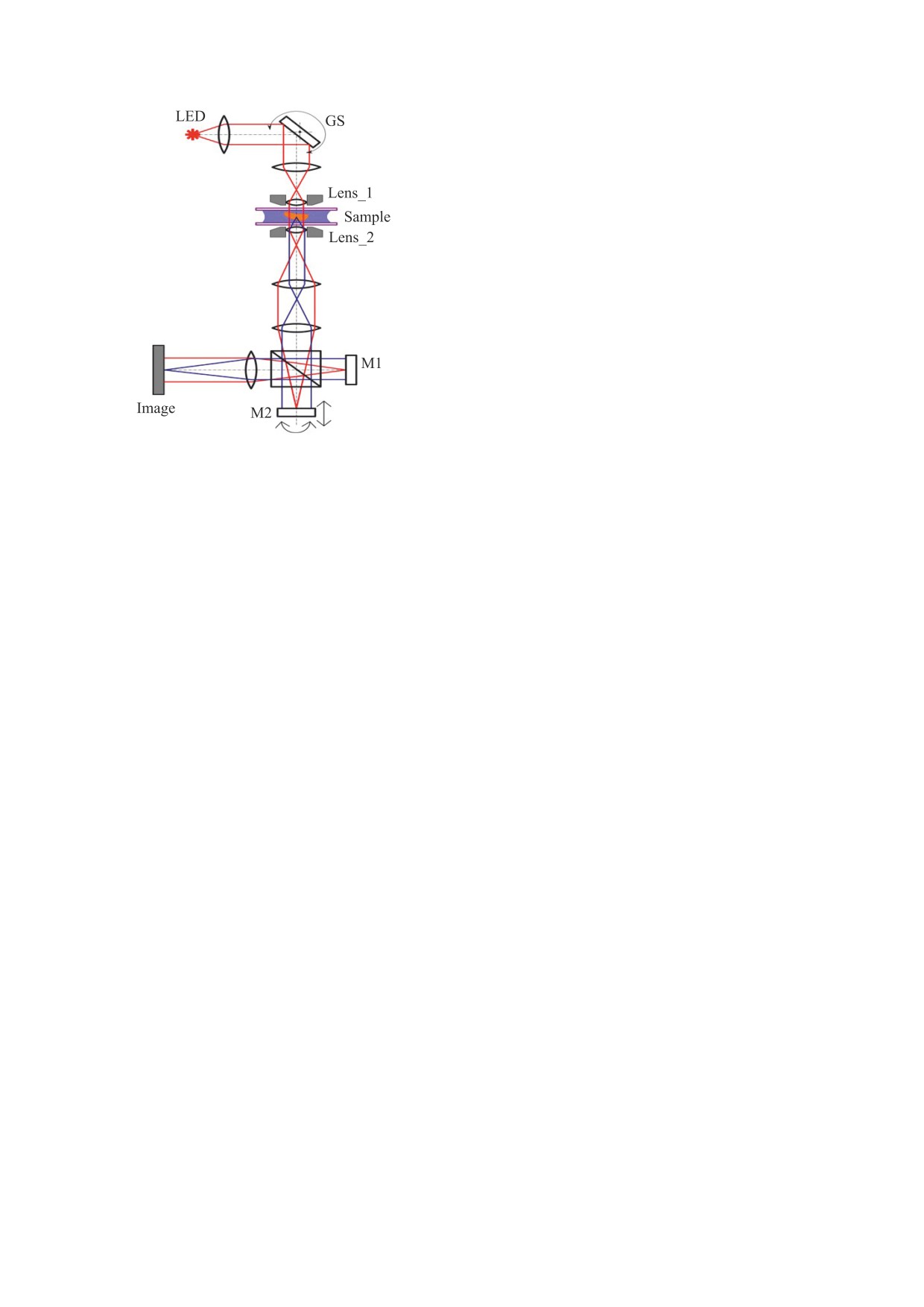
Рис. 1. Схема сдвигового интерференционного мик-
сдвигового интерферометра (рис. 1). Источником
ротомографа. Описание рисунка представлено в
излучения служил коллимированный линзой (1)
тексте.
точечный светодиод (LED) с размером площадки
80 мкм. Использование светодиода по сравнению
с лазером позволяет избавиться от спекл-шумов.
трехмерной структуры отдельных субклеточных
Образец (Sample) помещали между двумя по-
структур в заданных точках
3D-изображения
кровными стеклами и освещали параллельным
клетки.
лучом света (под разными углами) через широко-
МАТЕРИАЛЫ И МЕТОДЫ
апертурный объектив (Lens_1). Наклон луча ме-
няли за счет поворота зеркала (GS) с помощью
Культивирование первичной культуры грануляр-
гальвосканера. Такой способ сканирования лу-
ных клеток мозжечка крысы. Для приготовления
чом позволяет использовать фиксированные объ-
первичной культуры гранулярных клеток моз-
ективы и предметный столик, что существенно
жечка использовали двух-четырехсуточных крыс
упрощает конструкцию установки. Диапазон ска-
линии Wistar Kyoto. Декапитацию осуществляли в
нирования в нашей установке составил ~ ±60°.
соответствии с этическими требованиями по ра-
Изображение клетки получали с помощью
боте с животными. После декапитации животных
объектива Lens_2, идентичного объективу
все процедуры с клетками производили в сте-
Lens_1. Далее изображение попадало в сдвиговый
рильных условиях. Извлеченные мозжечки про-
интерферометр, состоящий из зеркал (M1) и (M2)
мывали в холодном бескальциевом и безмагние-
и светоделительным кубиком 50/50 между ними.
вом растворе Хенкса (Gibco, США) с 0.04% NaH-
Сдвиг изображений получали благодаря наклону
CO3, очищали от сосудов, пленок, ствола мозга и
одного из зеркал. Для реализации алгоритма фа-
других тканей, измельчали, после чего клеточную
зовых шагов одно из зеркал смещалось с помо-
суспензию помещали на 15 мин в 0.05%-й трип-
щью пьезоэлемента. Изображение формировали
син с 0.02% ЭДТА при 37°С (Gibco, США). После
на светочувствительной матрице (Image) с помо-
инкубации клетки на 2-3 мин помещали в 2-3 мл
щью системы линз. Восстановление фазовых
бычьей сыворотки для остановки реакции, а за-
изображений производили методом интерферо-
тем двукратно отмывали трипсин стандартным
метрии фазовых шагов. В результате каждая полу-
раствором Хенкса с феноловым красным (Gibco,
ченная проекция представляла собой изображе-
США), и культуральной средой МЕМ (Minimal
ние, аналогичное изображению, полученному в
Essential Medium, Gibco, США). Клетки диспер-
дифференциальном интерференционно-кон-
гировали в свежей среде МЕМ до получения од-
трастном микроскопе, но с численными значени-
нородной суспензии, которую центрифугировали
ями, соответствующими производной фазы.
2 мин при 3000 об/мин. Далее осажденные клетки
Для калибровки томографа использовали
ресуспендировали в среде NBM (Neurobasal Me-
стеклянные сферы размером 5 мкм, что позволи-
dium, Gibco, США), содержащей 2% Supplement
ло определить размер вокселя в восстановленном
B-27 (Gibco, США), 0.5 мM GlutaMax (Gibco,
США), 100 Ед/мл пенициллин/стрептомицин
изображении (0.1 мкм3). Время регистрации пол-
(Gibco, США) и 20 мM KCl (Sigma, CША). Под-
ного набора проекций составляло 8-10 с.
БИОФИЗИКА том 68
№ 1
2023
60
ЛЕВИН и др.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Особенности локальной дифференциальной то-
мографии. Локальные алгоритмы томографии от-
личаются тем, что для восстановления функции в
какой-то конкретной точке внутри объекта не
требуется измерять поле, прошедшее через весь
объект. Достаточно знать значение поля только в
небольшой области вокруг выбранной точки. Ло-
кальные алгоритмы достаточно широко исполь-
зуются в технических приложениях томографии,
так как обладают высокой чувствительностью к
изменениям внутренней структуры объекта. Так,
например, при исследовании быстропротекаю-
щих процессов, аэро- и гидропотоков, процессов
Рис. 2. Изображение нейрона, полученное с помо-
горения использовались методы томографиче-
щью оптического микроскопа (2D-проекция), на ко-
ской аналоговой интерферометрии в оптическом
тором отмечены границы нервной клетки (сомы - те-
диапазоне, которые позволили визуализировать
ла нейрона) и ее отростков (дендритов).
изображения сечений этих процессов в реальном
времени [9]. При этом использовались локальные
трансформации 2D-изображения в 3D-изобра-
алгоритмы обратного суммирования, которые
жение с помощью программы 3D Slicer были по-
позволяли получать некоторые приближения то-
лучены изображения клетки в трех проекциях: го-
мограмм. Локальный алгоритм синтеза томо-
ризонтальная (вид сверху) (рис. 3в), профильная
грамм из дифференциальных проекций нашел
(вид спереди, сагиттальная) (рис. 3г) и фронталь-
применение в рентгеновской томографической
ная (сбоку) (рис. 3а), а также объемный ренде-
дефектоскопии [10]. Ранее в нашей работе [8] бы-
ринг (трехмерный набор данных, где каждая
ли представлены результаты теоретических ис-
ячейка определяет плотность в этой точке)
следований и математическое моделирование ло-
(рис. 3б).
кальных алгоритмов томографии.
Так, область ядра нейрона представлена как в
Отметим, что изображения, восстановленные
горизонтальной проекции (рис. 3в), так и в объ-
по указанным выше алгоритмам локальной томо-
емном рендеринге (рис. 3б).
графии, не являются истинными томограммами.
Но эти изображения визуально воспринимаются
Выделение и характеристика отдельных слоев
как более четкие, с выраженными границами не-
трехмерной структуры в заданных точках 3D-изоб-
однородностей объекта и инородных включений
ражения нейрона. Следующая процедура анализа
в нем, что позволяет очень точно определить ко-
полученных изображений заключалась в выделе-
ординаты локализации этих структур внутри
нии отдельных слоев трехмерной структуры ней-
клетки. Другой особенностью локальных алго-
рона в заданных точках изображения (рис. 4a,б).
ритмов по дифференциальным проекциям явля-
Для случая, когда первая структура нейрона была
ется их высокая чувствительность к изменениям
выбрана на уровне -18 мкм, далее с шагом 2 мкм
внутри объекта, что делает их перспективными
были получены следующие срезы изображения
для исследования динамики внутриклеточных
субклеточных структур: область верхнего среза
процессов [11].
изображения нейрона (рис. 4в; выделена темно-
серым цветом) - в области -10.7 мкм, а нижний
Оптическая томография и 3D-изображение ней-
слой нейрона (рис. 4; выделен светло-серым цве-
рона. Для анализа ОКТ-изображения нативного
том) - 24 мкм. На следующем этапе анализа изоб-
нейрона использовали программу 3D Slicer, кото-
ражения с помощью опции инструмента «линей-
рая позволяла получить и исследовать произволь-
ка» были получен размеры высот нейрона (13.28
но ориентированные срезы клетки, строить моде-
мкм) и его ядра (8.169 мкм).
ли поверхности из меток изображений и аппарат-
но-ускоренный объемный рендеринг
(3D-
В связи с задачей исследования анализировали
изображение).
ОКТ-изображения отростков нейрона и их срезы
(рис. 4в).
На рис. 2 представлено оптическое изображе-
ние нейрона (2D-проекция), на котором отмече-
Отметим, что локальная ОКТ позволила полу-
ны границы нервной клетки (сома - тело нейро-
чить изображения слоев (срезы): цитоскелет, яд-
на) и ее отростков (дендриты и аксон). При
ро, органеллы вокруг ядра (рис. 5а). Очевидно,
БИОФИЗИКА том 68
№ 1
2023
ЛОКАЛЬНАЯ ОПТИЧЕСКАЯ ТОМОГРАФИЯ
61
Рис. 3. Проекции нейрона, полученная с помощью программы 3D Slicer: (а) - фронтальная (вид сбоку), (б) - объем-
ный рендеринг, (в) - горизонтальная (вид сверху), (г) - профильная (вид спереди, сагиттальная).
Рис. 4. Срезы нейрона: (a) - срезы (слои) с указанной размерностью в мкм, (б) - срез (слои) под углом, (в) - темно-
серым цветом выделен верхний слой нейрона, ОКТ-изображения отростков нейрона (аксон и дендрит), (г) -светло-
серым цветом выделен нижний слой.
БИОФИЗИКА том 68
№ 1
2023
62
ЛЕВИН и др.
Рис. 5. 3D-изображения нейрона: (а) - слои цитоскелета, ядра и органелл в одной модели, (б) - ядро, (в) - цитоскелет,
(г) - область дендрита и аксона.
что данный подход позволит не только исследо-
Как отмечалось выше, анализ изображений
вать 3D-структуру нейрона и его субклеточных
локальной ОКТ позволяет выбрать локализацию
структур, но и динамику изменения этих локаль-
(координаты) исследуемых структур нейрона и
ных структур при функционировании нейрона
оценить их динамику. Например, выберем точку
(рис. 5б-г).
в области ядра клетки (рис. 7a) и определим ее ко-
ординаты: (24.45289, 11.18260, -16.97716) мкм, в
С помощью опции «Fill beteen slicer» програм-
области цитоплазмы клетки (рис. 7б): (28.74976б
мы 3D Slicer были получены объемные 3D-изоб-
ражения нейрона с учетом выделенных слоев
11.61373б -14,30570) мкм, или же в области аксона
(рис. 6a,б), а также область ядра клетки (рис. 6в),
(рис. 7в): (14.99557, 7.57512. -14.17602) мкм. Раз-
цитоскелет (рис. 6г) и область аксона (рис. 6д).
мер указан с учетом перевода пикселей в мкм.
БИОФИЗИКА том 68
№ 1
2023
ЛОКАЛЬНАЯ ОПТИЧЕСКАЯ ТОМОГРАФИЯ
63
Рис. 6. Объемное 3D-изображение нейрона: (а) - верхний слой, (б) - нижний слой, (в) - область ядра, (г) -
цитоскелет в приближении «полупрозрачный», (д) - область аксона.
ЗАКЛЮЧЕНИЕ
ФИНАНСИРОВАНИЕ РАБОТЫ
Представленные в данной работе результаты
Исследование выполнено при финансовой
использования локальной ОКТ позволяют иссле-
поддержке Российского научного фонда (грант
№ 19-79-30062 для МГВ и КТА). Это исследова-
довать динамические процессы в субклеточных
ние также было поддержано Междисциплинар-
структурах функционирующего нейрона [12-16].
ной научно-образовательной школой МГУ име-
Преимущество предлагаемого подхода примене-
ни М.В. Ломоносова «Молекулярные технологии
ния локальной томографии заключается в том,
живых систем и синтетическая биология».
что метод позволяет проводить анализ динамики
распределения заданных структур нейрона в ин-
тересующей точке или области внутри клетки без
КОНФЛИКТ ИНТЕРЕСОВ
проведения полной реконструкции всего сечения
объекта. При этом остается возможность опреде-
Авторы заявляют об отсутствии конфликта
ления точных размеров, интересующей области
интересов. Спонсор работы не участвовал в раз-
клетки и координат субклеточных структур для
работке исследования; при сборе, анализе или
интерпретации данных; в написании рукописи
исследования их динамики. В данной модифика-
или в решении опубликовать результаты.
ции метод локальной томографии позволяет ис-
следовать большие клетки и клеточные структу-
ры, т.к. не требует освещения (анализа) всего по-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ля зрения. Зондирование только интересующей
исследователя части клетки позволяет, во-пер-
Все манипуляции с экспериментальными жи-
вых, сократить время регистрации данных для ло-
вотными проведены в соответствии с Европей-
кальных томограмм, и, во-вторых, исследовать
ской конвенцией по защите позвоночных живот-
одновременно динамику нескольких областей
ных, используемых в научных исследованиях
внутри клетки, если они находятся в поле зрения.
(1986, 86/609/EEC).
БИОФИЗИКА том 68
№ 1
2023
64
ЛЕВИН и др.
Рис. 7. Выбор локальных координат: (а) - в ядре, (б) - в цитоплазме, (в) - в аксоне.
БИОФИЗИКА том 68
№ 1
2023
ЛОКАЛЬНАЯ ОПТИЧЕСКАЯ ТОМОГРАФИЯ
65
СПИСОК ЛИТЕРАТУРЫ
9. G. N. Vishnyakov, G. G. Levin, et al., Proc. SPIE, 348,
596 (1982).
1. A. I. Yusipovich, E. Yu. Parshina, A. A. Baizhumanov,
et al., Instruments and Experimental Techniques, 64
10. Э. И. Вайнберг, И. А. Казак и В. П. Курозаев, ДАН
(6), 877 (2021).
СССР, 257 (1), 89 (1981).
2. А. И. Юсипович, С. М. Новиков, Т. А. Казакова
11. A. Faridani, E. L. Ritman, and K. T. Smith, J. Appl.
и др., Квантовая электроника, 36 (9), 874 (2006).
Math., 52 (2), 459 (1992).
(дата
посещения
12. А. Р. Браже, Н. А. Браже, О. В. Сосновцева и др.,
01.08.2022).
Компьютерные исследования и моделирование, 1
4. G. N. Vishnyakov, G. G. Levin, V. L. Minaev, et al.,
(1), 77 (2009).
Microscopy and Analysis, 87, 19 (2004).
13. A. A. Platonova, S. V. Koltsova, G. V. Maksimov, et al.,
5. M. Slaney and A. C. Kak, Proc. SPIE, 413, 2 (1983).
Biophysics, 58, 389 (2013).
6. T. A. Kazakova, O. N. Suchalko, A. D. Ivanov, et al.,
14. N. S. Bondarenko, A. I. Yusipovich, S. S. Kovalenko,
bioRxiv (The preprint server for biology) (2020).
et al., Biologicheskie Membrany, 30 (3), 199 (2013).
7. T. A. Kazakova, A. I. Yusipovich, and G. V. Maksimov,
Вестн. МГТУ им. Н.Э. Баумана (Естественные на-
15. A. I. Yusipovich, Yu. Berestovskaya, V. Shutova, et al.,
уки), 6 (93), 137 (2020).
Measurement Techniques, 55 (3), 351 (2012)
8. G. N. Vishnyakov, G. G. Levin, V.L. Minaev, et.al.,
16. A. R. Brazhe, N. A. Brazhe, G. V. Maksimov, et al., J.
Opt. Spectrosc., 125, 1065 (2018).
Biomed. Optics, 13 (3), 034004 (2008).
Local Optical Tomography of a Nerve Cell
G.G. Levin*, A.A. Samoilenko*, T.A. Kazakova**, T.A. Marakutsa***, and G.V. Maksimov**, ***
*All-Russian Research Institute of Optical and Physical Measurements, Ozernaya ul. 46, Moscow, 119361 Russia
** Lomonosov Moscow State University, Leninskie gory 1/24, Moscow, 119892 Russia
***National Research Technological University “MISiS”, Leninskiy prosp. 4, Moscow, 119049 Russia
The presented modification of the method of local optical tomography makes it possible to study the dynamic
processes of subcellular structures of native nerve cells. The advantage of this approach is that it is possible to
analyze the dynamics of the distribution of neuron structures at a point or area of interest inside the cell with-
out performing a complete reconstruction of the cell image. It has been proved that it becomes possible to
determine the dimensions, the cell area of interest, and the coordinates of subcellular structures for further
study of their dynamics. In this modification, the method of local tomography could be used to study both
cells and cellular structures, because it is not necessary to probe a full field of view. Local probing of the region
of interest during the functioning of the nerve cell will, firstly, reduce the time of data recording for obtaining
local tomograms, and, secondly, provide the opportunity to explore the dynamics of several regions inside the
cell at the same time.
Keywords: local optical tomography, neuron
БИОФИЗИКА том 68
№ 1
2023