БИОФИЗИКА, 2023, том 68, № 1, с. 79-86
БИОФИЗИКА КЛЕТКИ
УДК 612.111+615.1/4
СРАВНИТЕЛЬНЫЙ АНАЛИЗ СОДЕРЖАНИЯ МОНООКСИДА АЗОТА
В ЭРИТРОЦИТСОДЕРЖАЩИХ КОМПОНЕНТАХ КРОВИ
ПРИ ЕЕ ХРАНЕНИИ И ИХ ОПТИКО-МОРФОМЕТРИЧЕСКАЯ
ХАРАКТЕРИСТИКА
© 2023 г. Н.В. Акулич*, #, В.В. Зинчук**
*Национальная антидопинговая лаборатория, а/г Лесной, 31, Минский район, 223040, Беларусь
**Гродненский государственный медицинский университет, ул. М. Горького, 80, Гродно, 230009, Беларусь
#E-mail: akulichn@gmail.com
Поступила в редакцию 15.01.2022 г.
После доработки 15.01.2022 г.
Принята к публикации 01.11.2022 г.
Методом проточной цитометрии изучено внутриклеточное содержания монооксида азота в
эритроцит-содержащих компонентах крови при ее хранении с гемоконсервантом в течение четырех
недель. Установлено, что хранение крови сопровождается ростом внутриклеточного содержания
монооксида азота в эритроцитах и изменением оптико-морфометрических параметров красных
кровяных телец. На ранних этапах хранения эритроцитсодержащие компоненты крови были
представлены дискоцитами, на поздних этапах - преобладали сфероциты при возрастании
количества микроцитов, накапливающих монооксид азота и имеющих сниженный уровень
внутриклеточного гемоглобина.
Ключевые слова: монооксид азота, проточная цитометрия, эритроциты, консервация крови.
DOI: 10.31857/S0006302923010088, EDN: NZYGLR
В последнее время отмечается возрастание ин-
творов (аденин, гуанозин, Na2HPO4, NaH2PO4,
тереса к выяснению структурно-функциональ-
маннитол) предназначены для уменьшения функ-
ных изменений эритроцитов при хранении, ли-
циональных и метаболических изменений в эрит-
митирующим качество эритроцитсодержащих
роцитсодержащих компонентах крови за счет под-
компонентов донорской крови [1-3]. Это связано
держания энергетического обмена эритроцитов, а
с пониманием того, что эти клетки перифериче-
также буферной и осмотической стабильности [3].
ской крови не только играют существенную роль
Несмотря на применяемые растворы, происходит
в поддержании гомеостазиса, обеспечивая газо-
постепенная деградация различных компонентов
транспортные и реологические свойства крови,
эритроцитов, в совокупности называемых повре-
но и оказывают влияние на кровоток на уровне
ждением при хранении, что приводит к ограниче-
микроциркуляторного русла и магистральных со-
нию срока хранения. Так, в работе [3] указывается,
судов [3-5].
что «… в процессе хранения донорских эритроци-
Согласно рекомендациям, жизнеспособность
тов отмечается снижение содержания NO, нару-
эритроцитов влияет на эффективность перелива-
шающее регуляцию микроциркуляции». Посколь-
ния крови [3]. В практике гемотрансфузиологов
ку активность L-аргинин-NO-системы эритроци-
описаны негативные последствия таких процедур,
тов может зависеть от морфофункциональных
возникающие как из-за индивидуальных различий
свойств красных кровяных телец, целью исследо-
между донором и реципиентов, так и являющиеся
вания является оценка оптико-морфометрических
следствием хранения эритроцитов [3, 7, 8]. Обще-
параметров и внутриклеточного содержания NO в
известно, что эритроциты для переливания хранят
эритроцитсодержащих компонентах крови при
при 1-6°C до трех-семи недель, либо при темпера-
хранении крови в течение четырех недель.
туре -65°С и ниже - более длительный период
времени. Нахождение клеток в гемоконтейнере с
МАТЕРИАЛЫ И МЕТОДЫ
гемоконсервантом в условиях гипотермии не пол-
ностью воспроизводит условия in vivo. Применяе-
Исследования проводились на базе Нацио-
мые для хранения эритроцитов компоненты рас- нальной антидопинговой лаборатории (Минский
79
80
АКУЛИЧ, ЗИНЧУК
Рис. 1. Оптико-морфологические характеристики эритроцитов при хранении крови: (a) - контроль, (б) - после
четырех недель хранения. Вверху - микрофотографии эритроцитов, внизу - соответствующие гистограммы
распределения оптической плотности.
р-н, Беларусь). Каждая доза эритроцитов
применяемый в исследовании, позволял количе-
(400 мл ± 5%, гематокрит 70%) на протяжении че-
ственно оценить денситометрические параметры
тырех недель хранилась в пластиковом пакете,
красных кровяных телец (рис. 1). Для оценки
предварительно заполненном гемоконсервантом
площади поверхности эритроцитов (S_area) ис-
PAGGSM (Фрезениус Каби АГ, Германия), в со-
пользовали алгоритмы программного обеспече-
став которого входят раствор хлорида натрия,
ния «Диаморф-ЦИТО» (Россия). Поскольку ал-
аденин, глюкоза, гуанозин и маннитол. Забор
горитм подсчета S_area не учитывает выросты ци-
крови добровольцев проводили с использовани-
топлазматической мембраны, ее значения
ем К2ЭДТА. Кровь была подвергнута лейкофиль-
подсчитывали только для диско- и сфероцитов,
трации при сборе, после чего были получены сус-
исключая из анализа эхино- и сфероэхиноцитар-
ные трансформации красных кровяных телец.
пензии эритроцитов в соответствии со стандарт-
ными процедурами подготовки. Контролем
Концентрацию гемоглобина, средний объем
служила кровь добровольцев до хранения. Всего
эритроцита и показатель ширины распределения
проведено 14 серий исследований.
эритроцитов по объему определяли на гематоло-
гическом анализаторе XT 2000i (Sysmex, Япония).
Оптико-морфометрический анализ фиксиро-
Определения внутриклеточного NO проводили
ванных метанолом и окрашенных эозин метиле-
методом проточной цитометрии (цитофлуориметр-
новым синим (по Май-Грюнвальду) препаратов
сортер FACS ARIA, США). Для этого пробы крови
крови проводили в течение четырех недель. В ис-
окрашивали моноклональными антителами к ли-
следовании использовали микроскоп OLYMPUS
нейному маркеру эритроцитов (гликофорину А, CD
BX-53, дополненный монохроматическим филь-
235 a) и диацетильным производным 4-амино-5-ме-
тром с длиной волны 540 нм для проведения ден-
тиламино-2',7'-дифторфлуоресцеина (DAF-FM DA)
ситометрических исследований клеток. Для ана-
(Molecular Probes, США). Уровень внутриклеточно-
лиза каждого препарата создавали архив, содер-
го содержания NO коррелирует с интенсивностью
жащий полутоновые (8-битные) изображения не
флуоресценции DAF-FM [9].
менее 300 эритроцитов с разных (случайных)
участков мазка, содержащих монослой эритроци-
Для пробоподготовки использовали фосфат-
тов. Микроскопический анализ изображений, ный буфер FACS Flow (BD Bioscience, США). В
БИОФИЗИКА том 68
№ 1
2023
СРАВНИТЕЛЬНЫЙ АНАЛИЗ СОДЕРЖАНИЯ МОНООКСИДА АЗОТА
81
Таблица 1. Содержание монооксида азота и оптико-морфометрические характеристики эритроцитов при
хранении крови (Ме (25, 75))
До хранения
Срок хранения (недели)
Параметр
(контроль)
1-я
2-я
3-я
4-я
Площадь
139.0
141.6
132.0
114.2
109.3
поверхности, мкм2
(133.3-141.2)
(138.7-143.9)
(128.8-134.0)
(112.4-115.6)*
(107.4-110.9)*
Средний объем
88.2
95.4
114.4
108.7
105.9
эритроцита, фл
(83.0-92.0)
(91.2-99.1)
(109.0-119.6)*
(102.6-111.2)*
(100.4-107.8)*
Показатель
ширины
12.3
13.9
16.9
19.1*
17.0
распределения
(12.0-12.8)
(13.6-14.3)*
(15.9-17.3)*
(18.4-19.8)*
(16.1-17.5)*
эритроцитов по
объему, %
Интенсивность
242.0
234.7
307.0
327.6
310.0
флуоресценции
(240.0-248.0)
(233.3-236.8)
(289.2-315.0)*
(313.2-337.0)*
(300.7-315.0)*
нормоцитов, (о.е.)
Интенсивность
554.0
617.4
783.8
флуоресценции
0
0
(512.0-560.0)*
(599.0-632.0)*
(772.7-801.1)*
микроцитов, (о.е.)
Значение
малоуглового
1821.0
1853.5
1805.0
1895.3
1636.8
рассеяния луча
(1668.0-1962.0)
(1763.0-1978.1)
(1713.0-1868.0)*
(1788.0-1961.4)*
(1612.0-1740.9)*
лазера
нормоцитами, (о.е.)
Значение
малоуглового
1142.0
1342.1
1224.0
рассеяния луча
0
0
(1136.0-1157.0)*
(1321.2-1377.0)*
(1217.6-1240.1)*
лазера
микроцитами, (о.е.)
Примечание. * - Достоверные изменения в сравнении с контролем.
каждой пробе анализировали не менее 40000 кле-
анализ проводили с использованием коэффици-
ток. Кроме того, на проточном цитофлуориметре
ента корреляции Спирмена.
определяли содержание гемоглобина в отдельном
эритроците. Для этого использовали значения
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
малоуглового лазерного рассеяния, которые кор-
релируют с концентрацией гемоглобина в клетке
Анализ микроскопических препаратов пока-
[10]. Для исключения влияния двояковогнутой
зал, что в течение первой недели хранения эрит-
формы эритроцитов на определение клеточного
роциты характеризовались наличием впадины в
гемоглобина эритроциты превращали в правиль-
центре клетки (пэллор) и выраженным возвыше-
ный сфероид, обрабатывая клетки додецилсуль-
нием на периферии (тор), особенности морфоло-
фатом натрия после их предварительной фикса-
гии не выявлены - большинство клеток пред-
ции глютаровым альдегидом.
ставлено нормоцитами.
Полученные данные были обработаны метода-
Площадь поверхности эритроцитов контроль-
ми вариационной cтатиcтики c использованием
ных образцов составляла 139.0 (133.3-141.2) мкм2,
программы для персонального компьютера Statis-
а, хранящихся в течение недели - 141.6 (138.7-
ticа 10.0. Полученные значения представлены в
143.9) мкм2 (табл. 1). Таким образом, различия в
виде медианы, 25-й и 75-й процентили. Величина
величинах площади поверхности зарегистриро-
p рассчитана с учетом поправки Бонферрони-
ваны не были. Дальнейшее хранение (в течение
Холма. Все показатели проверяли на соответ-
двух и более недель) приводило к постепенному
ствие признака закону нормального распределе-
превращению нормоцитов в сфероциты, при
ния c использованием критерия Шапиpо-Уилка.
этом площадь поверхности значительно снижа-
Достоверность дисперсионного анализа множе-
лась - до 114.2 (112.4-115.6) (p < 0.05) и 109.3
ственных сравнений оценивали c использовани-
ем критерия Манна-Уитни. Корреляционный
(107.4-110.9) мкм2 (p < 0.05) на третьей и четвер-
БИОФИЗИКА том 68
№ 1
2023
82
АКУЛИЧ, ЗИНЧУК
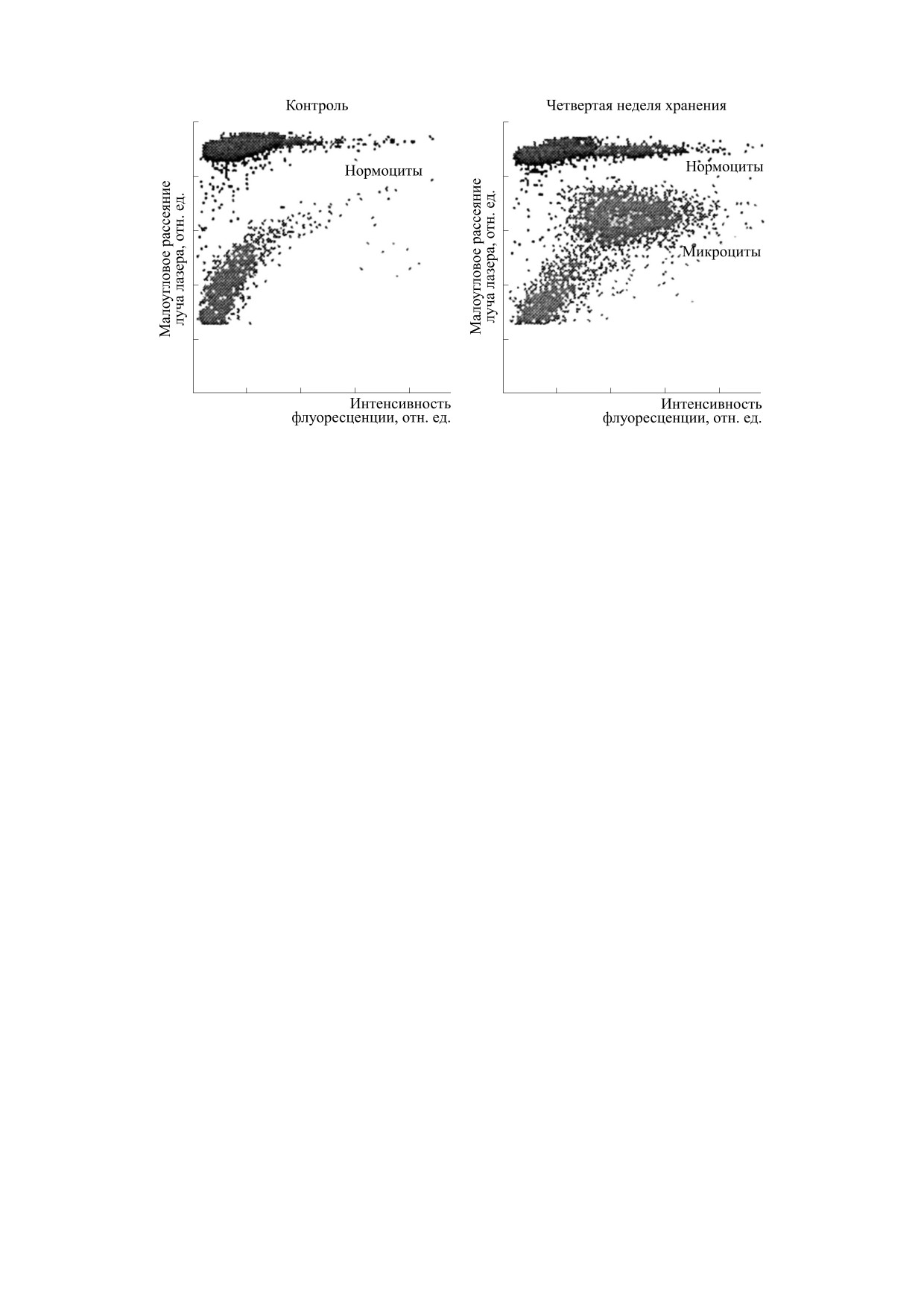
Рис. 2. Внутриклеточное содержание гемоглобина клеток - контроль и хранящейся крови по данным гематологиче-
ского анализатора XT 2000i: гистограмма рассеяния клеток по малоугловому рассеянию луча лазера (FSC) и интенсив-
ности флуоресценции (SFL).
той неделях соответственно. Все эритроциты бы-
Для получения дополнительной информации
ли представлены сфероцитами, с сохранением
были проанализированы гистограммы распреде-
высоких значений ширины полувысоты гисто-
ления неядерных клеток (эритроцитов и тромбо-
граммы распределения эритроцитов по объему.
цитов) образцов по значениям прямого светорас-
сеяния и флуоресценции гематологического ана-
Величина среднего объема эритроцита, изме-
лизатора (рис.
2), которые предоставляют
ренная волюметрическим методом на автомати-
вспомогательную информацию. Проведенный
ческом гематологическом анализаторе, наоборот
анализ позволил выявить среди проб хранящейся
повышалась - с 88.2 (83.0-92.0) до 114.4 (109.0-
более двух недель крови дополнительную популя-
119.6) фл (p < 0.05) - и превышала контрольные
цию клеток, имеющую меньшее значения прямо-
значения со второй по четвертую недели наблю-
го светорассеяния. Согласно данным работы [9],
дения. При этом и на первой неделе исследова-
такие клетки имеют меньшие линейные размеры
ния отмечалась тенденция к росту среднего объе-
и содержание гемоглобина, что коррелирует с
ма, составлявшего 95.4 (91.2-99.1) фл (p > 0.05).
микроцитарной группой красных кровяных
К концу первой недели наблюдения для эрит-
телец.
роцитов был характерен рост гетерогенности
Исследования при помощи проточной цито-
эритроцитов по объему - 13.9 (13.6-14.3) % (p <
метрии показали (рис. 3), что CD 235-позитив-
0.05), хотя значение анизоцитоза не превышало
ные клетки проб крови до второй недели хране-
нормы. Более 80% красных кровяных телец было
ния были представлены нормоцитами, микроци-
представлено сфероцитами, у части эритроцитов
ты в образцах отсутствовали. Нормоциты
регистрировался участок пэллора. В мазке отсут-
контрольных образцов характеризовались высо-
ствовали агрегаты, что предполагает наличие
кой неоднородностью сигнала бокового све-
нормальных значений дзета-потенциала.
торассеяния, после второй недели хранения,
популяция этих клеток становилась более одно-
Хранение крови в течение двух недель с ис-
родной. Поскольку для пробоподготовки исполь-
пользованием PAGGSM сопровождалось появле-
зовали додецилсульфат натрия, превращающий
нием микроцитов, их количество составляло 17%.
эритроциты в правильный сфероид, вариации бо-
Выявлено увеличение среднего объема эритроци-
кового светорассеяния не связаны с ориентацией
тов c 88.2 до 114.4 фл (p < 0.05). На некоторых
клеток в потоке проточного цитометра при про-
эритроцитах визуализировались спикулы. Отме-
ведении анализа.
чался рост анизоцитоза, показатель ширины рас-
пределения эритроцитов по объему достиг наи-
Уровень монооксида азота нормоцитов, изме-
больших значений к концу третьей недели хране-
ренный по интенсивности флуоресценции DAF-
ния - 19.1 (18.4-19.8) % (p < 0.05), превышая
FM, до первой недели хранения не различался и
нормальные значения.
составлял соответственно 242.0 (240.0-248.0) и
БИОФИЗИКА том 68
№ 1
2023
СРАВНИТЕЛЬНЫЙ АНАЛИЗ СОДЕРЖАНИЯ МОНООКСИДА АЗОТА
83
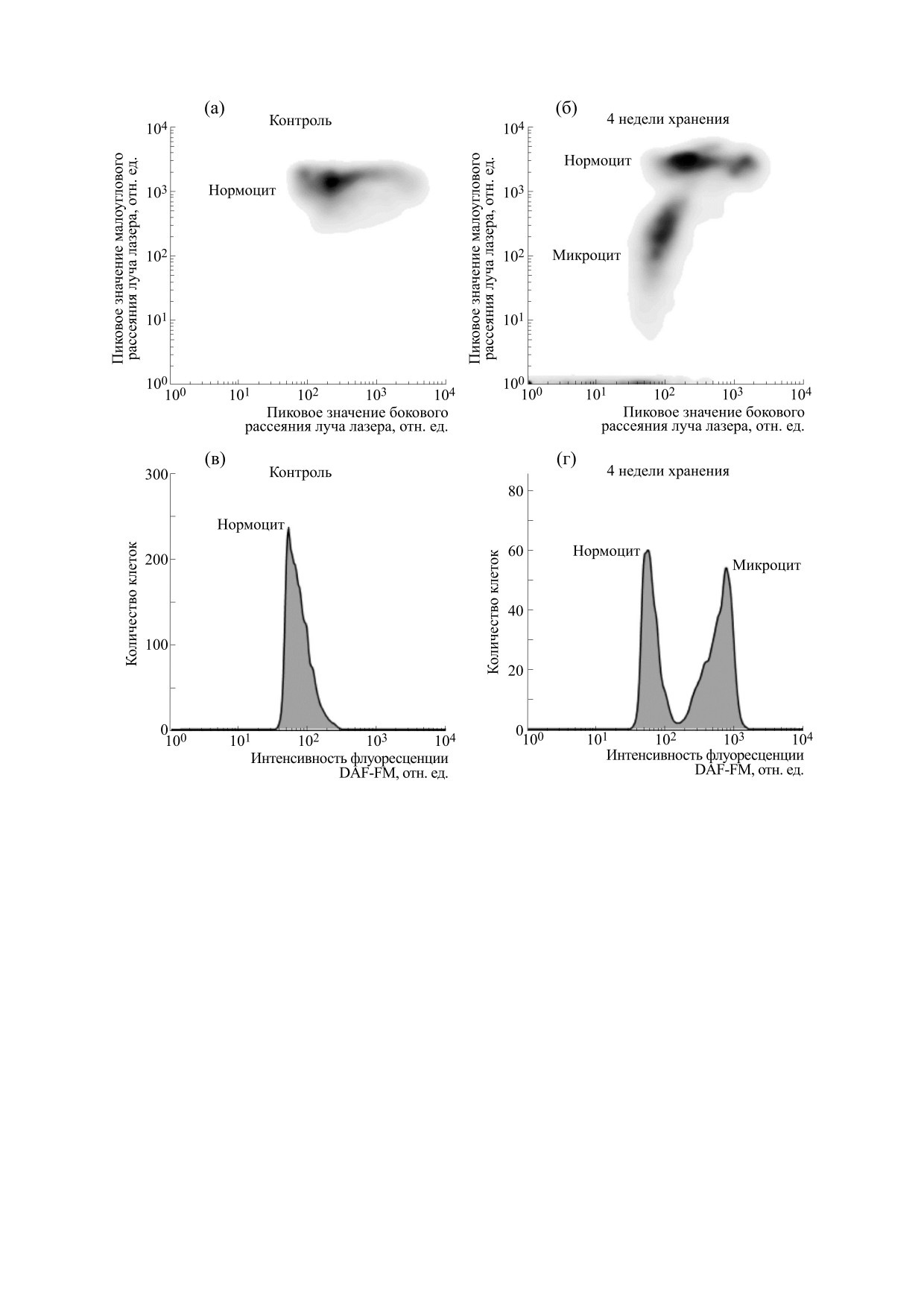
Рис. 3. Сравнительный анализ содержания монооксида азота в эритроцитах крови в процессе хранения (четыре
недели): (a) и (б) - гистограмма рассеяния клеток по малоугловому (FSC) и боковому (SSC) рассеянию луча лазера;
(в) и (г) - распределение клеток по содержанию монооксида азота (DAF-FM).
234.7 (233.3-236.8) о.е. (p > 0.05) в контроле и в
достигает 70% (p < 0.05). Содержание монооксида
крови, хранящейся одну неделю. Значение пря-
азота в нормоцитах продолжало постепенно на-
мого светорассеяния, свидетельствующее о внут-
растать, увеличиваясь к третьей неделе наблюде-
риклеточном содержании гемоглобина, составля-
ния на 35% (p < 0.05). Затем уровень NO несколь-
ло 1821.0 (1668.0-1962.0) о.е. в контроле и 1853.5
ко снизился и превышал значения контроля на
(1763.0-1978.1) о.е. (p > 0.05) у крови, хранящейся
28% (p < 0.05).
одну неделю.
Наибольшее содержание монооксида азота
При увеличении продолжительности хране-
выявлено в микроцитах. Эти клетки экспрессиру-
ния эритроцитсодержащих компонентов донор-
ют на цитоплазматической мембране линейный
ской крови в пробах увеличилось количество
маркер эритроцитов (CD 235а) и регистрируются
микроцитов. Так, доля клеток с низкими значе-
в виде компактного облака на гистограмме при
ниями прямого светорассеяния постепенно на-
анализе цельной крови на гематологическом ана-
растает с 17 до 26% (p < 0.05) со второй по третью
лизаторе. Для микроцитов было характерно сни-
неделю наблюдения, а затем к четвертой неделе
женное количество внутриклеточного гемогло-
БИОФИЗИКА том 68
№ 1
2023
84
АКУЛИЧ, ЗИНЧУК
Известно, что жизнеспособность красных
кровяных телец эритроцитсодержащих компо-
нентов крови не удается поддерживать длитель-
ное время, несмотря на низкую температуру хра-
нения, применение консерванта и лейкоредук-
цию/лейкодеплецию
[3]. С использованием
метода проточной цитометрии нами была уста-
Рис. 4. Трансформация эритроцита в процессе хране-
новлена взаимосвязь (рис. 5) между оптико-мор-
ния (четыре недели) крови по данным оптико-мор-
фометрическими параметрами эритроцитов и
фометрического анализа.
внутриклеточным содержанием монооксида азо-
та: на ранних этапах хранения эритроцитсодер-
жащие компоненты крови были представлены
бина 1142.0 (1136.0-1157.0) о.е. (p < 0.05), на вто-
нормоцитами, содержащими меньшее количе-
рой неделе наблюдения по сравнению с
ство монооксида азота, на поздних этапах - пре-
контролем p < 0.05), и этот уровень продолжал со-
обладали сфероциты с повышенным содержани-
храняться до завершения периода наблюдения.
ем NO.
Принимая во внимание, что доля таких клеток к
В частности, было установлено, что между
четвертой недели хранения значительно (более
средним объемом эритроцита и внутриклеточ-
чем в 20 раз) выросла, а интенсивность флуорес-
ным содержанием NO существует прямо пропор-
ценции DAF-FM превышала как уровень флуо-
циональная корреляционная связь (r = 0.63, p <
ресценции нормоцитов на второй неделе хране-
0.001). Между площадью поверхности эритроци-
ния (p < 0.05), так и интенсивность флуоресцен-
та и внутриклеточным содержанием NO суще-
ции DAF-FM дискоцитов в контроле, можно
ствует еще более тесная отрицательная корреля-
констатировать значительный суммарный рост
ционная зависимость (r = - 0.83, p < 0.001), кото-
внутриклеточного содержания монооксида азота
рая свидетельствует о снижении диффузионной
эритроцитсодержащих компонентов донорской
поверхности по мере роста внутриклеточного
крови при хранении. На основании полученных
NO. Следует обратить внимание на то, что самый
данных можно предположить, что снижение зна-
значительный рост монооксида азота отмечен в
чений малоуглового рассеяния луча лазера связа-
микроцитарной фракции красных кровяных
телец.
но с деструкцией и выходом гемоглобина из кле-
ток (рис. 4), т.е. постепенным превращением дис-
Показано, что в хранящейся крови парциаль-
коцита в сфероцит и формированием «теней
ное давление кислорода выше чем в контроле,
эритроцитов», содержащих мембранносвязаный
особенно высоко его значение в супернатанте [12]
гемоглобин и большое количество NO.
и верхнем слое клеток. Сатурация гемоглобина
Рис. 5. Зависимость между площадью поверхности эритроцита (левая ось ординат) и внутриклеточным содержанием
монооксида азота (правая ось ординат) от объема эритроцита (ось абсцисс).
БИОФИЗИКА том 68
№ 1
2023
СРАВНИТЕЛЬНЫЙ АНАЛИЗ СОДЕРЖАНИЯ МОНООКСИДА АЗОТА
85
различается от 41 до 57%, наименьшие значения
ВЫВОДЫ
были характерны для средних по расположению в
Хранение крови с использованием гемокон-
мешке для хранения слоев клеток. Следователь-
серванта на протяжении четырех недель сопро-
но, в зависимости от кислородного обеспечения
вождается ростом содержания монооксида азота
клеток в пакете хранящейся крови в эритроцитах
в эритроцитах, определяемого методом проточ-
могут происходить как процессы образования
ной цитометрии.
NO из L-аргинина, так и скавенжирования моно-
Выявлены закономерности оптико-морфо-
оксида азота. Другим возможным механизмом
метрических характеристик эритроцитов на раз-
регулирования уровня внутриклеточного NO при
личных этапах хранения крови с гемоконсерван-
хранении крови является нитритредуктазная ре-
том PAGGSM: на первой-второй неделе хране-
акция [11].
ния эритроцитсодержащие компоненты были
представлены дискоцитами, на третьей-четвер-
Как следует из полученных данных, в поддер-
той неделе преобладали сфероциты.
жании постоянства внутренней среды организма,
Установлена взаимосвязь между оптико-мор-
и, в частности, в обеспечении кислородтранс-
фометрическими параметрами эритроцитов и
портной функции крови в условиях, создаваемых
внутриклеточным содержанием NO на различ-
при ее хранении, принимает участие L-аргинин-
ных этапах хранения крови. Между средним объ-
NO-система эритроцитов [2]. С использованием
емом эритроцита и внутриклеточным содержани-
спектроскопии электронного парамагнитного
ем NO существует прямо пропорциональная
резонанса и абсорбционной спектроскопии уста-
корреляционная связь, а между площадью по-
новлено [13], что хранящиеся эритроциты обла-
верхности эритроцита и внутриклеточным содер-
дают более высокой способностью к скавенжиро-
жанием данного газотрансмиттера - более тесная
ванию монооксида азота, чем в контроле, при
обратно пропорциональная корреляционная за-
этом наилучшей способностью обладают диско-
висимость.
циты. В то же время установлена обратно пропор-
При хранении эритроцитсодержащих компо-
циональная зависимость между средней концен-
нентов крови происходит рост количества микро-
трацией гемоглобина в эритроците и его способ-
цитов, несущих на своей поверхности линейный
ностью к скавенжированию NO [14].
эритроидный маркер CD 235 а, имеющих сни-
женный уровень внутриклеточного гемоглобина
Проведена оценка продукции NO эритроцита-
и накапливающих монооксид азота.
ми у пациентов с серповидноклеточной анемией,
вызванной механическим воздействием (напря-
жением сдвига) [15]. Исходный уровень продук-
КОНФЛИКТ ИНТЕРЕСОВ
ции монооксида азота у данных пациентов был
Авторы заявляют об отсутствии конфликта
выше (особенно в субпопуляции дискоцитов па-
интересов.
циентов с этим заболеванием по сравнению с
контролем. В ответ на это воздействие регистри-
ровали рост NO во всех исследуемых группах на-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
блюдения. Этот выявленный феномен позволяет
Исследование одобрено комитетом по этике
высказать предположение о влиянии аминокис-
УЗ «Национальная антидопинговая лаборато-
лотного состава и структуры гемоглобина на
рия». От участников исследования было получе-
функционирование NO-системы эритроцитов.
но информированное добровольное согласие.
Возможным объяснением описанных в лите-
ратуре гемодинамических нарушений, связанных
СПИСОК ЛИТЕРАТУРЫ
с гемотрансфузией, является рост количества
1. K. Thangaraju, S. Neerukonda, U. Katneni, et al., Int.
микрочастиц эритроцитов (внеклеточных вези-
J. Mol. Sci., 22, 153 (2021).
кул) при хранении крови [11, 16]. При помощи хе-
2. V.V. Zinchuk, D. D. Zhadko, Nitric Oxide 1 (84) 45
молюминесцентного метода показано, что фос-
(2019).
фолипидные везикулы имеют большую способ-
3. А. И. Костин, О. А. Майорова, А. В. Ложкин и др.,
ность к скавенжированию моноксида азота [17],
Трансфузиология, 12 (2), 12 (2011).
чем эритроциты. Отмечаемый нами рост микро-
цитов, экспрессирующих линейный эритроци-
4. В. В. Зинчук и Е. С. Билецкая, Биофизика, 65, 915
(2020).
тарный маркер при хранении крови и содержа-
щих большее, чем эритроциты, количество NO,
5. C. Donadee, N. J. Raat, T. Kanias, et al., Circulation,
несомненно вносит вклад в свойства эритроцит-
124 (4), 465 (2011).
содержащих компонентов консервированной
6. M. García-Roa, M. Del Carmen Vicente-Ayuso,
крови.
A. M. Bobes, et al., Blood Transfus., 15 (3), 22 (2017).
БИОФИЗИКА том 68
№ 1
2023
86
АКУЛИЧ, ЗИНЧУК
7. R. Stapley, B. Y. Owusu, and A. Brandon, Biochem. J.,
12. B. Sandhagen, C. F. Hogman, C-H de Verdier, et al.,
446 (3), 499 (2012).
Vox Sang, 55, 139 (1988).
13. C. Liu, X. Liu, J. Janes, et al., Redox Biol., 2, 211
8. F. J. Willekens, J. M. Werre, Y. A. Groenen-Döpp,
(2014).
et al., Br. J. Haematol., 141 (4), 549 (2008).
14. В. П. Реутов, Успехи биол. наук, 35, 189 (1995).
9. N. Li, J. Sul, and P. Haydon, Neuroscitnce, 23, 10302
15. S. Suriany, I. Xub H. Liu, et al., Free Radic. Biol. Med.,
(2003).
171, 143 (2021).
10. C. Briggs, R. Rogers, B. Tompson, et al., Sysmex J.
16. A. H. Tayer, N. Amirizadeh, M. Ahmadinejad, et al.,
Int., 11 (2), 63 (2001).
Transfus. Med. Hemother., 46 (4), 224 (2019).
11. J. T. Alexander, A. M. El-Ali, J. L. Newman, et al.,
17. C. Donadee, N. J. Raat, T. Kanias, et al., Circulation,
Transfusion, 53 (11), 2619 (2013).
124, 465 (2011).
Comparative Analysis of the Nitrogen Monoxide Content and Optical-Morphometric
Characteristics of Erythrocyte-Containing Blood Components during Storage
N. V. Akulich* and V.V. Zinchuk**
*National Antidoping Laboratory, Lesnoi 31, Minsk Region, 223040 Belarus
**Grodno State Medical University, ul. M. Gorkogo 80, Grodno, 230009 Belarus
Flow cytometry was used to analyze the content of intracellular nitrogen monoxide in erythrocyte-containing
blood components during blood storage with hemopreservative for 4 weeks. It was found that storing of blood
is accompanied by increased levels of intracellular nitrogen monoxide in erythrocytes and thus by a change
in optical and morphometric parameters of red blood cells. In the early stages of storage, erythrocytes were
represented by discocytes, and during long storage erythrocytes became more spherical (spherocytes) as the
percentage of microcytes that accumulated nitrogen monoxide increased and their intracellular hemoglobin
levels were decreased.
Keywords: nitrogen monoxide, flow cytometry, erythrocytes, blood storage
БИОФИЗИКА том 68
№ 1
2023