БИОФИЗИКА, 2023, том 68, № 1, с. 87-97
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ВЛИЯНИЕ ПАРАКРИННЫХ ФАКТОРОВ КОНДИЦИОНИРОВАННОЙ
КУЛЬТУРАЛЬНОЙ СРЕДЫ СТВОЛОВЫХ КЛЕТОК НА ПРОДУКЦИЮ
АКТИВНЫХ ФОРМ КИСЛОРОДА В НЕЙТРОФИЛАХ КРОВИ
НА ФОНЕ АЦЕТАМИНОФЕН-ИНДУЦИРОВАННОЙ
ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ
© 2023 г. А.А. Темнов*, **, А.Н. Склифас*, В.К. Жалимов*, М.Г. Шарапов*, Р.С. Фадеев***,
М.И. Кобякова***, Н.И. Кукушкин*, #,
****
К.А. Рогов
*Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», Институтская ул., 3, Пущино Московской области, 142290, Россия
**Московский физико-технический институт (государственный университет), Институтский пер., 9,
Долгопрудный Московской области, 141701, Россия
***Институт теоретической и экспериментальной биофизики РАН,
Институтская ул., 3, Пущино Московской области, 142290, Россия
****НИИ морфологии человека Российского научного центра хирургии имени академика Б.В. Петровского,
ул. Цюрупы 3, Москва, 117418, Россия
#E-mail: nikukushkin@mail.ru
Поступила в редакцию 24.11.2022 г.
После доработки 24.11.2022 г.
Принята к публикации 07.12.2022 г.
Изучено влияние кондиционированной среды, полученной при культивировании мезенхимальных
стволовых клеток, на тяжесть системного воспалительного ответа, вызванного введением ацетами-
нофена, в том числе его отдаленное влияние на ткани печени. Использование фракции кондицио-
нированной среды <30 кДа оказывало максимальное защитное действие. Белки этой фракции сни-
жают выраженность системной воспалительной реакции и степень фиброза ткани печени в отда-
ленные сроки после введения токсина. При исследовании тканей печени экспериментальных
животных выявлено снижение выраженности гранулоцитарной инфильтрации, коррелирующее со
степенью некроза печеночной паренхимы (что подтверждается уровнем цитолитических фермен-
тов). Фракция <30 кДа увеличивала спонтанную и уменьшала индуцированную форбол-12-мири-
стат-13-ацетатом внутриклеточную продукцию активных форм кислорода. Результаты исследова-
ния показывают достоверное увеличение экспрессии макрофаг-ингибирующего фактора и тиоре-
доксина по сравнению с контролем на фоне повышенной спонтанной продукции активных форм
кислорода в нейтрофилах.
Ключевые слова: ацетаминофен, печень, фиброз, стволовые клетки, кондиционированные среды.
DOI: 10.31857/S000630292301009X, EDN: OAFUWG
ченочной недостаточности, прогрессирование
Передозировка ацетаминофена (АЦ), особен-
которой может привести к смерти больного [1, 2].
но связанная с истощением системы детоксика-
Активный метаболит АЦ, N-ацетил-пара-бен-
ции глутатиона, приводит к тяжелым поврежде-
зохинон, связывается с клеточными белками,
ниям паренхимы печени и индукции острой пе-
приводит к деградации митохондрий гепатоцитов
и повреждению митохондриальной ДНК, что
Сокращения: АЦ - ацетаминофен; NOX2 - НАДФН-окси-
вызывает гепатоцеллюлярную гибель [2]. В свою
даза; АФК - активные формы кислорода; КС - кондицио-
очередь массивный гепатоцеллюлярный некроз и
нированная среда; МСК - мезенхимальные стволовые
клетки; КС МСК - кондиционированная среда, получен- выброс внутриклеточных белков из гепатоцитов в
ная при культивировании мезенхимальных стволовых кле-
кровь вызывают активацию гранулоцитов и их
ток; ФМА - форбол-12-миристат-13-ацетат; МИФ - мак-
миграцию в паренхиму печени [3]. Их роль в раз-
рофаг-ингибирующий фактор, NET - нейтрофильные
внеклеточные ловушки.
витии дальнейшей гепатоцитарной недостаточ-
87
88
ТЕМНОВ и др.
ности в настоящее время активно обсуждается.
мг/кг массы тела). Затем животных случайным
Некоторые авторы считают, что гиперактивные
образом распределяли на три группы. Животным
нейтрофилы усиливают печеночную недостаточ-
контрольной группы (первая группа, n = 15) вво-
ность [4-6], в то время как другие исследователи
дили подкожно культуральную среду с эмбрио-
утверждают, что нет прямых доказательств повре-
нальной телячьей сывороткой в объеме 0.5 мл. Во
ждения клеток, связанного с функцией нейтро-
второй группе (опытная, n = 15) животным вводи-
филов [7-12]. Однако не вызывает сомнений, что
ли подкожно в объеме 0.5 мл КС, полученную в
нейтрофилы мигрируют в ткань печени при ток-
процессе культивирования МСК (общая фрак-
сическом воздействии АЦ [3].
ция, концентрация белка 0.5 мг/мл). В третьей
Роль оксидного комплекса НАДФН (NOX2),
группе (опытная, n = 15) подкожно в объеме
0.5 мл вводили фракцию КС МСК <30 кДа.
продуцирующего активные формы кислорода
(АФК), и его влияние на степень повреждения
Выделение стволовых клеток костного мозга.
паренхимы печени неоднозначны. Некоторые ав-
Костный мозг извлекали из бедренной кости мы-
торы показали, что АЦ усиливает активность
шей Balb/c под общей анестезией Золетилом. Для
NOX2 в гепатоцитах, а его ингибирование значи-
выделения мононуклеарной фракции клеток
тельно уменьшает гепатоцеллюлярную недоста-
костного мозга по стандартной методике исполь-
точность [13].
зовали градиент плотности со стандартным рас-
Также нет единого мнения о влиянии АФК на
твором Lympholyte-H (Cedarlane, Канада). Сус-
процессы регенерации в ткани печени после воз-
пензию мононуклеарных клеток высевали в чаш-
действия АЦ. В частности, авторы работы [14] по-
ки Петри и культивировали в среде DMEM с
казали, что активация спонтанной продукции
добавлением 10%-й эмбриональной телячьей сы-
АФК в нейтрофилах будет способствовать реге-
воротки в СО2-инкубаторе во влажной атмосфере
нерации ткани печени после воздействия АЦ, по-
с 10% О2, 5% СО2 и 85% N2.
скольку молекулы АФК, секретируемые нейтро-
Свойства МСК были подтверждены их остео-
филами, могут способствовать развитию макро-
генной, хондрогенной и адипогенной дифферен-
фагов и способствовать процессам регенерации
цировкой по стандартной операционной методи-
печени после токсического действия АЦ.
ке с использованием факторов роста [17].
С другой стороны, в работе [11] было показано,
Анализ фенотипического профиля МСК вы-
что у животных с блокировкой NOX2, нейтрофи-
явил следующие маркеры: 98.7% CD73+, 98.7%
лы которых не могут генерировать АФК, уровень
CD44+,
94.6% CD105+,
0.1% CD34+,
0.3%
повреждения гепатоцитов, вызванный АЦ, и их
CD45+.
способность к регенерации печени такие же, как
Получение кондиционированной среды при
и в контроле.
культивировании мезенхимальных стволовых кле-
Нашими предыдущими исследованиями по-
ток. После формирования клеточного монослоя
казано, что кондиционированная среда (КС), и
его культуральную среду полностью заменяли и
особенно ее фракция <30 кДа, полученная при
через трое суток объединяли с лизатом МСК.
культивировании мезенхимальных стволовых
клеток (МСК) в атмосфере 10% О2, оказывает за-
Получение фракции <30 кДа. КC отделяли уль-
трафильтрацией через фильтр Minimate TFF Cap-
щитное действие при АЦ-индуцированном
sule Omega 30K (Pall, США) и выделяли фракцию,
остром повреждении печени [15, 16].
содержащую в основном белки с массой <30 кДа.
Отмечено, что клиническое улучшение сопро-
Гистология. Материалы для гистологического
вождается снижением уровня цитолитических
исследования отбирали через 4, 24 и 96 ч, а образ-
ферментов в крови, при этом выраженность цен-
цы тканей животных для оценки отдаленных эф-
тролобулярного некроза коррелирует с уровнем
фектов отбирали через 10 суток после введения
гранулоцитарной инфильтрации, наблюдаемой в
АЦ. Образцы биопсии брали у шести животных
гистологических срезах.
каждой группы.
Цель исследования — сравнить клиническую
Для патоморфологической оценки изменений
картину ранних стадий АЦ-индуцированной пе-
ткани печени печень фиксировали в нейтральном
ченочной недостаточности с функциональной
активностью нейтрофилов под действием пепти-
забуференном 10%-м растворе формальдегида.
Патоморфологические изменения в тканях пече-
дов КС МСК.
ни оценивали по бальной системе со шкалой от 0
до 3 (0 баллов - без изменений, 1 балл - изменено
МАТЕРИАЛЫ И МЕТОДЫ
более 1/3 площади, 2 балла - более 2/3 площади,
3 - 100% области изменений).
Моделирование острой печеночной недостаточ-
ности. Для эксперимента использовали мышей-
Биохимическое обследование. Фермент печени
самцов линии Balb/c с массой тела 22-24 г. Всем
аспартатаминотрансферазу определяли в цель-
животным внутрибрюшинно вводили АЦ (270
ной крови перед экспериментом, а также через 4,
БИОФИЗИКА том 68
№ 1
2023
ВЛИЯНИЕ ПАРАКРИННЫХ ФАКТОРОВ
89
24, 48 и 96 ча после введения АЦ на приборе Re-
Внутриклеточный анализ активных форм кисло-
f latron (ROCH, США).
рода. Индуцируемую и спонтанную окислитель-
ную активность оценивали с использованием
Оценка внеклеточной ДНК. Концентрацию
зонда DCFHDA (Sigma-Aldrich, США) (Ex
внеклеточной ДНК определяли с помощью набо-
485 нм/Em 530 нм). Для оценки индуцируемой
ра для анализа двухцепочечной ДНК Quant-iT Pi-
окислительной активности клетки инкубировали
coGreen (Fisher Scientific, Landsmeer, Нидерлан-
в питательной среде с форбол-12-миристат-13-
ды) по методике, описанной ранее [18]. 10 мкл
ацетатом (ФМА) (Sigma-Aldrich, США) следую-
плазмы добавляли к 90 мкл трис-ЭДТА-буфера
щим образом: ФМА добавляли в концентрации
(10 мМ трис-HCl, 1 мМ ЭДТА, рН 7,5) в 96-лу-
100 нМ в течение 15 мин, промывали свежим сба-
ночном культуральном планшете. Каждая лунка
лансированным солевым раствором Хэнкса и за-
содержала 100 мкл раствора PicoGreen (разбав-
тем инкубировали в растворе Хэнкса с DCFHDA
ленного 1 : 200 в трис-ЭДТА-буфере). Смесь ин-
(40 мКС) в течение 15 мин в CO2-инкубаторе. Для
кубировали в течение 10 мин в темной комнате
оценки спонтанной окислительной активности
при комнатной температуре и измеряли ее флуо-
клетки инкубировали в растворе Хэнкса без ФМА
ресценцию на спектрофлуориметре RF-6000
в течение 15 мин, затем промывали свежим рас-
(Shimadzu, Япония) при длине волны возбужде-
твором Хэнкса и инкубировали с 40 мКС DCFH-
ния 480 нм и длине волны эмиссии 520 нм.
DA в течение 15 мин. После окрашивания клетки
трижды промывали раствором Хэнкса и анализи-
Выделение мРНК. Суммарную РНК выделяли
ровали флуоресценцию клеток с помощью про-
из 4-6 мг печени с помощью реагентов ExtractR-
точного цитометра BD Accuri C6 (BD Bioscience,
NA («Евроген», Россия) согласно протоколу про-
США).
изводителя. Образцы печени гомогенизировали в
тефлоновом гомогенизаторе в присутствии 1 мл
Статистическая обработка. Статистическую
реагента. Лизат инкубировали в течение 15 мин
обработку данных проводили с помощью про-
при комнатной температуре и центрифугировали
граммы Statistica 6.0. Для обработки непарамет-
при 18000 g в течение 10 мин. Супернатант пере-
рических данных использовали U-критерий Ман-
носили в новую пробирку, содержащую 0.2 мл
на-Уитни. Различия считали достоверными при
хлороформа. Смесь интенсивно перемешивали,
p < 0,05.
инкубировали 5 мин при комнатной температуре
и центрифугировали при 18000 g в течение 10 мин
РЕЗУЛЬТАТЫ
при 4°С. Верхнюю фазу переносили в новую про-
бирку, содержащую 0.5 мл изопропанола, пере-
Биохимическое исследование. Анализ наиболее
мешивали, инкубировали 10 мин при комнатной
эффективного способа введения кондициониро-
температуре и центрифугировали при 18000 g в те-
ванной среды животным проводили на первом
чение 10 мин. Осадок дважды промывали 75%-м
этапе исследования. Его результаты оценивали
этанолом. Полученный препарат тотальной РНК
по уровню в крови цитолитического фермента ас-
растворяли в 50 мкл воды без РНКазы и хранили
партатаминотрансферазы, высвобождающегося
при -20°С. Качество РНК проверяли по наличию
из разрушенных гепатоцитов под действием ток-
18s и 28s РНК при электрофорезе в агарозном
сических продуктов АЦ (рис. 1).
геле.
Через 4 ч после начала воздействия АЦ наиме-
нее эффективным способом является внутри-
Количественная полимеразная цепная реакция с
брюшинное введение препарата (уровень цито-
обратной транскрипцией. Для количественной
литического фермента снижается на 19% по срав-
ПЦР с обратной транскрипцией использовали
нению с контролем), а при пероральном и
реагенты компании «Евроген» (Россия). Для син-
подкожном введении - на 46 и 75% соответствен-
теза кДНК раствор тотальной РНК и 30 мКС оли-
но (рис. 1). Поэтому дальнейшие эксперименты
го-d(T)15 праймера инкубировали при 70°C в те-
включали подкожное введение АЦ.
чение 2 мин и сразу переносили на лед. Затем к
Подкожное введение суммарной фракции КС
смеси добавляли 11.5 мкл мастер-микса (1.3 мМ
dNTP, 0.02 мкл/мкл ингибитора РНКазы (Ribo-
вызывало достоверное снижение уровня цитоли-
Lock, ThermoFisher Scientific, США), 6 единиц
тического фермента по сравнению с контролем:
на 75% в первые 4 ч и на 50% в первые 24 ч (рис. 2;
M-MLV-ревертазы и 4 мкл 5-кратного буфера для
левые столбцы
- контроль; средние
M-MLV-ревертазы. Для завершения обратной
«Об. фракция» - общая фракция КС МСК; пра-
транскрипции образцы инкубировали при 42°С в
течение 50 мин. Полученную кДНК использова-
вые - фракция КC МСК, содержащая белки с
массой <30 кДа).
ли для ПЦР в реальном времени с праймерами,
специфичными к генам исследуемых белков и
Подкожное введение фракции <30 кДа приво-
эталонного гена. Изменение уровня экспрессии
дило к максимально значимому снижению уров-
генов рассчитывали по 2-ΔΔCt-методу [19].
ня аспартатаминотрансферазы в крови в начале
БИОФИЗИКА том 68
№ 1
2023
90
ТЕМНОВ и др.
Рис. 1. Влияние метода введения паракринных факторов КС МСК на уровень аспартатаминотрансферазы в крови
через 4 ч после введения АЦ; * - различия достоверны при сравнении с контрольной группой, # - различия
достоверны при сравнении с другими группами.
острого периода после введения АЦ (85% по срав-
держащая белки с массой <30 кДа). В более позд-
нению с контролем).
ние сроки (вторые и четвертые сутки) уровень
Экспрессия генов. Ингибирование пролифера-
экспрессии Ki-67 повышался более чем в два раза
ции гепатоцитов под действием паракринных
по сравнению с контролем.
факторов является одной из возможных причин
Гистология. В контрольной группе максималь-
снижения деструкции печеночной паренхимы в
ный уровень деструкции паренхимы печени на-
острой фазе недостаточности, вызванной введе-
блюдался через 4 ч после введения культуральной
нием КС МСК. В связи с этим были исследованы
среды (контроль) (рис. 4). Портальные вены в
вызванные КС изменения экспрессии маркера
тканях контрольного животного полнокровны,
пролиферативной активности белка Ki-67 в тка-
обширные полнокровные центролобулярные зо-
нях печени.
ны печеночных долек слиты. Площадь некроза
Введение КС (как общей фракции, так и фрак-
гепатоцитов колебалась от 35 до 50%. После вве-
ции <30 кДа), полученных при культивировании
дения КС зона полнокровия вокруг портальных
МСК, вызывало резкое снижение экспрессии Ki-
вен значительно уменьшалась по сравнению с
67 в первые двое суток (рис. 3; левые столбцы -
контролем. После введения фракции <30 кДа
контроль; средние «Об. фракция» - общая фрак-
полнокровные портальные вены не обнаружива-
ция КС МСК; правые - фракция КC МСК, со-
лись. Площадь зон центролобулярного полно-
Рис. 2. Динамика влияния КС МСК на уровень аспартатаминотрансферазы в крови на фоне введения АЦ; * -
достоверно по отношению к контрольной группе; # - различия достоверны при сравнении с другими группами.
БИОФИЗИКА том 68
№ 1
2023
ВЛИЯНИЕ ПАРАКРИННЫХ ФАКТОРОВ
91
Рис. 3. Влияние КС МСК на уровень экспрессии Ki-67 в ткани печени.
кровия была минимальной по сравнению с тако-
АЦ вызывало достоверное уменьшение площади
вой после введения тотальной фракции.
деструкции; использование фракции <30 кДа
оказывало максимальный протективный эффект.
Так, введение суммарной фракции кондицио-
нированной среды, полученной при культивиро-
Гистологический анализ, проведенный через
вании МСК, через четыре часа после воздействия
24 ч после воздействия AЦ, показал:
Рис. 4. Гистология печени: динамика влияния КС МСК на фоне введения АЦ. Окрашивание гематоксилином и
эозином.
БИОФИЗИКА том 68
№ 1
2023
92
ТЕМНОВ и др.
Таблица 1. Анализ морфологических изменений ткани печени при введении КС на фоне АЦ
Время
Изменения
Контроль
Общая фракция КС
КС <30 кДа
Полнокровие портальных вен
2.85 ± 0.11
1.75 ± 0.21*
0.40 ± 0.11*#
4 ч
Центролобулярное полнокровие
2.65 ± 0.12
1.82 ± 0.31*
0.67 ± 0.21*#
Дегенерация гепатоцитов
2.74 ± 0.23
0.81 ± 0.22*
0.54 ± 0.11*
Дегенерация гепатоцитов
2.66 ± 0.22
1.30 ± 0.13*
1.45 ± 0.12*
24 ч
Центролобулярный некроз
2.60 ± 0.16
1.45 ± 0.21*
0.30 ± 0.12*#
Регенерация гепатоцитов
0.70 ± 0.21
2.01 ± 0.10*
2.67 ± 0.22*#
Воспалительная инфильтрация
2.56 ± 0.31
0.41 ± 0.11*
0.44 ± 0.13*
96 ч
Дегенерация гепатоцитов
2.51 ± 0.31
0.81 ± 0.14*
1.20 ± 0.08*
Регенерация гепатоцитов
0.20 ± 0.08
1.82 ± 0.23*
2.67 ± 0.16*#
Примечание. Представлены средние значения ± стандартные отклонения; * - различия достоверны при сравнении с
контрольной группой, # - различия достоверны при сравнении с другими группами.
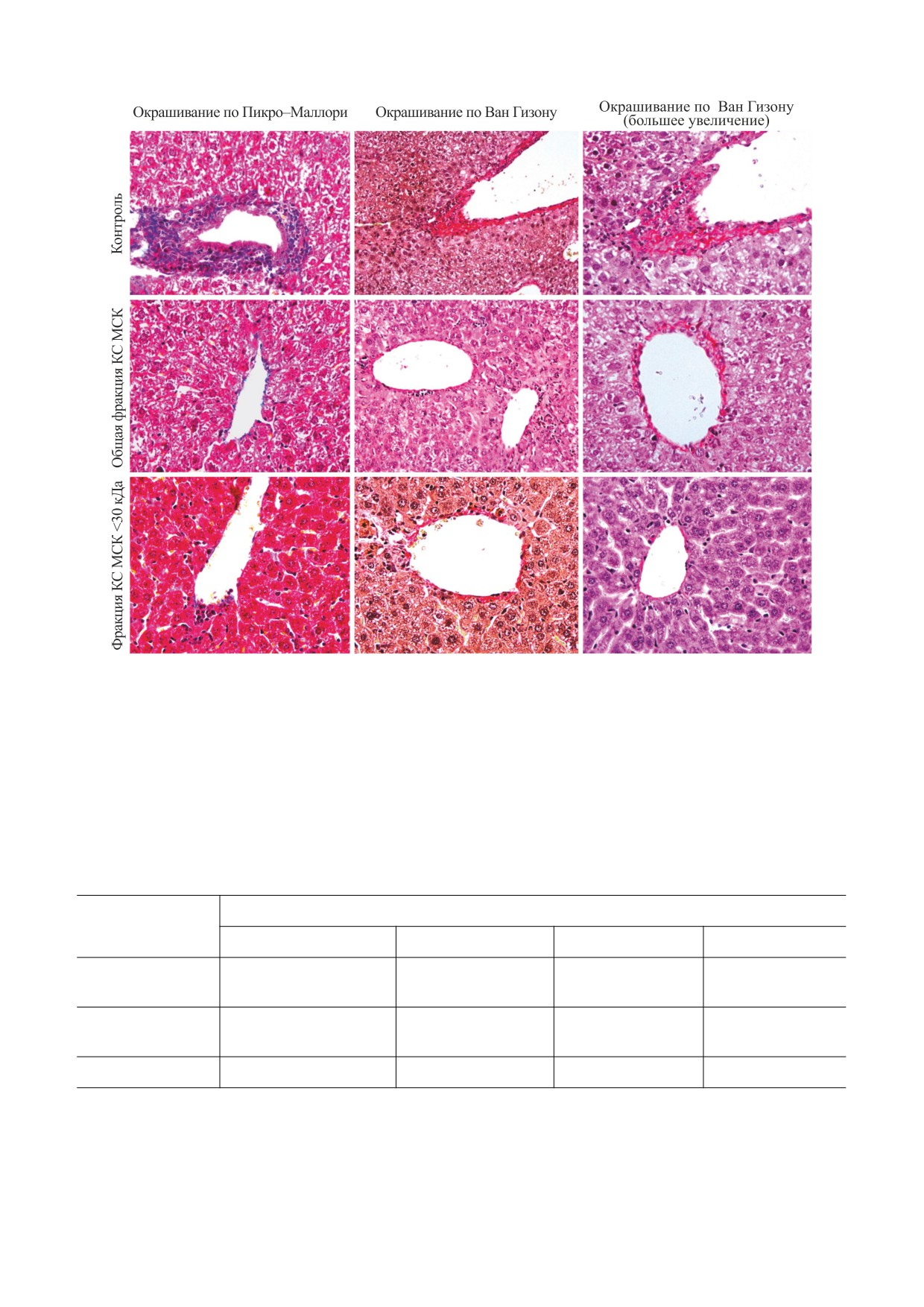
- в контрольной группе: обширные, соеди-
акции, способствует более ранним процессам ре-
ненные между собой зоны некроза гепатоцитов в
генерации.
центролобулярных зонах и узкая полоса регене-
Отдельно исследовано влияние КС на рост со-
рирующих гепатоцитов (характеризующаяся бо-
единительной ткани в отдаленные сроки после
лее интенсивным окрашиванием цитоплазмати-
токсического действия АЦ.
ческих клеток) в пограничных областях некроза;
Так, в контрольной группе (рис. 5) на десятые
- в опытной группе животных, которым вво-
сутки после воздействия в перипортальной зоне
дили общую фракцию КС МСК: очаги центроло-
вокруг воротной вены на фоне жировой дистро-
булярного некроза имеют минимальные размеры
фии гепатоцитов отмечается нарушение лучевого
и встречаются в отдельных долях.
строения долек (окраска по Пикро-Маллори).
- в опытной группе животных, которым вво-
Дополнительное окрашивание по Ван-Гизону
дили фракцию КС МСК <30 кДа: в центролобу-
также выявило нарушение балочной структуры в
лярных зонах долей печени некрозов не наблюда-
перипортальной области и прилежащие гепато-
лось, тем не менее эти зоны были умеренно пол-
циты в состоянии жировой дистрофии. Склеро-
нокровными.
тизованная перипортальная строма сохранила
Гистологический анализ, проведенный через
воспалительную инфильтрацию (окраска по Ван
четверо суток после введения АЦ и культураль-
Гизону).
ной среды, показал, что в контрольной группе зо-
Введение общей фракции КС приводило к по-
ны центролобулярного некроза сменялись об-
явлению признаков незначительных склеротиче-
ширной воспалительной инфильтрацией, а в дру-
ских изменений в портальной строме, содержа-
гих отделах долей печени можно было наблюдать
щей одиночные лимфоциты, что подтверждалось
дистрофические изменения гепатоцитов.
окрашиванием по Ван Гизону.
В отличие от контрольной группы, в печени
Следует отметить, что минимальный рост со-
животных, которым вводили общую фракцию
единительной ткани наблюдался при введении
КС, не наблюдалось воспалительных инфильтра-
кондиционированной среды и особенно ее фрак-
тов на всей площади печеночных долей, включая
ции <30 кДа.
центролобулярную зону. Введение белковой
Анализ экспрессии генов. Анализ экспрессии
фракции <30 кДа также не вызывало некротиче-
генов показал, что фракция КC <30 кДа индуци-
ских изменений в центролобулярной зоне. В то
рует измененную активность генов с провоспали-
же время можно было наблюдать многочислен-
тельными и противовоспалительными эффекта-
ные регенерирующие гепатоциты.
ми. Данные табл. 2 показывают, что КС вызывает
Морфометрический анализ (табл. 1) выявлен-
значительное повышение уровня гена, ответ-
ных изменений показал, что введение белковой
ственного за синтез тиоредоксина. Повышение
фракции <30 кДа снижает уровень повреждения
экспрессии этого фермента на фоне воздействия
гепатоцитов и выраженность воспалительной ре-
АЦ через 24 ч после введения КС сопровождалось
БИОФИЗИКА том 68
№ 1
2023
ВЛИЯНИЕ ПАРАКРИННЫХ ФАКТОРОВ
93
Рис. 5. Влияние КС МСК на рост соединительной ткани в отдаленные сроки после воздействия АЦ.
снижением экспрессии ИЛ-6, обладающего про-
ных функций нейтрофилов, на которой основан
воспалительной активностью, но повышением
их антибактериальный эффект.
экспрессии провоспалительного цитокина (мак-
Исследование показало, что через 4 ч после
рофаг-ингибирующего фактора - МИФ).
воздействия АЦ уровень спонтанной продукции
Продукция активных форм кислорода в нейтро-
АФК был таким же, как и в интактном контроле.
филах. Продукция АФК является одной из основ- Достоверные различия с группой интактных жи-
Таблица 2. Изменение уровня экспрессии генов после введения фракции КC МСК<30 кДа на фоне АЦ
Уровни экспрессии генов по отношению к контрольным значениям
Ген
4 ч
24 ч
48 ч
96 ч
МИФ
1.3 ± 0.7
3.2 ± 1.0*
1.1 ± 1.0
0.9 ± 0.4
Галектин
1.1 ± 0.4
1.4 ± 1.3
0.60 ± 0.55
1.4 ± 1.3
Каспаза 3
1.1 ± 0.3
1.4 ± 0.5
0.8 ± 0.6
1.1 ± 0.5
ИЛ6
0.6 ± 0.5
0.3 ± 0.2*
0.8 ± 0.4
0.8 ± 0.2
Тиоредоксин
1.4 ± 0.7
1.7 ± 0.3*
1.3 ± 0.5
0.6 ± 0.2
Примечание. Представлены средние значения ± стандартные отклонения; * - различия достоверны при сравнении с
контрольной группой, # - различия достоверны при сравнении с другими группами.
БИОФИЗИКА том 68
№ 1
2023
94
ТЕМНОВ и др.
Рис. 6. Влияние КС МСК на спонтанную продукцию
Рис. 7. Влияние КС МСК на ФМА-индуцированную
АФК в нейтрофилах. По оси ординат - средняя
продукцию АФК в нейтрофилах. По оси ординат -
интенсивность флуоресценции клеток (усл. ед.),
средняя интенсивность флуоресценции клеток (усл.
загруженных DCFHDA; # - различия достоверны
ед.), загруженных DCFHDA; # - различия достовер-
при сравнении с другими группами (p < 0.05).
ны при сравнении с группой АЦ (p < 0.05).
вотных, которым вводили только фракцию КС
ОБСУЖДЕНИЕ
МСК <30 кДа, также не наблюдались. Однако в
Таким образом, исследование показало, что
группе животных, которым на фоне АЦ вводили
КСа, полученная при культивировании МСК в
фракцию КС МСК <30 кДа, наблюдалось досто-
условиях гипоксии (10% О2), снижает уровень
верное увеличение спонтанной продукции АФК
АЦ-ассоциированной деструкции печеночной
в нейтрофилах (рис. 6).
ткани. Наиболее примечательным выводом из
Следует отметить, что анализ ФМА-индуци-
анализа печеночной ткани экспериментальных
рованной продукции АФК в нейтрофилах пока-
животных является уменьшение выраженности
зал противоположные результаты (рис. 7).
гранулоцитарной инфильтрации, которая может
прямо коррелировать со степенью некроза парен-
Показатель индуцированной продукции АФК
химы печени, подтвержденной уровнем цитоли-
в периферической крови животных, подвергших-
тического фермента [10]. В поздних наблюдениях
ся воздействию паракринных факторов КС на
фоне АЦ, был достоверно ниже, чем у животных,
подвергшихся воздействию АЦ. В то же время па-
ракринные факторы не оказывали существенного
влияния на продукцию АФК по сравнению с ин-
тактным контролем.
Уровень свободной внеклеточной ДНК. Иссле-
дование показало, что уровень внеклеточной
ДНК в плазме крови мышей, которым вводили
АЦ, достоверно повышался более чем в 30 раз
(рис. 8) по сравнению с интактным контролем.
В то же время уровень внеклеточной ДНК в
плазме животных, которым вводили фракцию КС
МСК <30 кДа на фоне АЦ, был достоверно в три
с половиной раза ниже уровня, который наблю-
дался у животных, получивших только АЦ. Уро-
вень внеклеточной ДНК у животных, которым
вводили только КС фракцию <30 кДа, был таким
Рис. 8. Влияние КС МСК на уровень внеклеточной
же, как и в контроле.
ДНК в плазме крови животных на фоне АЦ.
БИОФИЗИКА том 68
№ 1
2023
ВЛИЯНИЕ ПАРАКРИННЫХ ФАКТОРОВ
95
этот эффект достигался уменьшением объема
Подавление индуцированной продукции АФК
формируемой фиброзной ткани. Это могло быть
также могло иметь положительный эффект, по-
обусловлено как подавлением пролиферации
скольку было показано, что гиперпродукция
фибробластов пептидами КС, так и уменьшением
АФК на фоне АЦ с последующей дегрануляцией
выраженности начального воспалительного по-
и высвобождением нейтрофильных внеклеточ-
вреждения паренхимы.
ных ловушек (NET) вызывает прогрессирование
печеночной недостаточности [22, 23].
В то же время исследование показало, что КС
(особенно его фракция <30 кДа) может по-разно-
Снижение продукции АФК в индуцированных
му влиять на продукцию АФК в нейтрофилах:
клетках могло быть вызвано изменением актив-
усиливает спонтанную продукцию АФК и инги-
ности протеинкиназы С. Ряд авторов показали,
бирует продукцию АФК, индуцированную ФМА.
что стимуляция и активация нейтрофилов фор-
бол-12-миристат-13-ацетатом приводит к образо-
Наблюдаемый эффект может быть обусловлен
ванию NET. Образование NET после стимуляции
следующими фактами: спонтанная продукция
ФМА зависит от продукции АФК (через систему
АФК в нейтрофилах реализуется за счет уже акти-
NOX2). Однако было показано, что протеинки-
вированного NOX2, присутствующего в клеточ-
наза С и особенно ее изоформа ПКCβ, участвую-
ной мембране и паракринные факторы могут воз-
щие в сборке NOX2, наиболее важны для образо-
действовать непосредственно на уже функциони-
вания NET [24].
рующий комплекс.
Таким образом, возможно, что паракринные
В то же время ФМА-индуцированная продук-
факторы, активируя спонтанную активность
ция АФК требует поэтапной активации промежу-
NOX2 и ингибируя активность протеинкиназы С,
точных ферментов, в частности протеинкиназы
могут ингибировать продукцию АФК, дегрануля-
С, и ее ингибирование паракринными факторами
цию нейтрофилов и образование NET при кле-
может влиять на процесс сборки оксидазного
точной активации и тем самым снижать уровень
комплекса, что в свою очередь приведет к сниже-
гепатоцеллюлярной недостаточности. Косвенно
нию продукции АФК.
это предположение может быть подтверждено
Галектин 1 и тиоредоксин, факторы, присут-
данными, показавшими достоверное снижение
ствующие при КС, также могут влиять на NOX2.
уровня внеклеточной ДНК относительно АЦ при
В наших предыдущих исследованиях было пока-
введении КС.
зано, что условия культивирования существенно
Следует отметить, что вопрос об участии про-
влияют на продукцию этих паракринных факто-
теинкиназы С в патогенезе ацетаминофен-инду-
ров в стволовых клетках [15]. В условиях гипо-
цированного воспаления печени является акту-
ксии (О2 < 10%) значительно усиливалась про-
альным. Например, показано, что при АЦ проте-
дукция именно галектина 1 и тиоредоксина, т.е.
инкиназа С участвует в гепатотоксичности, а
факторов, способных изменять продукцию АФК.
применение ингибиторов протеинкиназы С эф-
фективно (до 80%) в снижении некроза гепатоци-
Галектин 1 является провоспалительным пеп-
тов, вызванного АФК [25, 26].
тидом, который может взаимодействовать с кле-
точной мембраной нейтрофилов, активируя
Также гепатопротективным эффектом может
NOX2, при условии, что клетки были активиро-
обладать тиоредоксин - еще один фактор КС. По
ваны процессом экстравазации тканей [20, 21].
литературным данным передозировка АЦ, вызы-
вающая избыточную продукцию АФК, приводит
Активация спонтанной продукции АФК в
к снижению эндогенной экспрессии тиоредокси-
нейтрофилах под действием КС (фракция
на и активации сигнального пути JNK. Таким об-
<30 кДа) будет способствовать регенерации пече-
разом, введение экзогенного тиоредоксина в со-
ночной ткани после воздействия АЦ, так как из-
ставе КС может значительно снижать уровень ге-
вестно, что молекулы АФК, секретируемые ней-
патоцеллюлярной недостаточности, о чем
трофилами, могут способствовать как развитию
свидетельствуют ранее полученные эксперимен-
макрофагов, так и процессам регенерации печени
тальные данные [27].
после токсического действия АЦ [14]. Следова-
тельно, увеличение спонтанной продукции ней-
Анализ экспрессии генов показал, что исполь-
трофилов под действием фракции КС <30 кДа,
зование КС МСК (фракция <30 кДа) значительно
продемонстрированное в исследовании, будет
увеличивает экспрессию МИФ и тиоредоксина в
способствовать более быстрому восстановлению
ткани печени. Распространено мнение, что МИФ
гепатоцитов, показанному в предыдущей работе
является провоспалительным цитокином, уро-
[16].
вень которого повышается при тканевой недоста-
БИОФИЗИКА том 68
№ 1
2023
96
ТЕМНОВ и др.
точности и системных заболеваниях [28]. В то же
СПИСОК ЛИТЕРАТУРЫ
время известно, что уровень экспрессии МИФ и
1.
A. M. Larson, Clin. Liver Dis., 11, 525 (2007).
тиоредоксина повышается практически при всех
2.
M. R. McGill, M. R. Sharpe, C. D. Williams, et al., J.
состояниях, связанных с окислительно-восста-
Clin. Invest., 122, 1574 (2012).
новительными процессами, которые следуют за
3.
H. Jaeschke, C. D. Williams, A. Ramachandran, et al.,
стрессом, травмой, дегенерацией, воспалением и
Liver Int., 32, 8 (2012).
гибелью клеток [29-31]. Таким образом, резуль-
4.
Y. Ishida, T. Kondo, A. Kimura, et al., Eur. J. Immu-
таты исследования показывают, что при введе-
nol., 36, 1028 (2006).
нии КС повышенная спонтанная продукция
5.
Z. X. Liu, D. Han, B. Gunawan, et al., Hepatology, 43,
АФК в нейтрофилах может вызывать повышение
1220 (2006).
уровня МИФ и тиоредоксина в тканях печени от-
6.
P. E. Marques, S. S. Amaral, D. A. Pires, et al., Hepa-
носительно контроля.
tology, 56, 1971 (2012).
7.
C. Cover, J. Liu, A. Farhood, et al., Toxicol. Appl.
Пока неясно, почему эффекты перорального и
Pharmacol., 216, 98 (2006).
подкожного введения КС МСК сопоставимы.
8.
H. S. Hou, C. L. Liao, H. K. Sytwu, et al., PLoS One,
Одной из возможных причин является влияние
7, e44880 (2012).
АЦ на Р-белок кишечника. Литературные данные
9.
J. A. Lawson, A. Farhood, R. D. Hopper, et al., Toxi-
не содержат сведений о влиянии АЦ на всасыва-
col. Sci., 54, 509 (2000).
ние коротких белковых молекул в кишечнике.
10.
C. D. Williams, M. L. Bajt, A. Farhood, et al., Liver
Однако ингибирование Р-белка АЦ и усиление
Int., 30, 1280 (2010).
всасывания ксенобиотиков в портальную систе-
11.
C. D. Williams, M. L. Bajt, M. R. Sharpe, et al., Toxi-
му печени [32] не позволяет исключить всасыва-
col. Appl. Pharmacol., 275 (2), 122 (2014).
ние сигнальных белков через слизистую оболочку
12.
C. D. Williams, A. Farhood, and H. Jaeschke, Toxicol.
кишечника и их прямое проникновение в ткань
Appl. Pharmacol., 247, 169 (2010).
печени.
13.
J. X. Wang, C. Zhang, L. Fu, et al., Toxicol. Lett., 265,
38 (2017).
14.
W. Yang, Y. Tao, Y. Wu, et al., Nat. Commun., 10 (1),
ВЫВОДЫ
1076 (2019).
Полученные данные позволяют сделать следу-
15.
A. Temnov, K. Rogov, V. Zhalimov, et al., Hepat.
ющие выводы:
Med., 11, 89 (2019).
1. Фракция КС <30 кДа оказывала максималь-
16.
A. A. Temnov, K. A. Rogov, A. N. Sklifas, et al., Mol.
ный протективный эффект на печень при введе-
Biol. Rep., 46 (3), 3101 (2019).
нии АЦ.
17.
H. Yagi, A. Soto-Gutierrez, N. Navarro-Alvarez, et al.,
2. Белки этой фракции снижают выражен-
Mol. Therapy, 18 (10), 1857 (2010).
ность системной воспалительной реакции и сте-
18.
F. A. von Meijenfeldt, L. C. Burlage, S. Bos, et al., Liv-
пень фиброза ткани печени в отдаленные сроки
er Transpl., 24 (12), 1716 (2018).
после введения токсина.
19.
T. D. Schmittgen and K. J. Livak, Nat. Protoc., 3 (6),
3. Степень выраженности гранулоцитарной
1101 (2008).
инфильтрации коррелирует со степенью некроза
20. J. Almkvist, C. Dahlgren, H. Leffler, et al., J. Immu-
печеночной паренхимы (что подтверждается
nol., 168 (8), 4034 (2002).
уровнем цитолитических ферментов).
21. M. T. Elola, M. E. Chiesa, and N. E. Fink, Comp. Bio-
chem. Physiol. B. Biochem. Mol. Biol., 141 (1), 23
4. Фракция КС <30 кДа увеличивает спонтан-
(2005).
ную и уменьшает индуцированную внутрикле-
точную продукцию АФК.
22. J. Liu, M. Jiang, Q. Jin et al., Front. Pharmacol., 12,
723881 (2021).
23. F. A. von Meijenfeldt, R. T. Stravitz, J. Zhang,
КОНФЛИКТ ИНТЕРЕСОВ
et al. Hepatology, 75 (3), 623 (2022).
Авторы заявляют об отсутствии конфликта
24. R. D. Gray, C. D. Lucas, A. MacKellar, et al., J. In-
интересов.
f lamm. (Lond.), 10 (1), 12 (2013).
25. B. Saberi, M. Shinohara, M. D. Ybanez, et al., Am. J.
Physiol. Cell Physiol., 295 (1), C50 (2008)
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
26. B. Saberi, M. D. Ybanez, H. S. Johnson, et al., Hepa-
Все манипуляции с экспериментальными жи-
tology, 59 (4), 1543 (2014).
вотными проведены в соответствии с Европей-
27. B. W. Lee, B. S. Jeon, and B. I. Yoon, J. Appl. Toxicol.,
ской конвенцией по защите позвоночных живот-
38 (7), 1008 (2018).
ных, используемых в научных исследованиях
28. T. Shimizu, R. Abe, H. Nakamura, at al., Biochem
(1986, 86/609/EEC).
Biophys Res Commun., 264 (3), 751 (1999).
БИОФИЗИКА том 68
№ 1
2023
ВЛИЯНИЕ ПАРАКРИННЫХ ФАКТОРОВ
97
29. A. Kudrin and D. Ray, Immunol. Cell Biol., 86 (3), 232
31. J. Yodoi, H. Nakamura, and H. Masutani, Biol.
(2008).
Chem., 383, 585 2002.
30. H. Lue, R. Kleemann, T. Calandra, et al., Microbes In-
32. A. Novak, G. D. Carpini, M. L. Ruiz, et al., J. Pharm.
fect., 4, 449 (2002).
Sci., 102 (10), 3830 (2013).
Paracrine Effects of Stem Cell Conditioned Medium on Production of Oxygen Reactive
Species in Blood Neutrophils in Acetaminophen-Induced Liver Failure
A.A. Temnov*, **, A.N. Sklifas*, V.K. Zhalimov*, M.G. Sharapov*, R.S. Fadeev***,
M.I. Kobyakova***, N.I. Kukushkin*, and
****
K.A. Rogov
*Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Moscow Institute of Physics and Technology, Institutskii per. 9, Dolgoprudny, Moscow Region, 141701 Russia
***Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
****Research Institute of Human Morphology, Petrovsky National Research Center of Surgery,
ul Tsurupy 3, Moscow, 117418 Russia
The current study examined the effects of mesenchymal stem cells-derived conditioned medium on the se-
verity of systemic inflammatory response induced by the administration of acetaminophen, as well as its long-
term effects on hepatic tissues. A conditioned medium fraction <30 кDа showed maximum protective effect.
Proteins of this fraction reduce the degree of systemic inflammatory response and liver tissue fibrosis long af-
ter the toxin administration. Liver tissues from experimental animals were examined, and a correlation be-
tween the reduction of granulocytic infiltration scoring and the degree hepatic parenchymal necrosis was
demonstrated (confirmed by the cytolytic enzyme level). The <30 кDа fraction increased the spontaneous
but decreased phobrol-12-myristate-13-acetate-induced intracellular production of reactive oxygen species.
Results from this study show that the level of macrophage migration inhibitory factor and expression of thi-
oredoxin significantly increase as compared to controls during increased spontaneous production of reactive
oxygen species in neutrophils.
Keywords: acetaminophen, liver, fibrosis, stem cells, conditioned media
БИОФИЗИКА том 68
№ 1
2023