БИОФИЗИКА, 2023, том 68, № 1, с. 108-111
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 577.3
ИССЛЕДОВАНИЕ ОБРАЗОВАНИЯ КОРОТКОЖИВУЩИХ АКТИВНЫХ
ФОРМ КИСЛОРОДА В ГОМОГЕНАТЕ СЕРДЦА КРЫСЫ МЕТОДОМ
ЭЛЕКТРОННОГО ПАРАМАГНИТНОГО РЕЗОНАНСА
© 2023 г. А.А. Тимошин*, #, В.Л. Лакомкин*, А.А. Абрамов*, Э.К. Рууге*, **
*Национальный медицинский исследовательский центр кардиологии имени академика Е.И. Чазова Минздрава
России, 3-я Черепковская ул., 15а, Москва, 121552, Россия
**Физический факультет Московского государственного университета имени М.В. Ломоносова,
Ленинские горы, 1/2, Москва, 119991, Россия
#E-mail: timoshin_a_a@mail.ru
Поступила в редакцию 30.09.2022 г.
После доработки 11.11.2022 г.
Принята к публикации 16.11.2022 г.
Работа посвящена исследованию защитного действия такого митохондриально-направленного
препарата, как пластомитин, в условиях гиперпродукции короткоживущих активных форм кисло-
рода в организме животных. Изучена интегральная скорость генерации высокотоксичных кисло-
родных радикалов в условиях окислительного стресса, инициированного введением в организм жи-
вотных доксорубицина, и защитного эффекта, вызываемого действием пластомитина. Экспери-
менты проводились на гомогенатах сердец крыс с использованием метода ЭПР. Установлено, что в
результате введения крысам доксорубицина достоверно увеличивается на 26% скорость образова-
ния короткоживущих активных форм кислорода в гомогенате, а в случае совместного применения
доксорубицина и пластомитина этот эффект в значительной степени подавляется.
Ключевые слова: активные формы кислорода, антиоксидант, гидроксиламин, доксорубицин, пластоми-
тин, спиновая ловушка, электронный парамагнитный резонанс.
DOI: 10.31857/S0006302923010118, EDN: OAJYWX
ствием, способным стимулировать образование
Известно, что образование короткоживущих
АФК в ткани миокарда [4-6].
высокотоксичных активных форм кислорода
(АФК) является одним из основных факторов,
В данной работе такие исследования проводи-
вызывающих существенные и необратимые по-
лись на гомогенатах сердец крыс с использовани-
вреждения органов и тканей [1]. Для защиты био-
ем метода электронного парамагнитного резо-
логических структур от повреждающего действия
нанса (ЭПР). Основной целью работы являлось
АФК в лабораторной и клинической практике
изучение интегральной скорости генерации вы-
широко применяются препараты, способные эф-
сокотоксичных кислородных радикалов в усло-
фективно перехватывать эти короткоживущие
виях окислительного стресса, инициированного
соединения, оказывая тем самым антиоксидант-
введением в организм животных доксорубицина
ное действие.
и защитного эффекта, вызываемого действием
пластомитина.
В данной работе исследовалось защитное дей-
ствие такого митохондриально-направленного
препарата, как пластомитин (SkQ, ионы Скулачё-
МЕТОДИКА ЭКСПЕРИМЕНТА
ва) [2, 3]. При этом важной задачей являлся ана-
Эксперименты проводили на нормотензивных
лиз действия этого антиоксиданта в условиях ги-
крысах линии Wistar (самцы массой 320-380 г).
перпродукции АФК, инициированной введени-
Животных содержали в биоклинике НМИЦ кар-
ем в организм доксорубицина (антибиотик
диологии им. ак. Е.И. Чазова Минздрава России
антрациклинового ряда, используемый для лече-
в клетках по 5 особей со свободным доступом к
ния злокачественных новообразований), облада-
сухим кормам и воде. Световой режим контроли-
ющего дозозависимым кардиотоксическим дей-
ровали (12:12 ч - свет : темнота) при достаточной
смене объемов воздуха и температуре 19-23°С.
Сокращения: АФК - активные формы кислорода, SkQ -
пластомитин (ионы Скулачёва), ЭПР
- электронный
Все животные были произвольным образом
парамагнитный резонанс.
разделены на три группы. Животные первой
108
ИССЛЕДОВАНИЕ ОБРАЗОВАНИЯ КОРОТКОЖИВУЩИХ АКТИВНЫХ ФОРМ КИСЛОРОДА
109
Для регистрации образования короткоживу-
щих активных форм кислорода в образцы супер-
натанта, соответствующие всем эксперименталь-
ным группам, добавляли водный раствор спино-
вой ловушки, в качестве которой применяли
гидроксиламин СРН
((3S)-1-гидрокси-2,2,5,5-
тетраметилпирролидин-3-карбоксиловая кисло-
та) [8, 9], конечная концентрация которого в об-
разцах составляла 1 мМ. Полученные пробы вво-
дили в газопроницаемые капилляры объемом
35 мкл, которые помещали в кварцевую трубку
внутренним диаметром 4 мм, продуваемую воз-
душным потоком при комнатной температуре и
расположенную в активной зоне резонатора
ЭПР-спектрометра.
Регистрацию спектров ЭПР проводили на спек-
Рис. 1. Спектр ЭПР нитроксильных радикалов, образую-
трометре Х-диапазона модели Е-109Е (Varian,
щихся при введении СРН в гомогенат сердца крысы.
США). Амплитуда ВЧ-модуляции магнитного поля
составляла 0.1 мТл при частоте 100 кГц. СВЧ-мощ-
ность спектрометра устанавливали на уровне 10
группы (контроль) получали подкожно физиоло-
мВт, а частота СВЧ-излучения всегда составляла
гический раствор. Вторая и третья группы живот-
9.14 ГГц. Запись серии сигналов ЭПР проводили в
ных получали доксорубицин в дозе 2 мг/кг под-
течение 30 мин после добавления СРН к образцам
кожно еженедельно в течение четырех недель.
гомогената, за это время записывали 7 спектров.
Животные из третьей группы в течение всего это-
Для анализа содержания полученных парамагнит-
го периода наряду с доксорубицином получали
ных аддуктов измеряли амплитуды высокопольной
также ежедневно подкожно пластомитин (в 50%-
компоненты их спектров.
м водном пропиленгликоле) в дозе 0.32 мг/кг.
Статистическую обработку данных и построе-
При таком введении крысам доксорубицина у
ние графиков проводили с использованием па-
них инициировалось развитие сердечной недо-
кетыта программ Origin
8 (OriginLab Corp.,
статочности [7], а пластомитин мог оказывать за-
США). Все данные представлены как среднее
щитное действие как митохондриально направ-
значение ± ошибка среднего. Кратность повторе-
ленный перехватчик короткоживущих кислород-
ния опытов составляла не менее пяти-шести экс-
ных радикалов.
периментов. Для проверки статистической досто-
верности эффектов использовали двусторонний
Через четыре недели всех животных забивали
t-критерий Стьюдента.
передозировкой уретана, после чего у них вскры-
вали грудную клетку, изолировали сердце и про-
мывали его в физиологическом растворе, после
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
чего замораживали в жидком азоте. Далее полу-
В ходе работы исследовали образование ко-
ченные образцы миокарда животных всех трех
роткоживущих АФК в ткани сердечной мышцы с
экспериментальных групп хранили в жидком азо-
использованием в качестве спиновой ловушки
те и размораживали непосредственно перед их
гидроксиламина CPH [8, 9]. Как известно, корот-
анализом методом ЭПР.
коживущие кислородные радикалы присоединя-
После размораживания образцы ткани сердеч-
ются к молекуле данной спиновой ловушки с об-
ной мышцы гомогенизировали. При этом для
разованием ковалентной связи. Продуктом этой
каждого образца навеску ткани миокарда, отмы-
реакции являются стабильные нитроксильные
тую от крови, измельчали ножницами, после чего
радикалы (спиновые аддукты), имеющие харак-
продавливали через сито c отверстиями диамет-
терный спектр ЭПР.
ром 0.8 мм, после этого перетирали в стеклянном
На рис. 1 представлен характерный спектр
гомогенизаторе с автоматическим приводом вме-
ЭПР нитроксильных радикалов, образующихся
сте со средой гомогенизации (из расчета 100 мг
при добавлении СРН в гомогенат ткани миокар-
ткани на 300 мкл среды). Все манипуляции про-
да. Из рисунка видно, что этот спектр представля-
водили при температуре 0-4°C. В качестве среды
ет собой триплет узких линий. Такой сигнал, как
гомогенизации использовали раствор Кребса-
известно, соответствует спектру нитроксильных
Хенселейта. Полученный грубый гомогенат оса-
радикалов, обладающих быстрым и изотропным
ждали центрифугированием в течение 3 мин при
молекулярным движением, образующихся в ре-
4000 об/мин, полученный супернатант сразу же
зультате взаимодействия СРН с короткоживущи-
исследовали методом ЭПР.
ми кислородными радикалами [8, 9].
БИОФИЗИКА том 68
№ 1
2023
110
ТИМОШИН и др.
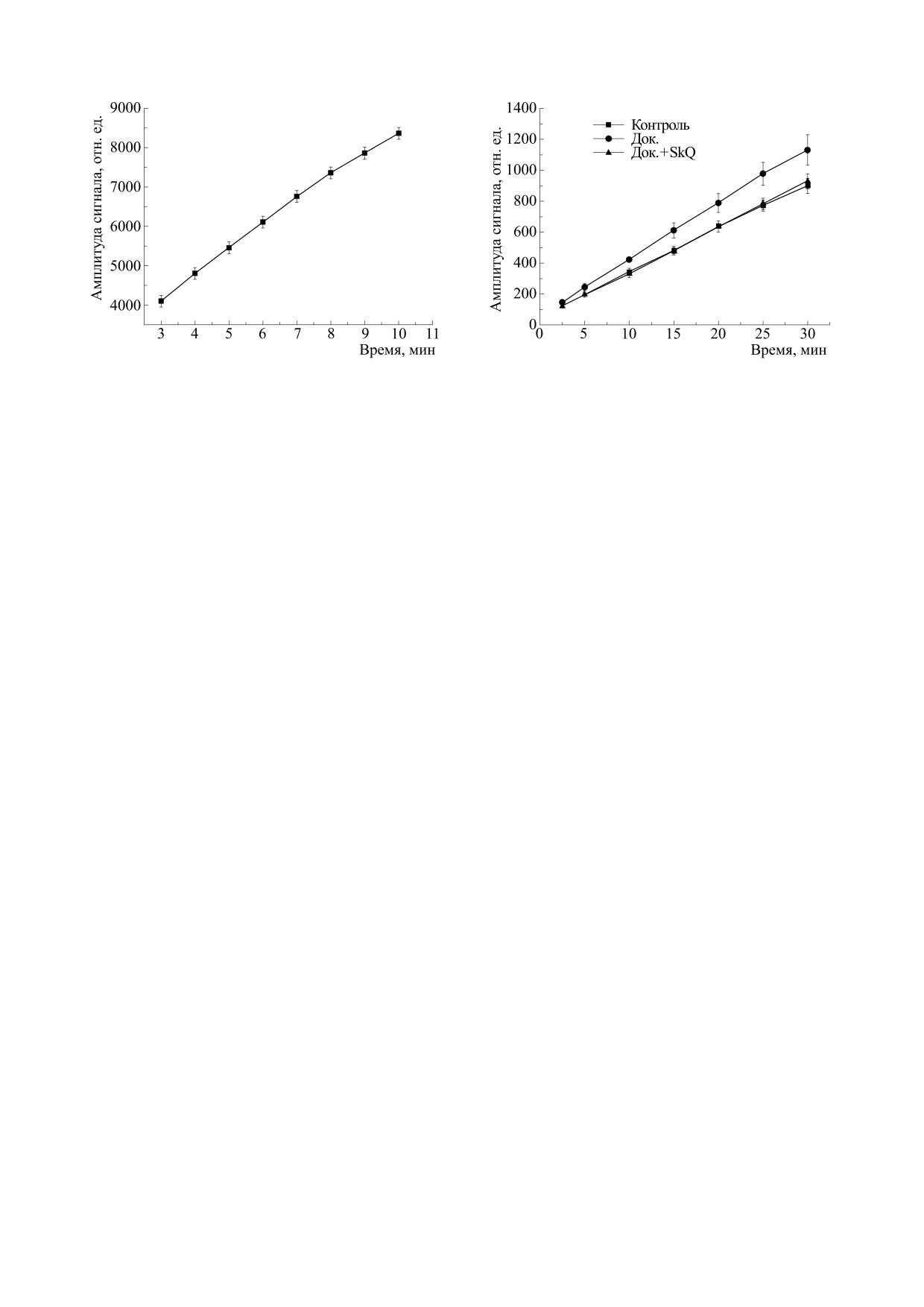
Рис. 3. Кинетики амплитуды высокопольной компо-
Рис. 2. Кинетика амплитуды высокопольной компо-
ненты сигналов ЭПР нитроксильных радикалов, обра-
ненты сигналов ЭПР нитроксильных радикалов, обра-
зующихся после добавления СРН в гомогенат ткани
зующихся в модельной системе, содержащей СРН и
миокарда крыс, соответствующих трем эксперимен-
ксантин-ксантиноксидазу. По оси абсцисс - время с
тальным группам. По оси абсцисс - время с момента
момента введения СРН в реакционную среду.
введения СРН в образцы гомогената.
Важно отметить, что реакция данной спиновой
В другой части работы исследовали кинетики
ловушки с различными окислителями приводит к
формирования и накопления стабильных нит-
образованию и накоплению практически одинако-
роксильных радикалов при введении СРН в об-
вых нитроксильных радикалов, поскольку такие ло-
разцы гомогената ткани миокарда. Для всех экс-
вушки на основе гидроксиламина не демонстриру-
периментальных групп животных рассчитывали
ют специфической реакционной способности к
усредненные кинетики образования этих пара-
определенному типу свободнорадикальных АФК и
магнитных соединений, полученные результаты
не допускают поэтому идентификации АФК по
представлены на рис. 3. Из этого рисунка видно,
спектру ЭПР. Тем не менее, на специфичность об-
что во всех трех группах животных после введе-
наружения супероксида указывает ингибирование
ния СРН в образцы гомогената наблюдалось уве-
сигнала ЭПР при добавлении в реакционную среду
личение содержания в пробах парамагнитных
супероксиддисмутазы [9].
нитроксильных радикалов, и во всех случаях ки-
нетика этого роста могла быть хорошо аппрокси-
Кроме того, способность СРН эффективно пе-
мирована линейной зависимостью. Исходя из
рехватывать супероксидные анион-радикалы бы-
этих зависимостей, для всех экспериментальных
ла показана в данных экспериментальных усло-
групп оценивали скорость образования нитрок-
виях на модельной системе, содержащей ксантин
сильных радикалов, результаты представлены на
и ксантиноксидазу в фосфатном буфере при
рис. 4.
pH 7.4. На рис. 2 представлена характерная кине-
Из этого рисунка видно, что при переходе от
тика изменения амплитуды высокопольной ком-
контрольной группы к животным, получавшим
поненты сигналов ЭПР образующихся в такой
доксорубицин, скорость образования парамаг-
системе нитроксильных радикалов. Из этого ри-
нитных аддуктов увеличивалась на 26%, а в случае
сунка видно, что их концентрация практически
совместного применения доксорубицина и пла-
линейно увеличивается.
стомитина она практически не отличалась от сво-
Следовательно, в данных экспериментальных
его значения, полученного в контроле.
условиях в результате взаимодействия СРН с су-
Таким образом, несмотря на то, что введение
пероксидными анион-радикалами, образующимися
СРН осуществлялось не в интактный организм
в системе «ксантин-ксантиноксидаза», происходит
животных, а в гомогенат ткани сердечной мышцы
образование стабильных нитроксильных радикалов,
после ее замораживания и оттаивания, в препара-
регистрируемых методом ЭПР. При этом форма
тах, соответствующих всем экспериментальным
спектров радикалов, регистрируемых в такой мо-
группам, происходит генерация короткоживущих
дельной системе, не отличается от формы сигналов
кислородных радикалов с образованием спино-
ЭПР этих парамагнитных соединений, образую-
вых аддуктов, регистрируемых методом ЭПР.
щихся в результате взаимодействия СРН с коротко-
При этом в результате введения крысам доксору-
живущими АФК в гомогенате ткани миокарда (дан-
бицина достоверно увеличивается скорость обра-
ные не приведены).
зования короткоживущих АФК в гомогенате, а в
БИОФИЗИКА том 68
№ 1
2023
ИССЛЕДОВАНИЕ ОБРАЗОВАНИЯ КОРОТКОЖИВУЩИХ АКТИВНЫХ ФОРМ КИСЛОРОДА
111
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта
интересов.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Все исследование выполнялись в соответствии
с директивой 2010/63/eu Европейского парла-
мента и совета Европейского союза от 22 сентяб-
ря 2010 года по охране животных, используемых в
научных целях, и принципами национального
стандарта ГОСТ Р 53434-2009.
СПИСОК ЛИТЕРАТУРЫ
Рис. 4. Усредненные значения скорости образования
1. R. Bolli, Cardiovasc. Drugs Ther., 5, 249 (1991)
нитроксильных радикалов, соответствующие трем
2. V. P. Skulachev, V. N. Anisimov, Y. N. Antonenko,
экспериментальным группам;
**
- р
<
0.05
et al., Biochimica et Biophysica Acta - Bioenergetics,
относительно контроля.
1787 (5), 437 (2009).
3. В. Л. Лакомкин и В. И. Капелько, Кардиология, 49
случае совместного применения доксорубицина
(10), 55 (2009).
и пластомитина этот эффект в значительной сте-
4. M. A. Mitry and J. G. Edwards, IJC Heart & Vascula-
пени подавляется.
ture, 10, 17 (2016).
Следует отметить также, что данный эффект,
5. H. Nohl, L. Gille, and K. Staniek, Zeitschrift Fur
полученный нами на модели гомогената ткани
Naturforschung. C, 53 (3-4), 279 (1998).
сердца крысы, хорошо согласуется с данными
6. P. K. Singal, N. Iliscovic, T. Li, et al., FASEB J., 11
других авторов, показывающих эффективное
(12), 931 (1997).
действие пластомитина как перехватчика корот-
7. А. А. Абрамов, В. Л. Лакомкин, А. В. Просвирнин
коживущих АФК [7].
и др., Кардиология, 59 (6), 35 (2019).
8. C. L. Hawkins and M. J. Davies, Biochimica et Bio-
БЛАГОДАРНОСТИ
physica Acta - General Subjects, 1840 (2), 708 (2014).
Авторы выражают благодарность Е.В. Щерба-
9. S. I. Dikalov, Y. F. Polienko, and I. Kirilyuk, Antioxi-
ченко за помощь в эксперименте.
dants & Redox Signaling, 28 (15), 1433 (2018).
EPR Study of the Generation of Short-Lived Reactive Oxygen Species
in Rat Heart Homogenate
A.A. Timoshin*, V.L. Lakomkin*, A.A. Abramov*, and E.K. Ruuge*, **
*Chazov National Medical Research Centre for Cardiology of the Ministry of Health of the Russian Federation,
3-ya Cherepkovskaya ul. 15a, Moscow, 121552 Russia
**Faculty of Physics, Lomonosov Moscow State University, Leninskie Gory, 1/2, Moscow, 119991 Russia
The aim of the present study was to investigate the protective effects of a mitochondrial-targeted antioxidant
such as plastomitin through ROS hypergeneration in animals. The average rate of the generation of highly re-
active oxygen radicals during oxidative stress, induced by doxorubicin injection in rats and a protective impact
of plastomitin use were investigated. The experiments were carried out with rat heart tissue homogenates us-
ing EPR spectroscopy. It was found that in case of doxorubicin injection in rats, there is a significant 26%
increase in the rate of short-lived reactive oxygen species generation in the homogenate but when doxorubicin
and plastomitin were used in combination, this effect was greatly suppressed.
Keywords: reactive oxygen species, antioxidant, hydroxylamine, doxorubicin, plastomitin, spin trap, electron para-
magnetic resonance
БИОФИЗИКА том 68
№ 1
2023