БИОФИЗИКА, 2023, том 68, № 1, с. 112-119
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 577.3
СРАВНЕНИЕ ДИНАМИКИ ПОВРЕЖДЕНИЙ ДНК ЛЕЙКОЦИТОВ КРОВИ
И ВЫЖИВАЕМОСТИ МЫШЕЙ ПОСЛЕ ИХ ТОТАЛЬНОГО ОБЛУЧЕНИЯ
ИОНАМИ УГЛЕРОДА В ПИКЕ БРЭГГА
ИЛИ РЕНТГЕНОВСКИМИ ЛУЧАМИ
© 2023 г. Е.А. Кузнецова*, #, О.М. Розанова*, Е.Н. Смирнова*, С.И. Глухов*, Т.В. Сирота*,
Т.А. Белякова**, Н.П. Сирота*
*Институт теоретической и экспериментальной биофизики РАН,
Институтская ул., 3, Пущино Московской области, 142290, Россия
**Физико-технический центр Физического института им. П.Н. Лебедева,
Академический пр., 2/110, Протвино, Московская область, 142281, Россия
#E-mail: kuzglu@rambler.ru
Поступила в редакцию 23.09.2022 г.
После доработки 15.11.2022 г.
Принята к публикации 07.12.2022 г.
В работе определены: выживаемость мышей, облученных ускоренными ионами углерода
(450 МэВ/нуклон) в пике Брэгга или рентгеновским излучением в дозе 6,5 Гр; методом ДНК-комет
- уровни повреждений ДНК (%TDNA) в лейкоцитах крови мышей за сутки до и через 1-23 сут по-
сле облучения ионами углерода и через 1-28 сут после воздействия рентгеновского излучения в той
же дозе. Обнаружено большее повреждающее действие ионов углерода по сравнению с рентгенов-
скими лучами по критериям выживаемости и %TDNA, а также у индивидуальных животных суще-
ственные вариации %TDNA, которые, по-видимому, могут служить причиной индивидуальных
различий при развитии нестабильности генома в отдаленные сроки. Можно полагать, что более вы-
сокий %TDNA лейкоцитов после облучения ионами углерода по сравнению с рентгеновским излу-
чением, его больший диапазон и несинхронность изменений у индивидуумов в пострадиационном
периоде связаны с возникновением кластерных повреждений в ДНК и дисфункцией митохондрий,
а также обусловлены генетическими и эпигенетическими факторами. Полученные результаты ука-
зывают на необходимость оценки состояния лейкоцитов крови животных с гетерогенным генети-
ческим фоном методом ДНК-комет перед облучением для формирования группы с близкими
значениями %TDNA. Выявленные различия у индивидуальных лабораторных животных требуют
дальнейшего изучения для совершенствования животных моделей в свете развития персонифици-
рованной биомедицины.
Ключевые слова: метод ДНК-комет, рентгеновское излучение, ускоренные ионы углерода, повреждения
ДНК лейкоцитов, индивидуальные животные.
DOI: 10.31857/S000630292301012X, EDN: OALBXD
бокие изменения структуры хроматина [1]. В от-
Изучение биологических эффектов ускорен-
личие от пучка ускоренных частиц,
ных частиц на живые организмы связано с реше-
направленного на локальный участок тела паци-
нием проблем космобиологии и медицины. Так,
ента, воздействие тяжелых заряженных частиц
в ограниченном количестве специализированных
при пилотируемых космических полетах может
клиник в качестве радиотерапии применяют об-
осуществляться на весь организм. Высокоэнерге-
лучение опухолей тяжелыми частицами, в част-
тические частицы (106-1021 эВ) и фотоны из вне-
ности, ионами углерода. Специфика передачи
земных источников, находящихся внутри и вне
энергии ускоренных тяжелых частиц биологиче-
нашей галактики, индуцируют повреждения
ским образцам заключается в максимальном вы-
ДНК культивируемых клеток и клеток крови кос-
делении энергии в пике Брэгга, что вызывает глу-
монавтов, даже несмотря на низкие дозы и не-
большие мощности доз [2, 3]. Основным неблаго-
Сокращения:
%TDNA - уровень повреждений ДНК,
приятным эффектом действия ионизирующих
ЛПЭ - линейная передача энергии, АФК - активные фор-
мы кислорода.
излучений при радиотерапии и долговременных
112
СРАВНЕНИЕ ДИНАМИКИ ПОВРЕЖДЕНИЙ ДНК ЛЕЙКОЦИТОВ КРОВИ
113
космических полетах является повышенный риск
але «Столбовая» НЦБМТ ФМБА, которых разво-
возникновения злокачественных новообразова-
дили и содержали в стандартных условиях вива-
ний [1, 4]. Поэтому изучение отдаленных биоло-
рия ИТЭБ РАН (Пущино, Московская область)
гических эффектов воздействия ускоренных ча-
при температуре 20 ± 2°С, естественном световом
стиц на моделях животных актуально для пони-
дне и свободным доступом к пище и воде. Мыши
мания последствий, как космических полетов,
содержались в полипропиленовых клетках по
так и применяемых протоколов лечения онколо-
10 особей.
гических пациентов. В качестве объекта радио-
Облучение. Мышей, предварительно анестези-
биологических исследований традиционно ис-
рованных смесью ксилазин-золетила (Interche-
пользуют мышей, в частности, для выявления
mie Werken. BV, Нидерланды; Virbac Sante Ani-
биологических эффектов облучения берут пробы
male, Франция), облучали тотально в индивиду-
крови. Использование крови мышей представля-
альных хорошо вентилируемых контейнерах на
ется интересным, поскольку основное количе-
установке «Радиобиологический стенд на угле-
ство лейкоцитов мыши - это лимфоциты, являю-
родном пучке У-70» НИЦ «Курчатовский инсти-
щиеся клетками иммунной системы, с одной
тут» - ИФВЭ (Протвино, Московская обл.) мо-
стороны, и наиболее радиочувствительными
ноэнергетическим пучком ускоренных ионов уг-
клетками крови, с другой. Результатом воздей-
лерода с энергией 450 МэВ/нуклон в пике Брэгга
ствия фотонов и ускоренных частиц является по-
в дозе 6.5 Гр, как описано в работе [7]. Расчетная
ражение клеточных структур, в частности,
величина линейной передачи энергии (ЛПЭ)
ДНК, в которой регистрируют различные повре-
ионов углерода при позиционировании мышей в
ждения - разрывы, повреждение или утрата ос-
модифицированном пике Брэгга составляла
нований, сшивки; особенностью действия уско-
100 кэВ/мкм. Дозиметрию во время облучения
ренных ионов на клетки является индукция кла-
проводили по показаниям монитора и ТЛД-дози-
стерных повреждений ДНК, то есть близко
метров типа ММТ. Профили пучка и равномер-
расположенных множественных нарушений
ность поперечного облучения контролировали с
структуры хромосомы [1, 5].
помощью радиохромной пленки ЕВТ-3 (Caf-
Chromic, США). Параллельно другие группы мы-
Одним из современных методов, выявляющих
шей были облучены в дозе 6.5 Гр на рентгенов-
широкий спектр повреждений ДНК индивиду-
ской установке «РУТ-250-15-1» (ЦКП «Источни-
альных клеток (одно- и двухнитевые разрывы,
ки излучений» ИБК РАН, Пущино, Московская
апуриновые/апиримидиновые сайты, реализую-
обл.) при мощности дозы 1.12 Гр/мин, напряжен-
щиеся в разрывы ДНК при высоком рН), являет-
ности 200 кВ, силе тока 20 мА, фильтры 1 мм Al и
ся щелочная версия метода ДНК-комет [6]. Ме-
1 мм Cu, фокусное расстояние 37 см, ЛПЭ =
тод является высокочувствительным, не требует
= 2 кэВ/мкм. Дозиметрию проводили по методу
большого количества биологического материала,
Фрике в присутствии бензойной кислоты с помо-
что позволяет проводить мониторинг уровня по-
щью дозиметра VA-J-18.
вреждений ДНК клеток крови облученных жи-
Метод ДНК-комет. Для определения уровня
вотных в течение их жизни в разные сроки после
повреждения ДНК в лейкоцитах крови у каждой
облучения. Поскольку, как правило, в группе жи-
мыши за сутки до, а также в разные периоды по-
вотных регистрируют средние значения изучае-
сле облучения на протяжении 23-28 суток надре-
мых показателей, то в свете развития персонифи-
зали кончик хвоста, брали по 5 мкл крови и поме-
цированной биомедицины особый интерес также
щали в пробирки с фосфатно-солевым буфером,
заключается в изучении показателей у индивиду-
рН 7.2, содержащим 0.001 моль/л ЭДТА. Цельную
альных животных на протяжении длительного
кровь мышей разбавляли этим раствором в шесть
пострадиационного периода.
раз. Слайды для анализа ДНК-комет готовили по
Цель работы: оценить выживаемость и уровни
методике [8] и анализировали под флуоресцент-
повреждений ДНК (%TDNA) лейкоцитов крови у
ным микроскопом
«ЛЮМАМ И-3» (ЛОМО,
индивидуальных животных в отдаленные сроки
Санкт-Петербург). Для экспериментов in vitro из
после воздействия на мышей ускоренных ионов
крови интактных мышей аналогичным образом
углерода с энергией 450 МэВ/нуклон в пике Брэг-
готовили слайды, которые облучали на льду на
га в дозе 6.5 Гр, сравнить динамику изменений
рентгеновской установке «РУТ-250-15-1» с той
уровней повреждений ДНК лейкоцитов с таковой
же мощностью дозы, как указано выше. Сразу по-
после воздействия рентгеновского излучения в
сле облучения слайды помещали в лизирующий
той же дозе.
раствор и проводили все процедуры согласно ра-
боте [8]. Изображения комет были сняты цифро-
вой камерой CoolPix 995 (Nikon, Япония) и обра-
МАТЕРИАЛЫ И МЕТОДЫ
ботаны с помощью специально разработанного
Животные. Эксперименты проводили на 8-
программного обеспечения, содержащего алго-
9-недельных самцах аутбредных мышей колонии
ритмы расчета стандартных параметров комет [9].
SHK (масса 31-35 г, n = 60), полученных в фили-
Уровень повреждения выражали в процентах
БИОФИЗИКА том 68
№ 1
2023
114
КУЗНЕЦОВА и др.
Рис. 1. Средние значения %TDNA лейкоцитов крови
после облучения рентгеновскими лучами слайдов, со-
Рис. 3. Динамика выживаемости мышей после тоталь-
держащих клетки крови, в диапазоне доз 0-8 Гр; * - до-
ного облучения ионами углерода и рентгеновским излу-
стоверные отличия от необлученных (р < 0.05).
чением в дозе 6.5 Гр.
ДНК, содержащейся в хвосте кометы, отно-
Статистическая обработка результатов. Анализ
сительно общего количества ядерной ДНК
статистической достоверности отличий проводи-
(%TDNA). Для каждой экспериментальной еди-
ли методом однофакторного дисперсионного
ницы анализировали по три слайда, фотографи-
анализа (one-way ANOVA), расчет p-value досто-
руя не менее 50 клеток на слайд, как описано в ра-
верности уровней значимости производили мето-
боте [10].
дом последующего теста Турки (Turkey HSD post-
hoc test), а также с использованием t-критерия
Определение выживаемости. Для определения
Стьюдента. Показатели выживаемости мышей
30-суточной выживаемости использовали 20 мы-
сравнивали с помощью непараметрических кри-
шей, которые были разделены на две группы. Бы-
териев: Гехана-Вилкоксона для оценки продол-
ли проведены два независимых эксперимента.
жительности жизни погибших от облучения жи-
После облучения в течение месяца ежедневно
вотных и логрангового критерия для сравнения
учитывали гибель животных и по итогам наблю-
30-ти суточной выживаемости. Различия считали
дения определяли 30-суточную выживаемость,
статистически значимыми при p ≤ 0.05.
динамику гибели и среднюю продолжительность
жизни погибших мышей.
РЕЗУЛЬТАТЫ
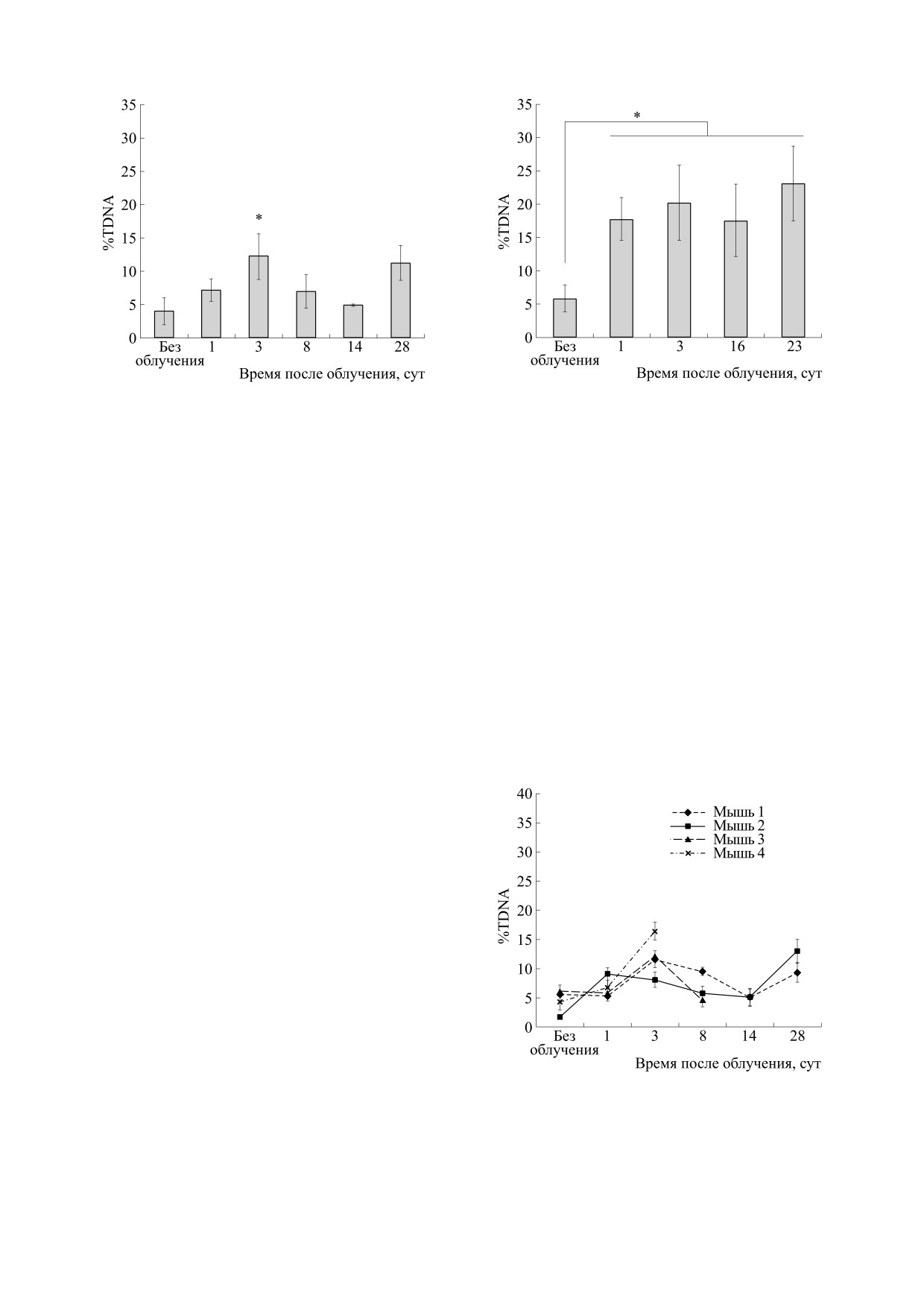
На рис. 1 показана зависимость %TDNA лей-
коцитов крови от дозы сразу после воздействия
рентгеновского излучения на кровь мыши in vitro.
Облучение клеток в дозах 0-8 Гр проводили в со-
ставе агарозных слайдов на льду для исключения
репарации ДНК. Видно, что с увеличением дозы
растут значения %TDNA.
На рис. 2 показана зависимость %TDNA лей-
коцитов крови через сутки после облучения мы-
шей рентгеновским излучением в диапазоне доз
0-5 Гр. Различия в уровнях остаточных повре-
ждений ДНК при облучении лейкоцитов при
этих дозах в условиях in vivo не были выявлены.
При данной постановке эксперимента регистри-
ровали лишь остаточные нерепарированные по-
вреждения.
На рис. 3 представлены кривые выживаемости
Рис. 2. Средние значения %TDNA лейкоцитов крови
мышей, облученных в дозе 6.5 Гр в пике Брэгга
через сутки после воздействия на мышей рентгеновско-
ионами углерода и для сравнения - рентгенов-
го излучения в диапазоне доз 0-5 Гр.
ским излучением. Основная гибель мышей при
БИОФИЗИКА том 68
№ 1
2023
СРАВНЕНИЕ ДИНАМИКИ ПОВРЕЖДЕНИЙ ДНК ЛЕЙКОЦИТОВ КРОВИ
115
Рис. 4. Средние значения %TDNA лейкоцитов крови
Рис. 5. Средние значения %TDNA лейкоцитов крови
через 1-28 сут после воздействия на мышей рентгенов-
через
1-23 сут после облучения мышей ионами
ского излучения в дозе 6.5 Гр (M ± SD); * - достоверные
углерода в дозе 6.5 Гр (M ± SD); * - достоверные
отличия от необлученных мышей (р < 0.05).
отличия от необлученных мышей (р < 0.05).
облучении ионами углерода наблюдалась с ше-
ми углерода. Видно, что уже через сутки %TDNA
стых по девятые сутки в отличие от рентгеновско-
достоверно увеличивался по сравнению с тако-
го излучения, где животные начинали гибнуть
вым до облучения и оставался высоким вплоть до
только с двенадцатых суток, что может быть обу-
23 суток (р < 0.05).
словлено разным характером течения лучевой бо-
Поскольку нами выявлены резкие различия в
лезни: развитие желудочно-кишечного синдрома
динамике уровней %TDNA лейкоцитов крови,
после действия ионов углерода и костномозгово-
индуцированных рентгеновским и ионным излу-
го синдрома после рентгеновского излучения. В
чениями, действие которых еще более значимо
период развития острой лучевой болезни во всех
проявились по критерию выживаемости мышей,
группах наблюдалось прогрессивное снижение
было интересно проанализировать индивидуаль-
массы тела животных и угнетение двигательной
ные вариации уровней повреждений ДНК у вы-
активности. Максимальная потеря веса на 30% в
живших мышей. На рис. 6 показана динамика ин-
группе мышей после рентгеновского излучения
дивидуальных изменений %TDNA лейкоцитов
наблюдалась через 11-15 суток, а в группе, облу-
крови через 1-28 суток после воздействия рентге-
ченной ионами, критическое снижение веса на-
новского излучения. У всех мышей на третьи сут-
блюдалось уже на 5-7 сутки. Средняя продолжи-
тельность жизни погибших при облучении иона-
ми углерода мышей составила 9 ± 3 суток, а при
рентгеновском облучении - 16 ± 3 суток. Дина-
мика гибели мышей после воздействия рентге-
новских фотонов и ионов достоверно различа-
лась (р < 0.05), и к 30 суткам при облучении иона-
ми углерода выживаемость составила 21%, а для
рентгеновского излучения - 40%.
В параллельных экспериментах изучали дина-
мику изменения %TDNA лейкоцитов крови у вы-
живших животных примерно в те же сроки после
воздействия на мышей ионов углерода и рентге-
новского излучения. На рис. 4 показана динами-
ка изменений средних значений %TDNA лейко-
цитов крови через 1-28 суток после воздействия
на мышей рентгеновского излучения в дозе
6.5 Гр. Как видно из этого рисунка, достоверные
отличия %TDNA от контрольного уровня наблю-
дались на 3 сут после облучения. На рис. 5 пока-
Рис. 6. Динамика изменений %TDNA у индивидуаль-
заны средние значения %TDNA лейкоцитов в те-
ных мышей через 1-28 сут после облучения рентгенов-
чение периода 1-23 суток после облучения иона-
ским излучением в дозе 6.5 Гр (M ± SEM).
БИОФИЗИКА том 68
№ 1
2023
116
КУЗНЕЦОВА и др.
in vivo (рис. 2), где уровень %TDNA практически
не зависел от дозы. Это объясняется тем, что при
облучении клеток в агарозных слайдах при 4°С
процессы репарации ДНК практически отсут-
ствовали, и регистрировался индуцированный
облучением уровень повреждений ДНК. Через
сутки после облучения мышей (рис. 2) регистри-
ровались остаточные повреждения ДНК лейко-
цитов после реализации как репарации ДНК, так
и клеточного обновления. Известно, что в клет-
ках через 20-24 ч после воздействия фотонов в
основном заканчивается репарация всех типов
повреждений ДНК [12]. Следует отметить, что
как при облучении in vitro, так и in vivo наблюда-
лись большие величины стандартного отклоне-
ния, что указывало на гетерогенность радиацион-
ного ответа клеток крови. Очевидно, что наблю-
даемая гетерогенность ответа связана не с
различным ответом субпопуляций лейкоцитов,
Рис. 7. Динамика изменений %TDNA у индивидуаль-
поскольку, как было показано, лимфоциты и гра-
ных мышей через 1-23 сут после облучения ионами уг-
лерода в дозе 6.5 Гр (M ± SD).
нулоциты не различаются по уровню поврежде-
ний ДНК в интервале доз 0.93-5.43 Гр [13].
Влияние гетерогенности радиационного отве-
ки наблюдались достоверные отличия значений
%TDNA от соответствующего контроля. Индиви-
та у отдельных животных по критерию уровня по-
дуальная динамика изменений %TDNA у мышей,
вреждений ДНК в последующих экспериментах
выживших к 28 суткам после облучения, была
было проанализировано при действии облучений
сходная. На рис. 7 показана динамика индивиду-
с разной ЛПЭ: рентгеновскими фотонами с
альных изменений %TDNA лейкоцитов крови на
ЛПЭ = 2 кэВ/мкм и ускоренными ионами угле-
1-23 сутки после облучения ионами углерода.
рода с ЛПЭ = 100 кэВ/мкм. Исходя из кривых на
Различия %TDNA на 16 сутки после облучения
рис. 1 и 2, была выбрана доза 6.5 Гр, при которой
между мышами №№ 1 и 2, 2 и 3, 2 и 4, 3 и 5, а так-
изучали динамику изменений %TDNA как у ин-
же на 23 сутки между мышами 2 и 4, 2 и 5, 3 и 5, 4
дивидуумов, так и в группе, а также анализирова-
и 5 статистически достоверны (р < 0.05).
ли выживаемость мышей примерно в одни и те же
сроки пострадиационного периода. Данные по
ОБСУЖДЕНИЕ
30-суточной выживаемости мышей, которая яв-
ляется базовой биологической характеристикой
Для исследования динамики изменений
объекта и исследуемого излучения, демонстриру-
%TDNA у животных в отдаленные сроки (до ме-
ют значительно большее повреждающее действие
сяца) после радиационного воздействия предва-
ускоренных ионов углерода по сравнению с рент-
рительно были проанализированы зависимости
геновским излучением (рис. 3) - за счет резкой
величин %TDNA лейкоцитов крови мышей от
дозы рентгеновского излучения in vitro и in vivo,
гибели мышей в более ранние сроки после облу-
поскольку нужно было оценить возможности ще-
чения ионами углерода, что согласуется с величи-
лочной версии метода ДНК-комет для регистра-
ной и динамикой уровней повреждений ДНК, ко-
ции повреждений ДНК в этом типе клеток. В
торые характеризуются повышением %TDNA от-
большинстве работ по определению молекуляр-
носительно контроля при рентгеновском
ных повреждений ДНК, выполненных этим ме-
облучении на третьи сутки, а после воздействия
тодом, используются, как правило, культуры кле-
ионов углерода - уже на первые сутки (рис. 4 и 5).
ток, высокие дозы облучения, а при облучении
Динамика изменений значений %TDNA на 3, 6-
животных повреждения регистрируются в корот-
14 и 23-28 сутки в целом похожа при обоих видах
кие сроки после облучения (до 4-6 ч). Лишь в не-
облучения, что, по-видимому, обусловлено про-
большом количестве работ регистрируют биоло-
цессами клеточного обновления в органах и тка-
гические эффекты воздействия тяжелых ионов в
нях, связанных с продукцией клеток крови и фор-
сильно отдаленные сроки - до одного года [11].
мированием иммунитета. Использование метода
Кривая «доза-эффект» облученных рентгенов-
скими фотонами лейкоцитов in vitro имела линей-
ДНК-комет для определения повреждений ДНК
ный характер (рис. 1) и существенно отличалась
в клетках крови представляется важным для
от кривой, полученной при облучении мышей
оценки лучевой реакции разных клеток в отда-
БИОФИЗИКА том 68
№ 1
2023
СРАВНЕНИЕ ДИНАМИКИ ПОВРЕЖДЕНИЙ ДНК ЛЕЙКОЦИТОВ КРОВИ
117
ленные сроки. Лейкоциты мышей представлены
как H2O2. Электростатически нейтральные моле-
в основном лимфоцитами (считающимися наи-
кулы H2O2 легко проникают сквозь мембраны и
более радиочувствительными среди клеток кро-
повреждают клеточные органеллы [5]. Митохон-
ви), и более высокие (по сравнению с рентгенов-
дрии, которые потребляют около 90% кислорода
ским излучением) уровни повреждений ДНК
в организме и генерируют большую часть АФК,
лейкоцитов при воздействии ионов углерода, по-
являются также одной из вероятных клеточных
видимому, отражают в какой-то степени реакцию
мишеней при облучении тяжелым ионами, по-
других активно делящихся и поэтому высокочув-
скольку расположены близко к ядру и занимают
ствительных клеток организма - кишечника и
существенную долю объема клетки. Индуциро-
костного мозга, что может свидетельствовать о
ванная ионами углерода генерация АФК может
разнице в стадиях развивающейся после воздей-
быть также обусловлена дисфункцией митохон-
ствия фотонов и ионов лучевой болезни - желу-
дрий, которая существенно зависит от характери-
дочно-кишечной или костномозговой.
стик генотоксического воздействия [16-18].
Очевидно, что повышенный уровень %TDNA
Следует отметить, что при анализе средних
у 12С-облученных мышей связан с особенностя-
значений %TDNA в группе облученных мышей
ми воздействия ионов углерода, которые индуци-
также регистрировались большие стандартные
руют многочисленные, сложные по структуре,
отклонения, что, по-видимому, связано с разли-
расположенные близко друг к другу повреждения
чиями в уровнях повреждений ДНК лейкоцитов у
ДНК, трудно репарируемые или не репарируемые
индивидуумов. Можно было предположить, что
[5, 14]. Возможно, что репарация таких специфи-
радиочувствительность мышей зависит от спон-
ческих повреждений ДНК не может в достаточ-
танного уровня %TDNA у индивидуумов. Спон-
ной мере реализоваться в наблюдаемые после об-
танный уровень повреждений ДНК в клетках не-
лучения углеродом сроки, что согласуется с дан-
облученных животных отражает физиологиче-
ными литературы о механизмах и путях
ские процессы возникновения и репарации
репарации повреждений при действии ионизиру-
повреждений, поскольку ДНК постоянно под-
ющих излучений с высокими значениями ЛПЭ
вергается окислению и спонтанной тепловой и
[14].
гидролитической деградации в условиях нор-
мального метаболизма организма [19]. Однако в
Сохраняющийся высокий уровень поврежде-
наших экспериментах спонтанные уровни повре-
ний ДНК через 23 суток после облучения ионами
ждений ДНК в лейкоцитах крови мышей не отли-
углерода может быть обусловлен не только сохра-
чались существенной вариабельностью и были
нением нерепарированных и результатом оши-
низкими - менее 10%. Динамика индивидуаль-
бочной репарации сложных кластерных повре-
ных изменений %TDNA у мышей, выживших к
ждений ДНК, но и атаками активных форм кис-
28 суткам после рентгеновского облучения, была
лорода и азота (АФК/А), внутриклеточная
сходная (рис. 6). В отличие от этого, при облуче-
генерация которых продолжается и в пострадиа-
нии ионами углерода наблюдались различия ми-
ционном периоде. Например, в гамма-облучен-
нимальных и максимальных значений %TDNA в
ных фибробластах человека обнаружили дозоза-
одни и те же сроки у разных индивидуумов и до-
висимую продукцию АФК, уровень которых воз-
стоверные отличия %TDNA на 16 и 23 сутки меж-
растал с третьих по седьмые сутки после
ду отдельными индивидуумами (рис. 7). Эти от-
облучения, как в цитоплазме клеток, так и в ми-
личия между индивидуумами могут быть связаны
тохондриях [5]. Ранняя и поздняя генерация ра-
с различиями в репарации сложных повреждений
диационно-индуцированных митохондриальных
ДНК и отличиями метаболизма ДНК, ассоцииро-
АФК/А опосредуют изменения числа копий ми-
ванными с особенностями генома и эпигенетиче-
тохондриальной ДНК, мутации и экспрессию ге-
ской регуляцией: аутбредные мыши SHK, как из-
нов, аутофагию и апоптоз, повреждение ядерной
вестно, отличаются большей генетической гете-
ДНК и нестабильность генома. Примечательно,
рогенностью [20]. Поскольку ускоренные ионы
что сохранение радиационных эффектов, приво-
углерода имеют высокую относительную биоло-
дящих к митохондриальной дисфункции в клет-
гическую эффективность и низкий коэффициент
ках-потомках, имеет серьезные последствия для
кислородного усиления по сравнению с рентге-
жизнедеятельности клеток и организма [15]. Если
новскими лучами, то необходимо дальнейшее
при воздействии фотонами в основном генериру-
ются высокореакционные радикалы, то при облу-
изучение биологических эффектов 12С-облуче-
чении тяжелыми частицами увеличивается выход
ния, связанных с участием АФК в отдаленные
генотоксичных молекулярных продуктов, таких
сроки после облучения в условиях in vivo [21].
БИОФИЗИКА том 68
№ 1
2023
118
КУЗНЕЦОВА и др.
Таким образом, выявлена вариация уровней
СПИСОК ЛИТЕРАТУРЫ
повреждений ДНК лейкоцитов крови как в груп-
1.
O. Mohamad, B. J. Sishc, J. Saha, et al., Cancers, 9, 66
пах животных, так и у индивидуальных мышей в
(2017). DOI: 10.3390/cancers9060066
отдаленные сроки после облучения ионами угле-
рода; при сравнении динамики изменений %TD-
2.
M. Moreno-Villanueva, M. Wong, T. Lu, et al., npj Mi-
crogravity, 3, 14 (2017). DOI: 10.1038/s41526-017-
NA при облучении ионами углерода с таковой
0019-7
при воздействии рентгеновского излучения у ин-
дивидуальных животных обнаружено, что и диа-
3.
I. Vavitsas and K. Kalachani, AIP Conf. Proc., 2075,
пазон значений %TDNA, и их вариабельность
200018 (2019). DOI: 10.1063/1.5099028
наиболее явственно выражены при облучении
4.
S. Muralidharan, S. P. Sasi, M. A. Zuriaga, et al.,
ионами углерода, что свидетельствует о большей
Front. Oncol.,
5,
231
(2015). DOI:
10.3389/
нестабильности генома после воздействия ионов.
fonc.2015.00231
Значение уровня повреждений ДНК в клетках
5.
E. I. Azzam, J. P. Jay-Gerin, and D. Pain, Cancer
крови лабораторных животных в формировании
Lett., 327, 48 (2012). DOI: 10.1016/j.canlet.2011.12.012
отдаленных последствий на организменном
уровне требует дальнейшего иcследования для
6.
A. R. Collins, A. A. Oscoz, G. Brunborg, et al., Muta-
genesis, 23 (3), 143 (2008).
разработки новых и совершенствования традици-
онных тест-систем с использованием моделей
7.
E. A. Kuznetsova, N. P. Sirota, I. Y. Mitroshina, et al.,
животных в свете развития как персонифициро-
Int. J. Radiat. Biol., 96 (10), 1245 (2020). DOI:
ванной биомедицины, так и применения их для
10.1080/09553002.2020.1807640
доклинического исследования источников ядер-
8.
E. A. Kuznetsova., A. R. Dyukina, I. A. Chernigina,
ной медицины.
et al., Bull. Eksperim. Biologii i Meditsiny, 155 (6), 757
(2013). DOI: 10.1007/s10517-013-2245-7
9.
N. K. Chemeris, A. B. Gapeyev, N. P. Sirota, et al.,
БЛАГОДАРНОСТИ
Mutat. Res., 558, 27 (2004).
Авторы выражают глубокую благодарность со-
10.
D. P. Lovell and T. Omori, Mutagenesis, 23 (3), 171
труднику лаборатории ионного лучевого ком-
(2008).
плекса
НИЦ
«Курчатовский институт»
11.
K. Datta, S. Suman, B. V. Kallakury, et al., PLoS One,
В.А. Пикалову за помощь в организации и прове-
7
(8),
e42224
(2012).
DOI:
10.1371/jour-
дении экспериментов на оборудовании радио-
nal.pone.0042224
биологического стенда на углеродном пучке У-70
и сотруднику лаборатории клеточной инженерии
12.
А. И. Газиев, Радиационная биология. Радиоэко-
ИТЭБ РАН С.И. Заичкиной за инициирование
логия, 39 (6), 630 (1999).
данного исследования.
13.
M. H. Lankinen, L. M. Vilpo, and J. A. Vilpo, Mutat.
Res., 352 (1-2), 31 (1996).
14.
J. M. Danforth, L. Provencher, and A. A. Goodarzi,
ФИНАНСИРОВАНИЕ РАБОТЫ
Front. Cell Dev. Biol., 10,
910440
(2022). DOI:
Работа выполнена в рамках Государственного
10.3389/fcell.2022.910440
задания ИТЭБ РАН № 075-00381-21-00.
15.
S. Kobashigawa, K. Suzuki, and S. Yamashita, Bio-
chem. Biophys. Res. Commun., 414, 795 (2011).
16.
K. I. Matsumoto and M. Ueno, Y Shoji et al., Free
КОНФЛИКТ ИНТЕРЕСОВ
Radic. Res.,
55
(4),
450
(2021). DOI:
10.1080/
10715762.2021.1899171
Авторы заявляют об отсутствии конфликта
интересов.
17.
D. Averbeck and C. Rodriguez-Lafrasse, Int. J. Mol.
Sci.,
22
(20),
11047
(2021). DOI:
10.3390/
ijms222011047.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
18.
R. B. Richardson and M. E. Harper, Oncotarget, 7
(16), 21469 (2016). DOI: 10.18632/oncotarget.7412
Все эксперименты на животных проводили в
соответствии с соответствующими национальны-
19.
N. Chatterjee and G. C. Walker, Environ. Mol. Muta-
ми и международными руководящими принци-
gen., 58 (5), 235 (2017). DOI:10.1002/em.22087
пами по уходу и гуманному использованию жи-
вотных. План экспериментов был одобрен Ко-
миссией ИТЭБ РАН по биобезопасности и
21. W. Tinganelli and M. Durante, Cancers (Basel), 12
биоэтике (протокол № 4/2018).
(10), 3022 (2020). DOI: 10.3390/cancers12103022
БИОФИЗИКА том 68
№ 1
2023
СРАВНЕНИЕ ДИНАМИКИ ПОВРЕЖДЕНИЙ ДНК ЛЕЙКОЦИТОВ КРОВИ
119
Comparison of the Dynamics of DNA Damage in Blood Leukocytes and Survival
of Mice after Total Body Irradiation with Bragg Peak Carbon Ions or X-Rays
E.A. Kuznetsova*, O.M. Rozanova*, E.N. Smirnova*, S.I. Glukhov*, T.V. Sirota*,
T.A. Belyakova** and N.P. Sirota *
*Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Physical-Technical Center of Lebedev Physical Institute, Russian Academy of Sciences,
Akademicheskii proezd 2/110, Protvino, Moscow Region, 142281 Russia
This study has determined a survival rate of mice irradiated with accelerated carbon ions (450 MeV/nucleon)
in the Bragg peak or X-ray at a dose of 6.5 Gy, using the comet assay. Levels of DNA damage (%TDNA) in
blood leukocytes from mice were measured 1 day before, 1-23 days after exposure to carbon ions and 1-
28 days after exposure to X-ray radiation at the same dose. According to survival and % TDNA parameters,
it was found that a damaging effect of carbon ions is greater than that of X-rays and substantial variations in
% TDNA, which occur in individual animals, could appear to cause individual differences in the develop-
ment of genome instability in the long term. It is assumed that a higher % TDNA in leukocytes after carbon
ion exposure compared to that of X-rays, a wide range of variations and asynchronous changes in individuals
in the post-irradiation period are associated with the induction of clustered DNA damages and mitochondrial
dysfunction, and are also due to genetic and epigenetic factors. The results obtained point to the need to assess
the state of blood leukocytes in animals with a heterogeneous genetic background using the comet assay be-
fore irradiation in order to form a group with similar %TDNA values. The revealed differences in individual
laboratory animals require further study in order to improve animal models in the light of the development of
personalized biomedicine.
Keywords: comet assay, X-ray irradiation, accelerated carbon ions, DNA damage in leukocytes, individual ani-
mals
БИОФИЗИКА том 68
№ 1
2023