БИОФИЗИКА, 2023, том 68, № 2, с. 218-229
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ИМИТАЦИОННОЕ МОДЕЛИРОВАНИЕ РАБОТЫ
ГЛУТАМАТ-ЦИСТЕИН ЛИГАЗЫ
© 2023 г. В.С. Копылова*, #, С.Е. Бороновский*, Я.Р. Нарциссов*, **
*НИИ цитохимии и молекулярной фармакологии, ул. 6-я Радиальная, 24/14, Москва, 115404, Россия
**Biomedical Research Group, BiDiPharma GmbH, Bültbek, 5, 22962, Siek, Germany
#E-mail: kopilova.veronika@yandex.ru
Поступила в редакцию 27.10.2022 г.
После доработки 22.11.2022 г.
Принята к публикации 07.12.2022 г.
Глутатион (γ-глутамил-цистеинил-глицин) - один из основных внутриклеточных антиоксидантов,
играющих важную роль в клеточном обмене. В клетках млекопитающих глутатион синтезируется в
две стадии, первая из которых катализируется глутамат-цистеин лигазой и является лимитирую-
щей. В данной работе стохастический алгоритм на основе марковских цепей с непрерывным време-
нем был использован для моделирования работы глутамат-цистеин лигазы. Было рассмотрено не-
сколько механизмов работы, учитывающих обратное ингибирование глутатионом, а также порядок
присоединения АТФ. На основании физиологических концентраций участвующих в реакции мета-
болитов была рассчитана скорость работы глутамат-цистеин лигазы эритроцитов человека. Среди
возможных вариантов присоединения субстратов в активный центр исследуемого фермента только
механизм, предусматривающий первичное связывание с АТФ, позволяет получить значение для
скорости реакции, соответствующее экспериментальной измеренной активности глутамат-цисте-
ин лигазы при физиологических уровнях субстратов. В случае других схем присоединения субстра-
тов различие значений скорости составляет более порядка. Проведенный анализ позволяет сделать
вывод о том, что при моделировании биосинтеза глутатиона в условиях in vivo необходимо учиты-
вать как концентрацию молекул АТФ, так и обратное ингибирование глутатионом.
Ключевые слова: глутатион, глутамат-цистеин лигаза, имитационное моделирование, стохастиче-
ский алгоритм.
DOI: 10.31857/S0006302923020023, EDN: BZOQUQ
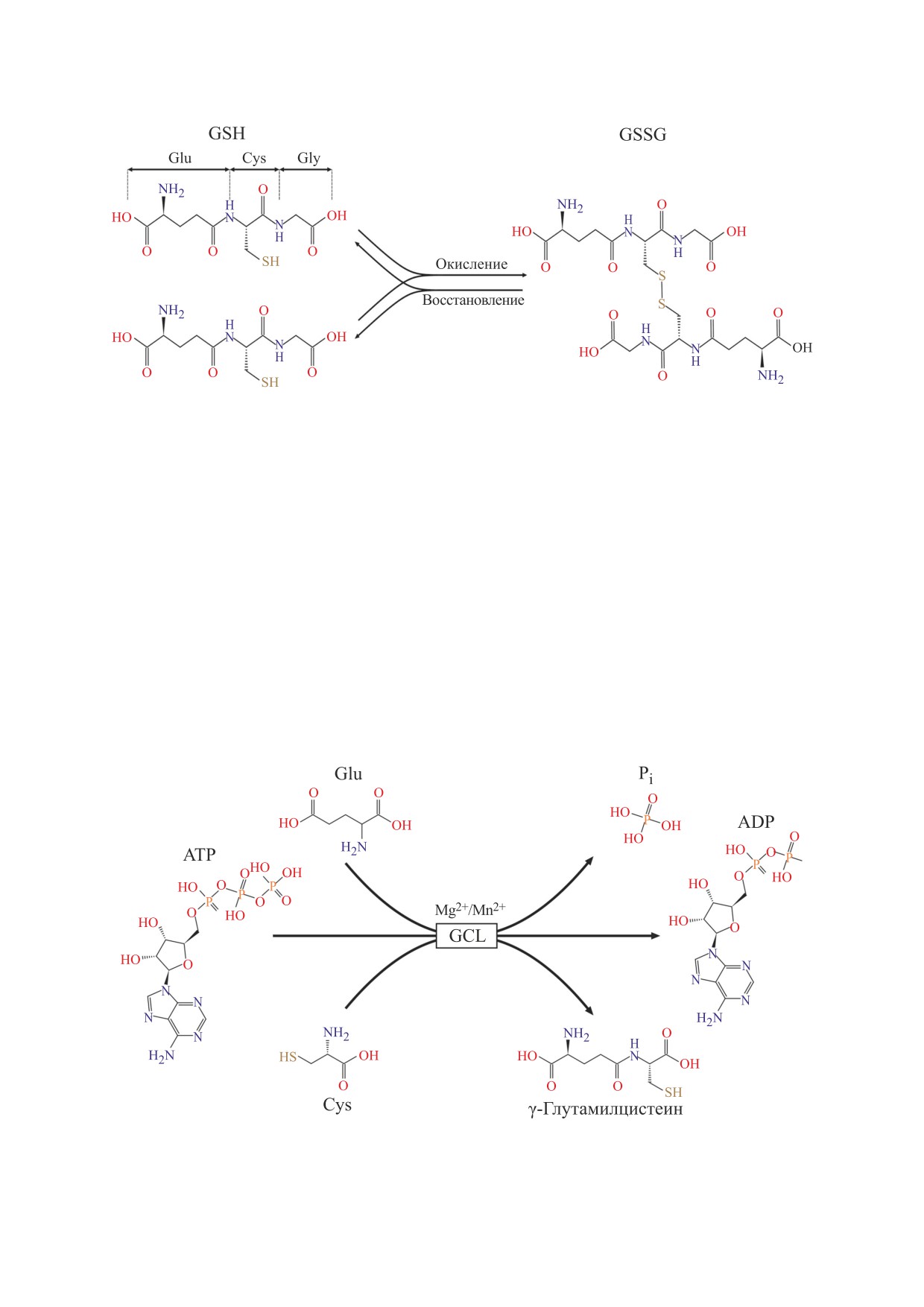
Глутатион представляет собой трипептид, мо-
ной (GSH) и окисленной (GSSG), структуры ко-
лекула которого содержит глутамат, цистеин и
торых приведены на рис.
1.
Почти все
глицин. Это соединение выполняет важную роль
биологические функции глутатиона реализуются
в функционировании клеток, являясь партнером
за счет превращения восстановленной формы в
по реакции детоксикации ксенобиотиков и ко-
окисленную с помощью различных ферментов,
фактором в реакциях изомеризации. Ключевую
таких как глутатион пероксидазы, пероксиредок-
роль глутатион играет как главный компонент ан-
сины, глутаредоксины, глутатион трансферазы и
тиоксидантной системы, которая выступает глав-
другие [6]. Одновременно с этим происходит вос-
ным защитным механизмом при развитии целого
становление глутатиона при участии NADPH-за-
ряда нейродегенеративных заболеваний, сопро-
висимой глутатион редуктазы, основная функция
вождающихся острой и хронической гипоксией
которой заключается в поддержании соотноше-
[1-3]. Кроме того, глутатион представляет собой
ния GSH/GSSG.
форму хранения и транспорта цистеина, необхо-
Основная доля GSH в клетках эукариот нахо-
дим для пролиферации клеток и поддерживает
дится в цитозоле, митохондриальный пул состав-
окислительно-восстановительный потенциал тио-
ляет 9-15%, при этом другие клеточные компарт-
лов, сохраняя сульфгидрильные группы белков в
менты (особенно микросомы) имеют значитель-
восстановленной форме [4]. Возрастные измене-
но более низкое содержание GSH [7]. В целом,
ния, стимуляция иммунных реакций, развитие
уровень глутатиона в клетках млекопитающих
острых и хронических заболеваний ассоциирова-
очень высок и может достигать 12 мМ [4]. При
ны с синтезом глутатиона [5]. Глутатион суще-
этом концентрация GSSG в тканях не превышает
ствует в двух основных формах - восстановлен-
0.5-1.0% от GSH, что объясняется необходимо-
218
ИМИТАЦИОННОЕ МОДЕЛИРОВАНИЕ
219
Рис. 1. Структура восстановленного (GSH) и окисленного (GSSG) глутатиона.
стью поддерживать тиол-дисульфидное равнове-
ными пептидазами и способствует устойчивости
сие в клетке, препятствуя взаимодействию GSSG
глутатиона к внутриклеточной деградации. Глу-
с сульфгидрильными группами белков [5].
тамат-цистеин лигаза представляет собой гетеро-
димер, состоящий из тяжелой (~73 кДа) и легкой
В отличие от белковых пептидов, образуемых
(~27 кДа) субъединиц. Тяжелая субъединица, ак-
путем матричного синтеза, глутатион имеет свой
тивируется во время окислительного стресса и
путь синтеза, который осуществляется в цитозоле
проявляет каталитическую активность фермента,
всех клеток млекопитающих посредством двух
последовательных АТФ-зависимых реакций.
тогда как легкая субъединица играет регулирую-
Первая реакция катализируется глутамат-цисте-
щую роль, модулируя сродство тяжелой субъеди-
ин лигазой (GCL) (EC 6.3.2.2) с участием двуxва-
ницы к субстратам и ингибиторам [8]. Трехмер-
лентныx ионов магния или маpганца (рис. 2).
ная структура GCL была идентифицирована для
На первом этапе синтеза образуется пептидная
некоторых видов бактерий, растений, а также
связь с участием γ-карбоксильной группы глута-
дрожжей, однако, фермент человека до сих пор не
миновой кислоты, эта необычная особенность
был кристаллизован [9]. В связи с этим использо-
защищает дипептид от гидролиза внутриклеточ-
вать точные методы для моделирования активно-
Рис. 2. Первая стадия синтеза глутатиона, катализируемая глутамат-цистеин лигазой.
БИОФИЗИКА том 68
№ 2
2023
220
КОПЫЛОВА и др.
сти белка человека, такие как, например, методы
мат, который затем может использоваться в син-
молекулярной динамики, не представляется воз-
тезе GSH. Гамма-глутамильный цикл является
можным.
сложным метаболическим путем, все функции
которого на текущий момент до конца не уста-
Активность GCL регулируется на нескольких
уровнях, что позволяет ряду стимулов либо инду-
новлены. Изначально предполагалось, что этот
цировать, либо ингибировать активность фер-
цикл служит для переноса нейтральных амино-
мента. Глутатион может регулировать свой
кислот через плазматическую мембрану
[16].
собственный синтез в физиологических концен-
Кроме того, в большинстве клеток он позволяет
трациях путем ингибирования GCL по отрица-
использовать глутатион в качестве источника ци-
тельной обратной связи, что свидетельствует о
стеина [15]. Помимо этого, в нейрональных клет-
быстрой реакции фермента на повышенную по-
ках γ-глутамильный цикл может компенсировать
требность в GSH [10]. Кроме того, активность
снижение возбуждающей нейропередачи, так как
глутамат-цистеин лигазы может регулироваться
глутатион может являться одной из форм хране-
обратимыми ковалентными или нековалентны-
ния глутамата [17].
ми взаимодействиями между тяжелой и легкой
Мутации, приводящие к инактивации глута-
субъединицами. В ответ на окислительный стресс
мат-цистеин лигазы, характеризуются развитием
или другие негативные условия, когда требуется
различных патологических состояний, которые
больше GSH, экспрессия GCL регулируется дву-
сопровождаются гемолитической анемией, нев-
мя редокс-чувствительными сигнальными путя-
ми, состоящими из систем Nrf2-EpRE и AP-1 [11].
рологическими симптомами, миопатией и ами-
ноацидурией. При проведении исследований на
Вторая реакция катализируется глутатион
нокаутных мышах было показано, что отсутствие
синтетазой (EC 6.3.2.3), которая добавляет гли-
легкой субъединицы фермента приводит к суще-
цин к γ-глутамилцистеину и образует GSH. Глу-
ственному снижению уровня глутатиона в клет-
татион синтетаза функционирует как гомодимер,
ках без соматических проявлений, тогда как мы-
где каждая субъединица имеет молекулярную
ши без тяжелой субъединицы погибают на ран-
массу 52 кДа, и принадлежит к суперсемейству
них сроках беременности [18].
глутатионсинтетазных АТФ-связывающих доме-
нов [12]. Эксперименты по сверхэкспрессии GCL
Большое количество экспериментальных ра-
и глутатион синтетазы показали, что лимитирую-
бот посвящено изучению кинетики глутамат-ци-
щей стадией синтеза GSH является первая реак-
стеин лигазы. Кинетический механизм был опи-
ция [13]. Помимо описанных выше стадий био-
сан как упорядоченный [19], с первичным связы-
ванием АТФ и случайным присоединением
синтеза глутатиона существует также механизм
оставшихся субстратов [20] и полностью случай-
его деградации, включающий четыре реакции
ным связыванием субстратов [21]. Первые иссле-
[14]. В совокупности они образуют γ-глутамиль-
дования начальной скорости и ингибирования
ный цикл, который функционирует следующим
указывают на частично случайный механизм ра-
образом: γ-глутамилтрансфераза катализирует
боты белка, при котором сначала присоединяется
перенос γ-глутамилового остатка на нуклеофиль-
АТФ, а затем цистеин либо глутамат связываются
ные акцепторы, в результате чего происходит
в случайном порядке с GCL. В соответствии с
гидролиз или трансглутамилирование. В первом
предполагаемым механизмом АДФ является кон-
варианте вода выступает в качестве акцептора,
курентным ингибитором по отношению к АТФ и
гидролизующего GSH, а во втором - акцептора-
неконкурентным ингибитором по отношению к
ми выступают аминокислоты, дипептиды, а так-
аминокислотным субстратам [20]. При этом при
же другая молекула GSH. Наиболее активным ак-
изучении метаболизма глутатиона с использова-
цептором аминокислот является цистин, но и
нием математических моделей не всегда учитыва-
ется влияние АТФ на скорость работы глутамат-
другие нейтральные аминокислоты, особенно
цистеин лигазы. Так, например, в исследовании
метионин и глутамин, могут выступать в этой ро-
синтеза GSH и фитохелатина в растениях на ос-
ли [15]. На следующем этапе цистеинил-глици-
нове кинетических уравнений для описания ра-
новая часть GSH гидролизуется на составляющие
боты GCL использовался обратимый случайный
его аминокислоты дипептидазой. Затем цистеин
биреактивный механизм Михаэлиса-Ментен с
транспортируется в клетки, где основная его мас-
конкурентным ингибированием GSH по глутама-
са расходуется на синтез глутатиона. В свою оче-
ту [22]. Аналогичная схема была использована и
редь, γ-глутамиламинокислота метаболизируется
при исследовании периода полураспада и регуля-
до 5-оксипролина и свободной аминокислоты с
ции синтеза глутатиона, а также его чувствитель-
помощью γ-глутамилциклотрансферазы. В ко-
ности к колебаниям поступления аминокислот
нечном итоге 5-оксипролин раскрывается 5-ок-
[23]. В более поздней работе изучалась регуляция
сипролиназой, превращая 5-оксипролин в глута-
концентрации глутатиона в эритроцитах с ис-
БИОФИЗИКА том 68
№ 2
2023
ИМИТАЦИОННОЕ МОДЕЛИРОВАНИЕ
221
пользованием математической модели, в которой
Таким образом, вероятность перехода из со-
для GCL рассматривался упорядоченный меха-
стояния i в состояние j за время t с учетом времени
низм работы белка [24]. Кроме того, на основе
перехода τ:
глобальной аппроксимации данных о начальной
q
скорости глутамат-цистеин лигазы растений бы-
ij
, i
≠
j
ло показано, что лучшее совпадение с экспери-
q
P{i
→
j
| t
≥τ}=
ij
ментальными данными было достигнуто при ис-
i≠ j
пользовании механизма «random-ter» [25]. Одна-
0, i = j
ко авторы утверждают, что факторы
взаимодействия указывают на предпочтительный
порядок связывания субстратов с активным цен-
Суть имитационного моделирования таких си-
тром фермента. Необходимо отметить, что дан-
стем заключается в поиске путей реакции с по-
ные об образовании различных промежуточных
следующей количественной оценкой необходи-
продуктов реакции не подтверждают механизм
мых биологических характеристик. В целом зада-
«пинг-понг» для моделирования активности GCL
чу по поиску путей протекания процесса с
различных организмов [26].
использованием данного метода исследования
можно разделить на несколько основных этапов.
Для разрешения неопределенности в выборе
возможного механизма работы фермента в работе
В первую очередь необходимо выбрать начальное
применяются комбинированные методы матема-
состояние системы. На следующем шаге рассчи-
тического моделирования. Среди неизученных
тывается время перехода в текущее состояние пу-
тем генерации непрерывной случайной величи-
вопросов особо необходимо отметить регуляцию
активности GCL глутатионом и АТФ, а также сам
ны, распределенной экспоненциально. Затем
механизм присоединения АТФ к белковым ком-
определяется следующее состояние системы с
плексам при уровне субстратов близким к состо-
учетом выбранного времени перехода с использо-
янию in vivo.
ванием относительных интенсивностей перехо-
дов. Таким образом, полученное состояние ста-
новится новым начальным и далее используется
МАТЕРИАЛЫ И МЕТОДЫ
для генерации дальнейшего перехода к следую-
Для моделирования активности глутамат-ци-
щему состоянию. Далее процесс моделирования
стеин лигазы используется компьютерный алго-
продолжается до достижения конечного состоя-
ритм, основанный на стохастическом подходе, в
ния системы, в котором фермент находится в сво-
котором каталитический цикл фермента пред-
бодной форме. Рассмотренный в работе алгоритм
ставлен как набор последовательных переходов
применялся для моделирования работы изолиро-
между отдельными состояниями с различным ко-
ванного белка на примере цитохромоксидазы ми-
личеством метаболитов. В данной работе схема
тохондрий [27]. В целом, методический подход по
переходов между дискретными состояниями реа-
оценке активности единичного белка на основе
лизуется на основе марковских цепей с непре-
различных стохастических комбинированных
рывным временем. Предполагается, что вероят-
механизмов использовался также для оценки ак-
ность перехода из состояния i в состояние j
тивности FoF1-АТФ-синтазы [28], глутаминсин-
P{i → j|Δt} прямо пропорциональна рассматривае-
тетазы [29] и глутаматного переносчика в нейро-
мому отрезку времени Δt:
нах [30].
В связи с тем, что на сегодняшний день точ-
P{i
→
j
| Δt} =
q
⋅Δ +o(Δt)
ij
ный механизм работы глутамат-цистеин лигазы
P{i
→
i |
Δt}=1−
q
⋅Δ +o(Δt)
неизвестен, и существуют разные подходы к мо-
ij
делированию активности этого фермента, в дан-
i≠ j
,
ной работе рассматривается несколько схем рабо-
где qij - интенсивность перехода, характеризую-
ты GCL, учитывающих обратное ингибирование
щая скорость соответствующего процесса, а
глутатионом, а также порядок присоединения
P{i → j|Δt} - вероятность остаться системе в состо-
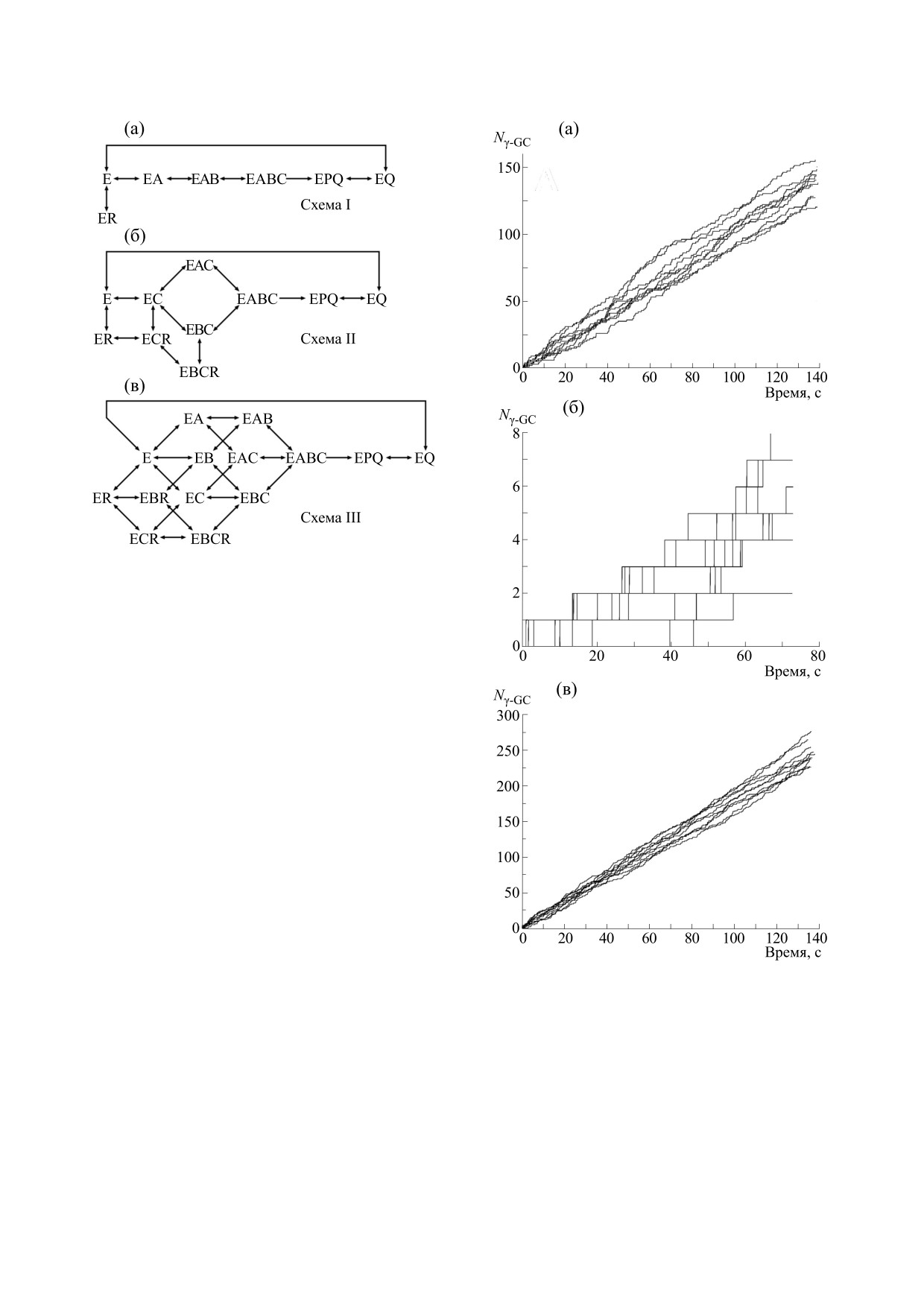
АТФ. На риc. 3а представлена схема I, в которой
янии j.
последовательно присоединяется каждый из суб-
Имитационное моделирование работы белка
стратов, а затем в обратном порядке происходит
осуществляется путем генерации непрерывных и
диссоциация продукта. При этом ингибирование
дискретных случайных величин, зная законы пе-
глутатионом происходит конкурентно с пустой
рехода между различными состояниями и коли-
формой белка. Схема II представляет собой рас-
чественные параметры. В качестве основного па-
ширение относительно конкурентного связыва-
раметра в данной модели выступает матрица интен-
ния GSH известной концепции [31], предполага-
сивностей, на основе которой определяется
ющей, в первую очередь, присоединение АТФ, а
направление перехода по цепи, а также рассчитыва-
затем случайное связывание с остальными суб-
ется время пребывания в конкретном состоянии.
стратами (рис. 3б). Кроме того, интересным для
БИОФИЗИКА том 68
№ 2
2023
222
КОПЫЛОВА и др.
Рис. 3. Схемы работы глутамат-цистеин лигазы c кон-
курентным по глутамату ингибированием глутатио-
ном: (а) - последовательное присоединение каждого
из субстратов; (б) - первичное присоединение АТФ с
последующим случайным присоединением оставших-
ся субстратов; (в) - полностью случайный порядок
связывания субстратов. E - GCL в активной форме,
A - глутамат, B - цистеин, С - АТФ, P - ADP, Q -
γ-глутамилцистеин, R - глутатион.
рассмотрения представляется механизм, который
предусматривает полностью случайный порядок
связывания субстратов c конкурентным по глута-
мату ингибированием глутатионом (схема III,
рис. 3в). Моделирование работы белка на основе
приведенных схем с использованием методов ки-
нетики позволяет описать ансамбль белков, одна-
ко, единичный белок работает стохастически, в
отличие от работы в ансамбле. Следовательно,
для оценки активности единичного фермента
предпочтительнее использовать описанный вы-
ше имитационный подход.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Используемый в данной работе подход позво-
Рис.
4. Зависимость произведенного единичным
ляет воспроизвести процесс протекания реакции,
белком γ глутамилцистеина от времени для трех схем
катализируемой GCL. Результатом единичного
работы: (а) - схема I; (б) - схема II; (в) - схема III.
компьютерного эксперимента является зависи-
мость потоков всех метаболитов от времени в
цистеин лигазы (рис. 4). Для каждого варианта
единичной точке пространства концентраций.
моделирования активности фермента было про-
Чтобы оценить количество полученного в ходе
реакции продукта, были построены зависимости
ведено 10 экспериментов, каждый из которых со-
произведенного γ-глутамилцистеина от времени
стоял из 2·107 шагов. Как видно из приведенных
для трех описанных выше схем работы глутамат-
графиков, в случае первичного связывания с АТФ
БИОФИЗИКА том 68
№ 2
2023
ИМИТАЦИОННОЕ МОДЕЛИРОВАНИЕ
223
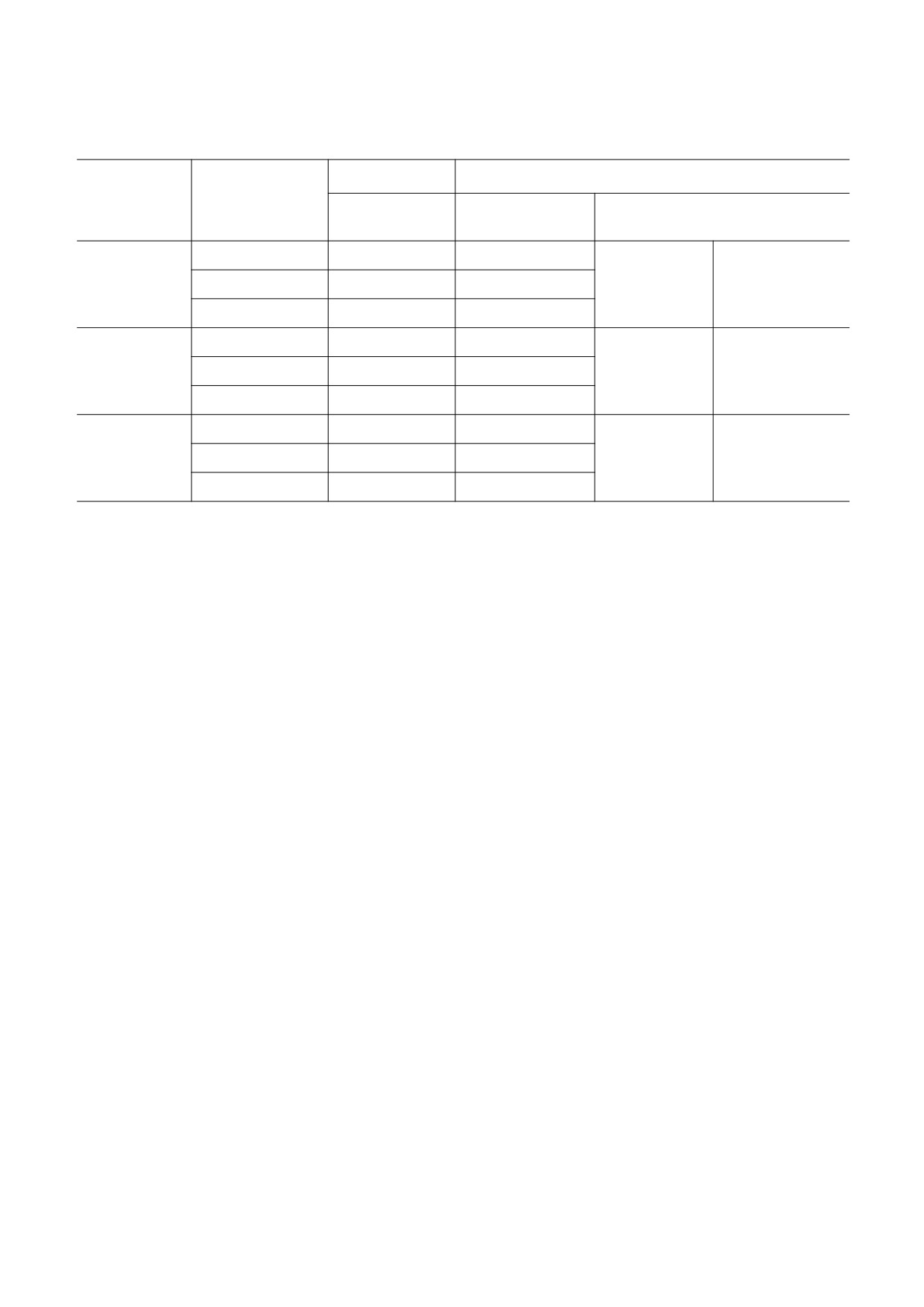
Таблица 1. Сравнение кинетических параметров GCL, полученных для трех рассматриваемых механизмов
работы, с литературными данными
Km, мМ
kcat, c-1
Субстрат
Схема
Результаты
Результаты
Экспериментальные данные
моделирования
моделирования
I
129.9
2.0
L-глутамат
II
1
25.7
2.0
1.9-2.4
[8, 31]
III
134.1
2.1
I
127.2
0.30
L-цистеин
II
123.6
0.33
0.1-0.5
[31, 33]
III
131.2
0.28
I
128.2
0.38
АТФ
II
130.6
0.86
0.35-0.88
[31, 34, 35]
III
132.0
0.41
поток γ-глутамилцистеина является наимень-
лученные значения основных кинетических па-
шим, а максимальная эффективность достигает-
раметров хорошо согласуются с эксперименталь-
ся при полностью случайном порядке присоеди-
ными данными для каждой из рассматриваемых
нения субстратов. Кроме того, схема II характе-
схем работы белка (табл. 1). При этом значение
ризуется наиболее стохастическим протеканием
константы Km для цистеина, учитывая клеточную
реакции, при котором количество произведенно-
концентрацию этой аминокислоты в условиях
го γ-глутамилцистеина существенно отличается
in vivo, свидетельствует о том, что именно кон-
от эксперимента к эксперименту, тогда как для
центрация цистеина является лимитирующим
схемы III количество продукта практически не
фактором работы глутамат-цистеин лигазы. Дан-
изменяется в серии экспериментов. Такой харак-
ный вывод подтверждается экспериментальными
тер работы белка связан с высокой чувствитель-
исследованиями, в которых показано, что регуля-
ностью к концентрации АТФ и GSH, которые в
ция синтеза глутатиона в целом осуществляется
данной схеме являются лимитирующими факто-
на первом этапе за счет нехватки цистеина. Кро-
рами, в особенности в условиях in vivo. Большая
ме того, молекул АТФ также может быть недоста-
часть времени модельного эксперимента прихо-
точно для высокой скорости протекания реак-
дится на переходы между состояниями E, E-АТФ
ции, исходя из рассчитанных значений Km, при-
и E-GSH, что приводит как к существенному раз-
чем наиболее существенно это сказывается для
личию между отдельными модельными экспери-
механизма работы GCL с первичным связывани-
ментами, так и к кратному падению средней ско-
ем с АТФ. Наряду с этим модельное значение kcat
рости синтеза γ-глутамилцистеина. Для схемы с
согласуется с результатами исследования глута-
последовательным присоединением субстратов
мат-цистеин лигазы эритроцитов человека [24].
(рис. 4а) характерно относительно случайное
Как было описано ранее, GCL ингибируется
протекание процесса, а количество произведен-
ного γ-глутамилцистеина близко с аналогичной
глутатионом по типу обратной связи, что указы-
характеристикой для схемы III.
вает на необходимость учитывать влияние данно-
го метаболита при моделировании активности
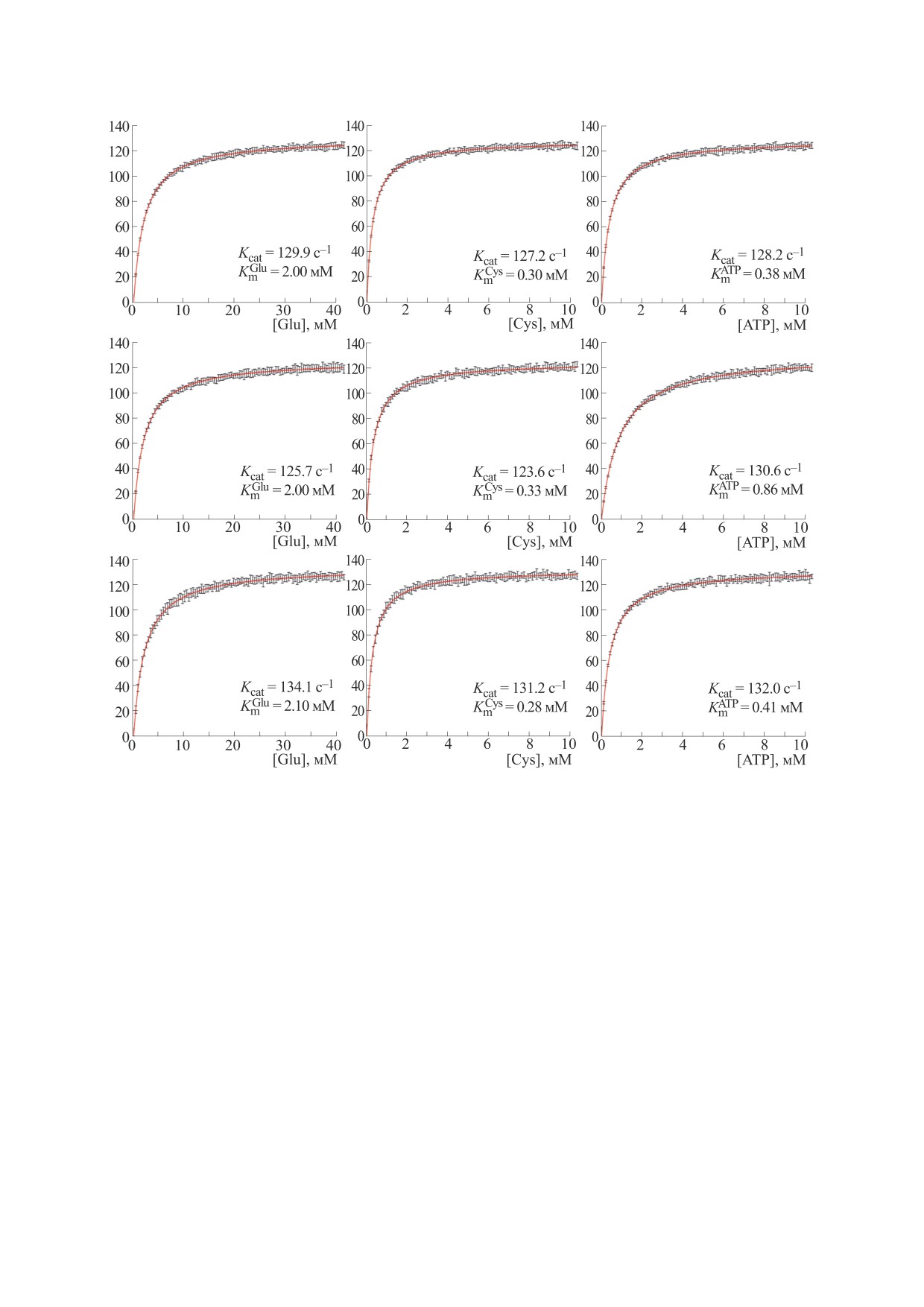
Стохастический алгоритм также применяли
глутамат-цистеин лигазы. Оценка ингибирова-
для оценки скорости работы фермента при раз-
ния GCL глутатионом проводилась путем расчета
личных концентрациях одного из субстратов, при
скорости реакции с увеличением концентрации
этом значения концентраций двух других суб-
глутамата для каждой фиксированной концен-
стратов фиксировались на уровне насыщения,
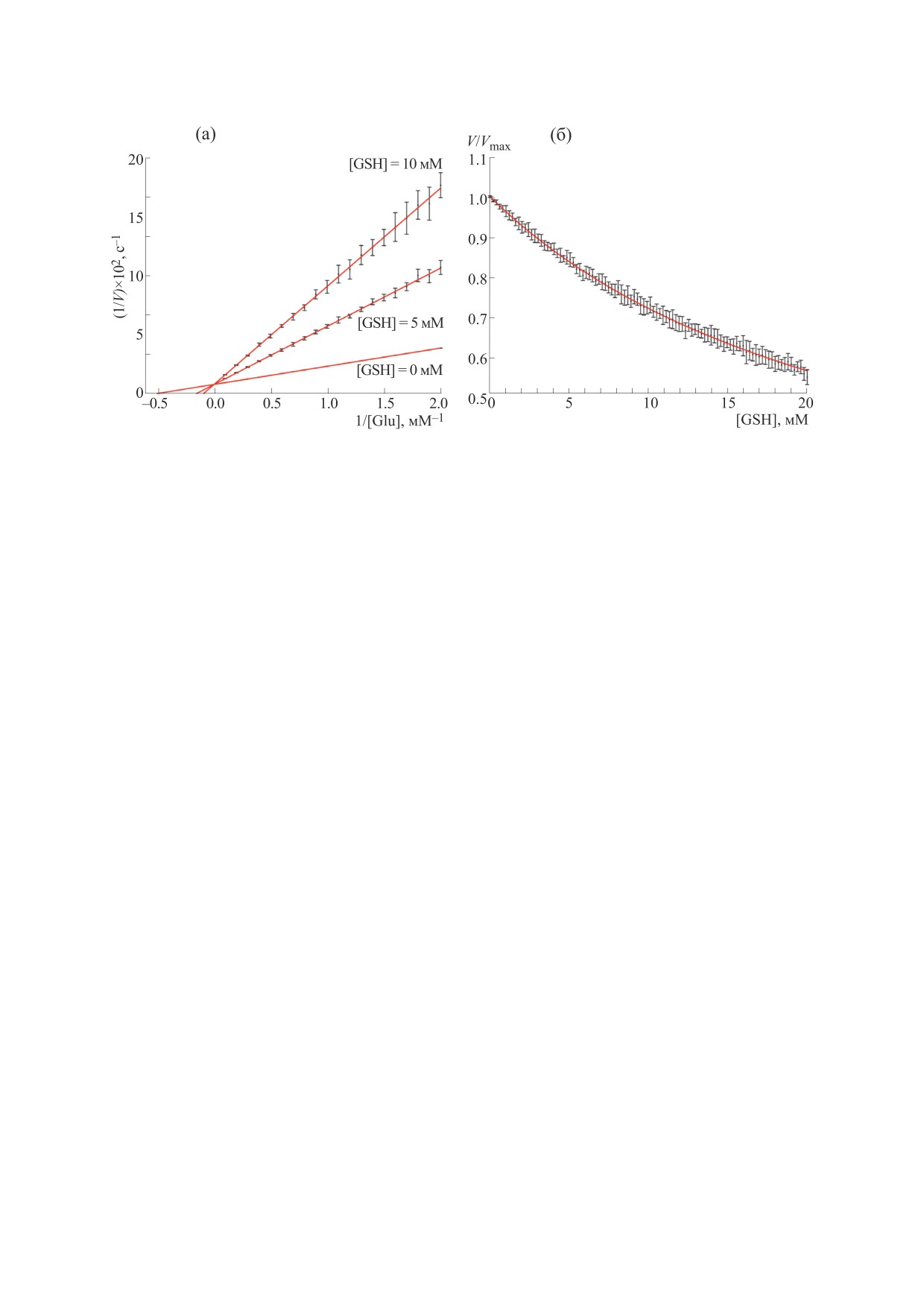
трации GSH. На рис. 6а приведена зависимость
который используется при экспериментальном
обратной скорости от обратной концентрации
изучении кинетики GCL [32]. Для каждой точки в
глутамата при различных концентрациях GSH,
пространстве концентраций было рассчитано
лежащих в пределах физиологического диапазо-
среднее значение скорости и стандартное откло-
на. Эффект ингибирования активности фермента
нение по серии из 20 экспериментов (рис. 5). По-
показан только для схемы с последовательным
БИОФИЗИКА том 68
№ 2
2023
224
КОПЫЛОВА и др.
Рис. 5. Скорость работы единичного белка в зависимости от концентрации одного из субстратов для каждой из трех схем
работы фермента: верхний ряд - схема I; средний ряд - схема II; нижний ряд - схема III. Результаты представлены в
виде M ± SD для 20 независимо проведенных компьютерных экспериментов.
присоединением субстратов, так как для двух дру-
активности на 30%. Следует отметить, что такие
гих механизмов двойная обратная зависимость
значения концентраций глутатиона наблюдаются
выглядит аналогичным образом. Полученные
в клетках в условиях in vivo. Представленная зави-
значения константы ингибирования (Ki = 2.27-
симость полностью совпадает с аналогичной кри-
2.32) согласуются с экспериментальными данны-
вой, полученной при экспериментальном иссле-
ми для каждой из рассматриваемых схем работы
довании кинетики ингибирования глутатионом
глутамат-цистеин лигазы человека [33].
GCL [36]. Также была построена зависимость от-
носительной активности фермента от концентра-
Наиболее интересным представляется изуче-
ции глутатиона (рис. 6б). Относительная актив-
ние активности фермента при концентрациях
ность представляет собой отношение активности
субстратов и регуляторов, соответствующих из-
GCL в присутствии различных концентраций
меренному in vivo. В данном исследовании с этой
GSH к аналогичной активности в отсутствии дан-
целью проводили моделирование работы глута-
ного ингибитора. Эффективность работы глута-
мат-цистеин лигазы эритроцитов человека. Кон-
мат-цистеин лигазы уменьшается на 10% при
центрации метаболитов, участвующих в реакции,
концентрации GSH, равной 1 мМ, при этом до-
были зафиксированы на физиологическом уров-
бавление 10 мМ глутатиона вызывает снижение
не в соответствии с экспериментальными данны-
БИОФИЗИКА том 68
№ 2
2023
ИМИТАЦИОННОЕ МОДЕЛИРОВАНИЕ
225
Рис. 6. Ингибирование единичного белка глутатионом. (а) - двойная обратная зависимость скорости реакции от
концентрации глутамата в присутствии 0, 5 и 10 мМ GSH; (б) - зависимость относительной активности от концентрации
глутатиона. Результаты представлены в виде M ± SD для 20 независимо проведенных компьютерных экспериментов.
ми. Так, концентрацию цистеина принимали
раз, тогда как при полностью случайном порядке
равной 5 мкМ [37], а концентрацию глутатиона -
связывания субстратов (схема III) различие зна-
1.4 мМ [38]. Поскольку гликолиз достаточно ста-
чений составляет более порядка. Таким образом,
бильно поддерживает концентрации АТФ и АДФ
можно сделать вывод, что наиболее точно меха-
в эритроцитах на одном уровне, концентрации
низм работы фермента в условиях in vivo воспро-
этих двух метаболитов также поддерживались по-
изводится с использованием схемы II. Более того,
стоянными и равнялись 0.65 мМ и 0.085 мМ соот-
моделирование биосинтеза глутатиона в предпо-
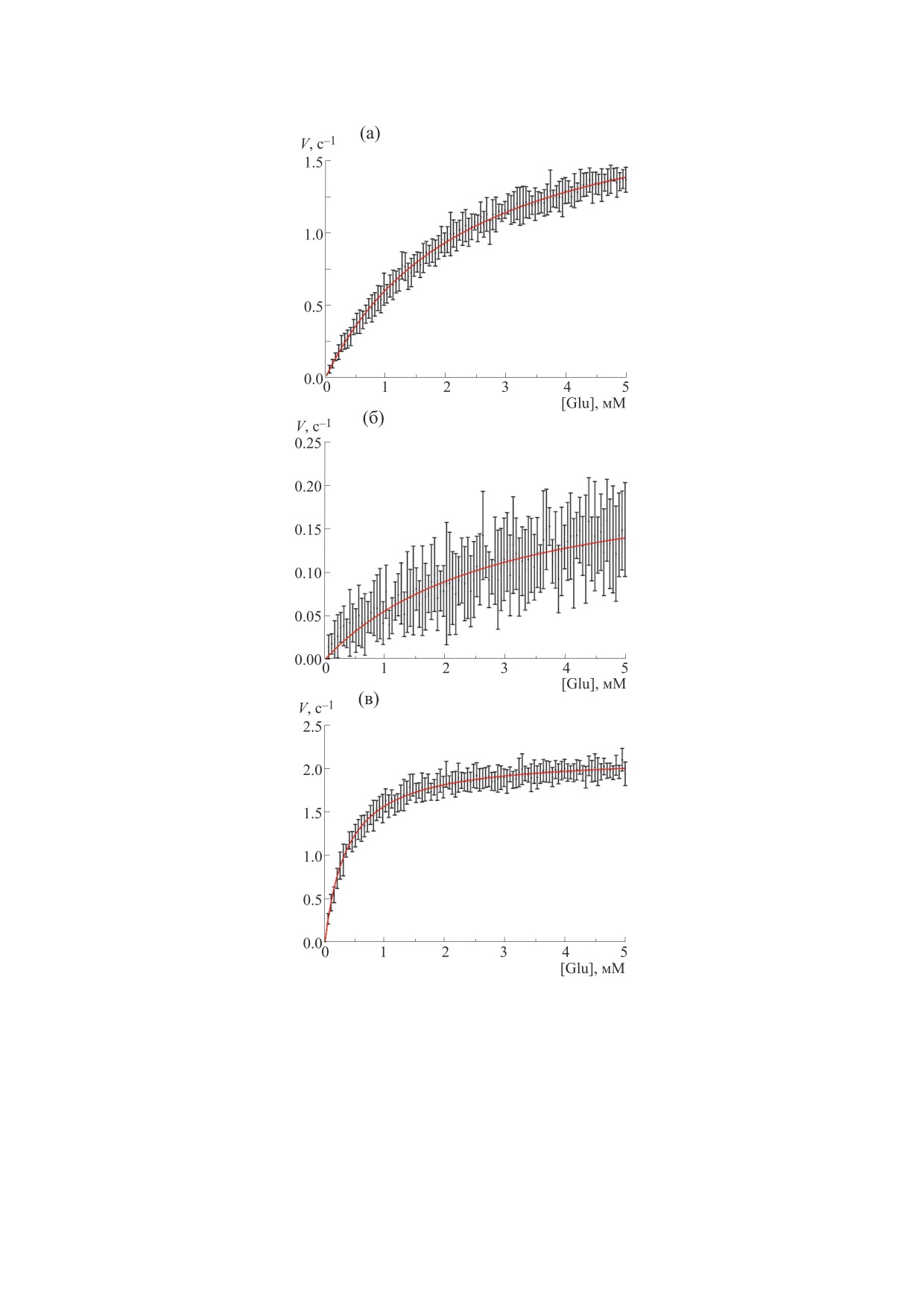
ветственно [39]. На рис. 7 представлена зависи-
ложении, что происходит насыщение АТФ, не от-
мость скорости работы GCL от концентрации
вечает физиологическим условиям, поскольку
глутамата для трех рассматриваемых схем. Как
значения Km по АТФ для схемы II (табл. 1) лежат
видно из приведенных результатов, скорости ра-
выше соответствующих эритроцитарных концен-
боты фермента существенно отличаются для каж-
траций. В условиях стресса, влияющих на биохи-
дого из механизмов. Так, с максимальной скоро-
мические пути выработки АТФ, данное предпо-
стью работает белок в случае полностью случай-
ложение может оказаться еще менее достовер-
ного порядка присоединения субстратов
ным. Так, например, на модели дрожжей было
(рис. 7в), при этом при последовательном связы-
показано, что снижение концентрации АТФ ни-
вании субстратов скорость GCL существенно
же 2 мМ приводит к резкому снижению уровню
снижается (рис. 7а). С учетом физиологической
глутатиона, аналогичная реакция на изменение
концентрации глутамата в эритроцитах человека,
АТФ ожидается и от растительной системы [22].
равной 0.4 мМ [40], была рассчитана скорость ра-
Поскольку экспериментальные измерения
боты глутамат-цистеин лигазы в условиях in vivo.
концентрации γ-глутамилцистеина в эритроци-
Необходимо отметить, что несмотря на то,
тах человека не проводились, концентрация дан-
ного метаболита в системе принималась равной
что значения Km, рассчитанные при концентра-
нулю. Однако если предположить, что концен-
циях субстратов, соответствующих уровню насы-
трация γ-глутамилцистеина сопоставима с изме-
щения, для всех трех моделей входят в диапазон
ренной в растительных клетках (0.04 мМ [42]), то
экспериментальных значений Km (табл.
1),
скорость работы GCL в случае присоединения
только для механизма, предусматривающего пер-
АТФ в качестве первого субстрата снизится в пол-
вичное связывание с АТФ, величина скорости
тора раза: V = (0.031 ± 0.018) c-1. Данная величина
(V = (0.049 ± 0.027) c-1) согласуется с экспери-
также соответствует физиологическому диапазо-
ментально измеренной в эритроцитах человека
ну скорости работы эритроцитарной GCL чело-
скоростью работы GCL [41]. Так, для схемы с по-
века.
следовательным присоединением субстратов
(схема I) скорость работы фермента превосходит
Следует подчеркнуть, что экспериментально
экспериментальное значение более, чем в пять измеренные концентрации глутатиона в эритро-
БИОФИЗИКА том 68
№ 2
2023
226
КОПЫЛОВА и др.
Рис. 7. Скорость работы единичного белка при концентрациях субстратов и регуляторов, соответствующих измеренному
in vivo, в зависимости от концентрации глутамата для каждой из трех схем работы фермента: (а) - схема I; (б) - схема II;
(в) - схема III. Результаты представлены в виде M ± SD для 20 независимо проведенных компьютерных экспериментов.
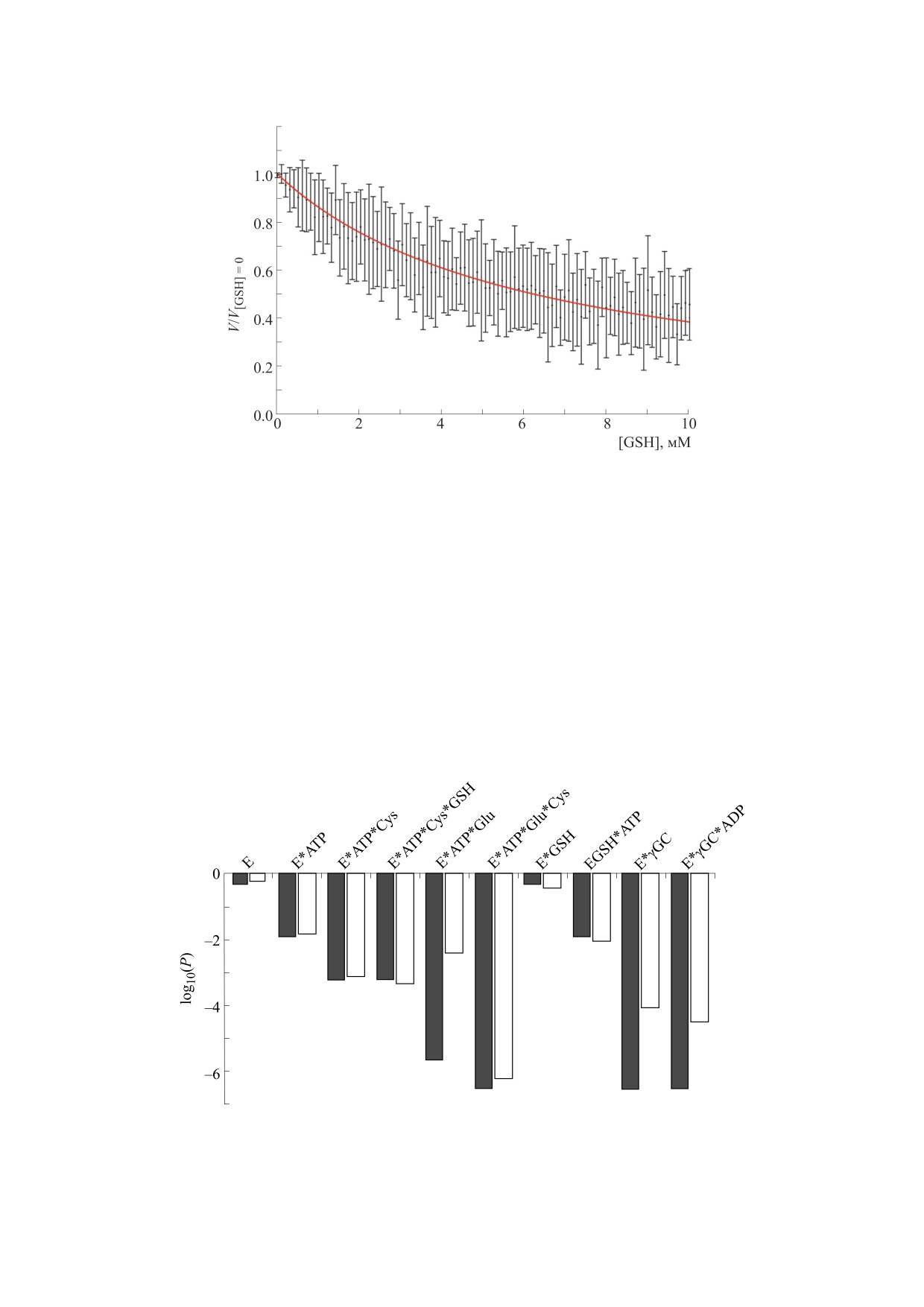
цитах человека лежат в широком диапазоне от
лигазы (рис. 8). Так, изменение концентрации
1.2 мМ до 8.8 мМ [41, 43]. Увеличение уровня
глутатиона в указанном диапазоне приводит к
GSH в клетках крови человека может существен-
уменьшению относительной активности фермен-
но снижать скорость работы глутамат-цистеин
та до 0.41. Таким образом, одним из механизмов
БИОФИЗИКА том 68
№ 2
2023
ИМИТАЦИОННОЕ МОДЕЛИРОВАНИЕ
227
Рис.
8. Относительная скорость работы единичного белка при концентрациях субстратов и регуляторов,
соответствующих измеренному in vivo, в зависимости от концентрации глутатиона для схемы II. Результаты
представлены в виде M ± SD для 20 независимо проведенных компьютерных экспериментов.
поддержания необходимой концентрации GSH
роцитов человека уровне, концентрация GSH, в
является регуляция активности глутамат-цистеин
частности, принималась равной 1.4 мМ. В соот-
лигазы. Следовательно, при моделировании син-
ветствии с проведенным анализом, белок чаще
теза глутатиона в условиях in vivo необходимо
всего находится в свободном состоянии (E), либо
учитывать обратное ингибирование GCL.
связан с глутатионом (E-GSH). По-видимому,
Кроме того, оценивали распределение частот
это объясняется достаточно низкими концентра-
состояний, в которых находилась система в тече-
циями аминокислотных метаболитов и высоким
ние модельного эксперимента (рис. 9). Концен-
уровнем глутатиона в клетках крови человека.
трации всех метаболитов в данном исследовании
Также высока вероятность нахождения фермента
были установлены на физиологическом для эрит-
связанным с АТФ, причем как в свободном со-
Рис. 9. Частота (темные столбики) и взвешенная по времени частота (светлые столбики) нахождения единичного белка
в определенном состоянии при концентрациях субстратов и регуляторов, соответствующих измеренным in vivo.
БИОФИЗИКА том 68
№ 2
2023
228
КОПЫЛОВА и др.
стоянии (E-АТФ), так и в комплексе с глутатио-
СПИСОК ЛИТЕРАТУРЫ
ном (E-GSH-АТФ). Интересно, что реже всего
1.
A. A. Korneev, I. A. Komissarova, and Y. R. Nartsissov,
встречается состояние, в котором GCL связан со
Bull. Exp. Biol. Med., 116, 1089 (1993).
всеми субстратами (E-АТФ-Glu-Cys), при этом,
2.
В. И. Скворцова, Я. Р. Нарциссов, М. К. Бодыхов
исходя из взвешенной по времени гистограммы,
и др., Журн. неврологии и психиатрии им.
данная стадия является достаточно быстрой. Об-
С.С. Корсакова, 107, 30 (2007).
ратная ситуация наблюдается для фермента, свя-
3.
Y. R. Nartsissov, Biochem. Soc. Trans., 45 (5), 1097
занного с АТФ и глутаматом (E-АТФ-Glu), что,
(2017).
скорее всего, обусловлено конкуренцией глута-
4.
R. Dringen, Progr. Neurobiol.. 62 (6), 649 (2000).
тиона и глутамата за сайт связывания с GCL.
5.
Л. П. Смирнов и И. В. Суховская, Учен. зап. Пет-
розавод. гос. ун-та, 6 (143), 34 (2014).
ЗАКЛЮЧЕНИЕ
6.
M. Deponte, Antioxid. Redox Signal., 27 (15), 1130
(2017).
Моделирование активности фермента с ис-
пользованием стохастических алгоритмов может
7.
V. I. Kulinskii and L. S. Kolesnichenko, Biomed. Kh-
быть полезно для оценки существующих теорий и
im., 55 (3), 255 (2009).
экспериментальных данных, так как такой под-
8.
K. Chik, F. Flourie, K. Arab, et al., J. Chromatogr. B:
ход позволяет воспроизвести работу единичного
Analyt. Technol. Biomed. Life Sci., 827 (1), 32 (2005).
белка, основываясь на известных физиологиче-
9.
Y. Yang, E. D. Lenherr, R. Gromes, et al., Biochem. J.,
ских параметрах. Изучение работы единичного
476 (7), 1191 (2019).
белка является первым шагом на пути моделиро-
10.
R. Njalsson, Cell Mol. Life Sci., 62 (17), 1938 (2005).
вания метаболического пути, в частности, γ-глу-
11.
H. Zhang and H. J. Forman, Semin. Cell Dev. Biol., 23
тамильного цикла, что объясняется необходимо-
(7), 722 (2012).
стью корректного математического представле-
12.
A. Dinescu, M. E. Anderson, and T. R. Cundari, Bio-
ния активности всех участвующих в нем
chem. Biophys. Res. Commun., 353 (2), 450 (2007).
ферментов. В данной работе с помощью описан-
13.
M. Grant, F. H. MacIver, and I. W. Dawes, Mol. Biol.
ного. подхода было показано, что при моделиро-
Cell., 8 (9), 1699 (1997).
вании биосинтеза глутатиона в условиях in vivo
14.
K. Bachhawat and S. Yadav, IUBMB Life, 70 (7), 585
необходимо учитывать влияние концентрации
(2018).
АТФ на эффективность работы глутамат-цистеин
лигазы, которая катализирует лимитирующую
15.
V. I. Kulinskii and L. S. Kolesnichenko, Biomed.
стадию синтеза GSH. Сравнение рассчитанной
Khim., 55 (4), 365 (2009).
скорости работы глутамат-цистеин лигазы в усло-
16.
A. Meister and M. E. Anderson, Annu. Rev. Biochem.,
виях in vivo с экспериментальными значениями
52, 711 (1983).
позволяет сделать вывод о том, что первичной
17.
T. W. Sedlak, B. D. Paul, G. M. Parker, et al., Proc.
стадией синтеза γ-глутамилцистеина является
Natl. Acad. Sci. USA, 116 (7), 2701 (2019).
связывание GCL с молекулой АТФ. Также суще-
18.
О. А. Борисенок, М. И. Бушма, О. Н. Басалай и др.,
ственное влияние на скорость работы данного
Мед. новости, 7 (298), 3 (2019).
фермента оказывает обратное ингибирование
19.
G. E. van Buskirk, J. E. Gander, and W. B. Rathbun,
глутатионом, концентрация которого в клетках
Eur. J. Biochem., 85 (2), 589 (1978).
человека может сильно варьироваться. Необхо-
20. B. Yip and F. B. Rudolph, J. Biol. Chem., 251 (12),
димо подчеркнуть, что в состоянии оксидативно-
3563 (1976).
го стресса, сопровождаемого изменениями кле-
21. D. L. Brekken and M. A. Phillips, J. Biol. Chem., 273
точных концентраций глутатиона, ингибирова-
(41), 26317 (1998).
ние будет оказывать еще большее влияние на
22. G. Mendoza-Cozatl and R. Moreno-Sanchez, J. The-
эффективность синтеза GSH. Данный механизм
or. Biol., 238 (4), 919 (2006).
является одним из способов поддержания необ-
ходимой клеточной концентрации глутатиона.
23. M. C. Reed, R. L. Thomas, J. Pavisic, et al., Theor. Bi-
ol. Med. Model., 5, 8 (2008).
24. J. E. Raftos, S. Whillier, and P. W. Kuchel, J. Biol.
КОНФЛИКТ ИНТЕРЕСОВ
Chem., 285 (31), 23557 (2010).
Авторы заявляют об отсутствии конфликта
25. J. M. Jez, R. E. Cahoon, and S. Chen, J. Biol. Chem.,
интересов.
279 (32), 33463 (2004).
26. M. Orlowski and A. Meister, Biochemistry, 10 (3), 372
(1971).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
27. V. Y. Titova, S. E. Boronovskiy, J. P. Mazat, et al., J.
Настоящая статья не содержит каких-либо ис-
Physics: Conf. Series, 1141, 012029 (2018).
следований с участием людей или животных в ка-
28. E. Mashkovtseva, S. Boronovsky, and Y. Nartsissov,
честве объектов исследований.
Math. Biosci., 243 (1), 117 (2013).
БИОФИЗИКА том 68
№ 2
2023
ИМИТАЦИОННОЕ МОДЕЛИРОВАНИЕ
229
29. N. V. Kazmiruk, S. E. Boronovskiy, and Y. R. Nartsiss-
37. K. Kiessling, N. Roberts, J. S. Gibson, et al., Hematol.
ov, Biophysics, 63 (3), 318 (2018).
J., 1 (4), 243 (2000).
30. O. A. Zagubnaya, S. Boronovskiy, and Y. R. Nartsissov,
38. D. Darmaun, S. D. Smith, S. Sweeten, et al., Diabetes,
J. Physics: Conf. Series, 1141, (2018).
54 (1), 190 (2005).
31. O. W. Griffith and R. T. Mulcahy, Adv. Enzymol.
39. E. Skotnicka, I. Baranowska-Bosiacka, W. Dudzinska,
Relat. Areas Mol. Biol., 73, 209 (1999).
et al., Biology of Sport, 25 (1), 35 (2008).
32. R. Quintana-Cabrera, S. Fernandez-Fernandez,
V. Bobo-Jimenez, et al., Nat. Commun., 3, 718 (2012).
40. J. C. Divino Filho, S. J. Hazel, P. Furst, et al., J. Endo-
33. Z. Tu and M. W. Anders, Arch. Biochem. Biophys., 354
crinol., 156 (3), 519 (1998).
(2), 247 (1998).
41. Y. Xiong, Y. Xiong, Y. Wang, et al., Cell Physiol. Bio-
34. M. N. Willis, Y. Liu, E. I. Biterova, et al., Biochemistry,
chem., 51 (5), 2172 (2018).
50 (29), 6508 (2011).
42. G. Noctor, A.-C. M. Arisi, L. Jouanin, et al., Physiol.
35. Y. Chen, H. G. Shertzer, S. N. Schneider, et al., J. Biol.
Plantarum, 100 (2), 255 (1997).
Chem., 280 (40), 33766 (2005).
36. O. W. Griffith, Free Radic. Biol. Med., 27 (9-10), 922
43. A. Kuster, I. Tea, S. Sweeten, et al., Anal. Bioanal.
(1999).
Chem., 390 (5), 1403 (2008).
Simulation Modeling of Glutamate Cysteine Ligase Activity
V.S. Kopylova*, S.E. Boronovskiy*, and Ya.R. Nartsissov*, **
*Institute of Cytochemistry and Molecular Pharmacology, ul. 6-ya Radialnaya 24/14, Moscow, 115404 Russia
**Biomedical Research Group, BiDiPharma GmbH, Bültbek, 5, 22962, Siek, Germany
L-γ-glutamyl-L-cysteinyl glycine, or glutathione, as one of the basic intracellular antioxidants, plays a vital
role in cellular metabolism. In mammalian cells, glutathione is synthesized via two steps. The first step that
is considered rate limiting is catalyzed by glutamate cysteine ligase. In this work, a stochastic algorithm based
on continuous-time Markov chains was used to simulate the activity of glutamate-cysteine ligase. Several dif-
ferent mechanisms of enzymatic activity including reversible inhibition of glutathione, and an ATP binding
motif have been considered. Based on physiological metabolite measurements made for human erythrocytes,
the activity of glutamate cysteine ligase was determined. There are many possible ways for substrates to bind
to an active site of the studied enzyme, but, only the mechanism by which primary binding to ATP can occur
makes it possible to obtain the catalytic rate value similar to that of the experimentally measured glutamate-
cysteine ligase activity relative to physiological concentrations of substrates. In other cases, the values differ
by more than one order of magnitude. The performed analysis allows the conclusion that when models for
glutathione biosynthesis are constructed in vivo conditions, the ATP concentration and reversible inhibition
of glutathione should be taken into account.
Keywords: glutathione, glutamate-cysteine ligase, simulation modeling, stochastic algorithm
БИОФИЗИКА том 68
№ 2
2023