БИОФИЗИКА, 2023, том 68, № 2, с. 241-247
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.32
ВЛИЯНИЕ pH НА КОНФОРМАЦИЮ МОДИФИЦИРОВАННОГО
АПТАМЕРА К БЕЛКУ НУКЛЕОЛИНУ
© 2023 г. П.В. Габрусенок*, Р.Р. Рамазанов**, А.С. Бучельников**, П.А. Соколов*, **, #
*Санкт-Петербургский государственный университет,
Университетская наб., 7/9, Санкт-Петербург, 199034, Россия
**Севастопольский государственный университет, Университетская ул., 33, Севастополь, 299053, Россия
#E-mail: p.a.sokolov@spbu.ru
Поступила в редакцию 07.12.2022 г.
После доработки 12.12.2022 г.
Принята к публикации 21.12.2022 г.
Поиск агентов для адресной доставки противораковых препаратов остается крайне востребованной
для медицины задачей. В этой связи находят свое применение ДНК-аптамеры к белкам,
специфичным к раковым клеткам. Вместе с тем дополнительная настройка активности аптамеров
для снижения их аффинности к мишеням вне раковых тканей может улучшить перспективы их
клинического применения ввиду сокращения иммуногенности и количества побочных эффектов.
Одним из подходов является использование нарушения кислотности в раковых клетках и тканях. В
данной работе мы модифицировали аптамер AS1411 к нуклеолину путем присоединения к нему
нуклеотидной последовательности, сообщающей аптамеру свойство pH-чувствительности.
Методами спектрофотометрического плавления и флуоресценции было продемонстрировано, что
конформация нового аптамера обусловлена pH среды.
Ключевые слова: аптамер, водородный показатель, ДНК, нуклеолин, рак.
DOI: 10.31857/S0006302923020047, EDN: CAEFMD
Нуклеолин является многофункциональным
исследуется и успешно применяется ДНК-апта-
белком, который задействован в процессах выжи-
мер AS1411 [12]. Наряду со сверхэкспрессией нук-
вания, роста и пролиферации клеток. У нормаль-
леолина раковые ткани характеризуются наруше-
ных клеток этот белок обнаруживается преиму-
нием кислотности внутри- и внеклеточного про-
щественно в ядре. В раковых клетках он также
странств [13, 14]. Это дает еще одну возможность
присутствует в цитоплазме и на поверхности [1].
для дополнительной тонкой настройки агентов
Последнее позволяет использовать его как целе-
доставки лекарств, придавая им способность ак-
вой белок для доставки лекарств в опухолевые
тивироваться в диапазоне pH, характерном для
ткани [2, 3] различного вида, включая нейробла-
опухолевых тканей.
стому [4], глиобластому [5], рак молочной железы
Ранее, на примере аптамера к аденозинтри-
[6], шейки матки [7] и колоректальный рак [8].
фосфату (АТФ), была предложена универсальная
В настоящее время для молекулярного узнава-
схема дополнения последовательности аптамеров
ния все чаще применяются аптамеры - высоко-
участками, которые в зависимости от кислотно-
аффинные нуклеотидные последовательности,
сти окружения с различной эффективностью ин-
специфичные к молекуле-мишени и являющиеся
терферируют с функциональной структурой ап-
хорошей альтернативой, например, монокло-
тамеров и регулируют таким образом их актив-
нальным антителам [9, 10]. По сравнению с анти-
ность при разных pH [15]. В присутствии АТФ
телами, ДНК-аптамеры обладают рядом преиму-
этот аптамер претерпевает структурную пере-
ществ. Среди них простота синтеза и стабиль-
стройку, формируя сайт связывания. При этом из
ность, а также они обладают небольшой или
его структуры вытесняется интерферирующий
нулевой иммуногенностью, что означает возмож-
участок, что приводит к росту фракции активных
ность многократного введения в терапевтических
аптамеров. Для различных pH размер данной
целях, а также меньшее количество побочных эф-
фракции существенно различается, что и обу-
фектов [11].
славливает эффективность подхода. На сего-
В качестве связывающегося с нуклеолином
дняшний день структурная перестройка при свя-
агента для адресной доставки лекарств широко зывании с мишенью была открыта также для
241
242
ГАБРУСЕНОК и др.
Таблица 1. Использованные в исследовании олигонуклеотиды
№
Обозначение
Последовательность 5'-3'
1
AS1411
Cy3-GGTGGTGGTGGTTGTGGTGGTGGTGG-BHQ2
2
AS1411-interfere
Cy3-GGTGGTGGTGGTTGTGGTGGTGGTGG-
TTTTTTTTTTTTTTT-CCAACACC-BHQ2
quad-tail
GGTGGTGG-...
interfere-tail
...-CCAACACC
3
quad
GGTGGTGG
4
dis
GGTGTTGG
5
disA14
GGTGTTGG-AAAAAAAAAAAAAA
6
Cy3T8
Cy3-TTTTTTTT
Примечание. Cy3 - цианин-3; BHQ2 - Black Hole Quencher 2; интерферирующая со структурой аптамера
последовательность interfere-tail выделена двойным подчеркиванием; комплементарные к interfere-tail
последовательности выделены одинарным подчеркиванием; нуклеотиды, участвующие в образовании не
уотсон-криковских пар (мисматчи), обозначены полужирным шрифтом.
ДНК-аптамеров к тромбину и кокаину [16]. При
Использованные в исследовании олигонук-
этом многие ДНК-аптамеры имеют консерватив-
леотиды представлены в табл. 1. Синтез проводи-
ные сайты связывания и не изменяют своей
ло ООО «ДНК-Синтез» (Москва, Россия). Кон-
структуры при комплексообразовании с мишеня-
центрация олигонуклеотидов AS1411, AS1411-in-
ми. Поэтому работоспособность упомянутого
terfere и Cy3T8 во всех опытах составляла
подхода для этого типа аптамеров нуждается в до-
полнительном изучении.
50 нмоль/л. Теоретическая температура плавле-
ния рассчитывалась при помощи калькулятора
В данной работе мы исследовали возможность
OligoAnalyzer (IDT, США) [17].
придания pH-зависимости консервативным ап-
тамерам на примере аптамера AS1411 к нуклеоли-
Плавление проводили на спектрофотометре
ну. Последовательность AS1411 была дополнена
Specord 2000 (Германия), регистрируя оптиче-
интерферирующим участком. Для решения задач
скую плотность проб на длине волны 260 нм. Гра-
исследования был разработан альтернативный
диент изменения температур во всех опытах не
подход к проверке активности используемого ап-
превышал 0.2°C/мин. Кривые плавления обрабо-
тамера в зависимости от pH. Он основан на изуче-
таны по алгоритму, предложенному в работе [18],
нии гибридизации сигнальной ДНК с интерфе-
и отражают долю α максимальной концентрации
рирующим участком аптамера, а не на детекции
комплексообразования с нуклеолином. Это су-
двунитевых участков (α = 1).
щественно упрощает процесс изучения системы,
Измерения интенсивности флуоресценции
так как нет необходимости работать с самим
красителя Cy3 проводили с помощью флуоримет-
белком.
ра F-7100 (Hitachi, Япония) в режиме «Time scan»
с напряжением на фотоумножителе 700 В. Длина
МАТЕРИАЛЫ И МЕТОДЫ
волны возбуждения во всех опытах была 539 нм
(ширина щели 5 нм), а интенсивность испуска-
Трис(гидроксиметил)аминометан
(≥99.9%),
ния измеряли на длине волны 590 нм (ширина
ацетат натрия, хлорид магния и аденозинтрифос-
щели 5 нм). При титровании измеряли флуорес-
фат были закуплены в компании Sigma (США).
ценцию через 10 мин после добавления титрую-
Агароза была куплена в компании AppliChem
щего раствора. Исследование зависимости флуо-
(США). Для приготовления всех растворов ис-
пользовали очищенную воду Milli-Q. Исследова-
ресценции олигонуклеотида Cy3T8 от pH показа-
ния проводили в буфере, содержащем 10 ммоль/л
ло, что флуоресценция Cy3 не зависит от pH в
Трис-HCl, 10 ммоль/л CH3COONa и 6 ммоль/л
диапазоне от 5.0 до
8.5 и составляет около
MgCl2.
100 условных единиц.
БИОФИЗИКА том 68
№ 2
2023
ВЛИЯНИЕ pH НА КОНФОРМАЦИЮ
243
Рис. 1. Схема экспериментов по проверке pH-чувствительности выбранного дизайна сенсора (а). Случай «низкого» (б)
и «высокого» (в) pH.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
меров, находящихся в функциональном
состоянии, и наоборот. Это придает аптамеру
Дизайн модифицированного аптамера к нуклео-
AS1411-interfere зависимость от pH. Мы полагаем,
лину. Исходный аптамер к нуклеолину AS1411,
что в случае отсутствия гибридизации участков
через политиминовый (полиТ) линкер был до-
interfere-tail и quad-tail аптамер AS1411-interfere
полнен участком interfere-tail, который за исклю-
переходит во «включенное» состояние аналогич-
чением одной пары A-G комплементарен к его
но тому, как это происходит для исходного апта-
концевому участку quad-tail. Можно предполо-
мера AS1411 [20]. Таким образом, измерение ста-
жить, что в растворе устанавливается равновесие
бильности гибридизации участка interfere-tail и
между «выключенными» макромолекулами апта-
quad-tail при различных pH является косвенным
меров, в которых участок interfere-tail гибридизо-
измерением фракции «включенных» аптамеров.
ван с quad-tail, и «включенными» макромолеку-
Для оценки стабильности указанного дуплекса
лами, в которых участок quad-tail включен в фор-
мы использовали подход конкурентного связыва-
мирование функциональной структуры аптамера.
ния сигнальных олигонуклеотидов quad, dis и
Стабильность дуплекса quad-tail:interfere-tail в
disA14 с участком interfere-tail, как это представле-
нейтральных и кислых pH различаются. С пони-
но на рис. 1. Чем эффективнее сигнальные олиго-
жением pH пара A-G протонируется [19], и ста-
нуклеотиды замещают quad-tail в дуплексе quad-
бильность дуплекса возрастает. Чем выше ста-
tail:interfere-tail, тем менее стабилен данный дуп-
бильность дуплекса, тем меньше фракция апта-
лекс. Эффективность замещения оценивали по
БИОФИЗИКА том 68
№ 2
2023
244
ГАБРУСЕНОК и др.
олигонуклеотидов quad, dis и disA14 с образовани-
ем нового более стабильного дуплекса [21].
Можно ожидать, что олигонуклеотид quad за-
мещает участок quad-tail с одинаковой эффектив-
ностью во всем диапазоне pH, так как их последо-
вательности полностью совпадают. Однако тит-
рование раствора AS1411-interfere с помощью
quad не вызвало роста флуоресценции во всех
случаях. Такое поведение мы, в первую очередь,
связываем с тем, что олигонуклеотид quad, явля-
ясь частью последовательности квадруплекса,
может собираться в подобные структуры по четы-
ре макромолекулы. Это препятствует его взаимо-
действию с участком аптамера interfere-tail.
Олигонуклеотиды dis и disA14 имеют один нук-
леотид, отличный от последовательности квад-
руплекса, поэтому формирование ими в растворе
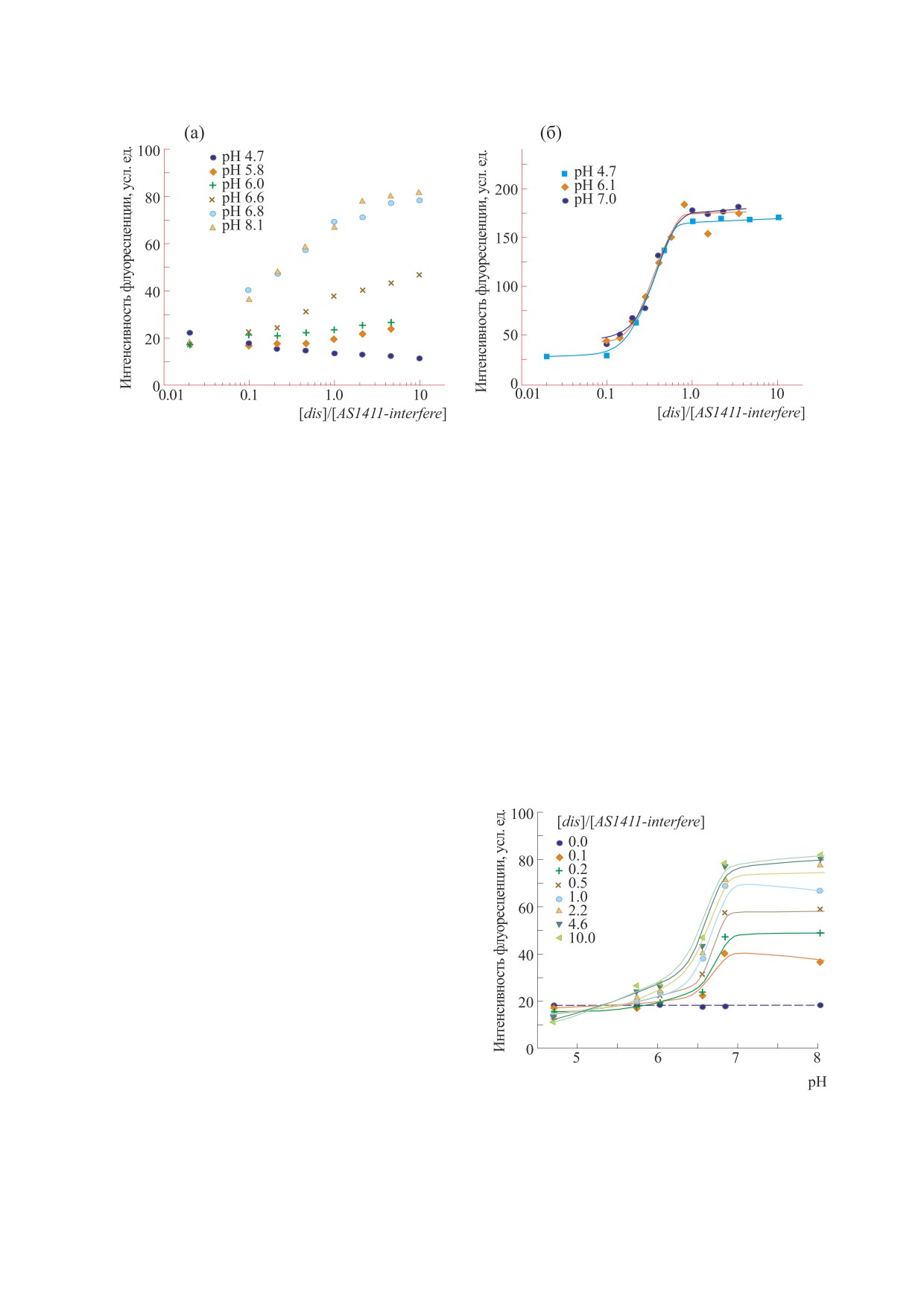
подобных надструктур маловероятно. На рис. 3а
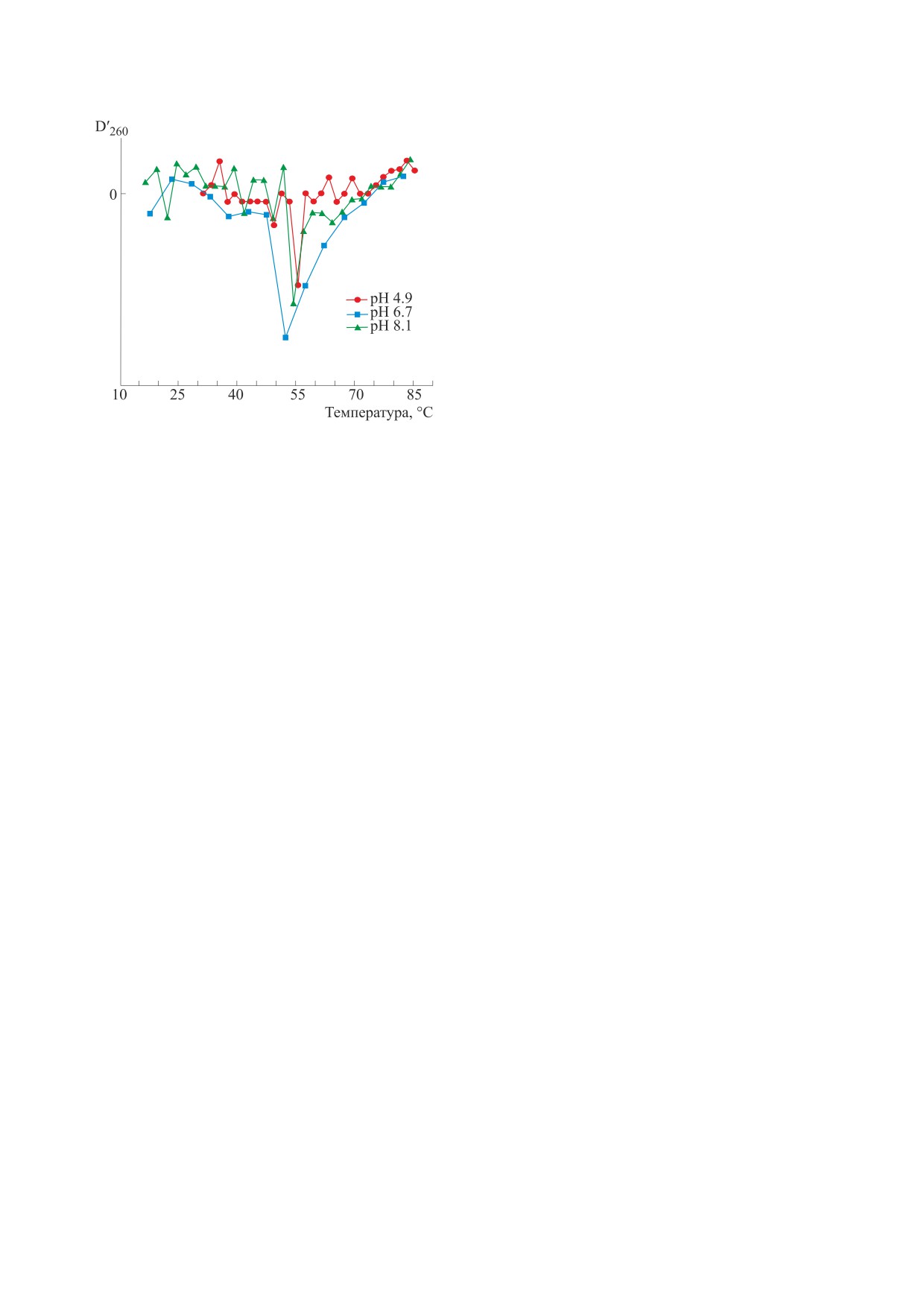
Рис. 2. Производная оптической плотности образцов
показано, как изменяется интенсивность флуо-
NLC по температуре.
ресценции метки Cy3 при титровании раствора
AS1411-interfere раствором олигонуклеотидом dis.
При pH < 6.0 увеличение концентрации олиго-
росту флуоресценции, сопровождающему разру-
нуклеотида dis в растворе не приводит к суще-
шение дуплекса.
ственному изменению сигнала. Олигонуклеотид
Изучение структуры аптамера при различных
dis при указанных pH не способен заместить
pH. Немодифицированный аптамер AS1411 при
quad-tail в дуплексе quad-tail:interfere-tail, так как
используемых в работе ионных силах и pH фор-
такой дуплекс стабилизируется в кислых pH до-
мирует структуру, температура плавления кото-
полнительно парой A+·G. При pH > 6.0 наблюда-
рой варьируется от 52 до 56°С (рис. 2), что соот-
ется существенный рост флуоресценции, связан-
ветствует литературным данным по плавлению
ный с гибридизацией олигонуклеотида dis с inter-
квадруплексов [18]. Òàêæå наблюдалось харак-
fere-tail и разнесением тушителя на interfere-tail и
терное для квадруплексов изменение оптической
красителя на quad-tail, как показано на рис. 1. В то
плотности с ростом температуры [18], заключаю-
же время олигонуклеотид disA14, содержащий до-
щееся в падении коэффициента экстинкции ε260
полнительную последовательность поли(А), во
и увеличении ε295 (данные не представлены). При
всем диапазоне pH приводит к возрастанию флу-
этом флуоресценция аптамера AS1411 составила
оресценции (рис. 3б). Это хорошо согласуется с
20 ± 3 усл. ед., что существенно ниже аналогич-
тем, что расчетная температура плавления дуп-
ных значений для олигонуклеотида Cy3T8 тех же
лекса disA14:interfere-tail в два раза выше темпера-
концентраций. Это также свидетельствует о том,
туры плавления дуплекса quad-tail:interfere-tail.
что 5’- и 3’-концы аптамера AS1411, модифици-
Также линкер полиТ в аптамере AS1411-interfere
рованные красителем и тушителем, находятся ря-
является точкой опоры для реакции с disA14, что
дом, как и предполагает структура квадруплекса.
существенно ускоряет протекание реакции [21].
Поэтому можно заключить, что в изучаемом диа-
Уже при соотношении концентраций
пазоне pH аптамер AS1411 формирует свою функ-
disA14:AS1411-interfere, равном 1:1, наблюдается
циональную квадруплексную форму.
выход зависимостей на плато вне зависимости от
pH. Это полностью соответствует схеме гибриди-
Для модифицированного аптамера AS1411-in-
зации.
terfere также наблюдали низкую интенсивность
флуоресценции (18 ± 1 усл. ед. в диапазоне pH от
В отличие от олигонуклеотида disA14, который
4.7 до 8.1). Это возможно в случае, если участок
имеет большую аффинность к аптамеру AS1411-
quad-tail комплементарно связан с участком inter-
interfere, а именно его участку interfere-tail, благо-
fere-tail. При этом, соответственно, quad-tail не
даря длинной комплементарной последователь-
участвует в формировании квадруплекса и апта-
ности, олигонуклеотид dis и участок аптамера
мер теряет функциональность. Доля «выключен-
quad-tail имеют сопоставимые константы связы-
ных» аптамеров зависит от стабильности дуплек-
вания с interfere-tail ввиду того, что конкуренция
са quad-tail:interfere-tail. В свою очередь, чем ме-
между ними за связывание с этим фрагментом
нее стабилен данный дуплекс, тем легче цепочка
практически отсутствует. В результате в растворе
quad-tail в нем может быть замещена на один из
возникает фракция аптамера AS1411-interfere, в
БИОФИЗИКА том 68
№ 2
2023
ВЛИЯНИЕ pH НА КОНФОРМАЦИЮ
245
Рис. 3. Зависимость интенсивности флуоресценции растворов аптамера AS1411-interfere от концентрации олигонуклео-
тидов dis (а) и disA14 (б) при различных pH.
которой он имеет форму шпильки, и образуется
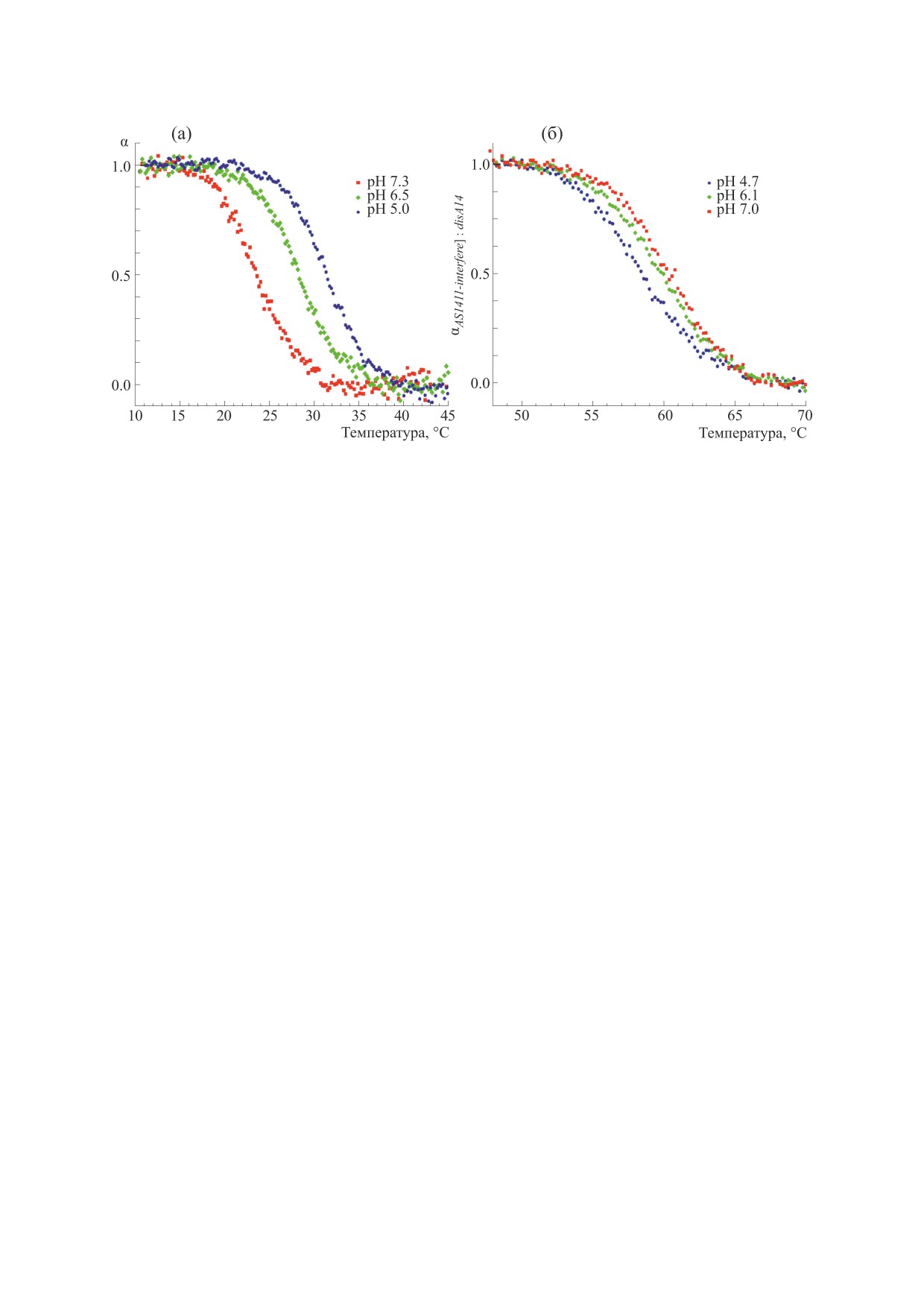
вится. С дальнейшим повышением температуры
дуплекс quad-tail:interfere-tail, и фракция, в кото-
будет происходить денатурация оставшейся наи-
рой он принимает форму квадруплекса, а его уча-
более стабильной фракции. Действительно, при
сток interfere-tail образует дуплекс dis:interfere-tail.
плавлении растворов dis и аптамера AS1411-inter-
По соотношению этих двух фракций можно су-
fere в соотношении 1:1 во всех областях pH на-
дить о стабильности дуплекса quad-tail:interfere-
блюдается только один переход (рис. 5а), несмот-
tail. Как следует из рис. 4, при низких pH дуплекс
ря на наличие двух фракций для pH 6.5 и 7.3
quad-tail:interfere-tail стабилен, аптамер находится
(рис. 4). При pH 7.3 некомплементарная пара
в «выключенном» состоянии. При pH > 6.0 дуп-
A-G в дуплексе quad-tail:interfere-tail не протони-
лекс относительно нестабилен и доля «включен-
рована и во время плавления фракция этого дуп-
ных» аптамеров должна расти, что согласуется с
лекса переходит во фракцию dis:interfere-tail. При
дизайном аптамера AS1411-interfere.
понижении pH пара A+-G стабилизирует дуп-
При соотношении dis и аптамера AS1411-inter-
лекс и фракция dis:interfere-tail с повышением
fere, равному 1:1, как видно из рис. 4, при pH < 6.0
температуры переходит во фракцию quad-tail:in-
практически не происходит замещения quad-tail
terfere-tail, которая имеет повышенную темпера-
на dis. При pH 6.5 замещение происходит при-
мерно для половины аптамеров от максимально-
го количества, которое достигается в области
pH > 7.0. Известно, что наличие некомплемен-
тарных оснований A-G в двойной спирали нук-
леиновых кислот значительно понижает их ста-
бильность и температуру плавления при ней-
тральных pH и существенно повышает в кислых
[22]. Основываясь на этом, можно предположить,
что температура плавления дуплексов quad-
tail:interfere-tail больше температуры плавления
дуплексов dis:interfere-tail в кислых pH и наоборот
- в нейтральных. Если к началу плавления в рас-
творе присутствуют две фракции quad-tail:inter-
fere-tail и dis:interfere-tail, то при повышении тем-
пературы сначала будет плавиться фракция с бо-
лее низкой температурой плавления. При этом
значительного изменения поглощения наблю-
даться не будет, так как высвободившийся inter-
fere-tail будет вовлечен в формирование дуплекса
Рис. 4. Зависимость интенсивности флуоресценции
в более стабильной фракции. Этот процесс будет
растворов аптамера AS1411-interfere, содержащих
идти пока первая фракция полностью не распла-
различные концентрации dis, от pH.
БИОФИЗИКА том 68
№ 2
2023
246
ГАБРУСЕНОК и др.
Рис. 5. Кривые плавления растворов AS1411-interfere, содержащих олигонуклеотиды dis (а) или disA14 (б). AS1411-inter-
fere:dis = AS1411-interfere:disA14 = 1:1.
туру плавления. Противоположная зависимость
КОНФЛИКТ ИНТЕРЕСОВ
температуры плавления от pH наблюдается для
Авторы заявляют об отсутствии конфликта
комплексов аптамера AS1411-interfere с disA14
интересов.
(рис. 5б). Так как дуплекс disA14:interfere-tail пла-
вится в области 60°С, что существенно выше, чем
30°С для quad-tail:interfere-tail, то перераспределе-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ние фракций во всем диапазоне pH отсутствует.
Настоящая статья не содержит каких-либо ис-
При этом наблюдается небольшое падение тем-
следований с участием людей или животных в ка-
пературы плавления с уменьшением pH, которое
честве объектов исследований.
можно соотнести с дестабилизацией самого дуп-
лекса disA14:interfere-tail в кислой среде. Кривые
СПИСОК ЛИТЕРАТУРЫ
плавления комплексов аптамера с олигонуклео-
тидами dis и disA14 полностью соответствуют схе-
1. F. Mongelard and P. Bouvet, Trends Cell Biol., 17 (2),
ме работы pH-зависимого аптамера AS1411-inter-
80 (2007).
fere.
2. S. Christian, J. Pilch, M. E. Akerman, et al., J. Cell
Biol., 163 (4), 871 (2003).
3. J. Mosafer and A. Mokhtarzadeh, Curr. Drug Delivery,
ВЫВОДЫ
15 (9), 1323 (2018).
4. C. Brignole, V. Bensa, N. A. Fonseca, et al., J. Exp.
Продемонстрированный в данной работе под-
Clin. Cancer Res., 40 (1), 180 (2021).
ход по изучению конформации модифицирован-
5. J. Balça-Silva, A. do Carmo, H. Tão, et al., Exp. Cell
ного аптамера AS1411 при помощи сигнальных
Res., 370 (1), 68 (2018).
олигонуклеотидов представляется весьма пер-
6. V. Moura, M. Lacerda, P. Figueiredo, et al., Breast
спективным. Методика не требует работы непо-
Cancer Res. Treat., 133 (1), 61 (2012).
средственно с мишенью - нуклеолином. Полу-
7. J. Carvalho, A. Paiva, M. P. Cabral Campello, et al.,
ченные с ее помощью результаты полностью со-
Sci. Rep., 9 (1), 7945 (2019).
гласуются с ранее описанным механизмом
8. N. F. Hosseini, R. Amini, M. Ramezani, et al.,
действия интерферирующей последовательно-
Biomed. Pharmacother., 155, 113690 (2022).
сти, несущей некомплементарный нуклеотид.
9. С. П. Радько, С. Ю. Рахметова, Н. В. Бодоев и др.,
Биомед. химия, 53 (1), 5 (2007).
10. С. А. Лапа, В. Е. Шершов, Г. С. Краснов и др., Био-
ФИНАНСИРОВАНИЕ РАБОТЫ
орг. химия, 46 (4), 411 (2020).
11. Z. Fu and J. Xiang, Int. J. Mol. Sci., 21 (8), 2793
Работа выполнена при финансовой поддержке
(2020).
Российского научного фонда (грант № 22-23-
12. R. Yazdian-Robati, P. Bayat, F. Oroojalian, et al., Int.
01066).
J. Biol. Macromol., 155, 1420 (2020).
БИОФИЗИКА том 68
№ 2
2023
ВЛИЯНИЕ pH НА КОНФОРМАЦИЮ
247
13. B. A. Webb, M. Chimenti, M. P. Jacobson, et al., Nat.
18. P. A. Rachwal and K. R. Fox, Methods, 43 (4), 291
Rev. Cancer, 11 (9), 671 (2011).
(2007).
19. J. A. Lee and M. C. DeRosa, Chem. Commun., 46 (3),
14. M. Damaghi, J. W. Wojtkowiak, and R. J. Gillies,
418 (2010).
Front. Physiol. 4, 370 (2013).
20. L. Bie, Y. Wang, F. Jiang, et al., Front. Mol. Biosci., 9,
15. I. A. P. Thompson, L. Zheng, M. Eisenstein, et al.,
1025313 (2022).
Nat. Commun., 11 (1), 2946 (2020).
21. F. C. Simmel, B. Yurke, and H. R. Singh, Chem. Rev.,
16. M. Debiais, A. Lelievre, M. Smietana, et al., Nucl. Ac-
119 (10), 6326 (2019).
ids Res., 48 (7), 3400 (2020).
22. S. E. Morse and D. E. Draper, Nucl. Acids Res., 23 (2),
302 (1995).
Study of the Influence of pH on the Conformation
of a Modified Aptamer to Nucleolin Protein
P.V. Gabrusenok*, R.R. Ramasanoff**, A.S. Buchelnikov**, and P.A. Sokolov*, **
*Saint-Petersburg State University, Universitetskaya nab. 7/9, St. Petersburg, 199034 Russia
**Sevastopol State University, Universitetskaya ul. 33, Sevastopol, 299053 Russia
The search for agents for targeted delivery of anticancer drugs remains a crucial challenge for medicine. For
this reason, DNA aptamers targeting cancer cell-specific proteins have medical use. At the same time, the
additional fine-tuning of aptamer properties to lower affinity of aptamers for target cells that are not sur-
rounding cancerous tissues makes the aptamers promising tools in clinical applications due to reduced im-
munogenicity and fewer side effects. One of the approaches is to use acidity disruption in cancer cells and
tissues. In this work, aptamer AS1411 was modified to increase affinity for nucleolin by attaching a nucleotide
sequence to its binding site to create a pH-sensitive linker. UV melting and fluorescence methods were em-
ployed to demonstrate that the conformation of the new aptamer depends on pH of the medium.
Keywords: aptamer, pH, DNA, nucleolin, cancer
БИОФИЗИКА том 68
№ 2
2023